Bab III Metodologi Penelitian
III.1 Pembuatan Katalis HTSC
Proses pembuatan katalis HTSC menggunakan metoda kopresipitasi. Katalis yang dihasilkan selanjutnya dikarakterisasi dan diuji aktivitasnya.
III.1.1 Bahan dan Peralatan
Bahan dan peralatan yang digunakan dibagi menjadi dua kelompok, yaitu bahan dan peralatan yang akan digunakan pada proses pembuatan katalis serta uji aktivitas.
III.1.1.1 Bahan
Bahan yang digunakan pada proses pembuatan katalis adalah sebagai berikut :
· Fe(NO3)3.9H2O dan Cr(NO3)3.9H2O yang berfungsi sebagai komponen utama
pada pembuatan katalis berbasis Fe oksida,
· Na2CO3 yang berfungsi sebagai precipitating agent, dan
· aquadest yang berfungsi sebagai pelarut.
Bahan yang digunakan pada uji aktivitas katalis adalah sebagai berikut :
· gas H2 yang berfungsi sebagai gas pereduksi,
· gas CO yang berfungsi sebagai reaktan,
· gas N2 yang berfungsi sebagai gas inert, dan
· aquadest yang berfungsi sebagai reaktan.
III.1.1.2 Peralatan
Peralatan yang digunakan pada proses pembuatan katalis, antara lain :
· magnetic stirer yang berfungsi sebagai pengaduk,
· furnace yang berfungsi sebagai pengering dalam proses kalsinasi,
· kertas saring yang berfungsi sebagai media penyaring,
· penyaring Butchner yang berfungsi sebagai alat penyaring,
· pengaduk gelas yang berfungsi sebagai pengaduk dalam pelarutan zat,
· pipet tetes yang berfungsi untuk mengambil larutan yang akan digunakan,
· cawan porselen yang berfungsi sebagai wadah untuk mengeringkan sampel,
· water bath yang berfungsi sebagai pemanas,
· gelas kimia 400 ml dan 1000 ml yang berfungsi sebagai wadah aquadest,
· termometer yang berfungsi sebagai pengukur temperatur reaksi pengendapan,
· piknometer 25 ml yang berfungsi sebagai pengukur densitas aquadest, dan
· penggerus porselen yang berfungsi sebagai penggerus katalis high temperature shift conversion.
Peralatan yang digunakan pada uji aktivitas katalis adalah sebagai berikut :
· termokopel yang berfungsi sebagai pengukur temperatur dalam reaktor,
· reaktor berfungsi sebagai wadah reaksi pergeseran CO, dan
· syringe pump yang berfungsi sebagai injektor dan pengatur laju aquadest ke dalam reaktor.
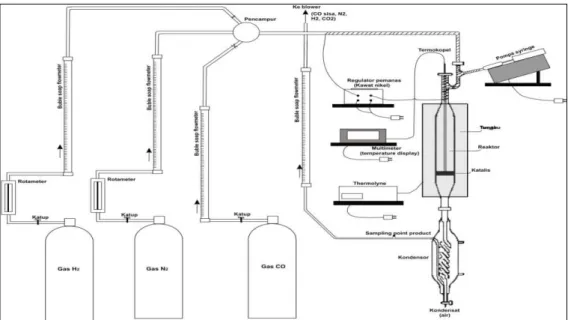
Rangkaian peralatan untuk uji aktivitas katalis HTSC dapat dilihat pada gambar III.1 berikut ini.
Gambar III.1 Rangkaian peralatan uji aktivitas katalis pada reaksi pergeseran CO menjadi CO2 dan H2 (Kholisoh, 2003).
Gambar III.1 menunjukkan rangkaian peralatan uji aktivitas katalis pada reaksi pergeseran CO menjadi CO2 dan H2. Sistem reaksi terdiri dari reaktor,
tabung gas N2, CO, dan H2, syringe pump, pemanas, termokopel, dan kondensor.
Tabung gas N2, CO, dan H2 dilengkapi dengan sebuah keran (needle valve) dan
flowmeter gelembung sabun untuk mengatur dan menunjukkan pembacaan laju alir gas. Reaktor yang digunakan berupa reaktor fixed bed yang terbuat dari tabung gelas pyrex dengan panjang 62 cm dan diameter dalam 1,4 cm. Reaktor diletakkan secara konsentris terhadap furnace. Unggun yang digunakan berupa 0,5 gr katalis HTSC diletakkan secara merata di atas glass wool. Selanjutnya air diinjeksikan melalui syringe pump ke dalam reaktor. Temperatur pemanas air masuk diset 120 oC untuk memanaskan air menjadi kukus dan memanaskan gas masuk yang nantinya dipergunakan sebagai reaktan. Temperatur di dalam reaktor diukur dengan menggunakan termokopel. Termokopel ini dilengkapi dengan display u n t u k mengetahui pembacaan temperatur dalam reaktor. kukus sisa reaktan selanjutnya dikondensasikan dengan menggunakan kondensor hingga menjadi kondensat. Laju alir gas keluaran selanjutnya dibaca melalui flowmeter dengan gelembung sabun pada bagian keluaran.
III.1.2 Metode Pembuatan Katalis
Prosedur pembuatan katalis HTSC terdiri dari beberapa tahapan, yaitu : tahap presipitasi, tahap pencucian dan penyaringan, tahap pengeringan, serta tahap kalsinasi. Secara umum, tahap – tahap pembuatan katalis dapat digambarkan pada diagram alir yang ditunjukkan pada gambar III.2 dan III.3 berikut ini.
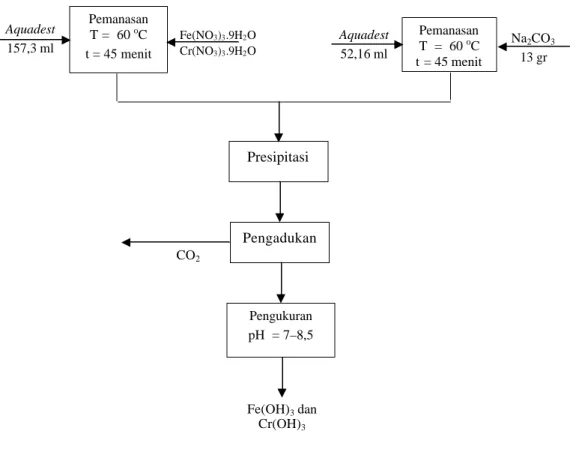
Gambar III.2 Diagram alir proses pembuatan katalis HTSC bagian I
Pemanasan T = 60 oC t = 45 menit Pemanasan T = 60 oC t = 45 menit Na2CO3 13 gr Pengukuran pH = 7–8,5 Fe(OH)3 dan Cr(OH)3 CO2 Fe(NO3)3.9H2O Cr(NO3)3.9H2O Aquadest 157,3 ml Aquadest 52,16 ml Pengadukan Presipitasi
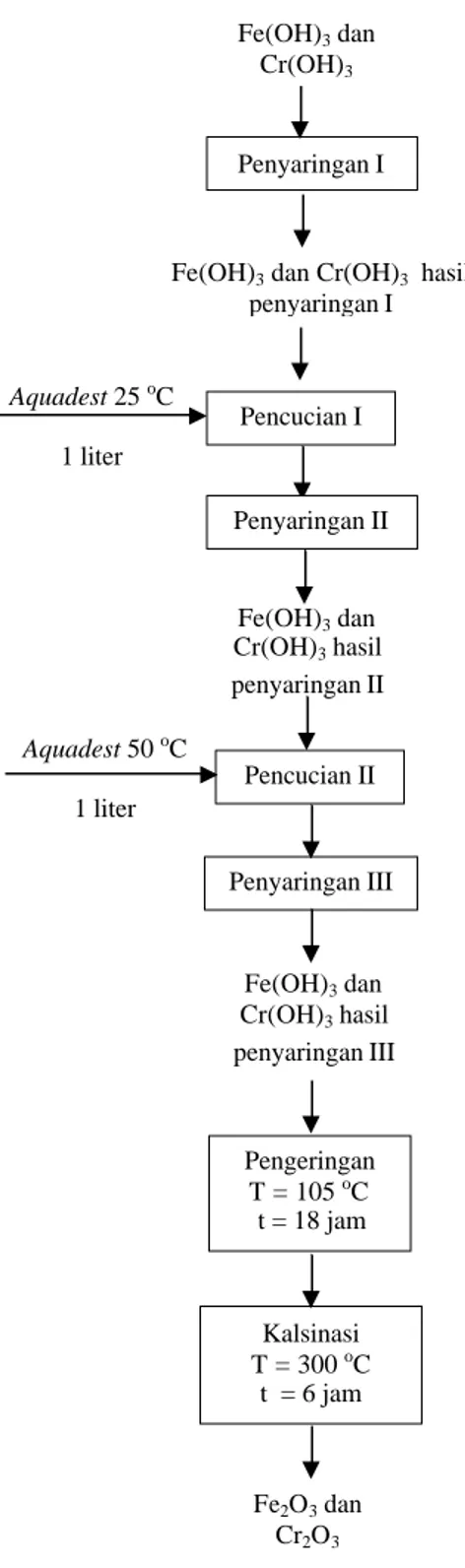
Gambar III.3 Diagram alir proses pembuatan katalis HTSC bagian II Penyaringan I Pencucian I Pengeringan T = 105 oC t = 18 jam Kalsinasi T = 300 oC t = 6 jam Fe2O3 dan Cr2O3 Aquadest 25 oC 1 liter Fe(OH)3 dan Cr(OH)3 hasil penyaringan II Pencucian II Aquadest 50 oC 1 liter Penyaringan II Penyaringan III Fe(OH)3 dan Cr(OH)3 hasil penyaringan III Fe(OH)3 dan Cr(OH)3
Fe(OH)3 dan Cr(OH)3 hasil
III.1.2.1 Tahap Presipitasi
Tujuan proses presipitasi adalah untuk mengendapkan larutan yang diperoleh dari pencampuran larutan I ke larutan II hingga menghasilkan presipitat. Presipitat yang diinginkan adalah presipitat dengan ukuran partikel yang kecil dengan luas permukaan yang besar. Urutan proses presipitasi yang dijelaskan adalah proses pembuatan katalis HTSC ITB 3.
Proses presipitasi ini diawali dengan membuat dua macam larutan, yaitu larutan I dan II. Larutan I dibuat dengan melarutkan ferri nitrat [Fe{NO3}3.9H2O]
27,25 gr dan kromium nitrat [Cr{NO3}3.9H2O] 2,7 gr dalam 157,3 ml aquadest
dan dipanaskan pada temperatur 60 oC selama 45 menit. Dasar pemilihan garam nitrat karena lebih mudah terdekomposisi dengan pemanasan menjadi oksidanya, lebih mudah dihilangkan dengan pencucian, dan tidak meracuni katalis (Szabo, 1976). Larutan presipitator (larutan II) dibuat dengan melarutkan Na2CO3 sebanyak 13 gr dalam 52,16 ml aquadest pada temperatur 60 oC selama
45 menit. Pemanasan pada saat pelarutan bertujuan untuk meningkatkan laju pelarutan. Selanjutnya larutan I dituang ke dalam larutan II dengan perlahan - lahan. Pencampuran dilakukan pada temperatur 60 oC dan pH akhir pencampuran yang mendekati netral (pH = 7-8,5) sambil terus diaduk hingga karbon dioksida yang terlarut dapat terlepas. Karbon dioksida terlarut ini dapat dilihat dengan adanya buih didalam suspensi (Jennings, 1981).
Reaksi yang terjadi pada tahap presipitasi adalah sebagai berikut :
Na2CO3 2Na+ + CO32- ...(3.1)
CO32- + H2O HCO3- + OH- ...(3.2)
6Na+ + 3HCO3- + 3OH- + 2Fe(NO3)3 2Fe(OH)3 + 6NaNO3 + 3CO2 ...(3.3)
6Na+ + 3HCO3- + 3OH- + 2Cr(NO3)3 2Cr(OH)3 + 6NaNO3 + 3CO2 ....(3.4)
III.1.2.2 Tahap Pencucian dan Penyaringan
Suspensi yang terbentuk selanjutnya dicuci sebanyak 2 kali dengan tujuan untuk memperoleh presipitat yang lebih murni dan bebas dari sisa karbonat. Pencucian dilakukan dengan menggunakan aquadest temperatur 25 oC d a n aquadest temperatur 50 oC. Pencucian dengan menggunakan aquadest 50 oC ini
bertujuan untuk menghilangkan impuritis yang akan mempengaruhi kemurnian presipitat, meningkatkan laju penyaringan, dan sebagai pengganti proses aging. Perbaikan kemurnian ini menyebabkan impuritis yang terperangkap dapat dilepaskan dan kembali ke larutan. Presipitat yang telah murni ditandai dengan pH air pencucian = 7.
Presipitat selanjutnya disaring secepatnya dengan menggunakan penyaring butchner dan media penyaring berupa kertas saring. Penyaringan presipitat harus dilakukan secepat mungkin dengan tujuan untuk menghindari terperangkapnya ion nitrat dalam pori katalis dan mengakibatkan luas permukaan katalis menjadi lebih kecil. Selain itu penyaringan presipitat sebaiknya dilakukan pada keadaan panas agar impuritis lebih mudah larut sehingga dapat dihilangkan dari presipitat, dan laju penyaringan menjadi semakin cepat (Hobart, 1940).
III.1.2.3 Tahap Pengeringan
Pengeringan bertujuan untuk menghilangkan kandungan air dalam katalis (Richardson, 1989). Temperatur yang disarankan pada proses pengeringan ini yaitu 105 oC selama 18 jam (Satterfield, 1979). Hasil yang diperoleh berupa padatan kering yang selanjutnya akan dikalsinasi di dalam furnace.
III.1.2.4 Tahap Kalsinasi
Proses kalsinasi bertujuan untuk menghilangkan sisa molekul air dan bahan – bahan yang tidak diinginkan dalam katalis. Selain itu kalsinasi juga digunakan untuk mendekomposisikan Fe(OH)3 menjadi Fe2O3 dan untuk
meningkatkan ketahanan mekanik katalis terhadap perubahan temperatur (Satterfield, 1989). Temperatur yang disarankan pada proses kalsinasi adalah 400-1000 oC selama 6 jam (Neel, 1979).
Reaksi yang terjadi pada tahap kalsinasi :
2Fe(OH)3 Fe2O3 + 3H2O ...(3.5)
2Cr(OH)3 Cr2O3 + 3H2O ...(3.6)
Selanjutnya katalis dibentuk sesuai dengan bentuk dan geometri partikel yang diinginkan. Katalis ini dinamakan katalis HTSC ITB. Biasanya katalis ini dihaluskan hingga memiliki bentuk akhir berupa serbuk (padatan halus) (Jennings, 1984). Katalis komersial yang dijadikan perbandingan juga dihaluskan hingga memiliki bentuk seperti katalis HTSC ITB. Kedua katalis ini kemudian dikarakterisasi dan diuji aktivitasnya.
III.1.3 Karakterisasi Katalis
Sifat fisiko kimia katalis yang akan dikarakterisasi adalah :
(1). Luas permukaan spesifik katalis yang akan ditentukan dengan metode BET (Brunaeur–Emmett–Teller).
(2). Struktur kristal katalis dianalisis dengan metode XRD.
III.1.3.1 Prosedur Analisa Luas Permukaan Spesifik dengan Metode BET Luas permukaan spesifik dapat dianalisa dengan menggunakan metode Brunauer– Emett–Teller (BET). Metode ini didasarkan pada pengukuran volum gas nitrogen yang teradsorp oleh sampel katalis pada berbagai kondisi tekanan rendah. Beda tekanan yang disebabkan oleh penyerapan permukaan katalis terhadap sejumlah volum gas nitrogen dalam peralatan pengujian diukur dan digunakan untuk menghitung luas permukaan BET. Alat yang dipergunakan untuk metode BET ini adalah NOVA 1000 Gas Sorption Analyzer yang terdapat di Laboratorium Analisis dan Instrumentasi Program Studi Teknik Kimia ITB.
Prinsip kerja BET , yaitu :
1. sampel dimasukkan ke dalam wadah sampel; 2. outgassing dilakukan pada temperatur 250 oC;
3. sampel didinginkan dengan menggunakan nitrogen cair;
4. menghitung luas permukaan dengan menggunakan persamaan 3.7.
I S 1 Vm + = …….(3.7)
dimana : Vm = Volume monolayer sampel katalis
S = Slope dari grafik P/P0 – vs – P/[V(P0-P)] I = Intersep dari grafik P/P0 – vs – P/[V(P0-P)]
Untuk mencari luas permukaan katalis, maka dapat menggunakan persamaan (3.8). STP N A V Sa x N x Vm Sa 2 = …(3.8)
dimana : Vm = Volume monolayer sampel katalis NA = Bilangan Avogadro = 6,02 x 1023
2 N
Sa = Luas permukaan 1 molekul gas N2 = 16,2 x 10-20 m2
VSTP = Volume gas pada keadaan STP = 22,4 liter
Untuk mencari luas permukaan spesifik katalis (Sg) dapat dilihat pada persamaan (3.9): m Sa Sg = …(3.9)
dimana : Sg = Luas permukaan spesifik katalis (m2/g) Sa = Luas permukaan katalis (m2)
III.1.3.2 Analisa Struktur Bahan Kristal dengan Metode XRD
Struktur bahan kristal katalis HTSC dapat dianalisa dengan menggunakan metode XRD. Identifikasi campuran bahan dalam katalis ini dapat diketahui dengan menggunakan pola referensi. Selain itu pola XRD juga memegang peranan penting dalam pengenalan struktur kristal tertentu dalam katalis kompleks (Satterfield, 1991).
Prinsip kerja XRD, yaitu :
1. membenturkan sinar x pada bahan material yang akan dianalisa; 2. mengukur intensitas cahaya yang direfleksikan;
3. intensitas berkas cahaya yang direfleksikan membentuk sudut antara permukaan sampel, refleksi berkas cahaya, dan jarak antar bidang kristal sampel. Hal ini dapat dilihat pada persamaan 3.10 berikut ini.
2 d sin q = n λ…..(3.10)
dimana : d = jarak antar bidang kristal sampel
q = sudut yang terbentuk antara permukaan sampel dan refleksi berkas cahaya
n = orde
λ = panjang gelombang
4. membandingkan hasil pengukuran penyebaran berkas cahaya terhadap pola referensi (Mijiritskii, 1973).
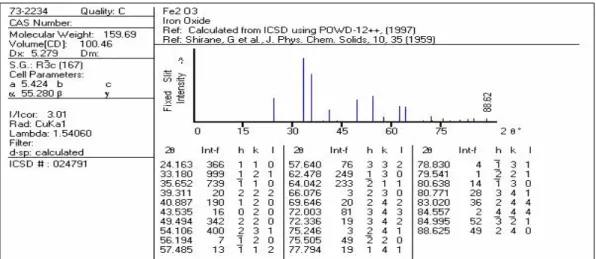
Difraktogram standar Fe2O3, dan Fe3O4 berdasarkan database
PCPDFWIN dapat dilihat pada gambar III.4 dan III.5 berikut ini.
Gambar III.4 Difraktogram standar Fe2O3 pada PDF 73-2234
III.2 Uji Aktivitas
Uji aktivitas katalis ini dimaksudkan untuk menghitung konversi. Aktivitas katalis HTSC diuji dengan menyelenggarakan reaksi pergeseran CO menjadi CO2 dan H2 pada skala laboratorium yang memiliki kondisi operasi yang
dapat dilihat pada tabel III.1 berikut ini.
Tabel III.1 Kondisi operasi uji aktivitas katalis pada skala laboratorium
No. Kondisi Operasi Nilai Satuan
1. Tekanan 1 atm
2. Temperatur 370 oC
3. Volume Hourly Space Velocity
(VHSV) 22234 Jam
-1
4. Rasio kukus terhadap gas umpan 0,87
5. Komposisi gas CO dalam umpan 12,5 %-v
Kondisi operasi pada proses pembuatan katalis HTSC komersial adalah sebagai berikut :
Tekanan : 3 MPa
Temperatur : 370-400 oC
VHSV : 9000-19000 Jam-1
Rasio kukus terhadap gas umpan : 0,6 Komposisi gas CO dalam umpan : 12,9%-v (Twigg, 1989)
Uji aktivitas katalis yang dilakukan pada reaksi pergeseran CO menjadi CO2 dan H2 terdiri dari proses aktivasi, dan reaksi.
III.2.1 Aktivasi
Tujuan proses aktivasi adalah untuk mengaktifkan katalis HTSC yang berbentuk haematit (Fe2O3) menjadi magnetit (Fe3O4) sebelum digunakan.
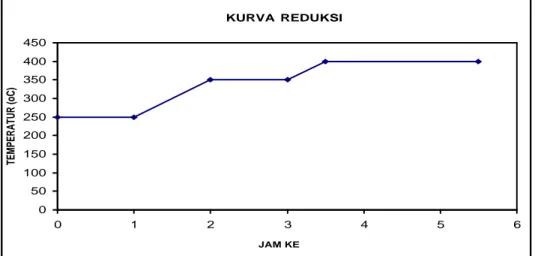
Proses reduksi dilakukan secara bertahap. Temperatur reduksi awal yang digunakan yaitu 250 oC selama 1 jam, dan 350 oC selama 1 jam. Temperatur
unggun katalis dinaikkan dari 250 oC sampai 350 oC dengan laju pemanasan 100 oC/jam. Pada temperatur reduksi ini digunakan H2:N2 = 1:1. Temperatur
reduksi selanjutnya dinaikkan hingga 400 oC selama 2 jam dengan tujuan untuk menghasilkan proses reduksi yang sempurna (Twigg, 1989). Temperatur unggun katalis dinaikkan dari 350 oC sampai 400 oC dengan laju pemanasan 100 oC/jam. Pada temperatur reduksi ini digunakan H2 dengan konsentrasi 2 kali lebih banyak
dari konsentrasi N2 untuk meningkatkan laju aktivasi katalis. Kurva reduksi dapat
dilihat pada gambar III.6 berikut ini.
Gambar III.6 Kurva proses reduksi katalis HTSC ITB
Pada proses reduksi dilakukan pengecekan terhadap kehadiran oksigen pada aliran masuk dan keluar reaktor dengan menggunakan GC. Kehadiran oksigen saat reaksi tidak inginkan karena menyebabkan terjadinya reaksi oksidasi yang dapat dilihat pada persamaan 3.11 berikut ini (Twigg, 1989).
2Fe3O4 + ½ O2 à 3Fe2O3 ∆H = -464,6 kJ/mol ...(3.11)
Reaksi oksidasi akan menyebabkan Fe3O4 yang aktif menjadi Fe2O3 yang tidak
aktif. KURVA REDUKSI 0 50 100 150 200 250 300 350 400 450 0 1 2 3 4 5 6 JAM KE TEMPERATUR (oC)
III.2.2 Reaksi Pergeseran CO Menjadi CO2 dan H2
Reaktan yang masuk ke dalam reaktor terdiri dari gas N2 dengan
laju alir 85,71 ml/menit yang berfungsi sebagai gas inert dan gas CO. Gas CO dialirkan dari tabung CO dengan laju alir sekitar 13,33 ml/menit. Selanjutnya air diinjeksikan ke dalam reaktor dengan menggunakan pompa suntikan umpan (syringe pump). Laju alir air yang masuk ke reaktor yaitu 0,06 ml/menit. Air yang diinjeksikan dan gas dipanaskan terlebih dahulu sebelum masuk
ke dalam reaktor dengan menggunakan temperatur pemanasan 120 oC. Tujuan pemanasan ini adalah untuk memanaskan gas dan seluruh air yang diinjeksikan sehingga menghasilkan kukus. Reaksi dilangsungkan pada temperatur 370 oC. Pembentukan embun menandai bahwa aliran air dari syringe pump telah terjadi. Hadirnya air dan gas CO memungkinkan terjadinya reaksi pergeseran CO menjadi CO2 dan H2. Selanjutnya sampel diambil pada aliran masuk dan keluar sebanyak
0,2 ml setelah 30 menit dari pembentukan embun di bawah reaktor untuk melakukan analisa kromatografi. Hal ini dilakukan terus hingga tercapai kondisi steady state (tunak), yakni suatu kondisi dimana konversi relatif konstan terhadap waktu reaksi. Stabilitas katalis diperiksa dengan menyelenggarakan reaksi pergeseran CO menjadi CO2 dan H2 selama 10 jam. Konversi CO selama waktu
tersebut diperiksa secara berkala (sekali dalam 1 jam).
III.2.3 Evaluasi dan Analisis
Evaluasi dan analisis gas – gas yang masuk dan keluar dari reaktor dilakukan tiap 1 jam dengan menggunakan peralatan GC-8AIT dari Schimadzu yang terdapat pada Laboratorium Teknik Reaksi Kimia dan Katalisis, Program Studi Teknik Kimia, ITB. Kondisi pengoperasian GC-8AIT dapat dilihat pada tabel III.2 berikut ini.
Tabel III.2 Kondisi pengoperasian GC – 8AIT dari Schimadzu (Kholisoh, 2003)
No. Kondisi Operasi Nilai Satuan
1. Temperatur kolom Molsieve 5A 50 oC
2. Temperatur injektor/detektor 70 oC
3. Arus listrik detektor 70 mA
Selain kondisi pengoperasian, variabel yang harus diketahui pada penggunaan GC adalah waktu retensi. Waktu retensi adalah waktu yang dibutuhkan sampel dari saat injeksi hingga terdeteksi oleh detektor. Data waktu retensi untuk gas H2, N2, dan CO standar dapat dilihat pada tabel III.3 berikut ini.
Tabel III.3 Waktu Retensi (tR) gas H2, N2, dan CO
Gas tR [menit]
H2 5,04-6,07
N2 2,21-2,84
CO 0,94-1,96
III.2.4 Perhitungan
Perhitungan yang dilakukan pada uji aktivitas katalis berupa perhitungan besarnya konversi reaksi yang didasarkan pada hasil analisis GC. C a r a menghitung konversi reaksi dapat dilihat pada persamaan 3.12 berikut ini.
% 100 x N area CO area N area CO area N area CO area XCO masuk 2 keluar 2 masuk 2 = ...…(3.12)