1
Verifikasi Metode COD secara ASTM D-1252, Photometri SQ 118 dan EPA 410.3, Salinitas berdasarkan Standard Method 16th Edition dan Horiba U-10,
dan DO secara yodometri dengan metode SNI 06-6989.14-2004
Angga Dwinovantyo
Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, Bogor, Indonesia 16680. Jalan Agatis Kampus IPB
Dramaga. Email: [email protected]
Data analisis yang baik dan benar hanya dihasilkan dari analisis yang menggunakan metode standar, baik standar nasional atau internasional yang tervalidasi menurut ketentuan SNI 19-17025-2000 serta memiliki ketertelusuran (traceability) ke standar nasional atau CRM (Certified Reference Materials). Meskipun demikian suatu laboratorium harus melakukan verifikasi kinerja metode tersebut agar dapat memenuhi persyaratan kebutuhan/ penggunaannya. Untuk metode hasil pengembangan suatu laboratorium, atau metode standar yang dimodifikasi, harus divalidasi terlebih dahulu.
Disadari akan pentingnya verifikasi dan validasi metode dalam menjamin ketepatan dan ketelitian data analisis, maka diperlukan data verifikasi minimal 1 kali dalam 1 tahun. Untuk bukti kepercayaan yang diberikan oleh instansi yang melakukan jasa analisis kimia, serta para produsen komoditi dimana salah satu penilaian kualitas produknya adalah hasil analisis kimia.
A. Chemical Oxygen Demand (COD) atau Kebutuhan Oksigen Kimia (KOK) Berdasarkan Metode ASTM D 1252 (A), Metode Photometri SQ 118, dan Metode EPA 410.3
Chemical Oxygen Demand (COD) atau Kebutuhan Oksigen Kimia (KOK) adalah jumlah oksigen (mg O2) yang dibutuhkan untuk mengoksidasi zat-zat organik yang terdapat dalam 1 liter sampel air, dengan pengoksidasi K2Cr2O7 yang digunakan sebagai sumber oksigen (oxidizing agent).
Angka BOD merupakan ukuran bagi pencemaran air oleh zat-zat organik yang secara alami dapat dioksidasikan melalui proses mikrobiologi, dan mengakibatkan berkurangnya oksigen terlarut di dalam air.
Analisis COD berbeda dengan analisis BOD namun perbandingan antara angka COD dengan angka BOD dapat ditetapkan. Nilai BOD selalu lebih kecil dari nilai COD. Hal ini disebabkan karena BOD bergantung kepada bakteri pengurainya. Misalnya dalam air terdapat senyawa kompleks dan senyawa sederhana. Umumnya, bakteri bisa menguraikan senyawa organik yang sederhana saja, sehingga senyawa organik yang kompleks belum teroksidasi sempurna. Berbeda dengan penetapan COD, seluruh senyawa organik bisa diuraikan sehingga jumlahnya selalu lebih besar dari BOD. Dalam tabel 1. Tercantum perbandingan angka tersebut untuk beberapa jenis air.
Tabel 1. Perbandingan rata-rata angka BOD5/COD untuk beberapa jenis air
Jenis Air BOD5/COD
Air buangan domestik (penduduk) 0,40 – 0,60
Air buangan domestik setelah pengendapan primer 0,60
Air buangan domestik setelah pengolahan secara biologis 0,20
Air sungai 0,10
Ket: BOD5 adalah BOD pada hari kelima
Angka perbandingan yang lebih rendah dari seharusnya, misalnya untuk air buangan penduduk (domestik) < 0,20, menunjukkan adanya zat-zat yang bersifat racun bagi mikroorganisme.
Tidak semua zat-zat organik dalam air buangan maupun air permukaan dapat dioksidasi melalui tes COD atau BOD. Tabel 2 dibawah ini merupakan jenis zat-zat organik atau anorganik yang tidak atau dapat dioksidasikan oleh tes COD dan BOD.
3
Tabel 2. Jenis zat-zat yang tidak atau dapat dioksidasi melalui tes COD dan BOD Jenis zat organik / anorganik Dapat dioksidasi melalui tes
COD BOD
Zat organik yang biodegradable a
(protein, gula, dan sebagainya) X X
Selulosa dan sebagainya X -
N organik yang biodegradable
(protein dan sebagainya) X X
N organik yang non-biodegradable, NO2-, Fe2+, S2-, dan Mn2+
X -
NH4+ bebas (nitrifikasi) - Xb
Hidrokarbon aromatik dan rantai Xc -
Keterangan :
a Biodegradable = dapat diuraikan
b Mulai setelah 4 hari, dan dapat dicegah dengan pembubuhan inhibitor. c Dapat dioksidasikan karena adanya katalisator Ag
2SO4
Theoretical Oxygen Demand (ThOD) atau Kebutuhan Oksigen Teoritis adalah kebutuhan oksigen untuk mengoksidasi zat organik dalam air yang dihitung secara teoritis. Jumlah oksigen tersebut dihitung bila komposisi zat-zat organik terlarut telah diketahui dan dianggap semua C, H, dan N habis teroksidasi menjadi CO2, H2O, dan NO3-. Untuk masing-masing jenis air (air sungai, air buangan penduduk, air limbah industri) terdapat perbandingan angka ThOD, COD, dan BOD yang tertentu. Tabel 3 menunjukkan perbandingan angka-angka tersebut untuk air buangan penduduk.
Tabel 3. Perbandingan angka kebutuhan oksigen teoritis, kimia, dan biokimia, untuk air buangan penduduk (suhu 20oC bagi tes BOD)
ThOD 100 %
COD (metode standar) 83 %
BOD20 (BOD ultimat) dengan nitrifikasi 69 %
BOD20 (BOD ultimat) nitrifikasi ditiadakan 59 %
BOD5 dengan nitrifikasi 48 %
BOD5 nitrikifasi ditiadakan 42 %
Keterangan :
Angka-angka tersebut dapat menyimpang sebesar 10 %. 1. Prinsip Analisis COD
Sebagian besar zat organik melalui tes COD ini dioksidasi oleh larutan K2Cr2O7 dalam keadaan asam yang mendidih (reaksi 1) :
Ag2SO4
CaHbOc + Cr2O7 2- + 8 H+ CO2 + 2 Cr3+ + 4 H2O (1) (warna kuning) (warna hijau)
Selama reaksi yang berlangsung ± 2 jam ini, uap direfluks dengan alat kondensor, agar zat organik yang bersifat volatil (mudah menguap) tidak lenyap keluar.
Perak sulfat (Ag2SO4) ditambahkan sebagai katalisator untuk mempercepat reaksi. Sedangkan merkuri sulfat (HgSO4) ditambahkan untuk menghilangkan gangguan klorida yang pada umumnya ada di dalam air buangan.
Untuk memastikan bahwa hampir semua zat organik habis teroksidasi maka zat pengoksidasi K2Cr2O7 masih harus tersisa sesudah direfluks. K2Cr2O7 yang tersisa di dalam larutan tersebut digunakan untuk menentukan berapa oksigen yang telah terpakai. Sisa K2Cr2O7 tersebut ditentukan melalui titrasi dengan fero amonium sulfat (FAS), dengan reaksi yang berlangsung sebagai berikut :
6 Fe2+ + Cr2O72- + 14 H+ 6 Fe3+ + 2 Cr3+ + 7 H2O (2) Indikator feroin yang digunakan untuk menentukan titik akhir titrasi yaitu disaat warna hijau kebiruan larutan berubah menjadi cokelat kemerahan. Sisa K2Cr2O7 dalam larutan blanko adalah K2Cr2O7 awal, karena diharapkan blanko tidak mengandung zat organik yang dapat dioksidasi oleh K2Cr2O7.
5
2. Prinsip Metode Photometri Spectro Quant 118
Metode ini sesungguhnya sebanding dengan metode uji cara refluks titrasi, yang membedakan hanya penggunaan volume larutan sampel dalam jumlah kecil berupa kuvet bulat dari spektrofotometer untuk absorbansinya pada panjang gelombang yang dipilih. Metode ini hanya diaplikasikan pada volume-volume sampel yang sedikit dan menghendaki rentang tiap analisis serta penggunaan bahan-bahan yang sedikit, sehingga lebih ekonomis.
Sampel dimasukkan dengan hati-hati pada tabung reaksi yang telah dimasukkan reagen deret tinggi dan katalis Ag2SO4 terlebih dahulu kemudian di tutup rapat. Teknik ini bertujuan untuk meminimalisi hilangnya bahan-bahan organik yang mudah menguap.
Setelah ditutup, tabung dipanaskan dalam pemanas listrik pada suhu 148oC selama 2 jam. Konsentrasi COD ditentukan melalui metode spektrofotometri pada panjang gelombang 600 nm setelah pemanasan.
Bahan-bahan organik yang mudah menguap akan hilang bila sampel dengan reagen dikocok-kocok sebelum kuvet ditutup. Hilangnya bahan-bahan organik pada prosedur metode spektrofotometri lebih sedikit daripada metode titrasi.
Kesalahan pengukuran secara spektrofotometer dapat terjadi karena kekeruhan dari garam-garam yang terbentuk. Kuvet yang digunakan harus bebas dari goresan pada kaca. Apabila kuvet kurang tepat untuk digunakan, jangan masukan sampel kedalamnya.
Penetapan Kebutuhan Oksigen Kimiawi cara Photometer SQ 118 ini berdasarkan kepada penentuan sisa oksidator, yaitu ke dalam larutan yang dianalisis dilewatkan berkas sinar monokromatis. Energi sinar yang melewati larutan tersebut hanya dapat diadsorb oleh dikromat. Besarnya energi yang diadsorbsi oleh dikromat berbanding lurus dengan konsentrasi dikromat dalam larutan.
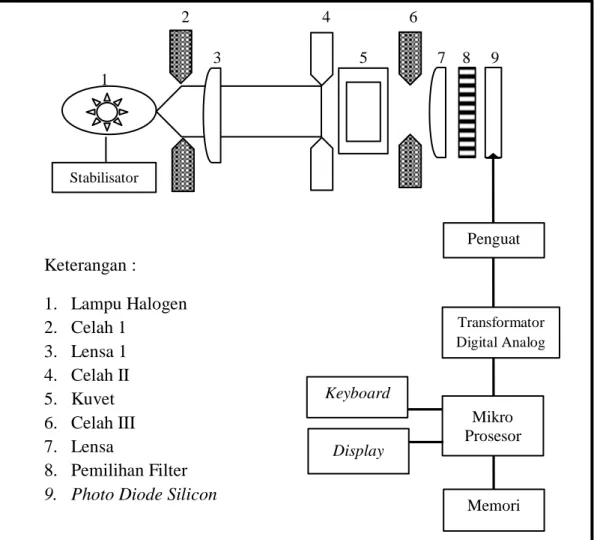
Spektofotometri adalah suatu proses analisis optis. Proses ini menggunakan serapan cahaya yang dilewatkan dalam larutan untuk menentukan konsentrasi dari zat yang terdapat dalam sampel. Lampu halogen yang tersedia berfungsi sebagai sumber cahaya dalam Photometer SQ 118. Lampu halogen ini memancarkan cahaya spektrum dilewatkan melalui celah masuk dan didispersikan oleh lensa.
Pita panjang gelombang yang sempit (idealnya monokhromatis) dari sinar yang didifraksikan melalui celah kedua dilewatkan ke dalam larutan sampel yang diukur. Sinar yang tidak diserap oleh larutan sampel tetapi melewati larutan dilewatkan celah ketiga dan dilewatkan melalui lensa kedua sampai pada pemilihan filter. Bagian ini digunakan untuk menyeleksi bagian sempit dari deret panjang gelombang kira-kira 10 nm. Sebagai contoh filter hijau, hanya cahaya hijau yang diperbolehkan untuk digunakan, sedangkan panjang gelombang yang lain memutar kembali. Kemudian setelah didapatkan panjang gelombang yang cocok sampai pada photodiode silicon dari instrumen, selanjutnya untuk mengukur intensitas sinar ditransmisikan secara elektronik dan pengukuran data diukur oleh mikro processor secara digital.
2 4 6 3 5 7 8 9 1 Keterangan : 1. Lampu Halogen 2. Celah 1 3. Lensa 1 4. Celah II 5. Kuvet 6. Celah III 7. Lensa 8. Pemilihan Filter 9. Photo Diode Silicon
Gambar 1. Konstruksi Pengukuran Photometer SQ 118
Stabilisator Memori Penguat Mikro Prosesor Transformator Digital Analog Display Keyboard
7
Bila cahaya jatuh pada suatu medium homogen, sebagian dari sinar masuk akan dipantulkan, sebagian diserap dalam medium itu dan sisanya diteruskan. Jika intensitas sinar yang diteruskan, maka perbandingan antara intensitas sinar yang masuk dengan intensitas sinar yang diteruskan digambarkan sebagai transmisi.
Gambar 2. Intensitas Cahaya Terhadap Media Keterangan :
Io = Intensitas cahaya mula-mula Ia = Intensitas cahaya yang diserap Ir = Intensitas cahaya yang dipantulkan
It = Intensitas cahaya yang diteruskan atau dipancarkan
Hukum yang mendasari alat spektrofotometer yaitu Hukum Lambert-Beer, yang berbunyi:
“Bila suatu cahaya monokromatis melalui suatu media yang transparan, maka bertambah turunnya intensitas cahaya yang dipancarkan sebanding dengan bertambahnya tebal media dan kepekatan zat uji.”
Hukum tersebut dapat dirumuskan sebagai berikut : A = -log T = logIo
It T = It
Io A = Ɛ.C.t
Sehingga dapat disimpulkan : A = -log T = log100
%T = Ɛ.C.t Keterangan :
T = transmisi Io = intensitas sinar masuk C = kepekatan It = intensitas sinar keluar t = tebal media
Ɛ = tetapan (molar absorbtivity index) Io
Ir Contoh
Ia
3. Gangguan, Keuntungan, dan Kekurangan Tes COD
a. Gangguan
Kadar klorida (Cl-) sampai 800 mg/L di dalam sampel dapat menggangu bekerjanya katalisator Ag2SO4, dan pada keadaan tertentu turut teroksidasi oleh dikromat, sesuai reaksi di bawah ini :
6 Cl- + Cr2O72- + 14 H+ 3 Cl2 + 2 Cr3+ + 7 H2O (3) Gangguan ini dapat dihilangkan dengan penambahan merkuri sulfat (Hg2SO4) pada sampel, sebelum penambahan pereaksi lainnya. Ion merkuri bergabung dengan ion klorida membentuk merkuri klorida, sesuai reaksi di bawah ini :
Hg2+ + 2 Cl- HgCl2 (4)
Dengan adanya ion Hg2+ ini, konsentrasi ion Cl- menjadi sangat kecil dan tidak mengganggu oksidasi zat organik dalam tes COD.
1Nitrit (NO
2-) juga teroksidasi menjadi nitrat (NO3-). 1 mg NO2 – N* ~ i, 1 mg COD. Jika konsentrasi NO2 – N > 2 mg/L, maka harus dilakukan penambahan 10 mg asam sulfamat per mg NO2 – N baik dalam sampel maupun dalam blanko.
b. Keuntungan tes COD dibandingkan dengan tes BOD
Analisis COD hanya memakan waktu kurang lebih 3 jam, sedangkan analisis BOD5 memerlukan waktu 5 hari. Untuk menganalisis COD antara 50 – 800 mg/L, tidak dibutuhkan pengenceran sampel, sedangkan pada umumnya analisis BOD selalu membutuhkan pengenceran.
Ketelitian dan ketepatan (reproducibility) tes COD adalah 2 sampai 3 kali lebih tinggi dari tes BOD. Gangguan dari zat yang bersifat racun terhadap mikroorganisme pada tes BOD, tidak menjadi masalah pada tes COD.
1 NO
-9
c. Kekurangan
Tes COD hanya merupakan suatu analisis yang menggunakan suatu reaksi oksidasi kimia yang menirukan oksidasi biologi (yang sebenarnya terjadi di alam), sehingga merupakan suatu pendekatan saja. Karena hal tersebut maka tes COD tidak dapat membedakan antara zat-zat yang teroksidasi secara biologi.
4. Ketelitian dan Perhitungan
Penyimpangan baku antar laboratorium adalah 13 mg/L. Penyimpangan maksimum dari hasil analisis dalam suatu laboratorium sebesar 6 % masih diperkenankan.
Perhitungan COD yaitu :
COD (mg/L) = (b−a) x N x 8 x 1000
S
Keterangan:
b = Volume FAS yang dibutuhkan untuk titrasi blanko. a = Volume FAS yang dibutuhkan untuk titrasi sampel. N = Normalitas FAS yang digunakan
S = Volume sampel yang digunakan.
5. Pengambilan dan Pengawetan Sampel
Gunakan botol kaca bila memungkinkan. Penggunaan botol plastik harus bersih dari zat-zat organik yang mungkin tersisa di dalamnya.
Sampel yang mengandung lumpur harus dikocok sampai merata sebelum dianalisis, karena lumpur juga terdiri dari zat-zat organik yang harus dioksidasikan dalam tes COD untuk mendapatkan angka COD yang benar dan tepat.
Sampel yang tidak stabil yaitu sampel yang mempunyai kadar bakteri atau Fe2+ tinggi, harus dianalisis segera.
Sampel dapat diawetkan dengan penambahan larutan H2SO4 pekat sampai pH 2 (kira-kira 0,8 mL H2SO4/ L sampel), dan disimpan pada suhu 4oC.
10
B. Salinitas dengan Standard Method 16th Edition dan Horiba U-10
1. Prinsip Analisis Salinitas
Salinitas adalah tingkat keasinan atau kadar garam terlarut dalam air. Salinitas juga dapat mengacu pada kandungan garam dalam tanah. Air laut secara alami merupakan air saline dengan kandungan garam sekitar 3 - 5 %.
Salinitas air berdasarkan persentase garam terlarut
Air Tawar Air Payau Air Saline Brine
<0,05 % 0,05 – 3 % 3 – 5 % > 5 %
Istilah teknik untuk keasinan lautan adalah halinitas, dengan didasarkan bahwa halida-halida terutama klorida adalah anion yang paling banyak dari elemen-elemen terlarut. Dalam oseanografi, halinitas biasa dinyatakan bukan dalam persen tetapi dalam bagian perseribu (part per thousand, ppt) atau permil (‰), kira-kira sama dengan jumlah gram garam untuk setiap kilogram larutan.
Salinitas menggunakan metode Argentometri, metode ini menggunakan penitar Perak Nitrat (AgNO3) 0,28 N dan indikator K2CrO4 (Underwood A.L, Analisis Kimia Kuantitatif). Disini terjadi pengendapan sempurna ion yang sedang ditentukan dengan larutan perak, misalnya saja untuk titrasi ion klorida, mula-mula akan terbentuk endapan putih AgCl sampai seluruh ion klorida habis bereaksi. Keberadaan sedikit ion kromat mampu membentuk endapan berwarna merah coklat dengan ion perak (I) berlebih.
Reaksinya adalah AgNO3 + Cl- AgCl (putih) AgNO3 + CrO42- Ag2CrO4 (merah bata)
Seluruh AgCl akan mengendap lebih dulu, karena hasil kelarutannya (ksp) lebih kecil daripada Ksp Ag2CrO4.
11
2. Gangguan, Keuntungan, dan Kekurangan Uji Salinitas
Kekurangan uji salinitas dengan metode argentometri adalah membutuhkan pereaksi perak yang harganya relatif mahal. Selain itu mungkin terjadi kesalahan pengamatan endapan pada saat pengamatan titik akhir dalam proses titrasi.
3. Ketelitian dan Perhitungan
- Klorisitas ekivalen dari 1 mL Larutan AgNO3 : Cl Eq = N AgNO3 x 0.0355
- Klorisitas
Clo = mL AgNO3 x Cl Eq x fp - Salinitas
Berdasarkan tabel konversi Klorisitas-Salinitas, didapatkan hasil dengan satuan g/kg.
12
C. Oksigen Terlarut Secara Yodometri SNI 06-6989.14-2004
1. Prinsip Analisis Oksigen Terlarut
Adanya oksigen terlarut di dalam air yang berasal dari udara dan dari prosen fotosintesa tumbuhan air, sangat penting untuk menunjang kehidupan organisme air. Kemampuan air untuk membersihkan pencemaran secara alamiah banyak tergantung pada kecukupan kadar oksigen terlarut. Oksigen terlarut (Dissolved Oxygen) adalah jumlah miligram oksigen terlarut dalam air yang dinyatakan dengan mg O2/L.
Oksigen dalam sampel akan mengoksidasi MnSO4 yang ditambahkan ke dalam larutan dalam keadaan basa sehingga terjadi endapan MnO2. Dengan penambahan asam sulfat pekat dan alkali iodida-azida, maka akan dibebaskan iod yang ekivalen dengan oksigen terlarut. Iod yang dibebaskan tersebut kemudian dianalisis dengan metode titrasi iodometri yaitu dengan menggunakan larutan standar tiosulfat dan indikator kanji dengan titik akhir tak berwarna.
Reaksi : MnSO4 + 2 KOH Mn(OH)2(putih) + K2SO4 Mn(OH)2 + ½ O2 MnO2 (coklat) + H2O MnO2 + KI + 2 H2O Mn(OH)2 + I2 + 2 KOH I2 + 2 Na2S2O3 2 NaI + Na2S4O6
2. Gangguan, Keuntungan, dan Kekurangan Uji Oksigen Terlarut
Kekurangan Uji Oksigen terlarut adalah proses pengamatan pada saat penambahan MnSO4 dan alkali iodida azida yang menghasilkan warna endapan coklat atau putih. Ketika penambahan H2SO4 pekat ke dalam larutan, maka endapan tersebut akan larut. Apabila terbentuk endapan coklat, maka larutan akan berwarna coklat dan apabila terbentuk endapan putih maka larutan akan tidak berwarna, sehingga proses pengamatan pada saat titrasi akan menjadi sulit.
3. Ketelitian dan Perhitungan
Mg/L DO = Volume Penitar (Tio) x N tio x Bst O2 x 1000 Volume Botol−(V. MnSO4+V. Alkali Iodida Azida) Ket : Bst O2 = 8
13 D. Pendekatan Statistik
1. Kesalahan di dalam Analisis Kimia
Setelah melakukan analisis terhadap suatu sampel, seorang analis akan selalu dihadapkan pada masalah, yaitu keterpercayaan hasil yang didapatkan. Untuk itu, yang harus diperhatikan pertama kali adalah hal-hal yang biasa menyebabkan data yang diperoleh tersebut tidak dapat dipercaya. Dalam hal ini tentunya adanya kesalahan dalam melakukan analisis. Istilah kesalahan ini menunjuk kepada perbedaan antara data yang didapat dengan nilai yang sesungguhnya. Nilai sesungguhnya dari konstituen dalam suatu sampel adalah abstrak, dan dapat dilakukan pendekatan. Semakin dekat dengan nilai sesungguhnya, maka semakin baik analisis yang dilakukan dan semakin dapat dipercaya.
Didalam pekerjaan analisis kimia (analisis kuantitatif) terdapat dua jenis kesalahan yang mungkin terjadi, yaitu kesalahan determinan dan kesalahan indeterminan. Kesalahan determinan merupakan kesalahan yang pada umumnya mudah diketahui. Dimana sumber kesalahan ini adalah :
a. Kesalahan peralatan
Kesalahan peralatan dapat disebabkan oleh peralatan yang tidak sesuai, rusak, atau tidak dikalibrasi.
b. Kesalahan operator
Merupakan kesalahan personal yang dapat diperbaiki dengan semakin bertambahnya pengalaman serta keterampilan operator atau teknisi dalam menangani pekerjaan analis kimia. Kesalahan yang sering terjadi misalnya: memindahkan larutan, melarutkan zat, pemanasan sampel, dan sebagainya. Kesalahan operator lainnya meliputi kesalahan perhitungan dan pengertian yang keliru tentang suatu pengukuran. c. Kesalahan metode
Merupakan kesalahan serius yang dilakukan oleh analis kimia. Beberapa sumber kesalahan metode antara lain kotoran, pelarutan kembali dari suatu endapan adalah reaksi samping, reaksi-reaksi yang tidak sempurna, adanya impuritas di dalam reagen kimia dan sebagainya.
Sedangkan kesalahan indeterminan merupakan perbedaan-perbedaan hasil yang kecil yang tidak dapat diprediksi atau diestimasi dan terjadi pada saat pekerjaan analisis dilakukan secara berulang oleh seorang analis pada kondisi yang identik atau sama. Maka dalam hal ini untuk mengambil kesimpulan yang dianggap paling benar dapat digunakan hukum-hukum probabilitas.
Kesalahan indeterminan pada hakekatnya disebabkan oleh keterbatasan kemampuan dari analis untuk mengenali, mengontrol atau mengoreksi adanya faktor luar yang menyebabkan terjadinya kesalahan.
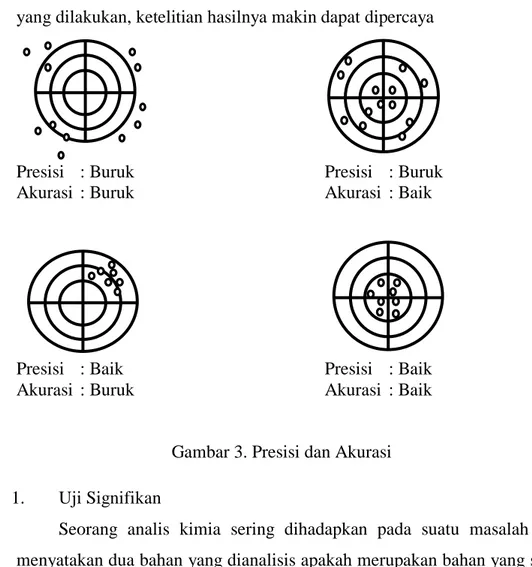
2. Ketepatan dan Ketelitian Pengukuran
Ketepatan atau akurasi adalah istilah yang digunakan untuk menyatakan ketepatan hasil pengukuran antara hasil yang diperoleh dari suatu pengukuran dengan hasil atau harga yang sebenarnya. Harga yang sebenarnya seringkali jarang diketahui, oleh sebab itu akurasi ini merupakan ukuran kecocokan dengan harga yang dianggap benar.
Akurasi dari suatu metode atau suatu pengukuran dapat dihitung dengan cara perbandingan harga yang diukur dengan harga yang diketahui dari suatu zat standar yang telah diketahui komposisinya.
Ketelitian atau presisi adalah istilah yang digunakan untuk menyatakan kecocokan hasil dari suatu pengukuran berulang dari suatu sampel yang diukur. Presisi dapat pula dinyatakan sebagai kedapatan ulang. Suatu pengukuran akan memberikan ketelitian atau presisi yang bagus tetapi belum tentu memberikan ketepatan atau akurasi yang baik, misalnya bila pada pengukuran terjadi kesalahan sistematik. Sebaliknya, presisi secara relatif memberikan harga yang jelek, namun akurasinya diantara sekian banyak pengukuran beberapa diantaranya memberikan harga yang tetap.
Namun karena pada umumnya harga pengukuran atau hasil analisis yang sebenarnya tidaklah diketahui, maka dapat dikatakan bahwa semakin baik presisinya, semakin besar kemungkinannya untuk mendapatkan harga yang sebenarnya. Kita tidak akan dapat mengharapkan hasil yang tepat atau akurat bila ketelitian atau presisi pengukurannya buruk. Para analis berupaya
15
melakukan pengukuran hasil yang menyakinkan semakin banyak pengukuran yang dilakukan, ketelitian hasilnya makin dapat dipercaya
Presisi : Buruk Presisi : Buruk
Akurasi : Buruk Akurasi : Baik
Presisi : Baik Presisi : Baik
Akurasi : Buruk Akurasi : Baik
Gambar 3. Presisi dan Akurasi 1. Uji Signifikan
Seorang analis kimia sering dihadapkan pada suatu masalah untuk menyatakan dua bahan yang dianalisis apakah merupakan bahan yang sejenis atau berbeda. Dalam hal ini keputusan harus diambil apakah perbedaan hasil analisis kedua bahan tersebut merupakan harga kesalahan indeterminan atau memang merupakan harga yang berbeda.
Selain itu, seorang analis juga perlu membandingkan dua metode analisis, misalnya salah satunya adalah metode analisis yang sedang dikembangkan dan metode lainnya adalah metode yang telah sering digunakan karena merupakan metode standar (misalnya metode ASTM, IP, ISO, SII, SNI, dll). Bagaimana seorang analis ini akan mengambil keputusan bila hasil-hasil analisis yang dikerjakan terhadap bahan yang sama tetapi menggunakan metode yang berbeda ini menunjukkan perbedaan yang signifikan? Untuk ini diperlukan kaidah statistik uji signifikan.
2. Uji Ketepatan (Uji t)
Tingkat ketepatan suatu metode dapat diuji dengan membandingkan harga rata-rata dari sederetan data dari percobaan dengan nilai rata-rata sesungguhnya yang merupakan harga yang telah diketahui dari penelitian sebelumnya atau jumlah yang diketahui dari suatu sampel larutan.
Cara ini disebut uji t dengan persamaan sebagai berikut : t = ( x̅ - µ ) √N
S Keterangan :
x̅ = rata-rata statistik dari sederetan data percobaan
µ = jumlah sesungguhnya suatu konstituen dalam sampel buatan s = standar deviasi
N = jumlah data
Bila harga t hitung yang diperoleh lebih kecil dari harga t pada tabel, maka perbedaan harga antara sebenarnya µ, dan harga hasil pengukuran x, tidak signifikan. Artinya kedua harga tersebut dikatakan sama.
5. Uji Kecermatan (Uji F)
Uji F digunakan untuk menunjukkan apakah ada perbedaan yang signifikan antara dua buah metode berdasarkan perhitungan simpangan baku masing-masing metode. F didefinisikan sebagai perbandingan variansi dari kedua metode, sedang variansi itu sendiri adalah kuadrat dari simpangan bakunya. Persamaan sebagai berikut :
F = 𝑆1
2
𝑆22
Dimana S12 > S22. Dalam hal ini terdapat dua derajat perbedaan yang berbeda, yaitu derajat kebebasan dari metode pertama dan derajat kebebasan dari metode lainnya yang besarnya masing-masing adalah N-1, dimana N adalah jumlah pengukuran masing-masing metode.
Bila harga F yang dihitung dengan rumus diatas harganya lebih besar dari harga F pada tabel pada tingkat kepercayaan yang dipilih, maka dikatakan adanya perbedaan yang signifikan dari variansi kedua metode tersebut.
17
METODE ANALISIS
A. Chemical Oxygen Demand (COD) atau Kebutuhan Oksigen Kimia (KOK) Berdasarkan Metode ASTM D 1252 (A), Metode EPA 410.3, dan Metode Photometri SQ 118
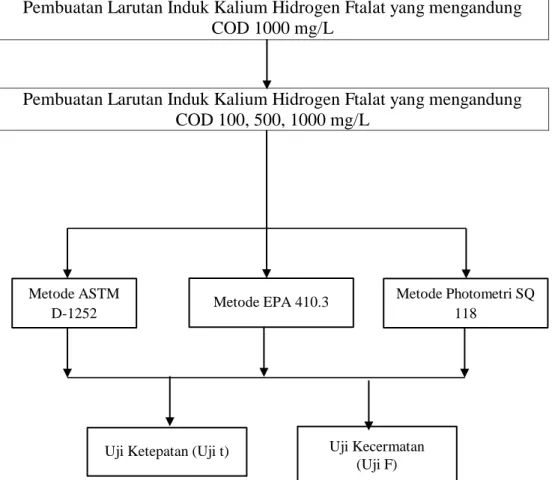
Pembuatan Larutan Induk Kalium Hidrogen Ftalat yang mengandung COD 1000 mg/L
Pembuatan Larutan Induk Kalium Hidrogen Ftalat yang mengandung COD 100, 500, 1000 mg/L
Gambar 4. Skema Langkah Kerja COD
Metode ASTM D-1252
Metode Photometri SQ 118
Uji Ketepatan (Uji t)
Metode EPA 410.3
Uji Kecermatan (Uji F)
1. Persiapan Analisis
a) Persiapan Larutan Standar Kalium Hidrogen Ftalat
- Larutan induk Kalium Hidrogen Ftalat yang mengandung COD 1000 mg/L (1 mL = 1 mg COD)
Dilarutkan 0,851 g Kalium Hidrogen Ftalat (KC8H5O4) standar primer dengan aquadest dalam labu ukur 1 L dan diencerkan sampai tanda batas.
- Larutan standar Kalium Hidrogen Ftalat yang mengandung COD 100 mg/L yaitu dengan cara memipet sebanyak 10 mL yang dimasukkan dan dilarutkan dengan air suling dalam labu ukur 100 mL, sehingga dalam labu ukur 100 mL tersebut terdapat 100 mg/L COD.
b) Persiapan Alat-Alat yang Digunakan
i. Alat-alat yang digunakan pada ASTM D – 1252 (A) : - Pipet volum 10, 20, dan 50 mL
- Labu semprot - Batu didih - Bulp - Buret 50 mL - Erlenmeyer Asah 500 mL - Statif - Piala Gelas 400 mL - Hot Plate - Refluks - Pipet Tetes - Gelas Ukur 100 mL - Neraca Digital
- Labu Ukur 100 mL dan 1 liter - Pengaduk
- Kaca Arloji - Corong - Lemari Asam
19
ii. Alat-alat yang digunakan pada Photometri SQ 118 : - Alat Photometer Spectro Quant 118 merk Merck - Thermoreactor
- Tabung Ulir
- Pipet serologi 5 dan 10 mL - Labu Ukur 100 mL dan 1 L - Corong
- Pengaduk - Bulb
iii. Alat-alat yang digunakan pada EPA 410.3 : - Pipet volum 10, 20, dan 50 mL
- Labu semprot - Batu didih - Bulp - Buret 50 mL - Erlenmeyer Asah 500 mL - Statif - Piala Gelas 400 mL - Hot Plate - Refluks - Pipet Tetes - Gelas Ukur 100 mL - Neraca Digital
- Labu Ukur 100 mL dan 1 liter - Pengaduk
- Kaca Arloji - Corong - Lemari Asam
c) Persiapan Bahan-Bahan yang Digunakan
i. Bahan-Bahan yang Digunakan pada ASTM D – 1252 (A)
- Larutan Standar Kalium Hidrogen Ftalat (KC8H5O4) 100, 1000 mg/L
- Fero amonium sulfat 0,25 N (FAS / FeSO4.(NH4)2SO4.6 H2O) - Merkuri sulfat (Hg2SO4)
- Indikator Ferroin Sulfat
- Kalium dikromat (K2Cr2O7) 0,25 N - Reagen Sulfat (Ag2SO4 dan H2SO4 pekat) - Aquadest
- Es batu
ii. Bahan-Bahan yang Digunakan pada Photometri SQ – 118
- Larutan Standar Kalium Hidrogen Ftalat (KC8H5O4) 100, 1000 mg/L
- Larutan COD A (Merkuri sulfat (HgSO4))
- Larutan COD B (Kalium dikromat (K2Cr2O7) dan Asam Sulfat pekat ( H2SO4 (p) )
- Aquadest
iii. Bahan-Bahan yang Digunakan pada EPA 410.3
- Larutan Standar Kalium Hidrogen Ftalat (KC8H5O4) 100, 500 mg/L
- Fero amonium sulfat 0,25 N (FAS / FeSO4.(NH4)2SO4.6 H2O) - Merkuri sulfat (Hg2SO4)
- Indikator Ferroin Sulfat
- Kalium dikromat (K2Cr2O7) 0,25 N - Reagen Sulfat (Ag2SO4 dan H2SO4 pekat) - Aquadest
- Es batu
21
2. Prosedur Analisis
a) Standarisasi Fero Alumunium Sulfat (FAS) 0,25 N a. Disiapkan larutan Kalium Dikromat (K2Cr2O7) 0,25 N
b. Dipipet 25 mL larutan Kalium Dikromat (K2Cr2O7), dimasukkan ke dalam erlenmeyer
c. Ditambahkan 5 mL H2SO4 4N dan beberapa tetes indikator Ferroin. d. Dititrasi dengan FAS hingga titik akhir larutan dan endapan merah
bata.
b) Prosedur Analisis COD ASTM D – 1252 (A)
a. Disiapkan sampel larutan standar COD (KHP) 100 dan 1000 mg/L. b. Dipipet 10 mL larutan standar COD, dipipet 40 mL air suling,
kemudian dimasukkan ke dalam erlenmeyer asah.
c. Dipipet 50 mL air suling ke dalam erlenmeyer asah untuk blanko. d. Erlenmeyer asah ditempatkan di atas baskom berisi es dan
ditambahkan 1-2 gram merkuri sulfat (Hg2SO4), 5 mL reagen sulfat, dan beberapa buah batu didih. Diaduk hingga homogen.
e. Dengan erlenmeyer asah tetap berada di baskom berisi es, ditambahkan 25 mL larutan kalium dikromat (K2Cr2O7) 0,25 N secara perlahan (dengan pipet volumetri) dan diaduk hingga homogen. f. Kemudian ditambahkan 70 mL reagen sulfat kembali secara perlahan,
Diaduk hingga homogen.
g. Erlenmeyer asah direfluks (memakai kondensor) dengan hot plate selama 2 jam.
h. Setelah 2 jam, erlenmeyer didinginkan, kemudian ditambahkan 8-10 tetes indikator feroin, lalu dititrasi dengan larutan FAS 0,25 N hingga titik akhir berwarna merah kecoklatan, dan dicatat volumenya.
c) Prosedur Analisis COD Photometri SQ 118
a. Dipipet 0,30 mL larutan A dan 2,30 mL larutan B, dimasukkan ke dalam test tube COD (kering dan bersih).
c. Ditambahkan 3 mL larutan standar Kalium Hidrogen Ftalat 100 dan 1000 mg/L ke dalam test tube yang telah diisi campuran larutan A dan B, dikocok sampai larut. Hal yang sama juga dilakukan untuk blanko. Perlu diperhatikan bahwa tabung reaksi menjadi panas akibat reaksi eksoterm dalam larutan.
d. Dipanaskan test tube tersebut di dalam thermoreactor selama 2 jam pada suhu 148oC.
e. Setelah itu test tube diangkat dan ditempatkan pada rak tabung, dibiarkan hingga dingin.
f. Tekan tombol n , masukkan nomor metode (nomor 29). Kemudian tekan tombol pada fotometer. Setelah itu tekan tombol . (blanko) tunggu sampai muncul waktu reaksi atau muncul tulisan “masukkan blanko” di layar.
g. Masukkan tabung yang bersisi blanko ke dalam tempat pengukuran. h. Tekan tombol , nilai blanko akan muncul (nol) di monitor. i. Keluarkan blanko, masukan sampel ke dalam tempat pengukuran. j. Tekan tombol , baca hasil yang keluar pada monitor.
d) Prosedur Analisis COD metoda EPA 410.3
a. Disiapkan sampel larutan standar COD (KHP) 100 mg/L dengan cara dipipet 10 mL larutan KHP 100.000 mg/L ke dalam labu ukur 100 mL.
b. Kemudian ditambahkan pengaruh gangguan kandungan Cl- 5000 mg/L (ditimbang 0,82399 g NaCl) dan 15000 mg/L (ditimbang 2,4720 g NaCl).
c. Diimpitkan dengan air suling hingga tanda tera.
d. Dipipet 10 mL larutan standar COD, kemudian dimasukkan ke dalam erlenmeyer asah. Dipipet 40 mL air suling, diaduk hingga hingga homogen.
e. Dipipet 50 mL air suling ke dalam erlenmeyer asah untuk blanko. f. Erlenmeyer asah ditempatkan di atas baskom berisi es dan
ditambahkan 1-2 gram merkuri sulfat (Hg2SO4), 5 mL reagen sulfat, dan beberapa buah batu didih. Diaduk hingga homogen.
23
g. Dengan erlenmeyer asah tetap berada di baskom berisi es, ditambahkan 25 mL larutan kalium dikromat (K2Cr2O7) 0,25 N secara perlahan (dengan pipet volumetri) dan diaduk hingga homogen. h. Kemudian ditambahkan 70 mL reagen sulfat kembali secara perlahan,
Diaduk hingga homogen.
i. Erlenmeyer asah direfluks (memakai kondensor) dengan hot plate selama 2 jam.
j. Setelah 2 jam, erlenmeyer didinginkan, kemudian ditambahkan 8-10 tetes indikator feroin, lalu dititrasi dengan larutan FAS 0,25 N hingga titik akhir berwarna merah kecoklatan, dan dicatat volumenya.
k. Membuat kurva koreksi klorida dengan COD (ordinat) dan klorida (absis) menggunakan Natrium Klorida dengan variasi konsentrasi klorida dari 4000 mg/L sampai 20.000 mg/L.
24
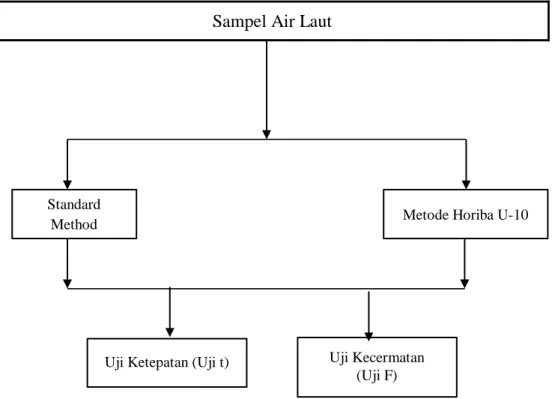
B. Salinitas Berdasarkan Standard Method 16th Edition dan Horiba U-10
Sampel Air Laut
Gambar 5. Skema Langkah Kerja Salinitas
Standard
Method Metode Horiba U-10
Uji Ketepatan (Uji t) Uji Kecermatan (Uji F)
25
1. Persiapan Analisis
a) Persiapan Larutan Standar NaCl
- Larutan induk Natrium Klorida yang memiliki konsentrasi 0,28 N. Dikeringkan 35,00 g NaCl, kemudian ditimbang sebesar 29,6740 g. Dilarutkan dengan aquadest dalam labu ukur 1 L dan diencerkan sampai tanda batas.
b) Persiapan Alat-Alat yang Digunakan i. Alat-alat yang digunakan pada ASTM :
- Pipet volum 25 mL - Labu semprot - Bulp - Buret 50 mL - Erlenmeyer Asah 500 mL - Statif - Piala Gelas 400 mL - Pipet Tetes - Gelas Ukur 100 mL - Neraca Digital - Labu Ukur 1 liter - Pengaduk
- Kaca Arloji - Corong
ii. Alat-alat yang digunakan pada Horiba : - Alat Water Checker U-10 Merk Horiba c) Persiapan Bahan-Bahan yang Digunakan
i. Bahan-Bahan yang Digunakan pada ASTM - Larutan Standar Natrium Klorida 0,28 N - Perak Nitrat (AgNO3) 0,28 N
- Indikator Kalium Kromat (K2CrO4) - Sampel Air Laut
ii. Bahan-Bahan yang Digunakan pada Horiba - Sampel Air Laut
2. Prosedur Analisis
a) Standarisasi Perak Nitrat 0,28 N
a. Disiapkan larutan Natrium Klorida (NaCl)
b. Dipipet 25 mL larutan NaCl, dimasukkan ke dalam erlenmeyer c. Ditambahkan 6 tetes indikator K2CrO4.
d. Dititrasi dengan AgNO3 hingga titik akhir terbentuk endapan coklat. b) Prosedur Analisis Salinitas ASTM
a. Disiapkan sampel larutan air laut, dipindahkan ke piala gelas 400 mL. b. Dipipet sebanyak 25 mL, dipindahkan ke dalam erlenmeyer asah 500
mL.
c. Ditambahkan 6 tetes indikator Kalium Kromat (K2CrO4) kemudian dihomogenkan.
d. Dititrasi dengan AgNO3 0,28 N dengan titik akhir endapan coklat.
c) Prosedur Analisis Salinitas Horiba
a. Disiapkan alat Horiba Water Checker U-10, ditekan tombol POWER. b. Setelah muncul angka pada layar, tekan tombol MODE. Pilih mode
SAL untuk pengecekan salinitas.
c. Dipindahkan sampel air laut ke dalam wadah pengukuran.
d. Dimasukkan tabung sel ke dalam wadah pengukuran, ditunggu hingga angka salinitas muncul dilayar.
27
C. Oksigen Terlarut Secara Yodometri SNI 06-6989.14-2004
1. Persiapan Analisis
a) Persiapan Larutan Natrium Tiosulfat 0,025 N
Ditimbang 6,2057 g Na2S2O3.5H2O. Kemudian dilarutkan dengan air suling dalam labu ukur 1 L. Dihomogenkan dan dipindahkan ke botol kaca.
b) Persiapan Pereaksi Larutan Alkali Iodida Azida
Ditimbang 70,0423 g KOH, 15,0013 g KI, dan 1,0035 g NaN3 kemudian masukkan ke dalam labu ukur 1 L, dilarutkan dengan air suling. Dihomogenkan dan dipindahkan ke botol kaca.
c) Persiapan Pereaksi Larutan MnSO4
Ditimbang 18,2003 g MnSO4.H2O kemudian dilarutkan dengan air suling ke dalam labu ukur 50 mL. Diaduk dan dihomogenkan.
d) Persiapan Alat-Alat yang Digunakan - Pipet volum 1 mL - Labu semprot - Bulp - Buret 50 mL - Erlenmeyer Asah 500 mL - Statif - Piala Gelas 400 mL - Pipet Tetes - Gelas Ukur 100 mL - Neraca Digital - Labu Ukur 1 liter - Pengaduk
- Kaca Arloji - Corong
e) Persiapan Bahan-Bahan yang Digunakan
- MnSO4.H2O - KOH
- Na2S2O3.5H2O - NaN3
2. Prosedur Analisis
a) Standarisasi Natrium Thiosulfat 0,025 N
a. Disiapkan larutan Kalium Dikromat (K2Cr2O7) 0,025 N
b. Dipipet 20 mL larutan Kalium Dikromat (K2Cr2O7), dimasukkan ke dalam erlenmeyer
c. Ditambahkan 10 mL Larutan KI 10%.
d. Dititrasi dengan Thio hingga warna larutan dari kuning menjadi kuning agak hijau, ditambahkan indikator kanji. Dititrasi kembali hingga titik akhir larutan berwarna hijau.
b) Prosedur Verifikasi Analisis Oksigen Terlarut a. Disiapkan air yang telah di aerasi selama 24 jam.
b. Disiapkan botol DO Winkler 300 mL, dicelupkan ke dalam wadah air aerasi sehingga terisi penuh, ditutup.
c. Ditambahkan 1 mL MnSO4 secara terukur.
d. Setelah itu ditambahkan 1 mL Alkali Iodida Azida secara terukur, ditutup kemudian dikocok hingga terbentuk endapan. (Endapan putih = DO kecil, Endapan Coklat = DO besar)
e. Ditambahkan 1 mL H2SO4 pekat ke dalam botol winkler tersebut. Dikocok kembali.
f. Dipindahkan larutan yang berada di dalam botol winkler ke dalam erlenmeyer.
g. Dititrasi dengan Thio hingga warna larutan dari kuning menjadi kuning agak hijau, ditambahkan indikator kanji. Dititrasi kembali hingga titik akhir larutan berwarna hijau.
29
HASIL DAN PEMBAHASAN
A. Hasil Penentuan COD Berdasarkan Metode ASTM D-1252 (A), Metode Photometri SQ 118, dan EPA 410.3
Tabel 4. Data hasil analisis COD berdasarkan metode ASTM D-1252 (A)
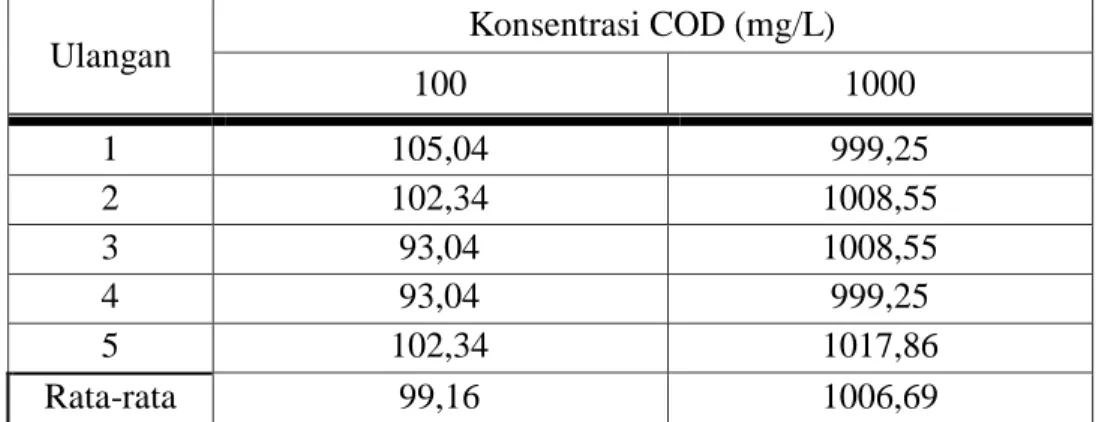
Ulangan Konsentrasi COD (mg/L)
100 1000 1 105,04 999,25 2 102,34 1008,55 3 93,04 1008,55 4 93,04 999,25 5 102,34 1017,86 Rata-rata 99,16 1006,69
Tabel 5. Nilai t perhitungan pada analisis COD berdasarkan metode ASTM D-1252 (A)
Konsentrasi COD (mg/L) Nilai t perhitungan t tabel
100 -0,3301 2,776
1000 1,9228 2,776
Tabel 6. Data analisis COD berdasarkan metode Photometri SQ 118
Ulangan Konsentrasi COD (mg/L)
100 1000 1 94 1004 2 96 993 3 101 990 4 104 980 5 98 1002 Rata-rata 98.6 993.8
Tabel 7. Nilai t perhitungan pada analisis COD berdasarkan metode Photometri SQ 118
Konsentrasi COD (mg/L) Nilai t perhitungan t tabel
100 -0,7885 2,776
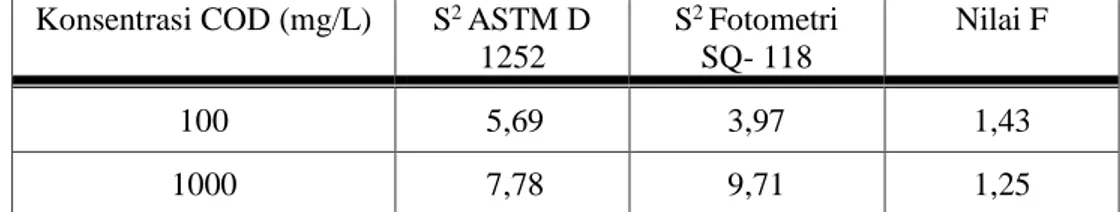
Tabel 8. Uji Kecermatan (Uji F) antara metode standard methods ASTM D 1252 dan Fotometri SQ- 118 dari hasil analisa COD 100 dan 1000 mg/L.
Konsentrasi COD (mg/L) S2 ASTM D
1252 S2 Fotometri SQ- 118 Nilai F 100 5,69 3,97 1,43 1000 7,78 9,71 1,25
Untuk melihat tingkat ketepatan masing-masing metode maka dilakukan uji ketepatan. Pengujian tingkat ketepatan harus ditentukan terlebih dahulu nilai t dalam tabel dengan derajat kepercayaan yang dipilih. Ternyata nilai t tabel untuk 5 buah data dengan derajat kepercayaan 95% adalah 2,776. Pada tabel 5 nilai t hitung untuk metode ASTM D 1252 (A) terhadap nilai COD pada konsentrasi 100 mg/L adalah -0,3301 dan nilai COD pada konsentrasi 1000 mg/L adalah 1,9228. Demikian pula untuk metode Photometri SQ 118, pada tabel 7 nilai t hitung pada nilai COD untuk konsentrasi 100 mg/L adalah -0,7885 dan untuk konsentrasi 1000 mg/L adalah sebesar -1,4278.
Uji kecermatan (Uji F) yang dilakukan untuk menunjuk apakah ada perbedaan yang signifikan antara metode standard methods ASTM D 1252 dan Fotometri SQ 118 berdasarkan perhitungan simpangan baku masing-masing metode, diperoleh bahwa harga F hitung lebih kecil dari F tabel, maka disimpulkan bahwa kedua metode tidak berbeda nyata.
31
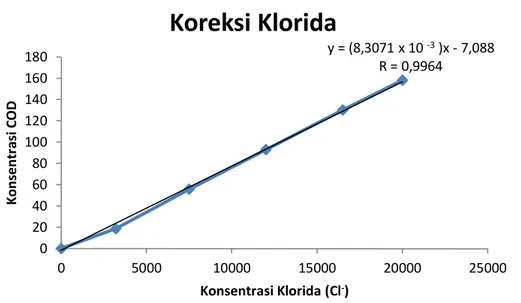
Gambar 6. Kurva Linearitas Koreksi Klorida COD Metode EPA 410.3
Tabel 9. Data hasil analisis COD berdasarkan metode EPA 410.3
Ulangan COD 100 mg/l dengan 5.000 mg/L Cl -COD 100 mg/l dengan 15.000 mg/L Cl -COD 500 mg/l dengan 5.000 mg/L Cl -COD 500 mg/l dengan 15.000 mg/L Cl -1 95,81 99,61 502,49 501,90 2 103,25 99,61 492,39 508,63 3 100,21 106,35 509,22 501,90 Rata-rata 99,76 101,86 501,37 504,14
Tabel 10. Nilai t perhitungan pada analisis COD berdasarkan metode EPA 410.3
Konsentrasi COD (mg/L)
dan pengaruh klorida (Cl-) Nilai t perhitungan t tabel
100 mg/L Cl- 5000 ppm -0.1112 4,303 100 mg/L Cl- 15000 ppm 0,8282 4,303 500 mg/L Cl- 5000 ppm 0,2802 4,303 500 mg/L Cl- 15000 ppm 1,8434 4,303 0 20 40 60 80 100 120 140 160 180 0 5000 10000 15000 20000 25000 K on sent ra si C O D Konsentrasi Klorida (Cl-)
Koreksi Klorida
y = (8,3071 x 10 -3)x - 7,088 R = 0,9964Pada tabel 10 (metode EPA 410.3) nilai t yang didapat pada COD konsentrasi 100 mg/L dengan gangguan klorida 5.000 mg/L Cl-, COD konsentrasi 100 mg/L dengan gangguan klorida 15.000 mg/L Cl-, COD konsentrasi 500 mg/L dengan gangguan klorida 5.000 mg/L Cl- dan COD konsentrasi 500 mg/L dengan gangguan klorida 15.000 mg/L Cl- berturut-turut adalah sebesar -0.1112, 0,8282, 0,2802, dan 1,8434. Nilai t perhitungan yang diperoleh pada seluruh percobaan lebih kecil dari nilai uji t (t tabel derajat kebebasan 4,303).
Maka disimpulkan bahwa nilai rata-rata percobaan metode ASTM D-1252 (A), Photometri SQ 118, dan EPA 410.3 tidak berbeda nyata dengan harga sesungguhnya pada sampel.
1) Pembahasan Metode ASTM D-1252 (A) dan EPA 410.3
i. Pada penentuan COD metode ASTM D-1252 (A) selama reaksi yang berlangsung ± 2 jam uap direfluks dengan alat kondensor agar zat organis volatil tidak lenyap keluar.
ii. Perak sulfat (Ag2SO4) ditambahkan sebagai katalisator untuk mempercepat reaksi.
iii. Penambahan merkuri sulfat (Hg2SO4) ditambahkan untuk menghilangkan ganggua klorida yang pada umumnya ada di dalam air buangan, namun pada analisa ini digunakan larutan standar Kalium Hidrogen Ftalat yang kemungkinan gangguan kloridanya kecil. Kadar klorida (Cl-) sampai 2000 mg/L di dalam sampel dapat menggangu bekerjanya katalisator Ag2SO4, dan pada keadaan tertentu turut teroksidasi oleh dikromat, sesuai reaksi dibawah ini : 6 Cl- + Cr2O72- + 14 H+ 3 Cl2 + 2 Cr3+ + 7 H2O iv. Gangguan ini dapat dihilangkan dengan penambahan merkuri sulfat
(Hg2SO4) pada sampel, sebelum penambahan pereaksi lainnya. Ion merkuri bergabung dengan ion klorida membentuk merkuri klorida, sesuai reaksi di bawah ini :
33
v. Dengan adanya ion Hg2+ ini, konsentrasi ion Cl- menjadi sangat kecil dan tidak mengganggu oksidasi zat organik dalam tes COD. vi. Nitrit (NO2-) juga teroksidasi menjadi nitrat (NO3-). 1 mg NO2 – N*
~ 1.1 mg COD. Jika konsentrasi NO2 – N > 2 mg/L, maka harus ada penambahan 10 mg asam sulfamat per mg NO2 – N baik dalam sampel maupun dalam blanko.
vii. Pada saat pembuatan reagen sulfat, Ag2SO4 tidak mudah larut, untuk larut membutuhkan waktu ± 1 hari, sehingga penghimpitan dilakukan setelah Ag2SO4 sudah larut sempurna.
viii. Pada penambahan pengoksidasi K2Cr2O7 harus berlebih untuk memastikan seluruh zat organis habis teroksidasi sempurna, karena K2Cr2O7 yang tersisa di dalam larutan tersebut digunakan untuk menentukan berapa oksigen yang telah terpakai. Sisa K2Cr2O7 tersebut ditentukan melalui titrasi dengan fero ammonium sulfat (FAS), dimana reaksi yang terjadi sebagai berikut :
7 Fe2+ + Cr2O72- + 14 H+ 6 Fe3+ + 2 Cr3+ + 7 H2O
2) Pembahasan Metode Photometri SQ 118
i. Setelah penambahan pereaksi dan sampel, tutup test tube serapat mungkin untuk menghindari zat organis volatile menguap.
ii. Setelah dilakukan pemanasan, test tube didinginkan dahulu hingga suhu kamar agar tidak terlalu panas untuk menghindari kerusakan pada dinding alat.
iii. Penggunaan test tube pada saat proses pengukuran harus diperhatikan karena baret pada dinding kaca akan mengakibatkan terdispersinya cahaya yang berasal dari fotometer.
iv. Diutamakan mengecek konsentrasi Cl- pada sampel secara fotometri sebelum melakukan analisis COD. Konsentrasi Cl- yang lebih dari 800 mg/L akan mengakibatkan nilai COD menjadi lebih besar dari sebenarnya.
34
B. Hasil Penentuan Salinitas Berdasarkan Standard Method 16th Edition dan Horiba U-10
Tabel 11. Data analisis salinitas berdasarkan Standard Method 16th Edition
Ulangan Analisa pada (g/kg)
1 30,06 2 30,06 3 30,03 4 30,13 5 30,09 6 30,06 7 30,13 8 30,03 9 30,06 10 30,06 Rata-rata = 30,07
Tabel 12. Data analisis salinitas berdasarkan metode Horiba
Ulangan Nilai Salinitas
(x) 1 30.80 2 30.70 3 30.80 4 30.70 5 30.80 6 30.70 7 30.85 8 30.70 9 30.70 10 30.80 Rata-rata = 30,75
Tabel 13. Uji Kecermatan (Uji F) antara metode standard methods ASTM dan Horiba dari analisis Salinitas
S2 Standard Method S2 Horiba Nilai F
0.0015 0.0036 2,40
Pembahasan :
i. Uji kecermatan (Uji F) yang dilakukan untuk menunjukan apakah ada perbedaan yang signifikan antara metode standard methods dan Horiba U-10 berdasarkan perhitungan simpangan baku masing-masing metode,
35
diperoleh bahwa harga F hitung sebesar 2,40 lebih kecil dari F tabel, maka disimpulkan bahwa kedua metode tidak berbeda nyata.
ii. Larutan AgNO3 dan larutan air laut pada awalnya masing-masing merupakan larutan yang jernih tidak berwarna. Larutan kemudian berubah menjadi kuning mengikuti warna K2CrO4 yang bertindak sebagai indikator.
iii. Setelah dititrasi dengan AgNO3, awalnya terbentuk endapan berwarna putih yang merupakan AgCl. Ketika ion Cl- sudah habis bereaksi dengan AgNO3, sementara jumlah AgNO3 masih ada, maka AgNO3 kemudian bereaksi dengan indikator K2CrO4 membentuk endapan Ag2CrO4 yang berwarna merah bata.
iv. Titrasi secara Argentometri ini dapat berlangsung dengan baik jika pH larutan diatur antara 6,5 – 9,0. Dalam larutan asam dapat terjadi perubahan kromat menjadi dikromat. Hal ini terjadi karena adanya reaksi :
2 CrO42- + 2H+ 2 HCrO4- 2 Cr2O7 + H2O
Sedangkan dalam larutan terlalu basa, dapat terjadi pengendapan menjadi perak (I) oksida. Hal ini terjadi karena adanya reaksi :
2 Ag+ + OH- 2 AgOH AgO2 (coklat) + H2O v. Dalam titrasi ini, perlu dilakukan secara cepat dan pengocokan harus
juga dilakukan secara kuat agar Ag+ tidak teroksidasi menjadi AgO yang menyebabkan titik akhir titrasi menjadi sulit tercapai.
36
C. Hasil Penentuan Oksigen Terlarut Berdasarkan Metode SNI 06-6989.14-2004
Tabel 14. Data analisis oksigen terlarut
Ulangan Analisa pada suhu 27oC (mg/L)
1 7.62 2 7.76 3 7.59 4 7.59 5 7.66 6 7.73 7 7.59 8 7.63 9 7.59 10 7.66 Rata-rata = 7.64
Keterangan : Pembanding nilai oksigen terlarut pada suhu 27 oC adalah 7,96
menurut Standard Method 16th Edition.
Tabel 15. Nilai t perhitungan pada analisis DO berdasarkan metode SNI 06-6989.14-2004 n Nilai DO teoritis (x) (x-X) = d d2 1 7.62 -0,02 0.0004 2 7.76 0.12 0.0144 3 7.59 -0.05 0.0025 4 7.59 -0.05 0.0025 5 7.66 0.02 0.0004 6 7.73 0.09 0.0081 7 7.59 -0.05 0.0025 8 7.63 -0.01 0.0001 9 7.59 -0.05 0.0025 10 7.66 0.02 0.0004 X x = 7,64 (d2) = 0.0338 S2 = Σd2 = 0,0338/9 = 0,00376 n-1 S = √ S2 = 0,0613 t = ( X – μ ) √N = (7,64 – 7,96) x √10/0,0613 = -16,5078
37
Untuk melihat tingkat ketepatan masing-masing metode maka dilakukan uji ketepatan. Pengujian tingkat ketepatan harus ditentukan terlebih dahulu nilai t dalam tabel dengan derajat kepercayaan yang dipilih. Ternyata nilai t tabel untuk 10 buah data dengan derajat kepercayaan 95% adalah 2,262. Pada tabel 15 nilai t hitung adalah -16,5078. Nilai t perhitungan yang diperoleh lebih kecil dari nilai t tabel derajat kebebasan.
Pada saat penambahan MnSO4 kemudian alkali iodida azida, terjadi pembentukan endapan coklat untuk DO tinggi, dan putih untuk DO rendah. Hal ini dikarenakan oleh jumlah oksigen yang berada dalam sampel tersebut, dengan reaksi :
MnSO4 + 2 KOH Mn(OH)2(putih) + K2SO4
Mn(OH)2 + ½ O2 MnO2 (coklat) + H2O
Apabila jumlah oksigen dalam sampel banyak, maka warna larutan ketika ditambahkan MnSO4 dan alkali iodida azida akan terbentuk endapan coklat (MnO2).
Jika oksigen terlarut memiliki konsentrasi yang sangat kecil dalam sampel, maka sulit dideteksi kandungannya karena warna endapan coklat hasil reaksi Mangan (II) hidroksida dengan oksigen tidak terbentuk. Hal ini dikarenakan jumlah oksigen dalam sampel tidak cukup banyak untuk mengoksidasi Mangan (II) Hidroksida membentuk Mangan (IV) Oksida.
Karena proses pengamatan pada saat penambahan MnSO4 dan alkali iodida azida yang menghasilkan warna endapan coklat atau putih. Ketika penambahan H2SO4 pekat ke dalam larutan, maka endapan tersebut akan larut. Apabila terbentuk endapan coklat, maka larutan akan berwarna coklat dan apabila terbentuk endapan putih maka larutan akan tidak berwarna, sehingga proses pengamatan pada saat titrasi akan menjadi sulit. Hal ini bisa diatasi dengan penambahan kanji langsung ketika hendak melakukan proses titrasi, karena masih mungkin terbentuk endapan MnO2 yang berwarna coklat walaupun sangat sedikit konsentrasinya sehingga tidak begitu terlihat warna coklatnya.
38
SIMPULAN DAN SARAN
A. Simpulan
1. Uji ketepatan (Uji t) terhadap metode standard methods ASTM D 1252 dan Fotometri SQ 11, dan EPA 410.3 dimana harga t yang diperoleh lebih kecil dari t tabel. Maka disimpulkan bahwa perbedaan antara harga sebenarnya dan harga hasil pengukuran tidak signifikan, artinya kedua harga tersebut sama.
2. Uji kecermatan (Uji F) yang dilakukan pada metode standar ASTM D 1252 dan Fotometri SQ 118 berdasarkan perhitungan simpangan baku masing-masing metode, diperoleh bahwa harga F hitung lebih kecil dari F tabel, maka disimpulkan bahwa kedua metode tidak berbeda nyata.
3. Metode Photometri SQ 118 memiliki kelebihan dalam hal efisiensi penggunaan pereaksi yaitu membutuhkan pereaksi yang lebih sedikit.
4. Penetapan salinitas diperoleh data pada Uji kecermatan (Uji F) yang dilakukan pada Standard Method 16th edition dan Horiba U-10 berdasarkan perhitungan simpangan baku masing-masing metode, diperoleh bahwa harga F hitung lebih kecil dari F tabel, maka disimpulkan bahwa kedua metode tidak berbeda nyata.
5. Pada penetapan oksigen terlarut (Dissolved Oxygen) didapat hasil uji t sebesar -16,5078. Nilai t perhitungan yang diperoleh lebih kecil dari nilai t tabel derajat kebebasan.
B. Saran
Berdasarkan hasil analisis dan kesimpulan yang didapatkan, maka penulis menyampaikan sedikit saran :
1. Dalam analisis COD dengan menggunakan metode Photometri SQ 118 pengukuran dilakukan pada suhu kamar agar tidak terlalu panas untuk menghindari kerusakan pada dinding alat.
39
2. Dalam analisis COD dengan menggunakan metode ASTM D-1252 (A) setelah proses refluks selesai, sebaiknya langkah titrasi menunggu sampai suhu erlenmeyer telah mendekati suhu ruangan dan lakukan pembilasan pada bagian kondensor dengan air suling.
3. Dalam analisis COD, khususnya pada sampel yang mengandung kadar Cl -tinggi seperti air laut, disarankan untuk menggunakan metode EPA 410.3 dan juga mengukur konsentrasi Cl- terlebih dahulu pada sampel. Hal ini dikarenakan pada konsentrasi Cl- diatas 854 mg/L akan mempengaruhi konsentrasi asli dari COD yang disebabkan oleh reaksi reduksi dari Kalium Dikromat menjadi Kalium Kromat oleh ion Cl-. Setelah didapat konsentrasi Cl-, kemudian dimasukkan pada rumus pengaruh klorida. Sehingga diperoleh perkiraan konsentrasi COD tambahan oleh ion Cl- tersebut. 4. Ketelitian pada analisis kimia sangat diperlukan, khususnya dalam proses
analisis kuantitatif. Penggunaan faktor koreksi pada setiap jumlah volume pada alat merupakan salah satu cara agar analisis yang dilakukan menjadi lebih teliti. Pengkalibrasian alat secara rutin juga sangat penting agar hasil yang didapat menjadi lebih akurat dan valid.
40 DAFTAR PUSTAKA
A. L. Underwood. 1989. Analisa Kuantitatif Edisi Keempat. Jakarta: Erlangga American Society Testing and Materials (ASTM). 2005. Standard Test Methods
for Chemical Oxygen Demand (Dichromate Oxygen Demand) of Water (D 1252)
Day RA. Jr dan A.L. Underwood. 1992. Analisis Kimia Kuantitatif Edisi Kelima. Jakarta: Erlangga
Eaton, Andrew D, Lenore S Clesceri, dkk. 2005. Standard Methods for The Examination of Water & Wastewater 21st Edition. Washington: American
Water Works Association.
Harjadi W. 1993. Ilmu Kimia Analitik Dasar. Jakarta : PT Gramedia Pustaka Utama.
Ismail, Krisnandi. 2009. Analisis Instrumental. Bogor: Sekolah Menengah Analis Kimia Bogor.
Manual Photometer Spectro Quant 118
U.S. Environmental Protection Agency – U.S EPA 410.3 Editorial Reviasion. 1978. Chemical Oxygen Demand (Titrimetric, High Level for Saline Waters) Vogel. 1985. Analisis Anorganik Kuantitatif. Jakarta: PT Kalman Media Pustaka
41 LAMPIRAN
COD Berdasarkan ASTM D 1252 (A) dan Photometri SQ 118
Dari hasil standarisasi dengan menggunakan larutan K2Cr2O7 0,25 N, maka volume Feri Aluminium Sulfat (terkoreksi berdasarkan kalkulasi persamaan regresi Y = 0,99369 X – 0,0522) yang digunakan adalah:
Pembacaan Alat (mL) Volume Sebenarnya (mL)
27,05 mL 26,82 mL
27,15 mL 26,92 mL
Rata-rata vol sebenarnya setelah terkoreksi adalah : 26,87 mL Sehingga konsentrasi dari FAS adalah :
N FAS = ((V . N) K2Cr2O7) / V Na2S2O3 = ( 25,021 X 0,25) / 26,97 = 0,2326 N
Volume FAS (terkoreksi berdasarkan kalkulasi persamaan regresi Y = 0,99369 X – 0,0522) yang digunakan untuk perhitungan adalah :
COD 100 mg/L
Pembacaan Alat (mL) Volume Sebenarnya (mL)
29,70 mL (Blanko) 29,46 mL 29,30 mL 29,06 mL 29,15 mL 28,91 mL 29,20 mL 28,96 mL 29,20 mL 28,96 mL 29,15 mL 28,91 mL COD 1000 mg/L
Pembacaan Alat (mL) Volume Sebenarnya (mL)
29,70 mL (Blanko) 29,46 mL 24,30 mL 24,09 mL 24,25 mL 24,04 mL 24,25 mL 24,04 mL 24,40 mL 24,19 mL 24,40 mL 24,09 mL
42 Contoh perhitungan nilai COD
V.FAS Blanko = 29,46 mL V.FAS Sampel = 24,09 mL
COD (mg/L) = (Vp.Blanko-Vp.Sampel) x N FAS x 8 x 1000 / Vol Sampel = (29,46-24,09) x 0,2326 x 8 x 1000 / 10
= 999,25 mg/L
Hasil analisa COD 1000 mg/L Hasil analisa COD 100 mg/L
Uji Ketepatan (uji t) Metode ASTM D 1252 dari hasil analisa COD 100 dan 1000 mg/L. n Nilai COD (x) (x-X) = d d 2 100 1000 100 1000 100 1000 1 105,04 999,25 5,88 -7,442 34,5744 55,3834 2 102,34 1008,55 3,18 1,858 10,1124 3,4521 3 93,04 1008,55 -6,12 1,858 37,4544 3,4521 4 93,04 999,25 -6,12 -7,442 37,4544 55,3834 5 102,34 1017,86 3,18 11,168 10,1124 124,7242 X 99,16 1006,69 Σd2 =129,708 Σd2= 242,3952 Untuk COD 100 mg/L S2 = Σd2 = 129,708/4 = 32,427 n-1 S = √ S2 = 5,69 t = ( X – μ ) √N = (99,16 – 100) x √5 / 5,69 = -0,3301 S Untuk COD 1000 mg/L S2 = Σd2 = 242,3952/4 = 60,60 N-1 S = √ S2 = 7,78 t = ( X – μ ) √N = (1006,69– 1000) x √5 / 7,78= 1,9228 S Analisa pada (mg/L) 999,25 1008,55 1008,55 999,25 1017,86 Rata-rata = 1010,49 Analisa pada (mg/L) 105,04 102,34 93,04 93,04 102,34 Rata-rata = 99,16
43
Uji Ketepatan (uji t) Metode Fotometri SQ 118 dari hasil analisa COD 100 dan 1000 mg/L. n Nilai COD (x) (x-X) = d d2 100 1000 100 1000 100 1000 1 94 1004 -4,6 10,2 21,16 104,04 2 96 993 -2,6 -0,8 6,76 0,64 3 101 990 2,4 -3,8 5,76 14,44 4 104 980 5,4 -13,8 29,16 190,44 5 98 1002 -0,6 8,2 0,36 67,24 X 98,6 993,8 Σd2=63,2 Σd2=376,8 Untuk COD 100 mg/L S2 = Σd2 = 63,2 = 63,2 = 15,8 N-1 5 – 1 4 S = √ S2 = 3,97 t = ( X – μ ) √N = (98,6 – 100) x √5 = -0,7885 S 3,97 Untuk COD 1000 mg/L S2 = Σd2 = 376,8 = 376,8 = 94,2 N-1 5 – 1 4 S = √ S2 = 9,71 t = ( X – μ ) √N = (993,8 – 1000) x √5 = -1,4278 S 9,71
Nilai t hitung pada analisis COD berdasarkan metode standard methods ASTM D 1252 dan Fotometri SQ- 118 dari hasil analisa COD 100 dan 1000 mg/L
Nilai t perhitungan Konsentrasi COD (mg/L) ASTM D 1252 fotometri SQ- 118 t tabel 100 -0,3301 -0,7885 4,604 1000 1,9228 -1,4278 4,604
Uji Kecermatan (Uji F) antara metode standard methods ASTM D 1252 dan Fotometri SQ- 118 dari hasil analisa COD 200, 600, dan 1000 mg/L.
Konsentrasi COD (mg/L) S2 ASTM D 1252 S2 Fotometri SQ- 118 Nilai F 100 5,69 3,97 1,43 1000 7,78 9,71 1,25
44 Untuk COD 100 mg/L F = S2 (1) = 5,69 = 1,43 S2 (2) 3,97 Untuk COD 1000 mg/L F = S2 (1) = 9,71 = 1.25 S2 (2) 7,78
45 COD Berdasarkan Metode EPA 410.3 Koreksi Klorida
Cl- (ppm) V FAS 0,25 N Dikali Faktor Koreksi COD
0 (Blank) 30,00 mL 29,76 mL 0,00 ppm 4000 29,90 mL 29,66 mL 18,61 ppm 8000 29,70 mL 29,56 mL 55,82 ppm 12000 29,50 mL 29,26 mL 93,04 ppm 16000 29,30 mL 29,06 mL 130,26 ppm 20000 29,15 mL 28,91 mL 158,168 ppm
Dari hasil standarisasi dengan menggunakan larutan K2Cr2O7 0,25 N, maka volume Feri Aluminium Sulfat (terkoreksi berdasarkan kalkulasi persamaan regresi Y = 0,99369 X – 0,0522) yang digunakan adalah:
Pembacaan Alat (mL) Volume Sebenarnya (mL)
29,95 29,71
29,95 29,71
Rata-rata vol sebenarnya setelah terkoreksi adalah : 29,71 mL
Sehingga konsentrasi dari FAS adalah : N FAS = ((V , N) K2Cr2O7)/ V Na2S2O3 = ( 25,021 X 0,25) / 29,71 = 0,2104 N 0 20 40 60 80 100 120 140 160 180 0 5000 10000 15000 20000 25000 K on sent ra si C O D Konsentrasi Klorida (Cl-)
Koreksi Klorida
y = (8,3071 x 10 -3)x - 7,088 R = 0,996446
Volume FAS 0,2126 N (terkoreksi berdasarkan kalkulasi persamaan regresi Y = 0,99369 X – 0,0522) yang digunakan untuk perhitungan adalah :
COD 100 mg/L with 5.000 mg/L Cl-
Pembacaan Alat (mL) Volume Sebenarnya (mL)
31,90 mL (Blanko) 31,64 mL
31,20 mL 30,94 mL memakai FAS 0,2326 N
31,15 mL 30,90 mL
31,50 mL (Blanko) 32,24 mL memakai FAS 0,2104 N
31,70 mL 31,44 mL
COD 100 mg/L with 15.000 mg/L Cl
-Pembacaan Alat (mL) Volume Sebenarnya (mL)
32,50 mL (Blanko) 32,24 mL 31,20 mL 30,95 mL 30,30 mL (Blanko) 30,05 mL 29,00 mL 28,76 mL 28,95 mL 28,72 mL COD 500 mg/L with 5.000 mg/L Cl
-Pembacaan Alat (mL) Volume Sebenarnya (mL)
32,50 mL (Blanko) 32,24 mL
29,30 mL 29,06 mL
29,35 mL 29,11 mL
29,25 mL 29,01 mL
COD 500 mg/L with 15.000 mg/L Cl
-Pembacaan Alat (mL) Volume Sebenarnya (mL)
31,90 mL (Blanko) 31,64 mL
28,20 mL 27,96 mL
28,15 mL 27,92 mL
28,20 mL 27,96 mL
Contoh perhitungan nilai COD 100 mg/l dengan 5000 mg/L Cl -V. FAS Blanko = 31,64 mL
47 COD =
{
(Vp.Blanko−Vp.Sampel) x N FAS x 8 x 1000Vol Sampel
}
– {8,3071x10 -3 x – 7,088} = (31,64−30,94) x 0,2104 x 8 x 1000 10 - {8,3071x10 -3 x 5000 – 7,088} = 130,256 – 34,4475 = 95,81 mg/LHasil analisa COD 100 mg/l with 5.000 mg/L Cl- (34,4475 mg/L COD)
COD (mg/L) Setelah dikurangi Koreksi
Klorida (mg/L)
130,26 95,81
137,70 103,25
134,66 100,21
Rata-rata = 99,76
Hasil analisa COD 100 mg/l with 15.000 mg/L Cl- (117,5185 mg/L COD)
COD (mg/L) Setelah dikurangi Koreksi
Klorida (mg/L)
217,13 99,61
217,13 99,61
223,87 106,35
Rata-rata = 101,86
Hasil analisa COD 500 mg/l with 5.000 mg/L Cl- (34,4475 mg/L COD)
COD (mg/L) Setelah dikurangi Koreksi
Klorida (mg/L)
536,94 502,49
526,84 492,39
543,67 509,22
Rata-rata = 501,37
Hasil analisa COD 500 mg/l with 15.000 mg/L Cl- (117,5185 mg/L COD)
COD (mg/L) Setelah dikurangi Koreksi
Klorida (mg/L)
619,42 501,90
626,15 508,63
619,42 501,90
48
Uji Ketepatan (uji t) Metode ASTM D 1252 dari hasil analisa COD 100 dan 1000 mg/L. n Nilai COD (x) (x-X) = d 100 Cl -5000 100 Cl -15000 500 Cl -5000 500 Cl -15000 100 Cl -5000 100 Cl -15000 500 Cl -5000 500 Cl -15000 1 95,81 99,61 502,49 501,90 -3,95 -2,25 1,12 -2,24 2 103,25 99,61 492,39 508,63 3,49 -2,25 -8,98 4,49 3 100,21 106,35 509,22 501,90 0,45 4,49 7,85 -2,24 X x = 99,76 x = 101,86 x = 501,37 x = 504,14 d2 100 Cl- 5000 100 Cl- 15000 500 Cl- 5000 500 Cl- 15000 15,6025 5,0625 1,2544 5,0176 12,1801 5,0625 80,6404 20,1601 0,2025 20,1601 61,6225 5,0176 d2= 27,9851 d2 = 30,2851 d2= 143,5173 d2= 30,1953 Untuk COD 100 mg/L Cl- 5000 S2 = Σd2 = 27,9851/2 = 13,9926 n-1 S = √ S2 = 3,74 t = ( X – μ ) √N = (99.76 – 100) x √3/3,74 = -0.1112 S Untuk COD 100 mg/L Cl- 15000 S2 = Σd2 = 30,2851/2 = 15,1426 n-1 S = √ S2 = 3,89 t = ( X – μ ) √N = (101,86 – 100) x √3/3,89= 0,8282 S Untuk COD 500 mg/L Cl- 5000 S2 = Σd2 = 143,5173/2 = 71,7587 n-1 S = √ S2 = 8,47 t = ( X – μ ) √N = (501,37 – 500) x √3/8,47 = 0,2802 S
49 Untuk COD 500 mg/L Cl- 15000 S2 = Σd2 = 30,1953/2 = 15,0977 n-1 S = √ S2 = 3,89 t = ( X – μ ) √N = (504,14 – 500) x √3/3,89 = 1,8434 S
Nilai t hitung pada analisis COD berdasarkan metode standard methods ASTM D 1252 dan Fotometri SQ- 118 dari hasil analisa COD 100 dan 1000 mg/L
Nilai t perhitungan Konsentrasi COD (mg/L) EPA 410.3 t tabel 100 mg/L Cl- 5000 -0.1112 4,303 100 mg/L Cl- 15000 0,8282 4,303 500 mg/L Cl- 5000 0,2802 4,303 500 mg/L Cl- 15000 1,8434 4,303
50
Penetapan Salinitas dengan Standard Method 16th Edition dan Horiba
U-10
Dari hasil standarisasi dengan menggunakan larutan NaCl, maka volume AgNO3(terkoreksi berdasarkan kalkulasi persamaan regresi Y = 0,99369 X – 0,0522) yang digunakan adalah:
Pembacaan Alat (mL) Volume Sebenarnya (mL)
45,10 mL 44,76 mL
45,00 mL 44,66 mL
Rata-rata vol sebenarnya setelah terkoreksi adalah : 44,71 mL
Sehingga konsentrasi dari AgNO3 adalah :
N AgNO3 = mg NaCl / Vp AgNO3 x Bst NaCl x fp = 29674 / 44.71 x 58,5 x 1000 / 25 = 0,2836 N
Volume AgNO3 (terkoreksi berdasarkan kalkulasi persamaan regresi Y = 0,99369 X – 0,0522) yang digunakan untuk perhitungan adalah :
Pembacaan Alat Volume Sebenarnya (d)
42,50 mL 42,18 mL 42,50 mL 42,18 mL 42,45 mL 42,13 mL 42,60 mL 42,32 mL 42,55 mL 42,23 mL 42,50 mL 42,18 mL 42,60 mL 42,28 mL 42,45 mL 42,13 mL 42,50 mL 42,18 mL 42,50 mL 42,18 mL
Contoh perhitungan nilai salinitas
Klorisitas ekivalen dari 1 mL Larutan AgNO3 : Cl Eq = N AgNO3 x 0,0355 = 0,2836 x 0,0355 = 0,01007 Klorisitas Clo = d x Cl Eq x fp Clo I = 42,18 x 0,01007 x 1000 / 25 = 16,99 Cl/L
51 Salinitas
Berdasarkan tabel konversi Klorisitas-Salinitas, didapatkan hasil konversi dari klorisitas sebesar 16,99 Cl/L adalah 30,06 g/kg salinitas.
Hasil analisa Klorisitas dan Salinitas Analisa pada Klorisitas (Cl/L) Salinitas (g/kg) 16,99 30,06 16,99 30,06 16,97 30,03 17,03 30,13 17,01 30,09 16,99 30,06 17,03 30,13 16,97 30,03 16,99 30,06 16,99 30,06 Rata-rata : 17,00 Rata-Rata : 30,07
Uji Kecermatan (uji F) Standard Method dari hasil analisa Salinitas
N Nilai Salinitas (x) (x-X) = d d2 1 30,06 -0,01 0,0004 2 30,06 -0,01 0,0004 3 30,03 -0,04 0,0016 4 30,13 0,06 0,0036 5 30,09 0,03 0,0009 6 30,06 -0,01 0,0004 7 30,13 0,06 0,0036 8 30,03 -0,04 0,0016 9 30,06 -0,01 0,0004 10 30,06 -0,01 0,0004 X X = 30,07 Σd2 =0,0133 S2 = Σd2 = 0,0133/9 = 0,0015 n-1
52
Uji Kecermatan (uji F) Metode Horiba dari hasil analisa Salinitas
n Nilai Salinitas (x) (x-X) = d d 2 1 30,80 0,05 0,0025 2 30,70 -0,05 0,0025 3 30,80 0,05 0,0025 4 30,70 -0,05 0,0025 5 30,80 0,05 0,0025 6 30,70 -0,05 0,0025 7 30,85 0,10 0,0100 8 30,70 -0,05 0,0025 9 30,70 -0,05 0,0025 10 30,80 0,05 0,0025 X 30,75 Σd2= 0,0325 S2 = Σd2 = 0,0250 = 0,0325 = 0,0036 N-1 10 – 1 9
Uji Kecermatan (Uji F) antara metode standard methods ASTM dan Horiba dari analisis Salinitas
S2 ASTM S2 Horiba Nilai F
0,0015 0,0036 2,40
F = S2 (1) = 0,0036= 2,40 S2 (2) 0,0015
Catatan : Nilai yang lebih besar sebagai S2 (1) Tabel Konversi Klorisiti ke Salinitas
Klorisitas (Cl/L) Salinitas (g/kg) Salinitas (g/kg) Klorisitas (Cl/L)
16,90 29,90 17,01 30,09 16,91 29,92 17,02 30,11 16,92 29,94 17,03 30,13 16,93 29,96 17,04 30,15 16,94 29,97 17,05 30,16 16,95 29,99 17,06 30,18 16,96 30,01 17,07 30,20 16,97 30,03 17,08 30,22 16,98 30,04 16,99 30,06 17,00 30,08
53
Penetapan Oksigen Terlarut Metode SNI 06-6989.14-2004
Dari hasil standarisasi dengan menggunakan larutan K2Cr2O7 0,025 N, maka volume natrium tiosulfat (terkoreksi berdasarkan kalkulasi persamaan regresi Y = 0,99369 X – 0,0522) yang digunakan adalah:
Pembacaan Alat (mL) Volume Sebenarnya (mL)
20,15 19,97
20,10 19,92
Rata-rata vol sebenarnya setelah terkoreksi adalah : 20,33 mL
Sehingga konsentrasi dari Na2S2O3 adalah : N Na2S2O3 = ((V . N) K2Cr2O7)/ V Na2S2O3
= ( 20,06 X 0,025) / 19,915 = 0,0251 N
Volume thio (terkoreksi berdasarkan kalkulasi persamaan regresi Y = 0,9936 X – 0,0522) yang digunakan untuk perhitungan adalah :
Pembacaan Alat (mL) Volume Sebenarnya (mL)
12,08 12,21 12,75 12,88 12,55 12,68 12,95 13,08 12,90 13,03 12,30 12,43 12,35 12,48 12,25 12,38 12,50 12,63 12,60 12,73
Contoh perhitungan nilai DO Volume Na2S2O3 = 4,095 mL
DO = (1000 .V.Np . Bst O2)/ (Vol botol – (Vol MnSO4 + Vol alkali iodida azida)) = ( 1000 x 4,095 x 0,0251 x 8) / (300-2)
54 Hasil analisa DO
Analisa pada suhu 27oC (mg/L) 7,62 7,76 7,59 7,59 7,66 7,73 7,59 7,63 7,59 7,66 Rata-rata = 7,64
Keterangan : Pembanding nilai oksigen terlarut pada suhu 27 oC berdasarkan Standard Method 16th Edition adalah 7,96
Uji Ketepatan (uji t)
n Nilai DO (x) (x-X) = d d 2 1 7.62 -0,02 0.0004 2 7.76 0.12 0.0144 3 7.59 -0.05 0.0025 4 7.59 -0.05 0.0025 5 7.66 0.02 0.0004 6 7.73 0.09 0.0081 7 7.59 -0.05 0.0025 8 7.63 -0.01 0.0001 9 7.59 -0.05 0.0025 10 7.66 0.02 0.0004 X x = 7,64 (d2) = 0.0338 S2 = Σd2 = 0,0338/9 = 0,00376 n-1 S = √ S2 = 0,0613 t = ( X – μ ) √N/S = (7,64 – 7,96) x √10/0,0613 = -16,5078
Tabel pengaruh suhu terhadap oksigen terlarut menurut Standard Method 16th Edition
Temperature oC Oksigen Terlarut (mg/L)
26,0 8,113
27,0 7,968
28,0 7,827
29,0 7,691