Keragaan Genetik Taura Syndrome Virus (TSV) yang Menginfeksi Udang Vanname
(Litopenaeus vannamei) dan Udang Windu (Penaeus monodon)
Ida Komang Wardana, Sari Budi Moria dan Ahmad Muzaki
Balai Besar Riset Perikanan Budidaya Laut, Gondol-Bali PO BOX 140 Singaraja, Dusun Gondol, Kecamatan Gerokgak Bali 81101
Telp: 0362 92278, Fax: 0362 92271/72
Abstract
I.K. Wardana, S.B. Moria, A. Muzaki and S. Suratmi. 2007. Genetic characteristic of Taura Syndrome Virus (TSV) infecting pacific white shrimp (Litopenaeus vannamei) and tiger shrimp (Penaeus monodon). Aquacultura Indonesiana, 8 (3): 163–168. Taura Syndrome Virus (TSV) is one of specific virus infecting shrimp which caused mass mortality (80–85%) on shrimp culture. The objective of this research was to find the genetic performance of Taura Syndrome Virus (TSV) infecting pacific white shrimp (Litopenaeus vannamei) and black tiger shrimp (Penaeus monodon). The infected pacific white shrimp samples were collected from pond culture in Bali and black tiger samples were taken from Timika, Papua waters. TSV detection was applied using IQ2000TM kit. Restriction
Fragment Length Polymorphism Mitochondria DNA (RFLP mt DNA) was applied to perform genetics of Taura Syndrome Virus (TSV) infecting pacific white shrimp and black tiger shrimp, by using 10 restriction enzymes i.e. Hae III, EcoR V, Dra I, Hha I Sau 3 A, Mnl I, Mbo I, EcoR I, Hinf I and Nla III. The infected shrimp samples, which analysed by using IQ2000TM kit showed medium infection with molecule weight of 630 and 330 bp. RFLP mt DNA
analysis showed that 7 out of 10 restriction enzymes digested TSV DNA, i.e.: Hae III, Hha I Sau 3 A, Mnl I, Mbo I, Hinf I and Nla III. Genetic performance of Taura Syndrome Virus (TSV) infecting pacific white shrimp and black tiger shrimp at the medium level was not different.
Keywords: Genetic performance; Taura Syndrome Virus (TSV); L. vannamei; P. monodon
Abstrak
Taura Syndrome Virus (TSV) merupakan salah satu virus yang spesifik menyerang udang vanname dan dapat menyebabkan kematian massal antara 80–85%. Penelitian ini bertujuan untuk mengetahui keragaan genetik TSV yang menginfeksi udang L. vannamei dan P. monodon. Sampel udang vannamei berasal dari tambak udang swasta di Bali, sedangkan sampel udang windu berasal dari perairan Timika, Papua. Deteksi TSV dilakukan dengan menggunakan kit IQ2000TM. Selanjutnya untuk mengetahui karakter genetik TSV yang menginfeksi udang
L. vannamei dan P. monodon dikaji dengan menggunakan metode Restriction Fragment Length Polymorphism Mitochondria DNA (RFLP mt DNA) dengan 10 macam enzim restriksi, yaitu: Hae III, EcoR V, Dra I, Hha I Sau 3 A, Mnl I, Mbo I, EcoR I, Hinf I dan Nla III. Sampel udang yang dianalisis dengan kit IQ2000TM menunjukkan infeksi
TSV tingkat medium dengan berat molekul 630 dan 330 bp. Dari 10 enzim restriksi yang digunakan, hanya 7 enzim yang menghasilkan pemotongan, yaitu Hae III, Hha I Sau 3 A, Mnl I, Mbo I, Hinf I dan Nla III. Keragaan genetik TSV yang menginfeksi udang L. vannamei dan P. monodon pada tingkat medium tidak berbeda.
Kata kunci: Keragaan genetik; Taura Syndrome Virus (TSV); L. vannamei; P. monodon
Pendahuluan
Udang adalah salah satu komuditas perikanan yang masih menjadi primadona ekspor dan mempunyai peluang pasar cukup terbuka, karena Indonesia terbebas dari kebijakan anti dumping dari Negara Uni Eropa. Produksi udang budidaya selama kurun waktu 4 tahun (2003–2007) mengalami peningkatan sebesar 16,39% yaitu dari 192.926 ton pada tahun 2003 menjadi 352.220 ton
di tahun 2007 dan didominasi oleh udang vanname (Purnomo, 2007). Berkembangnya usaha budidaya udang, tentunya harus didukung oleh berbagai fasilitas untuk mempertahankan produksi udang dimasa mendatang agar tetap dapat bersaiang di pasar dunia termasuk penanggulangan terhadap serangan penyakit. Serangan penyakit merupakan masalah yang cukup sulit untuk ditanggulangi terutama yang disebabkan oleh virus, karena pada umumnya dapat menyebabkan kematian massal
dalam waktu yang relatif singkat (Tan dan Grisez, 2004).
Beberapa jenis virus yang menginfeksi udang dan dapat menyebabkan kematian massal antara lain White Spot Syndrome Virus (WSSV), Taura Syndrom Virus (TSV) dan Infectious Myonecrosis Virus (IMNV). Taura Syndrom Virus (TSV) merupakan salah satu virus yang spesifik menyerang udang vanname (L. vannamei) dan udang rostris (L. stylirostris) (Prayitno et al., 2003; Sittidilokratna, 2005). Menurut laporan FAO (2004) dalam Widigdo (2005), TSV pertama kali di identifikasi tahun 1993 pada budidaya udang vanname di Peru dan Mexico. Di Indonesia penyakit TSV muncul pada tahun kedua setelah udang vanname diizinkan masuk oleh pemerintah Republik Indonesia pada tahun 2001 yang mewabah pada daerah pertambakan di Jawa Timur. Sampai saat ini TSV merupakan momok penyakit yang meresahkan petambak udang disamping white spot karena dapat menyebabkan kematian 80–85%. (Erickson et al., 2002). Gejala klinis udang yang terinfeksi TSV adalah adanya perubahan warna tubuh yang kontras menjadi pucat kemerahan, hepatopankreas menguning dengan bercak hitam kecoklatan ditubuhnya (nekrosis), ukuran tubuh kecil dan tidak merata serta saat terinfeksi pada fase akut terjadi mortalitas yang terlihat berassosiasi dengan proses moulting (Nirnama, 2006).
Mengingat virus bersifat obligat interseluler, maka kemungkinan untuk menginfeksi organisme lain sangat tinggi (Momoyama et al., 1997). Udang yang terinfeksi dapat menyebarkan virus TSV secara horizontal melalui cairan ekskresi yang dikeluarkan ke dalam perairan (Sudha et al., 1998). Penularan TSV pada udang lokal belum dilaporkan lebih lanjut, akan tetapi menurut Widigdo (2005) TSV mempunyai potensi mutasi yang tinggi menjadi virus yang lebih ganas dan dapat menular ke udang lainnya. Deteksi terhadap adanya serangan virus TSV pada udang dengan menggunakan mesin PCR, sudah banyak laboratorium yang melakukannya, akan tetapi analisa keragaan genetik virus TSV pada udang budidaya belum dilakukan peninjauan secara seksama. Berdasarkan hal tersebut diatas, penelitian ini bertujuan untuk mengetahui keragaan genetik Taura Syndrome Virus (TSV) yang menginfeksi udang vanname dan udang windu berdasarkan analisis PCR dengan menggunakan
TM
diharapkan dapat diketahui keragaan genetik TSV yang spesifik menyerang udang vanname mempunyai kesamaan dengan TSV yang menginfeksi udang windu.
Materi dan Metode
Penelitian ini dilakukan di Laboratorium Bioteknologi Balai Besar Riset Perikanan Budidaya Laut Gondol Bali. Sampel udang vanname dan udang windu yang terinfeksi TSV berasal dari tambak udang swasta di Bali dan dari perairan Timika Papua.
Ekstraksi RNA
Sampel udang (insang, kaki renang) dimasukkan ke dalam mikrotube steril 1,5 mL di tambah RNA extraction 500 µL, digerus dengan pellet pistle dan diamkan selama 3–5 menit. Kemudian ditambahkan chloroform 100 µL dan disentrifugasi dengan kecepatan 12000 rpm selama 15 menit. Supernatan diambil 200 µL dimasukan dalam mikrotube baru selanjutnya ditambahkan isopropanol 200 µL dan disentrifugasi dengan kecepatan 12000 rpm selama 10 menit. Kemudian supernatan dibuang dan sisa pelet ditambahkan alkohol 75%, selanjutnya sentrifugasi kembali pada kecepatan 9000 rpm selama 5 menit. Kemudian supernatan di buang dengan pelan dan dikeringkan selama 10 menit, setelah kering ditambah ddH2O (double distilited water) dengan volume yang disesuaikan dengan banyaknya pelet (10–50 µL).
Amplifikasi PCR
Amplifikasi genom TSV udang Litopenaeus vannamei dan Penaeus monodon, diawali dengan mencampurkan beberapa reagent PCR kit (IQ2000TM). Tahap pertama digunakan larutan yang terdiri dari RT (Reverse Transcriptase) PCR Premix 7,0 µL, IQzyme DNA polymerase 2 unit/ul 0,5 µL, RT Enzyme mix 0,5 µL dan genom 2 µL. Sedangkan pada tahap kedua (nested PCR) larutan terdiri dari Nested PCR premix 14 µL dan IQzyme DNA polymerase 2 unit/ul 1 µL. Larutan tersebut dimasukan ke dalam mikrotube 0,2 mL steril dan diinkubasi dalam mesin PCR (Corbert Research PC 960). Dalam amplifikasi, suhu yang digunakan untuk tahap pertama: denaturasi adalah 42oC (30 menit), 94oC (2 menit), dan 94oC (20 detik); suhu annealing
ini berulang sebanyak 15 kali, tahap akhir amplifikasi digunakan suhu 72oC (30 detik), 20oC (30 detik). Pada tahap nested amplifikasi menggunakan suhu 94oC (20 detik), 62oC (20 detik), 72oC (30 detik), diulang selama 15 kali, kemudian 72oC (30 detik) dan terakhir 20oC (30 detik). Untuk mengetahui pola pita tunggal yang dihasilkan dari amplifikasi, digunakan 1,5% agarose gel elektroforesis dalam 1x TAE (tris acetic acid EDTA) buffer selama 25 menit. Sebagai marker molekuler digunakan DNA ladder 100 bp, untuk pewarnaan digunakan ethidium bromide dengan cara merendam gel agarose selama 15 menit. Hasil yang diperoleh diamati di bawah UV transiluminator (Model TFM–40 Upland CA USA)dan didokumentasikan dengan gel kamera (GH-10 Polaroid GelCam, UK).
Restriction Frangment Length Polymorphism (RFLP)
Untuk mengetahui polimorfisme dan marker enzim restriksi, template hasil PCR dipotong dengan 10 jenis enzim restriksi antara lain: Dra I (TTT’AAA), EcoR I (G’AATTC), EcoR V (GAT’ATC), Mnl I (CCTC(N)7‘, Mbo I (‘GATC), Nla III (CATG’), Sau 3AI (‘GATC), Hae III (GG’CC), Hha I (GCG’C), dan Hinf I (G’ANTC) (New England Biolabs inc). Pemotongan template DNA diawali dengan menyiapkan larutan 10x buffer, 100xBSA, enzim restriksi dan aquades serta template DNA produk amplifikasi PCR dengan volume tertentu. Larutan tersebut selanjutnya diinkubasi dalam Thermoblock (TB 1 Whatman Biometra GmbH, Germany) pada suhu 37oC selama 3 jam dengan menggunakan 1,5% agarose gel dalam 1x TBE (Tris Boric EDTA) buffer dan di elektroforesis 25 menit serta pewarnaan dengan ethidium bromide selama 15 menit akan diperoleh panjang fragment dari masing–masing template DNA. Sebagai molekuler marker digunakan DNA ladder 100 bp, sedangkan kontrol digunakan template DNA yang tidak mengalami pemotongan. Hasil yang diperoleh diamati dibawah UV transilluminator dan didokumentasikan dengan kamera gel. Parameter yang diamati antara lain persentase loki polimorfik (polymorphic loci) dan hubungan genotif TSV yang menginfeksi udang vanname dan udang windu (P. monodon) berdasarkan polymorphic loci.
Hasil dan Pembahasan
Pengamatan morfologi terhadap sampel udang vanname yang terinfeksi TSV dalam penelitian ini menunjukkan perubahan warna yang kontras menjadi merah muda pucat dengan beberapa bintik hitam pada abdomen. Udang dalam kondisi tersebut, dikatakan mengalami fase kronik, karena menurut Erickson et al. (2002), TSV awalnya menginfeksi bagian kutikula/eksoskleton dari udang, selanjutnya terjadi 2 fase infeksi yaitu fase kronik yang ditandai dengan adanya luka bintik hitam yang menyebar di seluruh tubuhnya. Selanjutnya apabila serangan virus makin meningkat, maka udang akan mengalami fase akut yang dicirikan dengan kondisi udang makin lemah, tidak berorientasi, kulit melunak, saluran pencernaan kosong dan kromatopora mengalami perluasan sehingga menyebabkan perubahan warna tubuh bahkan kematian. Sedangkan sampel udang windu yang terinfeksi tidak memperlihatkan perubahan morfologi kecuali nafsu makan berkurang, hal ini sesuai dengan pendapat Chang et al. (2002) bahwa udang windu (P. monodon) tidak menunjukkan gejala klinis jika terinfeksi TSV, tetapi udang windu juga merupakan inang yang spesifik.
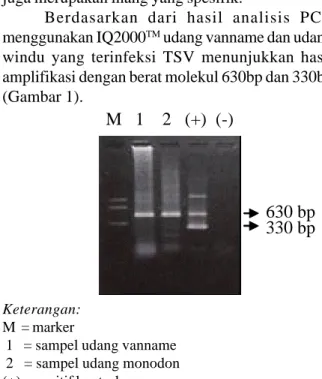
Berdasarkan dari hasil analisis PCR menggunakan IQ2000TM udang vanname dan udang windu yang terinfeksi TSV menunjukkan hasil amplifikasi dengan berat molekul 630bp dan 330bp (Gambar 1).
Gambar 1. Hasil deteksi TSV dengan PCR menggunakan IQ2000TM pada udang vanname dan windu
Keterangan: M = marker
1 = sampel udang vanname 2 = sampel udang monodon (+) = positif kontrol
(-) = negatif kontrol
M 1 2 (+) (-)
630 bp 330 bp
Pada gambar tersebut terlihat adanya kehadiran TSV pada tubuh udang yang ditunjukkan oleh adanya fragment DNA TSV pada gel agarose, yang berarti bahwa TSV yang menginfeksi udang vanname dan udang windu menunjukkan infeksi tingkat medium. Hal ini diketahui berdasarkan homologi pita fragment cDNA pada udang dibandingkan dengan positif kontrol berada pada posisi ditengah sebagai indikasi bahwa TSV yang menginfeksi udang vanname dan udang windu masih pada tahap awal atau udang mengalami fase kronik.
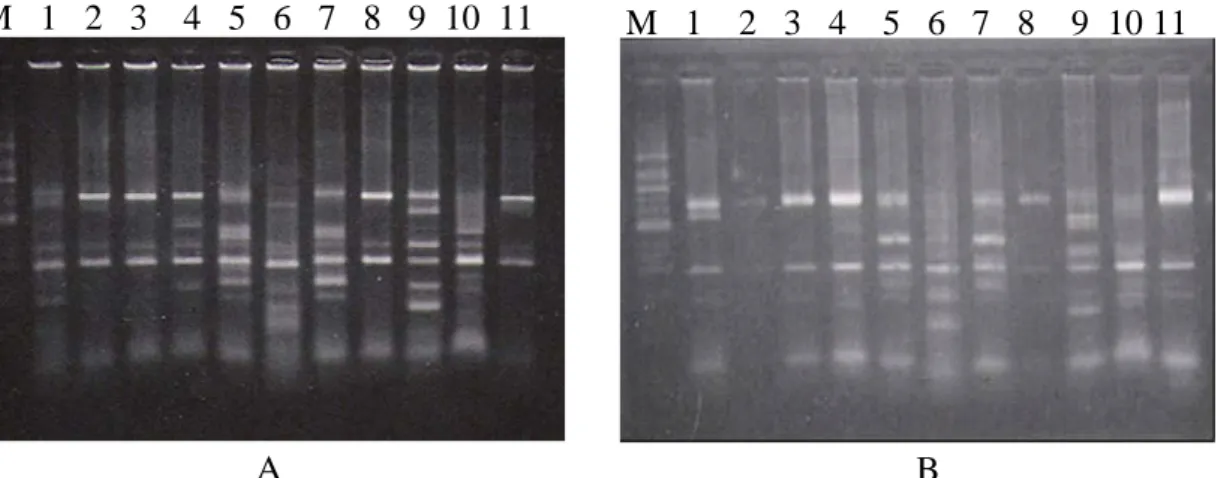
Keragaan genetik TSV yang menginfeksi udang vanname dan udang windu, dapat dilihat dari hasil analisis DNA dengan Restriction Frangment Length Polymorfism (RFLP). Hasil pemotongan tersebut tersaji pada Gambar 2. Pada gambar tersebut terlihat pemotongan dengan 10 enzym restriksi terhadap DNA TSV yang menginfeksi udang vanname dan udang windu tidak menunjukkan perbedaan. Hal tersebut diketahui dari gambaran fragment DNA yang nampak pada agarose gel memberikan pola pemotongan yang sama.
M 1 2 3 4 5 6 7 8 9 10 11
B M 1 2 3 4 5 6 7 8 9 10 11
A
Gambar 2. Pola polimorfisme DNA TSV yang menginfeksi udang L. vannamei (A) dan P. monodon (B) yang dipotong dengan enzim restriksi, M : DNA ladder 100 bp, 1 : Hae III, 2: EcoR V, 3: Dra I, 4: Hha I, 5: Sau 3AI, 6: Mnl, 7: Mbo I, 8: EcoR I, 9: Hinf I, 10: Nla III, 11: Tanpa pemotongan
Ukuran fragment DNA TSV yang menginfeksi udang vanname dan udang windu dipotong dengan 10 RE (restriction enzim) seperti tertera pada Tabel 1. Pada tabel tersebut menunjukkan bahwa dari 10 jenis enzim yang digunakan 7 diantaranya menunjukkan pemotongan yang sempurna dan dapat memotong 2 sampai 3 basa endonukleosis dengan berat molekul antara 100–530 bp antara lain; Hha I, Hinf I, Hae III, Mbo I, Nla III, Sau 3AI dan Mnl. Sedangkan 3 enzim restriksi yaitu Dra I, Ecor I dan Ecor V tidak menunjukkan pola pemotongan karena fragment DNA yang muncul sejajar dengan fragment produk PCR tanpa pemotongan dengan enzim restriksi (Gambar 2). Hal tersebut mengindikasikan bahwa ketiga jenis enzim restriksi tersebut, tidak dapat digunakan sebagai enzim restriksi untuk mengetahui keragaan genetik dari TSV yang menginfeksi udang. Enzim restriksi yang dapat memotong 3 basa endonukleosis adalah Mnl dengan berat molekul masing–masing 100 bp, 180
Mln dapat dijadikan sebagai penanda (marker gen) untuk menentukan adanya infeksi TSV pada udang. Berdasarkan dari hasil yang diperoleh dapat dikatakan bahwa virus TSV yang menginfeksi udang vanname dan udang windu merupakan jenis virus yang sama. Tetapi hal tersebut perlu dikaji kembali, karena menurut laporan Chang et al. (2002), bahwa isolat TSV pada udang Metapenaeus ensis (Tw2KMeTSV), P. monodon (Tw2KPmTSV) dan L. vannamei (Tw02LvTSV) yang dikoleksi dari pertambakan di Taiwan menunjukkan perbedaan pada struktur protein (capsid protein precursor) yaitu pada gene ORF2.
Hasil penelitian ini diharapkan dapat memberikan informasi tambahan mengenai keragaan genetik TSV yang menginfeksi udang vanname dan udang windu serta dapat dijadikan sebagai acuan untuk penelitian selanjutnya, terutama dalam hal biologi TSV agar diketahui inang spesifik dari virus tersebut, sehingga didapatkan cara yang
Kesimpulan
1. Keragaan genetik Taura Syndrome Virus (TSV) yang telah menginfeksi udang vanname (L. vannamei) dan udang windu (P. monodon) pada tingkat medium tidak berbeda atau dapat dikatakan bahwa virus TSV yang menginfeksi udang vanname dan udang windu merupakan jenis virus yang sama.
2. Enzim restriksi Mln dapat dijadikan sebagai penanda (marker gen) untuk menentukan adanya infeksi TSV pada udang.
Daftar Pustaka
Chang, Y.S., S.E. Peng, Y.T. Yu, F.C. Liu, C.H. Wang, C.F. Lo and G.H. Kou. 2002. Genetic and Phenotypic Variation of Isolate of Shrimp TSV Found in Penaeus monodon and Metapenaeus ensis in Taiwan. Institute of Zoology, National Taiwan University, Taipei, 106 pp.
Erickson, H.S., Z. M. Huzberg and D.V. Lightner. 2002. Detection of Taura Syndrome Virus (TSV) strain differences using selected diagnostic methods:
diagnostic implication in Penaeid shrimp. Dis Aquat. Org., 52: 5–10.
Momoyama, K., M. Hiraoka, K. Inouye, T. Kimura, H. Nakano and M. Yasui. 1997. Mass mortalities in the production of juvenile greasy-back shrimp, Metapennaeus ensis, cause by Pennaeid Acute Veremia (PAV). Fish Pathology, 32 (1): 51–56. Nirnama. 2006. Shrimp Diseases. Center for Tropical and
subtropical Aquaculture (CTSA), The Oceanic Institute, Hawaii, 121: 8.
Poernomo, S. 2007. Empat tahun ekspor udang naik 4,15%. http:www.endonesia.com. 1 Desember 2007.
Prayitno, S.B., H.N. Kamiso dan A.Rukyani, 2003. Petunjuk Pengendalian Penyakit Bercak Putih Pada Budidaya Udang Penaeid. Departemen Kelautan dan Perikanan, Direktorat jendral Perikanan Budidaya, Direktorat Kesehatan Ikan dan Lingkungan, No. 003 DFHE, 32 hlm. Sittidilokratna, N. 2005. Principles of PCR for detection
of shrimp viruses. Cartex Shrimp. National Centre for Genetic Engineering and biotechnology, Faculty of Science, Mahidol University, 20 pp.
Sudha, P.M., C.V. Mohan, K.M. Shanker and A. Hegde. 1998. Relationship between WSSV infection and Tabel 1. Ukuran fragment DNA TSV yang menginfeksi udang L. vannamei dan P. monodon yang dipotong dengan
10 enzim restriksi
Enzim restriksi Individu Ukuran fragmen Haplotip 1 2 3
Hha I L. vannamei 130 500 B P. monodon 130 500 B Hinf I L. vannamei 130 500 B P. monodon 130 500 B Hae III L. vannamei 100 530 B P. monodon 100 530 B Mnl L. vannamei 100 180 450 C P. monodon 100 180 450 C Mbo I L. vannamei 200 430 B P. monodon. 230 400 B Nla III L. vannamei 180 450 B P. monodon. 230 400 B Sau 3AI L. vannamei 200 430 B P. monodon. 230 400 B Dra I L. vannamei - - P. monodon. - - -Ecor I L. vannamei - - P. monodon. - - -Ecor V L. vannamei - - P. monodon. - -
-clinical manifestation in India cultured Penaeid shrimp. Aquaculture, 167: 95–101.
Tan, Z. and L. Grisez. 2004. Health Management Practice in Asian Mariculture. Current status and challenge the 7th Asian Fisheries Forum, Asian
Fisheries Society, Penang Malaysia, November 30, 2004, 12 pp.
Widigdo, B. 2005. Sekilas Tentang Taura Syndrom Virus. Trobos, Mei 2005, IV (68): 72.