Kualitas, Ekspresi HSP 70 dan Kerusakan DNA Spermatozoa Post Thawing Sapi Limosin Pasca Pendinginan pada Suhu 5°C
Semen Quality, HSP 70 Expression and DNA Damage of Post Thawing Limousine Bull Spermatozoa After Cooled At 5 °C
Anny Amaliya1, Suzanita Utama2, Hardijanto2
1Mahasiswa S2 Ilmu Biologi Reproduksi Fakultas Kedokteran Hewan Universitas Airlangga
2 Fakultas Kedokteran Hewan Universitas Airlangga Kampus C Unair, Mulyorejo Surabaya 60115
Tlp. 031-5992785 fax. 0315993015 e-mail : veterinaria.medika@gmail.com
Abstract
Good quality frozen semen is one of the factors that contribute to successful artificial insemination. To get high fertility, spermatozoa should be added with extender and cooled at 5°C for some time after collection. This study was aimed to know sperm quality variables including motility, viability, abnormality, and plasma membrane integrity as well as the expression of HSP 70 and the DNA damage of frozen semen after cooling at 5°C for 4 hours and 22 hours one limousine bull. Semen was collected from one Limosin bull twice a w week using artificial vagina. Following colection, semen were evaluated macroscopicly and microscopically including viability, abnormality and plasma membrane integrity. Semen then cooled at 5°C for 4 and 22 hours. Before freezing, semen was cooled at 5°C for 4 and 22 hours. Motility, viability, abnormality, plasma membrane integrity, expression of HSP 70 and DNA damage were evaluated before and after freezing. In before freezing evaluation showed significant difference (p<0,05) on motility beetween cooling at 5°C for 4 and 22 hours (55.6 ± 1.8 and 58,8 ± 2.3 % respectively), but there was no diference on viability, abnormality and plasma membrane integrity, HSP 70 expression and DNA damage. Meanwhile, in post thawing no diference was found on motility, viability, abnormality, plasma membrane integrity, expression of HSP 70 and DNA damage
Keywords: cooling at 5°C, HSP 70 , DNA damage Pendahuluan
IB merupakan teknik perkawinan dengan cara memasukkan atau deposisi semen ke dalam saluran kelamin betina menggunakan alat buatan manusia. IB bertujuan untuk meningkatkan mutu
genetik ternak, mengurangi resiko penyebaran penyakit terutama penyakit reproduksi, meningkatkan populasi dan produksi ternak. Keberhasilan IB dipengaruhi oleh banyak faktor diantaranya kualitas semen beku
yang digunakan. Kualitas semen beku dipengaruhi oleh kualitas semen segar, pengencer, waktu equilibrasi, teknik pembekuan dan penanganannya (Hafez, 2008).
Dalam proses pembekuan, 20–80% spermatozoa dapat mengalami kematian. Proses cooling, freezing, dan thawing dapat menimbulkan stress fisik dan kimia pada membran spermatozoa yang dapat menurunkan viabilitas dan kemampuan fertilitasnya (Chatterjee et al., 2001). Gadea et al., (2000) melaporkan ada proses penting selama proses pembekuan yaitu produksi reactive oxygen species
(ROS) yang dapat mengubah fungsi dan
struktur membran spermatozoa. Radikal bebas atau reactive oxygen species (ROS) dalam jumlah normal penting untuk fungsi biologis, namun ROS tidak memiliki target organ spesifik, sehingga dapat menyerang asam lemak tak jenuh ganda dari membran dan organel sel serta DNA yang dapat menyebabkan rusaknya struktur dan fungsi sel (Winarsi, 2007). Pada spermatozoa produksi ROS yang berlebih akan menyebabkan kerusakan asam lemak yang merupakan penyusun membran spermatozoa, inaktivasi enzim glikolitik, putusnya rantai DNA yang dapat menyebabkan turunnya motilitas dan menyebabkan apoptosis spermatozoa (Halliwell dan Whiteman, 2004).
Untuk mendapatkan fertilitas yang tinggi maka spermatozoa harus didinginkan untuk beberapa lama sesudah dicampur dengan bahan pengencer. Suhu optimum untuk pendinginan semen adalah 5°C . Saat ini dikenal dua metode untuk proses pembuatan semen beku yakni metode satu hari proses dan metode dua hari proses. Pada metode satu hari proses semen yang telah ditambahkan pengencer didinginkan pada suhu 5°C selama 4 jam, sedangkan pada metode dua hari semen yang telah ditambahkan pengencer didinginkan pada suhu 5°C selama 18 – 22 jam. Terdapat dugaan dari inseminator bahwa kualitas semen beku
yang dihasilkan dari metode satu hari proses lebih baik dibandingkan dengan metode dua hari proses.
Berdasarkan hal tersebut, akan dilakukan penelitian mengenai kualitas, ekspresi HSP 70 dan kerusakan DNA spermatozoa sapi limosin post thawing menggunakan pengencer tris dengan rentang waktu pendinginan berbeda pada suhu 5°C.
Materi dan Metode Penelitian
Penelitian dilakukan di Laboratorium Produksi Semen Beku Balai Besar Inseminasi Buatan Singosari. Penelitian dilaksanakan Bulan Oktober – Desember 2015. Sampel penelitian ini menggunakan pejantan sapi Limosin Caillin dengan umur 8 tahun. Dilakukan 8 kali pengambilan semen segar (n=8). Pembuatan preparat imunositokimia dilakukan di laboratorium Biomolekuler Universitas Brawijaya Malang.
Penampungan, Pengujian dan Pengolahan Semen
Penampungan semen dilakukan dua kali dalam satu minggu menggunakan vagina buatan. Selanjutnya dilakukan pengujian makroskopis dan mikroskopis semen segar. Pengujian makroskopis meliputi volume, warna, konsistensi dan pH. Pengujian mikroskopis meliputi gerak massa, gerak individu, konsentrasi, viabilitas, abnormalitas, dan membran plasma utuh.
Pengujian Kualitas Semen Segar
Motilitas Massa Spermatozoa. Sebanyak 5 µl semen diteteskan pada gelas objek yang telah diletakkan di atas slide warmer bersuhu 37ºC. Kemudian diamati menggunakan mikroskop Olympus BX-53 pembesaran 100 kali. Penilaian diberikan dengan kisaran 0 - +++.
Motilitas Individu Spermatozoa. Setelah di lakukan pemeriksaan gerak massa, tutup sampel dengan cover glass
kemudian periksa dengan menggunakan mikroskop Olympus BX-53pembesaran 200– 400 kalo. Penilaian diberikan dengan kisaran 0% - 100%.
Viabilitas Spermatozoa. Sebanyak 5 µl semen diteteskan pada gelas objek tambahkan 25 µl eosin negrosin, dihomogenkan. Dibuat preparat ulas. Dikeringkan menggunakan slide warmer. Preparat diamati dibawah mikroskop Olympus BX-53 pembesaran 400 kali. Spermatozoa yang hidup bagian kepalanya tetap jernih karena tidak menyerap zat warna. Sedangkan spermatozoa yang mati bagian kepalanya akan terwarnai. Pengamatan dilakukan pada 5 lapangan pandang yang berbeda dengan minimal spermatozoa yang diamati sebanyak 100 sel. Penghitungan persentase viabilitas spermatozoa sebagai berikut :
% Spermatozoa hidup = Jumlah spermatozoa hidup x 100 % Jumlah spermatozoa hidup + mati
Abnormalitas Spermatozoa. Sebanyak 5 µl semen diteteskan pada gelas objek tambahkan 25 µl eosin negrosin, dihomogenkan. Dibuat preparat ulas. Dikeringkan menggunakan slide warmer. Preparat diamati dibawah mikroskop Olympus BX-53 pembesaran 400 kali. Spermatozoa yang abnormal memiliki bentuk yang abnormal seperti ekor putus, tidak ada kepala spermatozoa, ekor menggulung, bentuk kepala yang tidak sempurna Pengamatan dilakukan pada 5 lapangan pandang yang berbeda dengan minimal spermatozoa yang diamati sebanyak 100 sel. Penghitungan persentase abnormalitas spermatozoa sebagai berikut :
% Abnormalitas = Jumlah spermatozoa abnormal x 100 % Jumlah spermatozoa normal + abnormal Membran Plasma Utuh. Pemeriksaan Membran Plasma Utuh dilakukan menggunakan uji HOS. Pemeriksaan dilakukan dengan menambahkan 100 µl semen ke dalam 1000 µl larutan HOS yang terdiri dari 0,9 gram D-fuktose, 0.490 gram tri sodium citrate dan 100
ml aquades, kemudian diinkubasi dalam inkubator suhu 37ºC selama 30 menit. Setelah diinkubasi ambil 1 tetes, teteskan pada obyek glass kemudian tutup dengan cover glass , amati di bawah mikroskop Olympus BX-53 dengan perbesaran 400x. Membran plasma utuh ditandai dengan ekor spermatozoa yang menggembung dan membran yang tidak utuh ditandai dengan ekor yang lurus. Pemeriksaan dilakukan pada 5 lapangan pandang berbeda dengan minimal spermatozoa yang diamati sebanyak 100 sel. Penghitungan persentase MPU spermatozoa sebagai berikut :
% MPU = Jumlah spermatozoa yang bereaksi x 100 % Jumlah spermatozoa yang bereaksi + tidak bereaksi
Pengujian Kualitas Spermatozoa Before Freezing
Setelah dilakukan pengujian semen segar semen yang memenuhi syarat selanjutnya ditambahkan pengencer A dan di dinginkan pada suhu 5°C selama 4 dan 22 jam kemudian ditambahkan dengan pengencer B yang mengandung glyserol 13%, diequilibrasi dan dilakukan pengujian before freezing. Pengujian before freezing meliputi motilitas, viabilitas, abnormalitas, membran plasma utuh, Ekspresi HSP 70 dan kerusakan DNA.
Ekspresi HSP 70. Pemeriksaan ekspresi HSP 70 dilakukan dengan pewarnaan imunositokimia dimaksudkan untuk menghitung jumlah spermatozoa imunoreaktif posistif terhadap HSP 70. Data sel imunoreaktif pada pemeriksaan merupakan data kuantitatif yang diperoleh dengan cara menghitung jumlah sel imunoreaktif yang ditemukan pada setiap 100 sel spermatozoa. Spermatozoa yang imunoreaktif akan berwarna coklat kromogen hingga kehitaman, sedangkan sel immunoreaktif negatif akan berwarna hijau kebiruan (Fucsh dan Auer, 2010)
Kerusakan DNA. Satu tetes semen dibuat preparat ulas pada gelas objek,
dikeringkan diudara dan difiksasi dalam etanol 96% - aseton (1:1) selama 30 menit pada suhu 4 oC. Setelah fiksasi, preparat dikeringkan di udara lalu dihidrolisis dalam HCl 0,1 N selama 5 menit pada suhu 4 oC. Preparat dibilas tiga kali menggunakan aquadest, lalu diwarnai dengan pewarnaan TB 0,05% dibiarkan selama 10 menit. Preparat yang telah diwarnai dicuci kembali dengan aquadest dan didehidrasi dengan menggunakan
t-butanol dua kali serta dibersihkan
dengan xylol sebanyak dua kali. Preparat diamati di bawah mikroskop Olympus BX-53 dengan pembesaran 400x. Kepala spermatozoa dengan integritas kromatin yang baik akan berwarna biru terang, sedangkan spermatozoa dengan integritas kromatin yang sudah berkurang akan berwarna biru tua. Pemeriksaan dilakukan pada 100 spermatozoa untuk setiap sampel.
Pengujian Kualitas Spermatozoa Post Thawing.
Pengujian semen beku dilakukan setelah thawing pada air bersuhu 37ºC selama 30 detik. Semen kemudian dimasukkan ke dalam test tube dan dilakukan pengujian motilitas, viabilitas, abnormalitas, membran plasma utuh, ekspresi HSP 70 dan kerusakan DNA. Prosedur pengujian sama seperti pengujian pada semen segar dan semen before freezing.
Analisa Data.
Rancangan penelitian yang digunakan adalah Faktorial. Data yang diperoleh dianalisa dengan menggunakan perangkat lunak Statistical Program for
Social Science (SPSS).
Hasil dan Pembahasan
Kualitas Semen Segar
Hasil pengujian makroskopis rataan volume semen sebesar 6,9 ± 0,8 ml (Tabel 1), volume tersebut tergolong normal, karena menurut Feradis (2010) volume semen sapi berkisar antara 5 – 8ml. Warna semen segar pada penelitian ini seperti air susu (Tabel 1), termasuk normal sesuai dengan pendapat Aminasari (2009) bahwa warna semen bervariasi antara warna air susu, coklat, kuning dan krem. Rataan tingkat keasaman semen segar pada penelitian ini 6,4 ± 0,1 (Tabel 1). Konsistensi spermatozoa yang digunakan dalam penelitian ini dikatagorikan sedang (Tabel 1).
Hasil pengujian makroskopis gerakan massa spermatozoa segar pada penelitian ini adalah +++ (Tabel 1). Rataan motilitas semen segar sapi limosin dalam penelitian ini sekitar 70,6 ± 1,8% (Tabel 1) , nilai ini masih berada di dalam batas normal. Susilawati (2011) menyatakan bahwa motilitas semen segar sapi potong berkisar antara 70–90%. Viabilitas spermatozoa segar yang digunakan dalam penelitian ini sebesar 89 ± 2,8% (Tabel 1). Dalam penelitian ini diperoleh hasil persentase abnormalitas morfologi spermatozoa sapi limosin sekitar 7,2 ± 0,5% (Tabel 1), Susilawati (2011) yang menyatakan bahwa abnormalitas semen segar sapi di bawah 20% masih memiliki fertilitas yang baik. Persentase Membran Plasma Utuh dalam penelitian ini 77,9 ± 2,6% (Tabel 1). Hasil ini masih dalam batasan normal seperti yang telah disampaikan oleh (Rizal dan Herdis, 2005) bahwa semen yang memenuhi syarat digunakan dalam program IB harus memiliki persentase motilitas paling sedikit sebesar 40% dan nilai persentase MPU semen segar lebih dari 60%.
Tabel 1 Kualitas Semen Segar Sapi Limosin
Evaluasi Rata- rata Volume (ml) Warna pH Konsistensi Konsentrasi (106/ml) Gerak Massa Gerak Individu (%) Viabilitas (%) Abnormalitas (%)
Membran Plasma Utuh (%)
6,9 ± 0,8 Air Susu 6,4 ± 0,1 Sedang 1.175,5 ± 149,4 + + + 70,6 ± 1,8 89 ± 2,8 7,2 ± 0,5 77,9 ± 2,6
Kualitas Spermatozoa Pasca Pendinginan Pada Suhu 5ºC
Dari hasil penelitian ini didapatkan bahwa lama pendinginan pada suhu 5°C menunjukkan hasil yang berbeda nyata pada motilitas spermatozoa before
freezing (Tabel 2) tetapi tidak berbeda
nyata pada viabilitas, abnormalitas dan membran plasma utuh before freezing. Semen yang didinginkan selama 22 jam menunjukkan motilitas before freezing yang lebih baik 58,8±2,3% daripada semen yang didinginkan selama 4 jam 55,6±1,8%. Serta terdapat pengaruh waktu pendinginan pada suhu 5°C terhadap motilitas spermatozoa
before freezing Semakin lama waktu
pendinginan menghasilkan motilitas spermatozoa before freezing yang lebih baik. Kemungkinan hal ini disebabkan lama pendinginan pada suhu 5°C selama 4 jam spermatozoa belum sepenuhnya
beradaptasi dengan pengencer akibatnya spermatozoa tidak terlindungi dari pengaruh luar termasuk terjadinya peroksidase lipid oleh ROS yang dapat menyebabkan kerusakan membran spermatozoa. Keutuhan membran plasma bagi semen mutlak diperlukan untuk menjamin kelangsungan hidup dan keberhasilan untuk membuahi sel telur. Fungsi membran plasma tidak hanya sebatas melindungi organel– organel yang terdapat didalam sel, tetapi lebih dari itu, membran plasma mampu berfungsi sebagai filter yang baik bagi pertukaran zat intra dan ekstraseluler. Apabila membran plasma rusak, maka proses metabolisme akan terganggu yang pada gilirannya akan menimbulkan akibat yang fatal bagi semen Jika membran plasma rusak, dapat menyebabkan integritas membran menurun. Akibatnya kontrol sistem transport terganggu yang berakibat pada menurunnya metabolisme, motilitas dan daya tahan hidup spermatozoa (Herdis et al., 2008). Ketika membran sperma mengalami kerusakan, enzim aspartat aminotransferase (AspAT) yang merupakan enzim utama dalam mitokondria yang memproduksi ATP akan dilepaskan dari sel dan masuk ke seminal plasma. Kehilangan AspAT akan mengganggu produksi ATP dan mengganggu motilitas spermatozoa (Arifiantini dan Purwantara 2010).
Tabel.2 Rataan dan Simpangan Baku Kualitas Spermatozoa Pasca Pendinginan pada Suhu 5°C
Perlakuan Motilitas (%)
(x±sd) Viabilitas (%)(x±sd) Abnormalitas (%)(x±sd) MPU (% )(x±sd)
Before Freezing P1 P2 Post Thawing P1 P2 55,6 a±1,8 58,8b±2,3 44,4±1,8 44,4±1,8 84,4 ± 2,8 85,5 ± 2,1 80,1 ± 2,5 81,8 ± 2,1 7,9 ± 0,6 7,7 ± 0,5 8,6 ± 0,6 8,5 ± 0,2 66,3±2,2 68,3±1,5 58,7±1,2 58,9±2,8 Keterangan : P1 adalah pendinginan pada suhu 5°C selama 4 jam
P2 adalah pendinginan pada suhu 5°C selama 22 jam
a,b Superkrip yang berbeda pada kolom yang sama menunjukkan perbedaan nyata (p<0,05)
Dari Hasil penelitian di dapatkan bahwa waktu pendinginan pada suhu 5°C tidak berpengaruh pada motilitas, viabilitas, abnormalitas dan membran plasma utuh post thawing (Tabel 2). Tidak adanya perbedaan kualitas spermatozoa
post thawing pasca pendinginan
pada suhu 5ºC selama 4 dan 22 jam diduga karena Komposisi pengencer yang digunakan mampu melindungi spermatozoa dari pengaruh cold shock. Komposisi pengencer yang digunakan antara lain laktosa yang merupakan salah satu senyawa pereduksi dan memiliki struktur yang stabil. Sebagai senyawa pereduksi, laktosa memiliki fungsi yang mirip dengan senyawa antioksidan karena mampu meredam senyawa-senyawa pengoksidasi, sehingga juga berperan dalam meminimalkan terjadinya reaksi oksidasi. Senyawa krioprotektan golongan karbohidrat seperti laktosa memiliki kemampuan menggantikan molekul air secara normal dalam kelompok polar hydrated. Sifat-sifat laktosa ini akan membantu menstabilkan membran plasma sel semen selama masa transisi melewati zona suhu yang kritis, serta mengubah sifat mekanik pengencer melalui peningkatan viskositas (Rizal, 2009).
Demikian pula penggunaan rafinosa pada pengencer juga mampu mempertahankan kualitas spermatozoa selama pembekuan. Sebagai sumber aktifitas rafinosa yang terdiri dari D-galaktosa, D-glukosa dan D-Fruktosa juga berfungsi menstabilkan kualitas semen terhadap pengaruh buruk penyimpanan dan pembekuan dalam nitrogen cair (Ariantie dkk.,2013). Kuning telur yang digunakan pada pengencer berfungsi untuk melindungi semen selama penyimpanan (Zega dkk., 2015). Khasiat utama kuning telur atau ekstrak kacang kedelai adalah kandungan lesitin (phosphatidyl choline) yang dapat bersifat membran coating untuk tetap mempertahankan konfigurasi normal
phospholipid bilayer yang merupakan
susunan utama membran sel semen dan pembekuan dalam nitrogen cair (Ariantie dkk., 2013).
Ekspresi HSP 70 dan Kerusakan DNA Spermatozoa Pasca Pendinginan Pada Suhu 5ºC
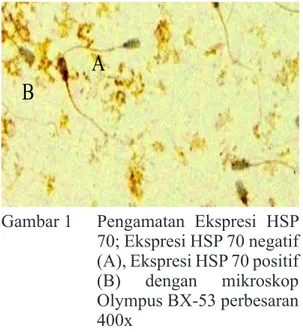
Pengamatan ekspresi HSP 70 spermatozoa dilakukan dengan pewarnaan imunositokimia. Spermatozoa yang imunoreaktif akan berwarna coklat kromogen hingga kehitaman, sedangkan yang negatif akan berwarna hijau kebiruan. (Gambar 1).
B
A
Gambar 1 Pengamatan Ekspresi HSP 70; Ekspresi HSP 70 negatif (A), Ekspresi HSP 70 positif (B) dengan mikroskop Olympus BX-53 perbesaran 400x
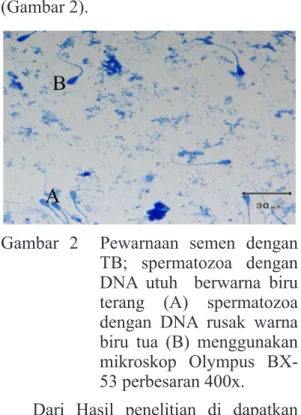
Kerusakan DNA spermatozoa dapat diamati melalui integritas kromatin dengan menggunakan pewarnaan Toluidine Blue (TB). Kepala spermatozoa yang memiliki integritas kromatin baik akan berwarna biru terang, sedangkan dengan integritas kromatin yang sudah berkurang akan berwarna biru tua
(Gambar 2).
B
A
Gambar 2 Pewarnaan semen dengan TB; spermatozoa dengan DNA utuh berwarna biru terang (A) spermatozoa dengan DNA rusak warna biru tua (B) menggunakan mikroskop Olympus BX-53 perbesaran 400x.
Dari Hasil penelitian di dapatkan bahwa tidak terdapat pengaruh lama pendinginan pada suhu 5°C terhadap ekspresi HSP 70 dan Kerusakan DNA Spermatozoa Before Freezing dan Post Thawing (Tabel 3).
Tabel 3 Rataan dan Simpangan Baku Ekspresi HSP 70 dan Kerusakan DNA Spermatozoa Pasca Pendinginan pada
Suhu 5°C Perlakuan HSP 70 (%) (x±sd) Kerusakan DNA(%) (x±sd) Before Freezing P1 P2 Post Thawing P1 P2 9,8±0,4 9,7±0,3 9,9±0,4 10,1±0,4 10,0±0,4 10,1±0,4 12,1±0,4 12,5±0,5 Keterangan :
• P1 adalah pendinginan pada suhu 5°C selama 4 jam
• P2 adalah pendinginan pada suhu 5°C selama 22 jam
Berbeda dengan hasil penelitian Sardjito (2014) bahwa pada semen beku
terjadi peningkatan ekspresi HSP 70 yaitu sebesar 30% jika dibandingkan dengan semen segar yang hanya terekspresi 10 %. Hasil ini menunjukkan bahwa stres spermatozoa pada saat pendinginan pada suhu 5°C dan pembekuan dapat ditekan sehingga ekspresi HSP 70 rendah, dengan demikian perubahan pada struktur sel dan fungsi protein dapat diminimalkan.
Diduga karena. proses pembekuan pada penelitian ini menggunakan mesin prefreezing dimana penurunan suhu diatur sedemikian rupa untuk mencegah terjadinya cold shock pada semen. Sardjito (2014) berpendapat bahwa HSP terekspresi apabila ada rangsangan stres termasuk stres pembekuan. Ekspresi HSP 70 yang rendah pada penelitian ini menunjukkan bahwa stres pada saat proses pembekuan dapat diminimalkan.
Hasil Penelitian menunjukkan bahwa lama pendinginan pada suhu 5°C tidak berpengaruh terhadap kerusakan DNA before freezing dan post thawing. Priyanto dkk., (2015) berpendapat bahwa proses pembekuan semen menurunkan presentase motilitas, viabilitas, MPU, dan TAU tetapi tidak menurunkan keutuhan DNA. Kerusakan DNA persentasenya rendah selama proses pembekuan.
Rendahnya kerusakan DNA ini kemungkinan disebabkan oleh manajemen pemeliharaan pejantan yang cukup baik sebagaimana pendapat menurut Morel dan Rodriguez-Martinez (2007) beberapa faktor yang dapat mempengaruhi kerusakan dan kualitas DNA, adalah pengaruh lingkungan, pakan, kesehatan, dan kondisi sapi. Lingkungan dan pakan sangat berpengaruh terhadap proses spermatogenesis terutama pada fase spermiogenesis. Selain itu rendahnya kerusakan DNA disebabkan oleh teknik pembekuan dan pengencer yang digunakan baik (Priyanto dkk., 2015).
Pada penelitian ini terbentuknya ROS dapat diminimalkan pada saat proses pembekuan, sehingga tidak mampu mengoksidasi lipid maupun
protein membran yang dapat dibuktikan dengan masih tingginya membran plasma utuh semen setelah pembekuan. Tingginya membran plasma utuh mampu menjaga akses faktor ekstrinsik terhadap DNA, sehingga fragmentasi DNA dapat dihindari. Dengan demikian ROS yang terbentuk masih dalam jumlah normal yang digunakan untuk fungsi biologis sebagaimana pernyataan Winarsi (2007) bahwa radikal bebas atau reactive oxygen
species (ROS) dalam jumlah normal
penting untuk fungsi biologis.
Sardjito (2014) berpendapat bahwa pada saat pembekuan terjadi peningkatan aktivitas caspase 3, 8 dan 9 serta gangguan potensial membran mitokondria tetapi tidak berpengaruh signifikan terhadap fragmentasi DNA. Fragmentasi DNA lebih banyak disebabkan oleh faktor thawing dari pada proses pembekuan.
Kesimpulan
Lama pendinginan pada suhu pada suhu 5°C tidak berpengaruh terhadap Kualitas, Ekspresi HSP 70 dan Kerusakan DNA Spermatozoa Post Thawing sapi limosin.
Daftar Pustaka
Ariantie, O.S, T.L Yusuf, D. Sajuthi dan R.I Arifiantini. 2013. Pengaruh Krioprotektan Gliserol dan Dime-thilformamida dalam Pembekuan Semen Kambing Peranakan Etawah Menggunakan Pengencer Tris Modifikasi. JITV Vol. 18 No. 4: 239-250.
Arifiantini, R.I dan B.Purwantara. 2010. Motility and viability of Friesian Holstein semen in three different extender stored at 5°C. J Indone-sian Trop Anim Agric.35:222-226. Chatterjee, S., E.R. Smith, K. Hanada,
V.L. Stevens dan S. Mayor. 2001. GPI Anchoring Leads to Sphin-golipid-Dependent Retention of Endocytosed Proteins in the
Re-cycling Endosomal Compartment. EMBO J. 20(7):1583–1592. Feradis. 2010. Bioteknologi Reproduksi
pada Ternak. Alfabeta. Bandung. Gadea, J., E. Selles, S. Ruiz, P. Coy, R.
Romar, C. Matas and I. Campos. 2000. Effect of the Presence of Glutathione in the Thawing Dilu-ent on The Penetrability Capacity of Porcine Oocytes In Vitro. Di dalam : Proceedings 14 ICAR : Stockholm, 2-6 Jul 2000. Abstract Vol 2, 17:11.
Hafez, E.S.E. 2008. Reproduction in Farm Animals. 6th Edition. Lea Febiger. Philadelphia.
Halliwell, B. and M. Whiteman. 2004. Measuring Reactive Species and Oksidative Damage In Vivo and in Cell Culture: How Should You Do It and What Do the Results Mean: British Journal of Pharmacology 142(2):231-255.
Herdis, M., Surachman, Yulnawati, M. Rizal dan H. Maheshwari. 2008. Viabilitas dan Keutuhan Membran Plasma Semen Epididimis Kerbau Belang pada Penambahan Maltosa dalam Pengencer Andromed®.
J Indon Trop Anim Agric 33(2):
101-106.
Morrell, J.M and H. Rodriguez-Martinez. 2009.Biomimetic techniques for improving sperm quality in ani-mal breeding: a review. The Open
J Androl 1 : 1-9.
Priyanto,L., R.I Arifiantini dan T.L. Yu-suf. 2015. Deteksi Kerusakan DNA Semen Semen Segar dan Semen Beku Sapi Menggunakan Pewarnaan Toluidine Blue.Jurnal Veteriner Maret 2015 Vol. 16 No. 1 : 48-55.
Rizal, M. 2009. Daya Hidup Semen Epi-didimis Sapi Bali yang Dipreser-vasi pada Suhu 3–5oC dalam Pen-gencer Tris dengan Konsentrasi
Laktosa yang Berbeda. JITV Vol. 14 No. 2: 142-149
Sardjito, T. 2014. Identifikasi Kasus In-fertilitas dan Pola Pita Protein Gel SDS-PAGE Serum Sapi Betina Crossbreed Baluran dan Peruba-han Molekuler DNA pada Semen Pejantan Baluran Post Thawing. Disertasi. Universitas Airlangga. Susilawati, T. 2011. Spermatology.
Uni-versitas Brawijaya Press. Malang. Winarsi.2007. Antioksidan Alami dan
Radikal.Kanisius. Yogyakarta Zega, I., S. Ilyas dan S. Hutahaean. 2015.
Kualitas Semen Sapi Limou-sin dalam Pengencer Two-Stetm
Extender Dengan Suplementasi
Kuning Telur Bebek Selama Pe-nyimpanan pada Refrigerator.Jur-nal Biosains Vol. 1 No. 3.