BAB II
TINJAUAN PUSTAKA
2.1 Uraian Sampel
2.1.1 Uraian Ikan Sembilang
Taksonomi ikan Sembilang: Kingdom : Animalia Filum : Chordata Kelas : Actinopterygii Ordo : Siluriformes Famili : Plotosidae Genus : Paraplotosus
Spesies : Paraplotosus albilabris
(Nelson, 2006) Ikan Sembilang atau Eel tailed catfish adalah jenis ikan laut yang bentuk tubuhnya menyerupai ikan Lele. Hidupnya pada kedalaman 0-10 meter. Sering dijumpai di daerah pesisir pantai atau laut dangkal. Bentuk badannya panjang tanpa sisik, sirip punggung pertama berduri tajam dekat dengan kepala, sirip punggung kedua bersambung dengan sirip ekor dan sirip dubur. Ikan ini dapat mencapai panjang 134 cm. Ikan Sembilang merupakan ikan predator, yang memangsa ikan-ikan kecil, selain itu ikan ini juga memakan hewan-hewan yang hidup di dasar laut yaitu hewan-hewan kelompok gastropoda, moluska dan krustasea. Ikan dewasa dapat hidup sendiri atau dalam kelompok kecil (Utomo, et al., 2007).
2.1.2 Uraian Ikan Kepala Batu
Taksonomi ikan Kepala Batu: Kingdom : Animalia Filum : Chordata Kelas : Actinopterygii Ordo : Atheriniformes Famili : Atherinidae Genus : Pranesus
Spesies : Pranesus duodecimalis
(Valenciennes, 1835) Ikan Kepala Batu atau yang biasa disebut ikan Gulamah merupakan ikan yang habitatnya di perairan pantai hingga ke laut dangkal dan sungai. Ikan ini memiliki bentuk tubuh memanjang dan seluruh bagian tubuhnya tertutup sisik kecuali ujung kepala. Sirip punggung tidak terputus, dengan lekukan yang dalam antara bagian sirip yang berjari-jari keras dengan bagian sirip yang berjari-jari lemah. Ikan ini menjadikan ikan-ikan kecil dan udang sebagai makanannya (Kottelat, et al., 1993).
2.2Pencemaran Laut
Kehidupan manusia di bumi sangat bergantung pada lautan. Manusia harus menjaga kebersihan dan kelangsungan kehidupan organisme yang hidup di dalamnya. Dengan demikian laut seakan-akan merupakan sabuk pengaman kehidupan manusia di muka bumi ini. Di lain pihak, lautan merupakan tempat pembuangan benda-benda asing dan pengendapan barang sisa yang diproduksi oleh manusia. Lautan juga menerima bahan-bahan yang terbawa oleh air dari
daerah pertanian dan limbah rumah tangga, dari atmosfer, sampah dan bahan buangan dari kapal, tumpahan minyak dari kapal tanker, pengeboran minyak lepas pantai, dan masih banyak lagi bahan yang terbuang ke lautan (Darmono, 2001).
Lautan dapat melarutkan dan menyebarkan bahan-bahan tersebut sehingga konsentrasinya menjadi menurun, terutama di daerah laut dalam. Kehidupan laut dalam juga terbukti lebih sedikit terpengaruh daripada laut dangkal. Daerah pantai, terutama daerah muara sungai, sering mengalami pencemaran berat, yang disebabkan karena proses pencemaran yang berjalan terus-menerus secara perlahan sehingga terjadi akumulasi (Darmono, 2001).
2.3 Klasifikasi Laut Berdasarkan Kedalamannya
Berdasarkan kedalamannya, laut dibagi menjadi 4 zona, yaitu: zona lithoral, zona neritis, zona bathial, dan zona abisal.
a. Zona Lithoral
Zona Lithoral adalah wilayah pantai atau pesisir atau shore. Pada saat air laut pasang wilayah ini tergenang air dan pada saat air laut surut wilayah ini berubah menjadi daratan. Oleh karena itu wilayah ini sering juga disebut wilayah pasang-surut.
b. Zona Neritis
Zona Neritis (wilayah laut dangkal) yaitu dari batas wilayah pasang surut hingga kedalaman 50 m. Pada zona ini masih dapat ditembus oleh sinar matahari sehingga pada wilayah ini paling banyak terdapat berbagai jenis kehidupan baik hewan maupun tumbuh-tumbuhan.
c. Zona Bathial
Zona Bathial (wilayah laut dalam) adalah wilayah laut yang memiliki kedalaman antara 50 m hingga 1800 m. Wilayah ini tidak dapat tertembus sinar matahari, oleh karena itu kehidupan organismenya tidak sebanyak yang terdapat di wilayah Neritis.
d. Zona Abisal
Zone Abisal (wilayah laut sangat dalam) yaitu wilayah laut yang memiliki kedalaman di atas 1800 m. Di wilayah ini suhunya sangat dingin dan tidak ada tumbuh-tumbuhan. Jenis hewan yang dapat hidup di wilayah ini sangat terbatas.
2.4 Logam
Logam dapat dibagi menjadi dua bagian yaitu logam esensial dan logam nonesensial. Logam esensial adalah logam yang diperlukan untuk membantu reaksi-reaksi biokimia yang terjadi di dalam tubuh makhluk hidup seperti membantu kerja enzim atau pembentukan sel darah merah. Sebaliknya logam nonesensial adalah logam yang keberadaannya dalam tubuh makhluk hidup dapat menimbulkan pengaruh-pengaruh negatif dan apabila kandungannya tinggi akan dapat merusak organ-organ tubuh makhluk hidup yang bersangkutan. Logam yang dapat menyebabkan keracunan adalah jenis logam berat. Logam ini termasuk logam yang esensial seperti Cu, Zn, Ni dan yang nonesensial seperti Hg, Pb, Cd, dan As (Palar, 2008).
Timbal
Timbal (Pb) merupakan salah satu jenis logam berat. Timbal memiliki titik lebur yang rendah, mudah dibentuk, memiliki sifat kimia yang aktif sehingga bisa
digunakan untuk melapisi logam agar tidak timbul perkaratan. Timbal adalah logam yang lunak bewarna abu-abu kebiruan mengkilat. Logam ini mempunyai nomor atom 82 dengan bobot atau berat atom 207,20. Timbal meleleh pada suhu 328o C, titik didih 1740o C dan memiliki masa jenis 11,34 g/cm3 (Widowati, 2008).
2.5.1 Kegunaan Timbal
Timbal merupakan salah satu logam yang populer dan banyak dikenal oleh orang awam. Hal ini dikarenakan timbal banyak digunakan di pabrik-pabrik baik dalam bentuk murni maupun dalam bentuk campurannya dengan logam lain (Darmono, 1995).
Penggunaan dalam jumlah yang paling besar adalah untuk bahan produksi baterai dan aki. Timbal oksida (PbO4) dan logam timbal dalam industri baterai
digunakan sebagai bahan yang aktif dalam pengaliran arus elektron. Alloy Pb yang mengandung 1% stibium (Sb) banyak digunakan sebagai kabel telepon. Alloy Pb dengan 0,15% As, 0,1% Sn, dan 0,1% Bi banyak digunakan untuk kabel listrik (Palar, 2004).
Logam Pb juga digunakan dalam industri percetakan (tinta) dalam bentuk senyawa PbS. Pb murni biasanya digunakan untuk melapisi logam lain dan pipa sehingga bahan yang dilapisi tersebut tidak mudah berkarat atau rusak karena bahan-bahan kimia yang bersifat korosif. Lebih dari 200.000 ton Pb digunakan dalam industri kimia yang berbentuk (CH3)4-Pb (tetrametil-Pb) dan (C2H5)4-Pb
(tetraetil-Pb), yang biasanya dicampur dengan bahan bakar kendaraan untuk melindungi mesin agar lebih awet (Palar, 2004).
Senyawa Pb juga digunakan untuk pembuatan cat, seperti PbCrO4 yang
menghasilkan cat berwarna kuning kemerahan, Pb(OH)2.2PbCO3 untuk
menghasilkan cat berwarna putih, sedangkan senyawa Pb3O4 digunakan untuk
mendapatkan warna merah (Palar, 2004).
Senyawa silikat timbal (Pb-silikat) digunakan secara luas sebagai salah satu bahan pengkilap keramik dan sekaligus berperan sebagai bahan tahan api, sedangkan persenyawaan yang terbentuk antara Pb dengan arsenat dapat digunakan sebagai insektisida (Palar, 2004).
2.5.2 Toksisitas Timbal
Keracunan yang ditimbulkan oleh persenyawaan logam Pb dapat terjadi karena masuknya persenyawaan logam tersebut ke dalam tubuh. Proses masuknya Pb ke dalam tubuh dapat melalui beberapa jalur, yaitu melalui makanan dan minuman, udara dan perembesan atau penetrasi melalui selaput atau lapisan kulit (Palar, 2004).
Meskipun jumlah Pb yang diserap oleh tubuh hanya sedikit, logam ini ternyata menjadi sangat berbahaya. Hal itu disebabkan karena timbal (Pb) adalah logam toksik yang bersifat kumulatif dan bentuk senyawanya dapat memberikan efek racun terhadap banyak fungsi organ yang terdapat dalam tubuh (Suharto, 2005).
Gejala yang khas dari keracunan Pb yaitu:
1. Anemia: Pb dapat menghambat pembentukan hemoglobin (Hb) sehingga menyebabkan anemia. Selain itu, lebih dari 95% Pb yang terbawa dalam aliran darah dapat berikatan dengan eritrosit yang menyebabkan mudah pecahnya eritrosit tersebut.
2. Ensefalopati: Pb menyebabkan kerusakan sel endotel dan kapiler darah otak sehingga dapat menimbulkan sakit kepala, mudah lupa, dan lain-lain.
3. Aminociduria: terjadinya kelebihan asam amino dalam urin disebabkan ikut sertanya senyawa Pb yang terlarut dalam darah ke sistem urinaria (ginjal) sehingga mengakibatkan terjadinya kerusakan pada saluran ginjal.
4. Gastroenteritis: keadaan ini disebabkan reaksi rangsangan garam Pb pada mukosa saluran pencernaan, sehingga menyebabkan pembengkakan, gerak kontraksi rumen dan usus terhenti, peristaltik menurun sehingga terjadi konstipasi dan kadang-kadang diare (Darmono, 1995).
2.6 Kadmium
Kadmium adalah logam berwarna putih perak, lunak, mengkilap, tidak larut dalam basa, mudah bereaksi, serta menghasilkan kadmium oksida bila dipanaskan. Kadmium (Cd) umumnya terdapat dalam kombinasi dengan klor (Cd klorida) atau belerang (Cd Sulfit). Kadmium bisa membentuk Cd2+ yang bersifat tidak stabil. Cd memiliki nomor atom 40, berat atom 112,4, titik leleh 321oC, titik didih 767oC dan memiliki masa jenis 8,65 g/cm3 (Widowati, 2008).
2.6.1 Kegunaan Kadmium
Seperti halnya Pb, logam ini banyak digunakan sebagai bahan pigmen untuk industri percetakan maupun industri cat, biasanya yang paling sering digunakan dalam industri cat yaitu dalam bentuk sulfida yang memberi warna kuning. Kadmium juga digunakan dalam pembuatan baterai atau aki karena memiliki potensial voltase yang stabil. Selain itu logam ini juga digunakan sebagai bahan untuk melapisi logam lain dan pipa karena sifatnya yang tahan terhadap korosi serta digunakan dalam pembuatan pupuk TSP (Darmono, 1995).
2.6.2 Toksisitas Kadmium
Penelitian menunjukkan bahwa logam Cd merupakan logam yang tingkat toksisitasnya tertinggi kedua setelah logam Hg. Adapun efek yang dapat timbul akibat keracunan logam ini yaitu:
1. Efek terhadap tulang
Serangan yang paling hebat dari keracunan yang disebabkan oleh logam Cd adalah kerapuhan pada tulang. Penyakit ini dinamakan “itai-itai” (itai-itai disease) yang berarti “aduh-aduh”. Penyakit ini mendatangkan rasa sakit pada persendian tulang belakang dan tulang kaki.
2. Efek terhadap ginjal
Logam Cd dapat menimbulkan gangguan dan bahkan mampu menimbulkan kerusakan pada sistem yang bekerja di ginjal. Kerusakan yang terjadi pada sistem ginjal dapat dideteksi dari tingkat atau jumlah kandungan protein yang terdapat di dalam urine. Penyakit ini disebut proteinuria. Proteinuria ditemukan pada orang-orang yang telah terpapar Cd dalam selang waktu yang lama, yaitu dalam jangka waktu 20-30 tahun.
3. Efek Cd terhadap paru-paru
Keracunan yang disebabkan oleh terhirupnya debu yang mengandung Cd dapat mengakibatkan kerusakan terhadap paru-paru. Terhirupnya Cd dalam jangka waktu yang lama dapat menyebabkan terjadinya pembengkakan paru-paru
(pulmonary emphysema). Peristiwa pembengkakan paru-paru ini disebabkan oleh penghambatan kerja enzim alfa-antipirin oleh logam Cd.
4. Efek terhadap sistem reproduksi
Daya racun yang dimiliki oleh Kadmium juga mempengaruhi sistem reproduksi dan organ-organnya. Pada konsentrasi tertentu Cd dapat mematikan sel-sel sperma pada laki-laki. Hal inilah yang menjadi dasar bahwa akibat terpapar oleh logam Cd dapat mengakibatkan impotensi (Palar, 2004).
2.7Toksisitas Logam pada Ikan
Ikan merupakan jenis organisme air yang dapat bergerak dengan cepat di dalam air. Ada jenis ikan yang hidup di perairan yang dangkal dan ada pula yang hidup di perairan dalam. Karena dapat berenang dengan cepat, ikan memiliki kemampuan untuk menghindarkan diri dari pengaruh polusi. Tetapi, pada ikan yang hidup dalam habitat yang terbatas, ikan-ikan ini akan sulit melarikan diri dari pengaruh polusi tersebut. Hal ini sering terjadi pada ikan-ikan yang hidup di perairan dangkal (Darmono, 2001).
Logam berat masuk ke dalam jaringan tubuh ikan melalui beberapa jalan, yaitu saluran pencernaan, saluran pernapasan dan penetrasi melalui kulit. Absorpsi logam melalui saluran pernapasan biasanya cukup besar, sedangkan logam yang masuk melalui kulit jumlah dan absorpsinya relatif kecil (Darmono, 2001).
Logam berat tersebut di dalam air kebanyakan dalam bentuk ion. Logam ini kemudian berikatan dengan protein yang terdapat pada tubuh ikan membentuk suatu persenyawaan yang disebut metalotionein yang bersifat permanen.
Metalotionein ini terbentuk secara perlahan-lahan dan sedikit demi sedikit sehingga terjadi bioakumulatif. Jika jumlahnya sudah melebihi batas yang dapat ditoleransi, maka akan timbul suatu keadaan toksik sebagai manifestasi dari keracunan logam berat tersebut (Darmono, 1995).
2.8 Destruksi Basah
Suatu sampel dapat diukur kandungan logamnya apabila logam-logam dalam sampel tersebut telah dibebaskan dari bahan organiknya. Pembebasan logam dari bahan organik dilakukan dengan destruksi (Greenberg, 1992).
Destruksi basah merupakan suatu proses pemanasan sampel organik dengan menambahkan pengoksidasi kuat seperti asam-asam mineral atau bahan pengoksidasi lainnya, baik tunggal maupun campuran. Penambahan bahan-bahan tersebut disertai dengan pemanasan yang cukup dalam beberapa menit dapat mengoksidasi sampel secara sempurna sehingga menghasilkan ion logam dalam larutan asam dalam bentuk senyawa anorganik untuk dianalisis selanjutnya (Anderson, 1987).
Destruksi basah biasanya menggunakan HNO3, H2SO4, HClO4, H2O2 atau
campuran dari bahan-bahan tersebut (Haswell, 1991).
Menurut Brix (1983) proses destruksi basah terhadap logam yang terikat di dalam jaringan tubuh makhluk hidup dapat dilakukan menggunakan campuran HNO3 dan H2O2 dengan perbandingan 10:3. Selanjutnya hasil destruksi ini dapat
dianalisa secara kuantitatif dengan menggunakan spektrofotometer serapan atom.
2.9Spektrofotometer Serapan Atom
Spektrofotometri serapan atom adalah suatu metode yang digunakan untuk mendeteksi atom-atom logam dalam fase gas. Metode ini seringkali mengandalkan nyala untuk mengubah logam dalam larutan sampel menjadi atom-atom logam berbentuk gas yang digunakan untuk analisis kuantitatif dari logam dalam sampel (Bender, 1987).
Peristiwa serapan atom pertama kali diamati oleh Fraunhofer ketika mengamati garis-garis hitam pada spektrum matahari, sedangkan yang memanfaatkan prinsip serapan atom pada bidang analisis adalah seorang berkebangsaan Australia bernama Alan Wals di tahun 1955. Sebelumnya ahli kimia banyak tergantung pada cara-cara spektrofotometrik atau metode analisis spektrografik. Cara ini sulit dan memakan waktu, sehingga digantikan dengan spektroskopi serapan atom atau atomic absorption spectroscopy (Harris, 1982).
Spektrofotometri serapan atom digunakan untuk analisis kuantitatif unsur-unsur logam dalam jumlah sekelumit (trace) dan sangat sekelumit (ultratrace). Cara analisis ini memberikan kadar total unsur logam dalam suatu sampel dan tidak tergantung pada bentuk molekul logam dalam sampel tersebut. Cara ini cocok untuk analisis sekelumit logam karena mempunyai kepekaan yang tinggi (batas deteksi kurang dari 1 ppm), pelaksanaanya relatif sederhana, dan interferensinya sedikit. Spektrofotometri serapan atom didasarkan pada penyerapan energi sinar oleh atom-atom netral dalam bentuk gas (Rohman, 2007).
Proses yang terjadi ketika dilakukan analisis dengan menggunakan spektrofotometri atom dengan cara absorbsi yaitu penyerapan energi radiasi oleh atom-atom yang berada pada tingkat dasar. Atom-atom tersebut menyerap radiasi pada panjang gelombang tertentu, tergantung pada sifat atom tersebut. Sebagai contoh plumbum menyerap radiasi pada panjang gelombang 283,3 nm, kadmium pada 228,8 nm, natrium pada 589 nm, sementara kalium menyerap pada panjang gelombang 766,5 nm. Dengan menyerap energi, maka atom akan memperoleh energi sehingga suatu atom pada keadaan dasar dapat ditingkatkan menjadi ke tingkat eksitasi (Rohman, 2007).
Secara eksperimental akan diperoleh puncak-puncak serapan sinar oleh atom-atom yang dianalisis. Garis-garis spektrum serapan atom yang timbul karena serapan sinar yang menyebabkan eksitasi atom dari keadaan azas ke salah satu tingkat energi yang lebih tinggi disebut garis-garis resonansi (Resonance line). Garis-garis resonansi ini akan dibaca dalam bentuk angka oleh Readout (Rohman, 2007).
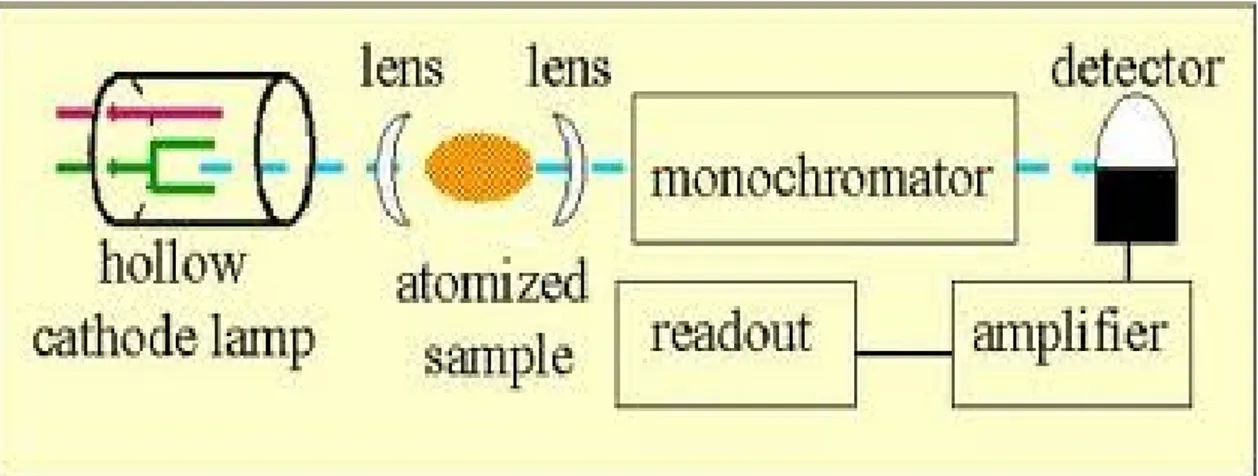
Adapun instrumentasi spektrofotometer serapan atom adalah sebagai berikut:
a. Sumber Sinar
Sumber sinar yang lazim dipakai adalah lampu katoda berongga (hollow cathoda lamp). Lampu ini terdiri atas tabung kaca tertutup yang mengandung suatu katoda dan anoda. Katoda berbentuk silinder berongga yang terbuat dari logam atau dilapisi dengan logam tertentu. Tabung logam ini diisi dengan gas mulia (neon atau argon). Bila antara anoda dan katoda diberi selisih tegangan yang tinggi (600 volt), maka katoda akan memacarkan beras-berkas elektron yang bergerak menuju anoda yang mana kecepatan dan energinya sangat tinggi. Elektron-elektron dengan energi tinggi ini dalam perjalanannya menuju anoda akan bertabrakan dengan gas-gas mulia yang diisikan tadi. Akibat dari tabrakan-tabrakan ini membuat unsur-unsur gas mulia akan kehilangan elektron dan menjadi bermuatan positif. Ion-ion gas mulia yang bermuatan positif ini selanjutnya akan bergerak ke katoda dengan kecepatan dan energi yang tinggi pula. Pada katoda terdapat unsur-unsur yang sesuai dengan unsur yang dianalisis. Unsur-unsur ini akan ditabrak oleh ion-ion positif gas mulia. Akibat tabrakan ini, unsur-unsur akan terlempar ke luar dari permukaan katoda. Atom-atom unsur dari
katoda ini mungkin akan mengalami eksitasi ke tingkat energi-energi elektron yang lebih tinggi dan akan memancarkan spektrum pencaran dari unsur yang sama dengan unsur yang akan dianalisis (Rohman, 2007).
b. Tempat sampel
Dalam analisis dengan spektrofotometer serapan atom, sampel yang akan dianalisis harus diuraikan menjadi atom-atom netral yang masih dalam keadaan azas. Ada berbagai macam alat yang digunakan untuk mengubah sampel menjadi uap atom-atomnya, yaitu:
1. Dengan nyala (Flame)
Nyala digunakan untuk mengubah sampel yang berupa cairan menjadi bentuk uap atomnya dan untuk proses atomisasi. Suhu yang dapat dicapai oleh nyala tergantung pada gas yang digunakan, misalnya untuk gas asetilen-udara suhunya sebesar 2200ºC. Sumber nyala asetilen-udara ini merupakan sumber nyala yang paling banyak digunakan. Pada sumber nyala ini asetilen sebagai bahan pembakar, sedangkan udara sebagai bahan pengoksidasi (Rohman, 2007). 2. Tanpa nyala (Flameless)
Pengatoman dilakukan dalam tungku dari grafit. Sejumlah sampel diambil
sedikit (hanya beberapa μL), lalu diletakkan dalam tabung grafit, kemudian
tabung tersebut dipanaskan dengan sistem elektris dengan cara melewatkan arus listrik pada grafit. Akibat pemanasan ini, maka zat yang akan dianalisis berubah menjadi atom-atom netral dan pada fraksi atom ini dilewatkan suatu sinar yang berasal dari lampu katoda berongga sehingga terjadilah proses penyerapan energi sinar yang memenuhi kaidah analisis kuantitatif (Rohman, 2007).
c. Monokromator
Monokromator merupakan alat untuk memisahkan dan memilih spektrum sesuai dengan panjang gelombang yang digunakan dalam analisis dari sekian banyak spektrum yang dihasilkan lampu katoda berongga (Rohman, 2007).
d. Detektor
Detektor digunakan untuk mengukur intensitas cahaya yang melalui tempat pengatoman (Rohman, 2007).
e. Amplifier
Amplifier merupakan suatu alat untuk memperkuat signal yang diterima dari detektor sehingga dapat dibaca alat pencatat hasil (Readout) (Rohman, 2007). e. Readout
Readout merupakan suatu alat penunjuk atau dapat juga diartikan sebagai pencatat hasil. Hasil pembacaan dapat berupa angka atau berupa kurva yang menggambarkan absorbansi atau intensitas emisi (Rohman, 2007).
Gambar 1. Komponen Spektrofotometer Serapan Atom
Gangguan-gangguan dapat terjadi pada saat dilakukan analisis dengan alat spektrofotometer serapan atom, gangguan itu antara lain adalah:
a. Gangguan oleh penyerapan non-atomik.
Gangguan jenis ini berarti terjadinya penyerapan cahaya dari sumber sinar yang bukan berasal dari atom-atom yang akan dianalisis. Penyerapan non-atomik dapat disebabkan adanya penyerapan cahaya oleh partikel-partikel pengganggu yang berada di dalam nyala. Cara mengatasi penyerapan non-atomik ini adalah bekerja pada panjang gelombang yang lebih besar (Rohman,2007).
b. Gangguan spektrum.
Gangguan spektrum dalam spektrofotometer serapan atom timbul akibat terjadinya tumpang tindih antara frekuensi-frekuensi garis resonansi unsur yang dianalisis dengan garis-garis yang dipancarkan oleh unsur lain. Hal ini disebabkan karena rendahnya resolusi monokromator (Mulja, 1995).
c. Gangguan kimia yang dapat mempengaruhi jumlah atau banyaknya atom di dalam nyala.
Pembentukkan atom-atom netral dalam keadaan azas di dalam nyala sering terganggu oleh dua peristiwa kimia, yaitu:
• Disosiasi senyawa-senyawa yang tidak sempurna disebabkan terbentuknya senyawa refraktorik (sukar diuraikan dalam api), sehingga akan mengurangi jumlah atom netral yang ada di dalam nyala.
• Ionisasi atom-atom di dalam nyala akibat suhu yang digunakan terlalu tinggi. Prinsip analisis dengan spektrofotometer serapan atom adalah mengukur absorbansi atom-atom netral yang berada dalam keadaan azas. Jika terbentuk ion maka akan mengganggu pengukuran absorbansi atom netral karena spektrum absorbansi atom-atom yang mengalami ionisasi tidak sama dengan spektrum atom dalam keadaan netral.
2.10 Validasi Metode Analisis
Validasi metode analisis adalah suatu tindakan penilaian terhadap parameter tertentu berdasarkan percobaan laboratorium untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya. Beberapa parameter analisis yang harus dipertimbangkan dalam validasi metode analisis adalah sebagai berikut:
a. Kecermatan
Kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan. Kecermatan ditentukan dengan dua cara, yaitu:
• Metode simulasi
Metode simulasi (Spiked-placebo recovery) merupakan metode yang dilakukan dengan cara menambahkan sejumlah analit bahan murni ke dalam suatu bahan pembawa sediaan farmasi (plasebo), lalu campuran tersebut dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan (kadar yang sebenarnya).
• Metode penambahan baku
Metode penambahan baku (standard addition method) merupakan metode yang dilakukan dengan cara menambahkan sejumlah analit dengan konsentrasi tertentu pada sampel yang diperiksa, lalu dianalisis dengan metode yang akan divalidasi. Hasilnya dibandingkan dengan sampel yang dianalisis tanpa penambahan sejumlah analit. Persen perolehan kembali ditentukan dengan
menentukan berapa persen analit yang ditambahkan ke dalam sampel dapat ditemukan kembali (Harmita, 2004).
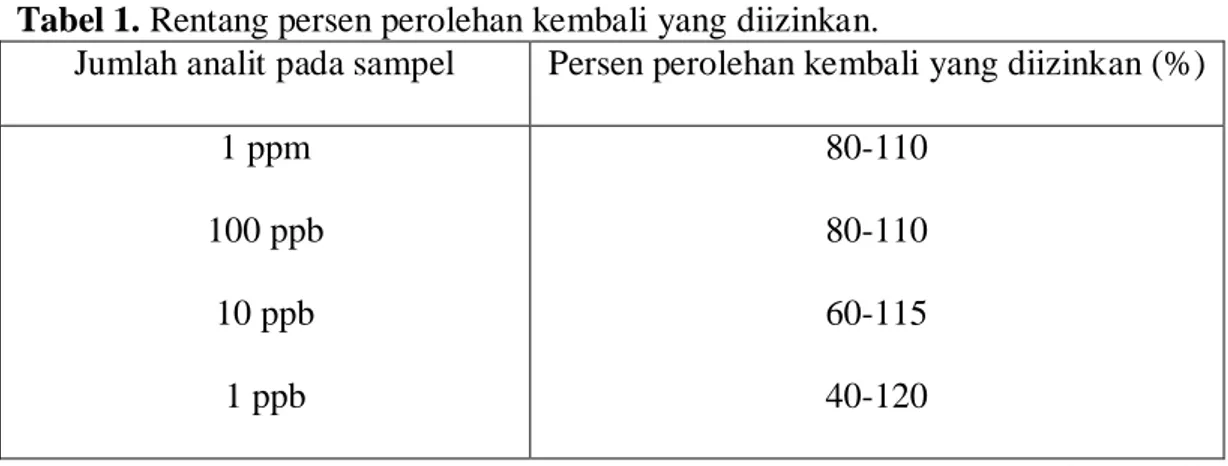
Rentang persen perolehan kembali yang diizinkan pada setiap konsentrasi analit pada matriks dapat dilihat pada tabel 1.
Tabel 1. Rentang persen perolehan kembali yang diizinkan.
Jumlah analit pada sampel Persen perolehan kembali yang diizinkan (%) 1 ppm 100 ppb 10 ppb 1 ppb 80-110 80-110 60-115 40-120 (Harmita, 2004) b. Keseksamaan (presisi)
Keseksamaan atau presisi diukur sebagai simpangan baku relatif atau koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara berulang untuk sampel yang homogen. Nilai simpangan baku relatif yang memenuhi persyaratan menunjukkan adanya keseksamaan metode yang dilakukan (Harmita, 2004).
Dari penelitian yang telah dilakukan, ditemukan bahwa simpangan baku relatif atau RSD meningkat seiring dengan menurunnya kadar analit yang dianalisis. Nilai simpangan baku relatif untuk analit dengan kadar kurang dari 1 ppm yang diizinkan yaitu tidak lebih dari 32% (Garfield, 1991).
c. Selektivitas (Spesifisitas)
Selektivitas atau spesifisitas suatu metode adalah kemampuannya yang hanya mengukur zat tertentu secara cermat dan seksama dengan adanya komponen lain yang ada di dalam sampel (Harmita, 2004).
d. Linearitas dan rentang
Linearitas adalah kemampuan metode analisis yang memberikan respon baik secara langsung maupun dengan bantuan transformasi matematika, menghasilkan suatu hubungan yang proporsional terhadap konsentrasi analit dalam sampel. Rentang merupakan batas terendah dan batas tertinggi analit yang dapat ditetapkan secara cermat, seksama dan dalam linearitas yang dapat diterima (Harmita, 2004).
e. Batas deteksi dan batas kuantitasi
Batas deteksi merupakan jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan, sedangkan batas kuantitasi merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama.