PEMBUATAN BIOETANOL DARI MIKROALGA DENGAN VARIASI
KONSENTRASI ASAM, WAKTU HIDROLISIS, DAN FERMENTASI
Aprila Yoga Erlangga, Cahyo Nugroho, Siti Miskah
Jurusan Teknik Kimia Fakultas Teknik Universitas Sriwijaya Jalan Raya Palembang Prabumulih Km. 32 Inderalaya, Ogan Ilir 30662Abstrak
Mikroalga mempunyai prospek yang sangat baik untuk dikembangkan sebagai salah satu kandidat bahan baku penghasil biofuel karena memiliki kemampuan tumbuh dengan cepat serta tidak bersaing dengan bahan pangan. Mikroalga mengandung karbohidrat, lemak, protein, dan mineral yang dapat dimanfaatkan untuk berbagai kegunaan. Mikroalga hijau seperti Nannochloropsis sp. mempunyai kandungan karbohidrat dalam bentuk selulosa dan hemiselulosa pada dinding selnya sehingga dapat dimanfaatkan dalam pembuatan bioetanol. Penelitian ini bertujuan untuk mempelajari pengaruh konsentrasi asam dan waktu pada proses hidrolisis selulosa yang terdapat pada mikroalga dan pengaruh waktu fermentasi terhadap bioetanol yang dihasilkan dari hasil hidrolisis mikroalga. Proses hidrolisis dilakukan pada 80 ˚C dengan konsentrasi asam sulfat 1-6% (w/v) selama 15-75 menit. Glukosa yang dihasilkan dianalisa dengan metode Luff-Schoorl. Kondisi hidrolisis yang menghasilkan kadar glukosa tertinggi digunakan untuk pembuatan substrat untuk fermentasi. Proses fermentasi dilakukan selama 24-120 jam. Hasil penelitian menunjukkan bahwa kadar glukosa tertinggi sebesar 27,90% didapat pada konsentrasi asam 4% dan waktu 75 menit. Waktu fermentasi selama 72 jam menghasilkan kadar etanol tertinggi sebesar 3,5942% dengan yield 8,9% (gram etanol/gram mikroalga).
Kata kunci: bioetanol;fermentasi; hidrolisis; konsentrasi asam; mikroalga
Microalgae has a good prospect to utilized as a candidate of biofuel feedstock because has a great productivity and not compete with food feedstock. Microalgae contains carbohydrates, fat, protein, and mineral which can be utilized for various purpose. Green microalgae like Nannochloropsis sp. has a carbohydrate content in the cellulose and hemicellulose form in its cell wall which can be utilized for bioethanol production. This research aimed to study the effect of acid concentration and time on hydrolysis of cellulose contained in microalgae and the effect of fermentation time to bioethanol produced from microalgae hydrolysate. Hydrolysis process conducted at 80˚Cwith sulphuric acid concentration 1-6% (w/v) for 15-75
minutes. The glucose produced was analyzed with Luff-Schoorl method. Hydrolysis condition that produces highest glucose yield was used to make a substrate for fermentation. Fermentation process conducted for 24-120 hours. The results showed that highest glucose yield obtained was 27,90% and this was achieved when the hydrolysis occurred at 4% (w/v) sulphuric acid concentration and for 75 minutes. Fermentation time 72 hours yielding highest ethanol concentration with 3,5942% and 8,9% in term of yield (gram ethanol/gram microalgae).
Keywords: bioethanol; fermentation; hydrolysis; acid concentration; microalgae
1. PENDAHULUAN
Energi merupakan kebutuhan primer bagi kehidupan dan persyaratan utama untuk menggerakkan perekonomian masyarakat. Peningkatan populasi penduduk yang pesat mengakibatkan peningkatan kebutuhan terhadap
Pengembangan bioetanol generasi pertama yang menggunakan bahan baku yang mengandung pati seperti ubi kayu, jagung, dan tetes tebu menyebabkan produksi bioetanol bersaing dengan kebutuhan pangan. Pada generasi kedua yang menggunakan bahan baku yang mengandung lignoselulosa seperti jerami, ampas tebu eceng gondok, dan limbah pertanian sulit dalam produksinya karena adanya kandungan lignin sehingga perlu dilakukan pre-treatment dan konversi yang dihasilkan sedikit. Pada generasi ketiga dikembangkan bioetanol menggunakan bahan baku yang berasal dari alga.
Mikroalga mempunyai prospek yang sangat baik untuk dikembangkan sebagai salah satu kandidat bahan baku penghasil biofuel. Hal ini dikarenakan mikroalga mempunyai kandungan yang dapat dimanfaatkan dalam pembuatan biofuel. Beberapa biofuel yang dapat dihasilkan dari mikroalga yaitu, biodiesel, bioetanol, dan biogas. Mikroalga dipilih karena memiliki kemampuan tumbuh dengan cepat serta tidak memerlukan area yang luas untuk kegiatan produksi. Di samping itu mikroalga mempunyai kemampuan menyerap karbondioksida dengan baik.
Nannochloropsis sp merupakan salah satu
spesies mikroalga yang telah dibudidayakan di Indonesia. Nannochloropsis sp mempunyai
kandungan lemak dan karbohidrat yang cukup besar sehingga dapat dimanfaatkan sebagai bahan baku pembuatan biodiesel dan bioetanol. Pemanfaatan mikroalga sebagai bahan baku biodiesel telah cukup banyak diteliti, diantaranya Kwangdinata (2013) yang meneliti pembuatan biodiesel dari Nannochloropsis sp dengan metode ultrasonik. Namun, penelitian tentang pembuatan bioetanol dari mikroalga, khususnya spesies
Nannochloropsis sp belum diteliti. Oleh karena
itu, perlu dilakukan penelitian mengenai pembuatan bioetanol dari mikroalga
Nannochloropsis sp.
1.1. Mikroalga
Mikroalga adalah alga berukuran mikro yang biasa dijumpai di air tawar maupun air laut. Mikroalga merupakan spesies uniseluler yang dapat hidup soliter maupun berkoloni. Berdasarkan spesiesnya, ada berbagai macam bentuk dan ukuran mikroalga. Beberapa contoh spesies mikroalga di antaranya yaitu Spirulina,
Nannochloropsis sp., Botryococcus braunii, Chlorella sp., Dunaliella primolecta, Nitzschia sp., Tetraselmis suecia, dan lain-lain. Sel-sel
mikroalga tumbuh dan berkembang pada media
air, sehingga mempunyai tingkat efisiensi yang lebih tinggi dalam hal penggunaan air, karbondioksida, dan nutrisi lainnya bila dibandingkan dengan tanaman tingkat tinggi (Widjaja, 2009).
Komposisi kimia sel mikroalga berbeda-beda, dipengaruhi oleh banyak faktor seperti jenis spesies dan kondisi kultivasi. Oleh karena itu, terdapat peluang untuk memperoleh mikroalga dengan komposisi kimia tertentu dengan memanipulasi faktor lingkungannya seperti suhu, cahaya, pH, ketersediaan karbondioksida, garam, dan nutrisi lainnya (Basmal, 2008). Beberapa jenis mikroalga juga diketahui mengandung lipid yang dapat diekstraksi dan diproses lebih lanjut untuk menjadi biodiesel. Hasil samping dari proses ekstraksi lipid mikroalga dapat dimanfaatkan sebagai bahan baku biometana, bioetanol dan biohidrogen.
Gambar 1. Nannochloropsis sp
(Sumber: Amini, S., 2010)
Mikroalga merupakan mikroorganisme yang dapat digunakan sebagai bahan baku biofuel. Beberapa biofuel yang dapat dihasilkan dari mikroalga yaitu hidrogen, biodiesel (yang diperoleh melalui proses transesterifikasi), bioetanol (yang diperoleh melalui proses fermentasi), dan biogas (Skill, 2007; Basmal, 2008; Harun et al., 2009). Untuk itu diperlukan pemanfaatan mikroalga secara optimal dengan mengolahnya menjadi bioetanol dan biodiesel. Hal ini bertujuan untuk menghasilkan suatu produk industri melalui sistem produksi bersih (Assadad, L. 2010).
Mikroalga memiliki kandungan selulosa dan hemiselulosa yang tinggi dan tidak mengandung lignin, terutama pada mikroalga hijau (Harun et al, 2009). Beberapa spesies mikroalga hijau diantaranya Chlorella vulgaris,
Ketiadaan lignin dan tingginya kandungan selulosa dan hemiselulosa dalam mikroalga hijau dapat dimanfaatkan untuk menghasilkan monomer gula berupa glukosa melalui proses hidrolisis. Dengan tidak adanya lignin pada mikroalga maka tahap delignifikasi dapat dihilangkan pada proses hidrolisis. Hal ini menjadi sebuah keuntungan dalam proses produksi bioetanol dari mikroalga. Penggunaan mikroalga sebagai bahan baku biofuel mempunyai beberapa keuntungan jika dibandingkan dengan tanaman pangan, di antaranya yaitu pertumbuhan yang cepat, produktivitas tinggi, dapat menggunakan air tawar maupun air laut, tidak berkompetisi dengan bahan pangan, konsumsi air dalam jumlah sedikit serta menggunakan biaya produksi yang relatif rendah (Guerrero, 2010).
Nannochloropsis sp merupakan salah
satu spesies mikroalga yang telah dibudidayakan di Indonesia. Nannochloropsis sp mempunyai
kandungan lemak dan karbohidrat yang cukup besar sehingga dapat dimanfaatkan sebagai bahan baku pembuatan biodiesel dan bioetanol. Selain itu, Nannochloropsis sp. mudah dikultur secara massal, tidak menimbulkan racun atau kerusakan ekosistem di bak pemeliharaan larva, pertumbuhannya relatif cepat dan memiliki kandungan antibiotik (Fulks dan Main, 1991).
Nannochloropsis sp secara komersial dimanfaatkan sebagai bahan makanan, energi biomassa, pupuk pertanian, dan industri farmasi karena mikroalga ini mengandung protein, karbohidrat, lipid dan berbagai macam mineral (Darsi, 2012).
Nannochloropsis sp bersifat kosmopolit
dapat tumbuh pada salinitas 0-35 ppt. Salinitas optimum untuk pertumbuhannya adalah 25-35 ppt, suhu 25-30°C, pH 8-9,5 dan intensitas cahaya 1000― 10000 lux (Isnansetyo dan Kurniastuty, 1995). Berikut klasifikasi dan morfologi mikroalga Nannochloropsis sp:
a. Klasifikasi
Klasifikasi Nannochloropsis sp. menurut Adehog (2001) dan Garofalo (2009) adalah sebagai berikut:
Kingdom : Protista Super Divisi : Eukaryotes Divisi : Chromophyta Kelas : Eustigmatophyceae Ordo : Eustigmatales Familia : Monodopsidaceae Genus : Nannochloropsis Spesies : Nannochloropsis sp
b. Morfologi
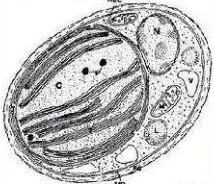
Fitoplankton Nannochloropsis sp. ini berukuran 2–4 m, berwarna hijau, memiliki dinding sel, mitokondria, kloroplas dan nukleus yang dilapisi membran (gambar 2.2). Nannochloropsis sp. termasuk jenis alga yang dapat berfotosintesis karena memiliki klorofil-a, karakteristik organisme ini ialah memiliki dinding sel yang terbuat dari komponen selulosa (Sleigh, 1989 ; Brown et al, 1997).
Gambar 2.2. Morfologi sel Nannochloropsis sp (Adehog, 2001)
1.2. Teknologi Proses Pembuatan Bioetanol Menurut Aiman (2014), berdasarkan bahan baku yang dipakai, bioetanol dikelompokkan menjadi generasi pertama (G1), kedua (G2), ketiga (G3), dan keempat (G4). Bioetanol yang dibuat dari pati serta fermentasi bahan mengandung gula dikategorikan sebagai bioetanol generasi pertama (G1). Bahan baku yang umum dipakai adalah gula tebu, gula bit, molase gula tebu dan bit atau pati dari ubi kayu, jagung, sorgum, gandum ataupun umbi-umbian lainnya. Pembuatan bioetanol generasi pertama pada akhir-akhir ini banyak dikaji kembali karena a) berkompetisi dengan bahan pangan sehingga akan mendorong kenaikan harga komoditi pangan, b) hanya menggunakan pati dan membuang lignoselulosa yang ada dalam bahan baku awal, sehingga limbah berjumlah besar, c) mendorong peningkatan produksi pupuk, yang akhirnya juga akan berujung pada biaya komoditi pangan, d) keterbatasan geografi daerah penghasil.
Bioetanol yang dikelompokkan sebagai G3 adalah yang dibuat dari alga, baik mikro ataupun makroalga, sehingga disebut sebagai etanol alga. Mikroalga dapat hidup di berbagai kondisi seperti air tawar, air asin, baik di daerah tropis maupun di daerah gurun. Alga mengandung minyak (lipid), karbohidrat, protein dengan variasi komposisi sangat luas, tergantung jenis alga dan kondisi hidupnya. Secara garis besar, alga bisa mengandung sampai 50% (dari berat sel kering) karbohidrat, atau 25-77% asam lemak dan sejumlah protein. Memperhatikan kandungan bahan ini serta kemungkinan untuk dibudidayakan maka dalam dua dekade terakhir alga menjadi bahan kajian di banyak laboratorium karena potensinya untuk menjadi bahan baku berbagai bentuk sumber energi seperti biodiesel, bioetanol, biogas, atau hidrogen
Bioetanol G4 atau “Etanol Lanjut” adalah bioetanol yang dihasilkan melalui biomassa yang telah mengalami modifikasi genetika, dimana dalam matriks biomassa terdapat enzim yang akan membantu penghancuran biomassa itu sendiri (autohydrolysis), sehingga akan mempermudah proses pretreatment.
1.3. Hidrolisis
Hidrolisis adalah reaksi kimia yang memecah molekul air (H2O) menjadi kation hidrogen (H+) dan anion hidroksida (OH-) melalui suatu proses kimia. Hidrolisis pati merupakan proses pemecahan molekul amilum menjadi bagian-bagian penyusunnya yang lebih sederhana seperti dekstrin, isomaltosa, maltosa dan glukosa (Rindit et al, 1998). Proses ini biasanya digunakan untuk memecah polimer tertentu, contohnya polimer organik yang memiliki rantai karbon. Untuk menghidrolisis ikatan glikosodik pati dapat dilakukan dengan bantuan katalis asam, katalis enzim maupun perpaduan antara keduanya. Jika pati dipanaskan dengan asam maka molekul-molekulnya akan terurai menjadi gula yang lebih sederhana (glukosa) secara umum reaksi hidrolisa dapat dituliskan sebagai berikut :
(C6H10O5)n + n-1 H2O nC6H12O6
Ada tiga metode hidrolisis yang biasa digunakan, yaitu 1) hidrolisis asam encer (dilute
acid hydrolysis), 2) hidrolisis asam pekat
(concentrated acid hydrolisis) dan 3) hidrolisis enzim (enzyme hydrolysis). Namun dari beberapa penelitian melaporkan bahwa proses hidrolisis secara enzimatis lebih menguntungkan dari pada menggunakan asam. Sebenarnya proses hidrolisis
dapat juga dilakukan tanpa bantuan katalis asam maupun enzimatik. Namun hidrolisis alami ini jarang digunakan karena waktu yang diperlukan untuk hidrolisis terlalu lama.
Hidrolisis asam dilakukan dengan menggunakan asam-asam organik seperti H2SO4, HCl, dan HNO3. Banyaknya pati yang terkonversi menjadi glukosa dipengaruhi oleh konsentrasi asam, waktu konversi, suhu dan tekanan selama reaksi. Pemotongan rantai pati oleh asam lebih tidak teratur dibandingkan dengan hasil pemotongan rantai pati oleh enzim. Hasil pemotongan oleh asam adalah campuran dekstrin, maltosa dan glukosa, sementara enzim bekerja secara spesifik sehingga hasil hidrolisis dapat dikendalikan (Assegaf, 2009).
Selulosa merupakan serat berantai panjang dimana monomernya saling berikatan melalui ikatan β -1,4-glikosida memiliki fleksibilitas yang rendah karena gaya antarmolekul yang kuat. Struktur cincin glukopiranosa juga membuat molekul sulit untuk berputar. Selulosa bisa dipecah menjadi unit-unit glukosa dengan melarutkannya dengan asam.
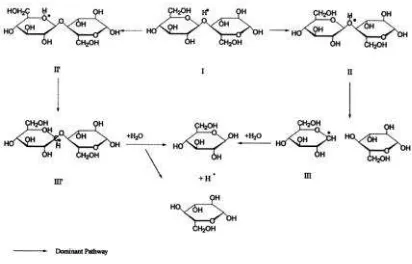
Mekanisme reaksi hidrolisis dengan katalis asam dapat ditunjukkan seperti pada Gambar 4.2.
Gambar 2. Proses Hidrolisis Selulosa dengan Katalis Asam
(Sumber: Xiang, 2003)
konjugasi menjadi ion karbonium siklik yang mengadopsi konformasi setengah kursi yang tidak stabil. Keberadaan air pada sistem akan menyebabkan OH- dari air berikatan dengan ion karbonium sehingga membebaskan gula dan proton. Proton yang terbentuk akan berinteraksi secara cepat dengan ikatan glikosidik oksigen pada dua unit gula yang lain. Proses tersebut terjadi secara kontinyu sampai semua molekul selulosa terhidrolisis menjadi glukosa (Xiang, 2003).
Menurut BeMiller dan Whitstler (2009) hidrolisis asam menghasilkan proses yang lebih murah tapi produk yang dihasilkan tidak sebaik pada hidrolisis enzimatik yang memakan biaya jauh lebih mahal. Namun pada hidrolisis asam, proses hidrolisis dapat berlangsung dalam waktu beberapa menit saja sedangkan proses hidrolisa enzimatik memerlukan waktu beberapa hari.
Penambahan asam dalam proses hidrolisis adalah sebagai katalis untuk mempercepat reaksi pemutusan rantai polisakarida menjadi glukosa karena proses hidrolisis alami menggunakan air berlangsung lambat dan dalam waktu yang sangat lama. Penambahan asam klorida (HCl) dalam proses hidrolisis asam akan mengahasilkan pati dengan struktur yang renggang sehingga saat proses pengeringan air lebih mudah menguap. Hal ini secara tidak langsung dapat meningkatkan konversi etanol yang dihasilkan. Pati dengan struktur yang rapat akan lebih banyak mengikat air. Prinsip dasar hidrolisis adalah untuk memotong ikatan α -1,4-glukosida dan ikatan α -1,6-glukosida dari amilopektin sehingga menghasilkan pati yang ukurannya lebih kecil (glukosa).
Dalam proses hidrolisis, banyak hal-hal yang perlu diperhatikan seperti jenis dan jumlah enzim atau asam yang digunakan, ukuran partikel zat yang akan dihidrolisis, kondisi operasi seperti temperatur, pH, waktu hidrolisis, pengadukan serta perbandingan volume starter untuk hidrolisis terhadap cairan terhadap bahan baku (volume substrat) yang akan dihidrolisis. Kondisi operasi yang tidak sesuai dapat memberikan hasil yang kurang optimal terhadap hasil hidrolisis.
1.4. Fermentasi
Proses fermentasi bertujuan untuk merubah senyawa yang kompleks menjadi sederhana. Pada proses ini glukosa difermentasikan dengan enzim zimase invertase yang dihasilkan oleh Saccharomyces cereviseae. Fungsi enzim zimase adalah untuk memecah
polisakarida (pati) yang masih terdapat dalam proses hidrolisis untuk diubah menjadi monosakarida (glukosa). Sedangkan enzim invertase selanjutnya mengubah monosakarida menjadi alkohol dengan proses fermentasi. Pada awal fermentasi masih diperlukan oksigen untuk pertumbuhan dan perkembangan Saccharomyces
cereviseae, tetapi kemudian tidak dibutuhkan lagi
karena kondisi proses yang diperlukan adalah anaerob (Retno, D. E., 2009). Secara singkat proses fermentasi alkohol (etanol) oleh
Saccharomyces cereviseae dapat ditulis sebagai berikut:
2 (C6H12O5) + H2O 2 C6H12O6
Disakarida Glukosa
C6H12O6 2 C2H5OH + 2 CO2
Glukosa Etanol + Karbon
dioksida
Menurut Winarno dkk, (1984), Proses fermentasi alkoholik dipengaruhi oleh beberapa faktor antara lain :
1) Jenis Bahan atau Substrat
Subtrat merupakan sumber energi bagi mikroba. Substrat inilah yang nantinya akan dipecah menjadi senyawa-senyawa sederhana dalam proses fermentasi.
2) Oksigen
Setiap mikroba membutuhkan jumlah oksigen yang berbeda untuk pertumbuhan atau membentuk sel-sel baru untuk proses fermentasi. Pada umunya proses fermentasi alkoholik berlangsung pada kondisi anaerob atau tanpa oksigen. Namun ada mikroba tertentu yang dapat berkembang dalam kondisi aerob aupun anaerob seperti khamir
Saccaromyces cerevisiae.
3) Waktu Fermentasi
Umumnya waktu yang digunakan untuk proses fermentasi adalah sekitar 1 sampai 6 hari. Tergantung dari jumlah mikroba yang digunakan, kondisi operasi dan konsentrasi substrat. Adanya gangguan pada kondisi operasi seperti pH dan kandungan oksigen dapat menghambat proses fermentasi
4) Konsentrasi Starter
Menurut Susanto dan Saneto (1994), jumlah ragi yang dipakai adalah 0,5% dari volume substrat yang akan difermentasikan. Pemberian ragi tidak boleh terlalu banyak namun juga tidak boleh terlalu sedikit karena bila jumlah ragi yang dipakai terlalu sedikit
Invertase
maka proses fermentasi akan berlangsung lama, sedangkan jika ragi yang dipakai terlalu banyak maka keaktifan khamir akan berkurang karena pada awal proses alkohol yang terbentuk sangat banyak sehingga fermentasinya lebih lama dan banyak glukosa yang belum terkonversi.
5) Temperatur
Umumnya ragi dapat berkembang baik pada suhu ruangan yaitu sekitar 25-30°C dalam proses fermentasi.
6) pH (Keasaman)
Untuk proses fermentasi alkohol ragi, pH optimum adalah 4 – 5. Jika pH terlalu asam atau terlalu basa mikroba yang digunakan tidak dapat tumbuh optimal atau bahkan mati sehingga proses fermentasi terganggu.
1.5. Khamir Saccaromyces cereviseae
Saccharomyces cereviseae merupakan
salah satu galur yang paling sering digunakan dalam proses fermentasi. Khamir ini bersifat fermentatif kuat dan dapat hidup dalam kondisi aerob maupun anaerob (anaerob fakultatif), memiliki sifat yang stabil dan seragam, memiliki pertumbuhan yang cepat dalam proses fermentasi sehingga proses fermentasi dapat berlangsung dengan cepat pula serta mampu memproduksi alkohol dalam jumlah banyak. Saccharomyces sp melakukan fermentasi terhadap gula jauh lebih cepat pada keadaan anaerobik, akan tetapi mengalami pertumbuhan lebih baik pada keadaan aerobik sehingga jumlahnya bertambah banyak.
Berikut taksonomi dari khamir
Saccharomyces cereviseae :
Domain : Eukaryota Kingdom : Fungi Subkingdom : Dikarya Phylum : Ascomycota Subphylum : Saccharomycotina Class : Saccharomycetes Order : Saccharomycetales Family : Saccharomycetaceae Genus : Saccharomyces
Specific descriptor : cerevisiae
Scientific name : Saccharomyces Cereviseae
2. METODOLOGI PENELITIAN
Penelitian ini meliputi pemanfaatan mikroalga untuk pembuatan bioetanol. Variasi yang digunakan dalam penelitian ini yaitu variasi waktu hidrolisis, konsentrasi asam, dan waktu fermentasi, untuk menghasilkan bioetanol yang maksimal.
Bahan yang digunakan adalah biomassa mikroalga Nannochloropsis sp. yang sudah kering, H2SO496%, aquadest, ragi Saccharomyces
cereviseae, dan NaOH 0,5 N. Alat yang
digunakan yaitu gelas ukur, thermometer, autoklaf, pemanas, kertas saring, botol, spatula, neraca analitik, mesin pengaduk, pipet tetes, seperangkat alat distilasi, statif, piknometer, dan pH universal.
Penelitian ini terdiri dari dua tahap. Pada tahap pertama ditinjau kondisi hidrolisis terbaik untuk menghasilkan kadar glukosa tertinggi dan pada tahap kedua ditinjau lama waktu fermentasi untuk menghasilkan yield etanol tertinggi. Pada tahap pertama variabel yang diuji adalah konsentrasi asam (1%, 2%, 3%, 4%, 5%, dan 6%) dan waktu hidrolisis (15 menit, 30 menit, 45 menit, 60 menit, dan 75 menit) dengan parameter yang diamati adalah kadar glukosa. Analisa kadar glukosa dilakukan dengan metode Luff-Schoorl. Kondisi hidrolisis yang menghasilkan kadar glukosa tertinggi pada tahap pertama digunakan untuk pembuatan substrat fermentasi pada tahap kedua. Pada tahap kedua variabel yang diuji adalah waktu fermentasi (24 jam, 48 jam, 72 jam, 96 jam, dan 120 jam) dengan parameter yang diamati adalah yield etanol.
2.1. Hidrolisis
Peralatan untuk melakukan hidrolisis adalah rangkaian refluks yang terdiri dari labu leher tiga, kondensor, heating mantle, magnetic
stirrer, dan statif. Mikroalga sebanyak 20 gram
dimasukkan ke dalam labu leher tiga, kemudian ditambahkan larutan H2SO4 dengan konsentrasi sesuai variabel penelitian (1, 2, 3, 4, 5, dan 6% b/v) dengan rasio 1:10. Larutan sampel dihidrolisis pada temperatur 80 °C dengan waktu sesuai variabel penelitian (15 menit, 30 menit, 45 menit, 60 menit, dan 75 menit). Larutan hasil hidrolisis diambil kurang lebih 10 ml untuk dianalisa kadar gula reduksinya menggunakan metode Luff-Schoorl.
2.2. Penyiapan Starter Fermentasi
ragi roti dimasukkan ke dala selanjutnya diinkubasi pada suhu 30 jam.
2.3. Fermentasi
Kondisi terbaik yang mengh glukosa tertinggi dari tahap hidrolis untuk pembuatan sampel untuk prose Larutan hasil hidrolisis didinginka pH-nya agar mencapai 4-5.
Larutan hasil hidrolisis di dalam erlenmeyer yang sudah menggunakan autoclave. Larutan sta 10% dari volume larutan has dimasukkan ke dalam erlenmeyer hasil hidrolisis. Erlenmeyer ditutu dihubungkan dengan selang.
Fermentasi dilakukan de sesuai dengan variabel penelitian (24 72 jam, 96 jam, dan 120 jam).
2.4. Distilasi
Rangkaian alat distilasi d dinyalakan. Larutan fermentasi did suhu 78°C. Proses distilasi dilakukan jam sampai bioetanol tidak menetes (bioetanol) yang dihasilkan disimp botol yang tertutup rapat. Bioe densitasnya dengan menggunakan pi
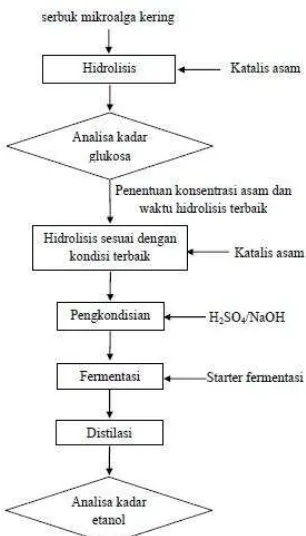
Gambar 3. Diagram prosedur p
alam substrat, er berisi larutan itutup rapat dan
dengan waktu (24 jam, 48 jam,
i disiapkan dan didistilasi pada kan selama 1-1,5 tes lagi. Distilat impan di dalam ioetanol diukur piknometer.
r penelitian
3. HASIL DAN PEMBAHASA
Setelah dilakukan penelitia bioetanol dari biomassa mikroa hasil pengamatan berupa kadar g waktu hidrolis dan waktu ferm kadar danyield etanol.
Data hasil pengamatan diuraikan dibawah ini:
3.1. Pengaruh konsentrasi H kadar glukosa pada be hidrolisis
Gambar 4. Grafik Pengaruh Ko dan Waktu Hidrolisis terhadap K
Berdasarkan Gambar 4 glukosa hasil hidrolisis untuk k 1% sampai 4% meningkat seiring disebabkan karena semakin lama maka semakin banyak juga ran hemiselulosa yang terurai me Peningkatan hasil glukosa dipeng konsentrasi katalis asam, karena d banyaknya ion H+ pada asam da ikatan glikosida yang terdapat sesuai dengan hasil penelitian Osv Kadar glukosa tertinggi yang did konsentrasi asam 4% dan wak menit, yaitu sebesar 27,90%.
Pada konsentrasi 5% glukosa hasil hidrolisis menurun Hal ini disebabkan karena pada k yang lebih tinggi akan menyebabk terbentuk terdegradasi lebih senyawa turunan glukosa dan ju produk samping. Beberapa seny terbentuk selama proses hidrolis adalah furfural, 5-hidroksimetilf asam levulinat, asam asetat, asa uronat, asam 4-hidroksibenzoat, vanillin, fenol, sinamaldehida, fo beberapa senyawa lain. Degra
ASAN
nelitian pembuatan roalga, didapatkan r glukosa terhadap rmentasi terhadap
tan secara lengkap
H2SO4 terhadap
berbagai waktu
Konsentrasi Asam p Kadar Glukosa
4 bahwa kadar konsentrasi asam iring waktu. Hal ini a waktu hidrolisis, antai selulosa dan menjadi glukosa. engaruhi juga oleh a dipengaruhi oleh dapat memutuskan pat pada selulosa Osvaldo dkk, 2012. didapat yaitu pada aktu hidrolisis 75
pembentukan produk samping ini tidak hanya akan mengurangi perolehan gula, tetapi juga dapat menghambat pembentukan etanol pada tahap fermentasi selanjutnya (Taherzadeh & Karimi, 2007).
3.2. Pengaruh waktu fermentasi terhadap kadar yield etanol
Gambar 5. Grafik Pengaruh Waktu Fermentasi terhadap Kadar Etanol
Gambar 5 menunjukan bahwa waktu fermentasi yang terbaik untuk menghasilkan etanol yaitu tiga hari dengan kadar etanol yang dihasilkan yaitu sebesar 3,5942%. Kadar etanol yang dihasilkan meningkat sampai hari ketiga namun menurun pada hari keempat dan kelima. Hal ini disebabkan karena nutrien yang dibutuhkan ragi sudah habis dan etanol yang terbentuk akan dikonversi lebih lanjut menjadi senyawa lain. Sari et al. (2008) menyatakan bahwa waktu fermentasi etanol oleh
Saccharomyces cerevisiae yang terbaik adalah
tiga hari. Setelah tiga hari, kadar etanol akan menurun karena etanol akan dikonversi menjadi senyawa lain seperti ester.
Gambar 6. Grafik Yield etanol
Kadar etanol yang diperoleh pada penelitian ini cenderung rendah karena pembentukan senyawa inhibitor selama proses hidrolisa yang dapat menghambat proses fermentasi sehingga etanol yang dihasilkan kurang maksimal. Yield atau perolehan etanol dari mikroalga Nannochloropsis sp ini ditunjukkan pada Gambar 6. Yield etanol tertinggi yang didapatkan sebesar 8,9% (gram etanol/gram mikroalga).
4. KESIMPULAN
1) Kondisi terbaik untuk menghidrolisis karbohidrat yang terkandung dalam mikroalga menjadi glukosa dengan konsentrsai H2SO4 4% dan waktu hidrolisis 75 menit.
2) Waktu fementasi yang terbaik untuk menghasilkan etanol dari hasil hidrolisis mikroalga adalah 72 jam.
3) Yield etanol yang dapat diperoleh dari
mikroalga 8,9%.
DAFTAR PUSTAKA
Adehog. 2001.
www.thealgasource.net/chromophyta Aiman, S. 2014. Perkembangan Teknologi dan
Tantangan dalam Riset Bioetanol di Indonesia. JKTI Vol. 16 No. 2,
Desember 2014:108-117 ISSN 0853-2788 Amini, S. 2010. Teknik Isolasi Beberapa Jenis
Mikroalga dari Perairan Tawar dan Laut.
Prosiding Seminar Nasional Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan
Assadad, L., et al. 2010. Pemanfaatan Mikroalga
sebagai Bahan Baku Bioetanol.
Squalen Vol. 5 No. 2, Agustus 2010 Azizah, N., et al. 2012. Pengaruh Lama
Fermentasi terhadap Kadar Alkohol, pH, dan Produksi Gas pada Proses Fermentasi Bioetanol dari Whey dengan Substitusi Kulit Nanas. Jurnal Aplikasi Teknologi Pangan Vol. 1 No.2,
2012:72-77
Brown, M.R, et al. 1997. Nutritional Properties Of Microalgae for Marinculture. Aquaculture, 151, hal. 315-331.
Darsi, R., et al. 2012. Karakteristik Kimiawi dan
Potensi Pemanfaatan Dunaliella salina dan Nannochloropsis sp. Fishtech
0 1 2 3 4
0 2 4 6
K
ad
ar
E
tan
ol
(
%
)
Waktu Fermentasi (Hari)
0 2 4 6 8 10
0 2 4 6
Yi
el
d
Et
an
ol
(%
w
/w
)
Universitas Sriwijaya Vol. 1 No. 1 November 2012
Fulks, W and K.L, Main. 1991. Rotifer and
Microalgae Culture System. Proceeding of a
U.S–Asia Workshop. Argent Laboratories. Garofalo, R. 2009. Alga and Aquatic Sustainable
Production of 2nd Generation Biofuels. Aquafuels.
González-Delgado, A. D. dan Kafarov, V. (2011).
Microalgae Based Biorefinery: Issues to Consider. CT&F - Ciencia,
Tecnología y Futuro, 4 (4), 5–22
Harun, R., et al. 2009. Microalgal Biomass as a
Fermentation Feedstock for Bioethanol Production. Journal of Chemical Technology
and Biotechnology 2010; 85:199-203 Harun, R., dan Danquah, M.K. 2010. Influence of
Acid Pretreatment on Microalgal Biomass for Bioethanol Production.
Elsevier Process Biochemistry, 46, pp.306–309.
Isnansetyo, A Dan Kurniastuty. 1995. Teknik Kultur Fitoplankton dan Zooplankton.
Kanisius. Yogyakarta.
Kwangdinata, R. et al. 2013. Produksi Biodiesel
dari Lipid Fitoplankton Nannochloropsis sp melalui Metode Ultrasonik. Marina Chimica Acta Jurusan Kimia FMIPA Universitas Hasanudin Makassar ISSN 1411-2132 Vol. 14 No. 2
Miranda, G., et al. 2014. Hidrolisis Mikroalga
Tetraselmis chuii dengan Variasi Konsentrasi Asam Sulfat Dan Temperatur. Jurnal Online Mahasiswa FTEKNIK Volume 1 No.2 Oktober 2014 Osvaldo, Z. S. et al. 2012. Pengaruh Konsentrasi
Asam dan Waktu pada Proses Hidrolisis dan Fermentasi Pembuatan Bioetanol dari Alang-alang. Jurnal Teknik Kimia No. 2,
Vol 18 April 2012
Putnarubun, C., et al. 2008. Penelitian Pendahuluan Pembuatan Biodisel dan Bioetanol dari Chlorella sp Secara Simultan. J. Sains MIPA, April 2008, Vol.
18, No. 1, Hal: 1–6 ISSN 1978-1873
Retno, D. E., et al. 2009. Bioetanol Fuel Grade
dari Talas (Colocasia Esculenta).
EKUILIBRIUM Vol. 8. No. 1. Januari 2009
Rusyani, E. 2012. Molase sebagai Sumber Mikro
Nutrien pada Budidaya Phytoplankton Nannochloropsis sp, Salah Satu Alternatif Pemanfaatan Hasil Samping Gula. [Tesis].
Program Studi Magister Ilmu Lingkungan Fakultas Pascasarjana Universitas Lampung
Sari, I. M., et al. 2008. Pemanfaatan Jerami Padi
dan Alang-alang dalam Fermentasi Etanol Menggunakan Kapang Trichoderma viride dan Khamir Saccharomyces cerevisiae. Vis Vitalis,
Vol. 01 No. 2 ISSN 1978-9513
Sleigh. M.A. 1989. Protista and Other Protists. Edward Arnold. London.
Taherzadeh, M. J. dan Karimi K. 2007.
Acid-Based Hydrolysis Processes for Ethanol from Lignocellulosic Materials: A Review. BioResources 2(3), 472-499
Xiang, Q., et al. 2003. Heterogenous Aspects of
Acid Hydrolysis of -Cellulose.