LAPORAN
PENELITIAN DOSEN PEMULA UNIVERSITAS LAMPUNG
ANALISIS EKSPRESI GEN PLA2G10 MENCIT JANTAN DENGAN INDEKS ATEROGENIK TINGGI SEBAGAI LANGKAH AWAL PENENTUAN
SIFAT ANTIATEROGENIK GEN PLA2G10
JURUSAN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
2021
33
IDENTITAS DAN URAIAN UMUM
1. Judul Penelitian : Analisis Ekspresi Gen PLA2G10 Mencit Jantan Dengan Indeks Aterogenik Tinggi Sebagai Langkah Awal Penentuan Sifat Antiaterogenik Gen PLA2G10 2. Tim Peneliti
No Nama Jabatan Bidang
Keahlian
Program Studi
Alokasi Waktu (jam/minggu) 1 Dzul Fithria
Mumtazah, S.Pd., M.Sc.
Ketua Fisiologi Hewan
S1 Biologi 12
2 Drs. M. Kanedi., M.Si.
Anggota Zoologi S1 Biologi 10
3 Gina Dania Pratami, S.Si., M.Si.
Anggota Zoologi S1 Biologi 10
3. Objek Penelitian
Sampel sediaan aorta dari mencit jantan sebagai bahan isolasi RNA dan pengukuran ekspresi gen.
4. Masa Pelaksaan
Mulai : bulan April tahun 2021 Berakhir : bulan September tahun 2021 5. Usulan Biaya : Rp.15.000.000,-
6. Lokasi Penelitian : Laboratorium Zoologi FMIPA Unila, Laboratorium Biologi Molekular FMIPA Unila, dan Laboratorium Biologi Molekuler Litbang Harapan Kita Jakarta 7. Instansi lain yang
terlibat
:
8. Kontribusi mendasar pada suatu bidang ilmu:
Penelitian ini menjadi awal penelitian lanjutan yang bertujuan untuk memperjelas peran gen PLA2G10 yang memiliki peran protektif terhadap aterosklerosis sehingga kemudian dapat menjadi target terapi dan pencegahan aterosklerosis penyebab penyakit jantung koroner.
9. Jurnal ilmiah yang menjadi sasaran untuk setiap penerima hibah: Biogenesis Sinta 2
44 RINGKASAN
Analisis Ekspresi Gen PLA2G10 Mencit Jantan Dengan Indeks Aterogenik Tinggi Sebagai Langkah Awal Penentuan Sifat Antiaterogenik Gen PLA2G10
Penelitian ini adalah lanjutan dari penelitian tahun sebelumnya yang menghasilkan sampel yang telah diisolasi. Sampel RNA kemudian akan dianalisis ekspresinya dengan penentuan level ekspresi gen dengan metode ΔΔCT. Penelitian masih berfokus pada topik mengenai aterosklerosis yang menyebabkan penyumbatan pada dinding pembuluh darah dan berakibat pada meningkatnya tingkat mortalitas dan morbiditas penyakit jantung koroner. Salah satu kelompok gen yang berperan dalam progresi aterosklerotik dalam tubuh adalah kelompok gen PLA yang mengode enzim sPLA2, enzim penghidrolisis lipid serta asam lemak dan mengubahnya menjadi tumpukan plak di tunika intima pada pembuluh darah. Plak yang menutup aliran darah menyebabkan penyumbatan dan menghalangi asupan oksigen serta nutrien ke sel-sel jantung. Salah satu gen dalam kelompok gen PLA adalah PLA2G10 yang mengode enzim sPLA2-GX. Berdasarkan hasil penelitian, pembatasan ekspresi gen ini dalam tubuh justru meningkatkan perkembangan aterosklerotik pada hewan coba yang dimodifikasi sampai 50%. Penelitian ini bertujuan untuk mengetahui peran gen PLA2G10 dalam perkembangan progresi aterosklerotik, apakah proaterogenik atau antiaterogenik yang kemudian akan menjadi informasi dasar biomarker (penanda biologis) deteksi dini resiko aterosklerosis penyebab berbagai penyakit kardiovaskuler. Sampel RNA total dikoleksi dari mencit jantan yang sebelumnya telah diberikan diet aterogenik sehingga menderita aterosklerosis. RNA (mRNA) total diisolasi dari darah mencit setelah delapan minggu diberikan diet aterogenik untuk mengukur level ekspresi gen tersebut di dalam sistem. Sampel RNA yang didapat kemudian akan diubah menjadi DNA komplementer (cDNA) melalui metode reverse transcription dan diamplifikasi dengan metode real-time PCR untuk dihitung level ekspresi gennya. Penghitungan level ekspresi gen dilakukan dengan metode ΔΔCT atau metode Livak. Penentuan kecenderungan sifat aterogenik dan antiaterogenik gen PLA2G10 ditentukan dengan membandingkan ekspresi gen PLA2G10 antara mencit normal dan mencit penderita aterosklerosis yang mengonsumsi diet aterogenik. Hasil penelitian dapat dijadikan dasar pengembangan biomarker (penanda biologis) dini aterosklerosis penyebab berbagai penyakit kardiovaskuler. Hasil penelitian akan dipublikasikan di jurnal nasional terindeks SINTA 4, dan juga akan dipresentasikan dalam Seminar Hasil Penelitian yang diselenggarakan oleh LPPM Universitas Lampung.
Kata kunci: antiaterogenik, pla2g10, indeks aterogenik, mencit
BAB 1. PENDAHULUAN
a. Latar Belakang
Aterosklerosis adalah kontributor utama dari peningkatan kasus mortalitas dan morbiditas, dan merupakan manifestasi klinik utama penyebab penyakit jantung koroner, stroke, dan penyakit arteri perifer (Rajamani & Fisher, 2017). Faktor resiko yang menjadi pendukung banyaknya penderita penyakit ini adalah kebiasaan merokok, hipertensi, diabetes, dan diet tidak seimbang yang kaya lemak sehingga menyebabkan kadar lipid darah menjadi abnormal. Selain faktor resiko tersebut, disfungsi endotel adalah salah satu proses awal patogenesis aterosklerosis. Disfungsi endotel ini dapat disebabkan oleh abnormalitas kadar lipid dalam darah karena peningkatan jumlah kolesterol, lipid termodifikasi, dan asam lemak jahat yang kemudian meningkatkan reaksi inflamatoris dalam pembuluh darah.
H a l - h a l t e r s e b u t merupakan salah satu faktor meningkatnya progesi aterosklerotik penyebab munculnya plak ( R o s e n s o n & G e l b , 2 0 0 9 ) . Proses pengubahan substansi lipid dan reaksi inflamatoris tersebut difasilitasi oleh kelompok enzim Secretory Phospolipase A2 (sPLA2). Kelompok enzim ini berperan dalam pembentukan plak di pembuluh darah maupun pencegahannya.
Ait-Oufella et al (2013) menyatakan bahwa ekspresi sPLA2-GX pada sel dari bone marrow membatasi perkembangan aterosklerosis dan mampu mengontrol respon imun dari sel Th1 yang proaterogenik pada hewan coba. Pada mencit transgenik yang sudah dilakukan knocked out pada gen PLA2G10 (PLA2G10-/-) sehingga enzim sPLA2-GX tidak terekspresi, akumulasi kolagen pembentuk plak aterosklerotik justru meningkat, dan ukuran necrotic core pada plak aterosklerotik naik menjadi empat kali lipat dibanding kontrol (PLA2G10+/+). Berdasarkan kejadian tersebut sPLA2-GX kemudian dikaitkan sebagai agen anti aterogenik yang justru menghambat pembentukan plak sampai 50% ( A i t - O u f e l l a e t a l . , 2 0 1 3 ) . Fluktuasi kadar ekspresi gen PLA2G10 dalam darah dapat disebabkan karena gen tersebut bermutasi (Guardiola et al., 2015). H al ini bisa berimbas pada kemampuan protektifnya. Peneliti telah mengisolasi sampel RNA dari mencit jantan untuk dilanjutkan dalam pengujian ekspresi gen PLA2G10. Dalam penelitian penulis sebelumnya, ditemukan tidak adanya mutasi pada gen PLA2G10 dari sampel pasien dengan diagnosis angina pektoris di Jakarta (Mumtazah et al., 2015), yang menyebabkan progresi plak pada sampel belum dapat ditentukan apakah disebabkan karena perubahan konsentrasi enzim sPLA2-GX dalam darah atau disebabkan karena faktor lain. Oleh karena itu penegakan peran PLA2G10 sebagai gen antiaterogenik
6
atau justru lebih aterogenik perlu dilakukan, agar sifat biologi gen PLA2G10 bisa diketahui.
Hal ini dapat menjadi acuan informasi dan pengembangan biomarker mapupun produk mengenai target terapi baru dan pencegahan penyakit kardiovaskuler karena aterosklerosis.
b. Rumusan Masalah
Rumusan masalah dari penelitian ini adalah:
1) Bagaimana level ekspresi gen PLA2G10 pada mencit jantan dengan indeks aterogenik tinggi?
2) Bagaimana kecenderungan status aterogenesitas gen PLA2G10 pada mencit jantan yang diberi diet aterogenik?
c. Tujuan Penelitian
Tujuan penelitian ini dirumuskan sebagai berikut:
1) Mengetahui level ekspresi gen PLA2G10 pada mencit jantan dengan indeks aterogenik tinggi.
3) Mengetahui kecenderungan status aterogenesitas gen PLA2G10 pada mencit jantan yang diberi diet aterogenik
BAB 2. TINJAUAN PUSTAKA
2.1. Analisis Ekspresi Gen
Ekspresi gen merupakan proses dasar biologis yang menjembatani antara gen pengkode sifat dengan produk gen yang fungsional. Untuk menjadi protein fungsional, DNA harus melewati serangkaian proses termasuk transkripsi, mRNA splicing, translasi, dan modifikasi post translasi. Proses ini dapat dipengaruhi dan dimodulasi pada tahapan manapun, sehingga hal tersebut menentukan kuantitas dan kualitas dari fungsi protein yang bekerja dalam tubuh (Volgin, 2013). Mengukur ekspresi gen dapat dilakukan dengan berbagai metode, salah satunya metode Livak dengan real-time PCR yang merupakan metode sensitif untuk mengukur mRNA sebagai manifestasi ekspresi gen. Real-time PCR bekerja dengan mendeteksi dan mengkuantifikasi mRNA gen target yang ditempelkan dengan primer berfluorescens. Sinyal fluoroesens meningkat dengan banyaknya amplikon (produk PCR) yang terdeteksi dalam reaksi. Peningkatan jumlah amplikon yang signifikan pada fase eksponensial berhubungan dengan jumlah inisiasi gen target, sehingga semakin tinggi amplikon gen target yang terdeteksi maka ekspresi gen semakin tinggi. Kuantifikasi ekspresi gen ini dilakukan dengan metode comparative CT (metode Livak), dengan menggunakan rumus matematis untuk menghitungk perbedaan tingkat ekspresi gen target dengan housekeeping gene (Livak & Schmittgen, 2001; Mahboudi et al., 2018).
2.2. Gen PLA2G10
PLA2G10 adalah gen pengkode protein sPLA2-GX, pada tikus berlokasi di kromosom 16 (16p13.1-p12) minus (reverse) strand. Gen ini juga dikenal sebagai sPLA2, GXPLA2, dan GXSPLA2 (NCBI 2010). Pada tikus, gen ini terekspresi pada kolon, testis, ginjal, paru- paru, jaringan otot rangka dan juga hati (Rat Genome Database Website, 2014;
Yu et al.,
2014). Ekspresi gen PLA2G10 terdeteksi pada level tinggi dan moderat pada 57 dari 78 tipe sel yang ada pada jaringan normal. Sebagian besar jaringan yang normal menunjukkan aktivitas sitoplasmik yang positif terhadap ekspresi PLA2G10 pada level sedang sampai kuat. Sedangkan sel-sel penyusun glomerulus ginjal, sel glial, limpoid germinal, pneumeosit, sel stromal pada uterus dan sel telur memiliki ekspresi PLA2G10 pada protein level yang negatif. Pada otot jantung, secara normal enzim ini tidak terekspresi (Yamamoto et al. 2011). Pada manusia, PLA2G10 yang terdiri dari 22120 bp, terekspresi pada level yang rendah, yaitu 11,1% dari rata-rata ekspresi gen keseluruhan pada sampel darah lengkap (whole blood) (NCBI 2010). Seperti yang telah
8
diungkapkan di atas, hasil transkripsi gen ini (mRNA) juga ditemukan pada kelenjar timus, limfa, dan leukosit. Hal tersebut mengindikasikan kemungkinannya berperan dalam imunitas dan reaksi inflamasi (Cupillard et al. 1997).
Ait-Oufella et al (2013) menyatakan bahwa ekspresi sPLA2-GX pada sel dari bone marrow membatasi perkembangan aterosklerosis dan mampu mengontrol respon imun dari sel Th1 yang proaterogenik pada hewan coba. Pada mencit transgenik yang sudah dilakukan knocked out pada gen PLA2G10 (PLA2G10-/-) sehingga enzim sPLA2-GX tidak terekspresi, akumulasi kolagen pembentuk plak aterosklerotik justru meningkat, dan ukuran necrotic core pada plak aterosklerotik naik menjadi empat kali lipat dibanding kontrol (PLA2G10+/+). Berdasarkan kejadian tersebut sPLA2-GX kemudian dikaitkan sebagai agen anti aterogenik yang justru menghambat pembentukan plak sampai 50% (Ait-Oufella et al. 2013). Fluktuasi kadar ekspresi gen PLA2G10 dalam darah dapat disebabkan karena gen tersebut bermutasi (Guardiola et al. 2015), hal ini bisa berimbas pada kemampuan protektifnya.
2.3. Mencit (Mus musculus L.)
Mencit adalah hewan model yang umum digunakan dalam mempelajari penyakit pada manusia karena kesamaannya secara biologis dan dapat menderita penyakit yang sama dengan manusia karena kesamaan genetik. Mencit dapat dimodifikasi secara genetik untuk meniru penyakit manusia dan kondisi lainnya meskipun memiliki perbedaan mendasar karena mengalami proses evolusi terhadap lingkungan yang berbeda (Perlman, 2016). Mencit (Mus musculus L.) merupakan salah satu hewan model yang digunakan dalam penelitian aterosklerosis karena mudah ditemukan, peta genetik yang terstruktur, dan mudah digunakan untuk pengambilan sampel. Berbagai studi menunjukkan mencit dapat mengembangkan lesi aterosklerotik tahap awal, seperti fatty streaks, dan dapat diinduksi dengan diet aterogenik dengan komposisi 1,25%
kolesterol, 0,5% asam kolat dan 15% lemak (Li et al., 2011).
2.4. Indeks Aterogenik
Faktor resiko utama terjadinya aterosklerosis adalah peningkatan konsentrasi kolesterol dalam darah karena diet tinggi lemak maupun kadar lemak yang berlebihan di dalam tubuh.
Kadar high density lipoprotein (HDL) yang tinggi di dalam darah memberikan efek perlindungan dari aterosklerosis sementara low density lipoprotein (LDL) yang tinggi menyebabkan aterosklerosis. Kemampuan lipid plasma untuk berpindah ke lapisan sub intima pada pembuluh darah merupakan langkah penting dalam aterosklerosis. Lipid dan lipoprotein merupakan prediktor penting dalam penyakit jantung koroner, yang ditandai dengan tingginya rasio kolesterol LDL terhadap HDL, dan meningkatnya trigliserida plasma. Saat ini ditemukan bahwa nilai indeks aterogeik yang didapatkan dengan membagi nilai konsentrasi trigliserida dengan konsentrasi HDL dapat menjadi penanda dari resiko aterosklerosis dan penyakit kardiovaskuler, yaitu nilai indeks aterogenik antara 0,1-0,24 menunjukkan resiko aterosklerosis dan penyakit kardiovaskuler yang medium (Wu et al.
2018). Tingginya kadar kolesterol total dan rendahnya HDL menggambarkan tingginya indeks aterogenik (Winarsi et al. 2013). Oleh
karena itu indeks aterogenik (IA) dihitung berdasarkan rumus:
IA : Indeks Aterogenik HDL : High Density Lipoprotein
Selain digunakan sebagai biomarker kuat dalam deteksi penyakit kardiovaskular, indeks aterogenik juga memiliki asosiasi yang kuat dengan obesitas (Bo et al., 2018; Zhu et al., 2018). Indeks aterogenik dapat naik seiring dengan lama perlakuan pemberian diet aterogenik (Murwani et al. 2013); Lailani, Edward, & Herman, 2013). Diet aterogenik dapat diberikan pada tikus putih selama delapan minggu dengan komposisi khusus untuk mengembangkan model hewan aterosklerosis. Diet aterogenik tersusun atas campuran kolesterol, pakan comfeed, asam kolat, minyak babi dan air (Murwani et al. 2013).
2.5. Antiaterogenik
Aterosklerosis adalah suatu kondisi di mana plak terbentuk di dalam dinding arteri.
Aterogenesis atau proses terbentuknya plak aterosklerotik terjadi karena berbagai faktor resiko. Hal ini dapat menurunkan fungsi arteri yang berfungsi membawa darah kaya oksigen ke jantung dan bagian lain dalam tubuh. Plak aterosklerotik tersusun atas lemak, kolesterol, kalsium, sel otot polos, dan substansi lain yang ada di darah. Seiring waktu,
10
plak dapat mengeras dan menyempitkan diameter arteri sehingga proses transfer oksigen dan nutrien terhambat (Rye et al. 2009).
Aterosklerosis dapat dicegah dengan meningkatkan asupan dan ekspresi zat antiaterogenik dalam tubuh. Antiaterogenik adalah suatu sifat benda, obat, bahan alam atau properti lainnya yang dapat melindungi dari aterogenesis atau pembentukan atheroma (plak) di dalam dinding pembuluh darah yang sebagai penyebab utama penyakit jantung koroner. Oleh karena itu, agen antiaterogenik dikaitkan dengan kemampuannya dalam pencegahan dan treatment penyakit kardiovaskuler. Dari berbagai penelitian sebelumnya, dilaporkan banyak hal yang bersifat antiaterogenik seperti resveratrol (RS) yaitu komponen polifenol dalam buah anggur dan turunannya (Ramprasath and Jones 2010). Sifat antiaterogenik juga dimiliki oleh hormon estrogen (Holm et al. 1999), sehingga resiko penyakit kardiovaskuler menjadi lebih tinggi pada wanita setelah menopause.
HDL diketahui memiliki sifat protektif terhadap aterosklerosis sehingga bersifat antiaterogenik (Rye et al. 2009), di samping itu HDL yang diperkaya dengan microRNA- 223 mampu meningkatkan sifat antiaterogeniknya karena microRNA mampu menurunkan inflamasi yang terjadi pada sel endotel dengan secara langsung menarget intercellular adhesion molecule 1 (ICAM1) (Fernández-Hernando 2014). Sifat antitaterogenik juga dimiliki oleh fitosterol (Nashed et al. 2005), jus sayuran yang terdiri dari campuran tomat, parsley, wortel, seledri, bit, bayam, selada dan selada air (El- Shatanovi et al. 2012), buah berry aronia hitam (Aronia melanocarpa) (Daskalova et al.
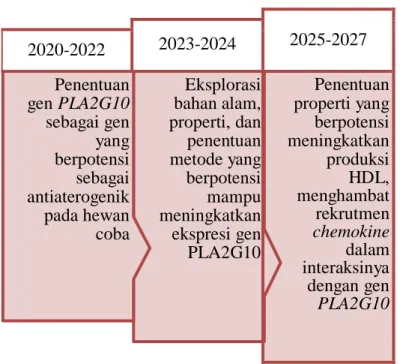
2015), dan juga hormon insulin (Dandona et al. 2008). Hal ini menunjukkan bahwa zat antiaterogenik bisa diperoleh dari dalam dan luar tubuh. PLA2G10 merupakan gen pengode enzim sPLA2-GX pada tubuh mammalia, saat enzim ini tidak terekspresi dalam tubuh, progresi plak aterosklerotik naik sampai 50% pada hewan coba yang gennya dimodifkasi, oleh karena itu enzim ini diprediksi jika ekspresinya di atas level rata-rata dalam sistem, ekspresi gen ini mampu memberikan efek proteksi dari aterosklerosis, dengan kata lain bersifat antiaterogenik. Penelitian ini adalah bagian dari road map penelitian yang ditunjukkan oleh gambar 2.
2025-2027 2023-2024
2020-2022
Penentuan properti yang berpotensi meningkatkan produksi HDL, menghambat rekrutmen chemokine dalam interaksinya dengan gen PLA2G10 Penentuan
gen PLA2G10 sebagai gen yang berpotensi sebagai antiaterogenik pada hewan coba
Eksplorasi bahan alam, properti, dan penentuan metode yang berpotensi mampu meningkatkan ekspresi gen PLA2G10
Gambar 2. Road Map penelitian
12
BAB 3. METODE PENELITIAN
A. Alat dan Bahan 1) Alat
Alat yang digunakan dalam penelitian ini antara lain adalah antara tiga set kandang tikus, tempat pakan dan minum, alat uji kolesterol (Easy Touch), Laminar air flow, micropipette (Eppendorf), pipet tip 200 ul dan 1000 ul, microtube, dan RT-PCR.
2) Bahan
Isolasi RNA Total
Sampel sediaan darah hewan dan arcus aorta tikus dikoleksi untuk kemudian dilakukan proses isolasi RNA dengan menggunakan High Pure RNA Isolation Kit (Roche®).
Analisis Ekspresi Gen PLA2G10
Ekspresi gen PLA2G10 diukur dengan cara mengubah RNA total menjadi cDNA dengan reverse transcription cDNA kit, lalu dilakukan assay dengan RT-PCR dengan High Pure Gene Expression Kit dari Roche®
B. Metode Penelitian
1) Persiapan Sampel. Sampel aorta dari penelitian sebelumnya dilakukan isolasi RNA.
RNA total dari masing-masing sampel kemudian dikelompokkan menjadi kelompok dengan indeks aterogenik rendah dan tinggi untuk dimasukkan ke proses selanjutnya yaitu pengubahan RNA total menjadi cDNA.
2) Isolasi RNA. Sampel sediaan aorta yang sudah dikoleksi kemudian disolasi RNA- n y a dengan menggunakan High Pure RNA Isolation Tissue Kit (Roche®) sesuai dengan protokol dari penyedia kit (Roche®). Hasil RNA yang sudah diisolasi kemudian diuji kualitas dan integrasinya dengan elektroforesis, lalu diuji kuantitasnya dengan nanospektrofotometer.
3 ) E k s p r e s i G e n . R N A t o t a l d a r i l a n g k a h s e b e l u m n y a d i u b a h m e n j a d i c D N A , d a n d i u k u r e k s p r e s i n y a d e n g a n R T P C R d a n m e t o d e Li v a k . Metode penelitian secara lengkap dapat dilihat pada gambar 3.
13
Pengujian KuGambar 3. Alur penelitian
Sampel Organ (telah dipreservasi pada suhu - 20◦C) (Lab. Zoologi Biologi
FMIPA Unila)
Isolasi RNA dari sampel (Lab. Biomolekuler Biologi
FMIPA Unila)
Pengubahan RNA Total ->
cDNA (Lab. Litbang Harkit)
Penghitungan ekspresi gen PLA2G10 dengan RT PCR
(Lab Litbang Harkit)
Penentuan ekspresi gen PLA2G10 berdasar indeks
aterogenik sampel (Lab Zoologi FMIPA unila)
BAB 4. BIAYA DAN JADWAL PENELITIAN
4.1. Anggaran Biaya
No Komponen Biaya
1 Pengadaan alat dan bahan penelitian 7.500.000
2 Biaya perjalanan penelitian 2.500.000
3 Alat tulis kantor/bahan habis pakai 1.250.000
4 Laporan/Diseminasi/Publikasi 3.750.000
Total 15.000.000
a. Alat dan Bahan Penelitian
No Nama bahan Kegunaan Volume Harga Satuan (Rp)
Harga Total (Rp) 1 High Pure RNA
Isolation Kit (Roche)
Isolasi RNA 15 sampel 250.000,- 3.750.000,-
2 cDNA reverse transcription kit
Pembentukan cDNA
15 sampel 250.000,- 3.750.000,-
Sub Total 7.500.000,-
b. Biaya Perjalanan Penelitian
No Nama Kegiatan Biaya
1 Perjalanan membeli alat dan bahan 500.000
2 Perjalanan mempersiapkan sediaan dan penyimpanan sampel 2.000.000 Sub Total 2.500.000
c. Bahan Habis Pakai
No Nama bahan Kegunaan Volume Harga Satuan (Rp)
Harga Total (Rp)
1 ATK Pencatatan
Kemajuan Penelitian
1 paket 150.000 150.000
6 Tip pipet 200 ul (1000 pcs)
Isolasi RNA 1 paket 300.000 300.000
7 Tip pipet 1000 ul (1000 pcs)
Isolasi RNA 1 paket 300.000 300.000
8 Tabung ependorf 1,5 ml (1000 pcs)
Isolasi RNA 1 paket 500.000 500.000
Sub Total 1.250.000,-
d. Laporan/Diseminasi/Publikasi
No Kegiatan Harga (Rp)
1 Cetak, perbanyak, dan penjilidan laporan 500.000
2 Proofreading naskah artikel jurnal 250.000
3 Biaya publikasi jurnal 2.500.000
Sub Total 3.750.000,-
12
4.2. Jadwal Penelitian
Kegiatan Bulan ke-
1 2 3 4 5 6
Persiapan pengadaan sampel
Isolasi RNA
Pengujian kualitas RNA:
1. Spektrofotometri 2. Elektroforesis Pengubahan RNA total menjadi cDNA
Penyusunan Laporan dan Seminar
13
BAB 5. HASIL DAN PEMBAHASAN
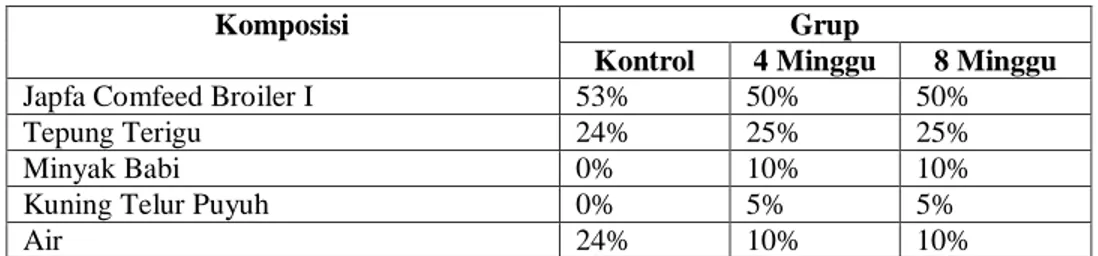
A. Komposisi Diet Tinggi Lemak Termodifikasi
Komposisi Grup
Kontrol 4 Minggu 8 Minggu
Japfa Comfeed Broiler I 53% 50% 50%
Tepung Terigu 24% 25% 25%
Minyak Babi 0% 10% 10%
Kuning Telur Puyuh 0% 5% 5%
Air 24% 10% 10%
B. Data Penambahan Bobot Hewan Objek
Tabel 1. Data penambahan bobot hewan objek
No Kelompok Perlakuan Bobot Hewan Objek (g) Pada Minggu ke- Rerata
1 2 3 4 5 6 7 8
1 Kontrol
Hewan 1 37
39 39 40 40 37 33 38 37,875
Hewan 2 33 31 38 33 30 40 41 33 36
Hewan 3 40 39 41 42 43 41 40 40 40,625
Hewan 4 40 38 39 45 46 45 43 44 42,5
Rerata 33,6 36,75 39,25 40 39,75 40,75 39,25 38,25 37,875 2 Perlakuan 1 (4 Minggu)
Hewan 1 28 33 35 38 - - - - 33,5
Hewan 2 29 36 31 37 - - - - 30,25
Hewan 3 33 33 34 34 - - - - 33,5
Hewan 4 37 37 39 33 - - - - 35,75
Hewan 5 38 38 39 34 - - - - 35,5
Rerata 33 35,4 35,6 35,2 - - - - 33,5
3 Perlakuan 2 (8 Minggu)
Hewan 1 40 32 42 37 39 37 29 42 37,25
Hewan 2 33 33 35 35 35 26 32 35 33
Hewan 3 41 39 42 40 40 42 45 44 41,625
Hewan 4 39 39 41 39 38 39 42 44 40,125
Hewan 5 35 37 37 38 39 40 43 43 39
Rerata
37,6 36 39,4 37,8 38,2 36,8 38,2 40,4 38,2
Bobot hewan diperhitungkan sebagai faktor pendukung tambahan dalam kenaikan kadar kolesterol dan komponennya di dalam darah. Perlakuan yang diberikan berupa pemberian pakan dengan komposisi berbeda sehingga diharapkan menghasilkan hewan dengan derajar perlemakan hati dan hiperkolesterolemia yang berbeda.
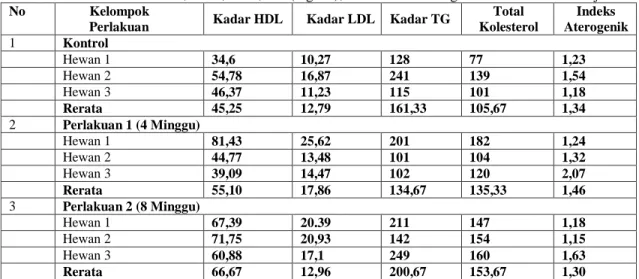
C. Total Kolesterol, HDL, LDL, dan TG Serum Hewan Objek
Tabel 2. Data Total Kolesterol, HDL, LDL, TG (mg/dL), dan Indeks Aterogenik Serum Hewan Objek
No Kelompok
Perlakuan Kadar HDL Kadar LDL Kadar TG Total Kolesterol
Indeks Aterogenik
1 Kontrol
Hewan 1 34,6 10,27 128 77 1,23
Hewan 2 54,78 16,87 241 139 1,54
Hewan 3 46,37 11,23 115 101 1,18
Rerata 45,25 12,79 161,33 105,67 1,34
2 Perlakuan 1 (4 Minggu)
Hewan 1 81,43 25,62 201 182 1,24
Hewan 2 44,77 13,48 101 104 1,32
Hewan 3 39,09 14,47 102 120 2,07
Rerata 55,10 17,86 134,67 135,33 1,46
3 Perlakuan 2 (8 Minggu)
Hewan 1 67,39 20.39 211 147 1,18
Hewan 2 71,75 20,93 142 154 1,15
Hewan 3 60,88 17,1 249 160 1,63
Rerata 66,67 12,96 200,67 153,67 1,30
Kolesterol sebagai bagian dari komposisi makanan kebanyakan dari generasi kita sehari- hari tidak dipungkiri memiliki peran penting dalam metabolisme tubuh. Tidak sepenuhnya buruk, kolesterol menyediakan insulasi yang mendukung kerja dari sel saraf dan banyak fungsi baik lainnya. Jenis kolesterol berbahaya (LDL dan trigliserida) yang konsentrasinya lebih tinggi dibanding kolesterol baik (HDL) di dalam tubuhlah yang menjadi masalah dari tingginya sindrom metabolik dan penyakit turunannya, salah satunya adalah aterosklerosis dewasa ini. Berbagai penelitian mengenai cara mereduksi konsentrasi LDL dan trigliserida di dalam darah telah banyak dilakukan sampai saat ini, salah satunya adalah dengan menggunakan bantuan hewan model yang dimodifikasi sehingga menghasilkan hewan model yang merepresentasikan organisme sakit yang memiliki kadar kolesterol LDL dan trigliserida berlebih sehingga mengembangkan aterosklerosis pada dinding pembuluh darahnya. Data di atas merupakan data kadar kolesterol total, LDL, HDL, dan TG dalam plasma darah hewan uji, dan menunjukkan indeks aterogenik masing-masing kelompok hewan. Pada data tersebut kadar kolesterol total dan trigliserida pada kelompok hewan perlakuan 8 minggu memiliki tingkatan yang paling tinggi. Hal ini bisa disebabkan karena lamanya paparan terhadap diet tinggi lemak dan sangat aterogenik pada pakan.
D. Ekspresi Gen PLA2G10
Sam ple Num ber
CtMean _GAPD
H
CtSD_GAP DH
CtMean_
PLA2G1 0
CtSD_PLA 2G10
DeltaCtMean_
PLA2G10
DeltaCtSE_PL A2G10 1 27,8547
2107 0,15413204
37,76216
888 0,00000000 9,90744781 0,00000000 2 29,1708
6411 0,12562998
37,10407
257 0,35598645 7,93320846 0,31921101 3 28,1112
2704 0,1725467
36,11631 775
0,20470015
7 8,005091667 0,17571341 4 24,8565
4449
0,23919093 6
35,59390 259
0,36207786
2 10,73736095 0,25054121 .*1-2 (plak, indeks aterogenik tinggi); 3-4 (non plak, normal); ekspresi gen pada dua kelompok perlakuan tidak berbeda nyata
Tidak ditemukannya perbedaan ekspresi gen relatif pada kedua kelompok kejadian plak dalam penelitian ini dapat disebabkan karena banyak faktor, antara lain variasi genetik dalam etnis, letak polimorfisme yang berbeda, dan jumlah sampel penelitian. Penggunaan hewan sebagai model pengganti bagi manusia pada penelitian medis dasar tidak bisa dipungkiri memiliki limitasi. Hewan yang sudah dimodifikasi secara genetis atau dengan bahan kimia untuk tujuan mimiking beberapa aspek pada penyakit manusia.
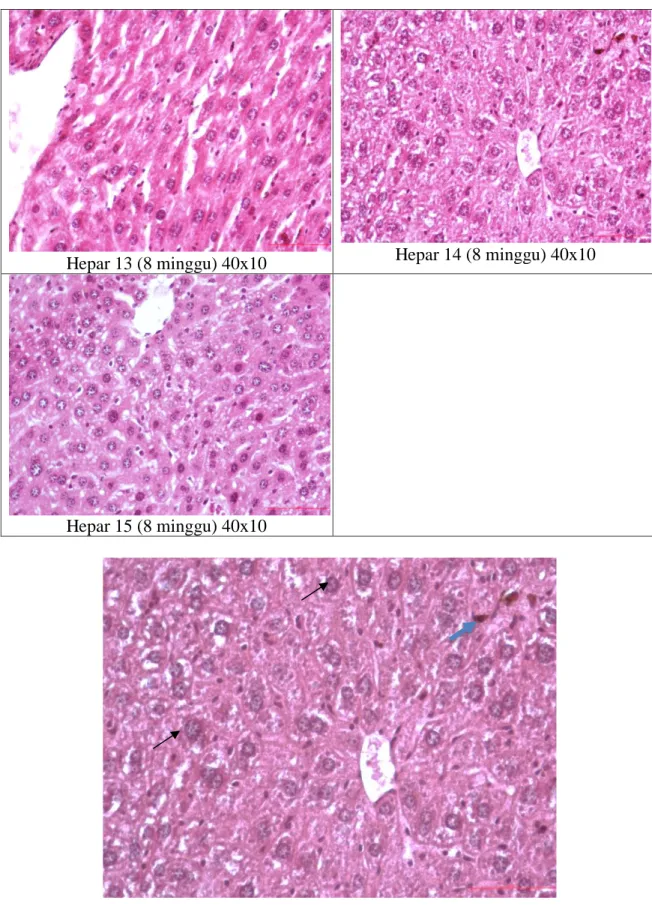
E. Data Tambahan 1: Gambaran Histopatologis Hati Hewan Coba
Hepar 1 (Kontrol) 40x10 Hepar 2 (Kontrol) 40x10
Hepar 3 (Kontrol) 40x10 Hepar 4 (Kontrol) 40x10
Hepar 6 (4 minggu) 40x10 Hepar 7 (4 minggu) 40x10
Hepar 8 (4 minggu) 40x10 Hepar 8.2 (4 minggu) 40x10
Hepar 9.1 (4 minggu) 40x10 Hepar 10 (4 minggu) 40x10
Hepar 11 (8 minggu) 40x10 Hepar 12 (8 minggu) 40x10
Hepar 13 (8 minggu) 40x10 Hepar 14 (8 minggu) 40x10
Hepar 15 (8 minggu) 40x10
Gambar 3. Sayatan melintang Hepar menunjukkan tunika intima dan tunika media, menunjukkan degenerasi hidropik dan nekrosis sel-sel hati
Gambar 3 menunjukkan gambaran histopatologi sel hati dalam tiga kelompok, menunjukkan adanya sel normal dan sel dengan tingkat kerusakan tertentu, yaitu degenerasi parenkim, degenerasi hidropik dan nekrosis. Degenerasi hidropik ditandai dengan pembengkakan sel, bentuk tidak beraturan, dan organel terpisah.
Tabel 3. Kerusakan sel hati pada kelompok kontrol, diet aterogenik 4 minggu dan diet aterogenik 8 minggu
Criteria Mean ± SD
Control 4 Weeks 8 Weeks Total Cells 198,8 ± 26,66 234,64 ± 53,80 314,44 ± 21,30 Normal Cells 18,4 ± 25,28 24,2 ± 15,39 34,88 ± 24,25 Parenchymatous
Degeneration 78,15 ± 22,71 95,6 ± 22,04 78,48 ± 22,37 Hydrophic Degeneration 20,05 ± 9,00 30,32 ± 23,77 90,76 ± 45,57 Necrotic 82,2 ± 12,83 84,52 ± 52,75 110,32 ± 31,25 Total Damage Cells
180,4 ± 36,34a
210,44 ±
59,54b 279,56 ± 12,11b
Hasil uji independent t-test menunjukkan bahwa jumlah sel yang rusak (mengalami degenerasi parenkim, degenerasi hidropik, dan nekrotik) pada kelompok diet aterogenik berbeda nyata dengan kelompok kontrol, dengan persentase kerusakan semua kelompok lebih dari 50%, meskipun perbedaan jumlah sel yang rusak antar kelompok kecil.
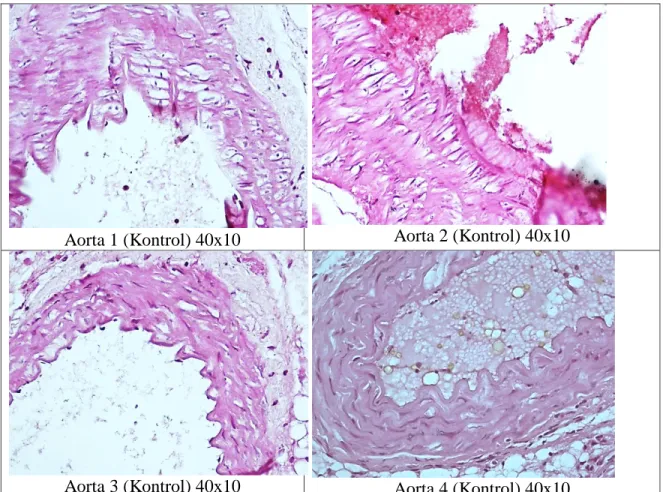
F. Data Tambahan 2 (Derajat Pembentukan Plak Pada Aorta)
Aorta 1 (Kontrol) 40x10 Aorta 2 (Kontrol) 40x10
Aorta 3 (Kontrol) 40x10 Aorta 4 (Kontrol) 40x10
Aorta 6 (4 minggu) 40x10 Aorta 7 (4 minggu) 40x10
Aorta 8 (4 minggu) 40x10
Aorta 9 (4 minggu) 40x10
Aorta 10 (4 minggu) 40x10
Aorta 11 (8 minggu) 40x10 Aorta 12 (8 minggu) 40x10
Aorta 13 (8 minggu) 40x10
Aorta 14 (8 minggu) 40x10
Aorta 15 (8 minggu) 40x10
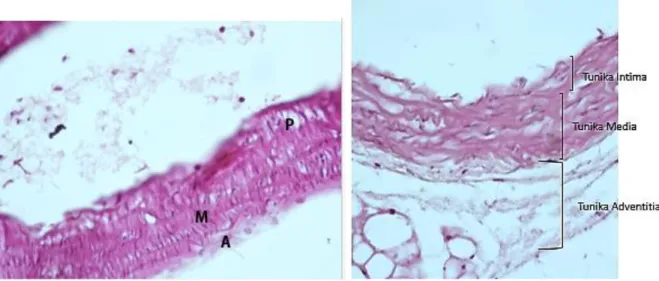
Gambar 4. P = plak, M = tunika media, A = tunika adventitia, pada sebagian besar sampel ditemukan plak di aorta
26 KESIMPULAN
Dari penelitian yang sudah dilaksanakan, sampel persiapan yang dikoleksi untuk penentuan ekspresi gen PLA2G10 pada penelitian ini berhasil dikoleksi untuk pengujian. Kelompok indeks aterogenik normal dan indeks aterogenik tinggi, tidak ada perbedaan signifikan dalam level ekspresi gen PLA2G10 relatifnya. Dalam lingkup ukuran sampel yang digunakan dalam penelitian ini, gen PLA2G10 belum dapat menjadi indikator/marker utama dalam menjadi prediktor tingkat keparahan atherosklerosis suatu organisme maupun kecenderungannya mengalami kejadian atherosklerosis di masa yang akan datang. Komposisi pakan diet aterogenik berupa tepung, comfeed untuk ayam pedaging, air, kuning telur puyuh, dan minyak babi dapat menjadi pakan alternatif untuk menghasilkan hewan model untuk kerusakan hati dan atherosklerosis. Jumlah rata-rata sel yang rusak antara kelompok kontrol dan kelompok diet aterogenik 4 minggu dan 8 minggu berbeda secara signifikan meskipun perbedaannya kecil.
Semua kelompok menunjukkan tingkat kerusakan sel lebih dari 50%, diduga karena peran campuran pati dalam pakan sebagai sumber karbohidrat melalui mekanisme pengubahan jalur karbohidrat menjadi lemak yang merusak sel hati.
REFERENSI
Ait-Oufella, Hafid, Olivier Herbin, Charlotte Lahoute, Christelle Coatrieux, Xavier Loyer, Jeremie Joffre, Ludivine Laurans, Bhama Ramkhelawon, Olivier Blanc-Brude, Sonia Karabina, Christophe A. Girard, Christine Payré, Kei Yamamoto, Christoph J.
Binder, Makoto Murakami, Alain Tedgui, Gérard Lambeau, and Ziad Mallat. 2013.
“Group X Secreted Phospholipase A2 Limits the Development of Atherosclerosis in LDL Receptor-Null Mice.” Arteriosclerosis, Thrombosis, and Vascular Biology 33(3):466–
73.
Bezzine, Sofiane, Rao S. Koduri, Emmanuel Valentin, Makoto Murakami, Ichiro Kudo, Farideh Ghomashchi, Martin Sadilek, Gérard Lambeau, and Michael H. Gelb. 2000.
“Exogenously Added Human Group X Secreted Phospholipase A2 but Not the Group UB, IIA, and V Enzymes Efficiently Release Arachidonic Acid from Adherent Mammalian Cells.” Journal of Biological Chemistry 275(5):3179–91.
Bo, Myat Su, Whye Lian Cheah, Soe Lwin, Tin Moe Nwe, Than Than Win, and Myint Aung.
2018. “Understanding the Relationship between Atherogenic Index of Plasma and Cardiovascular Disease Risk Factors among Staff of an University in Malaysia.”
Journal of Nutrition and Metabolism 2018.
Cupillard, Lionel, Kamen Koumanov, Marie Geneviève Mattéi, Michel Lazdunski, and Gérard Lambeau. 1997. “Cloning, Chromosomal Mapping, and Expression of a Novel Human Secretory Phospholipase A2.” Journal of Biological Chemistry
272(25):15745–
52.
Dandona, Paresh, Ajay Chaudhuri, Husam Ghanim, and Priya Mohanty. 2008. “The Anti- Inflammatory and Antiatherogenic Effects of Insulin.” Pp. 71–79 in Cardiovascular Endocrinology. Humana Press.
Daskalova, Elena, Slavi Delchev, Yulia Peeva, Lyudmila Vladimirova-Kitova, Maria Kratchanova, Christo Kratchanov, and Petko Denev. 2015. “Antiatherogenic and Cardioprotective Effects of Black Chokeberry (Aronia Melanocarpa) Juice in Aging Rats.” Evidence-Based Complementary and Alternative Medicine 2015.
El-Shatanovi, G. A. T. A., I. S. Ashoush, Enaam K. Ahmed, and Soad A. Ali. 2012.
“Antiatherogenic Properties of Vegetable Juice Rich in Antioxidants in Cholesterol- Fed Rats.” Annals of Agricultural Sciences 57(2):167–73.
Escobar, M. and J. L. Hunt. 2017. “A Cost-Effective RNA Extraction Technique from Animal Cells and Tissue Using Silica Columns.” Journal of Biological Methods 4(2).
Fernández-Hernando, Carlos. 2014. “Antiatherogenic Properties of High-Density Lipoprotein-Enriched MicroRNAs.” Arteriosclerosis, Thrombosis, and Vascular Biology 34(6):e13-4.
Guardiola, Montse, Holly J. Exeter, Claire Perret, Lasse Folkersen, Ferdinand Van’T Hooft, Per Eriksson, Anders Franco-Cereceda, Gabrielle Paulsson-Berne, Jutta Palmen, Kawah Li, Jackie A. Cooper, Kay Tee Khaw, Ziad Mallat, Ewa Ninio, Sonia Athina
28
Karabina, Steve E. Humphries, S. Matthijs Boekholdt, Michael V. Holmes, and Philippa J.
Talmud. 2015. “PLA2G10 Gene Variants, SPLA2 Activity, and Coronary Heart DiseaseRisk.” Circulation: Cardiovascular Genetics 8(2):356–62.
Holm, Pernille, Heidi L. Andersen, Malene R. Andersen, Elisabeth Erhardtsen, and Steen Stender. 1999. “The Direct Antiatherogenic Effect of Estrogen Is Present, Absent, or Reversed, Depending on the State of the Arterial Endothelium: A Time Course Study in Cholesterol-Clamped Rabbits.” Circulation 100(16):1727–33.
Karabina, Sonia Athina, Isabelle Brochériou, Gilles Le Naour, Monique Agrapart, Hervé Durand, Michael Gelb, Gérard Lambeau, and Ewa Ninio. 2006. “Atherogenic
Properties of LDL Particles Modified by Human Group X Secreted Phospholipase A2 on Human Endothelial Cell Function.” FASEB Journal 20(14).
Kukurba, Kimberly R. and Stephen B. Montgomery. 2015. “RNA Sequencing and Analysis.”
Cold Spring Harbor Protocols 2015(11):951–69.
Lailani, Mutia, Zulkarnain Edward, and Rahmatina B. Herman. 2013. “Gambaran Tekanan Darah Tikus Wistar Jantan Dan Betina Setelah Pemberian Diet Tinggi Garam.” Jurnal Kesehatan Andalas 2(3):146–50.
McCormick, D. L. 2017. “Preclinical Evaluation of Carcinogenicity Using Standard-Bred and Genetically Engineered Rodent Models.” Pp. 273–92 in A Comprehensive Guide to Toxicology in Nonclinical Drug Development. Elsevier.
Mumtazah, DZUL FITHRIA, Nastiti Wijayanti, and Erlin Listyaningsih. 2015. “Deteksi Polimorfisme Dan Ekspresi Gen PLA2G10 Sebagai Anti Aterogenik Pada
Kejadian Angina Pectoris.” Universitas Gadjah Mada, Yogyakarta.
Murwani, Sri, Mulyohadi Ali, and Ketut Muliartha. 2013. “DIET ATEROGENIK PADA TIKUS PUTIH (Rattus Novergicus Strain Wistar) SEBAGAI MODEL HEWAN ATEROSKLEROSIS.” Jurnal Kedokteran Brawijaya 22(1):6–9.
Nashed, Baher, Behzad Yeganeh, Kent T. HayGlass, and Mohammed H. Moghadasian.
2005. “Antiatherogenic Effects of Dietary Plant Sterols Are Associated with Inhibition of Proinflammatory Cytokine Production in Apo E-KO Mice.” The Journal of Nutrition 135(10):2438–44.
NCBI. 2010. “Homo Sapiens Gene PLA2G10, Encoding Phospholipase A2, Group X.”
Retrieved January 15, 2020
(https://www.ncbi.nlm.nih.gov/IEB/Research/Acembly/av.cgi?exdb=AceView&db=36 a
&term=PLA2G10).
Peirson, S. N. and J. N. Butler. 2007. “RNA Extraction From Mammalian Tissues.” Pp. 315–
27 in Methods in Molecular Biology Vo, 362: Circadian Rhytms: Methods and Protocol, edited by E. Rosato. Totowa, New Jersey: Humana Press.
Ramprasath, V. R. and P. J. H. Jones. 2010. “Anti-Atherogenic Effects of Resveratrol.”
European Journal of Clinical Nutrition 64(7):660–68.
Rat Genome Database Website. 2014. “Expression Data Report for Gene Pla2g10.”
Retrieved February 20, 2020
(https://rgd.mcw.edu/rgdweb/report/gene/expressionData.html?id=61935&fmt=full&lev el=&tissue=).
Rosenson, Robert S. and Michael H. Gelb. 2009. “Secretory Phospholipase A2:
AMultifaceted Family of Proatherogenic Enzymes.” Current Cardiology Reports 11(6):445–51.
Rye, Kerry-Anne, Christina A. Bursill, Gilles Lambert, Fatiha Tabet, and Philip J. Barter.
2009. “The Metabolism and Anti-Atherogenic Properties of HDL.” J. Lipid Res 50:195- 200 doi: 10.1194/jlr.R800034-JLR200.
Tan, Siun Chee and Beow Chin Yiap. 2013. “Erratum: DNA, RNA, and Protein Extraction:
The Past and the Present (BioMed Research International).” BioMed Research International 2013.
Vandenbergh, J. G. 2000. “Use of House Mice in Biomedical Research.” ILAR Journal 41(3):133–35.
Winarsi, Hery, Nurtjahjo Dwi Sasongko, Agus Purwanto, and Indah Nuraeni. 2013. “Ekstrak daun kapulaga menurunkan indeks atherogenik dan kadar gula darah tikus diabetes induksi alloxan (Cardamom Extract Leaves Decreased Atherogenic Indexs and Blood Glucose Level of Diabetic Rats Alloxans-Induced).” Agritech 33(03):273–80.
Wu, Ting Ting, Ying Gao, Ying Ying Zheng, Yi Tong Ma, and Xiang Xie. 2018.
“Atherogenic Index of Plasma (AIP): A Novel Predictive Indicator for the Coronary Artery Disease in Postmenopausal Women.” Lipids in Health and Disease 17(1).
Yamamoto, Kei, Yuki Isogai, Hiroyasu Sato, Yoshitaka Taketomi, and Makoto Murakami.
2011. “Secreted Phospholipase A2, Lipoprotein Hydrolysis, and Atherosclerosis:
Integration with Lipidomics.” Analytical and Bioanalytical Chemistry 400(7):1829–42.
Yu, Ying, James C. Fuscoe, Chen Zhao, Chao Guo, Meiwen Jia, Tao Qing, Desmond I.
Bannon, Lee Lancashire, Wenjun Bao, Tingting Du, Heng Luo, Zhenqiang Su, Wendell D. Jones, Carrie L. Moland, William S. Branham, Feng Qian, Baitang Ning, Yan Li, Huixiao Hong, Lei Guo, Nan Mei, Tieliu Shi, Kevin Y. Wang, Russell D. Wolfinger, Yuri Nikolsky, Stephen J. Walker, Penelope Duerksen-Hughes, Christopher E. Mason, Weida Tong, Jean Thierry-Mieg, Danielle Thierry-Mieg, Leming Shi, and Charles Wang. 2014. “A Rat RNA-Seq Transcriptomic BodyMap across 11 Organs and 4 Developmental Stages.” Nature Communications 5:3230.
Zhu, Xiaowei, Lugang Yu, Hui Zhou, Qinhua Ma, Xiaohua Zhou, Ting Lei, Jiarong Hu, Wenxin Xu, Nengjun Yi, and Shufeng Lei. 2018. “Atherogenic Index of Plasma Is a Novel and Better Biomarker Associated with Obesity: A Population-Based Cross- Sectional Study in China.” Lipids in Health and Disease 17(1):37.
Zulaeha, S., D. Purwoko, I. Cartealy, T. Tajuddin, Karyanti, and H. Khairiyah. 2019.
“Perbandingan TIga Kit Ekstraksi RNA Untuk Analisis Transkriptomika Pada Kelapa Sawit.” Jurnal Bioteknologi & Biosains Indonesia 6(1):118–29.
Livak, K. J., & Schmittgen, T. D. (2001). Analysis of relative gene expression data using real- time quantitative PCR and the 2-ΔΔCT method. Methods, 25(4), 402–408.
https://doi.org/10.1006/meth.2001.1262
Mahboudi, H., Heidari, N. M., Rashidabadi, Z. I., Anbarestani, A. H., Karimi, S., & Darestani,
30
K. D. (2018). Prospect and Competence of Quantitative Methods via Real-time PCR in a Comparative Manner: An Experimental Review of Current Methods. The Open
Bioinformatics Journal, 11(1), 1–11. https://doi.org/10.2174/1875036201811010001
Perlman, R. L. (2016). Mouse Models of Human Disease: An Evolutionary Perspective.
Evolution, Medicine, and Public Health, 2016(1), eow014.
https://doi.org/10.1093/emph/eow014
Rajamani, K., & Fisher, M. (2017). An Overview of Atherosclerosis. In Primer on Cerebrovascular Diseases: Second Edition (pp. 105–108). Elsevier Inc.
https://doi.org/10.1016/B978-0-12-803058-5.00020-5
Volgin, D. V. (2013). Gene Expression: Analysis and Quantitation. In Animal Biotechnology:
Models in Discovery and Translation (pp. 307–325). Elsevier Inc.
https://doi.org/10.1016/B978-0-12-416002-6.00017-1
Lampiran Foto-Foto Kegiatan Penelitian