11 BAB II
TINJAUAN PUSTAKA
2.1. Epidemiologi Ventilator Acquired Pneumonia (VAP)
Ventilator Acquired Pneumonia (VAP) merupakan infeksi nosokomial tersering ke 2 di IPI dengan insidens 11,7 per 1000 perawatan menggunakan ventilator mekanik. Perkiraan prevalens pneumonia nosokomial di IPI bervariasi antara 10-50%. VAP akan meningkatkan angka mortalitas apabila pneumonia yang disebabkan patogen tertentu seperti kuman Multi Drug Resisten (MDR), contoh kuman patogen A. baumanii, Pseudomonas aeruginosa dan MRSA atau pada kasus yang mengalami bakteremia sekunder. Kejadian disfungsi organ multipel atau
Acute Respiratory Distress Syndrome (ARDS) akan memperpanjang lama rawat menggunakan ventilator mekanik. Walaupun prosedur rutin dalam mensterilkan alat-alat sudah sedemikian maju, namun VAP masih merupakan komplikasi yang dapat terjadi pada pasien yang menggunakan ventilator mekanik dengan insidens 8-28%. Risiko terjadinya VAP pada pasien yang menggunakan ventilator mekanik meningkat 3-10 kali lipat dibandingkan pasien tanpa ventilator mekanik dengan angka kematian yang cukup bermakna yaitu berkisar antara 45-50%, bahkan pada keadaan tertentu dapat mencapai 70-76%. Faktor risiko yang berhubungan dengan VAP seperti usia, jenis kelamin, trauma, penyakit paru obstruktif kronik (PPOK) dan lama pemakaian ventilator telah banyak diteliti. (Chastre, 2002; Rello, 2002; Hunter, 2006; Augustyn, 2007; Dey, 2007; Rea-Neto, 2008; Song, 2008; Torres, 2008; Tejerina, 2009; Vincent, 2009; Timsit, 2011; Vardakas, 2012).
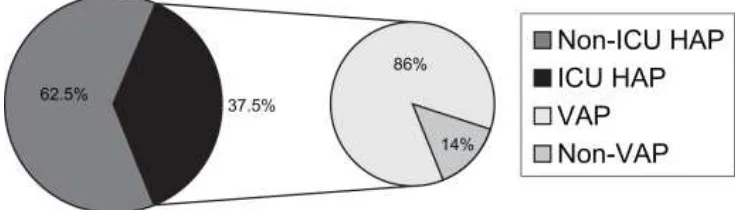
Rotstein dan kawan-kawan, 2008, mengamati insiden HAP dan VAP, dari 37,5% kasus HAP di IPI, maka 86% adalah kejadian VAP.
12
Gambar 2.1. Insidens HAP non IPI, HAP IPI, VAP dan bukan VAP
(Sumber Rotstein, 2008)
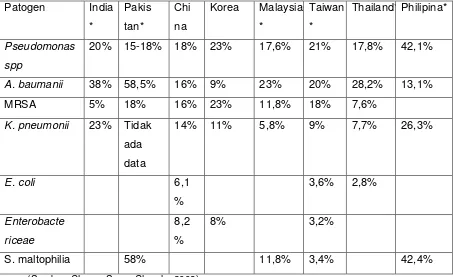
Chawla, Chung, Song dan kawan-kawan, 2008, bergabung melakukan penelitian di 8 negara Asia, Insidens HAP dan VAP tertinggi adalah di India, 53,9-89,5%, dengan angka mortalitas 37-47%, sedangkan yang terendah adalah Taiwan 5,1-8,5% dan korea 6.3% .
Tabel 2.1. Insidens HAP dan VAP di delapan Negara,dikutip Chawla, 2008 India Pakistan* China Korea Malaysia* Taiwan Thailand* Philipines*
IR HAP 53,9% 1 per
Multicenter surveillance study for nosocomial infections in major hospitals in Korea.
2.2. Etiologi dan Patogenesis VAP
13
Sedangkan American College of Chest Physicians mendefinisikan VAP
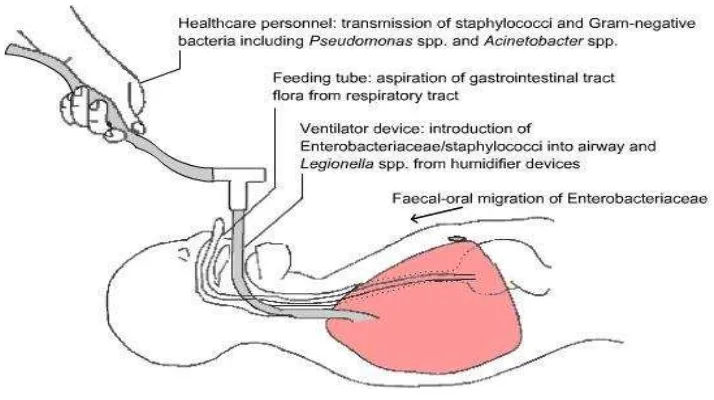
sebagai suatu keadaan dimana terdapat gambaran infiltrat baru dan menetap pada foto toraks disertai hasil biakan sputum. Faktor risiko untuk terjadinya VAP adalah salah satunya penggunaan ventilator mekanik dengan sirkuit, pipa trakea yang terpasang, dan faktor risiko lainnya seperti penyakit paru kronik, umur, keparahan penyakit, operasi abdomen atau dada, trauma kepala atau kesadaran yang menurun, dan penggunaan obat penghambat asam lambung. Aspirasi merupakan inokulasi utama mikro organisma ke dalam saluran napas paling distal. Karena itu sangat diperlukan pengamatan yang cermat perbaikan teknik pengambilan sputum seperti protected brush (PB) atau bilasan bronkoalveolar (bronchoalveolar lavage,BAL) dan perbaikan pemahaman epidemiologi dan pencegahan infeksi nosokomial di ruang rawat IPI (George, 1995; Cassetta,1999; Loanas, 2001; Craven, 2005; Rotstein, 2008 ).
Faktor risiko lainnya juga mempengaruhi, terjadinya kolonisasi patogen pada saluran napas bawah, seperti penurunan kadar albumin, residu makanan yang tidak diabsorbsi (Cook,1998; Wood, 2005; Klompas, 2009). Tabel 2.2. Faktor-faktor risiko berkaitan dengan VAP (dikutip Song,
2008).
14
antibiotik
Pada pipa trakea dijumpai pola kuman patogen dan kuman flora normal dari saluran napas atas, seperti : Candida albicans, gram positif dan gram negatif. Koener,2004 menjelaskan bahwa hasil negatif bisa terjadi karena kolonisasi kuman reaksi lambat pada neonatus, antibiotik alami (innate)
dalam sekret saluran napas atas dan aktivitas antibiotika intrinsik pada sekret saluran napas atas dan bawah. Komponen antimikrobial yaitu IgG 2-4%, secretory IgA 15%, lactoferrin 2-4%, lisozim 30%, dan IgM <1% (Cook,1998; Koener, 2004; Craven, 2005; Diebel, 2006; Hunter, 2006; Elgert, 2009).
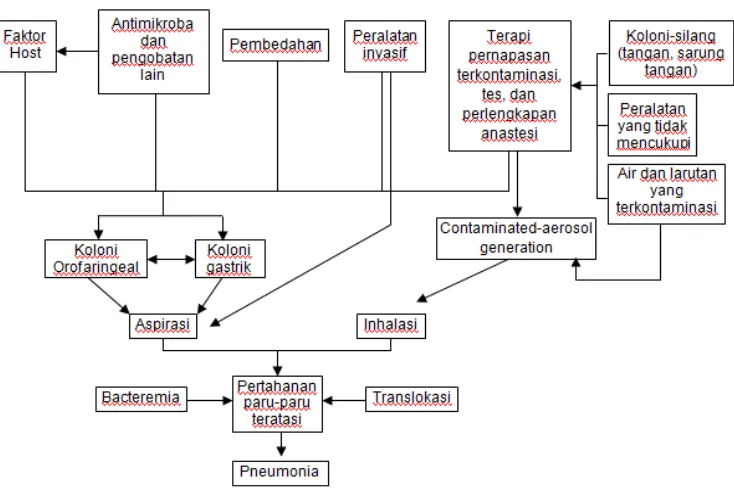
Gambar 2.2. Patogenesis asal kuman patogen VAP (Satcher,1997, ATS, 2005)
15
terjadi setelah 5 hari atau lebih memiliki prognosis yang lebih buruk karena disebabkan oleh patogen MDR seperti MRSA, A.Baumanii, P. Aeroginosa, K. Pneumoniae, E. Coli dengan ESBL(+) (Troullit, 1998; Ruiz, 2000; Erle, 2006; Kollef, 2006; Mai, 2007; Levin, 2008; Cohen, 2008; Chung, 2011; Restrepo, 2013).
16
Gambar 2.4. Skema pasien yang diintubasi pipa selang napas lewat hidung, kolonisasi yang terjadi di trakea, sering karena terkontaminasi oleh sekret di sekitar Subglotis di saat pemasangan pipa selang napas endotrakea. Dikutip Craven,2005.
17
Diagnosis VAP ditentukan berdasarkan 3 komponen klinis tanda infeksi sistemik yaitu demam, takikardi, dan leukositosis disertai gambaran infiltrat baru ataupun perburukan di foto toraks dan penemuan bakteri penyebab infeksi paru. Beberapa penelitian membuktikan bahwa pemeriksaan foto toraks berulang memiliki akurasi diagnostik lebih dari 68% yang umumnya disertai gambaran konsolidasi non homogen (air bronchogram) (Niederman, 2005; Agustyn, 2007; Muller, 2007; Seyman, 2008). Torres, 2009, menyatakan bahwa diagnosis VAP meliputi tanda-tanda infiltrat baru maupun progresif pada foto torak disertai gejala demam, leukositosis maupun leukopeni dan sekret purulen. Gambaran foto toraks disertai dua dari tiga kriteria gejala tersebut memberikan sensitivitas 69% dan spesifisitas 75% (Vidaur, 2005; Sachdev, 2011)
Tabel 2.4. Kriteria Diagnosis yang terbanyak didapatkan pada kejadian
18
Clinical Pulmonary Infection Score (skor CPIS) merupakan parameter untuk mengukur atau menilai kondisi klinis pasien, yang dinilai dari suhu tubuh, foto toraks, jumlah leukosit, kebutuhan oksigen, perubahan bentuk dahak dan hasil biakkan sputum atau cairan BAL, yang menunjukkan terjadinya infeksi di paru. Rentang nilai dari 0-10, bila nilai >6, maka dinyatakan ada pneumonia (Pugin,1991; Fartoukh,2003; ATS,2005; Tejerina, 2009; Huang,2010; Harde,2013).
Shan 2011, menyatakan bahwa skor CPIS merupakan sistem multifaktor dalam menegakkan VAP. Metode ini berdasarkan pemeriksaan klinis, radiologik, dan fisiologik. Ada dua cara penilaian, yaitu pertama adalah
CPIS klasik dengan disertai pemeriksaan biakkan sputum. Sedangkan modifikasi tanpa disertai biakkan sputum. Keuntungan dari CPIS klasik, dengan adanya biakkan sputum memberikan manfaat, sehingga dapat dihindari pemberian antibiotik yang tidak perlu (Park, 2012). Untuk jenis modifikasi CPIS maka komponen yang diperiksa adalah suhu tubuh, leukosit darah, sekret trakea, oksigenisasi dan foto toraks. Begitu juga Harde, 2013 dari hasil pengamatannya skor CPIS sangat baik dipakai untuk evaluasi pengobatan. Sedangkan Lodha 2011, mengatakan skor
CPIS mempermudah menegakkan diagnosis VAP. Skor CPIS
berkembang, berhubung biakkan patogen membutuhkan waktu dan teknik yang benar untuk pengambilan bahan sputum, sehingga skor CPIS
dimodifikasi. Bila skor CPIS >6, maka dilakukan tindakan BAL untuk membuat biakan patogen (Tan, 2007).
Kriteria diagnosis n (%)
Leukositosis 26 (68.4%)
demam 24 (63.1%)
Sekret dahak trakea purulen dan kental 22 (57.8%) Berkurangnya paling sedikit 10% rasio PaO2/FiO2 16 (42.1%) Auskultasi : Suara pernapasan melemah, ronkhi 9 (23.6%) Leukopenia dan Uji biakkan darah positif 4 (10.5%)
19
Tingginya morbiditas dan mortalitas VAP membutuhkan terapi antibiotik yang tepat dan cepat sehingga terapi empiris harus segera diberikan. Dibutuhkan informasi kuman patogen penyebab VAP dan resistensinya seakurat mungkin agar pengobatan pemberian antibiotika tidak sia-sia, sehingga dibutuhkan teknik pengambilan sampel yang tepat. Pengambilan sampel dapat dilakukan dengan metode non-invasif dan invasif. Metode non-invasif yang paling sering dilakukan adalah aspirasi endotrakeal sedangkan invasif adalah protected specimen brush
(PSB) dan bronchoalveolar lavage (BAL). Standar diagnostik VAP adalah dengan cara biakkan kuantitatif dari cairan BAL. Shan, 2011 hasil penelitian meta analisis bahwa skor CPIS sensitivitas 93% dan Sekret Trakea tidak ada atau sedikit
ada, tidak purulent purulent 0 1 2 Oksigenasi PaO2/FiO2 < 240, ARDS
240 dan tidak ada ARDS
0 2 Foto toraks tidak ada infiltrat
infiltrat difus infiltrat terlokalisir
20
menjumlahkan nilai skor CPIS > 6 dan biakkan patogen kuantitatif BAL
(Vidaur, 2005; Luna, 2006; Gorman, 2009; Vincent, 2010).
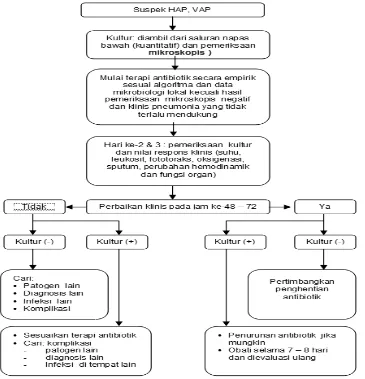
Penatalaksanaan dugaan adanya HAP, VAP dan HCAP, seperti alur penanganan di bawah ini:
Gambar 2.6. Kesimpulan dari penanganan pasien yang diduga HAP, VAP,atau
21
Gambar 2.7. Strategi yang mudah untuk memulai penatalaksanaan dugaan adanya VAP. Dikutip dari Hunter 2006
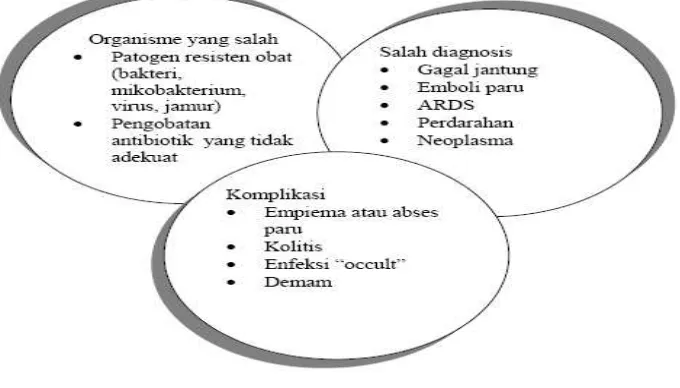
Faktor yang dapat menyebabkan kegagalan respon klinis terhadap pemberian antibiotik awal secara empiris adalah salah diagnosis, kuman yang tidak tepat, komplikasi yang terjadi, serta kejadian ARDS, sehingga dibutuhkan kecermatan, evaluasi perjalanan penyakit, dan teknik yang benar dan tepat untuk pembiakkan patogen (Milbrandt,2005; Klompas,2008; Wunderink,2008).
Dugaan klinis VAP
Infiltrasi pada radiografi dada + satu atau lebih dari hal berikut
Sekresi trakea purulen
Demam
Leukositosis
Pengambilan sekresi pernapasan segera untuk kultur kuantitatif (baik sampel bronkoskopi atau aspirasi trakea)
Mulai antibiotik spektrum luas empiris dipandu oleh ahli mikrobiologi
VAP dikonfirmasi dengan kemungkinan besar secara klinis atau mikrobiologis
Ya Tidak
Evaluasi kembali pada 48-72 jam
Lanjutkan antibiotik selama 8 hari Spektrum sempit tergantung pada data mikrobiologi
22
23
2.6. Rekomendasi IDSA / ATS Untuk Terapi Preventif VAP
Tabel 2.6. Terapi empiris antibiotik untuk HAP dan VAP pada pasien yang mempunyai faktor risiko terhadap patogen yang sudah resisten, VAP awitan dini dan keparahan penyakit lainnya, dikutip dari ATS,2005
Patogen potensial Antibiotik yang direkomendasi
Streptococcus pneumoniae Ceftriaxone
Haemophilus influenzae Atau
Methicillin-sensitive
Staphylococcus aureus
Levofloxacin, moxifloxacin, atau ciprofloxacin
Antibiotic-sensitive enteric gram-negative bacilli Atau
Escherichia coli Ampicillin/sulbactam
Klebsiella pneumoniae Atau
Enterobacter species Ertapenem
Proteus species
Serratia marcescens
Terapi empiris atau terapi preventif harus segera diberikan, setelah biakan patogen diambil untuk mikrobiologi. Pemberian Antibiotika spektrum luas dan disesuaikan dengan pola patogen setempat. Selanjutnya akan dilakukan evaluasi pengobatan, skor CPIS dan gejala klinis lainnya (Rello,1997-1999; Singh, 2000; Dennesen, 2001; Delevaux, 2003; Fagon, 2003-2007; Torres, 2009; Ferrer, 2010; File, 2010; Takesue, 2010).
24
Antibiotik Dosis
Antipseudomonal cephalosporin
Cefepime 1–2 g every 8–12 h
Ceftazidime 2 g every 8 h
Carbepenems
Imipenem 500 mg every 6 h or 1 g every 8 h
Meropenem 1 g every 8 h
ß-Lactam/ß-lactamase inhibitor
Piperacillin–tazobactam 4.5 g every 6 h Aminoglycosides
Gentamicin 7 mg/kg per d
Tobramycin 7 mg/kg per d
Amikacin 20 mg/kg per d
Antipseudomonal quinolones
Levofloxacin 750 mg every d
Ciprofloxacin 400 mg every 8 h
Vancomycin 15 mg/kg every 12 h
Linezolid 600 mg every 12 h
2.6. Pencegahan VAP
25
yakni strategi farmakologik yang bertujuan untuk menurunkan pertumbuhan patogen pada saluran napas bawah dan strategi nonfarmakologik yang bertujuan untuk menurunkan kejadian aspirasi dan patofisiologik inokulasi patogen lainnya (Koenig, 2006; Luna, 2006; McGowan, 2006; Mara, 2009; Nicasio, 2010).
Tabel 2.8. Intervensi Pencegahan VAP, dikutip dari Mara,2009
A. Intervensi dengan tujuan mencegah pertumbuhan saluran cerna
1. Mencegah penggunaan antibiotik yang tidak perlu
2. Membatasi profilaksis tukak lambung pada penderita risiko tinggi
3. Menggunakan sukralfat sebagai profilaksis tukak lambung
4. Menggunakan antibiotik untuk dekontaminasi saluran cerna secara selektif
5. Dekontaminasi dan menjaga kebersihan mulut
6. Menggunakan antibiotik yang sesuai pada penderita risiko tinggi
7. Selalu mencuci tangan sebelum kontak dengan penderita
8. Mengisolasi penderita risiko tinggi dengan kasus MDR B. Intervensi dengan tujuan utama mencegah aspirasi
1. Menghentikan penggunaan pipa nasogastrik atau pipa endotrakeal segera mungkin
2. Posisi penderita semirecumbent atau ½ duduk
3. Menghindari distensi lambung berlebihan
4. Intubasi oral atau nonnasal
5. Pengaliran subglotik
6. Pengaliran sirkuit ventilator
7. Menghindari reintubasi dan pemindahan penderita jika tidak diperlukan
8. Ventilasi masker noninvasif untuk mencegah intubasi trakea
9. Menghindari penggunaan sedasi jika tidak diperlukan
26
subglottic suctioning, intubasi non-nasal, menghindari manipulasi yang tidak perlu pada sirkuit ventilator, pemakaian heat and moisture exchangers, posisi setengah duduk, menghindari lambung penuh, pencegahan terbentuknya biofilm, dan mencuci tangan dan pemakaian desinfektan sebelum dan sesudah kontak dengan pasien (Satcher,1997; Aguald-Ohman, 2007; Mara, 2009; Torres, 2009). Ntoumenopoulos, 2002 melakukan pencegahan tambahan non-farmakologi chest physiotherapy,
fisioterapi dada dengan vibrasi dan ekspektorasi, bermakna dalam mengurangi insiden VAP.
Sedangkan pencegahan VAP secara non-farmakologik lainnya meliputi menekan pertumbuhan traktus orodigestif, pencegahan pembentukan biofilm kuman, dan menghindari penggunaan profilaksis stress ulcer
yang berlebihan. Meskipun pencegahan VAP secara non farmakologik sudah menjadi prosedur baku di ICU namun angka kejadian VAP masih cukup tinggi, sehingga masih perlu ditambahkan pencegahan VAP secara farmakologi (Kremer, 2004; Munro, 2004; Koenig, 2006; Augustyn, 2007; Mietto, 2013, Safdar, 2005).
Diagnosis banding gambaran konsolidasi, infiltrat paru pasien di IPI 1. Pneumonia
2. Hemoragik alveol 3. Aspirasi
4. Atelektasis
5. Edema paru Kardiogenik dan non-kardiogenik 6. Efusi Pleura
2.7 Sistem Imunitas Mukosa
27
jumlah yang lebih besar dibandingkan sistem imunitas sistemik. Antigen tersebut sedapat mungkin dicegah agar tidak menempel pada mukosa dengan pengikatan oleh s-IgA, barier fisik dan kimiawi dengan enzim-enzim mukosa. Antigen yang telah menembus mukosa juga dieliminasi dan reaksi imun yang terjadi diatur oleh sel-sel regulator. Hal ini untuk mencegah terjadinya respons imun yang berlebihan yang akhirnya merugikan oleh karena adanya pajanan antigen yang sangat banyak. Sedangkan sistem imunitas sistemik bersifat memicu respons imun oleh karena adanya paparan antigen. Sistem imunitas mukosa menggunakan beberapa mekanisme untuk melindungi pejamu dari respons imunitas yang berlebihan. Semua mekanisme ini ditujukan untuk menekan respon imunitas (Lusuardi, 2002; Mayer, 2003; Mestecky, 2005; Elgert, 2009).
Gambar 2.9. Sistem Imunitas Mukosa,dikutip dari Mayer, 2003
28
selain melindungi permukaan mukosa juga melindungi bagian dalam badan dari masuknya antigen lingkungan. Sistem imun lokal ini merupakan 80% dari semua imunosit tubuh pada orang sehat. Sel-sel ini terakumulasi di dalam atau berpindah antara berbagai Mucosa-Assosiated Lymphoid Tisssue (MALT), bersama-sama membentuk sistem organ limfoid terbesar (Befus, 1999; Bals, 2004; Martin, 2005; Gottesman, 2009).
Sistem imunitas mukosa mempunyai tiga fungsi utama yaitu;
1. Melindungi membran mukosa dari invasi dan kolonisasi patogen berbahaya yang mungkin menembus masuk.
2. Melindungi pengambilan (uptake) antigen-antigen terdegradasi meliputi protein asing dari makanan yang tercerna, material di udara yang terhirup dan patogen komensal.
3. Melindungi berkembangnya respon imun yang berpotensi merugikan terhadap antigen-antigen tersebut bila antigen tersebut mencapai masuk ke dalam tubuh. Sehingga disini MALT menyeleksi mekanisme efektor yang sesuai dan mengatur intensitasnya untuk menghindari kerusakan jaringan dan proses imun berlebih.
29
dengan limited resevoire diversity (sel T δ dan sel NKT). Respons imun mukosa dipengaruhi oleh alamiah antigen, tipe APC yang terlibat dan lingkungan mikro lokal. Kebanyakan adalah antigen non-patogen, jalur normal untuk sel dendritik mukosa dan APC lain terlihat melibatkan sel T helper 2 dan respons berbagai sel T regulator, biasanya hasilnya adalah supresi aktif imunitas sistemik. Antigen dan adjuvant, meliputi kebanyakan patogen, mempunyai motif disensitisasi oleh APC mukosa sebagai pertanda bahaya seperti ligan toll-like reseptor (TLR) disatu sisi dan kondisi proinflamasi pada umumnya, menghasilkan respons imun yang lebih kuat dan luas, baik sekresi hormonal maupun sisi efektor imunitas seluler dan tidak menghasilkan toleransi oral. Ini diasumsikan bahwa pengenalan patogen oleh TLR APC mukosa membedakan dari respon pada flora komensal. Tetapi terakhir ditemukan bahwa pada kondisi normal, patogen komensal dapat dikenali oleh TLR, interaksi ini tampaknya sesuatu yang penting untuk menjaga homeostasis epitel mukosa (Mayer, 2003; Bals, 2004; Martin, 2005; Mestecky, 2005; Muooz, 2005; Gottesman, 2009).
Gambar 2.10. Respon Imunitas Mukosa, dikutip dari Mayer, 2003
30
dan reseptor jaringan spesifik komplemen (adressin) pada sel endotel kapiler. Pada penelitian terbaru mengindikasikan bahwa sel dendritik mukosa dapat mempengaruhi properti homing . Meningkatkan ekspresi reseptor homing mukosa α4 7 dan reseptor CCR9, suatu reseptor untuk
gut-assosiated chemokine sel T memori dan sel T CD8+ memori, untuk
homing di epitel intestinal. Juga, sel dendritik imprinting of gut homing specifity, terlihat terdiri dari retinoid acid yang diproduksi oleh sel dendritik intestinal tetapi tidak oleh sel dendritik limfoid lain. Ini mungkin bisa menjelaskan dugaan sistem imun mukosa umum dimana imunosit teraktivasi pada suatu tempat menyebarkan imunitas ke jaringan mukosa lain. Pada saat yang sama, oleh karena kemokin, integrin dan sitokin terekspresi berbeda di antara jaringan mukosa, fakta tersebut juga bisa menerangkan sebagian, mengapa didalam sistem imun mukosa, ada hubungan kompartemenisasi khas dengan tempat mukosa terinduksi, contohnya usus dengan glandula payudara, hidung dengan saluran napas dan genital (Mayer, 2003; Lamm, 2006; Ballow, 2007).
Adanya keterkaitan ini menjadi pertimbangan untuk diberikannya imunisasi mukosa dengan adanya efek yang diharapkan. Imunisasi oral akan menginduksi antibodi di usus halus (paling kuat di proksimal), kolon asenden, kelenjar payudara dan kelenjar air ludah, tetapi tidak efektif menginduksi antibodi di segmen bawah usus besar, tonsil dan genital perempuan. Sebaliknya imunisasi di rectal , akan menghasilkan respon antibodi yang kuat di rektum tetapi tidak di usus halus dan colon proksimal. Imunisasi dalam rongga hidung dan tonsil akan memberikan respon antibodi di mukosa saluran napas bawah dan regio sekresi (saliva
dan nasal) tanpa respon imun di usus, tetapi juga terjadi respon imun di mukosa vagina seperti yang terlihat pada usaha imunisasi HIV. Pada tikus ditemukan bahwa suntikan transkutan bisa menimbulkan efek imunitas di mukosa vagina (Mayer, 2003; Bals, 004; Martin, 2005; Mestecky, 2005; Muooz, 2005; Gottesman, 2009).
31
32
Sistem imun mukosa telah mengembangkan berbagai cara untuk menjaga toleransi terhadap antigen yaitu antigen lingkungan pada mikroflora, antigen makanan dan antigen material udara terhirup. Tolerasi tersebut melalui mekanisme aktivasi sel penginduksi kematian (induce-cell death), anergi dan yang paling penting induksi sel T regulatori. Anergi terhadap sel T antigen spesifik terjadi bila inhalasi atau menelan sejumlah besar protein terlarut, dan penghilangan (deleting) sel T spesifik terjadi setelah pemberian antigen dosis nonfisiologis, secara masif. Mayer, 2003 pada percobaan tikus sudah diketahui ada 4 sel T regulator, yaitu;
1. Antigen-induced CD4+ T helper 2 like cells yang memproduksi IL-4 dan IL-10, dan antagonis sel efektor T helper 1,
2. Sel CD4+CD45RBlow yang memproduksi IL-10,
3. Sel CD4+ dan CD8+ yang memproduksi TGF- (T helper 3),
4. Sel Treg (CD4+CD25+) yang mensupresi proliferasi melalui suatu sel contact-dependent mechanism.
Gambar 2.12. Mekanisme Regulator pada Imunitas Mukosa, dikutip dari Mayer, 2003.
Meskipun in vitro, sel yang terakhir dapat dikembangkan menjadi suatu bentuk sel antigen spesifik in vivo setelah imunisasi. Sel ini bisa juga mengubah aktivitas supresor pada sel CD4+ lain dengan cara menginduksi ekspresi dari transkripsi faktor Foxp3 dan atau ikatan MHC Gambar 2.11. Interaksi sel-sel imunitas IgA, adanya antigen yang melekat pada T helper
33
klas II dengan molekul LAG-3 pada sel seperti infectious tolerance.
Mereka juga mempunyai hubungan langsung antara sel T inhibitor oleh Sel Treg , T helper 3, sel Tr 1. Selanjutnya natural human CD4+CD25+ Treg mengekspresikan integrin α4 7 mukosa, ketika bersama sel T CD4+ konvensional menginduksi sel T sekresi Tr 1 like IL 10 dengan aktifitas supresor kuat terhadap sel T efektor, dimana α4 1 Treg –positif lain memperlihatkan cara yang sama dengan cara menginduksi Thelper 3-like TGF-β-secreting supressor T cells. Data dari studi terakhir mengindikasikan bahwa kesemua sel regulator yang berbeda tipenya dan mekanismenya dapat diinduksi atau ditambah (expand) oleh adanya antigen mukosa mengawali terjadinya toleransi perifer. Sel T CD8+ δ intraepitelial mukosa respirasi dan usus juga dicurigai berperan dalam toleransi mukosa. Jadi, mekanisme pertahanan mukosa dari
autoagressive dan penyakit alergi melibatkan berbagai tahap regulasi. Sedangkan aktivasi, survival dan ekspansi sel regulator ini tampaknya dikontrol oleh jenis terspesialisasi APC, khususnya sel dendritik jaringan spesifik meliputi sel dendritik di hati, plak payeri, mukosa intestinal dan sistem respirasi paru (Danielle, 1999; Mayer, 2003).
2.8. Imunitas Mukosa Sistem Pernapasan
Folikel limfoid yang terisolir ditemukan tersebar di seluruh mukosa saluran napas. Sistem imunitas mukosa saluran napas terdiri dari nose-associated lymphoid tissue (NALT), larynx-associated lymphoid tissue (LALT), dan
34
Respons imun diawali oleh sel M (microfold cells) yang berlokasi di epitel yang melapisi folikel MALT. Folikel ini berisi sel B, sel T dan APC yang dibutuhkan dalam pembentukan respons imun. Sel M bertugas untuk
uptake dan transport antigen dari lumen dan kemudian dapat
mengaktifkan sel T. Sel APC dalam paru terdiri dari sel dendritik submukosa dan intersisial dan makrofag alveol. Makrofag alveol merupakan 85% sel dalam alveoli, dimana sel dendritik hanya 1%. Makrofag alveol ini merupakan APC didalam alveol, sel ini berperan melindungi saluran napas dari proses inflamasi pada keadaan normal. Saat antigen masuk, makrofag alveol akan mempengaruhi derajat aktivitas atau maturasi sel dendritik dengan melepaskan sitokin. Sel dendritik akan menangkap antigen, memindahkannya ke organ limfoid lokal dan setelah melalui proses maturasi, akan memilih limfosit spesifik antigen yang dapat memulai proses imun selanjutnya (Daniele 1999; Mayer, 2003; Gottesman, 2009).
Setelah menjadi sel memori, sel B dan T akan bermigrasi dari MALT dan kelenjar limfoid regional menuju darah perifer untuk dapat melakukan ekstravasasi ke efektor mukosa. Proses ini diperantarai oleh molekul adesi vaskular dan kemokin lokal, khususnya mucosal addressin cell
35
adhesion molecule-1 (MAdCAM-1). Sel T spesifik antigen adalah efektor penting dari fungsi imun melalui sel terinfeksi yang lisis atau sekresi sitokin oleh Th1 atau Th2. Perbedaan rasio atau polarisasi sitokin ini akan meningkatkan respons imun dan akan membantu sel B untuk berkembang menjadi sel plasma IgA (Daniele,1999; Lusuardi, 2002; Mayer, 2003; Bals, 2004; Martin, 2005; Mestecky, 2005; Muooz, 2005; Gottesman, 2009; Elgert, 2009).
Manfaat Klinis dari pengetahuan dan memahami Imunitas Mukosa adalah pemberian imunisasi melalui mukosa. Fakta, kebanyakan infeksi masuk melalui permukaan mukosa dan pada infeksi ini, jarang diberikan vaksin topikal untuk menginduksi respons imun protektif. Vaksinasi mukosa diharapkan akan memberikan perlindungan dengan cara mencegah penempelan dan kolonisasi patogen pada epitel mukosa dan mencegah penetrasi dan replikasi di mukosa serta menangkal ikatan toksin mikrobial pada epitel mukosa dan sel lain yang terkena. Beberapa patogen merangsang pembentukan produksi s-IgA dan sangat berhubungkan dengan memori imunitas. Selanjutnya memberikan imunitas protektif dengan diperantarai oleh sel T helper CD4 dan mungkin juga sel sitolitik CD8 dan sel NK. Pada sistim respirasi dan genital yang lebih permeabel dan mudah dipenetrasi oleh antibodi daripada mukosa intestinal, juga bisa mendapatkan imunitas protektif dengan pemberian imunisasi parenteral. Walaupun demikian masih ada kesulitan dalam mengembangkan vaksin mukosa untuk mendapatkan kadar antibodi s-IgA yang memadai. Baru beberapa vaksin mukosa yang ditemukan (Mayer, 2003; Aghamohamidi, 2004; Renegar, 2004; Mestecky, 2005; Bitonti, 2006; Ballow, 2007).
36
disuntikkan. Diharapkan akan terbentuk s-IgA dan IgG yang melindungi penyebaran sistemik patogen tersebut. Dimana mungkin juga secara transudasi memberikan proteksi lokal mukosa saluran napas bawah. Saat ini telah ada vaksin influensa yang diberikan topikal lewat nasal. Dengan cara ini tejadi respons imun seperti alamiahnya, bisa terjadi imunitas lokal dengan membentuk s-IgA yang menempel di permukaan virus hemaglutinin dan neuroamidase dan sistemik dengan cara membentuk IgG yang mencegah penyebaran virus sistemik, viremia. Kedua vaksin tersebut memberikan proteksi sebesar 60-90%. Vaksin mukosa untuk imunoterapi saat ini mulai dipikirkan. Adanya toleransi imunitas di mukosa menjadikan pilihan strategi untuk mengembangkannya (Steffen,1992; Dave,2004; Renegar, 2004; wright,2004; Mestecky, 2005; Judarwanto 2009).
2.9. Sekretori Immunogobulin A ( s-IgA )
37
dan telah dibuktikan dapat menghambat virus menembus mukosa (Steffen, 1992; Brandtzaeg, 1994; Schmekel, 1995; Danielle, 1999; Mayer,
2003, Elgert, 2009).
Gambar 2.14. IgA monomer dalam serum (20%), S-IgA dimer didalam
alveolus (70-80%). Dikutip dari Elgert, 2009.
38
Schmekel dkk,1995 melakukan penelitian dengan orang sehat, tidak merokok dengan melakukan BAL, mendapatkan hasil bahwa s-IgA didalam Alveol adalah rata rata 2800 ug/L. S-IgA, merupakan prinsip imunitas pertahanan tubuh pada sistem mukosa pernapasan dan juga mukosa lain didalam tubuh. Beberapa patogen penyebab nosokomial pneumonia mempunyai aktifitas IgA protease yang menghancurkan s-IgA yang memberikan kontribusi berkembangnya infeksi. Pada penelitian sebelumnya patogen gram negatif pada pasien pneumonia nosokomial mempunyai aktifitas IgA protease yang menyebabkan berkembangnya infeksi saluran napas. Pada penelitian in vitro mendapat kesimpulan bahwa rusaknya s-IgA oleh bakteri juga mempengaruhi fungsi anti-inflamasi IgA. Patogen gram negatif Pseudomonas aeruginosa dan
Acinetobacter baumanii dapat merusak fungsi efektor selular s-IgA, sehingga berkembang menjadi pneumonia dan keparahan penyakit bertambah karena tidak terkontrolnya respon inflamasi oleh host (Danielle, 1999; Wolf, 1994, Schmekel, 1995, Dave, 2004; Diebel, 2004-2009; Lamm, 2006).
Gambar 2.16. Sekretori epitel, s-IgA, dikutip dari Elgert, 2009
39
serial dan protein bronkial. Hasil penelitian menunjukan albumin dan IgG BAL tidak menunjukan perbedaan bermakna dari kelompok menjadi infeksi pneumonia dan yang tidak pneumonia. Namun s-IgA meningkat selama pasien dalam ventilator, tetapi produksi s-IgA menurun pada pasien yang berkembang menjadi VAP dan ARDS.
Mekanisme efek proteksi antibodi s-IgA belum jelas, Diebel 2009 melakukan penelitian mengenai efek s-IgA terhadap pelepasan inflamasi sitokin pada aktifitas monosit dengan stimulus Haemophilus influenza, lipopolysaccharida (LPS) Escherichia coli. Penelitian ini menunjukkan bahwa s-IgA mengurangi regulasi produksi tumor necrosis (TNF) dan interleukin-6 (IL-6), sedangkan IgG secara paralel tidak memberikan efek. Pembentukan TNF dan IL-6 ditekan bila s-IgA ada selama induksi sitokin dan IgA juga meng-inhibisi pecah monosit selama fase pembentukan sitokin. Regulasi TNF dan IL-6 oleh s-IgA bisa sebagai anti-inflamasi, mekanisme ini mencegah agar tidak terjadinya level inflamasi sitokin tak terkontrol selama inflamasi akut dan kronik (Hajis-Laengalis, 1992; Wiggins, 1994; Wolf, 1994; Dave, 2004; Wright, 2004; Furst, 2008; Diebel, 2009; Diebel, 2009).
2.10. Neutrofil
40
sedapat mungkin dicegah agar tidak menempel pada mukosa, bersama-sama dengan s-IgA mengikat antigen, barier fisik dan kimiawi dengan enzim-enzim mukosa. Antigen yang telah menembus mukosa juga dieliminasi dan reaksi imun yang terjadi diatur oleh sel-sel regulator. Hal ini untuk mencegah terjadinya respons imun yang berlebihan yang akhirnya merugikan oleh karena adanya pajanan antigen yang sangat banyak. Sedangkan sistem imunitas sistemik bersifat memicu respons imun oleh karena adanya paparan antigen, hal inilah yang terjadi dengan migrasinya neutrofil dalam jumlah besar kedalam alveol, dapat menyebabkan hancurnya lingkungan alveol. Sistem imunitas alveol menggunakan beberapa mekanisme untuk melindungi pejamu dari respons imunitas yang berlebihan. Semua mekanisme ini ditujukan untuk menekan respons imunitas. Jaringan mukosa ditemukan di sistem saluran napas, saluran cerna, saluran genital dan kelenjar payudara. Mekanisme proteksi terhadap antigen pada mukosa, terdiri dari membran mukosa yang menutupi mukosa dan enzim adalah perlindungan mekanik dan kimiawi yang sangat kuat, sistem imun alamiah mukosa (innate immunity)
berupa eliminasi antigen dengan cara fagositosis dan lisis, sistem imun mukosa adaptif dimana selain melindungi permukaan mukosa juga melindungi bagian dalam badan dari masuknya antigen lingkungan (Lusuardi, 2002; Singh, 2002; Mayer, 2003; Bals, 2004; Martin, 2005; Mestecky, 2005; Linssen, 2007; Elgert, 2009; Sim, 2009).
41
Gambar 2.17. Neutrofil dari BAL, alveol, dikutip dari Grigoriu,2006
Tabel 2.9. Persentase hitung jenis sel BAL orang dewasa Normal, tidak merokok, dikutip dari Meyer, 2012
Tipe sel Persentase hitung jenis sel
Makrofag Alveol ≥85%
Limposit ≤15%
Neutrofil ≤γ%
Eosinofil ≤1%
Sel Epitel Bronkial ≤5%
Sel Epitel Skuamous Nonea
Barreiro, 1996 melakukan penelitian neutrofil dari BAL, 90 subjek, mendapatkan hasil bahwa neutrofil pada kelompok (VAP-) adalah sekitar
42
Tabel 2.10. Karakteristik neutrofil BAL pada pasien dengan Ventilator
VAP (n=35) Non-VAP (n=55) p-value
43
perbaikan terapi penunjang seperti strategi proteksi ventilator. Walaupun yang terbaik adalah memahami molekular dan mekanisme seluler ARDS, yang belakangan ini diketahui cikal bakal yang terbaik. Aktifitas yang berlebihan dan migrasi dari sirkulasi neutrofil dari darah ke rongga alveol merupakan kunci mempercepatnya terjadinya ARDS. Pada prinsipnya pengambilan neutrofil kedalam paru merupakan pertahanan tubuh yang penting terhadap infeksi patogen. Jadi ada dua sisi yang berlawanan dari neutrofil didalam paru sebagai pertahanan tubuh terhadap infeksi dan mediator kerusakan sel-sel paru, sulit untuk dipahami, hal ini jadi pertimbangan untuk evaluasi terapi dan prognostik (Morrison, 1998; Befus,1999; Lee, 2001; Boyton, 2002; Retuerhan, 2004; Grigoriu, 2005; Halbertsma, 2005; Noble, 2006; Oeckler, 2007; Diebel, 2009; Gottesman, 2009; Meyer, 2012).
Gambar 2.18. Pengambilan Neutrofil kedalam jaringan paru
Keterangan Gambar :
44
peningkatan waktu bermigrasi (‘margination’) (inset A: margination). Didalam pembuluh vena kecil, adhesion molecule (AM)-tergantung dengan siklus proses ini. Respon dari stimulus inflamasi (panah merah), neutrofil melekat di endotel kapiler (inset B: sequestration). AM dan kemokin (tidak dilihatkan) bisa masuk bersama-sama dalam proses ini. Makrofag alveolar dan type II pneumocytes
menghasilkan kemokin, dengan cara ini neutrofil bermigrasi melalui endotel (inset C1: transendothelial migration), masuk ke intersisial, dan epitel (inset C2: transepithelial migration) dan berkumpul sangat banyak dalam rongga alveol. (dikutip Reutershan, 2004)
2.11. Bronchoalveolar Lavage (BAL)
Bronkoskop serat lentur pertama kali dikembangkan oleh Dr. Shigeto Ikeda pada tahun 1960-an. Walaupun telah banyak studi mengenai penggunaan BAL untuk aplikasi klinis pada beberapa penyakit paru namun belum ada konsensus baku mengenai penggunaan BAL, sehingga terdapat perbedaan antara berbagai pusat studi mengenai teknik pemeriksaan BAL. BAL adalah suatu teknik pemeriksaan dengan menggunakan bronkoskop serat lentur untuk mendapatkan sampel sel-sel dan komponen non-selular dari permukaan epitel saluran napas bawah atau unit bronkoalveolar. BAL dilakukan terutama dengan anestesi lokal dan premedikasi. Penggunaan atropin sebagai premedikasi untuk meminimalkan terjadinya bradikardi yang diinduksi oleh refleks vasovagal dan mengurangi sekresi saluran napas (Pugin,1991; Haslam,1999; ATS, 2005; Afessa, 2006; Cardeiro, 2008; Meyer; 2012; Rasmin, 2012).
Efek samping dari pemeriksaan BAL hampir sama dengan pemeriksaan bronkoskopi yaitu hipoksemia, batuk, demam, menggigil, infiltrasi alveolar, dan penurunan fungsi paru yang bersifat sementara. Efek samping terutama berhubungan dengan teknik endoskopi, lokasi dan luas area yang dikumbah, volume dan temperatur cairan yang diinstilasikan (Van-Hooser, 2006; Fagon, 2007; Ramirez, 2007; Rasmin, 2012).
45
Penggunaan tempat BAL pada lokasi lobus tengah paru kanan atau lingula karena secara anatomis, volume cairan BAL dan sel-sel yang didapat kembali akan lebih besar (Zaccard, 2009). Cairan yang digunakan untuk BAL adalah NaCl 0,9% dengan suhu 370C sehingga mengurangi terjadinya batuk, bronkospasme dan kurang menyebabkan penurunan fungsi paru, oleh karena itu akan meningkatkan jumlah cairan yang didapat kembali dan jumlah sel yang didapat. Cairan NaCl 0,9% dimasukkan bolus dengan spit dengan kecepatan 5 ml/dt atau dibiarkan mengalir dengan gaya hidrostatik dari reservoir. Cairan diaspirasi kembali dengan suction menggunakan tekanan negatif 25 – 100 mmHg atau dibiarkan mengalir dengan gaya gravitasi. Penggunaan suction mekanik harus berhati-hati karena dapat mengakibatkan trauma yang menyebabkan perdarahan sehingga terdapat eritrosit dalam cairan BAL. Umumnya cairan yang diperoleh kembali berkisar 40–60% dari jumlah volume yang diinstilasikan. Jumlah cairan yang digunakan berbeda-beda antara berbagai pusat studi. Sebagian besar menggunakan cairan sebanyak 100–300 ml pada masing-masing subsegmen dengan cairan 20 ml setiap kali bilasan. Volume cairan bilasan berpengaruh pada jumlah sel cairan BAL serta komponen non-selular lainnya. Semakin sedikit jumlah cairan maka sel yang didapat akan lebih menggambarkan sel-sel bronkial daripada alveolar yaitu pada volume kurang dari 100 ml (Elattrous, 2004; Jimenez,1993; Van-Hooser, 2006; Baugman, 2007; Fagon, 2007; Ramirez, 2007; Meyer, 2012; Rasmin, 2012).
46
(HBSS) dan disentrifugasi kembali untuk diperiksa diferensiasi sel-selnya. Diferensiasi sel dapat menggunakan teknik immunofluorescent dan
immunocytochemical. Teknik tersebut menggunakan antibodi monoklonal terutama dalam menentukan jenis limfosit. Penghitungan jumlah masing-masing tipe sel menggunakan flow cytometry. Pemeriksaan komponen nonselular meliputi radio-immunodiffusion untuk menghitung jumlah protein, radio-immunoassays cairan BAL misalnya aktivitas kemotaktik netrofil (Violan,199γ; Laursen,1994; Kayacan, β00γ; Chec’h, β006; Van -Hooser, 2006; Leo, 2008; Rasmin, 2012).
Van-Hooser, 2006 melakukan miniBAL, yaitu teknik invasif minimal yang sangat baik, memberikan informasi yang sangat penting tentang diagnosis, imunologi, inflamasi, dan proses infeksi sampai tingkat alveol. Sedangkan Zaccard, 2009 melakukan BAL, pada kedua paru (bilateral miniBAL), mendapatkan hasil yang lebih bermakna, efikasi yang baik. Biakan semikuantitatif BAL dapat menunjukkan lebih 105 koloni bakteri/ml. Menurut Daniele,1999, Imunoglobulin yang terdapat dalam cairan BAL(%): IgA = 10,2 1,0 ; IgG = 19,0 1,7; IgM = 0,08 0,04; IgD= 0 ; IgE= 0
47
2.11.1.Indikasi BAL (ATS, 2004; Afessa,2006; CCCTG, 2006;
Baughman, 2007; Meyer, 2012 ).
1. Pneumonia yang tidak mengalami perbaikan. 2. Infiltrat yang difus, intersisial dan atau alveolar.
3. Dugaan adanya perdarahan pada Alveol. 4. Uji kuantitatif untuk kasus VAP.
5. Adanya infiltrat pada kasus immunocompromised. 6. Kasus-kasus infeksi lain.
7. Untuk penelitian
2.11.2. BAL juga dapat untuk mendiagnosis
1. Alveolar hemorrhage
2. Proses keganasan 3. Infeksi
4. PCP
5. Mikobakterium Tuberkulosis 6. Bakteri
7. Jamur 8. Virus
2.11.3. Perlengkapan Sarana Melakukan BAL
1. Bronkoskop lentur/ fleksibel
2. Botol vakum yang steril , atau spit 20cc dispossibel 3. Pipa isap
4. Larutan garam NaCl 0,9% steril hangat 37 oC 5. Alat vakum
6. Spit steril 10 cc 7. Lidocaine 1-2%
2.11.4. Persiapan Preparat dan Anestesi
1. Buat izin persetujuan dari keluarga (informed consent).
48
3. Amati foto dada kemudian tentukan tempat yang ideal untuk melakukan BAL. Contoh bila dijumpai infiltrat yang luas maka lakukan BAL pada lobus tengah kanan, atau lingula kiri dengan posisi telentang.
4. Persiapkan prosedur bronkoskopi, tempat pengumpulan preparat dan pipa steril.
5. Persiapkan oksigen dan monitoring lengkap terhadap vital sign. 6. Premedikasi dengan bronkodilator, dan larutan garam hangat
agar tidak terjadi bronkospasme
7. Posisi telentang lakukan BAL di RML atau lingula 8. Gunakan monitor dan pemberian oksigen
9. Sedasi diberikan agar pasien merasa nyaman dan mengurangi reflek batuk.
Contoh : midazolam (dewasa dosis 1 to 2.5 mg IV) dan fentanyl (dewasa dosis 25-100 mcg IV).
10. Anastesi lokal dengan dosis minimal 8,2 mg/kg, lebih aman. 11. Konvensional 4-5 mg/kg 2% lidocaine.
2.11.5. Teknik BAL
1. Persiapkan prosedur preparat dan alat-alatnya, berikan sedasi yang adekuat.
2. Rencanakan dengan matang perlakuan BAL dengan alat bronkoskop, hindari agar jangan ada kontaminasi.
a. Hindari penyedotan sebelum hasil BAL diambil.
b. Bila perlu pipa alat sedotan dicuci dulu dengan larutan garam. 3. Minimalkan penggunaan anastesi lokal lidocaine karena
mempunyai efek bakteriostatik.
4. Lakukan bronkoskopi melihat seluruh cabang saluran napas sebelum memutuskan lokasi segmen yang akan di BAL. Hindari trauma bronkus bila ada tanda-tanda perdarahan alveol.
49
6. Atur posisi ujung bronkoskopi, isap dengan alat isap (50-80mmHg), kumpulkan spesimen dalam botol penampungan. Atau diisap dengan memakai spit 20cc steril dispossibel.
7. Ulangi langkah 5 dan 6 sampai 5 kali sampai 100-120 mL, sampai didapat specimen adekuat 40-60 mL (40-70%).
8. Amati aliran gelembung dari rongga alveol. 9. Ulangi isapan cairan yang keluar tadi.
10. Distal saluran napas bisa kolaps bila isapan dengan tekanan tinggi.
11. Kurangi tekanan isapan, intermiten agar saluran napas distal tidak kolaps.
12. Instruksikan pasien bernapas dalam agar lebih banyak spesimen yang didapat.
13. Bila diperlukan cairan yang dipakai bisa mencapai 300 ml. 14. Spesimen BAL sebaiknya diproses segera ke laboratorium. 15. Pasien diamati minimal 1 jam setelah prosedur dilakukan dengan
monitor.
2.11.6. Analisis yang biasa dilakukan
1. Spesimen diamati secara kasat mata. 2. hitung jenis sel (Cell count and differential)
a. makrofag di alveolar (Normal >80%) b. Neutrofil (Normal <3%)
b. Pengecatan dan pewarnaan histopatologi
c. Polymerase chain reaction (PCR) d. Biakan kuantitatif.
50
g. kolonisasi dari penyebab infeksi : bakteri, virus, aspergillosis, kandida dan mikobakterium atipikal.
4. Sitologi
2.11.7. Komplikasi
1. Tidak ada komplikasi ( 95% dari kasus ) 2. Batuk
3. Demam 4. Mialgia
5. Muncul infiltrat yang perbaikan dalam 24 jam. 6. Bronkospasme
7. Berkurangnya faal paru sementara waktu. 8. Berkurangnya sementara PaO2
9. Pada pasien dengan kondisi berat membutuhkan intubasi dan ventilasi mekanik.
2.12. Simplified Acute Physiology Score (Skor SAPS)
51
52
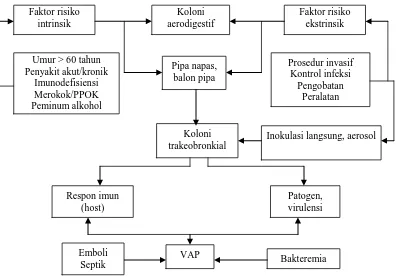
2.13. Kerangka Teori
Gambar 2.20. kerangka teori
53
2.14. Hipotesis
2.14.1 Hipotesis Mayor
Kadar S-IgA dan persentase neutrofil dari saluran napas bawah akan meningkat dengan kejadian VAP awitan dini.
2.14.2. Hipotesis Minor
1. Kadar S-IgA dari saluran napas bawah akan meningkat dengan paparan atau menggunakan ventilator mekanik dan akan lebih meningkat pada kejadian VAP awitan dini serta memberikan respon berbeda terhadap jenis patogen yang berbeda.
2. Persentase neutrofil dari saluran napas bawah akan meningkat dengan kejadian VAP awitan dini dan mempengaruhi perjalanan penyakit VAP.
2.15. Kerangka Konsep
Gambar. 2.21. Kerangka Konsep
S-IgA (ng/ml)
Neutrofil (%)
Patogen
VAP (skor CPIS)