BAB 2
TINJAUAN PUSTAKA
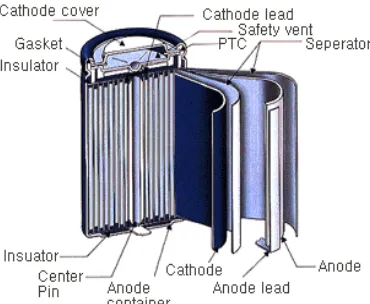
2.1 Pengertian Baterai
Secara umum, pengertian baterai mencakup satu atau beberapa sel baterai yang digabungkan secara seri atau paralel sesuai dengan tegangan dan kapasitas listrik yang digunakan. Sel baterai adalah unit terkecil dari suatu sistem proses elektrokimia yang terdiri dari elektroda, elektrolit, separator, wadah, dan terminal. Adapun komponen penting pada sel baterai yaitu sebagai berikut.
a. Elektroda negatif (anoda) adalah elektroda yang melepaskan elektron ke rangkaian luar serta mengalami proses oksidasi pada proses elektrokimia.
b. Elekttroda positif (katoda) adalah elektroda yang menerima elektron dari rangkaian luar serta mengalami proses reduksi pada proses elektrokimia.
c. Penghantar ion (elektrolit) adalah media transfer ion yang bergerak dari anoda ke katoda ke dalam sel baterai saat penggunaan. (Linden,2002)
2.1.1 Baterai Primer
Baterai Primer adalah baterai dengan penggunaan sekali saja. Struktur dan sifat material elektroda yang digunakan tidak menunjukkan penambahan energi listrik pada baterai yang efektif saat diisi ulang/ recharged. Pada umumnya baterai primer murah, mudah digunakan sebagai sumber listrik untuk peralatan portabel, memiliki densitas energi listrik yang besar dengan kecepatan discharge yang rendah dan tidak memerlukan perawatan. (Cheline,2009).
2.1.2 Baterai Sekunder
berlawanan. Baterai jenis ini disebut juga disebut juga sebagai baterai penyimpan/ strorange battery atau accumulator. Baterai sekunder diaplikasikan dalam dua kategori, yaitu :
a. Sebagai alat penyimpan energi/ Energy-storage Device. Umumnya baterai jenis ini tersambung dengan jaringan listrik primer saat digunakan. Contoh penggunaanya adalah dalam otomotif, pesawat terbang.
b. Sebagai sumber energi listrik pada portabel divais, pengganti baterai primer dan pada semua divais yang menggunakan baterai primer, seperti telephone genggam, kamera, notebook dan lain-lain.(Abbas,1997)
2.2 Baterai Lithium
Baterai Lithium teori adalah baterai yang digerakkan oleh ion lithium. Dalam kondisi discharge dan recharge baterai lithium bekerja menurut fenomena interkalasi, di mana ion lithium melakukan migrasi dari katoda melalui elektrolit ke anoda atau sebaliknya tanpa terjadi perubahan struktur kristal dari banyak keunggulan antara lain mempunyai tegangan yang bahan katoda ke anoda. Baterai lithium sangat menarik untuk dikembangkan karena besar, waktu hidup yang lama dan material elektrodanya tidak beracun.
Lithium Ion Battery memiliki pada umumnya memiliki empat komponen utama yaitu elektroda positif (katoda), elektroda negatif (anoda), elektrolit, dan separator.
2.2.1 Elektroda negatif (anoda)
Anoda merupakan elektroda yang berfungsi sebagai pengumpul ion lithium serta merupakan material aktif. Parameter pengembangan dari material untuk digunakan sebagai anoda ini antara lain kepadatan energi yang dihasilkan serta siklus pemakaian atau
cyclability.Material yang dapat dipakai sebagai anoda harus
berperan sebagai anoda adalah material yang berbasis carbon seperti LiC6
2.2.2 Elektroda positif (katoda)
atau grafit.Kepadatan energi secara teori yang dihasilkan dari material ini adalah berkisar 372 A.h/kg. Selain grafit, material berbasis karbon yang dapat digunakan untuk anoda yaitu soft carbon, graphene dan hard carbon.(Manjhunata,2010).
Katoda merupakan elektroda yang fungsinya sama seperti anoda yaitu pengumpul ion serta material aktif. Namun perbedaannya adalah katoda merupakan elektroda positif. Beberapa karakteristik yang harus dipenuhi suatu material yang digunakan sebagai katoda antara lain material tersebut terdiri dari ion yang mudah melakukan reaksi reduksi dan oksidasi, memiliki konduktifitas yang tinggi seperti logam, memiliki kerapatan energi yang tinggi, memiliki kapasitas energi yang tinggi, memiliki kestabilan yang tinggi (tidak mudah berubah strukturnya atau terdegradasi baik saat pemakaian maupun pengisian ulang), harganya murah dan ramah lingkungan. Pada tahun 1980 material LiCoO2 menjadi kandidat material
pertama yang digunakan sebagai katoda pada LIBs.Kerapatan energi yang dimiliki LiCoO2
2.2.3 Elektrolit
sebesar 140A.h/kg. Walaupun demikian material tersebut memiliki kestabilan yang rendah dan harganya relative mahal.(Bo Xu,2012).
energi. Beberapa material yang dapat digunakan sebagai elektrolit cair antara lain LiNO3 , LiClO ,Li2SO4 , garam LiNO3 , garam
Li2SO4, LiPF6
2.2.4 Separator adalah suatu material berpori yang terletak di antara anoda dan katoda berfungsi untuk menjegah agar tidak terjadi hubungan singkat dan kontak antara katoda dan anoda. Beberapa hal yang penting untuk memilih material agar diplih sebagai separator antara lain material tersebut bersifat insulator, memiliki hambatan listrik yang kecil, kestabilan mekanik (tidak mudah rusak), memiliki sifat hambatan kimiawi untuk tidak mudah terdegradasi dengan elektrolit serta memiliki ketebalan lapisan yang seragam atau sama di seluruh permukaan. Beberapa material yang dapat digunakan sebagai separator antara lain polyolefins (PE dan PP), Poly(vinylidene fluodire) (PVdF),danpoly(ethylene oxide).(Zhao,2011).
. Elektrolit padat sendiri keuntungannya yaitu memiliki konduktivitas yang besar serta dapat tahan lama dibandingkan dengan elektrolit yang cair.(Jin,2009).
Struktur sel sebuah baterai terdiri dari katoda (elektroda positif), anoda (elektroda negatif), elektrolit, dan separator.
Gambar 2.4. struktur sel sebuah baterai
menuju anoda sedangkan pada saat discharging elektron dari anoda mengalir ke katoda melalui kabel konektor sedangkan lithium yang berada pada sistem (di dalam baterai) lepas dari anoda karena kekurangan elektron untuk berpindah menuju katoda melalui elektrolit.
Pembuatan sel baterai selama ini dari thin film menggunakan metode penguraian terlebih dahulu. Pada prisnsipnya ada beberapa keuntungan baterai lithium yaitu:(Abbas,1997).
1. Tegangan maksimum (lebih besar dari baterai lain) dan energi tinggi. Baterai Lithium mempunyai energi pelepasan muatan 3 V, kira-kira 2 kali dari baterai kering yang konvensional ( umum). Karena keuntungan ini satu baterai Lithium dapat menggantikan 2 baterai konvensional.
2. Karakteristik pelepasan muatan yang baik.
Karena baterai Lithium mampu menjaga kestabilan tegangan selama pelepasan muatan, satu baterai dapat digunakan sebagai sumber tenaga internal.
3. Tahan terhadap kebocoran.
Penggunaan larutan organik dari alkali untuk elektrolit menghasilkan suatu yang lebih, yaitu mengurangi korosi dan kemungkinan kebocoran elektrolit.
4. Karakteristik penyimpanan muatan yang besar.
Baterai Lithium yang mengandung Lithium Ferro Phospat dan elektrolit yang stabil, dapat mengurangi resiko terjadinya self discharge.
5. Tidak berbahaya terhadap lingkungan. Kerugiannya :
-Tak tahan terhadap kelembaban -Densitas relatif kecil
-Produksi relatif mahal
2.3 Material Katoda
Salah satu komponen dalam sistem sel baterai lithium adalah katoda. Material katoda ini dapat menjadi salah satu acuan untuk menentukan kapasitas sel baterai secara teoritik.
Untuk setiap berat molekul katoda, jumlah ion lithium yang dilepaskan material katoda saat discharging menggambarkan densitas energi dan power sel baterai. Semakin banyak lithium dari katoda ke anoda, maka densitas energi sel baterai semakin besar dan semakin banyak lithium yang kembali ke katoda dari anoda, densitas powernya maka akan semakin besar.(Myounggu,2010).
Material katoda dapat disintesin dengan beberapa metode, antara lain yaitu metode kimia, metode presipitasi, dan metode metalurgi serbuk. Solid state method atau metode metalurgi serbuk adalah metode yang cukup sederhana dan mudah dilakukan, tetapi pada metode ini membutuhkan energi yang besar, waktu yang lama dan suhu pemanasan (sintering) yang lama untuk mendapatkan material katoda tanpa pengotor (impuritas).
2.3.1 Lithium Mangan oksida (LiMn2O4
Lithium mangan oksida merupakan bahan katoda yang cukup populer pada baterai lithium. Lithium mangan oksida mempunyai struktur spinel dengan kemampuan interkalasi tiga dimensi. Hal ini menyebabkan bahan katoda ini mampu disisipi ion lithium dalam tiga arah. Baterai lithium merupakan baterai yang berbasis ion dengan ion lithium sebagai motor penggerak.(Kiehne,1989).
)
Bahan katoda baterai lithium yang ada pada saat ini antara lain Lithium Cobalt oxide (LiCoO2), Lithium nickel oxide (LiNiO2), Lithium mangan oxide
(LiMn2O4
Kebanyakan baterai lithium yang sudah diproduksi di pasaran masih banyak menggunakan LiCoO
).(A,Veluchanny,2001).
2 dan LiNiO2 sebagai katodanya. Namun bahan Cobalt dan
Nikel cukup mahal. Dalam pencarian baterai lithium yang murah, bahan katoda yang murah dari segi bahan dasar dan proses pembuatan menjadi salah satu penyelesaiannya. LixMn2O4 yang juga dikenal sebagai bahan katoda akan
menjadi alternatif jawaban. LixMn2O4 mempunyai keunggulan lain dengan
Susunan atom oksigen dan octahedral mangan membentuk sebuah spinel framework dalam spinel LixMn2O4. Hal ini membuat gerak ion lithium dalam
proses interkalasi menjadi bebas dalam tiga dimensi. Dan framework ini cukup stabil ketikan ion lithium berpindah-pindah dalam proses interkalasi.(Koseva,2000).
2.3.2Lithium Iron Phosphate (LiFePO4
Lithium ferro phospat (LiFePO4) mempunyai bentuk struktur yang serupa, tetapi memiliki saling kelarutan yang rendah, tetapi memiliki saling kelarutan yang rendah. hal ini memastikan jarak dekat biaya atau debit tegangan (3,5V)dan oksidasi aktifnya lebih rendah dari komponen elektrolit dalam libs. Di dalam LiFePO4 partikel dilapisi dengan karbon tingkat pengisian dan pengosongan proses dibatasi oleh konduktvitas ion dari bahan. LiFePO
)
4/C komposit disusun
melalui sederhana dan suhu tinggi metode keadaan padat (solid-state) untuk lebih efektif meningkatkan kinerja elektrokimia LiFePO4/C, LiFePO4/C dengan Ni dan
Mn co-doping disintesis oleh suhu tinggi dengan solid-state. Pengaruh Ni dan Mn co-doping dengan jumlah yang berbeda pada struktur, morfologi dan properti elektrokimia LiFePO4/C.(Hongbo,2013).
Bockenfeldetal. jugatelah menunjukkansebagaiAC-LiFePO4 elektrodamemungkinkanpeningkatan kinerjatingkattinggi, sehubungan
denganorang-orangyang hanya berisiLiFePO4(LFP) danaditifkonduktif. PenambahanACdiusulkanuntuk memiliki
beberapaefek yaitu : MenipiskanpartikelLFPdan, sehingga menghindarikekurangan garamLi
menyediakan kapasitastambahan karenaformasidouble-layer.
2.4 Bahan baku pada serbuk LiFe0.9-xMnxNi0.1PO Serbuk senyawa dari LiFe
4
0.8Mn0.1Ni0.1PO4disintesis dengan cara dicampur
menurut perhitungan stoikiometri dari bahan-bahan dasar LiOH.H2O, Fe2O3,
2.4.1 LiOH.H2
Lithium adalah logam yang lunak, merupakan unsur padat yang paling ringan dan dapat mengapung pada produk minyak bumi. Bahan ini digunakan dalam industri porselen, keramik, agen pemutih, farmasi.
O
Reaksi berlangsung lambat bila dibandingkan dengan reaksi alkali yang lain, sehingga tidak berbahaya dibandingkan logam alkali lainnya. Oleh karena titik didihnya lebih tinggi dari air, maka bila bereaksi dengan air akan tetap sebagai padatan, sedangkan logam alkali lainnya akan meleleh. Lithium hydroxide merupakan senyawa inorganik, material higroskopis, tersedia secara komersial dalam bentuk monohidrat (yaitu LiOH.H2O) yang merupakan basa
kuat. Senyawa ini memiliki kemurnian hampir 99%.
Gambar 2.5 Serbuk Lithium Hydroxida
2.4.2 Besi Oksida
Iron Oxide atau sering juga disebut hematite memiliki kemurnian 95-100%. Hematite adalah bentuk mineral besi oksida (Fe2O3). Hematite mengkristalisasi
dalam sistem hingga abu-abu perak atau baja, coklat hingga merah kecoklatan atau merah. Dalam skala kekerasan, hematit berada dalam skala 5 dari 6.
2.4.3 Mangan Oksida
Mangan dioxide adalah senyawa anorganik dengan rumus MnO2. Kengunaan
utama dari MnO2 adalah untuk sel baterai kering , seperti baterai alkaline dan
baterai seng - karbon. Mangan dioxide memiliki kemurnian 100%.
Gambar 2.5 Serbuk Mangan dioxide (http://id.wikipedia.org/wiki/ManganDioxide)
2.4.4 Nikel (Ni)
Nikel memiliki kemurnian hamper 100%. Nikel biasa digunakan sebagai bahan pembuat paduan. Logam paduan nikel memiliki karakteristik kuat, tahan panas, serta tanan korosi.
Gambar 2.6 Serbuk Nikel
2.4.5 Asam Phospat
Gambar 2.7 Cairan Phosphoric Acid
2.5 XRD (X-Ray Diffraction)
XRD (X-Ray Diffraction) merupakan alat yang digunakan untuk mengkarakterisasi struktur kristal, dan ukuran kristal dari suatu bahan padat. Semua bahan yang mengandung kristal tertentu ketika dianalisa menggunakan XRD akan memunculkan puncak – puncak yang spesifik. Sehingga kelemahan alat ini tidak dapat untuk mengkarakterisasi bahan yang bersifat amorf. Metode difraksi umumnya digunakan untuk mengidentifikasi senyawa yang belum diketahui yang terkandung dalam suatu padatan dengan cara membandingkan dengan data difraksi dengan database yang dikeluarkan oleh International Centre for Diffraction data berupa PDF Powder Diffraction File (PDF).
Gejala difraksi akan ditunjukkan oleh sinar X disaat sinar yang merupakan gelombang elektromagnetik ini jatuh pada permukaan sampel dengan panjang gelombang kira-kira sama dengan jarak antar atom sampel. Atom-atom yang berjarak teratur ini akan berfungsi sebagai pusat penghambur sinar X. Percobaan yang dilakukan pertama kali ini adalah oleh Laue pada tahun 1912, dikembangkqn oleh Bragg untuk mendapatkan persamaan matematis. Sinar yang menumbuk atom akan didifraksikan, dengan demikian sinar yang sefase akan diperkuat sementara yang berbeda fase akan saling menghilangkan. Prinsip dasar difraksi sinar X diperlihat kan pada gambar 2.2.
Sinar X (sinar 1) yang datang membentuk sudut � terhadap permukaan sampel dan menumbuk atom, akan dipantulkan dengan sudut yang sama. Begitu pula dengan sinar X (sinar 2) yang jatuh pada bidang dibawahnya yang berjarak d. Sinar ini akan dipantulkan dengan sudut �, namun memiliki beda fase. Jika perbedaan fasa ini sama dengan kelipatan panjang gelombang, maka akan didapatkan persamaan Bragg :
2d Sin �= n λ...(2.2)
Setiap senyawa memiliki struktur kristal yang unik, baik itu fasa tunggal atau beberapa fasa. Oleh karenanya difraksi sinar yang didapat sangat karakteristik untuk senyawa tertentu. Informasi yang dihasilkan dari pola difraksi sinar X adalah posisi puncak (2 �) dalam satuan derajat, jarak antar bidang (d) dalam Angmstrong, intensitas (I) dalam counts/second, lebar penuh pada setengah puncak (Full Width at Half Maximum FWHM).(Triwibowo,2011)
2.6 SEM ( Scanning Electrochemical Microscopy)
Analisa SEM dilakukan untuk mengetahui permukaan serbuk hasil sinter terkait dengan fasa-fasa yang terbentuk, porositas dan besar butir. Analisa SEM juga dilakukan pada lembar kathoda. Hal ini dilakukan untuk mengetahui distribusi serbuk pada matriks, porositas dan kemampuan basahan serbuk terhadap matriks.
SEM mempunyai prinsip kerja bahwa suatu berkas insiden elektron yang sangat halus di-scan menyilangi permukaan sampel dalam sinkronisasi dengan berkas tersebut dalam tabung sinar katoda. Elektron-elektron yang terhambur digunakan untuk memproduksi sinyal yang memodulasi berkas dalam tabung sinar katoda, yang memproduksi suatu citra dengan kedalaman medan yang besar dan penampakan hampir tiga dimensi.
Sampel baik berupa serbuk maupun lembar kathoda tidak perlu di-coating terlebih dahulu dengan unsur Au,Pd, karena sampel sudah cukup konduktif untuk menghantarkan elektron dengan baik.
SEM memiliki tiga komponen pokok yaitu kolom elektron, ruang sampel, sistem pompa vakum, kontrol elektron dan sistem lensa magnetik. Didalam kolom elektron dapat penembak elektron yang terdiri dari katoda dan anoda. Katoda umumnya terbuat dari Wolfram (W). Elektron yang terlepas dari katoda bergerak ke arah anoda yang dalam perjalanannya berkas elektron ini dipengaruhi oleh lensa magnetik hingga didapatkan berkas elektron yang terfokus ke arah sampel. Saat elektron menumbuk sampel, akan terjadi beberapa fenomena yaitu terbentuknya dua jenis hamburan/scattering, sinar X dan foton.
Hamburan terbagi menjadi dua jenis yaitu hamburan elastis dan non elastis. Hamburan elastis dihasilkan dari tumbukan berkas elektron dengan inti atom sampel tanpa terjadi perubahan energi. Gejala ini disebut juga Back
Scaterred Electron/BSE. Kebalikannya dengan BSE, hamburan non elastis
ditimbulkan dari berkas elektron yang dipancarkan oleh penembak elektron menumbuk elektron sampel hingga terjadi perpindahan energi dari elektron asal ke elektron sampel yang lebih rendah.
2.7 EIS ( Electrochemical Impedance Spectrometry)
Pergerakan elektron dan ion dalam baterai lithium dapat diamati secara elektrokimia dengan menggunakan metode EIS (Electrochemical Impedance Spectrometry). Impedansi elektrokimia biasa diukur dengan menggunakan sebuah tegangan AC (U) pada sebuah sel elektrokimia dan mengukur arus listrik yang melalui sel. Arus massa dalam elektrolit dipengaruhi oleh besaran frekuensi, dimana kontrol kinetik sangat menonjol ketika frekuensi masih tinggi.
Kontrol arus akan dipengaruhi oleh transfer massa saat frekuensi rendah.
Impedance Spectroscopy merupakan tekhnik yang sangat penting untuk
Sebuah sel elektrokimia mirip dengan sebuah hambatan.Contohnya larutan elektrolit berkelakuan sebagai sebuah hambatan ohmik.Kapasitor juga merupakan elemen penting dalam impedansi elektrokimia spektroskopi electrochemical impedance spectroscopy (EIS).
Ruang diantara elektroda dan larutan secara ideal berkelakuan sebagai sebuah kapasitor yang disebut kapasitansi keping ganda elektrik-elecrical double layer capacitance.Besar impedansi kapasitor adalah 1/w C, dan sudut fasa 90° dimana impedansi merupakan pembagian antara tegangan potensial dan arus listrik.
Pengujian EIS dilakukan untuk mengetahui perilaku impedansi material serbuk LiFe0.9-xMnxNi0.1PO4
Pemilihan skala log (f) penting dilakukan untuk menghasilkan sebaran f pada frekuensi rendah.Gambar 2.9. Skema dan peralatan pengukuran EIS.
.alat yang digunakan adalah LCR meter, HIOKI 3532-50 Chemical Impedance Meter. Parameter yang dapat dihasilkan adalah:impedansi ril, impedansi imaginer, pergeseran sudut fasa, dan impedansi total, dengan variasi spektrum frekuensi dalam skala logaritmik.(Subhan,2011)
Gambar 2.9. (a) Skematik setup pengukuran EIS. (b)Peralatanpengujian electrochemical impedance spectroscopy (EIS).
hambatan. Ruang diantara elektroda dan elektron kolektor membentuk ruang yang bersifat sebagai kapasitor.
Adapun prosedur dari pengukuran konduktifitas adalah sebagai berikut:
1. lembar kathoda yang berupa komposit digunting dengan ukuran 35mm x 30 mm.
2. Sampel dijepit pada alat uji (sample holder) berbentuk pelat konduktor. 3. Atur rentang frekuensi yang digunakan pada pengujian (10Hz-100kHz),
kemudian start dan mulailah pengujian.
4. Alat uji konduktifitas akan menghasilkan data-data dari hasil respon bahan terhadap rentang frekuensi yang diberikan berupa nilai impedansi reel (Z’) dan impedansi imajiner (Z’’).
5. Jika diplot diantara Z’ dan Z’’ maka akan dihasilkan kurva nyquist 6. Tentukan Rtot
Kapasitas dari double layer secara umum dituliskan seperti dibawah ini:
dari grafik nyquist ini dengan melakukan ektrapolasi berupa garis setengah lingkaran.
Z = 1
��...(2.2) Untuk mendapatkan nilai Rtot maka kita harus mendapatkan Z” = 0 dengan
cara melakukan ekstrapolasi membentuk setengah lingkaran. Dari nilai Z = Rtot
R = � �
�...(2.3) kita dapat menentukan konduktivitas bahan dengan menggunakan persamaan :
Dimana :� = Hambatan jenis bahan [ohm.m] R = Resistivitas bahan [ohm] t = Tebal bahan [m]
A = Luas penampang bahan [m2 Dikarenakan � = 1
� maka rumus persamaannya adalah : ]
� = �
��...(2.4) Dimana :� adalah Konduktivitas [Ω-1m-1] atau [S/m].