P
a
g
e
1
DIKTAT
MATA KULIAH FISIKA MODERN
Di Susun Oleh :
EFFENDI , M.Pd
PROGRAM STUDI PENDIDIKAN FISIKA
SEKOLAH TINGGI KEGURUAN DAN ILMU PENDIDIKAN ( STKIP )
NURUL HUDA
SUKARAJA OKU TIMUR SUMATERA SELATAN
P
a
g
e
2
BAB I
RELATIVISTIK
1. Panjang Relativistik
Panjang L benda bergerak terhadap pengamat kelihatannya lebih pendek dari
panjang Lo bila diukur dalam keadaan diam terhadap pengamat. Gejala ini disebut
pengerutan Lorentz FitzGerald.
2. Waktu Relativistik
Kuantitas to yang ditentukan :
Menurut pengamat O, selang waktu mengalami pemuaian :
3. Massa, Energi dan Momentum Relativistik
A. Massa Relativistik
Massa benda akan menjadi lebih besar terhadap pengamat dari pada massa ketika
benda diam, jika bergerak dengan kelajuan relativistik.
Mo = massa diam
o A
B t t
t
' '
' t t
P
a
g
e
3
3. Hubungan Massa dan Energi
Hubungan yang paling terkenal yang diperoleh Einstein dari postulat relativitas khusus
adalah mengenai massa dan energi. Hubungannya dapat diturunkan langsung dari definisi
energi kinetik dari suatu benda yang bergerak.
- energi diam
- energi total
4. Hubungan Momentum dan Energi
Dari hubungan dan didapatkan :
uFds K 0
dt mu d F ooc E E
m mc
K 2 Eo moc2
2 2
2 2
1 v c
c m mc E o 2 mc
E 2
P
a
g
e
4
BAB II
TRANSFORMASI GALILEI
2.1Kegagalan Transformasi Galilei
Selama taransformasi galilei dan transformasi kecepatan menghasilkan sesuatu yang
cocok dengan eksperimen maka transformasi tersebut melanggar kedua postulat relativitas
khusus. Postulat pertama mensyaratkan persamaan-persamaan yang sama kedua persamaan
fisis tersebut baik dalam kerangka S maupun S’. ternyata kesamaan poko dalam kelistrikan
dan kemagnetan memiliki bentuk yang berbeda juka digunakan transformasi galilei untuk
mengubah kuantitas yang terukur pada suatu kerangka acuan ke kuantitas yang setara
dalam kerangka acuan lain. Postulat kedua mensyaratkan harga yang sama untuk kelajuan
cahaya c baik dalam kerangka S maupun S’. jika dilakukan pengukuran kelajuan cahaya
dalam arah x maka dalam sistam S adalah c, sedang dalam system S’ menjadi c’ = c- v.
bertolak dari kedua kenyataan tersebut maka transformasi galilei gagal sebagai cara
penggambaran gejala realivitik secara taat asas.
2.2Transformasi Lorentz
Suatu kejadian seperti kilatan cahaya terjadi di sekitar P , dilaporkan oleh dua
pengamat, pengamat yang satu diam pada kerangka acuan S dan pengamat lainnya dalam
kerangka acuan S’ yang sedang bergerak kekanan
y y’
v
p *kejadian
o x o’ x’
keranka acuan S kerangka acuan S’
Gambar 1 Penampilan suatu kejadian yang terjadi di sekitar P dilaporkan (diamati) oleh pengamat yang
diam dalam kerangka acuan S dan lainnya dalam kerngka acuan S’ yang sedang bergerak
P
a
g
e
5
Dengan kelajuan v, seperti ditunjukkan pada Gambar 1.1 pengamat di S melaporkan
kejadian tersebut dengan koordinat ruang -waktu (x, y,z, t), sedang pengamat dalam S’
melaporkan kejadian yang sama dengan mengunakan koordinat (x’, y’, z’, t’). Kaitan antara x
dan x’ yang rasional adalah memenuhi :
X’ = ( x – vt )
Dengan menyatakan faktor pembanding yang tak bergantung dari besaran x atau
t tetapi dapat merupsksn fungsi v.
2.3Taransformasi balik untuk x
Berpijak pada postulat pertama relativitas khusus maka persamaan fisika harus
berbentuk sama dalam kerangka S dan S’, sehingga kaitan x sebagai fungsi x’ dan t’ dapat
dinyatakan sebagai berikut:
X = ( x’+ vt’)
Sedang pada arah koordinat y’ dan z’ memenuhi persamaan :
Y’ = y
Z’ = z
2.4Transformasi t
Dari S ke S’
t’ =
Dari S’ ke S
t =
P
a
g
e
6
2
Perhatikan nilai seelalu lebih besar atau sama dengan satu.
2.5Rumus Transformasi Lorentz
Denagan memasukkan nilai ke dalam persamaan X’ = ( x – vt ) diperoleh persamaan
transformasi lengkap dari pengukuran suatu kejadian dalam kerangka S terhadap
pengukuran yang sesuai yang dilakukan dalam kerangka S’ :
X’ = x– vt
Y’ = y Z’ = z t’ = t-vx/c2
1-v2/c2
3 Persamaan Transformasi Lorentz Balik
Untuk memperoleh persamaan transformasi balik dilakukan dengan cara
mempertukrkan kuantitas beraksen dengan tanpa aksen dan mengganti v dengan –v sebagai
berikut :
X = x’ + vt’
Y = y’ Z = z’ t = t’+ vx’/c2
P
a
g
e
7
BAB III
DUALISME GELOMBANG ZARAH
A. Dualime Gelombang Zarah
Hipotesa Planck tentang kuantitasi osilator selaras, teori kuantum einstein tentang
cahaya, dan teori hamburan compton, menunjang gagasan dasar bahwa cahaya
terkuantitasi, dan dalam beberapa proses fisis berperilaku separti zarah.
Sifat-sifat cahaya sebagai zarah dapat dikemukakan sebagai berikut :
a. Energi dan kehadirannya terkonsentrasi dalam suatu volume diruang, dan tidak
menyebar kesegala arah.
b. Bergerak dengan kecepatan cahaya (c).
c. Memiliki momentum linier p=E/c, dengan E adalah energi foton.
d. Tidak memiliki massa diam (massa tak geraknya sama dengan nol).
Konsep cahaya sebagai gelombang juga memiliki andasan eksperimental yang
mantap. Interferensi dan difraksi hanya dapat diterangkan dengan merangkap cahaya
adalah gelombang, khususnya geombang elektromagnet. Sebagai gelombang cahaya
dcirikan oleh :
a. Kecepatan rambat dan kecepatan fase.
b. Panjang gelombang atau frekuensi.
Hal ini yang cukup penting adalah representasi cahaya yang dipancarkan dalam waktu
terbatas sebagai paket gelombang, dan interaksinya dengan materi yang dinyatakan dalam
indeks bias. Mengkategorikan prilaku cahaya sesuai dengan tingkat sistem makro
(gelombang) dan sistem mikro ( zarah) pun tidak benar karena dalam sistem atom pancaran
P
a
g
e
8
Kesimpulannya adalah bahwa beberapa gejala fasis hanya dapat diterangkan dengan
menggap bahwa cahaya berprilaku sebagai gelombang, dan beberapa gejala fasis yang
lain keterangan harus berpijak pada perilaku sebagai zarah. Sifat cahaya yang memiliki dua
penampilan ini dinamakan dualisme cahaya,. Dalam dualisme cahaya tidak pernah dua
wujud gelmbang zarah muncul sekaligus dalam satu gejala fasis.
B. Postulat De-Broglie
Louis Victor Duc de Broglie, yang kemudian menjadi pangeran de-Broglie adalag
seorang bangsawan prancis yang mempelajari sejarah pengetahuan Eropa di Unuversitas
Sarbonne Perancis.
De Broglie mengajukan hioitesa bahwa : ” setiap massa yang bergerak didampingi
oleh suatu gelombang pengaruh (pilot waves), Gelombang zat (mater waves) ini senantiasa
mengikuti massa yang bergerak dan memberikan ciri prilaku gelombang pada zarah.
Dalam gambaran de-Broglie, elektron yang mengelilingi atom Bohr didampingi oleh
gelombang pengarah. Kuantitas momentum anguler menurut Bohr, sebetulnya sama dengan
pemenuhan syarat resonasi gelobang pengarah terhadap panjang lintas edar elektron
tersebut didalam atom. Artinya pada orbit Bohr yang pertama panjang lintas edar sama
dengan satu panjang gelombang. Panjang lintas edar orbit kedua sama dengan dua panjang
pengarah.
Kuantitas momentum sudut menurut Bohr :
Ln = nh
Memberikan bahwa :
rn =
yang dapat ituliskan dalam bentuk :
P
a
g
e
9
Untuk bilangan kuantum utama maka n dalam gambar Bohr tentang atom Bohr, lintas edar
elektron adalah n kali panjang gelombang pengarahnya.
2 n = n �n
Sehingga panjang gelombang pengarah adalah :
�n =
Besaran m v adalah momentum besaran p, sehingga :
� =
C. Pstulat De-Broglie
Dualisme gelombang zarah berlaku untuk cahaya, juga berlaku untuk zarah. Setiap zarah
yang bergerak didampingi oleh gelombang zarah. Perilaku gelombang zat berkaitan
dengan perilaku zarahnya tetap seperti halnya dengan cahay. Suatu zarah yang bergerak
dengan momentum linier p, didampingi oleh gerak gelombang zat yang panjang
gelombangnya memenuhi = h/p, dengan h tetapan Planck.
Menurut teori radiasi, energi total radiasi E memenuhi :
E = pc
Sedangkan menurut teori radiasi Planck memberikan :
E = hv
Paduan dua persamaan tersebut memberikan :
Pc = hv
Sehingga untuk radiasi berlaku :
P = =
�
D. Percobaan Davisson-Germer
Perilaku gelombang dimanifestasikan oleh beberapa gejala seperti : interfensi, oleh
P
a
g
e
1
0
memperhatikan gejala-gejala seperti tersebut diatas. Pada tahun 1926 Elsosier menyaratkan
untuk menggunakan berkas elektron yang ditimbulkan pada kristal sebagai cara menguji
perilaku gelombang dari zarah. Kisi kristal dengan jarak atom beberapa angstrom akan
merupakan kisi yang baik untuk difraksi gelombang zat yang menyertai elektron.
Apabila tetapan kisi kristal a (antara atom yang berdekatan) sama besar dalam
tingkat ordenya dengan panjang gelombang v maka gejala difraksi dapat diamati. Misalkan
jarak antara atom a = 1 A0 , maka panjang gelombang v yang diperlukan juga 1 A0. Hal ini
berarti bahwa momentum linier elektron ;
P = � =
= 6,63x10-24 kgms-1
Energi yang diperlukan :
K = =
P
a
g
e
1
1
BAB IV
ATOM BOHR
1. POSTULAT DASAR MOLEKUL ATOM BOHRA
Ada empat postulat yang digunakan untuk menutupi kelemahan model atom
Rutherford,antara lain :
1. Atom hidrrogen diri dari sebuah elektron yang bergerak dalam suatu lintas edar
berbentuk lingkaran yang menggelilingi intinatom ;ngerak elektron tersebut
dipengaruhi oleh gaya coulomb sesuai dengan kaidah mekanika klasik.
2. Lintas edar elektron dalam hidrogen yang mantap hanyalah memiliki harga
momentum
L = n.h = n. h
2π
Dimana n = 1,2,3,... dan disebut sebagai bilangan kuantum utama, dan h adalah
konstanta planck.
3. Dalam lintas edar yang mantap elektron yang menggelilingi inti atom tidak
memancarkan energi elektromagnetik, dalam hal ini energi totalnya E tidak
berubah.
4. Jika suatu atom melakukan transisi dari keadaan energi tinggi Eu kek eadaan
energi lebih rendah E1, sebuah foton dengan energi hu = Eu-E1 diemisikan. Jika
sebuah foton diserap atom tersebut akan bertrasisi kekeadaa energi rendah ke
keadaan energi tinggi.
2. MODEL ATOM BOHR
“ Bohr menyatakan bahwa elektron-elektron hanya menepati orbit-orbit tertentu disekitar inti
atom, yang masing-masing terkait sejumlah energi kelipatan dari suatu nilai kuantum dasar. ( John Gribbin, 2002 )”
Model Bohr dari atom hidrogen menggambarkan elektron-elektron bermuatan negatif
mengorbit pada kulit atom dalam lintasan tertentu menggelilingi inti atom yang bermuatan
positif. Ketika elektron meloncat dari satu orbit ke orbit lainnya selalu disertai dengan
P
a
g
e
1
2
Menurut Bohr :
“ Ada aturan fisika kuantum yang hanya mengizinkan sejumlah tertentu elektron dalam tiap orbit. Hanya ada ruang untuk dua elektron dalam orbit terdekat dari inti. ( John Gribbin, 2005 )”
Model ini adalah pengembangan dari model punding prem (1904), model saturnia
(1904), dan model Ruthetford (1911). Karena model Bohr adalah pengembangan dari model
Ruthetford, banyak sumber mengkombinasikan kedua nama dalam penyebutannya menjadi
model Rutherford-Bohr.
Model Bohr adalah sebuah model primitif mengenai atom hidrogen. Sebagai sebuah
teori, model Bohr dapat dianggap sebagai sebuah pendekatan orde pertama dari atom
hidrogen menggunakan mekanika kuantum yang lebih umum dan akurat, dan dengan
demikian dapat dianggap sebagai model yang telah usang. Namun demikian, karena
kesederhanaannya, dan hasil yang tepat untuk sebuah sisitem tertentu, model Bohr tetap
diajarkan sebagai pengenalan pada mekanika kuantum.
Lintasan yang diizinkan untuk elektron dinomori n = 1, n = 2, n = 3 dst.
Bilangan ini dinamakan bilangan kuantum, huruf K,L,M,N juga digunakan untuk
menamakan.
Jari-jari orbit digunakan dengan 12, 22, 32, 42, ... n2. Untuk orbit tertentu
dengan jari-jari minimum a0 = 0,53 A.
Ao = 4π€hћ2
Me2
Jika elektron tertarik ke inti dan dimiliki oleh orbit n, energi dipancarkan dan
energi elektron menjadi lebih rendah sebesar.
En = - B
N2
B ; konstanta numerik dengan nilai 2,179 x 10-18 J = -13.6ev
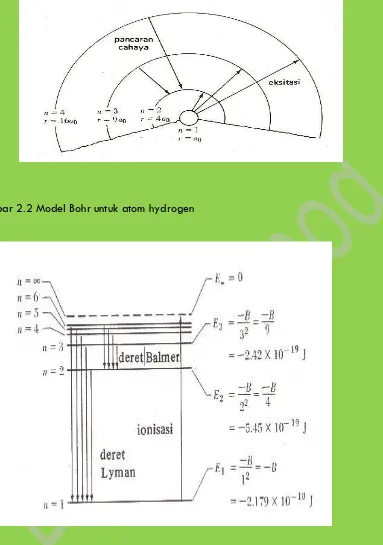
3. TINGKATAN ENERGI ELEKTRON DALAM ATOM HIDROGEN
Model Bohr hanya akurat untuk sistem satu elektron seperti atom hidrogen atau
helium yang terionosasi satu kali. Penurunan rumusan tingkat-tingkat energi atom
hidrogen menggunakan model Bohr.
P
a
g
e
1
3
1) Energi sebuah elektron dalam orbit adalah penjumlahan energi kinetik dan energi
potensialnya:
1 = Ekinetik \ Epotensial
= ⅟2 mrv2– kqr2
r
Dengan k = 1/ (4π€0), dan qe adalah muatan elektron.
2) Momentum sudut elektron hanya boleh memiliki harga disket tertentu:
L = mrur = n h
2π
Dengan n = 1,2,3,... dan disebut bilangan kuantum utama, h adalah konstanta
planck, dan h = h/(2π1).
3) Elektron berada dalam orbit diatur oleh gaya coulomb. Ini berarti gaya coulomb
sama dengan gaya sentripetal:
Kqr2 = mrv2
R2 r
Dengan memasukkan persamaan (6) ke persamaan (4), maka diperoleh
Kqr2mrv2 = mrv2
nh
Suku di sisi menyelesaikan persamaan (2) untuk r, didapatkan harga jari-jari yang
diperkenankan :
R = nh
mrv2
Dengan membagi kedua sisi persamaan (7) dengan mev didapatkan
Kqr2 = v
P
a
g
e
1
4
Dengan memasukkan harga v pada persamaan energi (persamaan (5)), dan
kemudian mensubsitisikan harga untuk k dan h, maka energi pada tingkatan orbit
berbeda dari atom hodrogen dapat ditentukan sebagai berikut :
En = -1 m (kqr2)2
2 nћ
= -1 mr ( 1 qr2 2π )2
2 4π€n nћ
= -mrqr2 1
8ћ2€2v n2
Dengan memasukkan harga semua konstanta, didapatkan
En = ( - 13.6 c V ) 1
N2
Dengan demikian, tingkat energi terendah untuk atom hidrogen (n = 1) adalah
-13.6 ev. Tingkat energi berikutnya (n = 2) adalah -3.4ev. tingkat energi ketiga (n
= 3) adalah -1.51 ev,dan seterusnya. Harga – harga energi ini adalah negatif,
yang menyatakan bahwa elektron dalam keadaan terikat dengan proton. Harga
energi yang positif berhubungan dengan atom yang berada dalam keadaan
terionosasi yaitu ketika elektron tidak lagi terikat, tetapi dalam keadaan tersebar.
4. KELEBIHAN DAN KELEMAHAN TEORI HOHR
Kelebihan
Keberhasilan teori Bohr terletak pada kemampuan meramalkan garis-garis
dalam spektrum atom hidrogen.
Salah satu penemuaan adalah sekumpulam garis halus, terutama jika
atom-atom yang dieksitasikan diletakkan pada medan magnet.
Kelemahan
Struktur garis halus ini dijelaskan melalui modifikasi teori Bohr tetapi teori ini tidak
pernah berhasil memberikan spektrum selain atom hidrogen
Belum mampu menjelaskan adanya struktur halus (fine structure) pada spectrum, yaitu
2 atau lebih garis yang sangat berdekatan
Belum dapat menerangkan spektrum atom kompleks
Itensitas relatif dari tiap garis spektrum emisi
Efek Zeeman, yaitu terpecahnya garis spektrum bila atom berada dalam medan
P
a
g
e
1
5
BAB V
ATOM
1 Sejarah Singkat Mengenai Atom
Di awal abad ke-20, percobaan oleh Ernest Rutherford telah dapat menunjukkan
bahwa atom terdiri dari sebentuk awan difus elektron bermuatan negatif mengelilingi inti
yang kecil, padat, dan bermuatan positif. Berdasarkan data percobaan ini, sangat wajar jika
fisikawan kemudian membayangkan sebuah model sistem keplanetan yang diterapkan pada
atom, model Rutherford tahun 1911, dengan elektron-elektron mengorbit inti seperti layaknya
planet mengorbit matahari. Namun demikian, model sistem keplanetan untuk atom menemui
beberapa kesulitan. Sebagai contoh, hukum mekanika klasik (Newtonian) memprediksi bahwa
elektron akan melepas radiasi elektromagnetik ketika sedang mengorbit inti. Karena dalam
pelepasan tersebut elektron kehilangan energi, maka lama-kelamaan akan jatuh secara
spiral menuju ke inti. Ketika ini terjadi, frekuensi radiasi elektromagnetik yang dipancarkan
akan berubah. Namun percobaan pada akhir abad 19 menunjukkan bahwa loncatan bunga
api listrik yang dilalukan dalam suatu gas bertekanan rendah di dalam sebuah tabung
hampa akan membuat atom atom gas memancarkan cahaya (yang berarti radiasi
elektromagnetik) dalam frekuensi-frekuensi tetap yang diskret.
Pada tahun 1913, Niels Bohr, fisikawan berkebangsaan Swedia, mengikuti jejak
Einstein menerapkan teori kuantum untuk menerangkan hasil studinya mengenai spektrum atom
hidrogen. Bohr mengemukakan teori baru mengenai struktur dan sifat-sifat atom. Teori atom
Bohr ini pada prinsipnya menggabungkan teori kuantum Planck dan teori atom dari Ernest
Rutherford yang dikemukakan pada tahun 1911. Bohr mengemukakan bahwa apabila
elektron dalam orbit atom menyerap suatu kuantum energi, elektron akan meloncat keluar
menuju orbit yang lebih tinggi. Sebaliknya, jika elektron itu memancarkan suatu kuantum
P
a
g
e
1
6
2 Model Atom Bohr
2 .1 Gagasan Utama Model Atom Bohr
Dua gagasan kunci adalah:
1. Elektron-elektron bergerak di dalam orbit-orbit dan memiliki momentum yang
terkuantisasi, dan dengan demikian energi yang terkuantisasi. Ini berarti tidak setiap
orbit, melainkan hanya beberapa orbit spesifik yang dimungkinkan ada yang berada
pada jarak yang spesifik dari inti.
2. Elektron-elektron tidak akan kehilangan energi secara perlahan-lahan sebagaimana
mereka bergerak di dalam orbit, melainkan akan tetap stabil di dalam sebuah orbit
yang tidak meluruh.
2.2 Postulat Dasar Model Atom Bohr
Ada empat postulat yang digunakan untuk menutupi kelemahan model atom
Rutherford, antara lain :
1. Atom Hidrogen terdiri dari sebuah elektron yang bergerak dalam suatu lintas
edar berbentuk lingkaran mengelilingi inti atom ; gerak elektron tersebut
dipengaruhi oleh gaya coulomb sesuai dengan kaidah mekanika klasik.
2. Lintas edar elektron dalam hydrogen yang mantap hanyalah memiliki harga
momentum angular L yang merupakan kelipatan dari tetapan Planck dibagi
dengan 2π.
dimana n = 1,2,3,… dan disebut sebagai bilangan kuantum utama, dan h adalah
P
a
g
e
1
7
3. Dalam lintas edar yang mantap elektron yang mengelilingi inti atom tidak
memancarkan energi elektromagnetik, dalam hal ini energi totalnya E tidak
berubah.
4. Jika suatu atom melakukan transisi dari keadaan energi tinggi EU ke keadaan
energi lebih rendah EI, sebuah foton dengan energi hυ=EU-EI diemisikan. Jika
sebuah foton diserap, atom tersebut akan bertransisi ke keadaan energi rendah
ke keadaan energi tinggi.
2.3 Model dari Atom Bohr
”Bohr menyatakan bahwa elektron-elektron hanya menempati orbit-orbit tertentu disekitar
inti atom, yang masing-masing terkait sejumlah energi kelipatan dari suatu nilai kuantum dasar.
(John Gribbin, 2002)”
Model Bohr dari atom hidrogen menggambarkan elektron-elektron bermuatan negatif
mengorbit pada kulit atom dalam lintasan tertentu mengelilingi inti atom yang bermuatan
positif. Ketika elektron meloncat dari satu orbit ke orbit lainnya selalu disertai dengan
pemancaran atau penyerapan sejumlah energi elektromagnetik hf.
Menurut Bohr :
” Ada aturan fisika kuantum yang hanya mengizinkan sejumlah tertentu elektron dalam
tiap orbit. Hanya ada ruang untuk dua elektron dalam orbit terdekat dari inti. (John Gribbin,
P
a
g
e
1
8
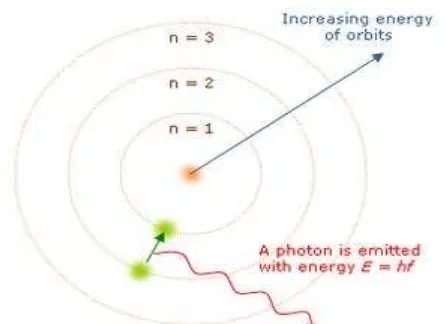
Gambar 2.1 Model Atom Bohr
Model ini adalah pengembangan dari model puding prem (1904), model Saturnian
(1904), dan model Rutherford (1911). Karena model Bohr adalah pengembangan dari model
Rutherford, banyak sumber mengkombinasikan kedua nama dalam penyebutannya menjadi
model Rutherford-Bohr.
Kunci sukses model ini adalah dalam menjelaskan formula Rydberg mengenai
garis-garis emisi spektral atom hidrogen, walaupun formula Rydberg sudah dikenal secara
eksperimental, tetapi tidak pernah mendapatkan landasan teoritis sebelum model Bohr
diperkenalkan. Tidak hanya karena model Bohr menjelaskan alasan untuk struktur formula
Rydberg, ia juga memberikan justifikasi hasil empirisnya dalam hal suku-suku konstanta fisika
fundamental.
Model Bohr adalah sebuah model primitif mengenai atom hidrogen. Sebagai sebuah
teori, model Bohr dapat dianggap sebagai sebuah pendekatan orde pertama dari atom
hidrogen menggunakan mekanika kuantum yang lebih umum dan akurat, dan dengan
demikian dapat dianggap sebagai model yang telah usang. Namun demikian, karena
kesederhanaannya, dan hasil yang tepat untuk sebuah sistem tertentu, model Bohr tetap
P
a
g
e
1
9
Keterangan
Gambar 2.2 Model Bohr untuk atom hydrogen
P
a
g
e
2
0
2.4 Tingkatan energi elektron dalam atom hidrogen
Model Bohr hanya akurat untuk sistem satu elektron seperti atom hidrogen atau helium
yang terionisasi satu kali. Penurunan rumusan tingkat-tingkat energi atom hidrogen
menggunakan model Bohr.
Penurunan rumus didasarkan pada tiga asumsi sederhana:
1) Energi sebuah elektron dalam orbit adalah penjumlahan energi kinetik dan energi
potensialnya:
dengan k = 1 / (4πε0), dan qe adalah muatan elektron.
2) Momentum sudut elektron hanya boleh memiliki harga diskret tertentu:
dengan n= 1,2,3,… dan disebut bilangan kuantum utama, h adalah konstanta Planck,
dan .
3) Elektron berada dalam orbit diatur oleh gaya coulomb. Ini berarti gaya coulomb
sama dengan gaya sentripetal:
P
a
g
e
2
1
Suku di sisi kiri menyatakan energi potensial, sehingga persamaan untuk energi
menjadi:
Dengan menyelesaikan persamaan (2) untuk r, didapatkan harga jari-jari yang
diperkenankan:
Dengan memasukkan persamaan (6) ke persamaan (4), maka diperoleh:
Dengan membagi kedua sisi persamaan (7) dengan mev didapatkan
Dengan memasukkan harga v pada persamaan energi (persamaan (5)), dan
kemudian mensubstitusikan harga untuk k dan , maka energi pada tingkatan orbit
P
a
g
e
2
2
Dengan memasukkan harga semua konstanta, didapatkan,
Dengan demikian, tingkat energi terendah untuk atom hidrogen (n = 1) adalah -13.6
eV. Tingkat energi berikutnya (n = 2) adalah -3.4 eV. Tingkat energi ketiga (n = 3) adalah
-1.51 eV, dan seterusnya. Harga-harga energi ini adalah negatif, yang menyatakan bahwa
elektron berada dalam keadaan terikat dengan proton. Harga energi yang positif
berhubungan dengan atom yang berada dalam keadaan terionisasi yaitu ketika elektron
tidak lagi terikat, tetapi dalam keadaan tersebar.
Dengan teori kuantum, Bohr juga menemukan rumus matematika yang dapat
dipergunakan untuk menghitung panjang gelombang dari semua garis yang muncul dalam
spektrum atom hidrogen. Nilai hasil perhitungan ternyata sangat cocok dengan yang
diperoleh dari percobaan langsung. Namun untuk unsur yang lebih rumit dari hidrogen, teori
Bohr ini ternyata tidak cocok dalam meramalkan panjang gelombang garis spektrum.
Meskipun demikian, teori ini diakui sebagai langkah maju dalam menjelaskan
fenomena-fenomena fisika yang terjadi dalam tingkatan atomik. Teori kuantum dari Planck diakui
kebenarannya karena dapat dipakai untuk menjelaskan berbagai fenomena fisika yang saat
P
a
g
e
2
3
2.3 Kelebihan dan Kelemahan Teori Bohr
2.3.1 kelebihan
o Keberhasilan teori Bohr terletak pada kemampuannya untuk meeramalkan
garis-garis dalam spektrum atom hidrogen
o Salah satu penemuan adalah sekumpulan garis halus, terutama jika atom-atom
yang dieksitasikan diletakkan pada medan magnet
2.3.2 Kelemahan
Struktur garis halus ini dijelaskan melalui modifikasi teori Bohr tetapi teori ini
tidak pernah berhasil memerikan spektrum selain atom hydrogen
Belum mampu menjelaskan adanya stuktur halus(fine structure) pada spectrum,
yaitu 2 atau lebih garis yang sangat berdekatan
Belum dapat menerangkan spektrum atom kompleks
Itensitas relatif dari tiap garis spektrum emisi.
Efek Zeeman, yaitu terpecahnya garis spektrum bila atom berada dalam
P
a
g
e
2
4
BAB VI
SINAR X
2.1 Pembahasan Sinar X
Sinar x adalah radiasi elaktromagnet dgn rentang panjang gelombang kurang lebih
dari 0,01 hingga 10 nm(energinya kurang lebih dari 100 eV hingga 100 keV).Dalam Bab 3
kita membahas spektrum sinar-x kontinu yang dipancarkan oleh elektron yg mengalami
kecepatan. Dalam pasal ini akan kita bahas spektrum sinar-x diskret yg dipancarkan oleh
atom.
Sinar x dipancarkan dalam transisi antara barbagai tingkat energiterisi yang lebih
rendah dari sebuah atom.Elektron-elektron terdalam terikat sedemikian kuatnya sehingga
ukuran lebar antara tingkat energinya memadai bagi pemancaran foton dalam retang
panjang gelombanng sinar X. Sebaliknya, ikatan Elektron-elektron terluar relatif lemah, dan
lebar antara tingkat energinya hanyalah beberapa elektronvolt; dengan demikian transisi
antara tingkat-tingkat ini hanyalah memberikan foton dalam spektrum cahaya tampak.
Transisi”optik” ini akan dibahas dalam pasal berikut.
Karena semua kulit terdalam sebuah atom terisi penuh, maka transisi sinar X tidak akan
pernah terjadi dalam keadaan normal. Sebagai contoh, sebuah elektron 2p tidak dapat
transisi ke supkulit 1s, karena semua atom setelah hidrogen memiliki supkulit 1s yang terisi
penuh. Untuk dapat mengamati transisi seperti ini, kita harus membebaskan sebuah elektron
dari subkulit 1s.Ini dapat dilakukan dengan menembakiatom dengan berkas elektrt-ron(atau
partikel lain) yang dipercepat hingga mencapai anergi yang cukup memadai untuk
menendang keluar sebuah elektron 1ssetelah bertumbukan dengannya.(Ini memerlukan
tegangan memercepat 10.000 V).
Begitu kita berhasil membebaskan satu elektron dari subkulit 1s, elektron dari suatu
P
a
g
e
2
5
dengan memancarkan sebuah foton sinar-X dalam proses ini. Tentu saja, energi foton sama
dengan beda energi keadaan awal dan akhir elektron yang bertransisi.
Didepan kita telah mendefinisikan suatu notasi yang menetapkan kulit n = 1 sebagai
kulit K.Ketika membebaskan satu elektron 1s, kita menciptakan suatu kekosongan dalam kulit
K. Semua sinar X yang dipancarkan dalam proses mengisi kekosongan ini dikenal
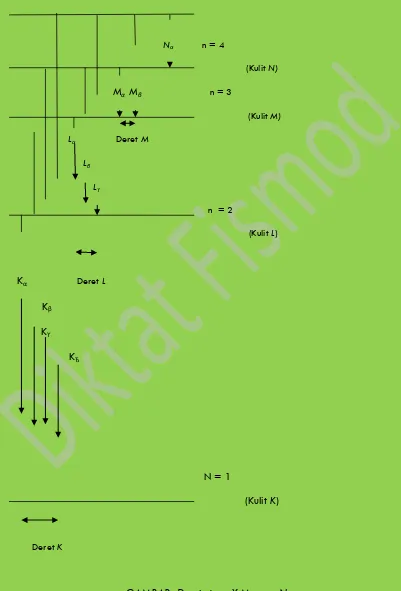
sebag-aisinar X kulit-K, atau secara singkat sinar X K. (Sinar X ini dipancarkan dalam transisi yang
datangnya dari kulit L, M, N, . . .,tetapi mereka dikenal oleh kekosongan yang mereka isi,
bu-kan oleh kulit asal mereka). Sinar X K yang berasal dari kulit n = 2(kulit L)dikenal sebagai
sinar X Kα, dan sinar X K yang berasal dari tinkat-tingkat yang lebih tinggi dikenal sebagai
Kβ, Kϒ, dan seterusnya. Ganbar 8 . 7 menggambarkan transisi-transisi ini.
Dapat pula terjadi bahwa penembakan atom dengan berkas elektron dapat
membebaskan sebuah elektron dari kulit L, dan elektron dari tingkat-tingkat tertinggi akan
segera berpindah ke bawah mengisi.
Kita belum meninjau beda energi dari subkulit dalam kulit utama. Sebagai
contoh, sinar X Lα dapat be-rasal dari salah satu subkulit tingkat n = 3 (3s, 3p, 3d) dan
berakhir pada salah satu subkulit tingkat n = 2 (2s,2p). Karena energi berbagai transisi ini
agak berbeda, maka akan terdapat banyak sekali sinar – X Lα, tetapi energi masing –
masingnya kecil sekali dibandingkan terhadap bada energi antara sinar X Lα dan Lβ. Dalam
praktek, ternyata kita tidak melihat pemisahan energi yang kecil ini.
Marilah kita tinjau sinar X Kα secara lebih terinci. Sebuah elektron pada kulit L
dihalangi oleh dua elektron 1 s, sehingga muatan inti efektifyang dirasakan adalah Zefektif = Z
– 2. Apabila salah satu elektron 1s tersebut dibebaskan guna menciptakan sebuah
kekosongan dalam kulit – K, maka hanya elektron 1s tersisa yang menghalangi kulit L,
elektron-P
a
g
e
2
6
elektron terluar karena sangat kecil; rapat probabilitasnya memang tidak nol didalam orbit
kulit-L, tetapi pengaruhnya pada Zefektif kecil sekali sehingga dapat diabaikan). Sinar X Kα
dengan demikian dapat dianalisis sebagai transisi dari kulit n = 2 ke kulit n = 1 dalam atom
elektron-satu dengan Zefektif = Z – 1. Dengan menggunakan hubungan (6.40) jam (6.43) bagi
model Bohr yang dikembangkan dalam bab 6, didapati bahwa frekuensi transisi Kα dalam
sebuah atom dengan nomor atom Z diberi oleh
3c R∞
v = (z -1 )2
4
Jika kita merajah data v sebagai fungsi dari Z, akan kita peroleh sebuah grafik
garis lurus dengan kemiringan (3cR∞/4)1/2. Gambar 8.9 adalah contoh gambar rajahan
tersebut. (Secara kebetulan, hasil ini tidak bergantung pada anggapan kita mengenai nilai
sebenarnya dari efek hilang. Artinya, kita dapat menulis Zefektif = Z – K, dengan K suatu
bilangan tidak diketahui, mungkin dekat ke 1. Satu-satunya perubahan dalam gambar
rajahan kita adalah pada titik potongnya. Jadi, kita tetap memperoleh grafik garis lurus
dengan kemiringan yang sama).
Metode ini memberi kita suatu cara yang sangat ampuh namun sederhana untuk
menentukan nomor atom Z suatu atom, sebagai mana pertama kali diperagakan pada tahun
1913 oleh fisikawan muda inggris,H. G. J. Moseley. Ia mengukur energi sinar-X Kα (dan
lainya)dari berbagai unsur dan dengan demikian menentukan nomor atomnya. Moseley
adalah fisikawan pertama yang memperagakan hubungan linier yang diperlihatkan pada
Gambar 8.9; grafik seperti ini kini dikenal sebagai grafik Moseley. Penemuanna memberikan
P
a
g
e
2
7
3
Kemiringan =
2
5,00 × 107
1 Titik potong
= 1
0
0 10 20 30 40 50 60
Nomor Atom Z
Cara baru untuk mengukur nomor atom berbagai unsur. Sebelumnya, unsur dalam
susunan berkala disusun berdasarkan pertambahan massa. Moseley kemudian menemukan
bahwa terdapat beberapa unsur yang tidak mengikuti aturan tersebut; unsur dengan Z yang
lebih besar memiliki massa yang lebih kecil (lihat, misalnya, kobal dan mikel atau iodin dan
telurium). Ia juga menemukan beberapa kotak kosong dalam susunan berkala yang
berhubungan dengan unsur yang belum ditemukan; sebagai contoh, unsur radioaktif alam
teknetium (Z = 43) (yang hanya dapat dihasilkan dalam laboratorium) belum dikenal
ketika Moseley melakukan penelitianya, tetapi ia memperlihatkan adanya sebuah kotak
kosong (dalam susunan berkala) pada Z = 43.
Pekerjaan Moseley ternyata sangat penting dalam pengembangan fisika atom. Moseley
P
a
g
e
2
8
mendukung model Rutherford-Bohr, tetapi juga memperlihatkan hubungan erat antara susunan
berkala, yang semulanya merupakan suatu skema pengelompokan unsur biasa, dan teori
atom.
Nα n = 4
(Kulit N)
Mα Mβ n = 3
(Kulit M)
Lα Deret M
Lβ
Lϒ n = 2
(Kulit L)
Kα Deret L
Kβ
Kϒ
KЂ
N = 1
(Kulit K)
Deret K
P
a
g
e
2
9
Kekosongan itu. Foton yang dipancarkan dalam berbagai transisi ini dikenal sebagai
sinar X Lα. Sinar X deret L berenergi terendah dikenal sebagai Lα, dan sinar X L lainnya
dinamai menurut urutan pertambahan energi seperti yang diperlihatkan pada gambar 8.7.
Tentu saja, mungkin pula terjadi bahwa sebuah sinar X L langsung dipancarkan setelah
sinar X kα. Satu kekosongan dalam kulit K dapat diisi oleh transisi dari kulit L, dengan
pemancaran sinar X Kα. Tetapi, elektron yang meloncat dari kulit L meninggalkan pula suatu
kekosongan pada kulit L, yang kemudian akan diisi oleh sebuah elektron dari kulit yang lebih
tinggi, disertai pemancaran sinar X L.
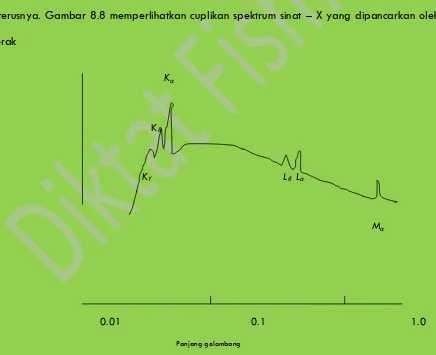
Dengan cara yang sama kita namai deret sinar-X lainnya dengan M,N,dan
seterusnya. Gambar 8.8 memperlihatkan cuplikan spektrum sinat – X yang dipancarkan oleh
perak
Kα
Kβ
Kϒ Lβ Lα
Mα
0.01 0.1 1.0
Panjang gelombang
Gambar 8 Spektrum sinar – X khas perak, yang dapat dihasilkan oleh berkas elektron
30 keV yang membentur suatu sasaran perak. Distribusi kontinu adalah spektrum
P
a
g
e
3
0
BAB VII
APLIKASI FISIKA MODERN
1. FISIKA MODERN
Fisika modern merupakan salah satu bagian dari ilmu Fisika yang mempelajari
perilaku materi dan energi pada skala atomik dan partikel-partikel subatomik atau
gelombang. Pada prinsipnya sama seperti dalam fisika klasik, namun materi yang dibahas
dalam fisika modern adalah skala atomik atau subatomik dan partikel bergerak dalam
kecepatan tinggi. Untuk partikel yang bergerak dengan kecepatan mendekati atau sama
dengan kecepatan cahaya, perilakunya dibahas secara terpisah dalam teori relativitas
khusus. Ilmu Fisika Modern dikembangkan pada awal abad 20, dimana
perumusan-perumusan dalam Fisika Klasik tidak lagi mampu menjelaskan fenomenafenomena yang
terjadi pada materi yang sangat kecil.
Fisika Modern diawali oleh hipotesa Planck yang menyatakan bahwa besaran energi
suatu benda yang beosilasi (osilator) tidak lagi bersifat kontinu, namun bersifat diskrit
(kuanta), sehingga muncullah istilah Fisika Kuantum dan ditemukannya konsep dualisme
partikel-gelombang. Konsep dualisme dan besaran kuanta ini merupakan dasar dari Fisika
Modern. Dalam makalah ini dibahas konsep, hipotesa dan eksperimen yang menjadikan
landasan pengembangan fisika modern serta penerapan fisika modern, dalam berbagai
bidang seperti kedokteran, telekomikasi, dan industri.
2. APLIKASI FISIKA MODERN DALAM BIDANG KOMUNIKASI, INDUSTRI, ASTRONOMI,
KESEHATAN, DAN MILITER
1. Komunikasi
Komunikasi di dasar yang paling adalah proses transmisi informasi dari sumber ke
penerima. Transmisi informasi yang cepat jarak jauh dan akses mudah ke informasi telah
menjadi fitur penting dari dunia modern. Fisika dan Fisikawan telah berada di garis depan
revolusi teknologi ini.
Ketika kita menggunakan telepon seluler, energi suara diubah menjadi energi
elektromagnetik (gelombang mikro - frekuensi radio gelombang tinggi) dan ditransfer dari
sumber ke penerima melalui pemancar radio. Energi elektromagnetik ini kemudian diubah
kembali menjadi energi suara oleh penerima.
P
a
g
e
3
1
Radiasi EM memiliki banyak efek dan menggunakan dalam kehidupan sehari-hari.
Sebagaimana disebutkan di atas, pita radio yang digunakan secara luas untuk komunikasi
dari semua jenis. The Ultra-High Frequency (UHF) band, mulai dari 300 megahertz (MHz)
untuk 3.000 MHz digunakan terutama untuk komunikasi dengan peluru kendali, dalam
navigasi pesawat terbang, radar, dan dalam transmisi televisi. Stasiun radio FM
menggunakan Sangat High Frequency (VHF) band dari 30 MHz hingga 300 gelombang
pendek radio.
Gelombang radio
Gelombang radio dapat dideteksi oleh kombinasi (i) udara untuk menerima gelombang
elektromagnetik dan mengubahnya menjadi osilasi listrik dan (ii) dioda dalam sirkuit
elektronik tepat didengarkan di penerima yang menghasilkan sinyal audio-frekuensi.
Gelombang radio banyak digunakan dalam bidang komunikasi. Gelombang radio dapat
mencapai tempat-tempat yang jauh karena gelombang ini mudah dipantulkan oleh partikel
bermuatan yang berada di lapisan atosfer bumi (ionosfer). Oleh karena itu gelombang ini
digunakan untuk membawa informasi baik dalam bentuk modulasi amplitudo (AM) maupun
modulasi frekuensi (FM).
Cahaya tampak
Cahaya tampak adalah cara dengan mana kita memandang dunia, terutama oleh
refleksi. Hal ini juga digunakan dalam komunikasi untuk mengangkut volume besar informasi
lebih besar jarak sangat oleh refleksi internal cahaya dalam serat optik. Gelombang cahaya
memiliki frekuensi tinggi dan pembawa kapasitas informasi yang meningkat sinyal dengan
frekuensi, membuat cahaya yang sempurna untuk pekerjaan itu. Cahaya terdeteksi oleh mata
kita, oleh sel foto, kamera dan dioda peka cahaya.
Gelombang televisi
Dengan frekuensi lebih tinggi daripada gelombang radio, gelombang televise mermbat
lurus sehingga tidak dapat dipantulkan oleh lapisan-lapisan atmosfer bumi. Untuk
menangkapsiaran televisi dari stasiun pemancar di Jakarta, misalnya di wilayah Bukit Tinggi
dibangun sebuah stasiun penghubung (relay) yang letaknya di puncak Gunung Merapi dan
untuk wilayah Medan dibangun di daerah Bandar Baru.
2. Industri
Sinar gamma merupakan sebuah bentuk radiasi mengionisasi; mereka lebih menembus
dari radiasi. Sinar gamma mempunyai daya tembus yang sangat besar, bahkan dapat
menembus baja sehingga dalam bidang industri dimanfaatkan untuk memotong baja dan
P
a
g
e
3
2
diperhitungkan bahwa sinar gamma diserap lebih banyak oleh bahan dengan nomor atom
tinggi dan kepadatan tinggi. Juga, semakin tinggi energi sinar gamma, makin tebal perisai
yang dibutuhkan.
3. Astronomi
Astronomi adalah ilmu yang melibatkan pengamatan dan penjelasan kejadian yang
terjadi di luar bumi dan atmosfernya. Dalm astronomi, informasi sebagian besar didapat dari
deteksi dan analisis radiasi elektromagnetik, foton, tetapi informasi juga dibawa oleh sinar
kosmik, neutrino, dan dalam waktu dekat gelombang gravitasional.
4. Kesehatan
Penggunaan Cahaya Tampak dalam Bidang Medis
Cahaya tampak digunakan dalam kedokteran karena memungkinkan bagi fisikawan
mendapatkan informasi visual tentang pasien. Misalnya, warna dari seseorang, adanya
ketidaknormalan struktur tubuh seseorang. Yang paling utama adalah kita dapat melihat
berbagai peralatan seperti ophtalmoscope untuk melihat ke bagian dalam mata, otoscope
untuk melihat bagian dalam telinga pada dasarnya menggunakan cahaya tampak yang
difokuskan ke bagian yang kita hendaki.
Inframerah
Kondisi-kondisi kesehatan dapat didiagnosis dengan menyelidiki pancaran inframerah
dari tubuh. Foto inframerah khusus disebut termogram digunakan untuk mendeteksi masalah
sirkulasi darah, radang sendi dan kanker. Radiasi inframerah dapat juga digunakan dalam
alarm pencuri. Seorang pencuri tanpa sepengetahuannya akan menghalangi sinar dan
membunyikan alarm.
Cahaya inframerah dapat dipancarkan dari benda yang panas, vibrasi tingkat
molekuler. Oleh karena itu cahaya inframerah digunakan dalam instrumentasi spektroskopi
iframerah. Peralatan ini digunakan untuk analisis ikatan krbon, gugus fungsional dari suatu
material. Dalam bidang teknologi penginderaan jauh (remote sensing) sinar inframerah
digunakan dalam usaha untuk mendeteksi kondisi lingkungan bumi, seperti adanya kebakaran
hutan, perubahan yang terjadi di permukaan bumi, pemetaan, penglihatan dalam gelap.
Ultraviolet
Sinar ultraviolet merupakan gelombang elektromagnetik yang mempunyai frekuensi
antara 1015 Hz sampai 1016 Hz. Sinar ultraviolet dihasilkan dari atom dan molekul dalam
P
a
g
e
3
3
dalam asimilasi tumbuhan dan dapat membunuh kuman-kuman penyakit kulit. Sinar ultraviolet
dari matahari dalam kadar tertentu dapat merangsang badan Andamenghasilkan vitamin D.
Sinar X
Sinar-X ditemukan oleh Whilthem Konrad Rontgen sehingga sinar-X sering disebut
sinar Rontgen. Sinar-X memiliki daya tembus yang kuat. Frekuensinya antara1016 Hz – 1020
Hz. Sinar X ini biasa digunakan dalam bidang kedokteran untuk memotret kedudukan tulang
dalam badan terutama untuk menentukan tulang yang patah. Akan tetapi penggunaan sinar
X harus hati-hati sebab jaringan sel-sel manusia dapat rusak akibat penggunaan sinar X yang
terlalu lama.
5. Militer
Pada bidang militer, dibuat teleskop inframerah yang digunakan melihat ditempat
yang gelap ataupun berkabut. Selain itu, sinar inframerah dibidang militer dimanfaatkan
satelit untuk memotret permukaan bumi meskipun terhalang oleh kabut atau awan.
Gelombang Mikro
Panjang gelombang radiasi gelombang mikro berkisar antara 0,3 ± 300 cm. Gelombang
mikro merupakan gelombang radio dengan frekuensi paling tinggi, yaitu dapat mencapai
3x109 Hz. Radar menggunakan gelombang mikro. Antena radar dapat bertindak sebagai
pemancar dan penerima gelombang elektromagnetik. Pengiriman gelombang dilakukan
secara terarah berbentuk pulsa dalam selang waktu tertentu.
Gelombang radar diaplikasikan untuk mendeteksi suatu objek, memandu pendaratan
pesawat terbang, membantu pengamatan di kapal laut dan pesawat terbang pada malam
P
a
g
e
3
4
DAFTAR PUSTAKA
Beiser,A. (1990). (Trans; The Houw Liong). Kensep Fisika Modern Edisi 4. Jakarta : Airlangga.
Hariyadi Supangkat. (1995). Fisika Kuantum. Bandung : ITB
Melissinos, A.C. (1966). Experiments in Modern Physics. New York : Academic Press