LAPORAN PRAKTIKUM
REKAYASA BIOPROSES
Materi : Kinetika Reaksi Enzimatis Tanggal : 22 Maret 2012 Asisten : Edi OLEH: YUSRINA RAKHMAH P051114031/BTK BIOTEKNOLOGI SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Kinetika reaksi enzimatik enzim α-amilase terhadap substrat amilum
Yusrina Rakhmah
Mahasiswa Pascasarjana Bioteknologi, Sekolah Pascasarjana, Institut Pertanian Bogor
Abstrak
Amilase merupakan enzim yang mengkatalisis reaksi hidrolisis pati menjadi gula‐gula sederhana, seperti maltosa, maltotriosa, dan glukosa. Amilase merupakan biokatalisator yang mempercepat jalannya reaksi tampa ikut bereaksi.
Kinetika reaksi enzimatik enzim α-amilase terhadap substrat amilum dilakukan dengan mengukur kecepatan reaksi enzim α-amilase terhadap substrat amilum pada beberapa konsentrasi substrat, yaitu 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, pada pH (7) dan suhu tetap (90-95oC), serta
menghitung Km dan Vmax enzim. Nilai Km yang diperoleh pada praktikum kali ini
adalah 0,4892, menunjukkan bahwa enzim α-amilase mempunyai afinitas rendah terhadap substrat, sehingga kesetimbangan reaksi kearah E + S. Vmax atau kecepatan
maksimum dari reaksi enzimatis ini diperoleh dengan nilai 12,64 ppm/menit, yang artinya pada enzim α-amilase dapat mengubah substrat amilum menjadi glukosa sebesar 12,64 ppm tiap menitnya. Kecepatan laju reaksi enzimatik dipengaruhi oleh kadar substrat dan enzim. Pada penambahan substrat sampai jumlah tertentu dengan jumlah enzim yang tetap akan mempercepat reaksi enzimatik sampai mencapai maksimum. Namun penambahan substrat selanjutnya tidak akan menambah kecepatan reaksi.
Kata kunci: enzim α-amilase, substrat, kinetika enzim.
1 Pendahuluan
1.1 Latar Belakang
Amilase merupakan enzim yang penting dalam bidang pangan dan bioteknologi. Amilase
merupakan enzim yang
mengkatalisis reaksi hidrolisis pati menjadi gula‐gula sederhana. Amilase mengubah karbohidrat yang merupakan polisakarida menjadi maltosa (alfa dan beta) ataupun
glukosa (glukoamilase). Amilase dapat diperoleh dari berbagai sumber seperti tanaman, binatang dan mikroorganisme. Saat ini sejumlah enzim amilase telah diproduksi secara komersial. Penggunaan mikroba dianggap lebih prosepektif karena mudah tumbuh, cepat
menghasilkan dan kondisi
lingkungan dapat dikendalikan (wordpress.com, 2010). Untuk produksi enzim amilase dapat menggunakan berbagai sumber karbon, seperti molase, amilum, tepung jagung, tepung tapioka, dan sebagainya.
Amilase sendiri adalah enzim yang merupakan biokatalisator yang mempercepat jalannya reaksi tampa ikut bereaksi. Pada umumnya enzim bekerja mengkatalis reaksi satu arah, meskipun ada yang mengkatalis reaksi dua arah. Enzim bekerja secara spesifik, karena sisi aktif enzim setangkup dengan permukaan subtrat tertentu. Umumnya enzim tidak dapat bekerja tanpa adanya suatu zat non protein tambahan yang disebut kofaktor. Enzim bersifat thermolabil, mudah rusak bila dipanaskan lebih dari 60°C. Enzim merupakan senyawa protein,
sehingga sifat protein masih melekat pada enzim. Enzim dibutuhkan dalam jumlah sedikit, sebagai biokatalisator, reaksinya menjadi sangat cepat dan berulang ulang. Enzim dapat bekerja didalam sel (endoenzim) dan diluar sel (ektoenzim). Enzim bekerja dengan membentuk kompleks substrat sebelum membentuk produk.
Reaksi enzimatik merupakan reaksi spesifik yang dipengaruhi oleh beberapa faktor, antara lain suhu, pH, tekanan, substrat dan jenis reaksinya. Pada praktikum ini, suhu dan pH dibuat tetap untuk menetapkan nilai Km dan aktivitas tertinggi dari enzim α-amilase. Laju kinetika enzim dapat diukur berdasarkan penurunan konsentrasi substrat dan pengambilan contoh yang dapat dilakukan selama reaksi berlangsung
(Mangunwidjaja dan Suryani, 1994). Kecepatan reaksi enzimatik juga dipengaruhi kadar enzim, jumlah enzim yang terikat substrat (ES) dan konstanta Michaelis (Km). Km menggambarkan kesetimbangan disosiasi kompleks ES menjadi enzim dan substrat. Nilai Km kecil
berarti enzim mempunyai afinitas tinggi terhadap substrat maka kompleks ES sangat mantap, sehingga kesetimbangan reaksi kearah kompleks ES. Apabila nilai Km besar berarti enzim mempunyai afinitas rendah terhadap substrat, sehingga kesetimbangan reaksi kearah E + S.
1.2 Tujuan
Tujuan praktikum ini adalah untuk mempelajari kinetika reaksi enzimatik enzim alpha-amilase terhadap substrat amilum dan menghitung Km dan V max enzim.
2 Metodologi
2.1; Alat dan Bahan
Alat yang digunakan pada praktikum ini waterbath (suhu 90 – 95oC), spektrofotometer, tabung
reaksi, gelas ukur, timbangan, vortex, erlenmeyer, dan stop watch.
Bahan yang digunakan untuk
enzim α-amilase, substrat (larutan amilum) dengan konsentrasi 0,1%, 0,2%, 0,3%, 0,4% dan 0,5%, buffer fosfat sitrat pH 7.00 50 mM, standar glukosa, pereaksi DNS (garam Na K tartat + NaOH + aquades + DNS).
2.2; Cara Kerja
2.2.1 Pembuatan kurva standar
Standar glukosa dibuat dengan menyiapkan larutan glukosa murni dengan konsentrasi 0,0 mg/mL sampai 0,35 mg/mL dengan selang 0,05. Sebanyak 1 mL dari masing-masing larutan glukosa murni dimasukkan ke dalam tabung reaksi dan ditambah 3 mL pereaksi DNS.
Larutan divortex untuk
dihomogenisasai kemudian
dipanaskan dalam air mendidih selama tepat 5 menit (gunakan stop watch). Blanko dibuat dengan
mengganti sampel dengan akuades dan diperlakukan sama. Setelah itu diukur absorbansinya pada spektrofotometer dengan panjang gelombang (λ) 550 nm. Kurva standar dibuat dengan memplot data konsentrasi glukosa murni (sumbu X) versus absorbansinya (sumbu Y). Catat pada tabel. 2.2.2 Pengukuran kecepatan reaksi Enzim α-amilase terhadap substrat amilum pada
beberapa konsentrasi substrat
Prinsip pengukuran kecepatan reaksi enzimatis ini ialah laju hidrolisa amilum diukur dari glukosa yang terbentuk oleh reaksi enzim α-amilase terhadap substrast amilum.
Sebanyak 10 mL substrat amilum dengan konsentrasi 0,1%, 0,2%, 0,3%, 0,4%, 0,5% dibuat dengan melarutkan amillum sesuai konsentrasi pada buffer fosfat sitrat pH 7. Substrat tersebut diinkubasi pada suhu 90-95oC. Pada
masing-masing tabung substrat tersebut ditambahkan larutan enzim + buffer (0,1 mL enzim ditambah 0,9 mL buffer fosfat sitrat pH 7, 50 mM, kemudian dipanaskan pada suhu 90-95oC selama 5 menit). Campuran
enzim substrat diinkubasi kembali pada suhu 90-95oC dan setiap 5
menit diambil sampel sebanyak 1 mL. Sampel tersebut ditambah 3 mL DNS, dipanaskan dalam air mendidih selama 5 menit dan diukur absorbansinya pada λ 550 nm. Catat pada Tabel 2. Kadar glukosa yang dibentuk oleh hasil hidrolisis enzim terhadap substrat amilum diukur dengan memplotkan absorbansi pada kurva standar di atas (pekerjaan no. 1) dan dicatat pada Tabel 3.
3 Hasil
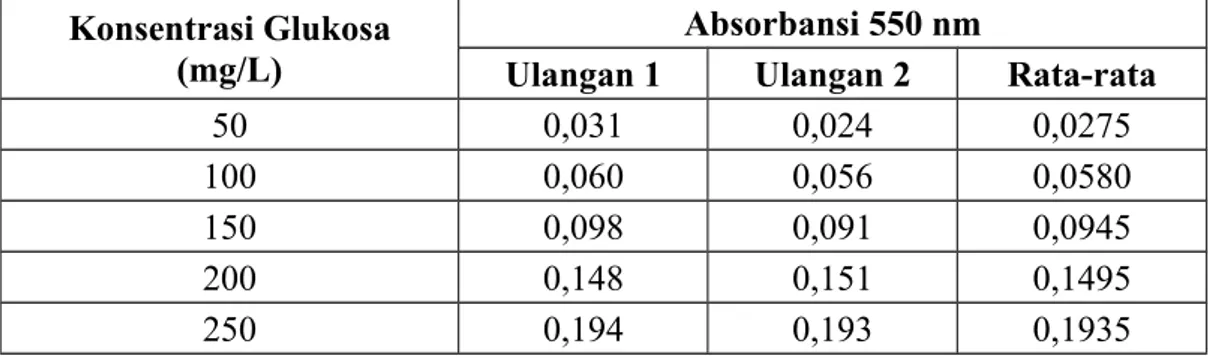
Hasil pembuatan kurva standar glukosa diperoleh absorbansi dari setiap konsentrasi glukosa yang ditunjukkan dalam Tabel 1. Sedangkan grafik kurva standar glukosa, seperti yang ditunjukkan pada Gambar 1.
Tabel 1 Absorbansi (sumbu Y) pada setiap konsentrasi glukosa murni (sumbu X).
Konsentrasi Glukosa (mg/L)
Absorbansi 550 nm
Ulangan 1 Ulangan 2 Rata-rata
50 0,031 0,024 0,0275
100 0,060 0,056 0,0580
150 0,098 0,091 0,0945
200 0,148 0,151 0,1495
300 0,229 0,269 0,2490
350 0,313 0,321 0,3170
Gambar 1 Kurva Standar Glukosa Hasil pengukuran
absorbansi dengan panjang gelombang (λ) 550 nm pada berbagai konsentrasi amilum yang dihidrolisis oleh amilase
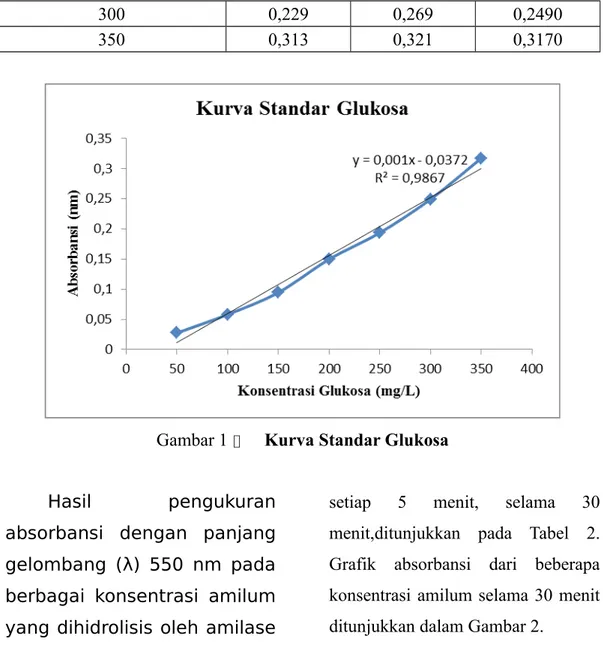
setiap 5 menit, selama 30 menit,ditunjukkan pada Tabel 2. Grafik absorbansi dari beberapa konsentrasi amilum selama 30 menit ditunjukkan dalam Gambar 2.
Tabel 2 Absorbansi 550 nm pada berbagai konsentrasi amilum yang dihidrolisis oleh amilase setiap selang 5 menit.
Waktu (menit)
Absorbansi λ 550 nm (nm) Amilum
0,1% Amilum 0,2% Amilum 0,3% Amilum 0,4% Amilum 0,5%
0 0,367 0,456 0,465 0,686 0,743 5 0,361 0,435 0,554 0,510 0,739 10 0,378 0,487 0,563 0,373 0,526 15 0,396 0,489 0,961 0,499 0,527 20 0,412 0,498 0,413 0,585 0,554 25 0,436 0,498 0,707 0,583 0,527 30 0,426 0,476 0,748 0,299 0,536
Gambar 2 Absorbansi pada beberapa konsentrasi amilum selama 30 menit.
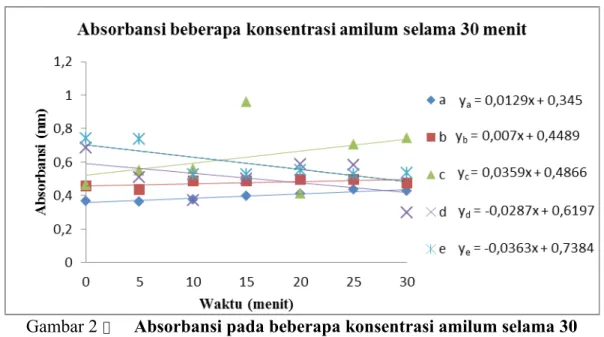
Sedangkan konsentrasi glukosa yang diperoleh dari hasil hidrolisis oleh amilase terhadap berbagai konsentrasi substrat amilum setiap 5 menit, selama 30 menit, ditunjukkan
pada Tabel 3. Grafik konsentrasi glukosa pada beberapa konsentrasi amilum selama 30 menit ditunjukkan pada Gambar 3.
Tabel 3 Konsentrasi glukosa yang diperoleh dari hasil hidrolisis oleh amilase terhadap berbagai konsentrasi substrat amilum setiap selang 5 menit. Waktu (menit) Konsentrasi Glukosa (mg/mL) Amilum 0,1% Amilum 0,2% Amilum 0,3% Amilum 0,4% Amilum 0,5% 0 404 493 502 723 780 5 398 472 591 547 776 10 415 524 600 410 563 15 433 526 998 536 564 20 449 535 450 622 591 25 473 535 744 620 564 30 463 513 785 336 573
Gambar 3 Konsentrasi glukosa pada beberapa konsentrasi amilum selama 30 menit.
Dari persamaan yang diperoleh dari konsentrasi glukosa pada beberapa konsentrasi amilum selama 30 menit, dapat dinyatakan bahwa y = ax + b, dimana a adalah slope dan dapat dinyatakan sebagai kecepatan reaksi (v) dari masing‐masing
konsentrasi substrat (s) amilum. Apabila a adalah kecepatan reaksi (v) dan b adalah substrat (s), maka dengan pengalihan persamaan Michelis‐Menten dapat diperoleh data seperti yang dapat dilihat pada tabel 4.
Tabel 4 Nilai kadar substrat amilum (s) terhadap kecepatan reaksi enzimatis (v) dan pengalihan persamaan Michelis‐Menten (1/s dan 1/v). s (%) v(ppm/menit) 1/s 1/v 0.1 12,8930 10,0000 0,0776 0.2 7,0357 5,0000 0,1421 0.3 35,8930 3,3333 0,0279 0.4 -28,6790 2,5000 -0,0349 0.5 -36,3210 2,0000 -0,0275
Dari data pengalihan
persamaan yaitu dengan
menggunakan nilai 1/s dan 1/v, dibuat lagi persamaan untuk mendapatkan nilai Km dan Vmax dari
proses reaksi enzimatis α‐
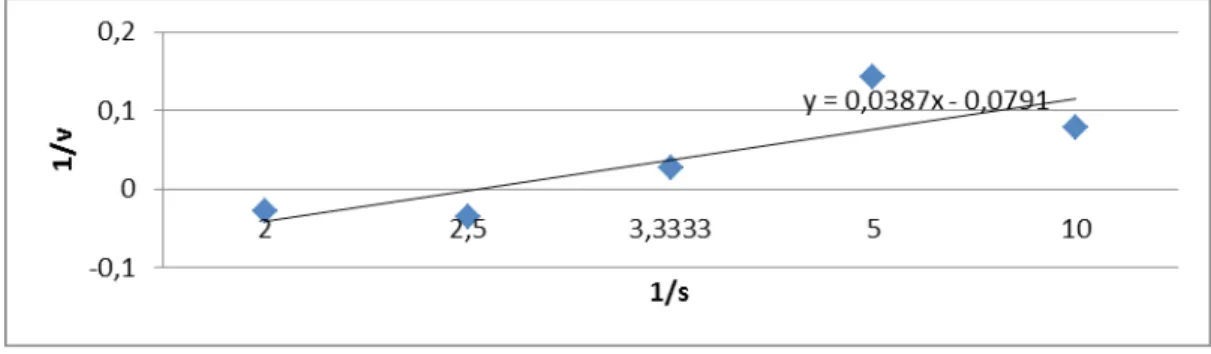
amilase terhadap substrat amilum sehingga diperoleh kurva seperti yang terlihat pada Gambar 4.
Gambar 4 Kurva reaksi enzimatis α‐amilase terhadap substrat amilum.
Dari gambar 4. diperoleh persamaan yaitu y = ‐0.0387x - 0.0791 dimana nilai a = 0.0387 dan nilai b = ‐0.0791. Dari pengalihan persamaan Michelis‐Menten, yaitu: maka, dapat diketahui bahwa nilai b = dan nilai a = . Sehingga dari persamaan tersebut dapat diperoleh bahwasanya nilai Vmax adalah 1/b
dimana nilai b adalah -0.0791, maka nilai Vmax = 12,64 ppm/menit,
sedangkan nilai Km dapat diketahui
dengan metode subtitusi nilai Vmax ke
persamaan nilai a = Km/Vmax,
sehingga , maka nilai Km adalah 0,4892.
4 Pembahasan
Berdasarkan hasil pembuatan kurva standar glukosa diperoleh absorbansi dari setiap konsentrasi
glukosa dengan persamaan, sebagai berikut:
Dimana, y merupakan nilai absorbansi dari glukosa pada panjang gelombang 550 nm, dan x merupakan konsentrasi glukosa. Dari persamaan ini, maka dapat diperoleh kadar glukosa yang dibentuk oleh hasil hidrolisis enzim terhadap substrat amilum dengan memplotkan absorbansi beberapa konsentrasi amilum pada persamaan, seperti pada gambar 3.
Dari hasil grafik konsentrasi glukosa pada beberapa konsentrasi amilum selama 30 menit diketahui bahwa, konsentrasi glukosa meningkat seiring lama waktu fermentasi, namun peningkatan tersebut juga dipengaruhi konsentrasi amilum. Ini dapat dilihat dari penurunan garis linier yang terjadi pada konsentrasi amilum 0,4% dan
0,5%. Hal ini menunjukkan bahwa konsentrasi substrat yang tinggi dapat menghambat laju pembentukan produk.
Menurut Mangunwidjaja dan Suryani (1994), pada reaksi dikatalisis enzim, laju kinetik pada konsentrasi substrat yang rendah merupakan garis lurus dan akan terhambat atau bahkan hilang pada konsentrasi substrat yang lebih tinggi.
Reaksi enzimatik merupakan reaksi spesifik yang dipengaruhi oleh beberapa faktor, antara lain suhu, pH, tekanan, substrat dan jenis reaksinya. Pada proses inkubasi dalam praktikum ini digunakan suhu 90-950C ditujukan untuk mengoptimalkan aktivitas enzim amilase. Enzim α-amilase pada umumnya memiliki aktivitas kerja pada kisaran suhu 250C sampai 950C (Poliana dan MacCabe, 2007). Enzim α-amilase akan memotong ikatan glikosidik α-1,4 pada molekul pati (karbohidrat), sehingga terbentuk molekul-molekul karbohidrat yang lebih pendek (Rodriguez, et al., 2007). Hasil dari pemotongan enzim
ini antara lain maltosa, maltotriosa, dan glukosa.
Pada praktikum ini, suhu dan pH dibuat tetap untuk menetapkan nilai Km dan aktivitas tertinggi dari enzim α-amilase. Laju kinetika enzim diukur berdasarkan penurunan konsentrasi substrat dan pengambilan contoh yang dapat dilakukan selama reaksi berlangsung. Kecepatan laju reaksi enzimatik dipengaruhi oleh kadar substrat dan enzim. Pada penambahan substrat sampai jumlah tertentu dengan jumlah enzim yang tetap akan mempercepat reaksi enzimatik sampai mencapai maksimum. Namun penambahan substrat selanjutnya tidak akan menambah kecepatan reaksi.
Kecepatan reaksi enzimatik juga dipengaruhi kadar enzim, jumlah enzim yang terikat substrat (ES) dan konstanta Michaelis (Km).
Km menggambarkan kesetimbangan
disosiasi kompleks ES menjadi enzim dan substrat. Nilai Km kecil
berarti enzim mempunyai afinitas tinggi terhadap substrat maka kompleks ES sangat mantap, sehingga kesetimbangan reaksi kearah kompleks ES. Apabila nilai
Km besar berarti enzim mempunyai afinitas rendah terhadap substrat, sehingga kesetimbangan reaksi kearah E + S.
Nilai Km yang diperoleh pada
praktikum kali ini adalah 0,4892. Ini menunjukkan bahwa nilai Km
besar yang berarti enzim α-amilase
mempunyai afinitas rendah terhadap substrat, sehingga kesetimbangan reaksi kearah E + S. Vmax atau
kecepatan maksimum dari reaksi enzimatis ini diperoleh dengan nilai 12,64 ppm/menit yang artinya pada enzim α-amilase dapat mengubah substrat amilum menjadi glukosa sebesar 12,64 ppm tiap menitnya.
5 Kesimpulan
Kesimpulan yang dapat diambil dari praktikum ini adalah bahwa kecepatan laju reaksi enzimatik dipengaruhi oleh kadar substrat dan enzim. Pada penambahan substrat sampai jumlah tertentu dengan jumlah enzim yang tetap akan mempercepat reaksi enzimatik sampai mencapai maksimum. Namun penambahan substrat selanjutnya tidak akan menambah kecepatan reaksi.
Nilai Km yang diperoleh pada
praktikum kali ini adalah 0,4892, menunjukkan bahwa enzim α-amilase mempunyai afinitas rendah terhadap substrat, sehingga kesetimbangan reaksi kearah E + S. Vmax
atau kecepatan maksimum dari reaksi enzimatis ini diperoleh dengan nilai 12,64 ppm/menit, yang artinya pada enzim α-amilase dapat mengubah substrat amilum menjadi glukosa sebesar 12,64 ppm tiap menitnya.
.
Daftar Pustaka
Mangunwidjaja, D., dan A. Suryani. 1994. Teknologi bioproses. Swadaya. Jakarta.
Poliana, J., MacCabe A. P. 2007.
Industrial Enzymes;
Applications. Dordrecht: Springer. Halaman 20-22. Rodriguez, V. B., Alamenda E. J., Gallegos J. F. M., Requena A. R., Lopez A. I. G., Cabral J. M. S., Fernandes P., Fonseca de L. I. P. 2006.
Modification of the activity
of an a-amylase from Bacillus licheniformis by several surfactants. Electron J Biotechnol 9 (5).
Wordpress.com. 2012. Amilase.
http://ptp2007.wordpress.com/2008/0 5/15/ amilase/. Diakses pada tanggal 28 Juni 2012