BAB I PENDAHULUAN
A. Latar Belakang
Dewasa ini malaria masih merupakan salah satu masalah kesehatan masyarakat yang utama. Malaria merupakan suatu penyakit dengan penyebaran yang luas dan menjadi endemis terutama di daerah tropis. Malaria termasuk penyakit tropik yang sampai sekarang tersebar luas di daerah tropis maupun subtropis. Malaria adalah penyakit infeksi yang disebabkan oleh parasit Plasmodium yang hidup dan berkembangbiak dalam sel darah manusia. Malaria ditularkan melalui gigitan nyamuk Anopheles.
Prevalensi nasional malaria berdasarkan hasil riskesdas tahun 2010 adalah 0,6 persen. Dimana provinsi dengan API (Annual Parasite Incidence) di atas angka rata-rata nasional adalah NTB, Maluku, Maluku Utara, Kalimantan Tengah, Babel, Kepri, Bengkulu, Jambi, Sulawesi Tengah, Gorontalo dan Aceh (DepKes RI Direktorat Jenderal Pengendalian Penyakit dan Penyehatan Lingkungan, 2011).
Menurut Kementerian Kesehatan RI, (2011) malaria masih menjadi beban masyarakat dan pemerintah Indonesia. Ancaman kesakitan dan kematian terutama pada kelompok resiko tinggi yaitu bayi, balita, ibu, penduduk usia produktif dan lain-lain. Penyebaran malaria disebabkan faktor yg komplek: perubahan lingkungan, vektor, sosial budaya masyarakat, resistensi obat dan akses pelayanan kesehatan. Pemberantasan & Eliminasi malaria perlu dilakukan secara terpadu oleh seluruh stake holder yang terlibat. Eliminasi meliputi Eliminasi di DKI, Bali, Batam 2010, Eliminasi di Jawa, NAD, Kepulauan Riau 2015. Eliminasi di Sumatra, NTB, Kalimantan, Sulawesi 2020. Eliminasi di Papua, Papua Barat, Maluku, Maluku Utara, NTT 2030.
Terdapat beberapa Kabupaten endemis di Kalimantan Tengah dimana penduduk di kabupaten tersebut berisiko tertular malaria. Berdasarkan hasil laporan penemuan malaria dari Dinas Kesehatan Provinsi Kalimantan Tengah
pada tahun 2010 adalah 2,4 persen yaitu penemuan penderita malaria berjumlah 53.002 jiwa. Pada tahun 2011 adalah 2,0 persen yaitu total penemuan penderita malaria berjumlah 43.810 jiwa. Sedangkan pada tahun 2012 adalah 1,9 persen yaitu total penemuan penderita malaria berjumlah 47.280 jiwa.
Diagnosis malaria yang cepat dan tepat merupakan hal yang sangat diperlukan dalam penatalaksanaan kasus malaria. Sediaan apus darah adalah suatu sarana yang digunakan untuk menilai berbagai unsur sel darah tepi, seperti eritrosit, leukosit, dan trombosit. Selain itu dapat pula digunakan untuk mengidentifikasi adanya parasit seperti malaria, mikrofilaria, dan lain-lain.
Sediaan apus yang dibuat dan dipulas dengan baik merupakan syarat mutlak untuk mendapatkan hasil pemeriksaan yang baik. Setelah penderita dicurigai secara klinis menderita malaria, pemeriksaan laboratorium untuk menemukan parasit harus secepatnya dilakukan. Pemeriksaan mikroskopik dengan pewarnaan Giemsa sampai saat ini masih merupakan baku emas pemeriksaan malaria. Pewarnaan Giemsa mampu mendeteksi parasit malaria walaupun pada densitas yang rendah. Kebanyakan cara memulas sediaan darah menggunakan prinsip Romanowski, seperti Wright, Giemsa, May-Grunwald-Giemsa atau Wright-Giemsa.
Konsentrasi parasit malaria dalam darah cukup merata sehingga pengambilan darah rutin dapat dilakukan pada ujung jari atau tumit kaki (bayi). Morfologi parasit yang optimal dapat dilihat dengan membuat sediaan darah yang diwarnai giemsa yang diambil dari ujung jari segera. Akhir-akhir ini darah vena dengan antikoagulan lebih sering digunakan sebagai bahan pemeriksaan (Harijanto, 2010).
Bahan pemeriksaan malaria yang terbaik adalah darah kapiler. Namun, di lapangan sering dijumpai pemeriksaan malaria menggunakan darah vena. Hal ini karena volume darah lebih banyak sehingga dapat digunakan untuk pemeriksaan hematologi lainnya. Oleh karena itu, penelitian ini dilakukan untuk mengetahui adanya perbedaan pada pemeriksaan malaria
menggunakan sampel darah vena dengan antikoagulan dan sampel darah kapiler tanpa antikoagulan.
Berdasarkan uraian diatas, maka penulis tertarik untuk melakukan penelitian mengenai Perbandingan Hasil Pemeriksaan Malaria Dengan Sampel Darah Vena dan Kapiler.
B. Identifikasi Masalah
Berdasarkan latar belakang masalah tersebut dapat diidentifikasi masalah sebagai berikut :
1. Apakah ada perbedaan hasil pemeriksaan malaria menggunakan darah vena dan kapiler ?
2. Bagaimana perbedaan hasil kepadatan malaria menggunakan darah vena dan kapiler ?
C. Batasan Masalah
Dengan penelitian ini peneliti hanya membandingkan hasil pemeriksaan malaria menggunakan darah vena dan kapiler berdasarkan kepadatan parasitnya.
D. Rumusan Masalah
Berdasarkan uraian di atas maka rumusan masalah dalam penelitian ini adalah:
Apakah ada perbedaan kepadatan parasit pada hasil pemeriksaan malaria menggunakan darah vena dan kapiler ?
E. Tujuan Penelitian 1. Tujuan umum
Tujuan umum dari penelitian ini adalah untuk mengetahui apakah ada perbedaaan yang bermakna pada hasil pemeriksaan malaria menggunakan sampel darah vena dan kapiler.
2. Tujuan Khusus
Tujuan khusus dari penelitian ini adalah untuk mengetahui kepadatan parasit pada pemeriksaan malaria menggunakan darah vena dan kapiler.
F. Manfaat Penelitian
1. Memberikan informasi kepada penyedia layanan kesehatan seperti laboratorium tentang perbandingan pemeriksaan malaria menggunakan darah vena dan kapiler.
2. Bagi peneliti, diharapkan mampu melakukan pemeriksaan malaria secara tepat dan cepat dengan cara mikroskopis.
BAB II
TINJAUAN PUSTAKA
A. Pengertian Malaria
Malaria adalah suatu penyakit yang disebabkan oleh protozoa obligat intraseluler dari genus Plasmodium. Malaria pada manusia dapat disebabkan Plasmodium malariae (Laveran,1888), Plasmodium vivax (Grosi dan Felati, 1890), Plasmodium falciparum (Welch,1897), dan Plasmodium ovale (Stephens,1922). Penularan malaria dilakukan oleh nyamuk betina dari tribus Anopheles (Ross,1897). Dari sekitar 400 spesies nyamuk anopheles telah ditemukan 67 species yang dapat menularkan malaria dan 24 diantaranya ditemukan di Indonesia (Harijanto, 2000).
Malaria adalah penyakit infeksi yang disebabkan oleh parasit Plasmodium yang hidup dan berkembang biak dalam sel darah merah manusia (Kemenkes RI, 2011). Malaria adalah parasit yang memiliki banyak stadium (multi-stage parasit) yang ditularkan oleh nyamuk Anopheles betina yang bertindak sebagai vektor penularnya. Malaria adalah penyakit dengan gejala demam yang terjadi tujuh hari sampai dua minggu sesudah gigitan nyamuk yang infektif (Soedarto, 2011).
Dari penjelasan di atas dapat disimpulkan bahwa malaria adalah penyakit infeksi yang disebabkan oleh parasit Plasmodium dan ditularkan oleh sejenis nyamuk tertentu yaitu Anopheles.
Taksonomi Plasmodium Kingdom : Protista Subkingdom : Protozoa Phylum : Apicomplexa Class : Sporozoasida Order : Eucoccidiorida
Family : Plasmodiidea
Genus : Plasmodium
Spesies : Plasmodium falciparum, Plasmodium vivax, Plasmodium ovale, Plasmodium malariae (Soedarto, 2011).
B. Morfologi
1. Plasmodium vivax
a. Stadium Tropozoit muda
1) Sitoplasma berbentuk cincin biru dan tebal serta mempunyai variasi dalam bentuk-bentuk tidak teratur (irregular), tidak dijumpai granula. 2) Kromatin satu besar berupa granula merah.
3) Titik Schuffner yang berwarna tengguli. 4) Sering dijumpai.
b. Stadium Tropozoit matang
1) Sitoplasma besar berwarna biru, bentuknya irregular karena merupakan organisme amuboid.
2) Didalamnya dijumpai butir-butir kecil pigmen yang berwarna coklat kekuningan.
3) Kromatin satu berupa titik merah. 4) Jarang dijumpai.
c. Stadium Schizont
1) Terdiri dari merozoit yang berjumlah 16-18, bentuknya besar, padat berupa granula merah, letaknya ditengah-tengah daerah yang dikelilingi oleh kelompokan sitoplasma yang berwarna biru pucat dan berbentuk huruf “koma”.
2) Sering dijumpai. d. Stadium Gametosit
1) Makrogametosit :
Bentuknya bulat padat/oval, warna biru. Inti berbentuk segitiga, padat, berwarna merah, letaknya dipinggir, disertai partikel-partikel berupa pigmen berwarna orange di dalamnya.
2) Mikrogametosit :
Bentuknya bulat, warna biru muda. Inti bulat, letak ditengah, berwarna merah muda, didalam inti dijumpai pigmen-pigmen oranye. 3) Sering dijumpai.
e. Sel Darah Merah tidak terlihat. f. Kepadatan parasit sedang. 2. Plasmodium falciparum
a. Stadium Tropozoit muda
1) Cincin berukuran kecil dengan bintik kromatin yang berukuran kecil dan halus.
2) Sitoplasma sangat halus, warna biru pucat dan tidak ada granula. 3) Kromatin bisa dijumpai 1 atau 2, berupa granula-granula yang
berwarna merah.
4) Bentuk ini yang sering dijumpai. b. Stadium Tropozoit matang
1) Sitoplasma lebih tebal, berupa cincin biru, bentuknya dapat berupa huruf koma atau tanda seru (Star in the sky).
2) Kromatin 1 atau 2, berukuran sedang dengan granula berwarna merah. c. Stadium Schizont
1) Stadium ini jarang terlihat, kecuali pada kasus yang berat. 2) Terdiri dari 18-32 merozoit kecil.
d. Stadium Gametosit
1) Bentuknya seperti buah pisang/bulan sabit.
2) Warna biru pada mikrogametosit dan warna biru ungu pada makrogametosit.
3) Inti merah ungu, pada mikrogametosit inti melebar dan menipis sedangkan pada makrogametosit intinya kompak.
4) Pigmen berupa granula yang berwarna biru padat. Letak mengumpul ditengah-tengah sitiplasma atau menyebar.
e. Sel darah merah tak terlihat. f. Kepadatan parasit sangat tinggi.
3. Plasmodium malariae a. Stadium Tropozoit muda
1) Bentuk cincin dengan sitoplasma tebal dan padat, berwarna biru dengan granula-granula yang berupa pigmen hitam.
2) Kromatin berjumlah besar berwarna merah. 3) Sering dijumpai.
b. Stadium Tropozoit matang
1) Sitoplasma dapat berbentuk bulat, padat, berwarna biru gelap dengan banyak partikel-partikel pigmen hitam. Bentuk pita hanya terlihat pada sediaan darah tipis.
2) Kromatin berbentuk bulat atau pita merah. 3) Sering dijumpai.
c. Stadium Schizont
1) Terdiri dari merozoit sebanyak 8-20 buah masing-masing besar, berwarna merah, bulat tersebar diantara sitoplasma yang pucat. Merozoit tersebut dapat tersusun tersebar diantara sitoplasma atau menggumpal membentuk “Rosette”.
2) Hampir sering dijumapi. d. Stadium Gametosit
1) Bentuknya besar, oval/bulat, warna biru padat yang mikrogametosit dan biru muda pada makrogametosit.
2) Inti berbentuk bulat, mengandung kromatin yang berwarna merah. Letak inti di tepi.
3) Pigmen besar, berwarna hitam dan tersebar di dalam sitoplasma. 4) Hampir sering dijumpai.
e. Sel Darah Merah tidak terlihat. f. Kepadatan parasit sangat rendah. 4. Plasmodium ovale
a. Stadium Tropozoit muda
1) Berbentuk cincin dengan sitoplasma yang berwarna biru padat. 2) Kromatin satu,berukuran sedang berbentuk granula merah.
b. Stadium Tropozoit matang
1) Sitoplasma berbentuk bulat berwarna biru didalamnya dijumpai partikel-partikel pigmen berwarna coklat.
2) Kromatin satu besar berwarna merah. c. Stadium Schizont
1) Terdiri dari merozoites sebanyak 8-14 buah, besar berupa granula-granula merah membentuk “Rosette” mengelilingi suatu partikel-partikel pigmen coklat.
d. Stadium Gametosit
1) Bentuk besar, bulat/oval, berwarna biru padat. 2) Inti berbentuk bulat, satu, berwarna merah.
3) Pigmen berwarna coklat sedikit tersebar di dalam sitoplasma. 4) Sel Darah Merah tidak terlihat.
5) Kepadatan parasit sedang. (Soedarto, 2011).
C. Etiologi
Malaria adalah penyakit yang mengancam jiwa yang disebabkan oleh parasit yang ditularkan pada manusia melalui gigitan nyamuk. Malaria disebabkan oleh parasit Plasmodium. Parasit ini ditularkan melalui gigitan nyamuk Anopheles yang merupakan vektor malaria yang terutama menggigit manusia malam hari mulai magrib (dusk) sampai fajar (down). Terdapat empat parasit penyebab malaria pada manusia yaitu : Plasmodium falciparum, Plasmodium vivax, Plasmodium malariae, plasmodium oval (Soedarto, 2011).
Plasmodium falciparum merupakan penyebab infeksi berat bahkan dapat menimbulkan kematian. Ke empat spesies Plasmodium yang terdapat di Indonesia yaitu Plasmodium falciparum yang menyebabkan malaria tropika, Plasmodium vivax yang menyebabkan malaria tertiana, Plasmodium malariae yang menyebabkan malaria kuartana dan Plasmodium ovale yang menyebabkan malaria ovale.
D. Gejala Klinis Malaria
Menurut Harijanto, (2010) Gejala klasik berupa “Trias Malaria” (Malaria proxysm) secara berurutan :
1. Periode Dingin
Mulai menggigil, kulit dingin, dan kering, penderita sering membungkus diri dengan selimut dan saat menggigil seluruh tubuh sering bergetar dan gigi-gigi saling terantuk, pucat sampai sianosis seperti orang kedinginan. Periode ini berlangsung 15 menit sampai 1 jam diikuti dengan meningkatnya temperatur.
2. Periode Panas
Muka merah, kulit panas dan kering, nadi cepat serta panas tubuh tetap tinggi, dapat sampai 40oC atau lebih, penderita membuka selimutnya, respirasi meningkat, nyeri kepala, nyeri orto orbital, muntah-muntah, dan syok. Periode ini lebih lama dari fase dingin, dapat sampai 2 jam atau lebih, diikuti dengan keadaan berkeringat.
3. Periode Berkeringat
Penderita berkeringat, mulai dari temporal, diikuti seluruh tubuh, sampai basah, temperatur turun, penderita merasa kelelahan dan sering tertidur. Jika penderita bangun akan merasa sehat dan dapat melakukan pekerjaan biasa.
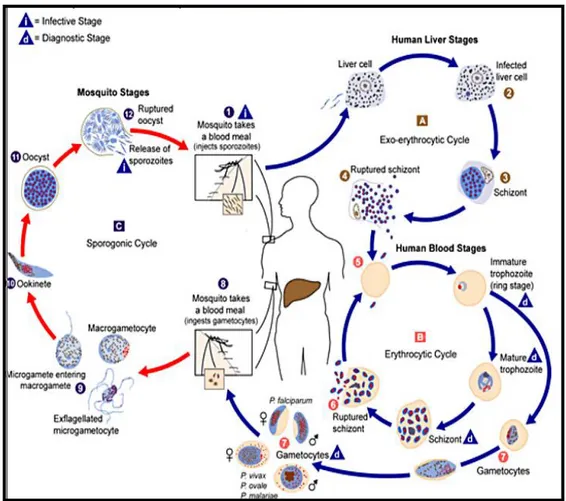
E. Siklus Hidup Plasmodium
Parasit malaria pada manusia mempunyai daur hidup pada tubuh manusia dan di dalam tubuh nyamuk Anopheles yang menjadi vektornya. 1. Siklus di dalam tubuh manusia
Sporozoit yang berasal dari dalam kelenjar ludah nyamuk Anopheles masuk melalui gigitan nyamuk pada kulit bersama air ludah nyamuk yang mengandung antikoagulansia. Segera sesudah memasuki aliran darah, dalam waktu 30 menit sporozoit akan menuju ke hati dan menembus hepatosit menjadi tropozoit hati. Parasit berada di dalam sel hati selama 9-16 hari dan
berkembang menjadi skizon hati yang mengandung 10.000-30.000 merozoit. Siklus ini disebut siklus eksoeritrositik.
Pada Plasmodium falciparum dan Plasmodium malariae berlangsung siklus skizogoni cepat (immediate schizogony), sedangkan pada Plasmodium vivax dan Plasmodium ovale dapat berlangsung siklus skizogoni cepat maupun skizogoni lambat (delayed schizogony), dimana sebagian tropozoit hati menjadi bentuk dorman (istirahat) yang pasif yang disebut hipnozoit. Bentuk hipnozoit dapat berada di dalam sel hati selama berbulan-bulan sampai bertahun-tahun. Jika daya tahan tubuh penderita menurun, parasit akan menjadi bentuk aktif sehingga menimbulkan kekambuhan (relaps).
Merozoit yang keluar dari skizon hati yang pecah akan meninggalkan sel hepatosit, memasuki aliran darah dan menginfeksi sel darah penderita. Perkembangan aseksual (proses schizogony eritrositik) Plasmodium dimulai sejak masuknya merozoit ke dalam eritrosit. Di dalam sel eritrosit tahap skizogoni berlangsung dengan pembentukan merozoit yang lebih banyak (membutuhkan waktu sekitar 22 jam). Setelah proses skizogoni darah berlangsung 2-3 siklus, sebagian merozoit yang menginfeksi eritosit akan membentuk stadium seksual mikrogamet (jantan) dan makrogamet (betina) yang membutuhkan waktu sekitar 26 jam. Pada Plasmodium falciparum, skizogoni eritrositik berlangsung selama 48 jam dan gametositosis 10-12 hari. Siklus skizogoni erotrositik pada umumnya berlangsung selama beberapa siklus sebelum terbentuknya gametosit untuk pertama kalinya (Soedarto, 2011).
2. Siklus pada nyamuk Anopheles betina
Apabila nyamuk anopheles betina menghisap darah yang mengandung gametosit, di dalam tubuh nyamuk, gamet jantan dan betina melakukan pembuahan menjadi zigot. Zigot berkembang menjadi ookinet kemudian menembus dinding lambung nyamuk. Pada dinding luar lambung nyamuk
ookinet akan menjadi ookista dan selanjutnya menjadi sporozoit. Sporozoit ini bersifat infektif dan siap ditularkan ke manusia.
Masa inkubasi adalah rentang waktu sejak sporozoit masuk ke tubuh manusia sampai timbulnya gejala klinis yang ditandai dengan demam. Masa inkubasi bervariasi tergantung spesies Plasmodium.
Masa prepaten adalah rentang waktu sejak sporozoit masuk ke rubuh manusia sampai parasit dapat dideteksi dalam sel darah merah dengan pemeriksaan mikroskopik (Depkes RI Direktorat Jenderal Pengendalian Penyakit dan Penyehatan Lingkungan).
Gambar 2.1. Siklus hidup plasmodium (DepKes RI Direktorat Jenderal Pengendalian Penyakit dan Penyehatan Lingkungan, 2011)
F. Patobiologi Malaria
Proses patologi malaria adalah akibat dari siklus eritrositik. Merozoit menyerang eritosit dimana mereka berkembang melalui bentuk cincin ke tropozoit dan akhirnya skizon. Pada kasus Plasmodium falciparum proses ini mengikuti perubahan terhadap eritrosit terinfeksi. Beberapa faktor kunci yang berkaitan parasit memainkan suatu peran dalam menyebabkan fenomena patogenesis seperti kecepatan dan kepadatan skizogoni, predileksi merozoit untuk jens eritrosit khusus, interaksi inang manusia dan parasit, dan sekuestrasi eritrosit terinfeksi pada pembuluh-pembuluh darah kecil dimana merupakan peristiwa sentral dan spesifik pada malaria falciparum.
Pada manusia, malaria falciparum berat dan berkomplikasi merubah fungsi normal dari banyak jaringan dan organ. Disini terdapat bukti-bukti peningkatan gangguan aliran darah lokal disebabkan oleh obstruksi mikrosirkulasi dalam kapiler dan venula dari organ dalam (Harijanto, 2010).
G. Pemeriksaan Laboratorium
Pemeriksaan mikroskopik dengan pewarnaan Giemsa sampai saat ini masih merupakan baku emas pemeriksaan malaria. Contohnya saja untuk pemeriksaan penyakit malaria akibat parasit Plasmodium. Melalui pemeriksaan laboratorium Plasmodium penyebab malaria pada manusia (Plasmodium falciparum, Plasmodium vivax, Plasmodium ovale, Plasmodium malariae, dan Plasmodium knowlest) dapat dibedakan berdasar stadium parasit yang ada di dalam darah, gambaran eritrosit yang terinfeksi parasit dan gambaran morfologi parasit yang ada di dalam sel eritrosit. Morfologi parasit yang optimal dapat dilihat dengan membuat sediaan darah yang diwarnai Giemsa yang diambil dari ujung jari segera. Akhir-akhir ini darah vena dengan antikoagulan lebih sering digunakan sebagai bahan pemeriksaan (Soedarto, 2011).
Bahan pemeriksaan yang terbaik adalah darah dari ujung jari. Bila menggunakan darah vena, sebaiknya darah yang digunakan adalah darah yang belum tercampur dengan anti koagulan (darah yang masih ada dalam spuit). Bila menggunakan darah dengan anti koagulan harus segera dibuat sediaan darah malaria, karena bila sudah lebih dari 1 jam, jumlah parasit berkurang dan morfologi dapat berubah (Kemenkes RI, 2011).
1. Pemeriksaan Mikroskopis
Sediaan apus darah tepi adalah suatu cara yang sampai saat ini masih digunakan pada pemeriksaan di laboratorium. Terhadap sediaan darah tetes tebal dan tipis dilakukan pemeriksaan mikroskopis untuk menentukan adanya parasit malaria, jenis spesies dan stadium parasit malaria serta kepadatan parasit.
a) Semi kuantitatif
Pemeriksaan kepadatan parasit semi kuantitatif menunjukkan nilai (-)/ Negatif : tidak ditemukan parasit pada 100 LPB (lapangan pandang besar)
(+) /Positif 1 : ditemukan 1-10 parasit per 100 LPB (++) / Positif 2 : ditemukan 11-100 parasit per 100 LPB (+++) / Positif 3 : ditemukan 1-10 parasit per 1 LP
(++++) / Positif 4 : ditemukan lebih dari 10 parasit per 1 LP b) Kuantitatif
Pemeriksaan kepadatan parasit kuantitatif dilakukan melalui pemeriksaan tetes tebal (per leukosit) atau sediaan darah tipis (per eritrosit) jumlah parasit dihitung per mikro liter darah (Soedarto, 2011). Untuk menentukan nilai ambang kepadatan parasit aseksual Plamodium faliparum yaitu menghitung jumlah parasit (N) dibanding minimal 200 leukosit dikalikan 8.000 leukosit normal. Bila N kurang dari 10,maka jumlah leukosit dihitung sampai 500 leukosit (bukan 200 leukosit).
Menurut Harijanto, (2010) Pada sediaan darah tebal parasit dihitung berdasarkan jumlah leukosit per darah, jika tidak diketahui biasanya diasumsikan leukosit penderita berjumlah 8000/ , dengan rumus sebagai berikut :
. . .
Cara menghitung yaitu sejak diketemukan parasit didalam lapang pandang, baru mulai dihitung parasit dan leukosit dan seterusnya pindah lapang pandang berikutnya walaupun tidak ada parasitnya, leukosit tetap dihitung hingga mencapai minimal 200 leukosit atau lebih. Bila parasit kurang dari 10 per 200 leukosit dilanjutkan dihitung hingga mencapai 500 leukosit. Jumlah parasit >100.000/ darah menandakan infeksi yang berat. Hitung parasit penting untuk menentukan prognosa penderita malaria, walaupun komplikasi juga dapat timbul dengan jumlah parasit yang minimal (Sudoyo, 2009).
Pelaporan hasil jika hasil pemeriksaan pulasan darah positif, perinciannya yaitu berdasarkan spesies parasit yang ditemukan, stadium perkembangan parasit tersebut dan densitas parasit (Mahode, Albertus A, 2011).
2. Rapid Diagnostic Test (RDT)
Pemeriksaan Tes Diagnostik Cepat dilakukan berdasar deteksi antigen parasit malaria dengan immunokromatografi dalam bentuk dipstik. Tes ini digunakan di UGD (Unit Gawat Darurat) pada waktu terjadi KLB (Kejadian Luar Biasa) atau untuk memeriksa malaria di daerah terpencil yang tidak tersedia sarana laboratorium atau untuk melakukan survei tertentu (Soedarto, 2011).
Sampai saaat ini ada banyak sekali rapid malaria test yang beredar di pasaran, tetapi secara garis besar hanya ada 3 macam antigen malaria yang
digunakan. Ketiga antigen tersebut adalah histidinerich protein-2 (HRP 2), lactate dehydrogenase (LDH) dan aldolase (Harijanto, 2010).
3. Sampel Pemeriksaan Mikroskopis a. Darah Vena
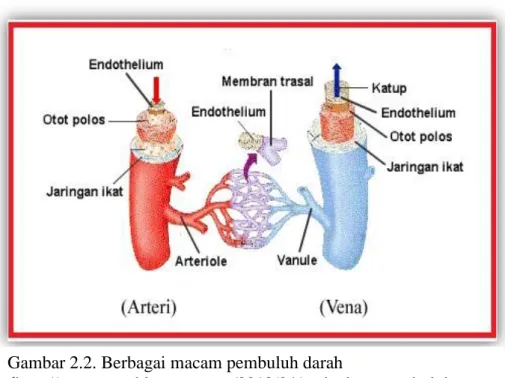
Pembuluh darah vena dikenal dengan nama pembuluh balik. Pembuluh darah ini adalah jenis pembuluh darah yang datang menuju serambi jantung. Vena bercabang-cabang membentuk venula. Venula membentuk cabang-cabang lebih kecil yang disebut kapiler. Vena yang berhubungan langsung dengan jantung atau paru-paru dikenal dengan vena kava. Vena mengandung banyak darah kaya karbon dioksida, kecuali vena pulmonalis mengandung banyak oksigen. Vena merupakan pembuluh berdinding lebih tipis, kurang elastis dan lubang pembuluh lebih besar daripada arteri. Pembuluh ini mempunyai beberapa katup untuk mencegah agar darah tidak berbalik arah (Pearce, 2009).
Gambar 2.2. Berbagai macam pembuluh darah
( http://antonagus.blogspot.com/2012/04/perbedaan-pembuluh-darah-vena-arteri.html)
b. Darah Kapiler
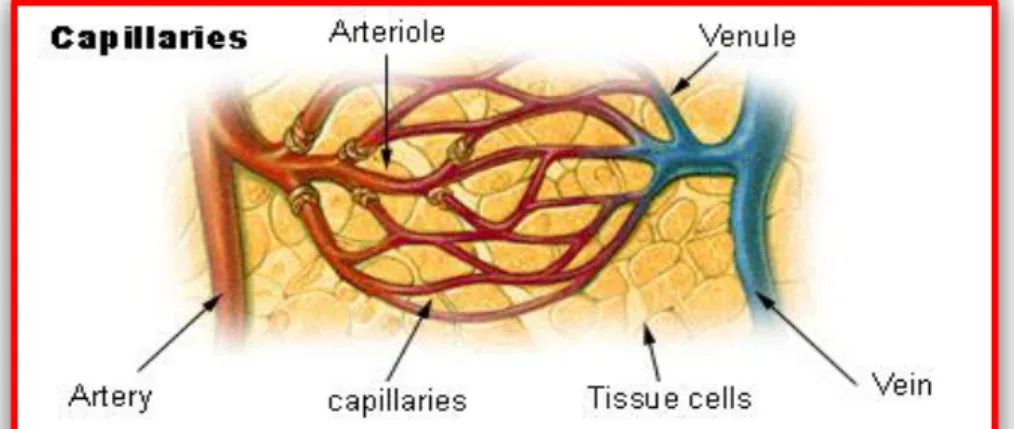
Kapiler ialah pembuluh darah yang sangat kecil tempat arteri berakhir. Cabang terkecil dari arteri dan vena disebut kapiler. Pembuluh darah kapiler memiliki diameter yang sangat kecil dan hanya memiliki satu lapisan tunggal endothelium dan sebuah membran basal. Jaringan pembuluh darah kapiler bekerja membentuk sebuah anyaman yang terdiri dari suatu jaringan dengan kandungan kurang lebih 2000 kapiler darah per millimeter (Pearce, 2009).
Menurut Syaifudin, (2009) Fungsi kapiler adalah sebagai berikut : 1) Sebagai penghubung antara pembuluh darah arteri dan vena.
2) Tempat terjadinya pertukaran zat antara darah dan cairan jaringan. 3) Mengambil hasil dari kelenjar.
4) Menyerap zat makanan yang terdapat dalam usus. 5) Menyaring darah pada ginjal.
Kapiler merupakan pembuluh darah berukuran kecil sebagai perpanjangan arteri dan vena. Darah di kapiler campuran dari darah vena dan darah arteri. Dinding sel pembuluh ini bersifat permeabel sehingga airan tubuh dan zat-zat terlarut dapat keluar masuk melalui dinding selnya. Selain itu, juga terjadi pertukaran oksigen, karbondioksida, zat-zat makanan, serta hasil-hasil ekskresi dengan jaringan yang ada di sekeliling kapiler.
Gambar 2.3. Pembuluh darah kapiler
4. Pemeriksaan darah untuk menemukan Plasmodium
Untuk membuat sediaan darah malaria dibuat 2 jenis sediaan darah yaitu sediaan darah tebal dan sediaan darah tipis. Sediaan darah tebal terdiri dari sejumlah besar sel darah merah yang terhemolisis. Parasit yang ada terkonsentrasi pada area yang lebih kecil sehingga akan lebih cepat terlihat di bawah mikroskop. Sedangkan sediaan darah tipis terdiri dari satu lapisan sel darah merah yang tersebar dan digunakan untuk membantu identifikasi parasit malaria setelah ditemukan dalam sediaan darah tebal (Kemenkes RI Direktorat Jenderal Pengendalian Penyakit dan Penyehatan Lingkungan, 2011).
Salah satu yang perlu diperhatikan pada saat membuat apusan darah adalah kaca objek/objek glass yaitu harus bersih, kering, dan tidak berlemak. Hal ini dapat dilakukan dengan cara sebagai berikut :
a. Slide yang sudah tergores tidak boleh dipakai. Yang terbaik adalah menggunakan objek glass yang baru dan tidak boleh menggunakan objek glass bekas pakai. Semua objek glass direndam dalam air sabun selama 30 menit-1 jam kemudian dibilas dengan air mengalir.
b. Membersihkan objek glass. Di lap dengan kasa atau kain bersih. Setelah objek glass dibersihkan, tidak boleh memegang pada bagian permukaan objek glass dan langsung dipakai atau disimpan pada slide box.
c. Menyimpan objek glass, slide box yang dianjurkan adalah terbuat dari bahan plastik/fiber yang tahan pecah. Slide box sebaiknya tidak terbuat dari bahan kayu karena dapat berpengaruh pada sediaan darah yang disimpan. Ketebalan objek glass 1,1-1,3 mm, ukurannya 25x75x1-1,5 mm (Kemenkes RI Direktorat Jenderal Pengendalian Penyakit dan Penyehatan Lingkungan, 2011).
BAB III
METODOLOGI PENELITIAN
A. Jenis Penelitian dan Rancangan Penelitian
Penelitian ini merupakan penelitian yang menggunakan metode deskriftif eksperimental, yaitu penelitian yang bertujuan untuk mengetahui adanya perbedaan kepadatan parasit malaria positif antara darah vena dan darah kapiler.
B. Waktu dan Tempat Penelitian
Waktu Penelitian ini dilaksanakan pada tanggal 02 Januari sampai dengan 02 Maret 2013 kemudian dilanjutkan kembali pada tanggal 05 Mei sampai dengan 15 Juni 2013. Penelitian ini dilakukan di laboratorium RSI PKU Muhammadiyah Palangkaraya.
C. Populasi dan Sampel 1. Populasi
Populasi pada penelitian ini adalah sediaan darah malaria menggunakan darah vena dan kapiler yang diambil dari pasien yang datang ke RSI PKU Muhammadiyah Palangkaraya dan telah positif malaria.
2. Sampel
Bahan pemeriksaan yang digunakan adalah darah vena dengan antikoagulan dan darah kapiler tanpa antikoagulan. Teknik sampling yang digunakan dalam penelitian ini adalah accidental sampling, yaitu sampel merupakan sediaan darah pasien rawat jalan dan rawat inap di RSI PKU Muhammadiyah dengan ukuran sampel 25. Setiap pasien dibuat 2 apusan darah yaitu masing-masing 1 sediaan darah vena dan kapiler.
D. Alat dan Bahan
1. Pemeriksaan malaria menggunakan sampel darah kapiler a. Alat yang digunakan:
1) Blood lancet disposible 2) Holder 3) Kaca objek 4) Kaca Penggeser 5) Kapas alkohol 6) Rak pengecatan 7) Mikroskop 8) Tissue
b. Reagen yang digunakan : 1) Akohol 70%
2) Giemsa 3% 3) Metanol
4) Sampel darah kapiler
2. Pemeriksaan malaria menggunakan sampel darah vena a. Alat yang digunakan :
1) Spuit 3cc 2) Torniquet 3) Kapas alkohol 4) Plester 5) Kaca objek 6) Kaca penggeser 7) Batang pengaduk 8) Rak pengecatan 9) Mikroskop 10) Tissue
b. Reagen yang digunakan : 1) Alkohol 70%
2) Giemsa 3% 3) Metanol
4) Sampel darah vena dengan antikoagulan E. Variabel dan Definisi Operasional Variabel
1. Variabel
Untuk mencapai tujuan, dalam penelitian ini variabel yang diamati adalah jumlah parasit dalam 200 atau 500 leukosit dengan menggunakan sampel darah vena dan kapiler.
2. Definisi Operasional Variabel
a. Perbandingan adalah adanya sesuatu yang tidak sama karena selisih atau perbedaan.
b. Pemeriksaan malaria adalah kegiatan mengumpulkan, mengolah data untuk sebuah penelitian tentang infeksi yang disebabkan oleh parasit Plasmodium yang hidup dan berkembang biak dalam sel darah merah manusia.
c. Pengambilan darah vena adalah pengambilan darah pada pembuluh darah pada lipat siku bagian dalam yang disebut fossa cubiti.
d. Pengambilan darah kapiler adalah pengambilan darah yang dilakukan pada ujung jari atau bayi pada tumit atau ibu jari kaki.
F. Teknik Pengumpulan data
Data dikumpulkan dari hasil pemeriksaan malaria positif dengan cara mikroskopis yang dilakukam pada sampel darah vena dari populasi penelitian yang sudah diperiksa di RSI PKU Muhammadiyah Palangkaraya yang kemudian dilakukan pemeriksaan mikroskopis darah kapiler.
1. Pengambilan Darah Kapiler a. Cara Kerja :
1) Memegang tangan kiri pasien dengan posisi telapak tangan menghadap ke atas.
2) Memilih jari tengah atau jari manis (pada bayi usia 6-12 bulan darah diambil dari ujung ibu jari kaki dan bayi <6 bulan darah diambil dari tumit).
3) Tempat yang akan ditusuk harus didesinfeksi dahulu dengan alkohol 70% lalu dikeringkan dengan kapas yang bersih.
4) Setelah kering, jari ditekan agar darah banyak terkumpul di ujung jari.
5) Menusuk bagian ujung jari (agak di pinggir, dekat kuku) dan dilakukan dengan gerakan yang cepat tetapi tepat sehingga terjadi luka yang dalamnya 3 mm.
6) Menghapus tetesan darah pertama harus dengan kapas yang bersih dan kering, karena ini mungkin tercampur dengan alkohol.
7) Tetesan darah yang keluar selanjutnya dapat dipergunakan. 8) Menyentuhkan tetesan darah tersebut pada kaca objek dengan 1
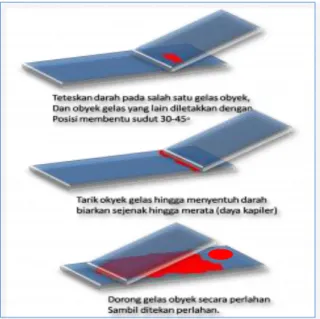
tetes untuk sediaan darah tipis dan 3 tetes untuk sediaan darah tebal.
9) Membuat sediaan darah tipis, objek glass baru (kaca penggeser) lalu menempelkan ujungnya pada tetes darah kecil dengan sudut 45o sampai darah menyebar ke sisi objek glass. Menggeser objek glass tersebut dengan cepat ke arah yang berlawanan dengan tetes darah tebal, sehingga di dapat sediaan hapus (seperti bentuk lidah).
10) Membuat sediaan darah tebal, menghomogenkan darah dengan memutar batang pengaduk searah jarum jam dari luar kedalam sehingga terbentuk bulatan dengan diameter 1 cm.
11) Memberi label/etiket pada bagian ujung objek glass dekat sediaan darah tebal, bisa menggunakan kertas label atau objek glass frosted. Pada label dituliskan KODE/INISIAL NAMA/TANGGAL PEMBUATAN.
12) Proses mengeringkan sediaan darah harus dilakukan secara perlahan-lahan di tempat yang datar. Tidak dianjurkan menggunakan lampu (termasuk lampu mikroskop), hair dryer. Hal ini dapat menyebabkan sediaan darah menjadi retak-retak sehingga mempengaruhi hasil pemeriksaan. Kipas angin dapat digunakan untuk mengeringkan sediaan.
13) Setelah kering, darah tersebut harus segera diwarnai. Pada keadaan tidak memungkinkan selambat-lambatnya dalam waktu 24 jam sediaan darah harus sudah diwarnai.
b. Pewarnaan sediaan apus darah :
1) Sediaan darah yang sudah kering difiksasi dengan methanol. Jangan sampai terkena sediaan darah tebal.
Gambar 3.1. Cara Pembuatan Apus Darah (http:/ratnatanjung.blogspot.com)
2) Meletakkan pada rak pewarna dengan posisi darah menghadap keatas.
3) Menyiapkan 3% larutan Giemsa dengan mencampur 3cc giemsa stock dan 97cc larutan buffer.
4) Menuang larutan Giemsa 3% dari tepi hingga menutupi seluruh permukaan object glass. Dibiarkan selama 30-45 menit.
5) Menuangkan air bersih secara perlahan-lahan dari tepi object glass sampai larutan Giemsa yang terbuang menjadi jernih. Mengangkat dan mengeringkan sediaan darah. Setelah kering, sediaan darah siap diperiksa.
(Kemenkes RI Direktorat Jenderal Pengendalian Penyakit dan Penyehatan Lingkungan, 2011)
c. Mengamati di bawah mikroskop dengan perbesaran 100x + oil imersi.
2. Pengambilan Darah Vena a. Cara Kerja :
1) Torniquet dipasang pada lengan atas.
2) Tempat yang akan ditusuk didesinfeksi dengan alkohol 70% atau desinfeksi lainnya.
3) Mengeringkan tempat tersebut lalu dengan menghapus dengan sepotong kapas atau kasa yang steril.
4) Vena difiksasi dengan menegangkan kulit pada bagian distal dari vena tersebut dengan pertolongan ibu jari.
5) Dengan lubang jarum menghadap ke atas menusuk vena pelan-pelan. Bila ujung jarum telah masuk ke dalam vena maka akan dirasakan tekanan yang tiba-tiba mengurang. Vena yang besar dapat ditusuk langsung sedangkan pada vena yang agak kecil lebih baik jarum dimasukkan dulu di antara kulit dan vena lalu vena ditembus.
6) Bila berhasil segera akan terlihat darah memasuki semprit dan pengambilan dilanjutkan dengan menarik toraknya pelan-pelan sampai didapatkan jumlah yang diinginkan.
7) Melepaskan torniquet.
8) Menempatkan sepotong kapas steril pada tempat penusukan lalu mengeluarkan jarumnya pelan-pelan.
9) Meminta pasien untuk meneruskan menekan sepotong kapas tadi selama 1-2 menit sambil mengangkat lengannya ke atas. 10) Melepaskan jarum dari semprit lalu memasukkan darah ke
dalam botol yang telah disediakan dengan pelan-pelan supaya tak timbul buih, sebaiknya darah dialirkan melalui dinding botol waktu memasukkan.
11) Bila digunakan antikoagulansia segera darah ini dikocok pelan-pelan supaya bercampur dengan antikoagulansianya.
12) Mengambil menggunakan batang pengaduk dengan 1 tetes untuk sediaan darah tipis dan 3 tetes untuk sediaan darah tebal. 13) Membuat sediaan darah tipis, dengan objek glass baru (kaca
penggeser) lalu mentempelkan ujungnya pada tetes darah kecil dengan sudut 45o sampai darah menyebar ke sisi objekt glass. Menggeser objek glass tersebut dengan cepat ke arah yang berlawanan dengan tetes darah tebal, sehingga di dapat sediaan hapus (seperti bentuk lidah).
14) Membuat sediaan darah tebal, menghomogenkan darah dengan memutar batang pengaduk searah jarum jam dari luar kedalam sehingga terbentuk bulatan dengan diameter 1 cm (Depkes RI, 1989).
15) Memberi label/etiket pada bagian ujung objek glass dekat sediaan darah tebal, bisa menggunakan kertas label atau objek glass frosted. Pada label dituliskan KODE/INISIAL NAMA/TANGGAL PEMBUATAN.
16) Proses mengeringkan sediaan darah harus dilakukan secara perlahan-lahan di tempat yang datar. Tidak dianjurkan menggunakan lampu (termasuk lampu mikroskop), hair dryer. Hal ini dapat menyebabkan sediaan darah menjadi retak-retak sehingga mempengaruhi hasil pemeriksaan. Kipas angin dapat digunakan untuk mengeringkan sediaan.
17) Setelah kering, darah tersebut harus segera diwarnai. Pada keadaan tidak memungkinkan selambat-lambatnya dalam waktu 24 jam sediaan darah harus sudah diwarnai.
b. Pewarnaan sediaan apus darah :
1) Sediaan darah yang sudah kering difiksasi dengan methanol. Jangan sampai terkena sediaan darah tebal.
2) Meletakkan pada rak pewarna dengan posisi darah menghadap keatas.
3) Menyiapkan 3% larutan Giemsa dengan mencampur 3cc giemsa stock dan 97cc larutan buffer.
4) Menuang larutan Giemsa 3% dari tepi hingga menutupi seluruh permukaan object glass. Dibiarkan selama 30-45 menit.
5) Menuangkan air bersih secara perlahan-lahan dari tepi object glass sampai larutan Giemsa yang terbuang menjadi jernih. Mengangkat dan mengeringkan sediaan darah. Setelah kering, sediaan darah siap diperiksa.
(Kemenkes RI Direktorat Jenderal Pengendalian Penyakit dan Penyehatan Lingkungan, 2011).
c. Amati di bawah mikroskop dengan perbesaran 100x + oil imersi. G. Pengolahan dan Analisis Data
Data hasil penelitian diperoleh dari pemeriksaan malaria menggunakan darah vena dan kapiler dengan cara membedakan sediaan apus darah vena dan kapiler. Satu sampel dibuat 2 apusan yaitu satu
apusan darah vena dan satu apusan darah kapiler yang kemudian dihitung kepadatan parasitnya untuk masing-masing apusan darah.
Untuk mengetahui perbedaan hasil pemeriksaan kedua sampel, data densitas parasit dianalisis dengan uji t pada tingkat signifikansi 1%. Hipotesis statistik yang diuji adalah :
Ho : µo = µl
Ha : µo ≠ µl
Keterangan :
µo = rata-rata hasil pemeriksaan malaria dengan darah vena µl = rata-rata hasil pemeriksaan malaria dengan darah kapiler
Ho = tidak ada perbedaan pemeriksaan malaria menggunakan darah vena
dan darah kapiler
Ha = ada perbedaan pemeriksaan malaria menggunakan darah vena dan darah kapiler
Kriteria penarikan kesimpulan : Jika, thitung ≤ ttabel maka Ho diterima
Jika, thitung > ttabel maka Ho ditolak
Rumus untuk t-test :
dimana
Keterangan :
elisih hasil pengukuran 1 dan 2 Standar deviasi
BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Penelitian
Penelitian dilakukan di Laboratorium RSI PKU Muhammadiyah Palangkaraya. Penelitian dilakukan mulai tanggal 02 Januari sampai dengan 02 Maret 2013 kemudian dilanjutkan kembali pada tanggal 05 Mei sampai dengan 15 Juni 2013 dan sampel berasal dari sediaan darah malaria menggunakan darah vena dan kapiler yang diambil dari pasien yang datang ke RSI PKU Muhammadiyah Palangkaraya dan telah positif malaria. Jumlah sampel sebanyak 25 orang.
Jumlah parasit >100.000/ darah menandakan infeksi yang berat. Hitung parasit penting untuk menentukan prognosa penderita malaria. Namun dari hasil pemeriksaan pada penelitian ini tidak ditemukan kepadatan parasit yang >100.000 darah.
Dari penelitian ini, didapat jumlah penderita malaria sebanyak 25 orang yaitu terdiri dari laki-laki sebanyak 19 orang dan perempuan sebanyak 6 orang. Berikut adalah grafik presentasi penderita malaria berdasarkan jenis kelamin.
Grafik 4.1. Presentasi Penderita Malaria 24%
76%
PEREMPUAN LAKI-LAKI
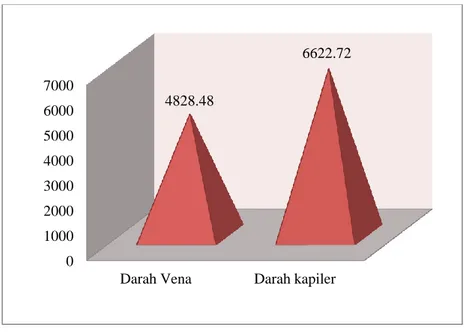
Dari penelitian ini diperoleh data pemeriksaan malaria dengan darah vena dan kapiler berdasarkan kepadatan parasitnya menunjukkan perbedaan jumlah yang bervariasi. Berikut ini adalah grafik rata-rata kepadatan parasit.
Nilai rata-rata kepadatan parasit pada darah vena adalah 4828,48, sedangkan pada darah kapiler didapat nilai rata 6622,72. Dari nilai rata-rata tersebut didapat hasil persentase darah kapiler secara deskriptif lebih besar dari darah vena yaitu darah kapiler sebesar 58% dan darah vena sebesar 42%. Berikut persentase nilai kepadatan parasit dapat dilihat pada grafik 4.3.
0 1000 2000 3000 4000 5000 6000 7000
Darah Vena Darah kapiler 4828.48
6622.72
42%
58%
Darah Vena Darah kapiler Grafik 4.2. Hasil rata-rata kepadatan parasit
Grafik 4.3. Persentasi Kepadatan Parasit
Berdasarkan hasil analisis diperoleh t hitung sebesar . Sedangkan berdasarkan tabel t, dengan derajat bebas 24 dan tingkat disignifikansi 1% diperoleh nilai t tabel adalah 2,7969.
Dengan membandingkan nilai t hitung = dengan nilai t tabel = 2,7969, maka diperoleh nilai t hitung lebih besar daripada nilai t tabel. Ini berarti hipotesis Ho ditolak, yang berarti ada perbedaan pemeriksaan malaria menggunakan darah vena dan darah kapiler pada tingkat signifikansi 1%.
B. Pembahasan
Sesuai dengan tujuan penelitian ini yaitu untuk membuat gambaran tentang suatu keadaan yang objektif melalui analisa statistik untuk melakukan perbandingan dua variasi data. Selain itu, penelitian ini juga bertujuan untuk mengetahui adanya perbedaan pada pemeriksaan malaria menggunakan sampel darah vena dan kapiler. Perbedaan yang terlihat hanya berdasarkan kepadatan parasitnya saja.
Pemeriksaan malaria berdasarkan kepadatan parasit itu penting untuk pemantauan pengobatan. Namun, untuk saat ini pemeriksaan malaria hanya berdasarkan ditemukannya parasit saja.
Dari hasil analisa data, nilai rata-rata hitung kepadatan parasit pada sampel darah vena adalah 4828,48 dan darah kapiler didapat nilai rata-rata 6622,72. Dari nilai rata-rata antara kedua sampel tersebut sudah terlihat bahwa ada perbedaan. Setelah dilakukan analisa statistik maka dapat disimpulkan ada perbedaan pada tingkat signifikansi 1% antara sampel darah vena dan kapiler pada pemeriksaan malaria.
Dilihat dari tabel hasil pemeriksaan malaria bahwa ada perbedaan hasil pemeriksaan malaria menggunakan sampel darah vena dan kapiler. Dari penelitian ini, hal-hal yang mungkin mempengaruhi kepadatan parasit lebih tinggi pada sampel darah kapiler dibanding darah vena karena darah vena adalah jenis pembuluh darah yang datang menuju serambi jantung kemudian bercabang-cabang membentuk venula. Venula membentuk cabang-cabang lebih kecil yang disebut kapiler. Darah kapiler yang merupakan
penghubungantara pembuluh darah arteri dan vena menyebabkan adanya campuran antara darah dari arteri dan vena.
Pada malaria akibat Plasmodium mempunyai patogenesis yang khusus. Beratnya penyakit malaria berhubungan dengan densitas parasit yang berhubungan dengan kemampuan parasit bermultiplikasi di antara eritrosit. Eritrosit yang terinfeksi Plasmodium akan mengalami proses sekuestrasi yaitu terkumpulnya eritrosit yang berparasit di dalam pembuluh kapiler. Sekuestrasi timbul akibat dari eritrosit matang yang tinggal dalam jaringan mikrovaskular. Hal ini dikarenakan pada Plasmodium seluruh siklus terjadi pada pembuluh darah perifer. Selain itu pada permukaaan eritrosit yang terinfeksi akan membentuk knob yang berisi berbagai antigen Plasmodium. Pada saat terjadi proses sitoadherensi, knob tersebut akan berikatan dengan reseptor sel endotel kapiler (Harijanto, 2000).
Setelah dilakukan analisa statistik diperoleh kesimpulan bahwa darah kapiler untuk pemeriksaan malaria lebih baik karena kepadatan parasitnya lebih banyak dibandingkan darah vena.
BAB V
PENUTUP
A. Simpulan
Dari hasil penelitian yang telah dilakukan dapat disimpulkan bahwa: 1. Didapat hasil nilai rata-rata hitung kepadatan parasit pada sampel darah
vena adalah 4828,48 dan darah kapiler didapat nilai rata-rata 6622,72. 2. Hasil kepadatan parasit menggunakan darah kapiler lebih banyak daripada
darah vena.
B. Saran
1. Untuk petugas laboratorium
Kepada petugas laboratorium, lebih baik menggunakan sampel darah kapiler karena kepadatan parasit lebih banyak dibandingkan sampel darah vena.
2. Untuk mahasiswa
Agar nantinya dapat melanjutkan penelitian ini dengan sampel yang lebih banyak.
DAFTAR PUSTAKA
Agus, A. Perbedaan Pembuluh darah vena, arteri dan kapiler. http://antonagus. blogspot.com/2012/04/perbedaan-pembuluh-darah-vena-arteri.html diakses pada tanggal 15 Juni 2013
Anonimous. Sistem Peredaran Darah Manusia. http://9reeners.wordpress.com /2009/01/30/sistem-peredaran-darah-manusia/ di akses 23 januari 2013 Departemen Kesehatan RI Direktorat Jenderal Pengendalian Penyakit dan
Penyehatan Lingkungan. 2011. Pedoman Penatalaksanaan Kasus Malaria Di Indonesia. Jakarta: Depkes RI
Evelyn CP. 2009. Anatomi dan Fisiologi untuk Paramedis. Jakarta: Gramedia Fajar Ibnu,dkk. 2009. Statistika untuk Praktisi Kesehatan. Yogyakarta: Graha
Ilmu
Harijanto PN. 2010. Malaria dari Molekuler ke Klinis. Jakarta: EGC
Kementerian Kesehatan RI Direktorat Pengendalian Penyakit Penyakit dan Penyehatan Lingkungan. 2011. Pedoman Teknis Pemeriksaan Parasit Malaria. Jakarta: Kemenkes RI
Mahode, Albertus A. Editor. 2011. Pedoman Teknik Dasar untuk Laboratorum Kesehatan Edisi 2. Jakarta: EGC
Pusat Pendidikan Tenaga Kesehatan. 1989. Hematologi. Jakarta: Depkes RI Ratna. Sediaan apus darah. http:/ratnatanjung.blogspot.com di akses 15 Juni 2013 Soedarto. 2011. Malaria. Jakarta: Sagung Seto
Sudoyo A.W, dkk. 2009. Buku Ajar Ilmu Penyakit Dalam. Jakarta: Pusat Penerbitan Departemen Penyakit Dalam FKUI
Sutisna,P. 2004. Malaria Secara Ringkas Dari Pengetahuan Dasar Sampai Terapan. Jakarta: EGC
Syaifuddin. 2009. Anatomi Tubuh Manusia Edisi 2 untuk Mahasiswa Keperawatan. Jakarta: Salemba Medika
Wikipedia. Pembuluh darah kapiler. http://id.wikipedia.org/wiki/Pembuluh_ darah_kapiler di akses 1 Mei 2013
Lampiran 1.
Data hasil penelitian hitung kepadatan parasit malaria dengan darah vena dan kapiler
No. Nama
Pasien Jenis Kelamin Umur
Densitas Parasit / L Darah Vena Darah kapiler 1 Tn.Bb Laki-laki 21th 32 128 2 Ny.Rm Perempuan 35th 4.760 8.720 3 An.Dk Laki-laki 4th 3.760 4.160 4 Tn.Wh Laki-laki 25th 5.480 5.920 5 Tn.Np Laki-laki 70th 5.480 8.240 6 Tn.Sl Laki-laki 25th 4.200 9.720 7 Tn.Kb Laki-laki 45th 10.440 13.280 8 An.Li Perempuan 8th 480 640 9 Tn.Sr Laki-laki 25th 1.800 2.080 10 Tn.Mr Laki-laki 36th 1.200 1.720 11 Ny.Mn Perempuan 27th 5.560 6.240 12 Tn.Hr Laki-laki 45th 3.200 4.080 13 Tn.Pm Laki-laki 19th 13.600 17.040 14 Tn.Jp Laki-laki 22th 360 480 15 Tn.Sm Laki-laki 42th 520 640 16 Ny.Sr Perempuan 30th 4.160 4.640 17 Tn.Yn Laki-laki 32th 7.680 9.120 18 Ny.Rh Perempuan 27th 1.600 4.960 19 Ny.Wn Perempuan 30th 4.840 5.400 20 Tn.Jm Laki-laki 41th 19.120 22.080 21 Tn.Mu Laki-laki 35th 1.920 4.880 22 Tn.Dn Laki-laki 26th 5.800 7.960 23 Tn.Sn Laki-laki 40th 2.720 6.440 24 Tn.Ra Laki-laki 36th 6.920 9.840 25 Tn.Rd Laki-laki 35th 5.080 7.160 Palangkaraya, Juli 2013
Lampiran 2.
Data hasil selisih kepadatan parasit antara kedua sampel :
No.
Densitas Parasit / L
Zi = Xi – Yi
(di) (/Mm3) (Zi - )2 Darah
Vena Darah kapiler
1 32 128 96 2.884.019,098 2 4.760 8.720 3.960 4.690.516,378 3 3.760 4.160 400 1.943.905,178 4 5.480 5.920 440 1.833.965,978 5 5.480 8.240 2.760 932.692,3776 6 4.200 9.720 5.520 1.388.1287,58 7 10.440 13.280 2.840 1.093.613,978 8 480 640 160 2.670.740,378 9 1.800 2.080 280 2.292.922,778 10 1.200 1.720 520 1.623.687,578 11 5.560 6.240 680 1.241.530,778 12 3.200 4.080 880 835.834,7776 13 13.600 17.040 3.440 2.708.525,978 14 360 480 120 2.803.079,578 15 520 640 120 2.803.079,578 16 4.160 4.640 480 1.727.226,778 17 7.680 9.120 1.440 125.485,9776 18 1.600 4.960 3.360 2.451.604,378 19 4.840 5.400 560 1.523.348,378 20 19.120 22.080 2.960 1.358.996,378 21 1.920 4.880 2.960 1.358.996,378 22 5.800 7.960 2.160 133.780,3776 23 2.720 6.440 3.720 3.708.551,578 24 6.920 9.840 2.920 1.267.335,578 25 5.080 7.160 2.080 81.658,7776 Jumlah 120.712 165.568 44.856 57.976.386,56
Lampiran 3.
Hasil perhitungan menggunakan analisa statistik.
1. Hipotesis :
Ho : Tidak ada perbedaan pemeriksaan malaria menggunakan darah vena
dan darah kapiler Ho : µo = µl
Ha : Ada perbedaan pemeriksaan malaria menggunakan darah vena dan darah kapiler
Ha : µo ≠ µl
2. Tingkat signifikansi ( α ) = 0,01 dan df = n-1 = 24, jadi titik kritisnya t = 2,7969
3. Kriteria pengujian :
Ho ditolak jika t hitung >2,7969 atau – t hitung < - 2,7969.
Perhitungan : Dimana : Dan
Kesimpulan :
Karena t hitung = dan t tabel = 2,7969, yang berarti t hitung > t tabel; maka hipotesis nol ditolak, ini berarti ada perbedaan hasil pemeriksaan malaria dengan darah vena dan kapiler pada tingkat signifikansi 1%.
Lampiran 4.
Dokumentasi alat pemeriksaan malaria menggunakan sampel darah vena dan kapiler
Alat dan Bahan untuk pengambilan darah vena dan kapiler
Alat pemeriksaan secara mikroskopis & oil imersi
Lampiran 5.
Dokumentasi pemeriksaan Malaria menggunakan sampel darah vena dan kapiler
Pengambilan darah vena Pembuatan Sediaan Apusan Darah Vena
Pengambilan Darah Kapiler Pembuatan Sediaan Apusan Darah
Proses fiksasi sediaan apusan menggunakan methanol
Proses Pewarnaan apusan darah menggunakan pewarnaan Giemsa
Lampiran 6.
Sediaan Apus Darah Vena dan Darah Kapiler
Sediaan Apusan Darah Vena
Lampiran 7.
Gambaran mikroskopis Sediaan apus darah kapiler
Tropozoit P.vivax Gametosit P.vivax
Tropozoit P.vivax Gametosit P.falciparum
Lampiran 8.
Gambaran mikroskopis Sediaan apus darah vena
Gametosit P.vivax Skizon P.vivax
Tropozoit P.falciparum Tropozoit P.falciparum
LAMPIRAN 10
PERNYATAAN
Yang bertanda tangan di bawah ini:
Nama Mahasiswa : Yusi Marhayni Nomor Induk Mahasiswa : 10. 72. 12006 Program Studi : Analis Kesehatan
Fakultas : Ilmu Kesehatan
Dengan ini saya menyatakan bahwa tugas akhir ini merupakan hasil karya sendiri dan belum pernah diajukan untuk memperoleh gelar Ahli Madya di suatu perguruan tinggi dan sepanjang pengetahuan saya dalam tugas akhir ini tidak terdapat karya tulis atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis di acu dalam naskah ini dan disebutkan dalam daftar pustaka.
Palangka Raya, Juli 2013 Yang Membuat Pernyataan
Yusi Marhayni