LAPORAN RESMI
PRAKTIKUM ANALISIS BAHAN ANALISIS GRAVIMETRI
(G)
Disusun oleh:
ADIMAS PRASETYAAJI 12/333664/TK/40007
KURNIAWAN 12/333478/TK/39831
LABORATORIUM ANALISIS BAHAN JURUSAN TEKNIK KIMIA
FAKULTAS TEKNIK UNIVERSITAS GADJAH MADA
LEMBAR PENGESAHAN
LAPORAN RESMI PRAKTIKUM ANALISIS BAHAN dengan judul praktikum :
ANALISIS GRAVIMETRI
Disusun oleh :
Nama Praktikan NIM Tanda Tangan
Adimas Prasetyaaji 12/333664/TK/40007
Kurniawan 12/333478/TK/39831
Yogyakarta, 14 November 2013 Dosen Pembimbing Asisten
1 ANALISIS GRAVIMETRI
I. TUJUAN PERCOBAAN
Percobaan ini bertujuan untuk menentukan kemurnian pupuk ZA dengan menggunakan metode analisis gravimetri yang meliputi pelarutan, pengendapan, pencucian, pemijaran, penimbangan, dan pelarutan.
II. DASAR TEORI
Analis gravimetri adalah jenis analisis kuantitatif dimana jumlah spesies dalam suatu material ditentukan dengan mengubah spesies ke produk yang dapat diisolasi secara lengkap dan dapat ditimbang (Ebbing: 2010).
Faktor-faktor yang memengaruhi keberhasilan analisis gravimetri adalah:
1. Endapan harus begitu tak larut sehingga tidak ada kehilangan yang cukup besar ketika dalam tahap penyaringan. Dalam praktiknya jumlah sisa dalam larutan tidak melebihi 0,1 mg.
2. Sifat fisik endapan harus sedemikian rupa sehingga dapat dengan mudah dipisahkan dari larutan dengan filtrasi, dan dapat dicuci bebas dari pengotor yang larut. Kondisi tersebut mengharuskan ukuran partikel sedemikian rupa sehingga tidak lolos melalui media penyaring, dan bahwa ukuran partikel tidak terpengaruh (atau setidaknya tidak berkurang) oleh proses pencucian.
3. Endapan harus bisa diubah menjadi bahan murni, hal ini dapat dilakukan dengan cara pengapian atau operasi kimia sederhana, seperti penguapan (Vogel: 1989).
Manfaat dari analisis gravimetri (analisis kuantitatif) adalah dalam penentuan konsentrasi/jumlah kadar suatu zat tertentu dalam suatu sampel. Contoh dari analisis gravimetri adalah :
1. Menentukan kadar ion 𝐶𝑙− dalam endapan AgCl (Aditya: 2013). 2. Menentukan kandungan kolesterol dalam biji-bijian.
3. Menentukan kandungan nikotin pada rokok.
4. Menentukan kadar ion dalam 𝑆𝑂42− dalam endapan 𝐵𝑎𝑆𝑂4.
A. Tahap pengendapan
Proses konversi dari analit menjadi endapan tidak larutnya dengan menambahkan agen pengendap yang cocok disebut pengendapan (Charan: 2011).
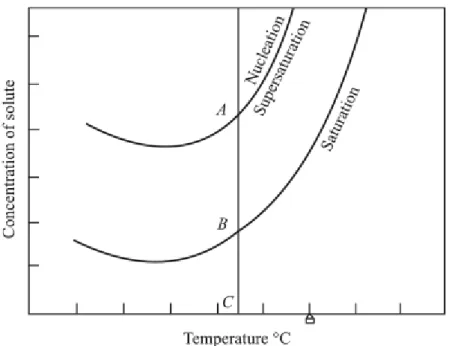
Pengendapan utamanya tergantung pada dua peristiwa, yaitu nukleasi dan pertumbuhan partikel. Nukleasi adalah proses pembentukan awal partikel terkecil dari endapan yang mampu tumbuh secara spontan. Partikel terkecil dari endapan itu disebut inti (nukleus). Pertumbuhan partikel merupakan proses pembentukan inti awal yang membentuk sebuah kristal dengan susunan geometri tertentu. Jika laju nukleasi lebih rendah dibandingkan laju pertumbuhan partikel, kristal yang dihasilkan lebih sedikit dan memiliki ukuran yang besar sehingga mudah untuk disaring. Kondisi ini dapat didekati dengan teori Von Weimarn tentang relatif supersaturasi.
Teori von Weimarn tentang supersaturasi
Supersaturasi (super jenuh) merupakan tingkatan dimana fase larutan mengandung lebih banyak zat terlarut yang larut dibandingkan pada kondisi saturasi (jenuh), seperti yang ditunjukkan pada Gambar 1 (bagian AB). Kondisi ini bersifat sementara dan akan hilang ketika pengendapan dimulai. Saat pengendapan terjadi, Kristal dari zat terlarut biasanya berbentuk seperti benih (bagian BC). Berdasarkan teori von Weimarn ukuran endapan berbanding terbalik dengan
relative supersaturation (RSS)/ super saturasi relatif, didefinisikan
sebagai
𝑅𝑆𝑆 = 𝐴 − 𝐵 𝐵
dimana A adalah konsentrasi sebenarnya dari zat terlarut ketika pengendapan mulai terjadi akibat dari penambahan agen pengendap dan B adalah konsentrasi kesetimbangan dari zat terlarut pada kondisi larutan jenuh. Bentuk A-B menunjukkan tingkat dari larutan supersaturasi. Perbandingan A B
B
disebut juga rasio von Weimarn. Karena ukuran partikel endapan berbanding terbalik dengan RSS, maka jelas bahwa ukuran partikel akan besar jika RSS-nya bernilai kecil. Oleh sebab itu, untuk memperoleh ukuran partikel endapan yang besar maka rasio von Weimarn A B
B
harus dibuat sekecil mungkin.
Gambar 1. Sifat Kelarutan
Kondisi pengendapan selektif dari teori von Weimarn
Rasio von Weimarn dibuat sekecil mungkin. Ini dapat dicapai dengan cara membuat A rendah dan B tinggi.
Kondisi untuk membuat A rendah :
1. Pengenceran larutan untuk mengurangi konsentrasi supersaturasi. 2. Agen pengendap dimasukkan setetes demi setetes.
Kondisi untuk membuat B tinggi :
1. Memanaskan larutan untuk menaikkan temperature, jadi pengendapan dilakukan pada larutan panas.
2. Mengatur pH dari larutan, dan pengendapan dilakukan pada pH serendah mungkin.
3. Menggunakan agen pembentuk senyawa kompleks.
Barium klorida ditambahkan dalam jumlah berlebih agar ion 𝑆𝑂42− yang terlarut sedikit. Tujuan penambahan 𝐵𝑎𝐶𝑙2. 2𝐻2𝑂 setetes demi setetes adalah untuk menghambat laju nukleasi seperti yang dijelaskan pada teori von Weimarn.
Alasan digunakan 𝐵𝑎𝐶𝑙2. 2𝐻2𝑂 sebagai agen pengendap adalah : 1. Mudah disaring dan dicuci dari pengotor.
Tujuan utama pengendapan pada analisis gravimetri adalah pemurnian (Frank: 2012). Endapan 𝐵𝑎𝑆𝑂4 yang terbentuk akibat penambahan 𝐵𝑎𝐶𝑙2. 2𝐻2𝑂 5 % ke larutan ZA, akan menempel pada kertas saring saat dilakukan penyaringan dan ion 𝐶𝑙−(pengotor) yang masih tertinggal dalam cairan yang menetes dan corong gelas bisa ditetes dengan 𝐴𝑔𝑁𝑂3 1%.
2. Komposisi setelah dibakar dan dikeringkan dapat diketahui dengan pasti.
Saat penyaringan digunkan kertas saring Whatman 40, sehingga setelah dilakukan pemijaran nantinya endapan 𝐵𝑎𝑆𝑂4 dapat ditimbang tanpa terpengaruh oleh abu sisa pembakaran kertas saring yang jumlahnya sedikit, yaitu sekitar 0,007% dari massa kertasnya (Whatman.com: 2009).
3. Kelarutannya rendah sehingga tidak banyak kehilangan dalam proses penyaringan. Dengan semakin rendahnya nilai Ksp maka nilai kelarutan (s) juga akan semakin rendah (Ksp≈s).
Apabila dibandingkan dengan agen pengendap dari golongan II A yang lain semisal CaCl2 , BaCl2 memiliki keunggulan dimana Ksp
2.2 2
BaCl H O < Ksp CaCl2 sehingga banyak endapan yang dihasilkan oleh BaCl2.2H O2 . Jadi BaCl2.2H O2 lebih cocok untuk menjadi agen pengendap dibandingkan CaCl2. Hal dapat ditunjukkan dalam reaksi berikut:
2(aq) 4 2 4 (aq) 4( )s 2 4 BaCl NH SO BaSO NH Cl (2)
2(aq) 4 2 4 (aq) 4( )s 2 4 CaCl NH SO CaSO NH ClDari daftar Ksp diketahui :
Ksp BaSO 4 = 1, 2 10 10 (Davis: 2006) 2 s = 1, 2 10 10 s = 1,1 10 5 Ksp CaSO 4 = 4 2, 4 10 (Charmichael: 2010) 2 s = 2, 4 10 4 s = 2 1, 6 10
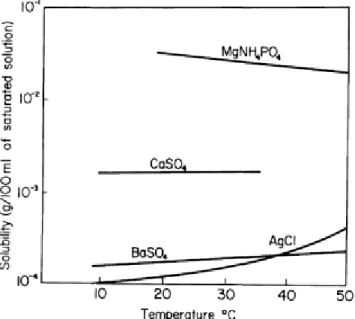
Kelarutan kedua garam pada berbagai suhu relatif tetap, Gambar 2.
Gambar 2. Kelarutan Garam (Frank: 2012)
Dilihat dari nilai kelarutannya (s), nilai s dari 𝐵𝑎𝑆𝑂4 lebih kecil dibanding 𝐶𝑎𝑆𝑂4 , maka 𝐵𝑎𝑆𝑂4 akan menghasilkan endapan lebih banyak. Selain itu 𝐵𝑎𝑆𝑂4 cenderung membentuk endapan dengan garam-garam lain dalam larutan atau sering disebut coprecipitation (Iqbal : 1994). Endapan kristal seperti 𝐵𝑎𝑆𝑂4 terkadang menyerap pengotor ketika ukuran partikelnya kecil. Selama partikel itu tumbuh maka pengotor akan melingkupi kristal 𝐵𝑎𝑆𝑂4. Proses ini disebut
occlusion. Dan jenis pengotor ini tidak dapat dihilangkan dengan
hanya dicuci (Charan: 2011).
Jika dalam penambahan 𝐵𝑎𝐶𝑙2 terlalu banyak, jumlah endapan yang terbentuk tidak akan terpengaruh karena ion 𝑆𝑂42− sudah terendapakan semua (𝑆𝑂42− sebagai pereaksi pembatas, 𝐵𝑎𝐶𝑙
2. 2𝐻2𝑂 masih tersisa). Secara kuantitatif jumlah endapan 𝐵𝑎𝑆𝑂4 yang terbentuk tidak terpengaruh dengan penambahan 𝐵𝑎𝐶𝑙2. 2𝐻2𝑂 yang berlebih, namun hal ini akan menyebabkan proses pencucian menjadi lebih lama sebab 𝐶𝑙− adalah pengotor. Sedangkan jika penambahan 𝐵𝑎𝐶𝑙2. 2𝐻2𝑂 terlalu sedikit, maka yang akan terjadi adalah beberapa
ion 𝑆𝑂42− tidak mengendap menjadi 𝐵𝑎𝑆𝑂4, hal ini akan mengakibatkan hasil penimbangan lebih kecil dari seharusnya, sehingga diperoleh data yang kurang akurat.
𝐵𝑎𝐶𝑙2. 2𝐻2𝑂 yang ditambahkan dalam larutan
NH4
2SO4adalah 𝐵𝑎𝐶𝑙2. 2𝐻2𝑂 encer (kadar 5%). Hal ini disebabkan oleh beberapa alasan, yaitu:
1. Mengurangi ion pengotor yang terdapat dalam endapan 𝐵𝑎𝑆𝑂4. 2. Agar endapan yang terbentuk berupa Kristal kasar, karena
konsentrasi pereaksi pengendapan rendah.
3. Jika larutan 𝐵𝑎𝐶𝑙2. 2𝐻2𝑂 yang digunakan mempunyai kadar lebih besar dari 5% maka 𝐶𝑙− yang terdapat dalam larutan akan menjadi lebih besar. Padahal ion 𝐶𝑙− merupakan pengotor karena diserap oleh endapan 𝐵𝑎𝑆𝑂4 yang terbentuk dan menyebabkan kemurniannya berkurang.
Jika larutan 𝐵𝑎𝐶𝑙2. 2𝐻2𝑂 yang digunakan kadarnya kurang dari 5% maka semakin encer sehingga kemampuan untuk menekan endapan 𝐵𝑎𝑆𝑂4 akan kurang maksimal.
Pengetesan dengan 𝐵𝑎𝐶𝑙2. 2𝐻2𝑂 5%
Pengetesan dilakukan untuk memastikan ada atau tidaknya ion 𝑆𝑂42− dalam larutan dengan melihat apakah masih ada endapan yang turun pada pengetesan dengan 𝐵𝑎𝐶𝑙2. 2𝐻2𝑂 5%. Pengetesan dilakukan pada suhu dingin untuk memudahkan pengamatan, karena jika suhu larutan panas maka suhu endapan akan tinggi dan menyebabkan endapan akan bercampur dengan cairan lagi, kelarutan sisa ion 𝑆𝑂42− terlarut menjadi besar sehingga pengendapannya membutuhkan waktu yang lama (Kenkel: 2002).
Reaksi
4
4( ) 2 2 ( ) 4( ) 4 ( ) 2 ( )2 aq .2 aq s 2 aq 2 l
Dari reaksi di atas endapannya adalah 𝐵𝑎𝑆𝑂4, setelah didiamkan beberapa saat, endapan akan turun perlahan-lahan. Tujuan pengetesan dengan 𝐵𝑎𝐶𝑙2. 2𝐻2𝑂 5% adalah untuk mengetes apakah ion 𝑆𝑂42− sudah terendapkan semua atau belum. Bila masih ada ion 𝑆𝑂42− terlarut, maka saat ditetesi 𝐵𝑎𝐶𝑙2. 2𝐻2𝑂 5% akan terjadi aliran endapan.
Reaksi
2 2
(aq) 4 (aq) BaSO4(s)
Ba SO (4)
Bila masih ada aliran endapan, maka larutan harus dipanaskan lagi agar semua ion 𝑆𝑂42− bereaksi lagi dengan 𝐵𝑎2+ membentuk endapan 𝐵𝑎𝑆𝑂4 karena reaksi akan berjalan lebih cepat pada suhu tinggi. Apabila sudah tidak terjadi aliran endapan berarti ion 𝑆𝑂42− telah terendapkan semua dalam bentuk endapan 𝐵𝑎𝑆𝑂4.
Setelah penambahan 𝐵𝑎𝐶𝑙2. 2𝐻2𝑂 5% larutan dipanaskan kembali sambil menutup gelas beker dengan gelas arloji yang sedikit dibuka dan diberi delas pengaduk di bawahnya. Hal ini bertujuan untuk mencegah uap 𝑆𝑂42− atau uap 𝐵𝑎2+ akan “hilang” ke udara atau bercampur dengan udara di luar system yang terbentuk. Tujuan diletakkannya gelas pengaduk di bawah gelas arloji adalah agar sedikit ruang agar menjaga tekanan udara di dalam gelas sama dengan tekanan luarnya. Jika gelas beker tertutup rapat dan suhu naik terus, tekanan akan meningkat dan bisa mengakibatkan gelas beker pecah.
Setelah dipanaskan, larutan didinginkan agar endapan terpisah dari larutan dan dapat diamati secara jelas. Kemudian dilakukan pengetesan pertama dengan melakukan penambahan 𝐵𝑎𝐶𝑙2. 2𝐻2𝑂 5% setetes demi setetes ke dalam larutan. Jika sampai akhir penambahan 𝐵𝑎𝐶𝑙2. 2𝐻2𝑂 5% pertama masih terjadi aliran endapan maka larutan dipanaskan kembali kemudian didinginkan kembali lalu dilakukan pengetesan kedua dengan menambahkan 𝐵𝑎𝐶𝑙2. 2𝐻2𝑂 5%
pada larutan sampai terjadi aliran bening seperti minyak saat pengetesan yang menandakan tidak ada lagi aliran endapan terbentuk.
B. Tahap penyaringan
Penyaringan bertujuan untuk memisahkan cairan dan endapan dalam larutan. Tujuan lain dari penyaringan adalah memisahkan
coprecipitation dari endapan 𝐵𝑎𝑆𝑂4, sehingga berfungsi juga untuk pemurnian. Penyaringan dilakukan dengan menggunakan kertas saring
Whatman 40 yaitu kertas saring bebas abu agar setelah pemijaran,
endapan yang diperoleh berupa garam sulfat murni. Kertas saring
Whatman 40 memiliki sifat medium dan dapat menahan partikel
berukuran sedang. Alasan lain pemakaian kertas Whatman 40 adalah kemampuannya untuk terbakar sempurna pada suhu 400° C menjadi gas 𝐶𝑂2 dengan syarat kebutuhan oksigen tercukupi dan tidak berlebihan terhadap persamaan stoikiometrisnya.
Keuntungan menggunakan kertas saring Whatman 40 adalah: 1. Mudah didapat.
2. Efisisensi penyaringan tinggi karena perbandingan luas pori-pori terhadap luas seluruh permukaanya besar.
3. Dapat menghindari adanya kontaminasi hasil endapan oleh abu ketika pemijaran.
Kekurangan menggunakan kertas saring Whatman 40 adalah: 1. Tidak dapat dikeringkan sehingga harus dibakar habis.
2. Mudah rusak sehingga harus perlahan-lahan saat menuangkan larutan ke kertas saring.
3. Dapat menyerap bahan-bahan dari larutan yang disaring.
Sebelum dipasang pada corong gelas, kertas saring dilipat terlebih dahulu membentuk seperampat lingkaran dan usahakan ujung lipatannya tidak terlalu ditekan sehingga tidak mengakibatkan kertas
saring menjadi berlubang. Selama dipasang, diusahakan tidak ada rongga udar disekitar corong gelas.
Saat kertas saring diletakkan pada corong gelas, maka kertas saring itu harus dibasahi dengan aquadest terlebih dahulu agar tidak ada rongga antara corong gelas dan kertas saring yang akan memperlambat penyaringan.
Selama penyaringan, tinggi cairan di kertas saring kurang dari 3
4 tinggi kertas. Hal ini dimaksudkan untuk menghindari meresapnya larutan pada kertas saring bersama partikel endapan yang tidak disaring.
Penyaringan dilakukan dengan mengalirkan larutan melalui batang gelas pengaduk untuk mengarahkan aliran agar larutan tidak tercecer.
C. Tahap pencucian
Tujuan utama pencucian adalah untuk menghilangkan kotoran diatas permukaan endapan (Kopkar: 1998)
Kualitas ideal dari cairan pencuci (Charan: 2011)
1. Cairan pencuci seharusnya tidak memiliki kecenderungan melarutkan endapan tapi harus memiliki kecenderungan untuk melarutkan pengotor yang melekat pada endapan. Jadi pelarut organik seperti etanol dan eter mungkin dapat digunakan untuk pencucian.
2. Tidak menyebabkan peptizing (perubahan ke bentuk fase koloid) yang menyebabkan endapan turun melewati kertas saring.
Aquadest merupakan agen peptizing yang seharusnya tidak
digunakan.
3. Tidak bereaksi dengan endapan.
4. Tidak terkandung molekul lain yang bisa mengganggu kesetimbangan.
Karena adanya ketarbatasan bahan, maka digunakan aquadest hangat sebagai cairan pencuci. Ada beberapa pertimbangan lain mengapa digunakan aquadest hangat yaitu:
1. Efektivitas pencucian akan lebih tinggi karena pada suhu tinggi, rapat massa aquadest akan lebih kecil kemudian akan menurunkan tegangan mukanya sehingga aquadest hangat akan mudah melewati pori-pori kertas saring. Jadi pencucian akan berjalan lebih cepat daripada menggunakan aquadest dengan suhu lebih rendah.
2. Aquadest hangat cenderung lebih sedikit melarutkan endapan daripada aquadest dingin, tetapi tetap saja ada yang larut.
3. Aquadest hangat mempunyai viskositas lebih rendah dibandingkan dengan aquadest dingin, sehingga lebih mudah melewati pori-pori kertas saring.
4. Menyingkirkan kotoran yang teradsorbsi pada permukaan endapan dan mencuci 𝐵𝑎𝐶𝑙2 berlebih (jika ada).
Cara pencucian yang baik (Charan: 2011) :
1. Menggunakan set cairan pencuci, endapan harus dipastikan benar-benar teraduk. Hal ini dapat diikuti dengan cara penyiraman pada pinggir kertas saring.
2. Frekuensi pencucian yang tinggi dengan volume cairan pencuci yang kecil lebih baik dan efisien dalam menghilangkan pengotor daripada frekuensi pencucian rendah dengan volume cairan pencuci besar.
3. Jika endapan benar-benar tidak larut dalam kondisi panas, cairan pencuci yang hangat lebih baik digunakan akibat dari besarnya kelarutan pengotor dan meningkatkan kecepatan penyaringan.
Tujuan dilakukan pencucian secara berulang-ulang dengan volume lebih kecil adalah :
1. Menghindari larutannya kembali mengendap dalam cairan pencuci.
2. Menghindari hilangnya endapan karena tumpah atau memercik. 3. Mendapatkan endapan yang murni karena fraksi pengotor pada
akhir pencucian lebih sedikit dibanding satu kali pencucian. Hal ini sesuai denga persamaan:
n n o u x x u v (Kopkar: 1998)
dimana, 𝑋0= konsentrasi pengotor sebelum pencucian 𝑋𝑛= konsentrasi pengotor setelah pencucian
𝑛 = jumlah pencucian
𝑢 = volume sisa pada endapan 𝑣 = volume larutan
4. Menghindari terkumpulnya endapan yang berlebihan pada kertas saring karena akan menyebabkan tersumbatnya pori-pori kertas saring sehingga penyaringan menjadi lama.
Pada tahap ini dilakukan pengetesan 𝐴𝑔𝑁𝑂3. Hal ini bertujuan untuk mendeteksi keberadaan ion 𝐶𝑙− dalam larutan sesuai dengan reaksi :
3
3(aq) (aq) ( )s (aq)
AgNO Cl AgCl NO (8)
Bila ion 𝐶𝑙− sudah tidak ada, maka hasil penambahan 𝐴𝑔𝑁𝑂3 1% tidak menyebabkan kekeruhan sehingga pencucian tidak diperlukan lagi.
D. Pemijaran
Pada tahap ini digunakan muffle bukan oven karena :
1. Muffle dapat digunakan untuk memijarkan hingga suhu yang sangat tinggi.
2. Pada muffle bagian atas terdapat lubang yang berfungsi sebagai tempat keluarnya uap air dan sisa pembakaran kertas saring. Tahap pemijaran yang pertama adalah dengan memijarkannya hingga suhu 400℃, hal ini bertujuan untuk mengeringkan kertas saring. Krus dimasukkan kedalam muffle dengan tutup krus sedikit terbuka, hal ini bertujuan agar oksigen yang mengalir masuk kedalam krus dapat dibatasi, sehingga tidak sampai memijarkan kertas saring karena dapat mereduksi 𝐵𝑎𝑆𝑂4 menjadi 𝐵𝑎𝑆 menurut reaksi :
4( )s 4 ( )s ( )s 4 ( )g
BaSO C BaS CO (9)
Untuk pemijaran kedua dilakukan pada suhu mencapai 800℃, hal ini bertujuan untuk mengabukan kertas saring. Pada pemijaran mencapai 800℃ ini tutup krus harus dalam keadaan terbuka seluruhnya agar semua karbon dari kertas saring berubah menjadi 𝐶𝑂2 dengan menyisakan sedikit abu dan menguapkan air yang masih tertinggal. Reaksi yang terjadi :
( )s 2( )g 2( )g
C O CO (10)
Tujuan dimasukkan ke dalam eksikator supaya air yang masih ada di endapan teruapkan karena silica gel dalam eksikator dapat menyerap air dan uap air yang masih ada di dalam endapan dan krus serta dapat menurunkan suhu krus dan endapan menjadi bersuhu kamar sehingga penyerapan ulang 𝐶𝑂2 dan air oleh krus dan endapan dapat dicegah.
E. Tahap penimbangan
Setelah krus porselen dipanaskan sampai suhu 800℃, krus dibiarkan dingin dulu hingga suhunya dibawah 100℃. Krus diambil dari muffle dan dimasukkan ke dalam eksikator untuk didinginkan dengan alasan :
1. Agar suhunya sama dengan suhu neraca. Perbedaan suhu yang besar dapat mengakibatkan kerusakan pada neraca.
2. Mencegah arus konveksi di udara terbuka yang menyebabkan udara dan krus yang kering cepat menyerap uap air dari udara dalam jumlah yang tidak terlalu besar. Jika didinginkan dengan eksikator, krus dan endapan akan cepat kering karena di dalam eksikator terdapat silica gel yang dapat menyerap uap air.
Penimbangan dilakukan ketika suhu krus sama dengan suhu neraca untuk menghindari kerusakan pada neraca karena perbedaan suhu yang besar antara krus dan neraca. Selain itu juga menjaga keakuratan penimbangan karena apabila krus masih dalam kondisi panas akan terjadi arus konveksi dan transfer panas yang selanjutnya akan berpengaruh pada hasil penimbangan.
Fungsi eksikator adalah untuk menghindari penyerapan uap air dari udara oleh endapan, karena eksikator berisi butiran-butiran silica
III. PELAKSANAAN PERCOBAAN A. Bahan
Bahan-bahan yang digunakan dalam analisis gravimetri ini adalah: 1. Aquadest yang diperoleh dari Laboratorium Analisis Bahan
Jurusan Teknik Kimia Universitas Gadjah Mada.
2. Kertas saring Whatman 40 yang diperoleh dari Laboratorium Analisis Bahan Jurusan Teknik Kimia Universitas Gadjah Mada. 3. Larutan AgNO 1% merek Merck yang diperoleh dari 3
Laboratorium Analisis Bahan Jurusan Teknik Kimia Universitas Gadjah Mada.
4. Larutan BaCl2.2H O2 5% merek Merck yang diperoleh dari Laboratorium Analisis Bahan Jurusan Teknik Kimia Universitas Gadjah Mada.
5. Pupuk ZA
NH4
2SO4 merek Riedel de Haen yang diperoleh dari Laboratorium Analisis Bahan Jurusan Teknik Kimia Universitas Gadjah Mada.B. Alat
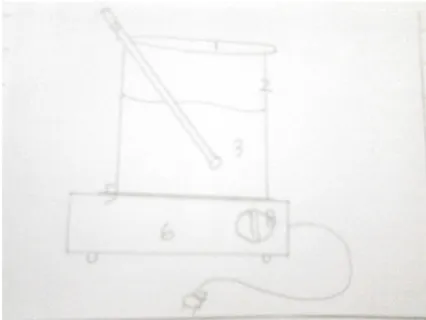
Alat yang digunakan dalam percobaan ini ditunjukkan oleh rangkaian alat berikut:
Gambar 8. Rangkaian Alat Pengendapan Keterangan Gambar:
1. Gelas Arloji
2. Gelas Beker 250 mL merek Iwaki Pyrex 3. Larutan ZA merek Riedel de Haen 4. Gelas Pengaduk
5. Asbes
6. Kompor Listrik 7. Steker
C. Cara Percobaan
1. Tahap Pengendapan
Pupuk ZA sebanyak 0,1017 gram ditimbang dengan gelas arloji menggunakan neraca analitis digital. Aquadest sebanyak 50,00 ml diambil dengan gelas ukur 100 ml lalu dituangkan ke dalam gelas beker 250 ml. Pupuk ZA
NH4
2SO4 yang sudah ditimbang dimasukkan ke dalam dimasukkan ke dalam gelas beker 250 ml yang berisi aquadest kemudian diaduk hingga homogen. Gelas beker 250 ml yang berisi larutan ZA
4
42
NH SO
dipanaskan di atas kompor
listrik dalam keadaan tertutup oleh gelas arloji dan diberi gelas pengaduk hingga mendidih. Setelah mendidih, kompor listrik dimatikan kemudian gelas beker diturunkan dari kompor listrik dan ditunggu hingga larutan agak dingan. Sebanyak 7,5 ml BaCl2.2H O 2
5% diambil dengan pipet ukur sebanyak 10 ml. Barium klorida dihidrat 5 % dimasukkan setetes demi setetes dengan pipet tetes ke dalam larutan ZA yang sudah agak dingin sambil diaduk dengan gelas pengaduk. Larutan dipanaskan lagi dengan kompor listrik hingga mendidih.
Kompor listrik dimatikan dan gelas beker 250 ml diturunkan. Larutan didinginkan hingga terbentuk endapan dan larutan bening. Pengetesan dilakukan dengan cara mengambil 10 ml BaCl2.2H O 5% 2
dengan pipet ukur 10 ml. Selanjutnya BaCl2.2H O 5% tersebut 2
dimasukkan ke dalam larutan ZA dengan pipet tetes, setetes demi setetes sampai tidak terjadi aliran endapan (seperti aliran minyak). Volume larutan BaCl2.2H O 5% yang digunakan selama pengetesan 2
dicatat. Percobaan dilakukan sekali lagi dengan berat ZA 0,1015 gram.
2. Tahap Penyaringan
Kertas saring Whatman 40 (kertas saring bebas abu) dilipat hingga seperempat lingkaran, kemudian dimasukkan ke dalam corong gelas. Kertas saring dibasahi dengan menggunakan aquadest hangat hingga tidak ada rongga. Larutan dituangkan ke corong gelas, sedikit demi sedikit dengan gelas pengaduk hingga semua larutan habis. 3. Tahap Pencucian
Aquadest sebanyak 400 ml dipanaskan dalam gelas beker 500 ml
dengan kompor listrik sampai suhu 30°C-40°C dan dimasukkan ke dalam botol semprot. Pencucian dilakukan dengan menyemprotkan dengan aquadest hangat dengan botol semprot pada gelas beker yang dipanaskan untuk larutan ZA berulang-ulang. Pengetesan dilakukan terhadap filtrat terakhir dengan cara meneteskan AgNO 1% pada 3
tetesan terakhir pada gelas arloji. Apabila larutan menjadi keruh, pencucian dilakukan hingga filtrat terakhir bila dilakukan pengetesan
3
AgNO 1% tidak keruh.
4. Tahap Pemijaran
Krus porselen dicuci dengan air bersih kemudian dikeringkan di dalam oven 60°C selama 15 menit. Krus porselen kemudian didinginkan dalam eksikator selama 10 menit. Krus porselen tersebut diukur beserta tutupnya dengan neraca analitis digital dan hasilnya dicatat. Kertas saring berisi endapan dimasukkan ke dalam krus porselen dan dimasukkan ke dalam muffle dengan tutup krus sedikit terbuka dengan suhu 200-400°C (selama 20 menit). Suhu muffle diturunkan sampai dibawah 200°C setelah muncul asap pada lubang
muffle kemudian dibuka tutup krus porselen lalu dipijarkan kembali
kedua krus sampai suhu 800°C. Suhu muffle diturunkan sampai suhu dibawah 200°C, lalu krus diambil dengan penjepit besi dan
didinginkan di dalam eksikator selama 15 menit. Krus beserta endapannya ditimbang dengan analitis digital dan dicatat hasilnya.
D. Analisis Data
1. Perhitungan jumlah endapan BaSO dari percobaan tiap sampel. 4
Untuk menganalisis berat endapan BaSO hasil percobaan 4
digunakan rumus:
mendapan=mkrus+tutup+endapan-mkruskosong+tutup (11) dimana, m=berat, gram
2. Menentukan tingkat kemurnian pupuk ZA
a. Menentukan jumlah mol BaSO (endapan) 4
1 1 1 m n Mr (12)
dimana, n1 = mol BaSO , mol 4
m1 = massa BaSO , gram 4
Mr1 = berat molekul BaSO , gram/mol 4
b. Menentukan massa
4
4 2NH SO dalam pupuk ZA
NH4
2SO4(aq)BaCl2(aq) BaSO4( )s 2NH Cl4 (aq) (2)karena
4
4 2NH SO dianggap habis bereaksi, maka:
mol BaSO = mol 4
NH4
2SO 42 2 2
m n Mr
dengan, m2= massa
NH4
2SO , gram 4 n2= mol
NH4
2SO , mol 4c. Menentukan kemurnian pupuk ZA 2 3 100% m Kemurnian m (14) dengan, m2= massa
4
4 2 NH SO , gramm3= massa pupuk ZA, gram
2
kemurnian
21 IV. HASIL DAN PEMBAHASAN
Hasil percobaan massa BaSO sampel I adalah 0,1773 gram. 4
Dengan perhitungan didapat jumlah mol BaSO sampel I adalah 4
4
7, 6094 10 mol. Karena memiliki Perbandingan stoikiometri 1:1 mol 4
BaSO sama dengan mol
NH4
2SO4 , sehingga massa
4
4 2NH SO
sampel I sebesar 0,1004 gram. Massa
4
4 2NH SO sampel I selanjutnya
dibandingkan dengan massa pupuk ZA sampel I yaitu sebesar 98,7656 %. Hasil percobaan massa BaSO sampel II adalah 0,1770 gram. 4
Dengan perhitungan didapat jumlah mol BaSO sampel II adalah 4
4
7,5966 10 mol. Karena memiliki Perbandingan stoikiometri 1:1 mol 4
BaSO sama dengan mol
NH4
2SO4 , sehingga massa
NH4
2SO 4sampel II sebesar 0,1003 gram. Massa
NH4
2SO sampel II selanjutnya 4dibandingkan dengan massa pupuk ZA sampel II yaitu sebesar 98,7792 %. Kemurnian pupuk ZA merek Riedel-de Haen adalah 99% (Pillai: 2009). Walaupun dengan merek yang sama, namun kemurnian sampel tidak dapat dibandingkan dengan referensi karena pada proses pembuatan maupun lama waktu simpan satu produk dengan produk lain berbeda.
Perbedaan kemurnian sampel I dan II disebabkan oleh tidak sempurnanya pembakaran kertas saring akibat penutupan krus di dalam
muffle tidak sama lebar. Selain itu perbedaan yang paling besar
diakibatkan oleh jumlah BaCl2.2H O 5% yang dimasukkan sehingga 2
muncul endapan BaSO4 dengan jumlah yang berbeda pula. Selain itu tahap peyaringan sampel I berlangsung lebih cepat dibanding sampel II.
22 V. KESIMPULAN
Kesimpulan yang dapat diperoleh dari percobaan analisis gravimetri ini adalah:
1. Analisis gravimetri dapat digunakan untuk menganalisis kemurnian pupuk ZA dengan tahapan pengendapan, penyaringan, pencucian dan pemijaran.
2. Hasil percobaan:
a. Berat endapan BaSO 4
Sampel I : 0,1773 gram
Sampel II : 0.1770 gram
b. Kemurnian pupuk ZA
Sampel I : 98,7656 %
23 VI. DAFTAR PUSTAKA
Aditya, I.M.P., 2013, “Analisis Gravimetri”, http://adiboga.blogspot.com/2013/03/analisis-gravimetri.html, Diakses pada Senin, 11 November 2013 (18.20).
Carmichael, A., 2010, “High School Chemistry Handbook” p.70, AuthorHouse, 500 Avebury Boulevard Central Milton Keynes, MK9 2BE.
Charan, D.D., 2011, “Analytical Chemistry” p.101-118, PHI Learning Pvt. Ltd., New Delhi.
Davis, R.E., Stanley, G.G., Peck, L.M., 2006, “Chemistry” 8th
ed., p.772, Cengage Learning, Belmont.
Ebbing, D.D., Gammon, S.D., 2010, “General Chemistry Enhanched Edition” 9th ed., p.158, Cengage Learning, Belmont.
Frank, Clyde, 2012, “Analytical Chemistry” p.90-124, Elsevier, London. Iqbal S.A., M.S. Setii, 1994, “An Introduction to Analytical Chemistry”
p.124-132, Discovery Publishing House, New Delhi.
Kenkel, John, 2002, “Analytical Chemistry for Technicians” 3rd ed., p.37-60, CRC Press, Florida.
Kopkar, S.M., 1998, “Basic Concepts Of Analytical Chemistry” p.20-28, New Age International, New Delhi.
Pillai, S.C., McCormack, D., Colreavy, J., Periyat, P., 2009, “One-Pot Synthesis of Anionic (Nitrogen) and Cationic (Sulfur) Codoped High-Temperature Stable, Visible Light Active, Anatase Photocatalyst”, Journal Phys. Chem. C, Vol. xxx, No. xx, XXXX. Vogel, A.I., 1989, “Textbook of Quantitative Chemical Analysis” 5th ed.,
Whatman, 2009, “Quantitative Filter Papers – Ashless Grades (Ash
0.007%)”,
http://www.Whatman.com/QuantitativeFilterPapersAshlessGrades. aspx, Diakses pada Selasa, 12 November 2013 (11.29).
25 VII. LAMPIRAN
A. Identifikasi Hazard Proses dan Bahan Kimia a. Hazard Proses
Bahaya yang dihadapi berkaitan dengan jalannya praktikum ini adalah:
1. Bahaya saat melakukan pemanasan dengan kompor listrik, antara lain:
Tersengat arus listrik saat menghidupkan saklar karena kondisi tangan yang basah.
Tidak sengaja menyentuh kasa/asbes saat pemanasan berlangsung.
Apabila saat pemanasan kompor listrik terletak di dekat kabel maka ada resiko kabel tersebut mengalami pemanasan dan terbakar.
Untuk pencegahannya, praktikan dapat melakukan hal-hal berikut: Memastikan tangan dalam kondisi kering saat
menghidupkan saklar.
Posisi tidak terlalu dekat dengan kompor listrik.
Memastikan kompor listrik tidak terletak di tempat yang membahayakan.
2. Saat proses pemijaran menggunakan muffle kita menghadapi resiko, yaitu:
Terkena udara panas karena membuka muffle yang masih menyala (suhu belum turun hingga batas aman di bawah 100°C).
Untuk pencegahannya, praktikan dapat melakukan hal berikut: Tidak membuka muffle yang masih bersuhu tinggi.
b. Hazard Bahan
Bahaya yang diakibatkan oleh bahan-bahan pada praktikum ini adalah: 1. ZA
4
4 2 NH SO Bahaya: Irritant (dapat menimbulkan iritasi bila terkena langsung). Dapat berupa iritasi pada kulit, mata dan paru-paru (bila terhirup).
Pencegahan: Menggunakan alat-alat perlindungan diri yaitu masker, sarung tangan, jas laboratorium dan sepatu tertutup.
Penanganan:
Kontak langsung dengan mata
Basuh dengan air bersih selama 15 menit. Apabila menggunakan lensa kontak, segera lepas dan bersihkan. Apabila parah sebaiknya segera mendapatkan perawatan medis.
2. BaCl2.2H O2
Bahaya: Irritant (menimbulkan iritasi pada mata dan kulit), berbahaya apabila termakan atau terhirup, bersifat toxic.
Pencegahan: Menggunakan alat-alat perlindungan diri yaitu masker, sarung tangan, jas laboratorium dan sepatu tertutup.
Penanganan:
Kontak langsung dengan mata
Basuh dengan air bersih selama 15 menit. Apabila menggunakan lensa kontak, segera lepas dan bersihkan. Apabila parah sebaiknya segera mendapatkan perawatan medis.
Kontak langsung dengan kulit
Basuh bagian kulit yang terkena dengan air bersih. Lepaskan sepatu atau pakaian yang sudah terkontaminasi dan bersihkan. Apabila parah sebaiknya segera mendapat perawatan medis.
Terhirup
Menghirup udara segar, apabila sampai sulit bernafas segera beri oksigen dan apabila parah sebaiknya segera mendapat perawatan medis.
3. AgNO 3
Bahaya: toxic, irritant, oxidizing
Pencegahan: Menggunakan alat-alat perlindungan diri yaitu masker, sarung tangan, jas laboratorium dan sepatu tertutup.
Penanganan:
Kontak langsung dengan mata
Basuh dengan air bersih selama 15 menit. Apabila menggunakan lensa kontak, segera lepas dan bersihkan. Apabila parah sebaiknya segera mendapatkan perawatan medis.
Kontak langsung dengan kulit
Basuh bagian kulit yang terkena dengan air bersih. Lepaskan sepatu atau pakaian yang sudah terkontaminasi dan bersihkan. Apabila parah sebaiknya segera mendapat perawatan medis.
Terhirup
Menghirup udara segar, apabila sampai sulit bernafas segera beri oksigen dan apabila parah sebaiknya segera mendapat perawatan medis.
B. Penggunaan Alat Perlindungan Diri a. Jas laboratorium lengan panjang
Untuk melindungi tubuh/kulit dari sentuhan langsung bahan kimia. Selain itu juga melindungi kulit/tubuh dari sentuhan langsung bahan-bahan dan alat-alat bersuhu tinggi.
b. Masker
Untuk menghalangi terhirupnya udara atau gas dari bahan-bahan yang beracun.
c. Sarung tangan
Untuk melindungi tangan dari sentuhan langsung bahan-bahan dan alat-alat bersuhu tinggi serta dari senyawa-senyawa/bahan-bahan yang bersifat merusak kulit tangan.
d. Sepatu tertutup
Untuk melindungi kaki dari sentuhan langsung bahan-bahan bersuhu tinggi dan bahan-bahan kimia.
e. Goggle
Untuk melindungi mata agar tidak terkena bahan kimia berbahaya yang biasanya masuk ke mata dalam bentuk partikel-partikel kecil melalui udara.
C. Manajemen Limbah
Reaksi antara BaCl2.2H O2 dan ZA:
4 2 4( ) 2 2 ( ) 4(s) 4 ( ) 2 ( )
(NH ) SO aq BaCl .2H Oaq BaSO 2NH Claq 2H Ol (1)
Hasil reaksi mengandung senyawa NH Cl dan ada senyawa 4
2
BaCl akibat jika penambahan BaCl2.2H O2 5% berlebih pada tahap penyaringan. Kedua senyawa yang dihasilkan mengandung ion Cl yang bersifat halogenik, sehingga limbah dari praktikum ini dibuang ke jerigen halogenik.
D. Data Percobaan Berat ZA
4
4 2 NH SO Sampel I : 0,1017 gram Sampel II : 0,1015 gram1. Penambahan Larutan BaCl2.2H O 2
Daftar I. Data Hasil Penambahan Larutan BaCl2.2H O 2
No Tahap Pengendapan (ml) Tahap Pengetesan (ml)
1. 7,50 0,60
2. 7,50 0,50
2. Berat Endapan Kosong
Daftar II. Data Hasil Penimbangan Berat Krus dan Endapan No. Berat Krus Kosong
(gram)
Berat krus + endapan (gram) Berat endapan (gram) 1 34,9037 35,0810 0,1773 2 31,4462 31,6232 0,1770 Rata-rata 0,1772 E. Perhitungan
1. Perhitungan Jumlah Endapan BaSO 4
Menghitungan berat endapan BaSO dari hasil percobaan dengan 4 persamaan (11)
Sampel I: berat krus + tutup + endapan = 35,0810 gram berat krus kosong + tutup = 34,9037 gram
berat endapan = (35,0810-34,9037) gram = 0.1773 gram
Sampel II: berat krus + tutup + endapan = 31,6232 gram berat krus kosong + tutup = 31,4462 gram
berat endapan = (31,6232-31,4462) gram = 0.1770 gram
2. Menentukan Tingkat Kemurnian Pupuk ZA
a. Menghitung jumlah mol BaSO (endapan) dengan menggunakan 4
persamaan (12)
Sampel I : massa BaSO 4 = 0,1773 gram Sampel II : massa BaSO 4 = 0.1770 gram Berat molekul BaSO 4 = 233,00 g/mol
Sampel I : mol BaSO 4 = 0,1773 233, 00 /
gram g mol
=7, 6094 10 4 mol Sampel II : mol BaSO 4 =
0,1770 233, 00 /
gram g mol
=7,5966 10 4 mol b. Menghitung massa
NH4
2SO dalam pupuk ZA dengan 4persamaan (13)
Menurut persamaan reaksi:
4 2 4( ) 2 2 ( ) 4(s) 4 ( ) 2 ( )
(NH ) SO aq BaCl .2H Oaq BaSO 2NH Claq 2H Ol (1)
mol BaSO = mol 4
NH4
2SO karena 4
NH4
2SO dianggap habis 4bereaksi.
Sampel I: massa
NH4
2SO = 44
7,6094 10 mol132,00 /g mol
= 0,1004 gram
Sampel II: massa
NH4
2SO = 4 7,5966 10 4mol132,00 /g molc. Menghitung kemurnian pupupk ZA dengan menggunakan persamaan (14)
d. Sampel I: massa
NH4
2SO 4 = 0,1004 grammassa pupuk ZA = 0,1017 gram
Kemurnian =0,1004 100% 0,1017
gram
gram
= 98,7656 %
Sampel II: massa
NH4
2SO 4 = 0,1003 grammassa pupuk ZA = 0,1015 gram
Kemurnian =0,1003 100% 0,1015
gram
gram
= 98,7928 %
Kemurnian rata-rata dihitung dengan persamaan (15)
Sampel I: Kemurnian = 98,7656 %
Sampel II: Kemurnian = 98,7928 %
Kemurnian rata-rata = 98, 7656% 98, 7928% 2
LAPORAN SEMENTARA GRAVIMETRI
(G)
Nama Praktikan : 1. Adimas Prasetyaaji NIM : 1. 40007
2. Kurniawan 2. 39831
Hari/Tanggal : Kamis/24 Oktober 2013 Asisten : Arini Muthiah Rosmaya Putri
DATA PERCOBAAN Berat ZA : 1. 0,1017 gram
2. 0,1015 gram
1. Penambahan Larutan BaCl2.2H2O
No. Tahap Pengendapan, ml Tahap Pengetesan , ml
1 7,50 0,60
2 7,50 0,50
2. Berat Endapan Kosong
No. Berat krus kosong, gr Berat krus + endapan, gr Berat endapan, gr
1 34,9037 35,0810 0,1773 2 31,4462 31,6232 0,1770 Rata-Rata 0,1772 Yogyakarta, 24 Oktober 2013 Praktikan, 1. 2. Asisten Jaga,