Mekanisme In Vitro Induksi Apoptosis dari RIP
(Ribosome-Inactivating Protein) Daun Bunga Pukul Empat (Mirabilis jalapa L)
In Vitro Mechanism of Apoptosis Induction of RIP
(Ribosome-InactivatingProtein) Isolated from Bunga Pukul Empat (Mirabilis jalapa
L) Leaves
Atina Hussaana1*, Chodidjah2, Sismindari3 dan Sudjadi3
ABSTRACT
Background: Ribosome-inactivating protein (RIP) isolated from the leave of Mirabilis jalapa L (MJ Protein)
has shown to possess anticancer activity by triggering apoptosis in HeLa cells in vitro. This study aimed at finding out the trigger mechanisms that induces apoptosis of RIP.
Design and Method: This study was conducted by giving the treatment of MJ Protein to the Hela cell culture
in vitro. Then the expression of and activation of caspase-3 were observed using Immunohistochemistry and colorimetry method.
Result: The data showed that the MJ protein treatment increased the caspase-3 expression and increased
the activity of caspase-3 in Hela cel culture in vitro.
Conclusion: This result indicates the anticancer potential of MJ protein through its effect on signal
tranduction process leading to apoptosis through caspase activation with caspase-3 as apoptosis executor (Sains Medika, 2(1): 23-31).
Key words: Mirabilis jalapa L , Protein MJ, apoptosis, caspase-3
ABSTRAK
Pendahuluan: Ribosome-inactivating protein (RIP) dari daun Mirabilis jalapa, L (Protein MJ) telah diketahui
potensinya sebagai antikanker karena mampu memacu apoptosis secara in vitro pada kultur sel HeLa. Penelitian ini dilakukan untuk mengetahui kemungkinan jalur mekanisme pemacuan apoptosis dari RIP tersebut, apakah melalui aktivasi caspase.
Metode Penelitian: Penelitian ini dilakukan dengan memberikan perlakuan Protein MJ secara in vitro
pada kultur sel HeLa, kemudian dilihat ekspresi dan aktivitas caspase-3 melalui pengecatan imunositokimia dan dengan metode kolorimetri.
Hasil penelitian: Data penelitian menunjukkan bahwa pemberian Protein MJ mampu meningkatkan
ekspresi caspase-3 dan meningkatkan aktivitas caspase-3 pada kultur sel HeLa secara in vitro.
Kesimpulan: Hasil penelitian tersebut mengimplikasikan potensi antikanker dari Protein MJ melalui
pengaruhnya pada proses transduksi sinyal yang memacu apoptosis, melalui aktivasi caspase, dengan caspase-3 sebagai eksekutor terjadinya apoptosis (Sains Medika, 2 (1): 23-31).
Kata kunci : Mirabilis jalapa, L , Protein MJ, apoptosis, caspase-3
PENDAHULUAN
Kanker merupakan penyakit yang menyebabkan kematian nomor dua setelah penyakit jantung di Amerika, dan nomor enam di Indonesia (Anonim, 1998). Selama ini pengobatan kanker dilakukan dengan pembedahan, kemoterapi dan radiasi. Antikanker yang digunakan dalam kemoterapi, selama ini didasarkan pada kemampuan menghambat proliferasi sel, sehingga sel normal pun akan terkena dampaknya. Strategi baru untuk
1 Bagian Farmakologi Fakultas Kedokteran Universitas Islam Sultan Agung (UNISSULA) * Email: atinahussaana@yahoo.com
2 Bagian Anatomi Fakultas Kedokteran Universitas Islam Sultan Agung (UNISSULA) 3 Fakultas Farmasi Universitas Gadjah Mada Yogyakarta
mengembangkan antikanker dengan tujuan untuk mengurangi efek samping, salah satunya adalah dengan mempengaruhi transduksi sinyal yang menuju apoptosis, sehingga merupakan antikanker yang selektif dan spesifik (Carmichael, 1994).
Ribosome-Inactivating Protein (RIP) adalah protein tanaman yang terdistribusi luas pada tanaman. Protein tersebut menghambat sintesis protein karena aktivitas RNA N-glikosidasenya, dengan memotong ikatan glikosidik adenin tertentu pada 28S rRNA (26S rRNA khamir). Pemotongan ini mencegah pengikatan faktor perpanjangan 2 (EF-2) pada ribosom sehingga sintesis protein berhenti (Chaddock et al., 1996). Selain aktivitas N-glikosidase, RIP juga mempunyai aktivitas memotong DNA plasmid superkoil dan sirkuler secara in vitro (Roncuzzi & Gasperi-Campadin, 1996). Protein sejenis RIP dari Mirabilis jalapa L telah dibuktikan mampu menginduksi apoptosis pada sel HeLa (Ikawati et al., 2002). Protein sejenis RIP dari Mirabilis jalapa L tersebut kemudian diisolasi dan dimurnikan sehingga diperoleh Protein MJ atau MJ-30, RIP dengan ukuran 30 kDa (Sudjadi et al., 2003) yang bertanggung jawab terhadap induksi apoptosis. Adanya kemampuan induksi apoptosis tersebut menjadikan Protein MJ berpotensi sebagai kandidat antikanker. Akan tetapi, mekanisme aksi yang terlibat di dalam proses induksi apoptosis tersebut sebagai penentu selektivitas dan spesifisitas antikanker, belum diketahui.
Apoptosis dapat terjadi dengan mekanisme yang beragam, diantaranya adalah: (1) apoptosis yang dipicu oleh sinyal dari dalam sel, biasanya melalui aktivasi 9, (2) apoptosis yang dipicu oleh sinyal dari luar sel, biasanya melalui aktivasi caspase-8, (3) apoptosis yang dipicu oleh Apoptosis-Inducing Factor (Anonim, 2003 a). Adapun caspase (Cystein Aspartate Specific Proteases) merupakan enzim yang bertanggungjawab terhadap perusakan (disasembly) sel secara sengaja menjadi bentuk apoptotik. Caspase-8 mengawali proses perusakan sebagai respon terhadap ligan ekstraseluler yang mengaktivasi death domains pada reseptor sitoplasma (Ashkenazi & Dixit, 1998 cit. Anonim, 2003 b). Caspase-9 mengawali perusakan sebagai respon terhadap zat yang memacu pelepasan sitokrom C dari mitokondria (Liu et al., 1996; Green & Reed, 1998 cit. Anonim, 2003 b), sedangkan caspase-3 mengamplifikasi sinyal dari caspase-8 atau caspase-9 menuju apoptosis (Li et al., 1997 cit. Anonim 2003 ). Adapun ricin, suatu RIP dari tanaman Ricinus communis, ternyata mampu menginduksi apoptosis melalui aktivasi caspase-3 (Keppler-Hafkemeyer et al., 1998 cit. Anonim, 1999). Dari penelitian tersebut,
timbul dugaan bahwa induksi apoptosis oleh MJ-30 kemungkinan juga melalui aktivasi caspase. Untuk membuktikan hal tersebut, dilakukan penelitian ini.
METODE PENELITIAN Isolasi dan pemurnian
Protein MJ diperoleh dengan mengisolasi protein dari daun Mirabilis jalapa L menggunakan dapar natrium fosfat 5 mM pH 7,2 yang mengandung 0,14 M natrium klorid pada suhu 4°C (Stirpe et al., 1983). Ekstrak protein yang diperoleh kemudian dimurnikan dengan kromatografi kolom menggunakan fasa diam CM Sepharose CL-6B dan dielusi dengan dapar natrium fosfat 5 mM pH 6,5. Setelah semua puncak keluar, protein yang terikat pada fasa diam dielusi dengan dapar natrium fosfat 50 mM yang mengandung natrium klorid secara bergradien. Protein MJ dihasilkan dari fraksi yang terelusi pada kadar natrium klorid sekitar 0,25 - 0,3 M (Sudjadi et al., 2003). Fraksi tersebut mempunyai aktivitas mampu memotong DNA superkoil dan mempunyai ukuran protein 30 kDa.
Uji ekspresi Caspase-3 dengan imunositokimia
Sel HeLa dengan konsentrasi sel 5 x 105 sebanyak 100 µl diinkubasi bersama MJ-30
dengan dosis 1,52 dan 4,55 µg/200 µl selama 24 jam. Pada akhir inkubasi, sel dipanen dan dicuci dengan PBS (Phosphate Bovine Saline). Sel kemudian diteteskan di atas gelas obyek polilisin dan dilakukan pengecatan imunositokimia dengan antibodi terhadap caspase-3. Hasil pengecatan diamati dibawah mikroskop dengan perbesaran 1000 kali dan dibandingkan dengan kontrol tanpa Protein MJ.
Uji Aktivitas Caspase-3 dengan metode pengukuran aktivitas secara kolorimetri (Caspase-3 Colorimetric Assay kit, Promega)
Sel HeLa dengan konsentrasi 106 sel/ml sebanyak 1 ml diinkubasi bersama MJ-30
dengan dosis 0,056 µg/µl selama 24 jam. Setelah inkubasi, sel dipanen dan dicuci dengan PBS. Sel disentrifugasi dan diresuspensikan dalam buffer lisis. Setelah inkubasi selama 15 menit di atas es, debris sel disentrifugasi pada 12.000 g, 20 menit, 4°C. Supernatan diambil dan diberi 2 µl substrat DEVD-pNA (Caspase-3 Colorimetric Assay kit). Substrat akan dipecah menghasilkan kromofor p-nitroanilida yang bisa ditetapkan secara spektrofotometri.
HASIL PENELITIAN Uji ekspresi Caspase-3
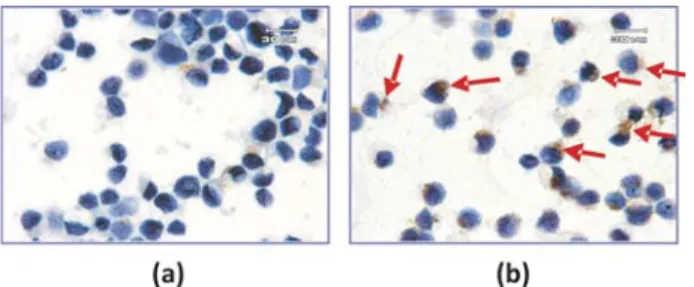
Pada penelitian sebelumnya telah diketahui bahwa protein MJ hasil isolasi dari daun M. jalapa L. mampu menginduksi apoptosis pada sel HeLa dengan menyebabkan fragmentasi DNA (data tidak ditunjukkan). Hal tersebut mendorong dilakukannya penelitian untuk mengetahui mekanisme induksi apoptosis atau jalur transduksi sinyal pada proses induksi apoptosis tersebut. Untuk itu, pada penelitian ini dilakukan uji ekspresi caspase-3 untuk mengetahui jalur transduksi sinyal apakah melalui aktivasi caspase (caspase-dependent apoptosis). Data pengecatan imunositokimia terhadap caspase-3 (Gambar 1.), menunjukkan adanya peningkatan warna coklat pada sitoplasma sel yang mendapat perlakuan dengan Protein MJ (dosis 7,6 ng/µl). Hal tersebut menandakan terjadinya peningkatan caspase-3.
Gambar 1. Peningkatan ekspresi caspase-3 pada sel HeLa karena perlakuan Protein MJ
selama 24 jam dengan metode imunositokimia (perbesaran 1000 kali): (a) Sel HeLa kontrol tanpa perlakuan Protein MJ, (b) Sel HeLa yang mendapat perlakuan dengan Protein MJ 7,6 ng/µl. Terlihat adanya peningkatan jumlah sel yang mempunyai sitoplasma berwarna coklat (tanda panah merah)
Uji aktivasi Caspase-3 dengan metode pengukuran aktivitas secara kolorimetri (Caspase-3 Colorimetric Assay kit, Promega)
Proses transduksi sinyal menuju apoptosis pada umumnya tergantung pada aktivitas caspase (Cysteine Aspartic Acid-specific Protease) atau caspase-dependent apoptosis. Untuk mengetahui apakah proses apoptosis yang diinduksi oleh Protein MJ pada sel HeLa merupakan caspase-dependent apoptosis, pada penelitian ini dilakukan pengukuran aktivitas caspase-3. Prinsip pengukuran aktivitas caspase pada penelitian ini didasarkan pada kemampuan caspase-3 untuk memotong substrat spesifik yang dilabel dengan kromofor nitroanilin (Ac-DEVD-pNA). Pemotongan tersebut akan menghasilkan
p-nitroanilin bebas berwarna kuning yang dapat ditetapkan kadarnya secara spektrofotometri pada 405 nm. Jumlah p-nitroanilin yang terbentuk sebanding dengan besar aktivitas caspase-3 (Thornberry, 1994). Induksi apoptosis oleh caspase-3 akan dihambat oleh Z-VAD-FMK yang merupakan inhibitor caspase-3. Inhibitor tersebut akan memblok sisi pemotongan substrat oleh caspase-3 secara ireversibel (Hartfield et al., 1998).
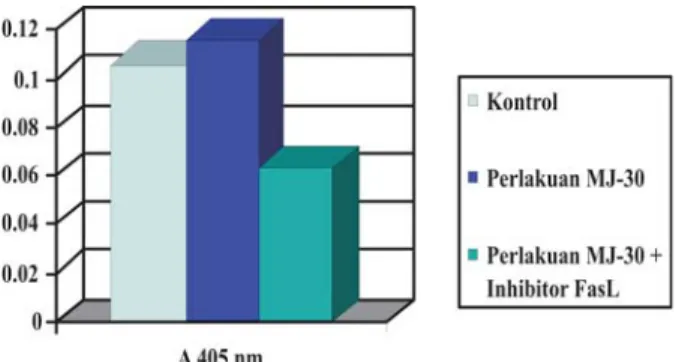
Hasil uji aktivasi caspase menunjukkan bahwa MJ-30 menyebabkan peningkatan aktivitas caspase-3. Sel HeLa yang mendapat perlakuan dengan MJ-30 dosis 0,056 µg/µl, mengalami peningkatan aktivitas caspase-3 sebesar 9,5 % dibanding dengan sel HeLa kontrol, sedangkan pada sel HeLa yang mendapat perlakuan dengan MJ-30 dan Z-VAD-FMK, aktivitas caspase-3 nya sangat rendah yaitu 40,6% dibawah kontrol (Gambar 2).
Gambar 2. Aktivitas Caspase-3. Aktivitas caspase-3 ditunjukkan dengan besar serapan pada 405 nm (A405 nm). Aktivitas caspase-3 pada sel HeLa kontrol, sel HeLa yang mendapat perlakuan dengan MJ-30 0,056µg/µl dan yang mendapat perlakuan dengan MJ-30 + Z-VAD-FMK, berturut-turut adalah 0,106; 0,116 dan 0,063. Terjadi peningkatan aktivitas caspase-3 yang diakibatkan oleh MJ-30, sebesar 9,5% .
PEMBAHASAN
Protein MJ yang merupakan Ribosome inactivating protein hasil isolasi dari daun M. jalapa, mampu menginduksi apoptosis melalui jalur aktivasi caspase (caspase-dependent apoptosis). Secara lebih detil, jalur aktivasi caspase yang diinduksi oleh Protein MJ ternyata dimulai dari peningkatan ekspresi protein p53 (Hussaana et al., 2010) yang menjadi upstream dalam proses transduksi sinyal menuju apoptosis.
faktor transkripsi dari gen-gen yang menjadi target gen p53 (downstream gen). Target gen p53 dan fungsi fisiologis dari masing-masing target gen tersebut sangat beragam. Diantara target gen p53 tersebut adalah gen Bax yang akan meneruskan proses transduksi sinyal menuju apoptosis. Peningkatan ekspresi protein p53 kemungkinan akan diikuti dengan peningkatan transkripsi Bax. Protein Bax akan bertindak sebagai penghambat transkripsi Bcl-2, suatu protein anti apoptosis. Peningkatan ekspresi Bax dan penurunan ekspresi Bcl-2 akan memacu pelepasan sitokrom C dari mitokondria (Liu et al., 1996 ; Green & Reed, 1998 cit. Anonim, 2003). Sitokrom C akan mengaktifkan jalur selanjutnya yang merupakan rangkaian proses proteolitik yang dikatalisis oleh caspase.
Adapun caspase (Cystein Aspartate Specific Proteases) merupakan enzim yang bertanggungjawab terhadap perusakan (disasembly) sel secara sengaja menjadi bentuk apoptotik. Caspase adalah kelompok enzim protease yang berperan dalam apoptosis sel mamalia (Nicholson et al., 1995). Aktivasi caspase terjadi sebagai akibat dihentikannya growth factor, pemaparan radiasi atau zat kemoterapi, atau inisiasi proses kematian sel yang diperantarai reseptor Fas/Apo-1.
Pada penelitian ini telah dibuktikan bahwa Protein MJ mampu meningkatkan aktivitas caspase-3 pada sel HeLa. Caspase-3 mempunyai peran sentral dalam rangkaian reaksi apoptosis, secara spesifik memotong ujung C dari residu aspartat dari urutan asam amino DEVD (Asp-Glu-Val-Asp) (Garcia et al., 1999). Walaupun peningkatan aktivitas caspase-3 yang terjadi relatif kecil, tetapi hasil tersebut sejalan dengan hasil uji ekspresi 3 dengan imunositokimia yang menunjukkan adanya peningkatan ekspresi caspase-3 pada sel HeLa yang mendapat perlakuan dengan Protein MJ.
Mekanisme induksi apoptosis oleh protein MJ pada sel HeLa melalui jalur aktivasi caspase, didahului oleh peningkatan ekspresi protein p53 dan akhirnya akan terjadi aktivasi caspase-3 sebagai eksekutor terjadinya apoptosis. Sebagai catatan, pada penelitian ini telah ditunjukkan bahwa Z-VAD-FMK, suatu inhibitor caspase-3 mampu mencegah aktivasi caspase-3 yang disebabkan oleh MJ-30, tetapi pada percobaan lebih lanjut ternyata Z-VAD-FMK tidak menyebabkan penghambatan apoptosis yang diinduksi oleh Protein MJ (data tidak ditunjukkan). Hal tersebut merupakan temuan yang menarik yang mengarah pada dugaan bahwa induksi apoptosis oleh Protein MJ kemungkinan melibatkan dua mekanisme, yaitu jalur aktivasi caspase (caspase-dependent apoptosis) maupun jalur
diluar aktivasi caspase (caspase-independent apoptosis). Walaupun masih memerlukan penelitian lebih lanjut, dugaan terlibatnya dua mekanisme penginduksian apoptosis tersebut menyebabkan Protein MJ menjadi kandidat antikanker yang lebih potensial. Potensi lebih dari Protein MJ tersebut adalah terbukanya peluang Protein MJ untuk dikembangkan menjadi anti kanker, baik untuk sel kanker yang tidak terdapat mutasi pada gen p53 sehingga dapat diinduksi apoptosisnya melalui jalur aktivasi caspase, maupun sel kanker yang terdapat mutasi pada gen p53 yang resisten terhadap induksi apoptosis melalui jalur aktivasi caspase.
KESIMPULAN
Protein MJ hasil isolasi dari daun Mirabilis jalapa L mampu memacu apoptosis dengan jalur aktivasi caspase. Jalur tersebut diawali dengan peningkatan ekspresi protein p53 sebagai upstream regulator yang kemudian melalui rangkaian proses transduksi sinyal sampai pada peningkatan ekspresi dan aktivitas caspase-3 sebagai eksekutor terjadinya apoptosis.
SARAN
Pengembangan Protein MJ sebagai anti kanker, baik untuk sel kanker yang tidak terdapat mutasi pada gen p53 sehingga dapat diinduksi apoptosisnya melalui jalur aktivasi caspase, maupun sel kanker yang terdapat mutasi pada gen p53 yang resisten terhadap induksi apoptosis melalui jalur aktivasi caspase.
UCAPAN TERIMAKASIH
Terimakasih kepada Dirbinlitabmas Ditjen Dikti yang telah membiayai penelitian ini melalui Proyek Hibah Pekerti Angkatan II dengan nomor kontrak: 347/P4T/DPPM/HPTP/ IV/2004.
DAFTAR PUSTAKA
Anonim, 1998, Apoptosis : Caspase Pathways, Cytokine Bulletin, www. rndsystems. com, Dikutip tgl. 23.06.2007.
Anonim, 1999, Immunotoxin induced Apoptosis, Cytokine Bulletin, www. rndsystems.com, Dikutip tgl. 28.06.2007.
Anonim, 2003, Apoptosis, www. rndsystem. com; October 2003, Dikutip tgl. 30.05.2008. Anonim, 2003, Apoptosis, http: // users.rcn.com/ jkimball.ma.ultranet/Biology Pages/A/
Apoptosis. Html, Dikutip tgl. 03.08.2009.
Brigotti, M, Alfieri, R, Sestili, P., Bonelli, M, Petronini, P.G., Guidarelli, A. , Barbieri, L. , Stirpe, F. , dan Sperti, S. , 2002, Damage to nuclear DNA induced by Shiga toxin 1 and ricin in human endothelial cells, The FASEB Journal, 16:365 – 372.
Carmichael, J. , 1944, Current Issues in Cancer : Cancer Chemotherapy : Identifying novel anti cancer drugs, BMJ 308: 1288 – 1290.
Chaddock, J. A., Mozingo, A. E., Robertus, J. D., Lord, J. M ., and Robert, L. M., 1996. Major structural differences between pokeweed antiviral protein and ricin A-chain do not account for their differing ribosome specificity, J. Biochem, 235: 159 – 166 Garcia, C.M., et al., 1999, Purification and catalytic properties of human caspase family
members, Cell Death Diff., 6: 362-369.
Hartfield, P. J., Bilney, A. J., and Murray, A. W., 1998, Neurotrophic factors prevent ceramid-induced apoptosis downstream of c-Jun N-terminal kinase activation in PC12 cells, J. Neurochem., 71:161-9.
Hussaana A., Chodidjah, Sismindari, Sudjadi, 2010, Jalur Induksi Apoptosis RIP Hasil Isolasi Daun Mirabilis jalapa, L pada Kultur Sel HeLa, Prosiding Seminar Nasional Farmasi, Imunomodulator dan Perkembangannya, Semarang 15 Mei 2010 (In press). Ikawati, Z., Sudjadi, Sismindari, Sari, R. P., dan Maulani, N., 2002. Efek fraksi sejenis RIP
(Ribosome inactivating protein) yang diisolasi dari akar Mirabilis Jalapa L terhadap proses kematian sel HeLa dan sel Raji, Biologi, 2: 769 – 783.
Kasagi, N., 1999, Ethanol induces apoptosis in human gastric carcinoma cells:The role of apoptosis related molecules, Yonago Acta Me, 42: 197 – 199.
Nelson, DL, Cox, MM., 2000, Lehninger Principles of Biochemistry, 3rd ed.Worth Publ., New
York, p. 476 – 477.
Nicholson, D. W., 1995, Identification and inhibition of the ICE/CED-3 protease necessary for mammalian apoptosis, Nature 376: 37-43.
Roncuzzi, L ., and Gasperi – Campani A ., 1996, DNA nuclease activity of the single chain ribosome inactivating proteins diathin 30, saporin 6 and gelonin, FEBS Let., 392: 16 –20.
Sambrook J, Fritsch E. F and Maniatis T., 1989, Molecular cloning, A laboratory manual, Second edition, Cold Spring Harbor Laboratory Press, New York.
Sharif-Askari, E. et al., 2001, Direct cleavage of the human DNA-fragmentation factor-45 by granzyme B induces caspase-activated DNase release and DNA fragmentation, The EMBO Journal, 20( 12): 3101-3113.
Sismindari and Lord , J.M . 2000 . Ribosome-Inactivating Protein: RNA N-glycosidase activity of Miabilis Jalapa L. Morinda citrifolia L and Carica papaya L, Indon J. Biotech., 324-345.
Stirpe, F. and Barbieri, L., 1986, Ribosome- Inactivating Proteins up to date, FEBS Lett., 195: 1- 8.
Sudjadi, Ikawati. Z., Sismindari, Krisandika, F. A., 2002, Efek fraksi protein dan biji Mirabilis Jalapa , L pada proses kematian sel Hela, Biologi., 2: 743 – 754
Suprapti, E., 1997, Identifikasi RIPs dari daun, akar dan biji Kembang Pukul Empat ( Mirabilis jalapa ) yang tumbuh di Jawa Indonesia, Skripsi, Fakultas Farmasi UGM, Yogyakarta. Sudjadi, Sismindari, Herawati, T. dan Prasetyowati, A. T., 2003, Pemurnian Ribosome Inactivating Protein (RIP) dari daun Mirabilis Jalapa L. dengan kolom CT9 – Sepharose CL- 6B dan Sephacryl S- 300 HR, Majalah Farmasi Indonesia, 14 (2): 316-321.
Thornberry, N.A., 1994, Interleukin-1 beta converting enzyme, Meth. Enzymol., 244: 615-31.