RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden
Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP
Standar Kompetensi
1. Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat-sifat senyawa
Kompetensi Dasar
1.1.Menjelaskan teori atom Bohr dan mekanika kuantum untuk menuliskan konfigurasi elektron dan diagram orbital serta menentukan letak unsur dalam tabel periodik
I. Indikator Pencapaian Kompetensi
1. Memahami percobaan Bohr tentang spektra atom hidrogen 2. Memahami ide pokok teori atom Bohr
3. Memahami kelemahan teori atom Bohr II. Tujuan Pembelajaran
Siswa dapat:
1. Memahami percobaan Bohr tentang spektra atom hidrogen 2. Memahami ide pokok teori atom Bohr
3. Memahami kelemahan teori atom Bohr III. Materi Pembelajaran
Teori atom Bohr IV. Metode Pembelajaran
1. Pendekatan pembelajaran : scientific approach 2. Model pembelajaran : TGT
V. Langkah-Langkah Pembelajaran
Deskripsi Alokasi Waktu
1. Salam pembuka
2. Berdoa sebelum memulai pelajaran, mengecek kehadiran siswa, dan menanyakan kesiapan siswa untuk belajar
3. Motivasi dan Apersepsi: Ketika kelas X, kita telah mempelajari perkembangan teori atom, mulai dari yang paling sederhana sampai yang paling modern. Coba sebutkan teori atom apa saja yang telah kalian pelajari. Bagaimana ide pokok dari masing-masing teori tersebut? Bagaimana kelemahan teori atom Rutherford? Apakah di dalam atom, inti dan elektron saling tarik-menarik? Apa yang terjadi jika elektron tarik menarik dengan inti atom? Apakah akan ada atom? Teori atom Rutherford memberikan pertanyaan yang tak terjawab untuk kita. Menurut hukum fisika klasik, materi yang bergerak akan kehilangan energi dalam bentuk gelombang elektromagnetik. Elektron termasuk materi, elektron
mengelilingi inti atom, elektron akan kehilangan energi sehingga elektron dapat tertarik ke inti. Jika hal ini terjadi, maka atom akan hancur, tetapi pada kenyataannya tidak demikian Kegiatan inti Fase 2
1. Guru menyampaikan tujuan pembelajaran yang akan dicapai
2. Guru menyampaikan materi tentang teori atom Bohr
1. Guru membagi siswa menjadi 7 kelompok, tiap kelompok terdiri dari 4-5 siswa dengan kemampuan yang heterogen
2. Guru membagikan LKS berisi latihan soal tentang teori atom Bohr kepada masing-masing kelompok
1. Guru membimbing siswa dalam diskusi membahas latihan soal bab teori atom Bohr
2. Siswa melakukan tanya-jawab dan berdiskusi dengan teman satu kelompok mengenai materi yang disampaikan
3. Menyimpulkan hasil diskusi tentang teori atom Bohr
1. Siswa diminta untuk 75
Evaluasi
Fase 6 Memberikan penghargaan
mempresentasikan hasil diskusi kelompoknya di depan kelas
2. Siswa yang
mempresentasikan hasil kelompok mendapatkan skor individu dan skor kelompok 3. Guru memberikan tanggapan
terhadap hasil kerja siswa, memberikan penguatan, menjelaskan hal-hal yang belum diketahui dan menyimpulkan hasil pembelajaran
1. Guru mengapresiasi keaktifan masing-masing kelompok dengan memberikan skor
Penutup 1. Guru bersama-sama dengan
siswa membuat kesimpulan tentang teori atom Bohr 2. Guru menyampaikan materi
ajar yang akan dibahas pada pertemuan selanjutnya, yaitu teori atom mekanika kuantum
3. Guru menutup pelajaran dan memberi salam penutup
VI. Alat dan Sumber Belajar
1. Alat dan Bahan: alat tulis, internet, ppt 2. Sumber belajar:
Das Salirawati. 2007. Belajar Kimia Secara Menarik untuk SMA/MA Kelas XI. Jakarta: Grasindo
Sunardi dan Dini Kurniawati. 2015. Kimia Berbasis Pendidikan Karakter Bangsa untuk SMA/MA. Bandung: PT. Sewu (Srikandi Empat Widya Utama)
VII. Penilaian
Siswa mengerjakan latihan soal dan soal games
Bantul, 17 Juli 2016
Guru Pembimbing Lapangan Mahasiswa PPL
Wiji Wati, S.T
NIP. 19810910 201101 2 003
LAMPIRAN 1: MATERI PEMBELAJARAN
Pada tahun 1913 Bohr memperkenalkan model atomnya untuk menjelaskan bahwa elektron dapat mempunyai orbit yang stabil dan mengelilingi inti. Pergerakan elektron pada model atom Rutherford merupakan gerak yang tidak stabil. Berdasarkan teori mekanika klasik dan elektromagnetik, suatu partikel yang bermuatan akan memancarkan radiasi elektromagnetik saat bergerak sesuai dengan orbitnya, sehingga elektron semakin lama akan kehilangan energinya dan akan bergerak secara spiral menuju ke inti atom.
Berdasarkan fisika klasik, suatu elektron yang mengorbit suatu inti atom akan memancarkan radiasi elektromagnetik (foton) secara terus menerus, sebab elektron tersebut secara terus-menerus mempercepat gerakannya dalam orbitnya. Sebagai akibat dari hilangnya energi, elektron tersebut bergerak secara spiral dan jatuh menuju ke inti atom dengan waktu yang sangat singkat.
Bohr memperbaiki model atom Rutherford pada bagian stabilitas elektron. Bohr beranggapan bahwa elektron bergerak dalam orbit pada ukuran dan energi tertentu. Energi suatu elektron bergantung pada ukuran orbit, semakin kecil orbitnya energinya juga semakin rendah. Tingkat energi paling rendah adalah kulit elektron yang terletak paling dalam, semakin keluar semakin besar nomor kulitnya dan semakin tinggi tingkat energinya Sedangkan radiasi hanya dapat terjadi saat elektron berpindah dari satu orbit ke orbit yang lain. Atom yang paling stabil adalah atom dengan orbit yang paling kecil, yaitu orbit yang berada paling dekat dengan inti atom, sebab tidak ada elektron dengan energi yang lebih rendah dimana elektron tersebut dapat berpindah.
Bohr menyatakan bahwa elektron bergerak pada orbit tertentu. Suatu elektron dapat berpindah antar lintasan dengan menyerap atau memancarkan suatu foton dengan panjang gelombang tertentu.
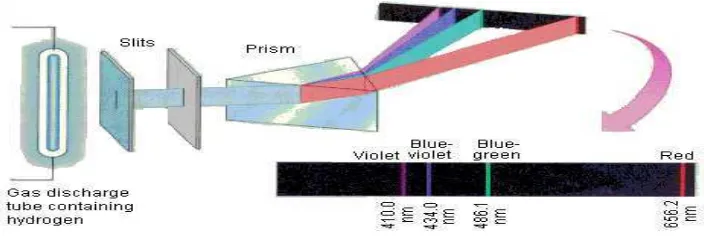
Niels Bohr melalui percobaannya tentang spektrum atom hidrogen berhasil memberikan penjelasan bagaimana elektron-elektron berada di daerah sekitar inti atom.
Percobaan dilakukan dengan menggunakan gas hidrogen bertekanan rendah dalam tabung yang dihubungkan dengan listrik tegangan tinggi dan menyebabkan gas hidrogen tersebut terurai menjadi atom-atom hidrogen yang memancarkan energi dalam bentuk foton (cahaya). Foton ini kemudian dilewatkan ke dalam celah sempit dan diteruskan oleh prisma. Cahaya yang keluar dari prisma ditangkap oleh layar dan menunjukkan adanya spektrum garis atom hidrogen. Spektrum garis yang dihasilkan merupakan bukti bahwa elektron mengelilingi inti pada lintasan tertentu dan dapat berpindah lintasan dengan jalan menyerap atau melepaskan energi. Penjelasan Niels Bohr didasarkan pada dua anggapan (postulat), untuk menjawab kelemahan teori atom yang dikemukakan oleh Rutherford:
1. Elektron mengelilingi inti atom pada lintasan tertentu yang stasioner disebut orbit atau kulit. Walaupun elektron bergerak cepat, tetapi elektron tidak memancarkan atau menyerap energi elektron konstan. Hal ini berarti elektron yang berputar mengelilingi inti atom mempunyai lintasan tetap sehingga elektron tidak jatuh ke inti
Gambar 2. Model Atom Bohr
2. Elektron dapat berpindah dari kulit yang satu ke kulit yang lain dengan memancarkan atau menyerap energi.
LAMPIRAN 2: RUBRIK PENILAIAN SPIRITUAL
No Nama Siswa
Skor Aspek
Pengamatan Skor Total Nilai 1 2 3
1 2 3 4 5
Keterangan Aspek :
1. Berdoa sebelum dan sesudah melakukan sesuatu
2. Memelihara hubungan baik dengan sesama umat ciptaan Tuhan Yang Maha Esa 3. Memberi salam pada saat awal dan akhir presentasi sesuai agama yang dianut Keterangan skor:
1 – 3 = kurang 4 – 6 = cukup 7 – 9 = baik
10 – 12 = sangat baik
LAMPIRAN 3: RUBRIK PENILAIAN SIKAP
No Nama Siswa Aspek Sikap Skor Total Nilai Kritis Kerjasama
1 2 3 4 5
Keterangan skor: 1 – 3 = kurang 4 – 6 = cukup 7 – 9 = baik
LAMPIRAN 4: RUBRIK PENILAIAN PENGETAHUAN
Pembelajaran Butir Soal Jawaban Skor
Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat sifat senyawa
Menjelaskan teori atom Bohr dan mekanika kuantum untuk menuliskan konfigurasi elektron dan diagram orbital serta menentukan letak unsur dalam tabel periodik
Memahami percobaan Bohr tentang spektra atom hidrogen
Bagaimana prinsip kerja percobaan Bohr?
Mengapa cahaya disebut sebagai gelombang namun juga disebut sebagai partikel?
Tabung vakum diisi gas hidrogen dan diberi aliran listrik sehingga atom hidrogen berpendar menghasilkan cahaya, cahaya dilewatkan pada prisma dan terbentuk spektrum
Cahaya sebagai gelombang : karena sinar memiliki panjang gelombang dan dapat menghasilkan radiasi
Cahaya sebagai partikel : karena memiliki energi tertentu (diskontinu) yang dapat menabrak elektron dengan energi tertentu sehingga elektron lepas dari atomnya
10
Memahami ide pokok teori atom Bohr
Jelaskan bagaimana terjadinya
perpindahan elektron dalam atom ?
Sebutkan postulat – postulat dalam model atom Bohr ?
Terjadinya perpindahan elektron dalam atom adalah elektron hanya dapat berpindah dari lintasa stasioner yang lebih rendah ke lintasan stasioner yang lebih tinggi jika menyerap energy. Jika elektron berpindah dari lintasan stasioner yang lebih tinggi ke rendah terjadi pelepasan energi
4. Dalam atom, elektron beredar mengelilingi inti atom pada orbit tertentu yang dikenal sebagai keadaan gerakan stasioner (tetap) yang selanjutnya disebut dengan tingkat energi utama (kulit elektron) yang dinyatakan dengan bilangan kuantum utama (n)
5. Selama elektron berada
10
dalam lintasan stasioner energi akan tetap, sehingga tidak ada cahaya yang dipancarkan 6. Elektron hanya dapat
berpindah dari lintasa stasioner yang lebih rendah ke lintasan stasioner yang lebih tinggi jika menyerap energi. Dan sebaliknya, jika elektron berpindah dari lintasan stasioner yang lebih tinggi ke rendah terjadi pelepasan energi Memahami kelemahan
teori atom Bohr
Bagaimana
kelemahan model atom Bohr?
Hanya mampu menjelaskan atom Hidrogen
Lintasan elektron tidak sesederhana seperti yang diajukan Bohr
Tidak mampu menjelaskan pengaruh medan magnet terhadap suatu spektrum atom
Mengapa dalam spektra atom terdapat lebih dari satu garis? Jelaskan secara singkat terjadinya spektra atom!
Energi radiasi yang diserap oleh atom menyebabkan elektronnya berpindah dari orbit yang berenergi lebih rendah ke orbit yang berenergi yang lebih tinggi. Sebaliknya, energi radiasi (dalam bentuk foton) dipancarkan bila elektron berpindah dari orbit yang berenergi lebih tinggi ke orbit yang berenergi lebih rendah dalam bentuk spektra atau cahaya. Spektra garis merupakan energi, jadi elektron dalam atom mempunyai energi-energi tertentu yang digambarkan dengan lintasan-lintasan sesuai dengan tingkat energinya
10
Nilai = or ota
LEMBAR PENILAIAN PENGETAHUAN
No Nama Siswa Nilai
LAMPIRAN 5: RUBRIK PENILAIAN KETERAMPILAN
LEMBAR PENILAIAN KETERAMPILAN
No Nama Siswa Aspek Skor
Total Nilai Diskusi Presentasi
1 2 3 4 5
Keterangan skor: 1 – 3 = kurang 4 – 6 = cukup 7 – 9 = baik
LAMPIRAN 6: SOAL
1. Mengapa cahaya disebut sebagai gelombang namun juga disebut sebagai partikel?
Cahaya sebagai gelombang : karena sinar memiliki panjang gelombang dan dapat menghasilkan radiasi
Cahaya sebagai partikel : karena memiliki energi tertentu (diskontinyu) yang dapat menabrak elektron dengan energi tertentu sehingga elektron lepas dari atomnya.
2. Bagaimana prinsip kerja percobaan Bohr?
Tabung vakum diisi gas hidrogen dan diberi aliran listrik sehingga atom hidrogen berpendar menghasilkan cahaya, cahaya dilewatkan pada prisma dan terbentuk spektrum
3. Jelaskan bagaimana terjadinya perpindahan elektron dalam atom ?
Terjadinya perpindahan elektron dalam atom adalah elektron hanya dapat berpindah dari lintasa stasioner yang lebih rendah ke lintasan stasioner yang lebih tinggi jika menyerap energy. Jika elektron berpindah dari lintasan stasioner yang lebih tinggi ke rendah terjadi pelepasan energi
4. Sebutkan postulat – postulat dalam model atom Bohr ?
7. Dalam atom, elektron beredar mengelilingi inti atom pada orbit tertentu yang dikenal sebagai keadaan gerakan stasioner (tetap) yang selanjutnya disebut dengan tingkat energi utama (kulit elektron) yang dinyatakan dengan bilangan kuantum utama (n)
8. Selama elektron berada dalam lintasan stasioner energi akan tetap, sehingga tidak ada cahaya yang dipancarkan
9. Elektron hanya dapat berpindah dari lintasa stasioner yang lebih rendah ke lintasan stasioner yang lebih tinggi jika menyerap energi. Dan sebaliknya, jika elektron berpindah dari lintasan stasioner yang lebih tinggi ke rendah terjadi pelepasan energi
5. Mengapa dalam spektra atom terdapat lebih dari satu garis? Jelaskan secara singkat terjadinya spektra atom!
6. Bagaimana kelemahan model atom Bohr? Hanya mampu menjelaskan atom Hidrogen
Lintasan elektron tidak sesederhana seperti yang diajukan Bohr
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden
Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 3 JP
Standar Kompetensi
1. Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat-sifat senyawa
Kompetensi Dasar
1.1.Menjelaskan teori atom Bohr dan mekanika kuantum untuk menuliskan konfigurasi elektron dan diagram orbital serta menentukan letak unsur dalam tabel periodik
I. Indikator Pencapaian Kompetensi
1. Memahami dasar munculnya teori mekanika kuantum 2. Memahami ide pokok teori atom mekanika kuantum II. Tujuan Pembelajaran
Siswa dapat:
1. Memahami dasar munculnya teori mekanika kuantum 2. Memahami ide pokok teori atom mekanika kuantum III. Materi Pembelajaran
Teori atom mekanika kuantum IV. Metode Pembelajaran
1. Pendekatan pembelajaran : scientific approach 2. Model pembelajaran : TGT
VI. Langkah-Langkah Pembelajaran
Deskripsi Alokasi
Waktu
1. Salam pembuka
2. Berdoa sebelum memulai pelajaran, mengecek kehadiran siswa, dan menanyakan kesiapan siswa untuk belajar 3. Motivasi dan Apersepsi:
Pertemuan sebelumnya kita sudah belajar apa saja anak-anak? Masih ingatkah kalian, apa inti dari teori atom Bohr? ibu minta, salah satu dari kalian untuk menggambarkan model atom Bohr. Lalu, apakah bentuk atom sesederhana seperti yang digambarkan oleh Bohr? Tentu tidak, maka dari itu kita akan belajar tentang pembaharuan dan perbaikan teori atom Bohr, yaitu teori mekanika kuantum.
5 menit
1. Guru menyampaikan tujuan pembelajaran yang akan dicapai 2. Guru menyampaikan materi
tentang teori atom mekanika kuantum
1. Guru membagi siswa menjadi 7 kelompok, tiap kelompok terdiri dari 4-5 siswa dengan kemampuan yang heterogen 2. Guru membagikan LKS berisi
latihan soal tentang teori atom mekanika kuantum kepada
Fase 4 diskusi membahas latihan soal bab teori atom mekanika kuantum
2. Siswa melakukan tanya-jawab dan berdiskusi dengan teman satu kelompok mengenai materi yang disampaikan
3. Menyimpulkan hasil diskusi tentang teori atom mekanika kuantum
1. Siswa diminta untuk mempresentasikan hasil diskusi kelompoknya di depan kelas 2. Siswa yang mempresentasikan
hasil kelompok mendapatkan skor individu dan skor kelompok
3. Guru memberikan tanggapan terhadap hasil kerja siswa, memberikan penguatan, menjelaskan hal-hal yang belum diketahui dan menyimpulkan hasil pembelajaran
1. Guru mengapresiasi keaktifan masing-masing kelompok dengan memberikan skor
Penutup 1. Guru bersama-sama dengan
siswa membuat kesimpulan tentang teori atom mekanika kuantum
kepada siswa
3. Guru menyampaikan bahwa akan diadakan games pada pertemuan selanjutnya
4. Guru menutup pelajaran dan memberi salam penutup
Pertemuan ketiga : games (1 JP) VII. Alat dan Sumber Belajar
1. Alat dan Bahan: alat tulis, internet, ppt 2. Sumber belajar:
Das Salirawati. 2007. Belajar Kimia Secara Menarikuntuk SMA/MA Kelas X. Jakarta : Grasindo
Sunardi dan Dini Kurniawati. 2015. Kimia Berbasis Pendidikan Karakter Bangsa untuk SMA/MA. Bandung: PT. Sewu (Srikandi Empat Widya Utama)
VIII. Penilaian
Siswa mengerjakan latihan soal dan soal turnamen
Bantul, 17 Juli 2016
Guru Pembimbing Lapangan Mahasiswa PPL
Wiji Wati, S.T
NIP. 19810910 201101 2 003
LAMPIRAN 1: MATERI PEMBELAJARAN Teori Mekanika Kuantum (1924)
Dalam teorinya, Niels Bohr mengatakan bahwa elektron bergerak mengelilingi inti atom menurut lintasan tertentu yang berbentuk lingkaran. Pada kenyataannya, gerak elektron tampak sebagai gelombang elektromagnetik. Segera setelah Niels Bohr mengajukan teori atomnya, gagasan tentang partikel radiasi yang dikemukakan oleh Max Planck menjadi terkenal. Menurut Max Planck, radiasi elektromagnetik bersifat diskrit dan terdiri atas partikel-partikel berukuran kecil. Hal itu sejalan dengan teori atom Niels Bohr. boh yang berbicara tentang partikel kecil atom dan radiasi akibat perpindahan elektron dalam atom.
Louis de Broglie, seorang ahli fisika dari Perancis pada tahun 1923 mengajukan hipotesis tentang gelombang materi. Menurut Louis de Broglie, gerakan partikel yang bergerak dengan kecepatan mendekati kecepatan cahaya seperti gerakan elektron mengelilingi inti atom, mempunyai sifat gelombang. Berdasarkan hipotesis Louis de Broglie (prinsip dualisme gelombang), Heisenberg mengemukakan prinsip ketidakpastiannya, bahwa kedudukan elektron di sekeliling inti adalah kebolehjadian menemukan elektron pada jarak tertentu dari inti atom .
LAMPIRAN 2: RUBRIK PENILAIAN SPIRITUAL
No Nama Siswa
Skor Aspek
Pengamatan Skor Total Nilai 1 2 3
1 2 3 4 5
Keterangan Aspek :
1. Berdoa sebelum dan sesudah melakukan sesuatu
2. Memelihara hubungan baik dengan sesama umat ciptaan Tuhan Yang Maha Esa 3. Memberi salam pada saat awal dan akhir presentasi sesuai agama yang dianut Keterangan skor:
1 – 3 = kurang 4 – 6 = cukup 7 – 9 = baik
10 – 12 = sangat baik
LAMPIRAN 3: RUBRIK PENILAIAN SIKAP
No Nama Siswa Aspek Sikap Skor Total Nilai Kritis Kerjasama
1 2 3 4 5
Keterangan skor: 1 – 3 = kurang 4 – 6 = cukup 7 – 9 = baik
LAMPIRAN 4: RUBRIK PENILAIAN PENGETAHUAN
Pembelajaran Butir Soal Jawaban Skor
Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat sifat senyawa
Menjelaskan teori atom Bohr dan mekanika kuantum untuk menuliskan konfigurasi elektron dan diagram orbital serta menentukan letak unsur dalam tabel periodik
Memahami dasar munculnya teori mekanika kuantum dengan konstanta Planck sebesar 6,626 x 10-34 J.s dan kecepatan rambat cahaya 3 x 108 ms-1?
Tetapan Planck = 6,626 x 10-34 J.s
Bagaimana hipotesis de Broglie menjelaskan fakta bahwa energi elektron dalam atom hidrogen
terkuantisasi?
Bila gelombang cahaya dapat berperilaku sebagai partikel, maka mungkin partikel seperti elektron dapat memiliki sifat gelombang. Meurut de Broglie, sebuah elektron yang terikat pada inti berperilaku seperti gelombang berdiri, maka dari itu panjang gelombangnya harus benar-benar sesuai dengan keliling orbit. Jika tidak, gelombang itu secara sebagian akan meniadakan dirinya sendiri pada setiap orbit yang berurutan, akhirnya amplitudonya akan berkurang dan gelombang itu akan hilang
Mengapa persamaan
λ = ℎ
�� menjadi bermakna hanya bila diterapkan pada partikel
submikroskopis semacam elektron dalam atom dan tidak pada benda makroskopis?
Neutron termal adalah neutron yang bergerak dengan cepat sebanding dengan kecepatan molekul udara pada
Karena sifat gelombang dapat teramati hanya untuk benda-benda submikroskopik, hal ini disebabkan kecilnya nilai konstanta Planck yang muncul di bagian pembilang. Artinya, jika massanya besar, maka panjang gelombang yang dihasilkan sangatlah kecil sehingga sukar teramati, sedangkan jika massanya kecil, maka panjang gelombang yang dihasilkan besar sehingga dapat teramati
λ = ℎ
�� =
, x − J.
, x − 7 g . , x /
=
0,565x 10-9 m = 0,565 nm10
suhu kamar. Neutron termal paling efektif untuk menginisiasi reaksi inti berantai pada isotop �. Hitunglah panjang gelombang (dalam nm) neutron yang bergerak dengan kecepatan 7,00 x 102 m/s. (Massa neutron = 1,675 x 10-27 kg) Memahami ide pokok
teori atom mekanika kuantum
Bagaimanakah posisi elektron berdasarkan model atom modern?
Bagaimakah Schrodinger
menginterpretasikan elektron-elektron dalam suatu atom?
Posisi elektron tidak dapat ditentukan secara pasti
Elektron-elektron pada atom tidak mengorbit inti, tetapi lebih bersifat sebagai gelombang bergerak pada jarak tertentu dan dengan energi tertentu di
10
Bagaimana ide pokok teori atom mekanika kuantum?
sekeliling inti atom
Posisi elektron dalam atom hanya probabilitas saja
10
Nilai = o o a
�
LEMBAR PENILAIAN PENGETAHUAN
No Nama Siswa Nilai
LAMPIRAN 5: RUBRIK PENILAIAN KETERAMPILAN
LEMBAR PENILAIAN KETERAMPILAN
No Nama Siswa Aspek Skor
Total Nilai Diskusi Presentasi
1 2 3 4 5
Keterangan skor: 1 – 3 = kurang 4 – 6 = cukup 7 – 9 = baik
LAMPIRAN 6: SOAL
1. Berapa energi sinar biru jika diketahui panjang gelombangnya adalah 470 nm dengan konstanta Planck sebesar 6,626 x 10-34 J.s dan kecepatan rambat cahaya 3 x 108 ms-1?
� = ℎ� �
� = , x − �. � x ��−
� − � = , � − � 2. Bagaimanakah posisi elektron berdasarkan model atom modern?
Posisi elektron tidak dapat ditentukan secara pasti
3. Bagaimakah Schrodinger menginterpretasikan elektron-elektron dalam suatu atom?
Elektron-elektron pada atom tidak mengorbit inti, tetapi lebih bersifat sebagai gelombang bergerak pada jarak tertentu dan dengan energi tertentu di sekeliling inti atom
4. Tentukan panjang gelombang dari neutron yang bergerak dengan kecepatan 8 x 102 ms-1. Massa neutron 1,6 x 10-24 gram. Tetapan Planck = 6,626 x 10-34 J.s
� =� � �ℎ
� =
, x , x − 7 g � x − g / .− = 4,89375 x 10-10 m5. Bagaimana hipotesis de Broglie menjelaskan fakta bahwa energi elektron dalam atom hidrogen terkuantisasi?
Bila gelombang cahaya dapat berperilaku sebagai partikel, maka mungkin partikel seperti elektron dapat memiliki sifat gelombang. Meurut de Broglie, sebuah elektron yang terikat pada inti berperilaku seperti gelombang berdiri, maka dari itu panjang gelombangnya harus benar-benar sesuai dengan keliling orbit. Jika tidak, gelombang itu secara sebagian akan meniadakan dirinya sendiri pada setiap orbit yang berurutan, akhirnya amplitudonya akan berkurang dan gelombang itu akan hilang
6. Mengapa persamaan λ = ℎ
�� menjadi bermakna hanya bila diterapkan pada partikel submikroskopis semacam elektron dalam atom dan tidak pada benda makroskopis?
jika massanya besar, maka panjang gelombang yang dihasilkan sangatlah kecil sehingga sukar teramati, sedangkan jika massanya kecil, maka panjang gelombang yang dihasilkan besar sehingga dapat teramati
7. Neutron termal adalah neutron yang bergerak dengan cepat sebanding dengan kecepatan molekul udara pada suhu kamar. Neutron termal paling efektif untuk menginisiasi reaksi inti berantai pada isotop �. Hitunglah panjang gelombang (dalam nm) neutron yang bergerak dengan kecepatan 7,00 x 102 m/s. (Massa neutron = 1,675 x 10-27 kg)
Diketahui: h = 6,63 x 10-34 J.s m = 1,675 x 10-27 kg u = 7,00 x 102 m/s Ditanya: λ = . . . nm? Jawaban: λ = ℎ
�� =
, x − J.
, x − 7 g . , x /
=
0,565x 10-9
m = 0,565 nm
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden
Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 2 JP
Standar Kompetensi
1. Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat-sifat senyawa
Kompetensi Dasar
1.2 Menjelaskan teori jumlah pasangan elektron di sekitar inti atom dan teori hibridisasi untuk meramalkan bentuk molekul
I. Indikator Pencapaian Kompetensi
1. Menuliskan konfigurasi elektron suatu unsur
2. Menggambarkan struktur Lewis suatu molekul atau senyawa
3. Meramalkan bentuk molekul suatu senyawa berdasarkan teori VSEPR II. Tujuan Pembelajaran
Siswa dapat:
1. Menuliskan konfigurasi elektron suatu unsur
2. Menggambarkan struktur Lewis suatu molekul atau senyawa 3. Menentukan jumlah PEI dan PEB suatu senyawa
4. Meramalkan bentuk molekul berdasarkan teori VSEPR III. Materi Pembelajaran
Teori VSEPR
IV. Metode Pembelajaran
1. Pendekatan pembelajaran : scientific approach 2. Model pembelajaran : TGT
V. Langkah-Langkah Pembelajaran
Deskripsi Alokasi Waktu
1. Salam pembuka
2. Berdoa sebelum memulai pelajaran, mengecek kehadiran siswa, dan menanyakan kesiapan siswa untuk belajar
3. Motivasi dan Apersepsi: “Bagaimana hasil Ulangan Harian kalian? Baik bukan? Jika belum baik, harus lebih berusaha lagi ya, sering-sering latihan soal. Oh iya, hari ini kita akan mempelajari bab baru. Ibu percaya kalian bisa lebih baik lagi dalam memahami pembelajaran kali ini, asalkan kalian fokus dan ikhlas mengikuti pembelajaran. Nah anak-anak,ada yang bisa menuliskan struktur Lewis molekul metana (CH4)?”
Apakah bentuk molekul metana tersebut sesederhana itu?”
Kegiatan Inti Fase 2
1. Guru menyampaikan materi yang akan dipelajari, yaitu bentuk molekul
2. Guru menyampaikan tujuan pembelajaran yang akan dicapai
3. Guru menjelaskan materi tentang teori VSEPR
1. Guru membagi siswa menjadi 7 kelompok, tiap kelompok terdiri dari 4-5 siswa dengan kemampuan yang heterogen
2. Guru membagikan LKS kepada masing-masing kelompok
3. Guru juga membagi plastisin sebagai media untuk meramalkan bentuk molekul melalui teori VSEPR
1. Guru membimbing siswa dalam diskusi membahas LKS “Meramalkan bentuk molekul melalui teori VSEPR”
2. Siswa melakukan tanya-jawab dan berdiskusi dengan teman satu
Fase 5 Evaluasi
kelompok mengenai materi yang disampaikan 3. Menyimpulkan hasil
diskusi tentang bentuk molekul
1. Siswa diminta untuk mempresentasikan hasil diskusi kelompoknya di depan kelas mengenai cara meramalkan bentuk molekul melalui teori
VSEPR, serta
menunjukkan peragaan bentuk molekul menggunakan plastisin
2. Siswa yang
mempresentasikan hasil kelompok akan mendapatkan skor individu dan skor kelompok
Fase 6 Memberikan penghargaan
1. Guru mengapresiasi keaktifan masing-masing kelompok dengan memberikan skor
Penutup 1. Guru bersama-sama
dengan siswa membuat kesimpulan tentang cara meramalkan bentuk molekul melalui teori VSEPR
2. Guru memberikan penugasan kepada siswa 3. Guru menyampaikan
materi ajar yang akan dibahas pada pertemuan selanjutnya, yaitu meramalkan bentuk molekul melalui teori hibridisasi
4. Guru menutup pelajaran dan memberi salam penutup
VII. Alat dan Sumber Belajar
1. Alat dan Bahan: alat tulis, internet, ppt, LKS 2. Sumber belajar:
Das Salirawati. 2007. Belajar Kimia Secara Menarik untuk SMA/MA Kelas X. Jakarta : Grasindo
Sunardi dan Dini Kurbiawati. 2015. Kimia untuk SMA/MA Kelas XI. Bandung: PT. SEWU (Srikandi Empat Widya Utama)
VIII. Penilaian
Siswa mengerjakan lembar kerja siswa dan tes tertulis berupa soal pilihan ganda
Bantul, 29 Juli 2016
Guru Pembimbing Lapangan Mahasiswa PPL
Wiji Wati, S.T
NIP. 19810910 201101 2 003
LAMPIRAN 1 : MATERI PEMBELAJARAN TEORI VSEPR
Bentuk molekul berhubungan dengan posisi atom-atom dalam suatu molekul. Bentuk molekul menggambarkan posisi atom-atom dalam ruang tiga dimensi dan besarnya sudut ikatan yang terjadi dalam ikatan kovalen dalam suatu molekul. 1. Teori VSEPR ( Valence Shell Electron Pair Repulsion)
Teori VSEPR adalah suatu cara untuk meramalkan geometri molekul berdasarkan tolak menolak elektron pada kulit luar atom pusat. Domain elektron berarti kedudukan elektron atau daerah keberadaan elektron.
Teori ini didasarkan pada gagasan pada semua pasangan elektron yang terikat secara langsung pada suatu atom, yaitu pasangan elektron ikatan (PEI) dan pasangan elektron bebas (PEB) di sekitar atom pusat dan akan mengatur posisinya sebisa mungkin saling menjauh satu sama lain.
Meramalkan Bentuk Molekul berdasarkan Teori VSEPR Langkah-langkah dalam menentukan bentuk molekul: a. Membuat konfigurasi elektron
b. Menentukan elektron valensi c. Membuat struktur Lewis
d. Menententukan PEI dan PEB pada atom pusat e. Menentukan bentuk molekulnya
Rumus pasangan elektron dalam suatu molekul disimbolkan sebagai berikut: AXnEm
Keterangan : A = atom pusat
X = pasangan elektron ikatan E = pasangan leketron bebas
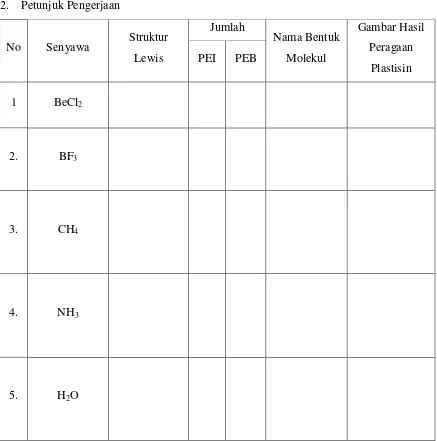
BENTUK MOLEKUL BERDASARKAN TEORI VSEPR Jumlah
Domain
Jumlah PEI (X)
Jumlah PEB (E)
Notasi
VSEPR Geometri Molekul
Nama Bentuk Molekul
Contoh Molekul
2 2 0 AX2
Linear
Linear BeCl2
3
3 0 AX3
Segitiga datar
Segitiga datar BCl3
2 1 AX2E
Segitiga datar
Bentuk V SO2
4
4 0 AX4
Tetrahedral
Tetrahedral CH4
3 1 AX3E
Tetrahedral
Segitiga
piramida NH3
2 2 AX2E3
Tetrahedral
Bentuk V H2O
5 5 0 AX5
Segitiga
Segitiga bipiramida
4 1 AX4E
Segitiga bipiramida
Tetrahedral
terdistorsi TeCl4
3 2 AX3E2 Bentuk T ClF3
2 3 AX2E3
Segitiga bipiramida
Linear XeF2
6
6 0 AX6
Oktahedral
Oktahedral SF6
5 1 AX5E
Oktahedral
Segiempat
piramida IF5
4 2 AX4E2
Oktahedral
Segiempat
LAMPIRAN 2: RUBRIK PENILAIAN SPIRITUAL
No Nama Siswa
Skor Aspek
Pengamatan Skor Total Nilai 1 2 3
1 2 3 4 5
Keterangan Aspek :
1. Berdoa sebelum dan sesudah melakukan sesuatu
2. Memelihara hubungan baik dengan sesama umat ciptaan Tuhan Yang Maha Esa
3. Memberi salam pada saat awal dan akhir presentasi sesuai agama yang dianut Keterangan skor:
1 – 3 = kurang 4 – 6 = cukup 7 – 9 = baik
10 – 12 = sangat baik
LAMPIRAN 3: RUBRIK PENILAIAN SIKAP
No Nama Siswa Aspek Sikap Skor Total Nilai
Rasa ingin tahu Tanggungjawab 1
2 3 4 5
Keterangan skor: 1 – 3 = kurang 4 – 6 = cukup 7 – 9 = baik
LAMPIRAN 4: RUBRIK PENILAIAN PENGETAHUAN
Standar Kompetensi Kompetensi dasar Indikator Pembelajaran Butir Soal Skor
Memahami struktur
atom untuk
meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat sifat senyawa
Menjelaskan teori jumlah pasangan elektron di sekitar inti atom dan teori hibridisasi untuk meramalkan bentuk molekul
Menuliskan konfigurasi elektron suatu unsur
Menggambarkan struktur Lewis suatu molekul atau senyawa
Meramalkan bentuk molekul suatu senyawa berdasarkan teori VSEPR
Bentuk molekul NH3 (7N dan 1H) adalah ...
A. Segitiga datar B. Bentuk V C. Tetrahedral D. Segitiga piramida
E. Segitiga bipiramida
Jumlah PEI dan PEB molekul H2O
A. Segitiga datar
10
10
B. Bentuk V C. Tetrahedral
D. Tetrahedral terdistorsi
E. Linear
Molekul di bawah ini yang memiliki sudut ikatan terbesar adalah ... A. H2O
B. NH3 C. BF3
D. BeCl2 E. IF3
Sudut ikatan molekul H2O adalah 104,5o, padahal pasangan-pasangan elektronnya menempati posisi ruang tetrahedral, hal ini disebabkan oleh adanya ...
A. 2 pasangan elektron bebas
B. 2 pasangan elektron ikatan C. Pasangan elektron yang jauh dari
atom pusat D. Ikatan hidrogen
10
E. Dipol tetap
Suatu molekul mempunyai 5 pasangan elektron di sekitar atom pusat, dua diantaranya merupakan pasangan elektron bebas. Bentuk molekul tersebut yang paling mungkin adalah ...
A. Segitiga datar B. Tetrahedral C. Segitiga piramida D. Bentuk V
E. Bentuk T
10
Nilai = or ota
LEMBAR PENILAIAN PENGETAHUAN
No Nama Siswa Nilai
LAMPIRAN 5: RUBRIK PENILAIAN KETERAMPILAN
LEMBAR PENILAIAN KETERAMPILAN
No Nama Siswa
Aspek
Skor
Total Nilai Presentasi Meramalkan bentuk molekul
menggunakan plastisin 1
2 3 4 5
Keterangan skor: 1 – 3 = kurang 4 – 6 = cukup 7 – 9 = baik
LAMPIRAN 6: LEMBAR KERJA SISWA
BENTUK MOLEKUL
A. TUJUAN
1. Siswa dapat meramalkan bentuk molekul suatu senyawa berdasarkan teori VSEPR menggunakan peragaan plastisin
2. Siswa dapat menggambarkan bentuk molekul suatu senyawa berdasarkan teori VSEPR B. TEORI
Teori VSEPR
Teori VSEPR (Valence Shell Electron Pair Repulsion) adalah tolakan pasangan elektron pada kulit valensi/kulit terluar. Prinsip utama teori ini adalah bahwa pasangan elektron valensi di sekitar atom akan saling tolak menolak sampai gaya tolaknya minimal, sehingga susunan pasangan elektron tersebut akan mengadopsi susunan yang meminimalisasi gaya tolak menolak. Gaya tolak PEB lebih besar daripada gaya tolak PEI.
- Pasangan elektron ikatan (PEI) adalah pasangan elektron yang digunakan untuk berikatan
- Pasangan elektron bebas (PEB) adalah pasangan elektron yang tidak digunakan untuk berikatan.
C. ALAT DAN BAHAN
- Plastisin untuk mebuat bola-bola
- Batang korek api batangnya sebagai sepasang elektron ikatan (PEI) dan ujungnya yang bulat hitam sebagai atom yang terikat dengan atom pusat
- Jarum pentul sebagai pasangan elektron bebas (PEB) D. KEGIATAN
Kegiatan 1. Meramalkan bentuk molekul berdasarkan teori VSEPR 1. Cara Membuat Bentuk Molekul
- Tancapkan batang korek api sebagai pasangan elektron ikatannya dan atom yang terikat pada atom pusat
- Apabila terdapat pasangan elektron bebas, pasangkan jarum pentul (sebagai tanda bahwa tolakan PEB lebih besar daripada PEI).
2. Petunjuk Pengerjaan
No Senyawa Struktur Lewis
Jumlah
Nama Bentuk Molekul
Gambar Hasil Peragaan
Plastisin PEI PEB
1 BeCl2
2. BF3
3. CH4
4. NH3
5. H2O
Pertanyaan
1. Berdasarkan tabel di atas, mengapa bentuk molekul H2O berbentuk V (bengkok
membentuk sudut ) sedangkan bentuk molekul BeCl2 linear?
2. Mengapa bentuk molekul BF3 segitiga datar sedangkan bentuk molekul NH3
piramidal trigonal? Jawab:
3. Apa yang mempengaruhi bentuk molekul senyawa kovalen? Jawab:
4. Bagaimanakah besar sudut yang dibentuk oleh atom pusat dengan atom yang terikat dengannya untuk molekul CH4, NH3 dan H2O, makin besar atau makin kecil?
Jawab:
5. Apa yang mempengaruhi besar sudut antara atom pusat dengan atom yang terikat dengannya untuk molekul CH4, NH3 dan H2O?
Jawab:
Kesimpulan
Bagaimanakah hubungan bentuk molekul senyawa kovalen dengan jumlah Pasangan Elektron Ikatan dan Pasangan Elektron Bebas?
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden
Mata Pelajaran : Kimia Kelas/Semester : XI/1 Alokasi Waktu : 3 JP
Standar Kompetensi
1. Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat-sifat senyawa
Kompetensi Dasar
1.2 Menjelaskan teori jumlah pasangan elektron di sekitar inti atom dan teori hibridisasi untuk meramalkan bentuk molekul
I. Indikator Pencapaian Kompetensi 1. Menggambar diagram orbital
2. Menentukan bentuk molekul suatu senyawa berdasarkan teori hibridisasi II. Tujuan Pembelajaran
Siswa dapat:
1. Menggambar diagram orbital
2. Menentukan bentuk molekul suatu senyawa berdasarkan teori hibridisasi III. Materi Pembelajaran
Teori hibridisasi
IV. Metode Pembelajaran
1. Pendekatan pembelajaran : scientific approach 2. Model pembelajaran : TGT
VI. Langkah-Langkah Pembelajaran
Deskripsi Alokasi
Waktu
1. Salam pembuka
2. Berdoa sebelum memulai pelajaran, mengecek kehadiran siswa, dan menanyakan kesiapan siswa untuk belajar 3. Motivasi dan Apersepsi:
“Alhamdulillah kita masih dapat berjumpa lagi. Pertemuan sebelumnya kita sudah membahas apa saja anak-anak?”
“Sudahkah kalian belajar tentang teori hibridisasi?” “Pembelajaran hari ini kita akan membahas tentang teori hibridisasi dan akan dilanjutkan games diakhir pembelajaran. Ibu berharap kalian benar-benar dapat memahami pembelajaran hari ini sehingga tujuan pembelajaran kita dapat tercapai dan kalian mendapatkan nilai yang baik. Amin”
1. Guru menyampaikan tujuan pembelajaran yang akan dicapai
2. Guru menjelaskan materi tentang teori hibridisasi
1. Guru membagi siswa dalam 7 kelompok, tiap kelompok
asi siswa kemampuan yang heterogen 2. Guru membagikan LKS
kepada masing-masing kelompok
1. Guru membimbing siswa dalam diskusi membahas LKS 2. Siswa melakukan tanya-jawab dan berdiskusi dengan teman satu kelompok mengenai materi yang disampaikan 3. Menyimpulkan hasil diskusi
tentang teori hibridisasi
1. Siswa diminta untuk mempresentasikan hasil diskusi kelompoknya di depan kelas
2. Siswa yang mempresentasikan hasil kelompok mendapatkan skor individu dan skor kelompok
3. Guru mengadakan games mengenai bentuk molekul 4. Guru memberikan tanggapan
terhadap hasil kerja siswa, memberikan penguatan, menjelaskan hal-hal yang belum diketahui dan menyimpulkan hasil pembelajaran
Penutup 1. Guru bersama-sama dengan siswa membuat rangkuman/ kesimpulan tentang VSEPR dan teori hibridisasi
2. Guru memberikan penugasan kepada siswa
3. Guru menyampaikan bahwa akan diadakan ulangan harian bentuk molekul pada pertemuan berikutnya
4. Guru menutup pelajaran dan memberi salam penutup
10 menit
Pertemuan berikutnya: UH bentuk molekul (1 JP) VII. Alat dan Sumber Belajar
1. Alat dan Bahan: alat tulis, internet, ppt, LKS 2. Sumber belajar:
Sunardi dan Dini Kurbiawati. 2015. Kimia untuk SMA/MA Kelas XI. Bandung: PT. SEWU (Srikandi Empat Widya Utama)
VIII. Penilaian
Siswa mengerjakan lembar kerja siswa dan tes tertulis berupa soal pilihan ganda
Bantul, 29 Juli 2016
Guru Pembimbing Lapangan Mahasiswa PPL
Wiji Wati, S.T
NIP. 19810910 201101 2 003
LAMPIRAN 1 : MATERI PEMBELAJARAN TEORI HIBRIDISASI
Hibridisasi adalah proses pembentukan orbital-orbital baru yang dilakukan oleh suatu atom. Bentuk molekul senyawa yang terjadi dapat ditentukan oleh orbital-orbital atom yang saling bertindihan (overlapping).
Meramalkan Bentuk Molekul berdasarkan Teori Hibridisasi Langkah-langkah dalam menentukan bentuk molekul: a. Membuat konfigurasi elektron
b. menetukan elektron valensi
c. Membuat diagram orbital pada keadaan dasar d. Membuat hibridisasi
e. Menentukan bentuk molekulnya Orbital
Hibrida
Jumlah PEI (X)
Jumlah PEB (E)
Geometri Molekul Nama Bentuk Molekul
sp 2 0
Linear
Linear
sp2 3 0
Segitiga datar
Segitiga datar
sp3
4 0
Tetrahedral
Tetrahedral
3 1
Tetrahedral
Segitiga piramida
2 2
Tetrahedral
dsp3 5 0
Segitiga bipiramida
Segitiga bipiramida
d2sp3 6 0
Oktahedral
LAMPIRAN 2: RUBRIK PENILAIAN SPIRITUAL
No Nama Siswa
Skor Aspek
Pengamatan Skor Total Nilai 1 2 3
1 2 3 4 5
Keterangan Aspek :
1. Berdoa sebelum dan sesudah melakukan sesuatu
2. Memelihara hubungan baik dengan sesama umat ciptaan Tuhan Yang Maha Esa 3. Memberi salam pada saat awal dan akhir presentasi sesuai agama yang dianut Keterangan skor:
1 – 3 = kurang 4 – 6 = cukup 7 – 9 = baik
10 – 12 = sangat baik
LAMPIRAN 3: RUBRIK PENILAIAN SIKAP
No Nama Siswa Aspek Sikap Skor Total Nilai
Rasa ingin tahu Tanggungjawab 1
2 3 4 5
Keterangan skor: 1 – 3 = kurang 4 – 6 = cukup 7 – 9 = baik
LAMPIRAN 4: RUBRIK PENILAIAN PENGETAHUAN Standar
Kompetensi
Kompetensi
dasar Indikator Pembelajaran Butir Soal
Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat sifat senyawa
Menjelaskan teori jumlah pasangan elektron di sekitar inti atom dan teori hibridisasi untuk meramalkan bentuk molekul
Menggambar diagram orbital
Menentukan bentuk molekul suatu senyawa berdasarkan teori hibridisasi
Orbital hibrida molekul BeCl2 (4B adalah ... terjadi pada molekul BCl3 adalah ...
A. sp
B. sp2
C. sp3 D. sp3d E. sp3d2
Molekul dengan orbital hibrida sp bentuk orbital ...
A. Linear
B. Segitiga datar
C. Segitiga piramida D. Tetrahedral E. Oktahedral
Unsur 5X dan 17Y membentuk se Bentuk molekul senyawa tersebut
A. Segitiga datar
C. Segitiga piramida D. Bentuk V
E. Bentuk T
Nilai = or ota
4
�
LEMBAR PENILAIAN PENGETAHUAN
No Nama Siswa Nilai
LAMPIRAN 5: RUBRIK PENILAIAN KETERAMPILAN
LEMBAR PENILAIAN KETERAMPILAN
No Nama Siswa
Aspek
Skor
Total Nilai Presentasi Meramalkan bentuk molekul
menggunakan plastisin 1
2 3 4 5
Keterangan skor: 1 – 3 = kurang 4 – 6 = cukup 7 – 9 = baik
LAMPIRAN 6: LEMBAR KERJA SISWA
Meramalkan bentuk molekul berdasarkan teori hibridisasi Molekul Konfigurasi Elekton Elektron
Valensi Keadaan Dasar
Keadaan
Tereksitasi Hibridisasi
Bentuk Molekul BeCl2
BCl3
NH3
CCl4
SF4
SF6
Kesimpulan
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden
Mata Pelajaran : Kimia Kelas/Semester : XI/1
Alokasi Waktu : 2 JP
Standar Kompetensi
1. Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat-sifat senyawa
Kompetensi Dasar
1.3 Menjelaskan interaksi antar molekul (gaya antar molekul) dengan sifatnya I. Indikator Pencapaian Kompetensi
1. Menjelaskan proses terjadinya gaya Van der Waals dan ikatan hidrogen 2. Menjelaskan perbedaan sifat fisik (titik didih, titik lelah) berdasarkan gaya
antar molekul (gaya Van der Waals, gaya London, dan ikatan hidrogen) II. Tujuan Pembelajaran
Siswa dapat:
1. Menjelaskan proses terjadinya gaya Van der Waals dan ikatan hidrogen 2. Menjelaskan perbedaan sifat fisik (titik didih, titik lelah) berdasarkan gaya
antar molekul (gaya van der Waals, gaya London, dan ikatan hidrogen) III. Materi Pembelajaran
1. Gaya Van der Waals 2. Ikatan hidrogen IV. Metode Pembelajaran
1. Pendekatan pembelajaran : scientific approach 2. Model pembelajaran : TGT
VI. Langkah-Langkah Pembelajaran
Deskripsi Alokasi
Waktu
1. Salam pembuka
2. Berdoa sebelum memulai pelajaran, mengecek kehadiran siswa, dan menanyakan kesiapan siswa untuk belajar 3. Motivasi dan Apersepsi:
“Tahukah kamu bahwa dalam kehidupan sehari-hari, kita selalu berhubungan dengan zat yang partikelnya berupa molekul, misalnya air yang kita minum merupakan kumpulan molekul H2O, udara yang kita
hirup mengandung molekul O2,
dsb. Jika molekul-molekul membentuk senyawa atau pun membentuk molekul yang lebih kompleks tentunya ada interaksi antarmolekul tsb. Interaksi tsb berupa gaya tarik-menarik yang disebut gaya antarmolekul”
5 menit
1. Guru menyampaikan tujuan pembelajaran yang akan dicapai
1. Guru membagi siswa dalam 7 kelompok, tiap kelompok terdiri dari 4-5 siswa dengan kemampuan yang heterogen 2. Guru membagikan LKS berupa
tugas membuat mind map tentang gaya antarmolekul
Fase 4
kepada masing-masing kelompok
1. Guru membimbing siswa dalam menyusun mid map tentang gaya antarmolekul
2. Siswa melakukan tanya-jawab dan berdiskusi dengan teman satu kelompok mengenai materi yang disampaikan
3. Menyimpulkan hasil diskusi tentang gaya antarmolekul
1. Siswa diminta untuk mempresentasikan mind map tentang gaya antarmolekul di depan kelas
2. Guru mengadakan games mengenai gaya antarmolekul 3. Guru memberikan tanggapan
terhadap hasil kerja siswa, memberikan penguatan, menjelaskan hal-hal yang belum diketahui dan menyimpulkan hasil pembelajaran
1. Guru memberikan apresiasi mind map paling menarik
Penutup 1. Guru dan siswa membuat
kesimpulan
2. Guru menyampaikan bahwa akan diadakan ulangan harian pada pertemuan selanjutnya 3. Guru menutup pelajaran dan
memberi salam penutup
VII. Alat dan Sumber Belajar
1. Alat dan Bahan: alat tulis, internet, ppt 2. Sumber belajar:
Das Salirawati. 2007. Belajar Kimia Secara Menarik untuk SMA/MA Kelas X. Jakarta : Grasindo
Sunardi dan Dini Kurniawati. 2015. Kimia untuk SMA/MA Kelas XI. Bandung: PT. SEWU (Srikandi Empat Widya Utama)
VIII. Penilaian
Siswa mengerjakan lembar kerja siswa dan tes tertulis berupa soal pilihan ganda
Bantul, 8 Agustus 2016
Guru Pembimbing Lapangan Mahasiswa PPL
Wiji Wati, S.T
NIP. 19810910 201101 2 003
LAMPIRAN 1: MATERI PEMBELAJARAN
GAYA ANTARMOLEKUL
Gaya antarmolekul adalah gaya tarik menarik atau tolak menolak diantara molekul-molekul.
1. Gaya Van der Waals
Johannes Diderik Van der Waals berpendapat bahwa molekul-molekul dalam suatu zat tidak
saling tolak menolak karena diantara molekul-molekul tersebut terdapat suatu gaya tarik
menarik yang lemah. Gaya tarik menarik yang lemah ini disebut gaya Van der Waals.
Macam-macam gaya Van der Waals yaitu gaya tarik menarik dipol-dipol, gaya induksi, dan
gaya London atau gaya dispersi, tetapi yang terpenting adalah gaya tarik-menarik dipol-dipol
dan gaya London atau gaya dispersi.
a. Gaya Tarik-Menarik Dipol-Dipol
Gaya tarik-menarik dipol-dipol terjadi diantara molekul polar dengan molekul
polar. Bagian positif molekul polar menarik bagian negatif molekul polar lainnya,
sedangkan bagian negatif molekul polar menarik bagian postif molekul polar lainnya,
sehingga terjadi gaya tarik-menarik dipol-dipol.
Contoh: gaya tarik-menarik dipol-dipol pada molekul air, metanol, amonia, HCl.
b. Gaya Induksi
Gaya induksi terjadi diantara molekul polar dan molekul nonpolar. Molekul
polar menginduksi molekul nonpolar sehingga terjadi dipol sesaat pada molekul
nonpolar, yang menimbulkan gaya tarik menarik diantara kedua molekul tersebut yang
disebut gaya induksi. Contoh: gaya antara H2O dengan O2
c. Gaya London Atau Dispersi
Gaya London adalah gaya tarik menarik yang terjadi antara molekul non polar yang
mengalami dipol sesaat dengan non polar yang mengalami dipol terinduksi.
Mudah tidaknya suatu molekul membentuk dipol sesaat disebut polarisasi. Hal ini
berkaitan dengan dengan massa molekul relatif (Mr) dan bentuk molekul.
Mr
Semakin besar Mr, makan semakin mudah terpolarisasi dan semakin kuat gaya
London. Contoh: urutan kekuatan gaya London dari yang paling kuat adalah Br2 > O2
> N2 > H2 karena Mr Br2 > Mr O2 > Mr N2 > Mr H2
Bentuk molekul
Makin besar ukuran molekul, gaya london juga makin kuat. Contoh: gaya London
d. Ikatan Hidrogen
Ikatan hidrogen adalah ikatan yang terjadi antara atom H dengan atom yang
elektronegatifitasnya tinggi (N, O, F) baik antar molekul atau inter molekul. Kutub positif
pada kedudukan H berikatan dengan kutub negatif pada atom yang keelektronegatifannya
besar seperti N, O, F.
Ikatan hidrogen jauh lebih kuat dari pada gaya Van der Waals, sehingga zat yang
mempunyai ikatan hidrogen mempunyai titik cair dan titik didih yang relatif tinggi.
Adanya ikatan hidrogen menyebabkan anomali pada air. Air dalam keadaan padat
(es) akan mengapung. Padahal biasanya suatu zat dalam keadaan padat memiliki
kerapatan yang lebih tinggi daripada keadaan cairnya. Hal ini terjadi karena ketika
air dalam keadaan cair kerapatannya lebih tinggi akibat molekul air yang bergerak
bebas dapat membentuk ikatan hidrogen.
SIFAT FISIK SUATU MOLEKUL
Gaya antarmolekul memiliki pengaruh terhadapa sifat fisik suatu molekul. Semakin kuat gaya
antarmolekulnya, maka semakin tinggi pula titik didik dan titik lelehnya. Kekuatan gaya
antarmolekul berturut-turut dari yang besar ke yang kecil adalah ikatan hidrogen > gaya dipol-dipol >
gaya induksi > gaya London. Misalkan:
Senyawa Mr Titik Didih
Propana 44 120C
Etanol 46 780C
Etanol memiliki titik didih yang sangat tinggi dibandingkan dengan propana, padahal Mr
keduanya tidak jauh berbeda. Hal ini dikarenakan karena dalam molekul etanol terdapat ikatan
LAMPIRAN 2: RUBRIK PENILAIAN SPIRITUAL
No Nama Siswa
Skor Aspek
Pengamatan Skor Total Nilai 1 2 3
1 2 3 4 5
Keterangan Aspek :
1. Berdoa sebelum dan sesudah melakukan sesuatu
2. Memelihara hubungan baik dengan sesama umat ciptaan Tuhan Yang Maha Esa 3. Memberi salam pada saat awal dan akhir presentasi sesuai agama yang dianut Keterangan skor:
1 – 3 = kurang 4 – 6 = cukup 7 – 9 = baik
10 – 12 = sangat baik
LAMPIRAN 3: RUBRIK PENILAIAN SIKAP
No Nama Siswa Aspek Sikap Skor Total Nilai Aktif Kerjasama
1 2 3 4 5
Keterangan skor: 1 – 3 = kurang 4 – 6 = cukup 7 – 9 = baik
LAMPIRAN 4: RUBRIK PENILAIAN PENGETAHUAN
Pembelajaran Butir Soal Skor
Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat sifat senyawa
Menjelaskan interaksi antar molekul (gaya antar molekul) dengan sifatnya
Menjelaskan proses terjadinya gaya Van der Waals dan ikatan hidrogen
Gaya tarik-menarik atau tolak-menolak antara molekul-molekul disebut ...
A. Gaya antarmolekul
B. Gaya tarik-menarik dipol-dipol C.Gaya induksi
D.Gaya London atau dispersi E. Ikatan hidrogen
Gaya yang terjadi antara molekul polar dengan molekul polar disebut ...
A.Gaya London B. B. Gaya induksi
C. Gaya tarik-menarik dipol-dipol D.Gaya dispersi
E. Ikatan hidrogen
Gaya yang terjadi antara molekul polar dengan molekul nonpolar disebut ...
A.Gaya London
10
10
B. Gaya induksi
C.Gaya tarik-menarik dipol-dipol D.Gaya dispersi
E. Ikatan hidrogen
Ikatan yang terjadi antara atom H dengan atom yang elektronegatifitasnya tinggi (F, O, N) disebut ...
A.Ikatan ion
B. Ikatan kovalen polar C.Ikatan kovalen non polar D. Ikatan hidrogen
E. Ikatan kovalen koordinasi
Gaya London atau gaya dispersi pada molekul-molekul non polar terjadi karena terbentuk ... dan ... A. Dipol permanen dan dipol permanen
B. Dipol sesaat dan dipol terinduksi C. Dipol permanen dan dipol sesaat D. Dipol terinduksi dan dipol terinduksi E. Ikatan hidrogen
10
Diantara senyawa berikut yang memiliki gaya London adalah ...
A.CHCl3
B. H2O
C. CH4
D.NH3
E. HCl
Diketahui pasangan-pasangan senyawa berikut. a. NH3 dan HF
b. H2O dan HCl
c. HF dan H2O
d. NH3 dan HBr
e. NH3 dan H2S
Kelompok senyawa yang dapat membentuk ikatan hidrogen adalah ...
A.b dan c B. d dan e C.a dan e D. a dan c E. c dan d
10
Gaya yang terjadi antara molekul HCl dengan molekul HCl lain disebut ...
A. Gaya tarik-menarik dipol-dipol B. Gaya induksi
C.Gaya London
D.Gaya Van der Waals E. Ikatan hidrogen
10
Menjelaskan
perbedaan sifat fisik (titikdidih, titik lelah) berdasarkan gaya antar molekul (gaya van der Waals, gaya London, dan ikatan hidrogen)
Pernyataan berikut ini yang benar adalah ...
A. Titik didih molekul yang memiliki ikatan hidrogen lebih besar daripada molekul yang memiliki gaya Van der Waals
B. Polarisabilitas suatu molekul dipengaruhi oleh kepolaran molekul
C.Gaya London hanya berlaku untuk molekul polar saja
D.Gaya induksi terjadi antara molekul polar dengan molekul polar
E. Urutan kekuatan gaya antarmolekul yaitu ikatan hidrogen > gaya London > gaya tarik-menarik dipol-dipol
Titik didih HF lebih tinggi daripada HCl. Hal ini
10
karena antarmolekul HF terdapat ... A.Ikatan kovalen
B. Ikatan ion
C. Ikatan hidrogen D.Gaya Van der Waals E. Ikatan kovalen koordinasi
Nilai = Skor total
LEMBAR PENILAIAN PENGETAHUAN
No Nama Siswa Nilai
LAMPIRAN 5: RUBRIK PENILAIAN KETERAMPILAN
LEMBAR PENILAIAN KETERAMPILAN
No Nama Siswa Aspek Skor
Total Nilai Kreatifitas Presentasi
1 2 3 4 5
Keterangan skor: 1 – 3 = kurang 4 – 6 = cukup 7 – 9 = baik
RENCANA PELAKSANAAN PEMBELAJARAN Nama Sekolah : SMA Negeri 1 Sanden
Mata Pelajaran : Kimia Kelas/Semester : XI/1
Alokasi Waktu : 2 JP
Standar Kompetensi
1. Memahami kinetika reaksi dan kesetimbangan kimia dan faktor-faktor yang mempengaruhinya, serta penerapannya dalam kehidupan sehari-hari dan industri Kompetensi Dasar
3.1 Mendeskripsikan pengertian laju reaksi dengan melakukan percobaan tentang faktor-faktor yang mempengaruhi laju reaksi
I. Indikator Pencapaian Kompetensi 1. Menjelaskan konsep laju reaksi
2. Memahami konsep kemolaran suatu larutan
3. Memahami cara membuat larutan dengan molaritas tertentu melalui pengenceran dan pencampuran larutan
I. Tujuan Pembelajaran Siswa dapat:
1. Menjelaskan konsep laju reaksi
2. Memahami konsep kemolaran suatu larutan
3. Memahami cara membuat larutan dengan molaritas tertentu melalui pengenceran dan pencampuran larutan
II. Materi Pembelajaran 1. Konsep laju reaksi
2. Kemolaran, pengenceran, dan pencampuran larutan III. Metode Pembelajaran
1. Pendekatan pembelajaran : scientific approach 2. Model pembelajaran : Discovery Learning
3. Metode pembelajaran : ceramah, tanya-jawab, diskusi, penugasan IV. Langkah-Langkah Pembelajaran
Langkah Pembelajaran
Sintak dalam model pembelajaran
Diskripsi Alokasi Waktu Pendahuluan 1.Guru memberikan salam
kemudian mengecek kehadiran
siswa
2.Guru menyampaikan tujuan pembelajaran yang akan dicapai 3.Guru memberi apersepsi dengan
mengajukan pertanyaan untuk mengarahkan siswa ke materi yang akan dipelajari:
Hari ini kita akan belajar bab baru, yaitu laju reaksi. Apa pengertian dari laju? Lalu apa pengertian dari reaksi kimia? Dalam kehidupan sehari-hari, kalian tentu pernah mendengar kata laju bukan? Laju mempunyai padanan kata kecepatan, sering kalian mendengar manakala seseorang mengoperasikan kendaraan, misalnya mobil bergerak dengan kecepatan 70 km/jam, kecepatan rata-rata sepeda motor Valentino Rossi pada pertandingan motor GP adalah 250 km/jam. Berarti, sepeda motor Rossi sudah menempuh jarak 250 km dalam 1 jam. Bukan hanya kendaraan yang memiliki laju, reaksi kimia juga memiliki laju.
4.Guru memotivasi siswa
awet, hal ini dikarenakan suhu yang rendah dapat memperlambat pertumbuhan bakteri yang tidak tahan terhadap suhu rendah, dsb Kegiatan Inti Stimulasi dan
identifikasi kelompok, masing-masing kelompok terdiri dari 4-5 siswa 2.Guru memberi stimulus dengan
membagikan LKS tentang kemolaran, pengenceran, dan pencampuran larutan
3.Guru memberi kesempatan siswa untuk mengidentifikasi masalah kenapa kita harus mempelajari kemolaran, pengenceran, dan pencampuran larutan
1.Guru meminta siswa menggali informasi tentang kemolaran, pengenceran dan pencampuran larutan dari berbagai sumber
1.Siswa mengolah informasi yang didapat dari membaca sumber – sumber tentang kemolaran, pengenceran, dan pencampuran larutan dengan cara diskusi dengan teman sebangkunya
1.Guru memberi kesempatan kepada siswa untuk
mempresentasikan hasil diskusi 2.Guru membimbing siswa
membandingkan hasil diskusi untuk memperoleh hasil yang diharapkan.
Generalisasi
3.Siswa menyimpulkan hasil diskusi
1.Guru memberikan tanggapan dan penguatan terhadap kesimpulan hasil diskusi siswa
Penutup 1.Siswa dan guru bersama-sama mereview hasil pembelajaran tentang kemolaran, pengenceran, dan pencampuran larutan
2.Guru memberi tugas siswa untuk membaca materi faktor-faktor penentu laju reaksi
3.Guru menutup kegiatan pembelajaran dengan
mengucapkan salam dan berdoa bersama
5 menit
V. Alat dan Sumber Belajar
1. Alat dan Bahan: alat tulis, internet, ppt 2. Sumber belajar:
Das Salirawati. 2007. Belajar Kimia Secara Menarikuntuk SMA/MA Kelas X. Jakarta : Grasindo
Sunardi dan Dini Kurniawati. 2015. Kimia untuk SMA/MA Kelas XI. Bandung: PT. SEWU (Srikandi Empat Widya Utama)
VI. Penilaian
Siswa mengerjakan lembar kerja siswa dan tes tertulis berupa soal essay
Guru Pembimbing Lapangan Mahasiswa PPL
Wiji Wati, S.T
NIP. 19810910 201101 2 003
LAMPIRAN 1: MATERI PEMBELAJARAN
A. Pengertian Laju Reaksi
Laju reaksi adalah laju penurunan reaktan (pereaksi) atau laju bertambahnya produk (hasil reaksi). Laju reaksi ini juga menggambarkan cepat lambatnya suatu reaksi kimia, sedangkan reaksi kimia merupakan proses mengubah suatu zat (pereaksi) menjadi zat baru yang disebut sebagai produk.
Beberapa reaksi kimia ada yang berlangsung cepat. Natrium yang dimasukkan ke dalam air akan menunjukkan reaksi hebat dan sangat cepat, begitu pula dengan petasan dan kembang api yang disulut. Bensin akan terbakar lebih cepat daripada minyak tanah. Namun, ada pula reaksi yang berjalan lambat. Proses pengaratan besi, misalnya, membutuhkan waktu sangat lama sehingga laju reaksinya lambat. Cepat lambatnya proses reaksi kimia yang berlangsung dinyatakan dengan laju reaksi.
B. Pengertian Kemolaran
Kemolaran atau molaritas merupakan satuan untuk menyatakan konsentrasi suatu larutan. Kemolaran yaitu jumlah mol zat terlarut dalam 1 Liter larutan. Secara matematis, kemolaran dirumuskan sebagai berikut:
� = ��
Dimana M : molaritas (mol L-1) n : mol zat terlarut (mol) V : volume larutan (L)
Untuk menyatakan konsentrasi dapat menggunakan notasi kurung siku, misal konsentrasi larutan HCl dapat ditulis [HCl].
C. Pengenceran
Pembuatan larutan terkadang tidak berasal dari kristal murninya, tetapi dari larutan pekat. Cara membuatnya disebut pengenceran. Mula-mula larutan pekat ditambahkan zat pelarut sehingga mengubah larutan menjadi lebih encer. Pengenceran menyebabkan volume dan konsentrasi (kemolaran) berubah, tetapi jumlah mol zat terlarut tidak berubah. Oleh karena itu, maka dapat disimpulkan bahwa:
n1 = n2
V1 . M1 = V2 . M2
V1 : volume larutan awal (mL atau L)
M1 : konsentrasi/molaritas awal (M)
V2 : volume larutan setelah pengenceran (mL atau L)
D. Pencampuran
Pencampuran merupakan penggabungan 2 atau lebih zat yang jenisnya sama, tetapi konsentrasinya berbeda. Pada proses pencampuran beberapa jenis zat berlaku rumus:
LAMPIRAN 2: RUBRIK PENILAIAN SPIRITUAL
No Nama Siswa
Skor Aspek
Pengamatan Skor Total Nilai 1 2 3
1 2 3 4 5
Keterangan Aspek :
1. Berdoa sebelum dan sesudah melakukan sesuatu
2. Memelihara hubungan baik dengan sesama umat ciptaan Tuhan Yang Maha Esa 3. Memberi salam pada saat awal dan akhir presentasi sesuai agama yang dianut Keterangan skor:
1 – 3 = kurang 4 – 6 = cukup 7 – 9 = baik
10 – 12 = sangat baik
LAMPIRAN 3: RUBRIK PENILAIAN SIKAP
No Nama Siswa Aspek Sikap Skor Total Nilai Aktif Kerjasama
1 2 3 4 5
Keterangan skor: 1 – 3 = kurang 4 – 6 = cukup 7 – 9 = baik
LAMPIRAN 4: RUBRIK PENILAIAN PENGETAHUAN
Pembelajaran Butir Soal Skor
Memahami serta penerapannya dalam kehidupan sehari-hari dan industri
Mendeskripsikan pengertian laju reaksi dengan melakukan
percobaan tentang faktor-faktor yang mempengaruhi laju reaksi
Menjelaskan konsep laju reaksi
Memahami konsep kemolaran suatu larutan
Memahami cara membuat larutan dengan molaritas tertentu melalui pengenceran dan pencampuran larutan
1. Apa yang dimaksud dengan larutan KOH 1 M? 2. Berapakah kemolaran 0,1 mol H2SO4 dalam
500 mL larutan?
3. Berapakah molaritas larutan NaOH, jika 10 gram NaOH (Mr = 40) dilarutkan ke dalam air sehingga volume larutan menjadi 2 Liter? 4. Berapakah molaritas larutan yang mengandung
0,5 mol glukosa dalam 2 Liter larutan?
5. Berapa molaritas larutan H2SO4 pekat jika
pada botolnya tertera kadar 98% dan massa jenis 1,8 kg L-1?
6. Berapa mL air yang harus ditambahkan ke dalam 100 mL larutan NaOH 0,5 M agar konsentrasi NaOH menjadi 0,1 M?