ii Hak Cipta pada Direktorat Pembinaan SMK Kementerian Pendidikan dan Kebudayaan
Dilindungi Undang-Undang
Penulis : Supartono.
Dewi Selvia Fardhyanti
2017
Disusun dengan huruf Times New Roman, 11 pt
iii
KATA PENGANTAR
Undang-Undang Dasar Negara Republik Indonesia Tahun 1945 Pasal 31 ayat (3)
mengamanatkan bahwa Pemerintah mengusahakan dan menyelenggarakan satu sistem pendidikan
nasional, yang meningkatkan keimanan dan ketakwaan serta akhlak mulia dalam rangka
mencerdaskan kehidupan bangsa, yang diatur dengan undang-undang. Atas dasar amanat tersebut
telah diterbitkan Undang-Undang Republik Indonesia Nomor 20 Tahun 2003 tentang Sistem
Pendidikan Nasional
Implementasi dari undang-undang Sistem Pendidikan Nasional tersebut yang dijabarkan
melalui sejumlah peraturan pemerintan, memberikan arahan tentang perlunya disusun dan
dilaksanakan delapan standar nasional pendidikan, diantaranya adalah standar sarana dan
prasarana. Guna peningkatan kualitas lulusan SMK maka salah satu sarana yang harus dipenuhi
oleh Direktorat Pembinaan SMK adalah ketersediaan bahan ajar siswa khususnya bahan ajar
Peminatan C1 SMK sebagai sumber belajar yang memuat materi dasar kejuruan
Kurikulum yang digunakan di SMK baik kurikulum 2013 maupun kurikulum KTSP pada
dasarnya adalah kurikulum berbasis kompetensi. Di dalamnya dirumuskan secara terpadu
kompetensi sikap, pengetahuan dan keterampilan yang harus dikuasai peserta didik serta rumusan
proses pembelajaran dan penilaian yang diperlukan oleh peserta didik untuk mencapai kompetensi
yang diinginkan. Bahan ajar Siswa Peminatan C1 SMK ini dirancang dengan menggunakan proses
pembelajaran yang sesuai untuk mencapai kompetensi yang telah dirumuskan dan diukur dengan
proses penilaian yang sesuai.
iv
terbentang luas di sekitarnya. Bahan ajar ini merupakan edisi ke-1. Oleh sebab itu Bahan Ajar ini
perlu terus menerus dilakukan perbaikan dan penyempurnaan.
Kritik, saran, dan masukan untuk perbaikan dan penyempurnaan pada edisi berikutnya sangat
kami harapkan; sekaligus, akan terus memperkaya kualitas penyajian bahan ajar ini.Atas kontribusi
itu, kami ucapkan terima kasih. Tak lupa kami mengucapkan terima kasih kepada kontributor
naskah, editor isi, dan editor bahasa atas kerjasamanya. Mudah-mudahan, kita dapat memberikan
yang terbaik bagi kemajuan dunia pendidikan menengah kejuruan dalam rangka mempersiapkan
Generasi Emas seratus tahun Indonesia Merdeka (2045).
v
B. REAKSI EKSOTERM DAN ENDOTERM ... 2
C. PERSAMAAN TERMOKIMIA ... 5
D. ENTALPI DAN JENIS-JENIS PERUBAHAN ENTALPI REAKSI ... 5
E. PENENTUAN ENTALPI REAKSI ... 10
F. KALOR PEMBAKARAN ... 16
E. TEORI TUMBUKAN DARI LAJU REAKSI ... 37
UJI KOMPETENSI ... 42
BAB 3 KESETIMBANGAN REAKSI ... 46
A. DEFINISI DAN PRINSIP KESETIMBANGAN REAKSI ... 46
B. KARAKTERISTIK KEADAAN SETIMBANG ... 49
C. HUKUM KESETIMBANGAN ... 52
D. KONSTANTA KESETIMBANGAN ... 54
E. FAKTOR-FAKTOR YANG MEMPENGARUHI KESETIMBANGAN REAKSI ... 57
F. PENERAPAN KESETIMBANGAN KIMIA ... 62
UJI KOMPETENSI ... 66
BAB 4 TEORI ASAM BASA ... 70
A. ELEKTROLIT ... 71
B. TEORI ARRHENIUS ... 72
C. TEORI BRONSTED-LOWRY ... 73
D. TEORI LEWIS ... 75
E. IKHTISAR TEORI ARRHENIUS, BRONSTED-LOWRY, LEWIS ... 78
vi
G. REAKSI IONISASI ASAM DAN BASA DALAM AIR ... 80
H. DERAJAT IONISASI ... 82
O. BUFFER: LARUTAN PENYANGGA pH ... 96
P. INDIKATOR ASAM BASA ... 98
D. PENGGOLONGAN KOLOID ... 108
E. PEMBUATAN KOLOID... 111
F. KOLOID ASOSIASI ... 116
G. PEMURNIAN KOLOID ... 117
H. BEBERAPA SIFAT KOLOID ... 118
I. BERBAGAI MACAM KOLOID ... 126
J. PENGGUNAAN KOLOID DAN KOLOID DALAM KEHIDUPAN SEHARI-HARI ... 128
UJI KOMPETENSI ... 131
BAB 6 HIDROKARBON ... 134
A PENDAHULUAN ... 134
B. IDENTIFIKASI UNSUR C, H, DAN O DALAM SENYAWA KARBON ... 135
C. SENYAWA HIDROKARBON DAN TURUNANNYA ... 136
UJI KOMPETENSI ... 157
BAB 7 POLIMER ... 160
A. PENDAHULUAN ... 160
B. KLASIFIKASI POLIMER... 162
C. REKAYASA DAN APLIKASI POLIMER DALAM DUNIA MODERN ... 176
UJI KOMPETENSI ... 183
DAFTAR PUSTAKA... 186
GLOSARIUM ... 189
vii
DAFTAR GAMBAR
Gambar 1.1. Ilustrasi Proses Reaksi Eksotermis dan Endotermis ... 4
Gambar 1.2. Kalorimeter Bom ... 122
Gambar 1.3. Kalorimeter Sederhana ... 13
Gambar 2.1. Reaksi Kimia dengan Laju Reaksi Cepat dan Lambat ... 266
Gambar 2.2. Penyimpanan Makanan dalam Lemari Es ... 266
Gambar 2.3. Petunjuk Konsentrasi Larutan Kimia dalam Laboratorium ... 28
Gambar 2.4. Konsentrasi HI versus waktu. ... 30
Gambar 2.5.(a) Pembakaran Rokok di Udara Terbuka ... 34
Gambar 2.6. Pembakaran Potongan Kayu Balok ... 35
Gambar 2.7.(a) Menggoreng kentang dalam minyak panas, ... 36
Gambar 2.8. (a) Katalis Anorganik pada Perengkahan Hidrokarbon secara Katalitik, ... 36
Gambar 2.9. Penggambaran Kontak antara Partikel-Partikel Pereaksi. ... 38
Gambar 2.10.Diagram Energi Potensial untuk Reaksi ... 39
Gambar 2.11. Pengaruh Konsentrasi Pereaksi terhadap Laju Reaksi ... 40
Gambar 2.12. Pengaruh Luas Permukaan Sentuh terhadap Laju Reaksi ... 40
Gambar 2.13. Pengaruh Kenaikan Suhu terhadap Laju Reaksi ... 41
Gambar 2.14. Pengaruh katalis terhadap Laju Reaksi ... 41
Gambar 3.1. Reaksi bolak-balik (reversible). ... 50
Gambar 3.2. Perubahan konsentrasi dan laju reaksi. ... 54
Gambar 3.3. Kurva kesetimbangan 2NO2 (g) N2O4(g) ... 57
Gambar 3.4. Proses Peredaran Oksigen dalam Darah ... 64
Gambar 4.1. Larutan Elektrolit ... 71
Gambar 4.2. Larutan Nonelektrolit ... 71
Gambar 4.3. Svante August Arrhenius ... 72
Gambar 4.4. Reaksi Asam ... 72
Gambar 4.5. Reaksi Basa ... 73
Gambar 4.6. Pasangan Asam Basa Konjugasi ... 73
Gambar 4.7. Bronsted-Lowry Fase Gas ... 74
Gambar 4.8. Teori Asam Basa Lewis ... 76
Gambar 4.9. Hujan Asam ... 79
Gambar 4.10. Reaksi Kesetimbangan Air ... 84
Gambar 4.11. pH sebagai Fungsi Konsentrasi ... 90
Gambar 4.12. Trayek Perubahan Warna ... 99
viii
Gambar 5.1. Beberapa contoh Benda-Benda Bersifat Koloid ... 106
Gambar 5.2. Larutan gula, larutan kanji, dan campuran air dan pasir ... 107
Gambar 5.3. Koloid Liofil (a) selai (b) kapsul (c) mayonese ... 110
Gambar 5.4. Cara Membuat Sistem Koloid ... 111
Gambar 5.5. Pembentukan koloid AgCl oleh NaCl dan AgNO3 ... 113
Gambar 5.6. Dispersi Proses Mekanik untuk Mendapatkan Koloid ... 114
Gambar 5.7. Proses Dispersi dengan Cara Peptisasi menjadi Koloid ... 115
Gambar 5.8. Dispersi dengan Cara Busur Bredig ... 116
Gambar 5.9. Proses Kerja Sabun dalam Mengangkat Kotoran ... 117
Gambar 5.10. Proses Dialisis ... 118
Gambar 5.11. Pengaruh Penghamburan Cahaya dalam Larutan ... 118
Gambar 5.12. Efek Tyndall karena Sinar Matahari ... 119
Gambar 5.13. Gerak Brown ... 120
Gambar 5.14. Percobaan Elektroforesis ... 121
Gambar 5.15. Proses Dialisis sebagai Alat Cuci Darah ... 122
Gambar 5.16. Koagulasi Koloid ... 123
Gambar 5.17. Contoh Koloid Pelindung ... 125
Gambar 5.18. Adsorpsi Koloid ... 125
Gambar 5.19. Emulsi Cair ... Error! Bookmark not defined. Gambar 5.20. Produk dalam Bentuk Gel... 128
Gambar 5.21. Penjernihan Air ... 129
Gambar 6.1. Struktur Etil Metil Eter dan Struktur propanol ... 138
Gambar 6.2. Penentuan Rantai Karbon Terpanjang. ... 139
Gambar 6.3. Penentuan Cabang Pada Rantai Utama ... 139
Gambar 6.4. Penentuan Nomor Pada Atom Karbon ... 139
Gambar 6.5. Struktur 4-etil-3 metil-2,4-heksanadiol ... 140
Gambar 6.6. Tata Nama Eter ... 141
Gambar 6.7. Penempatan atom Karbon dalam molekul ... 141
Gambar 6.8. Reaksi Oksidasi Pada Alkohol ... 144
Gambar 6.9. Struktur Dasar Keton, Aldehida ... 146
Gambar 6.10. Struktur Propanal dan Propanon ... 147
Gambar 6.11. Struktur Asam Karboksilat ... 152
Gambar 6.12. Struktur Ester ... 152
Gambar 6.13. Tata Nama Asam Karboksilat... 153
Gambar 6.14. Tata Nama Ester ... 153
Gambar 7.1. Aplikasi Polimer dalam Kehidupan Sehari-hari ... 161
ix
Gambar 7.3. Susunan Molekul Polietena dengan Monomernya. ... 162
Gambar 7.4. Diagram Klasifikasi Polimer ... 162
Gambar 7.5. Contoh Polimer Alam ... 163
Gambar 7.6. Struktur Polimer pada Pati ... 164
Gambar 7.7. Contoh Polimer Buatan ... 165
Gambar 7.8. Jenis Struktur Polimer ... 166
Gambar 7.9. Ilustrasi Struktur Homopolimer ... 166
Gambar 7.10. Ilustrasi Struktur Beberapa Jenis Kopolimer ... 168
Gambar 7.11. Ilustrasi Struktur Rantai Kopolimer ... 168
Gambar 7.12. Diagram Klasifikasi Polimer berdasarkan Sifat dan Karakteristiknya. ... 169
Gambar 7.13. Struktur Termoplastik Amorf dan Semi-Kristalin ... 170
Gambar 7.14. Struktur Rantai Termoplastik, Elastomer dan Termoset ... 171
Gambar 7.15. Penampakan Partikel Nano CaCO3 pada Matrik HDPE ... 173
Gambar 7.16. Diagram Klasifikasi Polimer Berdasarkan Reaksi Polimerisasi ... 174
Gambar 7.17. Contoh Polimerisasi Adisi ... 174
Gambar 7.18.Contoh Polimerisaasi Pondensasi ... ... 176
Gambar 7.19. Contoh Aplikasi Kevlar Pada Dunia Modern ... 177
Gambar 7.20. Diagram Skematik dari Polimer Sel Surya: PET, ITO, PEDOT:PSS, Active Layer, Al. ... 178
Gambar 7.21. Benang Bedah yang Terbuat dari Polyglycolic Acid ... 180
x
DAFTAR TABEL
Tabel 1.1. Perbedaan reaksi eksoterm dan endoterm ... 3
Tabel 1.2. Simbol entalpi pada berbagai proses ... 6
Tabel 1.3. Nilai entalpi pembentukan berbagai zat dan persamaan termokimia pembentukannya ... 7
Tabel 1.4. Entalpi pembakaran dari berbagai zat pada kondisi standar ... 8
Tabel 1.5. Entalpi pembentukan senyawa ... 15
Tabel 1.6. Energi ikat antar atom dari berbagai senyawa (kJ/mol) ... 16
Tabel 1.7. Komposisi dan nilai kalor dari berbagai jenis bahan bakar ... 18
Tabel 2.1. Hasil pengukuran konsentrasi HI setiap 50 detik. ... 29
Tabel 2.2. Laju reaksi 𝑣𝐻𝐼 pada tiga selang waktu pertama ... 29
Tabel 2.3.Persamaan laju reaksi untuk beberapa reaksi kimia ... 31
Tabel 2.4.Hasil pengukuran laju reaksi NO dan Cl2 ... 32
Tabel 2.5. Perhitungan tetapan laju reaksi, k, dalam v = k[NO]2 [Cl2]. ... 33
Tabel 2.6.Katalis dan aplikasinya. ... 37
Tabel 3.1. Susunan k e s e t i m b a n g a n reaksi gas CO dengan H2 ... 52
Tabel 3.2. Harga Kp pada Berbagai Suhu untuk Pembentukan NH3 ... 61
Tabel 3.3. Harga Kp pada Berbagai Suhu untuk Reaksi H2 dan CO2 ... 61
Tabel 4.1. Perbandingan Tiga Teori Asam-Basa ... 78
Tabel 4.2. Harga untuk Beberapa Asam ... 83
Tabel 4.3. Harga Kb untuk Beberapa Basa ... 84
Tabel 4.4. Harga Kw pada Berbagai Suhu ... 85
Tabel 4.5. Hubungan antara pH dan pOH pada 25 °C ... 88
Tabel 4.6. pH Beberapa Larutan ... 88
Tabel 4.7. Contoh Asam Monoprotik dan Poliprotik ... 91
Tabel 4.8. Contoh Senyawa Amfoter ... 96
Tabel 4.9. Indikator untuk Menunjukkan Asam atau Basa ... 98
Tabel 4.10. Trayek Perubahan Warna Indikator ... 99
Tabel 5.1. Perbedaan antara Larutan, Koloid, dan Suspensi ... 107
Tabel 5.2.Sistem Dispersi Koloid ... 108
Tabel 5.3. Perbedaan Koloid Hidrofil dan Koloid Liofob. ... 110
Tabel 6.1. Gugus Fungsional Karbon ... 137
Tabel 6.2. beberapa nama trivial dan sistem IUPAC untuk alkohol ... 140
Tabel 6.3. Kelarutan alkohol dan eter dalam air ... 143
Tabel 6.4. Nama IUPAC dan trivial aldehid ... 148
Tabel 6.5. Nama IUPAC dan Trivial asam karboksilat ... 154
xi
Tabel 7.2. Contoh polimer sintesis, monomer penyusunnya dan kegunaannya. ... 165
Tabel 7.3. Perbandingan antara struktur amorf dan kristalin ... 170
Tabel 7.4. Contoh Termoplastik-Elastomer (TPE) ... 172
Tabel 7.5. Contoh polimer adisi ... 175
Tabel 7.6. Aplikasi polimer pada industri otomotif ... 181
xii
PENDAHULUAN
A.
Deskripsi
Buku Kimia untuk SMK Teknologi dan Rekayasa kelas XI ini terdiri dari 2 buku, yaitu buku 1 dan buku 2. Buku ini merupakan buku 1 yang akan mempelajari tentang termokimia, laju reaksi, kesetimbangan kimia, larutan asam basa, koloid, senyawa karbon, dan polimer.
B.
Prasyarat
Untuk mempelajari buku tidak diperlukan prasyarat mata pelajaran tertentu.
C.
Petunjuk Penggunaan Buku
Untuk mempermudah penggunaan buku perlu diperhatikan petunjuk berikut ini: 1. Pelajari daftar isi serta peta konsep setiap materinya,
2. Perhatikan langkah-langkah dalam melakukan pekerjaan dengan benar untuk mempermudah dalam memahami suatu proses pekerjaan, sehingga diperoleh hasil yang maksimal,
3. Pahami setiap materi teori dasar yang akan menunjang penguasaan suatu pekerjaan dengan membaca secara teliti. Jawablah tes formatif dengan jawaban yang singkat dan jelas serta kerjakan sesuai dengan kemampuan Anda setelah mempelajari buku ini,
4. Catatlah kesulitan yang Anda dapatkan dalam buku ini untuk ditanyakan pada guru pada saat kegiatan tatap muka. Bacalah referensi yang lain yang berhubungan dengan materi buku agar Anda mendapatkan pengetahuan tambahan,
D.
Tujuan Akhir
Setelah mempelajari buku ini, saudara diharapkan dapat: 1. Menjelaskan tentang termokimia,
2. Menjelaskan tentang laju reaksi,
3. Menjelaskan tentang kesetimbangan kimia, 4. Menjelaskan tentang larutan asam basa, 5. Menjelaskan tentang koloid,
1
BAB 1
TERMOKIMIA
PETA KONSEP
Setelah mempelajari bab ini, Anda diharapkan dapat: 1. Menjelaskan pengertian termokimia,
2. Membedakan entalpi dan perubahan entalpi, 3. Menjelaskan pengertian eksoterm dan endoterm, 4. Menjelaskan persamaan termokimia,
5. Menentukan entalpi pembentukan, penguraian dan pembakaran,
6. Menentukan perubahan entalpi berdasarkan metode kalorimetri, hukum Hess, entalpi pembentukan standar dan data energi ikatan,
7. Menjelaskan pengertian kalor pembakaran berbagai bahan bakar dalam kehidupan sehari-hari,
8. Menjelaskan persamaan reaksi pembakaran sempurna,
9. Menjelaskan dampak pembakaran bahan bakar yang tidak sempurna berdasarkan sifat gas yang dihasilkan.
10. Aplikasi termokimia pada kehidupan sehari-hari
A.
PENDAHULUAN
Tahukah Anda berasal darimana energi yang Anda gunakan untuk berlari, belajar, bekerja dan bermain? Energi tersebut berasal dari reaksi yang berlangsung di
Termokimia
Reaksi
Endoterm dan
Eksoterm
Persamaan
Termokimia
Entalpi reaksi
2 dalam tubuh. Bahan makanan yang masuk ke dalam tubuh kamu dirubah menjadi energi melalui serangkaian reaksi kimia dalam tubuh. Mengapa kita perlu memulai pemahaman termokimia dari energi? Karena termokimia adalah bahasan ilmu kimia yang berhubungan dengan energi. Setiap materi memiliki energi internal berupa energi potensial maupun energi kinetik. Jika energi yang terkandung dalam materi ini berubah, maka perubahan energi ini kita namakan dengan kalor. Jika ada perubahan kalor pada tekanan tetap, kita namakan sebagai perubahan entalpi (ΔH). Di dunia ini tidak semua energi dapat diukur besar energi dalamnya, namun kita masih dapat mengetahui perubahan energi yang terjadi di dalamnya.
Untuk memudahkan dalam memahami konsep kalor mari kita bersama-sama simak contoh berikut ini. Ada sebuah termos yang di dalamnya berisi air panas, dalam hal ini kita tidak dapat mengatakan jika di dalam air tersebut mengandung banyak kalor. Di dalam termos tersebut memiliki energi yang kita sebut dengan energi internal namun bukan berarti air tersebut mengandung banyak kalor. Kenapa? Karena kalor akan ada jika energi di dalam energi tersebut berubah, sehingga air di dalam termos tersebut baru memiliki kalor jika ada perubahan energi di dalamnya. Lalu kapan kalor itu ada? Apabila air dikeluarkan dari dalam termos kemudian air ini berinteraksi dengan lingkungan sehingga terjadi perubahan energi maka itu kita sebut dengan kalor.
Kalor dapat berpindah dari satu benda ke benda yang lain karena adanya perbedaan suhu. Seperti pada contoh sebelumnya, apabila air di dalam termos memiliki suhu 100°C kemudian kita menuangkan air tersebut pada gelas dengan yang berisi air dengan suhu 25°, maka akan ada perpindahan kalor dari air yang suhunya lebih tinggi menuju air yang suhunya lebih rendah. Perubahan suhu inilah yang nantinya akan dapat kita gunakan dalam menentukan suatu reaksi kimia bersifat endoterm atau eksoterm.
B.
REAKSI EKSOTERM DAN ENDOTERM
Pada proses perpindahan energi, energi berpindah dari lingkungan ke sistem atau sebaliknya. Apa itu sistem dan lingkungan? Sistem adalah segala sesuatu yang dipelajari
KEGIATAN SISWA
3 perubahan energinya sedangkan lingkungan adalah segala sesuatu yang berada di sekeliling sistem dan tentunya terpengaruh akan adanya sistem tersebut. Dalam pelajaran kimia yang biasanya berhubungan dengan reaksi, maka sistem di sini dapat kita katakan sebagai jumlah zat yang bereaksi. Sedangkan lingkungannya adalah segala sesuatu selain zat yang bereaksi tersebut, misalnya adalah gelas kimia yang menjadi tempat terjadinya reaksi.
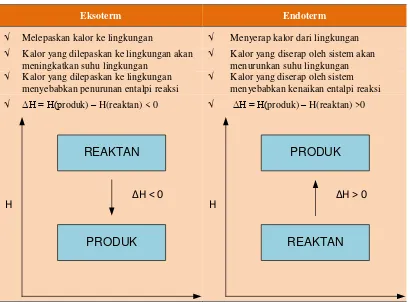
Reaksi kimia berlangsung dengan dua cara yaitu menyerap atau membebaskan kalor. Jika reaksi tersebut menyerap kalor maka reaksi ini disebut dengan reaksi endoterm, sedangkan jika reaksi tersebut membebaskan kalor ini disebut dengan reaksi eksoterm. Pada Tabel 1.1 berikut adalah perbedaan antara reaksi eksoterm dan endoterm.
Tabel 1.1. Perbedaan reaksi eksoterm dan endoterm Eksoterm Endoterm
√ Melepaskan kalor ke lingkungan √ Menyerap kalor dari lingkungan
√ Kalor yang dilepaskan ke lingkungan akan meningkatkan suhu lingkungan
√ Kalor yang diserap oleh sistem akan menurunkan suhu lingkungan
√ Kalor yang dilepaskan ke lingkungan menyebabkan penurunan entalpi reaksi
√ Kalor yang diserap oleh sistem menyebabkan kenaikan entalpi reaksi
√ ΔH = H(produk) – H(reaktan) < 0 √ ΔH = H(produk) – H(reaktan) >0
REAKTAN
PRODUK
H ΔH < 0
PRODUK
REAKTAN
4
Sumber: https://id.wikipedia.org
Gambar 1.1.Ilustrasi proses reaksi eksotermis dan endotermis
Pada reaksi eksoterm kalor akan dilepas di lingkungan sehingga kalor yang dilepaskan akan meningkatkan suhu lingkungan namun suhu sistemnya akan turun. Sebagai contoh adalah reaksi pencampuran antara natrium hidroksida (NaOH) dengan asam klorida (HCl), pada saat diukur, maka akan kita ketahui bahwa suhunya naik, suhu manakah yang naik? Suhu sistem atau suhu lingkungan? Perlu kita ketahui bahwa pada reaksi pencampuran ini reaksi ini bersifat eksoterm karena suhu lingkungannya yang naik, karena reaksi ini menghasilkan panas dan panas ini dilepaskan ke lingkungan. Panas yang dilepas ke lingkungan ini akan menyebabkan penurunan entalpi reaksi. Hal ini terjadi karena entalpi produk lebih kecil daripada entalpi reaktan, sehingga ΔH nya memiliki nilai negatif. Contoh lain dari reaksi eksoterm adalah pembentukan CO2 dari C
dan O2, berikut adalah persamaan reaksinya:
C(s) + O2(g) → CO2(g) ΔH = ‑393,5 kJ (1.1)
Pada reaksi endoterm, karena reaksi ini menyerap kalor dari lingkungan, maka kalor yang diserap oleh sistem ini akan menyebabkan turunnya suhu lingkungan. Kalor yang diserap akan menaikkan entalpi reaksi sehingga nilai ΔH nya bertanda positif karena entalpi produk lebih tinggi dari entalpi reaktan. Berikut adalah salah satu contoh reaksi endoterm, yaitu reaksi peruraian CaCO3 menjadi CaO dan CO2.
CaCO3(s) → CaO(s) + CO2(g) ΔH = +178,5 kJ (1.2)
SISTEM
kalor kalor kalor
kalor
Eksoterm
SISTEM
kalor kalor kalor
kalor
Endoterm
5
C.
PERSAMAAN TERMOKIMIA
Pada suatu reaksi kimia, untuk dapat mengetahui seberapa besar jumlah kalor yang terjadi, maka kita perlu menyusun terlebih dahulu persamaan termokimianya. Apa saja yang diperlukan dalam menyusun persamaan termokimia? Berikut adalah langkah-langkah yang diperlukan untuk menyusun persamaan termokimia.
1. Pertama-tama tuliskan persamaan reaksi, lengkap dengan koefisien dan fasenya lalu
tuliskan ΔH di ruas sebelah kanan atau bersebelahan dengan hasil reaksi,
2. Untuk reaksi eksoterm ΔH nya bernilali negatif dan sebaliknya untuk reaksi endoterm
ΔH nya bernilai positif,
3. Jika persamaan termokimia dikalikan dengan suatu faktor tertentu, maka nilai ΔH juga harus dikalikan dengan faktor tersebut. Begitu juga apa bila persamaan
termokimia dibagi dengan faktor tertentu maka nilai ΔH nya juga harus dibagi
dengan faktor yang sama. Jika ada dua persamaan yang ditambahkan, maka ΔH nya juga harus dijumlah begitu juga dengan operasi pengurangan,
4. Koefisien pada persamaan termokimia sama dengan jumlah mol masing- masing komponen/molekul,
5. Jika arah persamaan kimianya dibalik maka nilai ΔH akan berubah tandanya, dari (+)
menjadi (-) atau sebaliknya.
D.
ENTALPI DAN JENIS-JENIS PERUBAHAN ENTALPI REAKSI
Perubahan entalpi yang diukur pada suhu 25 °C dan tekanan 1 atm disebut dengan perubahan entalpi standar (ΔH°). Jenis-jenis perubahan entalpi standar bergantung pada jenis reaksi, di antaranya adalah perubahan entalpi pembentukan standar (𝛥𝐻𝑓𝑜), perubahan entalpi penguraian standar (𝛥𝐻𝑑𝑜) dan perubahan entalpi pembakaran standar (𝛥𝐻𝑐𝑜).
KEGIATAN SISWA:
6 Tabel 1.2. Simbol entalpi pada berbagai proses
Simbol Proses yang direpresentasikan ΔHcomb Heat of combustion (Pembakaran)
ΔHf Heat of formation (Pembentukan) ΔHr Heat of a reaction (Reaksi)
ΔHfus Heat of fusion (Peleburan) ΔHvap Heat of vaporization (Penguapan) ΔHsolid (fre) Heat of solidification (Pembekuan)
ΔHcond Heat of condensation (Pengembunan) ΔHsol Heat of solution (Pelarutan)
1.
Perubahan Entalpi Pembentukan Standar
Perubahan entalpi pembentukan standar adalah (𝛥𝐻𝑓𝑜) adalah perubahan entalpi yang menyertai reaksi pembentukan satu mol senyawa dari unsur- unsurnya dan diukur pada keadaan standar. Simbol f di sini adalah formation yang berarti pembentukan. Entalpi pembentukan biasa dinyatakan dalam kJ/mol. Pada umumnya persamaan termokimia dinyatakan :
𝑎𝐴 + 𝑏𝐵 → 𝑐𝐶 + 𝑑𝐷 𝛥𝐻𝑓𝑜= 𝑥 𝑘𝐽/𝑚𝑜𝑙 (1.3)
di mana 𝑎, 𝑏, 𝑐 dan 𝑑 adalah koefisien reaksi, 𝐴, 𝐵, 𝐶 dan 𝐷 adalah jenis senyawa dan 𝛥𝐻° adalah perubahan entalpi pada keadaan tersebut. Nilai entalpi pembentukan standar memiliki kriteria sebagai berikut:
Bernilai positif bila menyerap panas dari lingkungan, Bernilai negatif jika melepas panas ke lingkungan,
Bernilai nol jika unsur tersebut sudah terdapat di alam secara alami,
Bentuk unsur yang sudah ada di alam terbagi menjadi dua yaitu monoatomik dan poliatomik.
7 gas lainnya selain gas mulia. Semua unsur yang sudah terdapat di alam ini nilai entalpi pembentukannya adalah 0.
Nilai entalpi pembentukan berbagai zat serta persamaan termokimia reaksi pembentukannya dapat dilihat pada tabel berikut ini.
Tabel 1.3. Nilai entalpi pembentukan berbagai zat dan persamaan termokimia pembentukannya
Rumus
Kimia Zat 𝜟𝑯𝒇
𝒐(kJ/mol) Persamaan Termokimia Reaksi Pembentukan
H2O(l) -285,9 H2(g) + ½ O2(g) → H2O(l)
2.
Perubahan Entalpi Penguraian Standar
Perubahan entalpi penguraian standar (𝛥𝐻𝑑𝑜) adalah perubahan entalpi yang menyertai reaksi penguraian satu mol senyawa menjadi unsur-usurnya dan diukur pada keadaan standar. Contoh nya adalah penguraian satu mol H2O(l), maka persamaan
termokimia untuk penguraian H2O(l) pada keadaan standar adalah sebagai berikut :
H2(g) + ½ O2(g) → H2O(l) 𝛥𝐻𝑑𝑜= 285,9 kJ/mol (1.4)
8
AgCl2(s) → Ag(s) + ½ Cl2(g) 𝛥𝐻𝑑𝑜= 127 kJ/mol (1.5)
KMnO4(s) → K(s) + Mn(s) + 2O2(g) 𝛥𝐻𝑑𝑜= 813 kJ/mol (1.6)
CO2(g) → C(s) + O2 𝛥𝐻𝑑𝑜= 393,5 kJ/mol (1.7)
3.
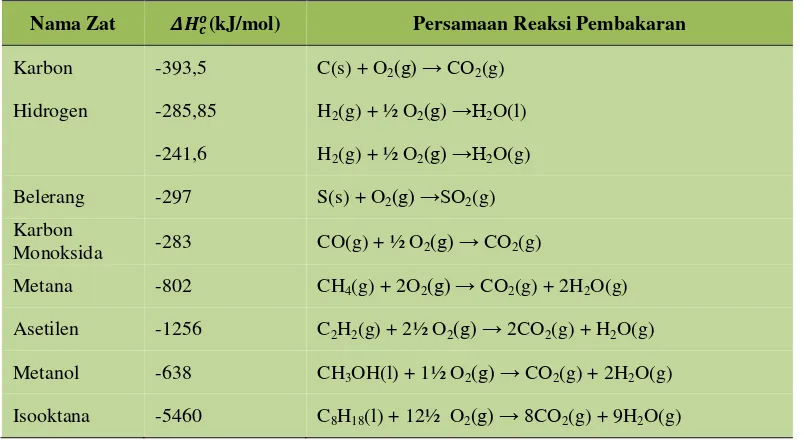
Perubahan Entalpi Pembakaran Standar
Perubahan entalpi pembakaran standar (𝛥𝐻𝑐𝑜) adalah perubahan entalpi yang menyertai reaksi pembakaran satu mol senyawa dengan gas oksigen dan diukur pada keadaan standar. Ciri utama dari reaksi pembakaran ada tiga yaitu merupakan reaksi eksoterm, melibatkan oksigen dalam reaksinya dan produk pembakarannya adalah sebagai berikut karbon akan terbakar menjadi CO2, hidrogen akan terbakar menjadi H2O
dan belerang akan terbakar menjadi SO2. Nilai entalpi pembakaran dari berbagai zat pada
kondisi standar dapat dilihat pada Tabel 1.4.
Tabel 1.4. Entalpi pembakaran dari berbagai zat pada kondisi standar
Nama Zat 𝜟𝑯𝒄𝒐(kJ/mol) Persamaan Reaksi Pembakaran
Karbon -393,5 C(s) + O2(g) → CO2(g)
Hidrogen -285,85 H2(g) + ½ O2(g) →H2O(l)
-241,6 H2(g) + ½ O2(g) →H2O(g)
Belerang -297 S(s) + O2(g) →SO2(g)
Karbon
Monoksida -283 CO(g) + ½ O2(g) → CO2(g)
Metana -802 CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Asetilen -1256 C2H2(g) + 2½ O2(g) → 2CO2(g) + H2O(g)
Metanol -638 CH3OH(l) + 1½ O2(g) → CO2(g) + 2H2O(g)
Isooktana -5460 C8H18(l) + 12½ O2(g) → 8CO2(g) + 9H2O(g)
4.
Perubahan Entalpi Netralisasi Standar
Perubahan entalpi netralisasi standar (𝛥𝐻𝑛𝑜) adalah perubahan entalpi yang menyertai eaksi netralisasi satu mol basa oleh asam pada keadaan standar. Contohnya adalah netralisasi natrium hidroksida dengan menggunakan asam klorida. Berikut adalah persamaan termokimianya.
9
5.
Perubahan Entalpi Pelarutan Standar
10 Berikut ini adalah beberapa contoh persamaan termokimia untuk proses pelarutan:
NH3(g) + aq → NH3(aq) 𝛥𝐻𝑠𝑜= -35,2 kJ/mol (1.9)
HCl(g) + aq → H+
(aq) + Cl-(aq) 𝛥𝐻𝑠𝑜= -72,4 kJ/mol (1.10)
NaCl(s) + aq → Na+
(aq) + Cl-(aq) 𝛥𝐻𝑠𝑜= 4,0 kJ/mol (1.11)
6.
Perubahan Entalpi Molar Lain
Selain perubahan entalpi molar yang telah dibahas, masih terdapat berbagai entalpi molar lain, seperti entalpi peleburan, entalpi penguapan, entalpi sublimasi dan entalpi pengatoman. Masing-masing dihitung berdasarkan kuantitas per mol. Semua entalpi molar dinyatakan dalam kJ/mol.
E.
PENENTUAN ENTALPI REAKSI
Pada bagian ini kita akan membahas cara-cara apa saja yang dapat digunakan untuk mengetahui besarnya perubahan entalpi pada suatu reaksi. Secara umum ada empat cara yang sudah sering digunakan yaitu menggunakan alat eksperimen yang bernama kalorimeter (kalorimetri), menggunakan Hukum Hess (Hukum Penjumlahan), Menggunakan tabel entalpi pembentukan dan yang terakhir adalah menggunakan data energi ikatan.
1.
Kalorimetri
Kalorimetri yaitu cara penentuan kalor reaksi dengan menggunakan kalorimeter. Seperti yang telah kita ketahui, perubahan entalpi adalah perubahan kalor yang diukur pada tekanan konstan sehingga untuk menentukan perubahan entalpi dilakukan dengan cara yang sama dengan penentuan perubahan kalor yang dilakukan pada tekanan konstan. Perubahan kalor pada suatu reaksi dapat diukur melalui pengukuran perubahan suhu yang terjadi pada reaksi tersebut. Pengukuran perubahan kalor dapat dilakukan dengan alat yang disebut kalorimeter.
11 Berdasarkan Asas Black berlaku pernyataan jumlah kalor yang dilepas oleh benda panas sama dengan jumlah kalor yang diterima (diserap) oleh benda dingin. Di mana secara umum Asas Black dapat dituliskan dengan persamaan sebagai berikut:
𝑄𝑙𝑒𝑝𝑎𝑠= 𝑄𝑡𝑒𝑟𝑖𝑚𝑎 (1.12)
Jumlah kalor (𝑄) dapat dihitung dengan menggunakan persamaan:
𝑄𝑙𝑎𝑟𝑢𝑡𝑎𝑛= 𝑚 × 𝐶𝑝 × Δ𝑇 (1.12)
𝑄𝑘𝑎𝑙𝑜𝑟𝑖𝑚𝑒𝑡𝑒𝑟= 𝐶 × ∆𝑇 (1.13)
di mana, q = jumlah kalor (J) m = massa zat (kg)
∆𝑇 = perubahan suhu (°C atau K) 𝐶𝑝 = kalor jenis (J/kg.°C) atau (J/kg.K)
𝐶 = kapasitas kalor kalorimeter (J/°C) atau (J/K)
Karena tidak ada kalor yang terbuang ke lingkungan, maka persamaan kalor untuk sistem kalorimeter dapat dituliskan sebagai berikut:
𝑄𝑟𝑒𝑎𝑘𝑠𝑖= −(𝑄𝑙𝑎𝑟𝑢𝑡𝑎𝑛+ 𝑄𝑘𝑎𝑙𝑜𝑟𝑖𝑚𝑒𝑡𝑒𝑟) (1.14)
∆𝐻 = 𝑄𝑟𝑒𝑎𝑘𝑠𝑖
𝑗𝑢𝑚𝑙𝑎ℎ 𝑚𝑜𝑙 (1.15)
Ada dua jenis kalorimeter yang umum diketahui, yaitu kalorimeter bom (kalorimeter volum konstan) dan kalorimeter sederhana (kalorimetri tekanan konstan) a. Kalorimeter Bom
Kalorimeter bom adalah alat yang digunakan untuk mengukur jumlah kalor (nilai kalori) yang dibebaskan pada pembakaran sempurna (dalam O2 berlebih) suatu senyawa,
12 Oleh karena tidak ada kalor yang terbuang ke lingkungan, maka :
𝑄𝑟𝑒𝑎𝑘𝑠𝑖= −(𝑄𝑎𝑖𝑟+ 𝑄𝑏𝑜𝑚) (1.16)
Jumlah kalor yang diserap oleh air dapat dihitung dengan persamaan:
𝑄𝑎𝑖𝑟 = 𝑚𝑎𝑖𝑟𝐶𝑝𝑎𝑖𝑟∆𝑇 (1.17)
dengan 𝑚𝑎𝑖𝑟 = massa air dalam kalorimeter (kg)
𝐶𝑝𝑎𝑖𝑟 = kalor jenis air dalam kalorimeter (J/kg.°C) atau (J/kg.K)
∆𝑇 = perubahan suhu (°C atau K)
Sedangkan jumlah kalor yang diserap oleh bom dapat dihitung dengan persamaan:
𝑄𝑏𝑜𝑚 = 𝐶𝑏𝑜𝑚∆𝑇 (1.18)
dengan, 𝐶𝑏𝑜𝑚 = kapasitas kalor bom (J/°C atau J/K) ∆𝑇 = perubahan suhu (°C atau K)
Sumber : Chemistry: The Science in Context (3rd edition) Gambar 1.2. Kalorimeter bom
Reaksi yang berlangsung pada kalorimeter bom berlangsung pada volume tetap
(ΔV = nol). Oleh karena itu, perubahan kalor yang terjadi di dalam sistem = perubahan energi dalamnya. ∆𝐻 = 𝑄 + 𝑊 dimana 𝑊 = −𝑃. ∆𝑉 (Jika ∆𝑉 = 0 maka 𝑊 = 0) sehingga ∆𝐻 = 𝑄𝑟𝑒𝑎𝑘𝑠𝑖.
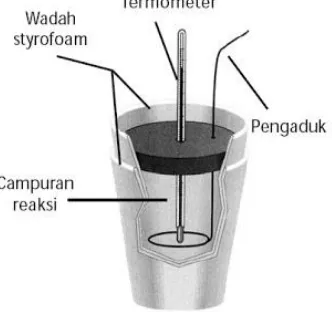
b. Kalorimeter Sederhana
13 reaksi yang reaksinya berlangsung dalam fase larutan (misalnya reaksi netralisasi asam- basa / netralisasi, pelarutan dan pengendapan).
Pada kalorimeter ini, kalor reaksi = jumlah kalor yang diserap/dilepaskan larutan sedangkan kalor yang diserap oleh gelas dan lingkungan diabaikan.
𝑄𝑟𝑒𝑎𝑘𝑠𝑖 = −(𝑄𝑙𝑎𝑟𝑢𝑡𝑎𝑛+ 𝑄𝑘𝑎𝑙𝑜𝑟𝑖𝑚𝑒𝑡𝑒𝑟) (1.19)
Jika harga kapasitas kalor kalorimeter sangant kecil maka dapat diabaikan sehingga 𝑄𝑘𝑎𝑙𝑜𝑟𝑖𝑚𝑒𝑡𝑒𝑟= 0 dan perubahan kalor dapat dianggap berakibat pada kenaikan suhu larutan dalam kalorimeter yang menjadi 𝑄𝑟𝑒𝑎𝑘𝑠𝑖 = −𝑄𝑙𝑎𝑟𝑢𝑡𝑎𝑛 dimana:
𝑄𝑙𝑎𝑟𝑢𝑡𝑎𝑛= 𝑚𝑙𝑎𝑟𝑢𝑡𝑎𝑛× 𝐶𝑝𝑙𝑎𝑟𝑢𝑡𝑎𝑛× Δ𝑇 (1.20)
Dengan, 𝑚𝑙𝑎𝑟𝑢𝑡𝑎𝑛 = massa larutan dalam kalorimeter (kg)
𝐶𝑝𝑙𝑎𝑟𝑢𝑡𝑎𝑛 = kalor jenis larutan dalam kalorimeter (J/kg.°C) atau
(J/kg.K)
Δ𝑇 = perubahan suhu (°C atau K)
Pada kalorimeter ini, reaksi berlangsung pada tekanan tetap (ΔP = nol ) sehingga
perubahan kalor yang terjadi dalam sistem=perubahan entalpinya (∆𝐻 = 𝑄𝑟𝑒𝑎𝑘𝑠𝑖).
Sumber: https://id.wikipedia.org
Gambar 1.3. Kalorimeter sederhana
14
2.
Hukum Hess
Hukum ini dikemukakan oleh Germain Henry Hess pada tahun 1840 yang
berbunyi “Bila suatu perubahan kimia dapat dibuat menjadi beberapa jalan/cara yang berbeda, jumlah perubahan energi panas keselurahannya (total) adalah tetap, tidak
bergantung pada jalan/cara yang ditempuh”. Maksudnya adalah, suatu reaksi dapat terjadi melalui beberapa tahap reaksi, dan bagaimanapun tahap atau jalan yang ditempuh tidak akan mempengaruhi entalpi reaksi. Perubahan entalpi reaksi hanya tergantung pada keadaan awal dan akhir sistem. Bukan tahap atau jalan yang ditempuh. Perubahan entalpi ini juga merupakan penjumlahan entalpi reaksi dari setiap tahap. Dengan demikian hukum Hess dapat digunakan untuk menghitung ΔH reaksi berdasarkan reaksireaksi lain
yang ΔH-nya sudah diketahui.
∆𝐻𝑟𝑒𝑎𝑘𝑠𝑖= ∆𝐻𝑝𝑟𝑜𝑑𝑢𝑘− ∆𝐻𝑟𝑒𝑎𝑘𝑡𝑎𝑛 (1.21)
Hukum ini digunakan ketika kita ingin mengetahui perubahan entalpi suatu reaksi namun tidak dapat diukur menggunakan kalorimeter secara langsung. Sebagai contoh adalah penentuan perubahan entalpi pembentukan standar (∆𝐻𝑓𝑜) CO. Pada reaksi pembakaran karbon tidak mungkin hanya menghasilkan gas CO saja tanpa disertai terbentuknya gas CO2. Jadi, bila dilakukan pengukuran perubahan entalpi dari reaksi tersebut; yang terukur tidak hanya reaksi pembentukan gas CO saja tetapi juga perubahan
entalpi dari reaksi pembentukan gas CO2.
Dalam penerapan Hukum Hess, persamaan termokimia yang ada terkadang perlu dimodifikasi terlebih dahulu. Berikut beberapa aturan dalam memanipulasi persamaan termokimia:
Ketika persamaan reaksi dibalik (reaktan menjadi produk, produk menjadi reaktan),
tanda nilai ΔH juga harus dibalik (dari positif menjadi negatif, dan sebaliknya). Substansi yang dihilangkan dari kedua sisi persamaan reaksi harus dalam fase yang
sama.
Jika semua koefisien dari suatu persamaan reaksi dikali atau dibagi dengan faktor
15
3.
Entalpi Pembentukan (
𝜟𝑯
𝒇𝒐)
Kalor suatu reaksi dapat juga ditentukan dari data entalpi pembentukan zat pereaksi dan produknya. Dalam hal ini, zat pereaksi dianggap terlebih dahulu terurai menjadi unsur-unsurnya, kemudian unsur-unsur itu bereaksi membentuk zat produk.
∆𝐻𝑟𝑒𝑎𝑘𝑠𝑖= Σ𝑛. 𝛥𝐻𝑓𝑜 (𝑝𝑟𝑜𝑑𝑢𝑘) − Σ𝑛. 𝛥𝐻𝑓𝑜 (𝑟𝑒𝑎𝑘𝑡𝑎𝑛) (1.22)
Apabila suatu reaksi memiliki persamaan reaksi 𝑎𝐴 + 𝑏𝐵 → 𝑐𝐶 + 𝑑𝐷 dimana 𝑎, 𝑏, 𝑐 dan 𝑑 adalah koefisien stoikiometrik, maka persamaan entalpi reaksinya adalah:
∆𝐻𝑟𝑒𝑎𝑘𝑠𝑖= [𝑐. 𝛥𝐻𝑓𝑜(𝐶) + 𝑑. 𝛥𝐻𝑓𝑜(𝐷)] − [𝑎. 𝛥𝐻𝑓𝑜(𝐴) + 𝐵. 𝛥𝐻𝑓𝑜(𝐵)]
(1.23) Beberapa nilai entalpi pembentukan suatu senyawa dapat dilihat pada Tabel 1.5.
Tabel 1.5. Entalpi pembentukan senyawa
Senyawa 𝜟𝑯𝒇𝒐(kJ/mol) Senyawa 𝜟𝑯𝒇𝒐(kJ/mol)
H2(g) 0 C2H4(g) +52,5
O2(g) 0 CCl4(g) -96,0
C(s) 0 NH3(g) -45,9
H2O(g) -241,8 NO2(g) +33,2
H2O(l) -285,8 SO2(g) -296,8
CO2(g) -393,5 HCl(g) -92,3
CO(g) -110,5 NO(g) +90,3
4.
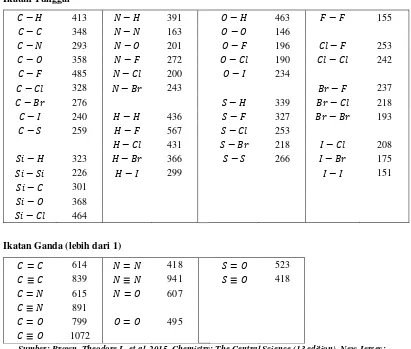
Energi Ikatan
Energi ikatan (𝐷) didefinisikan sebagai energi yang diperlukan untuk memutuskan 1 mol ikatan dari suatu molekul dalam wujud gas. Reaksi kimia antar molekul dapat dianggap berlangsung dalam 2 tahap yaitu pemutusan ikatan pada pereaksi dan pembentukan ikatan pada produk. Sehingga Entalpi reaksi dapat diestimasi dari total energi ikatan dari ikatan yang putus dikurangi total energi ikatan dari ikatan yang terbentuk.
∆𝐻𝑟𝑒𝑎𝑘𝑠𝑖= Σ𝐷(𝑖𝑘𝑎𝑡𝑎𝑛 𝑝𝑢𝑡𝑢𝑠) − Σ𝐷(𝑖𝑘𝑎𝑡𝑎𝑛 𝑡𝑒𝑟𝑏𝑒𝑛𝑡𝑢𝑘) (1.24)
∆𝐻𝑟𝑒𝑎𝑘𝑠𝑖= Σ𝐷(𝑟𝑒𝑎𝑘𝑡𝑎𝑛) − Σ𝐷(𝑝𝑟𝑜𝑑𝑢𝑘) (1.25)
16 Tabel 1.6. Energi ikat antar atom dari berbagai senyawa (kJ/mol)
Ikatan Tunggal
Ikatan Ganda (lebih dari 1)
𝐶 = 𝐶 614 𝑁 = 𝑁 418 𝑆 = 𝑂 523
Sumber: Brown, Theodore L. et al. 2015. Chemistry: The Central Science (13 edition). New Jersey: Pearson Education, Inc.).
F.
KALOR PEMBAKARAN
Reaksi kimia yang umum digunakan untuk menghasilkan energi adalah pembakaran, yaitu suatu reaksi cepat antara bahan bakar dengan oksigen yang disertai terjadinya api. Bahan bakar utama dewasa ini adalah bahan bakar fosil, yaitu gas alam, minyak bumi, dan batu bara. Bahan bakar fosil itu berasal dari pelapukan sisa organisme, baik tumbuhan atau hewan. Pembentukan bahan bakar fosil ini memerlukan waktu ribuan sampai jutaan tahun.
17 beberapa sumber mengandung H2S, suatu kontaminan yang harus disingkirkan sebelum
gas digunakan sebagai bahan bakar karena dapat mencemari udara. Beberapa sumur gas juga mengandung helium.
Minyak bumi adalah cairan yang mengandung ratusan macam senyawa, terutama alkana, dari metana hingga yang memiliki atom karbon mencapai lima puluhan. Dari minyak bumi diperoleh bahan bakar LPG (Liquified Petroleum Gas), bensin, minyak tanah, kerosin, solar dan lain-lain. Pemisahan komponen minyak bumi itu dillakukan dengan distilasi bertingkat. Adapun batu bara adalah bahan bakar padat, yang terutama, terdiri atas hidrokarbon suku tinggi. Batu bara dan minyak bumi juga mengandung senyawa dari oksigen, nitrogen, dan belerang.
Bahan bakar fosil, terutama minyak bumi, telah digunakan dengan laju yang jauh lebih cepat dari pada proses pembentukannya. Oleh karena itu, dalam waktu yang tidak terlalu lama lagi akan segera habis. Untuk menghemat penggunaan minyak bumi dan untuk mempersiapkan bahan bakar pengganti, telah dikembangkan berbagai bahan bakar lain, misalnya gas sintesis (sin-gas) dan hidrogen.
Gas sintetis diperoleh dari gasifikasi batubara. Batu bara merupakan bahan bakar fosil yang paling melimpah, yaitu sekitar 90 % dari cadangan bahan bakar fosil. Akan tetapi penggunaan bahan bakar batubara menimbulkan berbagai masalah, misalnya dapat menimbulkan polusi udara yang lebih hebat daripada bahan bakar apapun. Karena bentuknya yang padat terdapat keterbatasan penggunaannya. Oleh karena itu, para ahli berupaya mengubahnya menjadi gas sehingga penggunaannya lebih luwes dan lebih bersih. Gasifikasi batubara dilakukan dengan mereaksikan batubara panas dengan uap air panas. Hasil proses itu berupa campuran gas CO, H2 dan CH4.
Sedangkan bahan sintetis lain yang juga banyak dipertimbangkan adalah hidrogen. Hidrogen cair bersama-sama dengan oksigen cair telah digunakan pada pesawat ulang-alik sebagai bahan bakar roket pendorongnya. Pembakaran hidrogen sama sekali tidak memberi dampak negatif pada lingkungan karena hasil pembakarannya adalah air. Hidrogen dibuat dari air melalui reaksi endoterm berikut:
𝐻2𝑂(𝑙) → 2𝐻2(𝑔)+ 𝑂2(𝑔) ΔH = 572 kJ (1.26)
18 Tabel 1.7. Komposisi dan nilai kalor dari berbagai jenis bahan bakar
Jenis Bahan Bakar
Komposisi Nilai Kalor
(kJ per gram)
C H O
Gas alam 70 23 0 49
Batu bara (antrasit) 82 1 2 31
Batu bara (bituminos) 77 5 7 32
Minyak mentah 85 12 0 45
Bensin 85 15 0 48
Arang 100 0 0 34
Kayu 50 6 44 18
Hidrogen 0 100 0 142
Nilai kalor bahan bakar digunakan untuk memperkirakan harga energi suatu bahan bakar.
1.
Penentuan Kalor Bahan Bakar
a. Secara Empiris
Metode ini sudah dibahas pada sub bab sebelumnya, untuk perhitungan secara empiris kita dapat menggunakan bom kalorimeter. Suatu hal yang anda ketahui, di dalam dunia industri terutama industri kimia rumus kimia bahan bakar terkadang tidak terlalu diperhatikan karena yang terpenting dari suatu bahan bakar adalah nilai kalornya saja. Sebagai contoh adalah minyak bumi dan batu bara yang digunakan sebagai pembangkit boiler.
b. Rumus Molekul
Dalam ilmu kimia murni, kalor juga dapat dihitung berdasarkan rumus molekul dan ikatan dari hidrokarbonnya. Berikut adalah contoh hidrokarbon sederhana.
CH4(g) + 2O2(g)→ CO2(g) + 2 H2O(l) (1.27)
19 Heating Value) dan LHV (Low Heating Value). Pada dasarnya yang dapat kita manfaatkan hanyalah LHV karena semua hasil pembakaran biasanya berbentuk gas.
c. Asumsi Pembakaran Sempurna
Penentuan kalor bahan bakar juga dapat dilakukan dengan menganggap bahwa proses pembakarannya terjadi secara sempurna, dalam proses ini memerlukan jumlah oksigen yang cukup sehingga jika pembakarannya dianggap ideal maka tidak ada reaktan yang tersisa. Namun pada kenyatannya oksigen yang digunakan dalam proses pembakaran berasal dari alam yang juga mengandung 79% nitrogen maka reaksi yang terjadi adalah:
CH4 + 2O2 + N2→ CO2 + 2H2O + N2 + CO + NOx + heat (1.28)
Jika reaksi mendekati ideal, maka CO dan NOx jumlahnya akan sangat kecil (ppm, part per million). Di sini dibutuhkan jumlah oksigen yang lebih banyak dari kebutuhan standarnya (sesuai dengan persamaan reaksi), bisa sampai 30 % lebih banyak.
Apabila pada jumlah oksigen yang digunakan pada proses pembakaran tidak mencukupi maka jumlah CO yang dihasilkan akan semakin besar. NOx adalah nitrogen yang mengikat O dalam kadar yang bermacam macam. Kedua- duanya baik CO maupun NOx ini merupakan gas beracun.
2.
Pembakaran Sempurna dan Tidak Sempurna
Pembakaran bahan bakar dalam mesin kendaraan atau dalam industri tidak terbakar sempurna. Pembakaran sempurna senyawa hidrokarbon (bahan bakar fosil) membentuk karbon dioksida dan uap air. Sedangkan pembakaran tak sempurna membentuk karbon monoksida dan uap air. Misalnya:
a. Pembakaran sempurna isooktana
𝐶8𝐻18(𝑙)+ 1212𝑂2(𝑔) → 8𝐶𝑂2(𝑔)+ 9𝐻2𝑂(𝑔) ΔH = -5460 kJ (1.29)
b. Pembakaran tak sempurna isooktana
𝐶8𝐻18(𝑙)+ 812𝑂2(𝑔)→ 8𝐶𝑂(𝑔)+ 9𝐻2𝑂(𝑔) ΔH = -2924,4 kJ (1.30)
3.
Dampak Pembakaran Tidak Sempurna
20 karbon monoksida (CO), yang bersifat racun. Oleh karena itu, pembakaran tak sempurna akan mencemari udara.
Gas CO selain berperan dalam pencemaran lingkungan, juga merupakan salah satu zat yang berbahaya bagi tubuh. Kenapa? Karena gas CO lebih mudah terikat oleh hemoglobin dalam tubuh manusia dibandingkan gas O2.
Hemoglobin berfungsi untuk menangkut oksigen dari paru-paru ke seluruh tubuh, sehingga jika hemoglobin banyak mengikat CO, kita akan kekurangan oksigen dan akan berujung sampai pada kematian. Berikut adalah reaksi antara CO dengan Hb:
CO + Hb → HbCO (1.31)
O2+ Hb → HbO2 (1.32)
Daya ikat HbCO ini 200 kali lipat lebih kuat dibandingkan daya ikat HbO2. Di
21
UJI KOMPETENSI
I. SOAL PILIHAN GANDA
Pilihlah dengan memberi tanda silang (X) pada huruf a, b, c, d atau e di jawaban yang tepat!
1. Diketahui reaksi – reaksi sebagai berikut: S(s) + O2(g)→ SO2(g) ΔH = A kkal
2SO2(g) + O2(g)→ 2SO3(g) ΔH = B kkal
Perubahan entalpi (ΔH) untuk reaksi berikut: 2S(s) + 3O2(g)→ 2SO3(g) adalah....
a. (A + B) kkal b. (2A + B) kkal c. (2A - B) kkal d. (A + 2B) kkal e. (2A – 2B) kkal
2. Jika diketahui kalor pembentukan Fe3O4 = 226 kkal dan kalor pembentukan H2O(g) =
58 kkal, maka kalor reduksi 3Fe + 4 H2O(g)→ Fe3O4 + 4 H2 adalah....
a. – 6 kkal b. – 208 kkal c. 324 kkal d. 498 kkal e. 372 kkal
3. Persamaan reaksi 2CO + O2→ 2 CO2 + 136,6 kkal menyatakan bahwa pembakaran 1
mol CO terjadi perubahan entalpi sebesar.... a. 136,6 kkal
b. -136,5 kkal c. -68,3 kkal d. 68,3 kkal e. -52,2 kkal
4. Pada suatu reaksi kimia jika terjadi perpindahan energi dari sistem ke lingkungan, maka energi yang dipindahkan ini berasal dari....
22 d. Perubahan wujud zat
e. Perubahan suhu
5. Jika pada reaksi N2(g) + 2O2(g)→ 2NO2(g) dibutuhkan panas sebesar 16,2 kkal, maka ΔH panas pembentukan NO2 adalah....
a. Zat-zat yang bereaksi b. Zat-zat hasil reaksi c. Gesekan selama reaksi d. Perubahan wujud zat e. Perubahan suhu 6. Dari reaksi berikut ini:
2C2H2(g) + 5O2(g)→ 4CO2(g) + 2H2O(l) ΔH = -674 kkal
Harga perubahan entalpi di atas menunjukkan bahwa....
a. ΔH pembentukan C2H2 dan unsur - unsurnya
b. ΔH pembentukan 1 mol C2H2 secara sempurna
c. ΔH pembentukan CO2 dari reaksi C2H2 dan O2
d. ΔH reaksi 2 mol C2H2 dengan O2
e. ΔH reaksi 1 mol C2H2 dengan O2
7. Untuk menguraikan 17 gram NH3(g) (BM = 17) menjadi unsur-unsurnya diperlukan
energi 11 kkal, maka panas pembentukan NH3(g) adalah....
a. 11 kkal/mol b. 11/17 kkal/mol c. -11 kkal/mol d. 14 kkal/mol e. -14 kkal/mol
8. Kalor lebur yang diperlukan suatu zat pada waktu zat tadi melebur adalah.... a. Menaikkan suhu
b. Mematahkan energi ikatan kisi c. Mengubah padat menjadi wujud gas d. Mempertahankan temperatur tetap e. Semua jawaban benar
9. Dalam suatu proses dimana sistem melakukan kerja sebesar 60 kkal, sistem tersebut mengalami penurunan energi dalam sebesar 30 kkal. Dapat disimpulkan bahwa kalor dari proses tersebut adalah....
23 b. -30 kkal
c. 60 kkal d. -60 kkal e. 75 kkal
10. Pasangan perubahan manakah di bawah ini yang mengakibatkan suatu sistem kimia mengalami reaksi spontan?
24
II. SOAL URAIAN
Jawablah pertanyaan-pertanyaan berikut ini dengan singkat dan jelas!
1. Sepotong besi mempunyai kapasitas kalor 5,5 J/K, hitung panas yang diperlukan untuk memanaskan besi tersebut dari suhu 25°C hingga 55°C!
2. Berapakah jumlah kalor yang dikeluarkan dari 1 kg air panas hingga suhunya turun dari 100°C menjadi 25°C? Diketahui kalor jenis air = 4,18 J/g.K
3. Pada pembentukan 1 gram NaCl dibebaskan kalor 7,024 kJ. Tuliskan persamaan termokimia reaksi pembentukan NaCl beserta jumlah entalpi pembentukannya! (Mr Na = 23; Cl = 35,5)
4. Diketahui:
a) 𝐻2(𝑔)+ 𝐹2(𝑔)→ 2𝐻𝐹(𝑔) ∆𝐻 = −537 𝑘𝐽 b) 𝐶(𝑠)+ 2𝐹2(𝑔) → 𝐶𝐹4(𝑔) ∆𝐻 = −680 𝑘𝐽 c) 2𝐶(𝑠)+ 2𝐻2(𝑔)→ 𝐶2𝐻4(𝑔) ∆𝐻 = 52,3 𝑘𝐽 Tentukan entalpi reaksi berikut:
𝐶2𝐻4(𝑔)+ 6𝐹2(𝑔) → 2𝐶𝐹4(𝑔)+ 4𝐻𝐹(𝑔)
5. Tuliskanlah persamaan termokimia untuk masing masing reaksi berikut:
a) Penguraian 1 mol amonia menjadi gas nitrogen dan gas hidrogen dengan diperlukan kalor 46 kJ!
b) Pembakaran 1 mol gas etana membentuk karbon dioksida dan uap air menghasilkan 142 kJ!
c) Penguraian 1 mol kalsium karbonat (CaCO3) menjadi kalsium oksida dan karbon
25
BAB 2
LAJU REAKSI
PETA KONSEP
Setelah mempelajari bab ini, saudara diharapkan dapat: 1. Menjelaskan pengertian laju reaksi,
2. Memahami konsep laju reaksi, 3. Menjelaskan hukum laju reaksi,
4. Menjelaskan faktor-faktor yang mempengaruhi faktor laju reaksi, 5. Memahami teori tumbukan pada laju reaksi.
6. Menjelaskan aplikasi laju reaksi pada kehidupan sehari-hari.
A.
PENDAHULUAN
Pada kehidupan sehari-hari, sebagian reaksi kimia ada yang berlangsung sangat cepat, dan ada yang berlangsung sangat lambat. Salah satu contohnya adalah reaksi oksidasi kembang api yang berlangsung sesaat dan perkaratan besi di udara yang berlangsung secara bertahap, bahkan selama berbulan-bulan atau bertahun-tahun (Lihat Gambar 2.1). Cepat lambatnya suatu reaksi kimia berlangsung inilah yang disebut laju reaksi.
Laju Reaksi
Konsep Laju
Reaksi
Hukum Laju
Reaksi
Faktor yang
Mempengaruhi
Laju Reaksi
26
Sumber: https://en.wikipedia.org
Gambar 2.1. Reaksi kimia dengan laju reaksi cepat dan lambat
Dalam bab ini akan dibahas konsep laju reaksi, hukum laju reaksi, faktor-faktor apa saja yang mempengaruhi laju reaksi dan teori tumbukan yang menjelaskan bagaimana reaksi terjadi dan bagaimana faktor-faktor tersebut mempengaruhi laju reaksi. Pemahaman faktor-faktor ini memungkinkan kita mengontrol laju dari suatu reaksi kimia dalam kehidupan sehari-hari dan juga di industri. Misalnya, lemari es memperlambat laju perusakan makanan dan katalis yang dapat mempercepat laju proses industri. (Simak Gambar 2.2).
Sumber: http://www.hipwee.com
27
B.
KONSEP LAJU REAKSI
Di dalam suatu reaksi kimia, pereaksi akan bereaksi dan membentuk produk reaksi. Di sini jumlah pereaksi akan berkurang sedangkan jumlah produk reaksinya akan bertambah. Perubahan konsentrasi zat pereaksi atau produk reaksi per satuan waktu dinyatakan sebagai laju reaksi (v).
𝐿𝑎𝑗𝑢 𝑟𝑒𝑎𝑘𝑠𝑖, 𝑣 = Perubahan konsentrasiPeriode waktu reaksi (2.1) Jumlah pereaksi atau produk reaksi umumnya dinyatakan menggunakan kemolaran (molaritas) dengan satuan mol/L dan satuan periode detik, yang memberikan satuan mol 𝐿−1 𝑑𝑒𝑡𝑖𝑘−1 untuk laju reaksi. Namun, perhatikan untuk gas, laju reaksi terkadang dinyatakan sebagai cm3detik−1 atau atm detik−1.
Untuk memahami laju reaksi zat, perhatikan reaksi berikut:
𝑋 → 𝑌 (2.2)
Sewaktu reaksi berlangsung, jumlah pereaksi X berkurang dan jumlah produksi reaksi Y bertambah. Perubahan konsentrasi untuk pereaksi X, ∆[𝑋], akan memiliki nilai negatif. Agar laju reaksi pereaksi X, 𝑣x, memiliki nilai positif, maka 𝑣x didefinisikan sebagai berikut:
𝐿𝑎𝑗𝑢 𝑟𝑒𝑎𝑘𝑠𝑖 𝑝𝑒𝑟𝑒𝑎𝑘𝑠𝑖 𝑋, 𝑣𝑥 = −∆[𝑋]Δ𝑡 (2.3)
Sementara itu, perubahan konsentrasi Y, ∆[𝑌], akan memiliki nilai positif. Jadi, laju reaksi pereaksi Y, 𝑣y didefinisikan sebagai:
𝐿𝑎𝑗𝑢 𝑟𝑒𝑎𝑘𝑠𝑖 𝑝𝑒𝑟𝑒𝑎𝑘𝑠𝑖 𝑌, 𝑣𝑦=∆[𝑌]Δ𝑡 (2.4)
Oleh karena perbandingan koefisien reaksi X dan Y adalah 1 : 1, maka jalur reaksi pereaksi X sama dengan laju reaksi produk reaksi Y:
𝑣𝑥= 𝑣𝑦 (2.5)
Untuk reaksi dengan koefisien reaksi berbeda, laju reaksi zat-zat yang terlibat saling terkait menurut persamaan reaksi setaranya. Pada reaksi berikut:
𝑎𝐴 + 𝑏𝐵 → 𝑝𝑃 + 𝑞𝑄 (2.6)
28
Kemolaran atau molaritas menyatakan konsentrasi zat, yakni jumlah zat dalam volume yang ditempatinya, kemolaran biasanya dinyatakan dalam satuan mol/L atau disingkat M.
𝐾𝑒𝑚𝑜𝑙𝑎𝑟𝑎𝑛, 𝑀 =𝑣𝑜𝑙𝑢𝑚𝑒 𝑦𝑎𝑔𝑛 𝑑𝑖𝑡𝑒𝑚𝑝𝑎𝑡𝑖 𝑧𝑎𝑡 =𝑚𝑜𝑙 𝑧𝑎𝑡 𝑛𝑣 (2.9) dengan: M = kemolaran (mol/L); n = mol zat (mol); V = volume yang ditempati zat (L atau dm3).
Kemolaran zat dapat dinyatakan menggunakan lambang [… ]. Sebagai contoh, [NaCl] menyatakan kemolaran NaCl.
Sumber: https://bottlepy.org/
Gambar 2.3. Petunjuk konsentrasi larutan kimia dalam laboratorium
Perhatikan reaksi peruraian hidrogen iodida (HI) menjadi H2 dan I2 berikut:
2𝐻𝐼(𝑔)→ 𝐻2(𝑔)+ 𝐼2(𝑔) (2.10)
29 dapat dihitung berdasarkan perubahan konsentrasi pada selang waktu ∆𝑡 = 50 detik. Nilai demikian disebut laju reaksi rata-rata.
Tabel 2.1. Hasil pengukuran konsentrasi HI setiap 50 detik.
Waktu (detik) [HI] (mol/L)
Simak perhitungan 𝑣𝐻𝐼pada tiga selang waktu (∆𝑡) pertama. (Simak Tabel 2.2) Tabel 2.2. Laju reaksi 𝑣𝐻𝐼 pada tiga selang waktu pertama
Waktu Laju reaksi, 𝒗𝑯𝑰 disebut laju reaksi sesaat.
𝑣𝐻𝐼 = limΔ𝑡→00Δ[𝐻𝐼]Δ𝑡 (2.11)
30
Sumber: https://id.wiktionary.org/wiki/plot Gambar 2.4. Konsentrasi HI versus waktu.
Laju reaksi pada t = 100 detik 𝑣𝐻𝐼= −(tan 𝜃)
𝑣𝐻𝐼= −(−2,5 × 10−4)𝑚𝑜𝑙 𝐿−1𝑑𝑒𝑡𝑖𝑘−1
𝑣𝐻𝐼= 2,5 × 10−4𝑚𝑜𝑙 𝐿−1𝑑𝑒𝑡𝑖𝑘−1
C.
HUKUM LAJU REAKSI
Pengukuran laju reaksi dari berbagai eksperimen menunjukkan bahwa laju reaksi merupakan fungsi dari konsentrasi pereaksinya. Hal ini dirumuskan sebagai Hukum Laju Reaksi.Untuk reaksi di bawah ini.
𝑎𝐴 + 𝑏𝐵 → 𝑃𝑟𝑜𝑑𝑢𝑘 𝑟𝑒𝑎𝑘𝑠𝑖 (2.12)
Hukum laju reaksi dinyatakan dalam bentuk persamaan laju reaksi sebagai berikut: perlu memiliki nilai yang sama seperti koefisien reaksi a
31 Jumlah orde reaksi m terhadap A, orde reaksi n terhadap konsentrasi B seterusnya disebut orde reaksi keseluruhan.
𝑂𝑟𝑑𝑒 𝑟𝑒𝑎𝑘𝑠𝑖 𝑘𝑒𝑠𝑒𝑙𝑢𝑟𝑢ℎ𝑎𝑛 = ∑(𝑚 + 𝑛 + ⋯ ) (2.14)
Tabel 2.3. Persamaan laju reaksi untuk beberapa reaksi kimia Orde
reaksi Contoh reaksi Laju reaksi
Satuan tetapan laju reaksi (k)
0
Perubahan gas amonia menjadi H2 dan N2 pada permukaan Pt panas
2 Peruraian asam iodida (HI)
32
1.
Menentukan Persamaan Laju Reaksi
Metode laju awal melibatkan pengukuran laju reaksi pada awal reaksi untuk beberapa konsentrasi awal pereaksi. Untuk lebih jelasnya, simak reaksi antara nitrogen oksida (NO) dan klorin Cl2 (T = 27 oC) di bawah ini.
2𝑁𝑂(𝑔)+ 𝐶𝑙2(𝑔)→ 2𝑁𝑂𝐶𝑙(𝑔) (2.15)
Persamaan laju reaksi diberikan oleh: 𝑣 = 𝑘[𝑁𝑂]𝑥[𝐶𝑙
33
Jadi, persamaan laju reaksi di atas dapat ditulis menjadi 𝑣 = 𝑘[𝑁𝑂]2[𝐶𝑙
2]1= 𝑘[𝑁𝑂]2[𝐶𝑙2] (2.19)
2.
Menentukan Konstanta Kecepatan Reaksi
Nilai tetapan laju reaksi k dapat dihitung dari persamaan laju reaksi dan data pada Tabel 2.5. sebagai berikut:
Perhitungan diberikan pada Tabel 2.5.
Tabel 2.5. Perhitungan tetapan laju reaksi, k, dalam v = k[NO]2 [Cl2].
Jadi, persamaan laju reaksinya adalah: v = k[NO]2 [Cl2]
v = (120 mol−2 L2 det−1) [NO]2 [Cl2]
34
D.
FAKTOR
–
FAKTOR YANG MEMPENGARUHI LAJU REAKSI
Ada 4 faktor yang mempengaruhi laju reaksi: konsentrasi pereaksi, luas permukaan sentuh, suhu, dan katalis.
1.
Konsentrasi Pereaksi
Laju reaksi umumnya naik dengan bertambahnya konsentrasi pereaksi. Sebagai contoh, rokok terbakar lebih cepat jika kadar oksigen dinaikkan dari ~21% (dalam udara terbuka) menjadi 100% (dalam wadah tertutup. (Simak Gambar 2.5.). Apa yang dapat Anda simpulkan dari Gambar 2.5.?
Sumber: https://en.wikipedia.org/wiki/Sword Gambar 2.5.(a) Pembakaran rokok di udara terbuka,
(b) Pembakaran rokok dalam wadah berisi O2 murni
2.
Luas Permukaan Sentuh
35
Sumber: https://pixabay.com
Gambar 2.6. Pembakaran potongan kayu balok
Untuk memahami pengaruh luas permukaan sentuh terhadap laju reaksi, lakukan kegiatan berikut.
3.
Suhu
Pengaruh suhu terhadap laju reaksi dapat diamati dalam kehidupan sehari-hari. Sebagai contoh, makanan seperti kentang akan lebih cepat masak jika digoreng dalam minyak panas dibandingkan jika direbus dalam air. Hal ini karena suhu minyak panas lebih tinggi dibandingkan suhu air mendidih. Demikian pula penyimpanan makanan di lemari es dapat memperlambat laju perusakan makanan. Ini berarti laju reaksi dipengaruhi oleh suhu. (Simak Gambar 2.7.).
Sebagian besar reaksi kimia akan berlangsung lebih cepat pada suhu yang lebih tinggi. Para ilmuwan mengamati bahwa laju reaksi banyak yang menjadi sekitar dua kali lipat dengan kenaikan suhu sebesar 10°C. Oleh karena itu, banyak reaksi industri yang berlangsung pada suhu tinggi.
36
Sumber: (a) https://id.wikipedia.org/wiki/Penne (b) www.hipwee.com
Gambar 2.7. (a) Menggoreng kentang dalam minyak panas,
(b) Menyimpan makanan dalam lemari es
4.
Katalis
Katalis adalah suatu zat yang dapat mengubah laju reaksi kimia tanpa mengalami perubahan secara kimiawi di akhir reaksi. Katalis yang mempercepat laju reaksi disebut katalis positif atau lebih umum disebut katalis saja (Lihat Gambar 2.8.). Sedangkan katalis yang memperlambat laju reaksi dikenal sebagai katalis negatif atau sebagai inhibitor.
Sumber: (a) www.pertamina.com, (b) https://id.wikipedia.org
Gambar 2.8. (a) Katalis anorganik pada perengkahan hidrokarbon secara katalitik, (b) Katalis
organik (Enzim) pada pembuatan keju dan margarin.
b
a
37
Tabel 2.6.Katalis dan aplikasinya.
Jenis Katalis Aplikasi
Katalis anorganik V2O5 Untuk produksi asam sulfat (H2SO4) menggunakan proses kontak.
Platina (Pt) Untuk pembuatan asam nitrat Nikel (Ni) Untuk proses hidrogenasi seperti
pada pembuatan margarin dari
Gel Aluminia-Silika Untuk reaksi perengkahan hidrokarbon rantai panjang
Renin Untuk pengolahan susu untuk membuat keju
Enzim dari ragi Untuk industri makanan
Tripsin Untuk pencernaan awal makanan bayi
E.
TEORI TUMBUKAN DARI LAJU REAKSI
Teori tumbukan menggambarkan pertemuan partikel-partikel pereaksi sebagai suatu tumbukan. Tumbukan yang dapat menghasilkan partikel-partikel produk reaksi disebut tumbukan efektif. Ada 2 faktor yang menentukan terjadinya suatu tumbukan efektif, yaitu orientasi atau arah partikel yang bertumbukan dan energi kinetik partikel (atau energi kinetik molekul).
1.
Orientasi atau Arah Partikel yang Bertumbukan
Suatu tumbukan efektif dapat terjadi jika partikel-partikel pereaksi juga mempunyai orientasi yang tepat pada saat bertumbukan. Perhatikan reaksi antara gas nitrogen oksida (NO) dengan ozon (O3) di bawah ini.
38
Sumber: https://pixabay.com
Gambar 2.9. Penggambaran kontak antara partikel-partikel pereaksi
2.
Energi Kinetik Partikel (Energi Kinetik Molekul)
Suatu tumbukan efektif dapat terjadi jika partikel-partikel pereaksi memiliki energi kinetik (𝐸𝑘) yang cukup untuk mengatasi gaya tolak-menolak sewaktu kedua partikel mendekat. Dengan demikian, penetrasi partikel-partikel satu sama lain terjadi sehingga ikatan partikel-partikel pereaksi akan putus sementara ikatan partikel-partikel produk reaksi akan terbentuk. Energi kinetik minimum yang diperlukan partikel untuk menghasilkan tumbukan efektif disebut energi pengaktifan (𝑬𝒂).
39 a. Endoterm
b. Eksoterm
(Sumber: https://mediabelajaronline.blogspot.co.id) Gambar 2.40.Diagram energi potensial untuk reaksi
(a) Endoterm, dan (b) Eksoterm
3.
Konsentrasi Pereaksi
40 (Sumber: http://batalyonchamistr.blogspot.co.id)
Gambar 2.11. Pengaruh konsentrasi pereaksi terhadap laju reaksi
4. Luas Permukaan Sentuh
Pengaruh luas permukaan sentuh terkait dengan mudah tidaknya partikel-partikel pereaksi untuk bertemu. Apabila luas permukaan sentuh bertambah, maka pertikel-partikel dapat lebh mudah bertemu sehingga jumlah tumbukan efektif akan meningkat. Hal ini berarti peningkatan laju reaksi. Dengan cara yang sama, kita juga dapat menjelaskan penurunan laju reaksi apabila luas permukaan sentuh berkurang. (Simak Gambar 2.12). Pada reaksi antara serbuk besi dan HCL lebih cepat karena luas permukaan sentuh serbuk besi lebih besar daripada batang besi.
(Sumber: http://teenagermultimedi.blogspot.co.id/)
Gambar 2.12. Pengaruh luas permukaan sentuh terhadap laju reaksi
5.
Suhu
41 bertumbukan semakin banyak sehingga reaksi semakin cepat berlangsung. Sehingga dapat disimpulkan semakin tinggi suhu laju reaksi semakin besar.
(Sumber: http://kimtikgroup4.blogspot.co.id/)
Gambar 2.13. Pengaruh Kenaikan Suhu terhadap Laju Reaksi
a. Suhu rendah, b. Suhu Tinggi
6.
Katalis
Peran katalis terkait dengan energi pengaktifan reaksi, 𝐸𝑎. Katalis yang digunakan untuk mempercepat reaksi memberikan suatu mekanisme/jalur reaksi alternatif dengan nilaiEa yang lebih rendah (Simak Gambar 2.14.). Dengan 𝐸𝑎 yang lebih rendah, maka lebih banyak partikel yang memiliki energi kinetik yang cukup untuk mengatasi halangan 𝐸𝑎 yang rendah ini. Hal ini menyebabkan jumlah tumbukan efektif akan bertambah, sehingga laju reaksi juga akan meningkat.
42
e. Tidak ada yang benar
2. Pada saat reaksi : 2HI(g) H2(g) + I2(g), jumlah pereaksi HI berkurang sebanyak 0,004 mol setelah 20 detik. Diketahui volume yang di tempat H sebesar 0,5 L. Berapa laju reaksi terhadap H2 dan I2?
3. Dari suatu eksperimen ternyata reaks berikut: A + B C + D diketahui mempunyai persamaan laju reaksi v = k [A]2 [B]. Jika konsentrasi A dan B menjadi dua kali lipat, maka laju reaksinya menjadi .... lebih besar dari laju reaksi awal.
43 a. 2
b. 3 c. 2,5 d. 1 e. 0
5. Di bawah ini adalah faktor-faktor yang mempengaruhi laju reaksi, kecuali.... a. Luas permukaan sentuh
b. Konsentrasi pereaksi c. Orde reaksi
d. Katalis e. Suhu
6. Pernyataan yang benar tentang Teori Tumbukan adalah....
a. Tumbukan antar-partikel pereaksi selalu menghasilkan partikel-partikel produk reaksi.
b. Tumbukan efektif selalu menghasilkan partikel-partikel produk reaksi.
c. Tumbukan efektif hanya terjadi jika partikel-partikel sudah memiliki 𝐸𝑘 cukup. d. Partikel-partikel yang bertumbukan dengan orientasi yang akurat pasti akan
menghasilkan tumbukan efektif
e. Partikel-partikel yang bertumbukan dengan 𝐸𝑘 cukup dan orientasi yang tepat tidak selalu menghasilkan tumbukan efektif.
7. Energi yang dimiliki molekul-molekul untuk bertumbukan disebut.... a. Energi kinetik
b. Energi potensial c. Energi vibrasi d. Energi kisi
e. Energi pengaktifan
8. Katalis dapat mempercepat laju reaksi dengan cara.... a. Menurunkan konsentrasi pereaksi
b. Mengubah nilai perubahan entalpi (∆H) c. Menaikkan energi aktivasi
d. Menaikkan jumlah molekul e. Tidak ada yang benar
44 b. Pereaksi, energi kinetik, produk reaksi
c. Energi aktivasi, pereaksi, produk reaksi d. Produk reaksi, energi aktivasi, pereaksi e. Pereaksi, energi aktivasi, produk reaksi 10. Kc = [N2][H2]
3
/[NH3] 2
Jadi, Kc = 4 x 10 -6
Reaksi penguaraian
2SO3(g) 2SO2(g) + O2(g)
Memiliki kesetimbangan K = 0,025 mol L-1 pada suhu tertentu untuk dapat membatasi penguraian 2 mol L-1SO3sampai 20% saja, pada suhu tersebut perlu
ditambah gas O2 sebanyak....
a. 0,8 mol L-1 b. 0,4 mol L-1 c. 0,2 mol L-1 d. 0,1 mol L-1 e. 0,0625 mol L-1
II. SOAL URAIAN
Jawablah pertanyaan-pertanyaan berikut ini dengan singkat dan jelas!
1. a. Definisikan laju reaksi?
b. Tulis laju pengurangan masing-masing pereaksi X dan laju pembentukan dari produk reaksi untuk reaksi berikut:
5A + B + C 2P
2. Seorang siswa melakukan eksperimen untuk mempelajari laju reaksi antara Zn dan H2SO4 dan mendapatkan data sebagai berikut :
Zn(s)+ H2SO4(aq)ZnSO4(aq) + H2(g)
a. Plot volume gas yang terbentuk sebaga fungsi waktu.
b. Hitung laju reaksi pada t = 20 detik, t = 240 detik dan t = 360 detik. Waktu (detik) Volume gas yang terbentuk
45
3. Seorang siswa mempelajari laju reaksi dari reaksi berikut: 2ICl(g)+ H2(g)I2(g) + 2HCl(g)
Data yang diperolehnya disajikan pada tabel di bawah ini.
Eksperimen Konsentrasi ICl awal (mol L−1) b. Tentukan tetapan laju reaksi.
c. Tuliskan persamaan laju reaksinya. 4. Reaksi peruraian HI:
2HI(g)H2(g) + I2(g)
Memiliki persamaan laju reaksi v = k [HI]2. Jika konsentrasi H sebesar 0,01 mol/L, maka :
a. Hitung laju peruraian pada suhu 500 K diketahu k = 9,5 x 10−9 mol L−1 det−1 b. Berapa nilai laju reaksi jika reaksi berlangsung pada suhu 600K?
5. a. Definisikan laju reaksi?
b. Tulis laju pengurangan masing-masing pereaksi X dan laju pembentukan dari produk reaksi untuk reaksi berikut: