SMA
Kelas X
Direktorat Pembinaan SMK
Kementrian Pendidikan dan Kebudayaan
Republik Indonesia
2016
KIMIA
SMK TEKNOLOGI REKAYASA
Penulis:
Hak Cipta pada Kementerian Pendidikan dan Kebudayaan Dilindungi Undang-Undang
Penulis:
Bayu Triwibowo Catur Rini Widyastuti
2017
Disusun dengan huruf Times New Roman, 12 pt
Milik Negara
Tidak Diperdagangkan
i
KATA PENGANTAR
Undang-Undang Dasar Negara Republik Indonesia Tahun 1945 Pasal 31 ayat (3) mengamanatkan bahwa Pemerintah mengusahakan dan menyelenggarakan satu sistem pendidikan nasional, yang meningkatkan keimanan dan ketakwaan serta akhlak mulia dalam rangka mencerdaskan kehidupan bangsa, yang diatur dengan undang-undang. Atas dasar amanat tersebut telah diterbitkan Undang-Undang Republik Indonesia Nomor 20 Tahun 2003 tentang Sistem Pendidikan Nasional
Implementasi dari undang-undang Sistem Pendidikan Nasional tersebut yang dijabarkan melalui sejumlah peraturan pemerintan, memberikan arahan tentang perlunya disusun dan dilaksanakan delapan standar nasional pendidikan, diantaranya adalah standar sarana dan prasarana. Guna peningkatan kualitas lulusan SMK maka salah satu sarana yang harus dipenuhi oleh Direktorat Pembinaan SMK adalah ketersediaan bahan ajar siswa khususnya bahan ajar Peminatan C1 SMK sebagai sumber belajar yang memuat materi dasar kejuruan
Kurikulum yang digunakan di SMK baik kurikulum 2013 maupun kurikulum KTSP pada dasarnya adalah kurikulum berbasis kompetensi. Di dalamnya dirumuskan secara terpadu kompetensi sikap, pengetahuan dan keterampilan yang harus dikuasai peserta didik serta rumusan proses pembelajaran dan penilaian yang diperlukan oleh peserta didik untuk mencapai kompetensi yang diinginkan. Bahan ajar Siswa Peminatan C1 SMK ini dirancang dengan menggunakan proses pembelajaran yang sesuai untuk mencapai kompetensi yang telah dirumuskan dan diukur dengan proses penilaian yang sesuai.
ii merupakan edisi ke-1. Oleh sebab itu Bahan Ajar ini perlu terus menerus dilakukan perbaikan dan penyempurnaan.
Kritik, saran, dan masukan untuk perbaikan dan penyempurnaan pada edisi berikutnya sangat kami harapkan; sekaligus, akan terus memperkaya kualitas penyajian bahan ajar ini.Atas kontribusi itu, kami ucapkan terima kasih. Tak lupa kami mengucapkan terima kasih kepada kontributor naskah, editor isi, dan editor bahasa atas kerjasamanya. Mudah-mudahan, kita dapat memberikan yang terbaik bagi kemajuan dunia pendidikan menengah kejuruan dalam rangka mempersiapkan Generasi Emas seratus tahun Indonesia Merdeka (2045).
iii
DAFTAR ISI
Kata Pengantar ... Error! Bookmark not defined.
Daftar Isi ... iiii
Daftar Gambar ... iv
Daftar Tabel ... ivi
Pendahuluan ... ivii
BAB 1 KONSEP MOL DAN HUKUM–HUKUM DASAR KIMIA DALAM PERHITUNGAN ... 1
A. Massa Molekul Relatif ... Error! Bookmark not defined. B. Persamaan Reaksi ... Error! Bookmark not defined. C. Hukum Dasar Kimia ... 9
D. Rumus Empiris dan Rumus Molekul ... 18
E. Senyawa Hidrat (Air Kristal) ... 20
F. Konsep Mol ... 22
G. Konsentrasi Larutan ... 26
H. Perhitungan Kimia ... 28
MENGENAL PARA TOKOH PENEMU HUKUM DASAR KIMIA ... 31
UJI KOMPETENSI ... 36
BAB 2 ELEKTROKIMIA ... 44
A. Sel Volta ... 45
B. Elektrolisis ... 62
C. Korosi ... 68
MENGENAL PARA TOKOH PENEMU HUKUM DASAR KIMIA ... 77
UJI KOMPETENSI ... 91
BAB 3 KONSEP REAKSI KIMIA ... 99
A. Asam dan Basa ... 989
B. Reaksi Reduksi dan Reaksi Oksidasi ... 13836
UJI KOMPETENSI ... 143
DAFTAR PUSTAKA ... 14950
GLOSARIUM ... 150
iv
DAFTAR GAMBAR
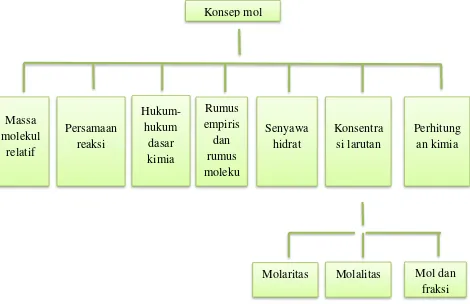
Gambar 1.1. Peta konsep ... 2
Gambar 1.2. Penimbangan dalam pengukuran massa atom ... 2
Gambar 1.3. Proses fotosintesis tumbuhan ... 8
Gambar 1.4. Antoine Laurent Lavoisier ... 10
Gambar 1.5. Percobaan Lavoisier ... 11
Gambar 1.6. Joseph Louis Proust... 11
Gambar 1.7. Dalton ... 14
Gambar 1.8. Gay Lussac ... 16
Gambar 1.9. Skema hubungan antara jumlah mol dengan jumlah partikel ... 23
Gambar 1.10. Antoine Laurent Lavoisier ... 31
Gambar 1.11. Lorenzo Romano Amedeo Carlo Avogadro ... 34
Gambar 2.1. Peta konsep ... 44
Gambar 2.2. Rangkaian Sel Galvani atau Sel Volta ... 46
Gambar 2.3. Sel galvani atau sel volta antara Zn dan Larutan CuSO4 ... 47
Gambar 2.4. Susunan baterai kering ... 57
Gambar 2.5. Susunan baterai alkalin ... 58
Gambar 2.6. Susunan baterai kancing ... 58
Gambar 2.7. Korosi pada pagar ... 68
Gambar 2.8. Proses korosi pada material logam ... 69
Gambar 2.9. Korosi permukaan ... 71
Gambar 2.10. Korosi Galvanis ... 71
Gambar 2.11. Korosi Tegangan ... 72
Gambar 2.12. Korosi celah ... 72
Gambar 2.13. Korosi sumuran ... 73
Gambar 2.14. Korosi erosi ... 74
Gambar 2.15. Korosi pelarutan selektif ... 74
Gambar 2.16. Korosi antar batas butir... 76
Gambar 2.17. Svente Arrhennius ... 77
Gambar 2.18. Laboratorium Arrhenius ... 78
Gambar 2.19. Johannes Nicolaus Brønsted ... 81
v
Gambar 2.21. Thomas Martin Lowry ... 84
Gambar 2.22. Gilbert Newton Lewis ... 87
Gambar 3.1. Peta konsep ... 99
Gambar 3.2. Bahan Makanan yang Mengandung Asam ... 100
Gambar 3.3. Produk Bersifat Basa dalam Kehidupan Sehari-hari ... 101
Gambar 3.4. Garam ... 101
Gambar 3.5. Teori Asam Lewis ... 105
Gambar 3.6. Teori Asam Basa Lewis ... 106
Gambar 3.7. Asam Anorganik dan Asam Organik ... 108
Gambar 3.8. Kertas Lakmus ... 115
Gambar 3.9. Identifikasi Kertas Lakmus ... 115
Gambar 3.10. Sumber Indikator Alami ... 116
Gambar 3.11. Indikator pH Kertas ... 117
Gambar 3.12. Skala pH Berdasarkan Warna ... 117
Gambar 3.13. Warna Larutan Indikator pH ... 118
Gambar 3.14. Indikator PP berwarna pink saat basa dan tak berwarna saat asam ... 118
Gambar 3.15. pH Meter ... 119
Gambar 3.16. Skala Kesetimbangan Asam Basa ... 123
Gambar 3.17. Metode Titrasi ... 126
Gambar 3.18. Titik Ekuivalen Titrasi ... 127
Gambar 3.19. Kurva titrasi asam kuat (titrat) dengan basa kuat (titran) ... 128
Gambar 3.20. Kurva titrasi asam lemah dengan basa kuat ... 129
Gambar 3.21. Kurva titrasi asam kuat dengan basa lemah ... 130
Gambar 3.22. Kurva titrasi asam lemah dengan basa lemah ... 130
Gambar 3.23. Penerapan asam basa dalam bidang pertanian ... 135
vi
DAFTAR TABEL
Tabel 1.1 Hasil Penelitian Proust ... 12
Tabel 1.2 Perbandingan Nitrogen dan Oksigen dalam Senyawanya ... 15
Tabel 1.3.Data penelitian Gay Lussac ... 16
Tabel 1.4 Beberapa Data Hasil Percobaan Volume Gas Yang Bereaksi ... 16
Tabel 1.5 Beberapa Contoh Senyawa Hidrat ... 21
Tabel 1.6 Massa Molar Beberapa Zat ... 22
Tabel 2.1 Deret volta ... 50
Tabel 2.2 Nilai Potensial Standar Elektroda ... 53
Tabel 3.1 Senyawa Asam Lemah dan Asam Kuat ... 109
Tabel 3.2 Senyawa Basa Lemah dan Basa Kuat ... 111
Tabel 3.3 Hasil Pengamatan Beberapa Indikator Asam Basa Alami ... 116
vii
PENDAHULUAN
A.
Deskripsi
Buku Kimia untuk SMK Teknologi dan Rekayasa Kelas X terdiri dari dua modul, yaitu modul 1 untuk semester 1 dan modul 2 untuk semester 2. Modul ini merupakan modul 2, yang akan mempelajari konsep-konsep dasar ilmu kimia, meliputi Reaksi Oksidasi Reduksi; Hukum Dasar Ilmu Kimia dan Hitungan Kimia; serta Elektrokimia.
B. Prasyarat
Untuk mempelajari modul ini tidak diperlukan prasyarat mata pelajaran tertentu.
C. Petunjuk Penggunaan Modul
• Pelajari daftar isi serta peta konsep tiap materi dengan cermat dan teliti, untuk mengetahui kedudukan tiap konsep.
• Perhatikan langkah-langkah dalam melakukan pekerjaan dengan benar untuk mempermudah dalam memahami suatu proses pekerjaan, sehingga diperoleh hasil yang maksimal.
• Pahami setiap materi teori dasar yang akan menunjang penguasaan suatu pekerjaan dengan membaca secara teliti. Apabila terdapat evaluasi, maka kerjakan evaluasi tersebut sebagai sarana latihan.
• Jawablah tes formatif dengan jawaban yang singkat dan jelas serta kerjakan sesuai dengan kemampuan Anda setelah mempelajari modul ini.
• Bila terdapat penugasan, kerjakan tugas tersebut dengan baik dan jika perlu konsultasikan hasil tersebut pada guru atau instruktur.
• Catatlah kesulitan yang Anda dapatkan dalam modul ini untuk ditanyakan pada guru pada saat kegiatan tatap muka. Bacalah referensi yang lain yang berhubungan dengan materi modul agar Anda mendapatkan pengetahuan tambahan.
D. Tujuan Akhir
Setelah mempelajari modul ini diharapkan anda dapat: 1. Menjelaskan tentang konsep Reaksi Oksidasi Reduksi
1
BAB 1
KONSEP MOL DAN HUKUM
–
HUKUM DASAR KIMIA
DALAM PERHITUNGAN
Gambar 1.1. Peta konsep konsep mol dan hukum-hukum dasar kimia dalam perhitungan
Setelah mempelajari bab 1 ini, saudara diharapkan dapat menjelaskan tentang massa molekul relatif, persamaan reaksi umum, persenyawaan hidrat, perhitungan konsep larutan hingga hukum-hukum dasar kimia yang mendasari materi itu semua.
A.
MASSA RELATIF
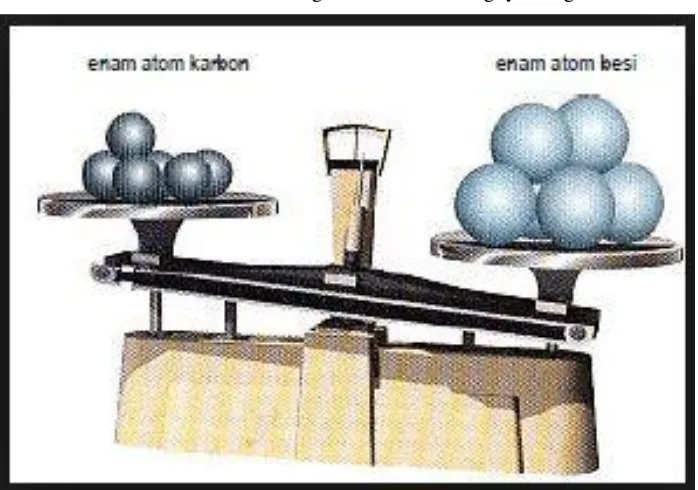
Pada awal Abad-20 telah ditemukan peralatan yang sangat peka. Hal tersebut menyebabkan para ahli kimia melakukan percobaan tentang massa satu atom. Berdasarkan percobaan, dihasilkan hasil pengukuran untuk:
2 Dari data tersebut dapat dilihat bahwa massa satu atom sangatlah kecil. Para ilmuwan sepakat menggunakan besaran Satuan Mass (sma) atau Atomic Massa Unit (amu) atau biasanya disebut juga satuan Dalton. Ukuran atom kecil sekali sehingga tidak memungkinkan menentukan massa atom dengan cara menimbangnya dengan neraca.
Sumber: http://chemistryeducenter.blogspot.co.id
Gambar 1.2. Penimbangan dalam pengukuran massa atom
Para Ilmuwan atau yang ahli di bidang kimia menggunakan isotope karbon C-12 sebagai standar dengan massa atom relative sebesar 12. Massa atom relatif tersebut menyatakan perbandingan massa rata–rata satu atom suatu unsur terhadap 1/12 massa atom C-12. Pernyataan tersebut dapat dituliskan sebagai berikut:
1 satuan massa atom (amu)= 1/12 massa 1 atom C-12
Contoh soal 1:
Massa atom rata–rata oksigen sebesar 1,33 kali massa atom karbon C-12. Maka massa atom relative dari oksigen adalah...
Jawab:
3 Para ilmuwan membandingkan massa atom yang berbeda–beda dengan menggunakan skala massa atom relatif dengan “Ar”.
Para ahli membuat kesepakatan untuk menggunakan C-12 atau isotope 12C sebagai standar karena mempunyai kestabilan inti yang inert dibanding dengan atom lainnya. Massa atom relatif suatu unsur (Ar) merupakan bilangan yang menyatakan perbandingan massa satu atom tersebut dengan 1/12 massa satu atom C-12.
Apabila pernyataan tersebut dituliskan dalam persamaan yaitu sebagai berikut: ArX= 1massa atom rata-rata X
12 massa atom karbon-12
Contoh soal 2:
Apabila diketahui massa 1 atom oksigen 2,7 x 10-23 gram, Ar atom O apabila massa atom C=1,99 x 10-23gram adalah…
Jawab:
Ar atom O = 1 massa 1 atom O
12massa 1 atom karbon C-12
= 12,7 x 10-23 12x 1,99 x 10-23 =16,283
Besarnya harga Ar juga ditentukan oleh harga rata–rata isotop tersebut. Sebagai contoh, di dalam terdapat 35Cl dan 37Cl dengan perbandingan 75% dan 25% maka Ar Cl dapat dihitung dengan cara:
Ar Cl = (75% x 35) + (25% x 37) = 35,5
Ar merupakan angka perbandingan sehingga tidak mempunyai satuan.
Molekul merupakan gabungan dari beberapa unsur dengan perbandingan tertentu. Unsur–unsur yang sama bergabung membentuk molekul unsur, sedangkan unsur–unsur yang berbeda membentuk molekul senyawa. Massa molekul relative adalah perbandingan massa molekul (Mr). Massa molekul relatif adalah perbandingan massa molekul unsur atau senyawa terhadap 1/12 x massa atom C-12. Secara matematis dapa dinyatakan menjadi:
4 Mr (senyawa)= 1massa molekul senyawa
12 x massa atom karbon-12
Massa molekul dapat dihitung dengan menjumlahkan Ar dari atom-atom pembentuk molekul tersebut.
Mr=∑Aratom penyusun
Contoh:
Mr H2O = (2 x Ar H) + (1 x Ar O) = (2 x 1) + (1 x 16) = 18
Mr (NH4)2SO4 = (2 x Ar N) +(8 x Ar H) + (1 x Ar S) + (4 x Ar O) = (2 x 14) + (8 x 1) + (1 x 32) + (4 x 16) = 28 + 8 + 32 + 64
= 132
SOAL LATIHAN
Hitunglah massa molekul relatif senyawa- senyawa berikut:
1. SO3 6. Na2CO3
2. CO2 7. Ca3(PO4)2 3. NH3 8. CaC2O4
4. CH4 9. urea
5. Fe2O3 10. Amonium Nitrat
B.
PERSAMAAN REAKSI
Persamaan reaksi menggambarkan suatu reaksi kimia yang terdiri atas rumus kimia pereaksi (reaktan) dan hasil reaksi (produk) disertai koefisiennya masing – masing.Persamaan reaksi yang sempurna disebut juga persamaan reaksi yang telah setara.Syarat – syarat suatu persamaan reaksi yang setara adalah sebagai berikut. 1. Jenis unsur–unsur sebelum dan sesudah reaksi selalu sama.
5 3. Perbandingan koefisien reaksi menyatakan perbandingan mol (khusus yang berwujud gas perbandingan koefisien juga menyatakan perbandingan volume asalkan suhu dan tekanannya sama).
4. Pereaksi (reaktan) dan hasil reaksi (produk) dinyatakan dengan rumus kimia yang benar. Pada reaksi kimia atau perubahan kimia, zat-zat yang mengalami perubahan disebut zat pereaksi (reaktan) dan zat-zat hasil perubahan disebut hasil reaksi (produk).
xA + yB → zC
(zat ruas kiri) (zat ruas kanan)
(reaktan) (produk)
(pereaksi) (hasil reaksi)
Keterangan: x, y z adalah koefisien reaksi.
Wujud zat–zat yang terlibat reaksi harus dinyatakan dalam tanda kurung setelah rumus kimia.
Dalam rangka penyetaraan persamaan reaksi kita diperbolehkan mengubah jumlah rumus kimia (jumlah molekul atau satuan rumus) tetapi tidak boleh mengubah rumus kimia zat–zat yang terlibat persamaan reaksi.Jumlah satuan rumus kimia disebut koefisien.Selain menggambarkan rumus kimia, persamaan reaksi yang sempurna juga menunjukkan wujud zat yang terlibat dalam reaks. Wujud zat dalam persamaan reaksi disingkat dengan:
(s) : solid (zat padat) (l) : liquid (zat cair)
(aq) : aqueous (larutan dalam air) (g) : gas
Contoh:
Ca(s) + 2H2O (l) →Ca(OH)2(aq) + H2(g)
Dibaca: unsur kalsium dalam bentuk padat bereaksi dengan dua buah molekul air dalam bentuk cair menghasilkan kalsium hidroksida (zat terlarut dalam air) dan hidrogen dalam bentuk gas.
Persamaan reaksi disetarakan terlebih dahulu agar disebut persamaan reaksi yang sempurna. Beberapa syarat disebut persamaan reaksi setara adalah:
6 2. Memenuhi hukum kekekalan massa yang ditunjukkan oleh jumlah atom-atom sebelum reaksi (di sebelah kiri tanda panah) harus sama dengan jumlah atom-atom sesudah reaksi (di sebelah kanan tanda panah)
3. Wujud zat-zat yang terlibat reaksi harus dinyatakan dalam tanda kurung setelah rumus.
Contoh soal 3:
Setarakan persamaan reaksi berikut. a. N2 (g) + H2 (g) → NH3 (g)
b. C2H6 (g) + O2 (g)→ CO2 (g) + H2O (l)
Jawab:
a. N2 (g) + H2 (g) → NH3 (g)
Dapat dilihat bahwa persamaan reaksi tersebut belum setara
➢ Unsur atom N diruas kiri terdapat 2 atom, di ruas kanan terdapat 1 atom N
➢ Unsur atom H diruas kiri terdapat 2 atom, di ruas kanan terdapat 3 atom H Agar persamaan reaksi tersebut menjadi setara, maka:
➢ Tuliskan angka 2 (sebagai koefisien reaksi) di depan NH3
➢ Tuliskan angka 3 (sebagai koefisien reaksi) di depan H2 Persamaan reaksi akan menjadi:
N2 (g) + 3 H2 (g) → 2 NH3 (g) b. C2H6 (g) + O2 (g)→ CO2 (g) + H2O (l)
Dapat dilihat bahwa persamaan reaksi tersebut belum setara
➢ Unsur atom C diruas kiri terdapat 2 atom, di ruas kanan terdapat 1 atom C
➢ Unsur atom H diruas kiri terdapat 6 atom, di ruas kanan terdapat 2 atom H
➢ Untuk atom O diruas kiri terdapat 2 atom, di ruas kanan terdapat 3 atom C Agar persamaan reaksi tersebut menjadi setara, maka:
➢ Tuliskan angka 2 (sebagai koefisien reaksi) di depan CO2
➢ Tuliskan angka 3 (sebagai koefisien reaksi) di depan H2O
➢ Tuliskan angka 7/2 (sebagai koefisien reaksi) di depan O2 Persamaan reaksi akan menjadi:
C2H6 (g) + 7/2 O2 (g)→ 2 CO2 (g) + 3 H2O (l)
Agar koefisien tersebut berupa bilang bulat maka seluruh koefisien dikalikan 2, persamaan reaksi menjadi:
7
SOAL LATIHAN
1. Setarakan persamaan reaksi berikut! a. C3H4 + O2→ CO2 + H2O b. Fe2O3 + HBr → FeBr3 + H2O c. Al + HCl → AlCl3 + H2 d. Zn + H2SO4→ ZnSO4 + H2
e. I2+ NaOH → NaI + NaIO3 + H2O 2. Setarakan reaksi berikut!
a. Na (s) + H2O(l) NaOH (aq) + H2 (g)
b. Ba(OH)2 (aq) + P2O5 (s) Ba3(PO4)2(s) + H2O (l)
c. Zn (s) + HNO3 (aq) Zn(NO3)2 (aq) + NH4NO3 (s) + H2O(l)
d. CH4(g) + O2(g) CO2(g) + H2O (g)
8
PENGETAHUAN UMUM
PERSAMAAN REAKSI DALAM ILMU BIOLOGI
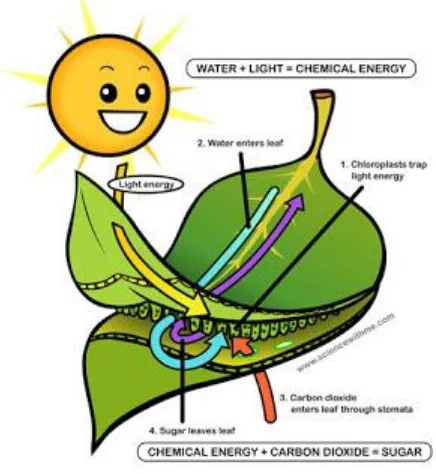
Reaksi Dan Proses Fotosintesis Pada Tumbuhan
Sumber: www.gudangbiologi.com
Gambar 1.3. Proses fotosintesis pada tumbuhan
Fotosintesis merupakan kata yang berasal dari bahasa Yunani, yakni foto dan synthesis. Foto sendiri diartikan sebagai cahaya sedangkan synthesis merupakan kata yang bermakna menggabungkan atau penggabungan. Kata fotosintesis sering digunakan dala lingkup kajian ilmu biologi. Apa sebenarnya fotosintesis tersebut? Secara sederhana, ia bisa diartikan sebagai proses pembuatan makanan yang dilakukan oleh tumbuhan berwarna hijau dengan melibatkan cahaya matahari di dalamnya. Selain matahari, proses fotosintesis ini juga melibatkan beberapa enzim. Proses fotosintesis ini biasa dilakukan oleh tumbuh-tumbuhan, beberapa jenis alga dan juga bakteri dalam rangka menghasilkan energi yang akan digunakan dalam berbagai aktifitas. Energi tersebut biasa juga disebut dengan nutrisi.
9 bumi ini sebagian besar diproduksi oleh tumbuhan. Hal inilah yang menjadikan pepohonan sering dijuluki paru-paru planet bumi. Organisme yang melakukan proses fotosintesis dikenal dengan nama fototrof. Fotosintesis sebenarnya merupakan salah satu cara asimilasi karbon sebab pada proses fotosintesis, karbon bebas kemudian diikat sehingga menjadi gula.
Proses fotosintesis pada terdapat pada tumbuhan hijau yang bersifat autotrof yakni bisa menyusun makanannya sendiri. Melalui daun, tumbuhan menyerap molekul karbondioksida juga air dalam rangka menghasilkan gula dan juga oksigen. Kedua senyawa tersebut kemudian akan digunakan sebagai penyokong pertumbuhannnya. Adapun persamaan rekaksi yang terjadi dalam proses fotosintesis adalah sebagai berikut:
6H2O + 6CO2 + cahaya → C6H12O6 (glukosa) + 6O2
Tumbuhan yang melakukan proses fotosintesis memerlukan bantuan cahaya matahari. Mereka mampu menyerap cahaya tersebut sebab mereka memiliki zat hijau daun atau klorofil. Klorofil ini sendiri ada di dalam bagian organel bernama kloroplast. Pada bagian daun tumbuhan, terdapat dua lapisan sel yang dinamai denegan mesofil. pada bagian ini terdapat kurang lebih setengah juta kloroplast yang tersebar di setiap millimeter persegi. Cahaya matahari selanjutnya akan melewati lapisan epidermis yang tanpa warna kemudian melaju menuju mesofil. Pada bagian inilah sebagian besar kegiatan fotosintesis berlangsung.
C.
HUKUM DASAR KIMIA
Terdapat empat hukum dasar kimia yang dipakai dalam perhitungan kimia. Keempat hukum dasar tersebut adalah sebagai berikut:
1. Hukum Kekekalan Massa. 2. Hukum Perbandingan Tetap. 3. Hukum Perbandingan Berganda. 4. Hukum Perbandingan Volume.
10
1.
Hukum Kekekalan Massa (Hukum Lavoisier)
Sumber: id.wikipedia.org Gambar 1.4.Antoine laurent lavoisier
Hukum kekekalan massa ini ditemukan oleh Antoine Laurent Lavoisier (1743-1794). Lavoisier adalah seorang ahli kimia yang berkebangsaan Inggris. Dia menyelidiki hubungan massa zat sebelum dan setelah reaksi. Lavoisier melakukan penelItiannya dengan cara menimbang zat-zat sebelum bereaksi kemudian menimbang hasil-hasil reaksi tersebut. Penelitiannya ternyata menghasilkan massa zat sebelum dan setelah bereaksi selalu sama.
Sumber: id.wikipedia.org Gambar 1.5. Percobaan lavoisier
11 dipanaskan kembali, senyawa tersebut akan terurai menghasilkan sejumlah cairan merkuri dan gas oksigen dengan jumlah yang sama seperti semula.
Pada reaksi kimia biasanya disertai perubahan–perubahan materi yang umumnya berlangsung dalam sistem terbuka. Pada sistem terbuka tersebut, ada hasil reaksi yang meninggalkan sistem (misalnya pada pembakaran kertas) atau pada proses yang masuk ke dalam sistem (misalnya pada proses fermentasi aerob yang memerlukan oksigen dari luar sistem). Hal tersebut menyebabkan seakan–akan massa zat sebelum dan setelah reaksi menjadi tidak sama. Lavoisier melakukan penelitian yang membuktikan bahwa massa sebelum dan setelah reaksi adalah sama.
Kesimpulan penelitian Lavoisier menghasilkan hukum yang dikenal dengan “Hukum Kekekalan Massa”. Hukum tersebut berbunyi:
“Dalam reaksi kimia, massa zat –zat sebelum dan sesudah reaksi adalah sama”
Contoh:
Hidrogen + Oksigen → air
(8g) (64 g) (72 g)
2.
Hukum Perbandingan Tetap (Hukum Proust)
Sumber: id.wikipedia.org
Gambar 1.6. Joseph louis proust
12 senyawa, seorang ahli kimia Perancis yang bernama Joseph Louis Proust (1754–1826) melakukan penelitian yaitu mencoba menggabungkan hidrogen dan oksigen untuk membentuk senyawa air. Hasil dari penelitian Proust dapat dilihat pada Tabel 1.1.
Tabel 1.1. Hasil Penelitian Proust
Massa Hidrogen hidrogen bereaksi dengan 8 gram oksigen menghasilkan 9 gram senyawa air. Hal tersebut membuktikan bahwa massa hidrogen dan oksigen yang terkandung dalam senyawa air memiliki perbandingan yang tetap yaitu 1:8. Perbandingan tersebut berlaku untuk berapapun banyaknya air yang terbentuk. Berdasarkan penelitian yang dilakukan oleh Proust, terbentuklah suatu teorinya yang sering dikenal dengan sebutan “Hukum Perbandingan Tetap”. Hukum tersebut berbunyi:
“Perbandingan massa unsur–unsur penyusun suatu senyawa selalu tetap”
Contoh soal 4:
Apabila Kun mereaksikan 8 gram hidrogen dengan 80 gram oksigen, berapa massa air yang terbentuk?
Jawab:
Perbandingan massa hidrogen dengan oksigen= 1:8.
Perbandingan massa hidrogen dengan oksigen yang dicampurkan= 8:80
Perbandingan massahidrogen dan oksigen adalah selalu tetap, sehingga untuk 8 gram hidrogen yang bereaksi memerlukan oksigen sebanyak 8 x 8 gram oksigen= 64 gram oksigen.
Pada soal ini oksigen yang dicampurkan tidak bereaksi sempurna karena masih terdapat sisa oksigen sebanyak (80–64) gram= 16 gram. Setelah mengetahui massa oksigen dan hidrogen yang bereaksi maka kita bisa menghitung massa air yang terbentuk dari 8 gram hidrogen dan 64 gram oksigen yaitu sebanyak 72 gram air dengan sisa oksigen sebanyak 16 gram.
13
H2 + O2 → H2O
perbandingan massa 1 8 9
awal reaksi 8 80 -
yang bereaksi 8 64 72
yang tersisa - 16 72
Hukum Proust dapat dijabarkan lagi untuk menentukan kadar unsur atau massa unsur dalam senyawa yang terbentuk. Penjabaran tersebut adalah sebagai berikut:
Bentuk umum senyawa AxBy dapat dijabarkan menjadi: % A dalam senyawa AxBy =Mr AxBy . %AxByx . ArA
Massa B dalam senyawa AxBy =Mr AxBy . massa AxByn . ArB
Dari persamaan di atas dapat diturunkan kadar zat dalam campuran, cuplikan, atau mineral, atau bijih, yaitu sebagai berikut:
% zat dalam campuran= Banyaknya zat tersebutBanyaknya campuran x 100%
Contoh soal 5:
Berapa kadar Ca dalam 100 gram CaCO3? (Ar: C= 12, O= 16, Ca= 40)
Jawab:
Massa Ca = (Ar Ca/Mr CaCO3) x massa CaCO3 = 40/100 x 100 gram
= 40 gram
Kadar Ca = massa Ca/Massa CaCO3 x 100% = 40/100 x 100%
= 40%
Berdasarkan uraian di atas dapat disimpulkan mengenai sifat–sifat suatu senyawa yaitu sebagai berikut:
1. Tergolong zat tunggal 2. Homogen
3. Dapat diuraikan menjadi dua jenis zat atau lebih dengan cara kimia 4. Terdiri atas dua jenis atau lebih unsur dengan perbandingan tertentu.
14
3.
Hukum Perbandingan Berganda (Hukum Dalton)
Sumber: id.wikipedia.org Gambar 1.7. Dalton
Dalam senyawa kimia, rumus kimia menunjukkan komposisi kimianya. Dalam suatu senyawa misalnya gula, tiga unsur bergabung dan masing-masing menyumbangkan atom tertentu untuk membentuk suatu senyawa. Pada senyawa air terdapat dua unsur pembentuk senyawa yaitu unsur hidrogen dan oksigen. Unsur yang sama dapat membentuk senyawa yang berbeda–beda, misalnya unsur belerang dan oksigen dapat membentuk senyawa SO3 dan SO4. Contoh lainnya misalnya unsur hidrogen dan oksigen dapat membentuk senyawa H2O dan H2O2.
Seorang ahli fisika dan kimia serta guru sekolah dari Inggris yang bernama Dalton menyelidiki perbandingan unsur–unsur pembentuk senyawa pada setiap senyawa dan mendapatkan suatu pola keteraturan. Pola tersebut dinamakan sebagai hukum perbandingan berganda. Hukum tersebut berbunyi:
“Apabila suatu unsur dapat membentuk lebih dari satu senyawa, massa salah satu unsur tersebut tetap (sama), maka perbandingan massa unsur yang lain dalam
senyawa–senyawa tersebut merupakan bilangan bulat dan sederhana”.
Contoh:
15
Tabel 1.2. Perbandingan Nitrogen dan Oksigen dalam senyawanya
Senyawa Massa Nitrogen
(g)
Massa Oksigen (g)
Perbandingan
N2O 56 32 7:4
NO 28 32 7:8
N2O3 56 96 7:12
N2O4 56 128 7:16
Dari Tabel 1.2. dapat dilihat bahwa massa unsur N dibuat tetap atau sama sebanyak 7 gram maka perbandingan massa oksigen dalam masing–masing senyawa N2O, NO, N2O3, dan N2O4 secara berurutan adalah 4:8:12:16 atau 1:2:3:4.
4.
Hukum Perbandingan Volume (Gay Lussac)
Sumber: id.wikipedia.org
Gambar 1.8. Gay lussac
16 Data penelitian yang dilakukan oleh Gay Lussac dapat dilihat pada tabel 1.3.
Tabel 1.3. Data penelitian Gay Lussac
Percobaan ke- Volume gas
Gay Lussac mengatakan bahwa 2 volume gas hidrogen bereaksi dengan 1 volume gas oksigen membentuk 2 volume uap air. Pada reaksi pembentukan uap air tersebut, agar reaksi sempurna, maka untuk setiap 2 volume gas hidrogen diperlukan 1 volume gas oksigen, menghasilkan 2 volume uap air.
“Semua gas yang direaksikan dengan hasil reaksi, diukur pada suhu dan tekanan yang sama atau (T,P) sama”
Bunyi dari hukum Gay Lussac adalah sebagai berikut: 𝑽𝟏 tersebut memenuhi hukum perbandingan volume Gay Lussac. Data percobaan tersebut adalah sebagai berikut.
Tabel 1.4. Beberapa Data Hasil Percobaan Volume Gas Yang Bereaksi
17
Berdasarkan data percobaan yang terdapat dalam Tabel 1.4.,
perbandingan volume gas yang bereaksi dan hasil reaksi, berbanding sebagai
bilangan bulat. Data percobaan yang terdapat dalam tabel tersebut sesuai
dengan hukum perbandingan volume atau sering dikenal dengan hukum Gay
Lussac. Bunyi dari hukum tersebut adalah sebagai berikut.
“
Pada suhu dan tekanan yang sama perbandingan volume gas
–
gas yang
bereaksi dan hasil reaksi be
rbanding sebagai bilangan bulat”.
SOAL LATIHAN
Unsur besi dan belerang dapat membentuk dua jenis senyawa yaitu FeS dan Fe2S3. Ambillah sebanyak 112 gram serbuk besi dan 64 gram belerang, kemudian reaksikan kedua unsur tersebut. Kemudian ambillah 224 gram serbuk besi dan 192 gram belerang, kemudian reaksikanlah. Setelah itu tuliskan hasil pengamatan dari reaksi tersebut ke dalam tabel berikut ini:
Pertanyaan: berapakah perbandingan antara belerang dalam FeS dan Fe2S3? Berdasarkan tabel tersebut, kesimpulan apakah yang dapat diambil?
Coba lakukan pada senyawa lain (misalnya pada H2O dan H2O2) & dikerjakan secara berkelompok dan diskusikan!
D.
RUMUS EMPIRIS DAN RUMUS MOLEKUL
Perbandingan massa dan kadar dalam suatu senyawa dapat ditentukan dari molekulnya. Persamaannya yaitu sebagai berikut:
Kadar unsur= jumlah atom xArunsur
18
Penentuan Rumus Empiris dan Rumus Molekul
➢ Rumus kimia menunjukkan jenis atom unsur dan jumlah relatif masing–masing
unsur yang terdapat dalam zat. Banyaknya unsur yang terdapat dalam zat. Banyaknya unsur yang terdapat dalam zat ditunjukkan dengan angka indeks.
➢ Rumus kimia dapat berupa rumus empiris dan rumus molekul.
➢ Rumus empiris, rumus yang menyatakan perbandingan terkecil atom–atom dari unsur–unsur yang menyusun senyawa.
➢ Rumus molekul, rumus yang menyatakanjumlah atom–atom dari unsur–unsur yang menyusun satu molekul senyawa.
➢ Massa atom relatif dari molekul adalah sebagai berikut: Rumus molekul = (Rumus Empiris)n
Mr Rumus Molekul = n x (Mr Rumus Empiris)
n = bilangan bulat
Penentuan rumus empiris dan rumus molekul suatu senyawa dapat menggunakan langkah–langkah sebagai berikut:
1. Mencari massa (presentase) tiap unsur penyusun senyawa 2. Mengubah ke satuan mol,
3. Perbandingan mol tiap unsur merupakan rumus empiris, 4. Mencari rumus molekul dengan cara sebagai berikut:
(Mr rumus empiris)n= Mr rumus molekul, n dapat dihitung, 5. Mengalikan n yang diperoleh dari hitungan dengan rumus empiris.
Contoh Soal 6:
Suatu senyawa terdiri dari unsur P dan O dengan komposisi unsur P sebesar 43,7% dan O sebesar 56,3%. Apabila massa senyawa 200 gram dan Ar: P =31 dan O =16, rumus molekul senyawa tersebut adalah…
Jawab:
Massa masing–masing unsur adalah 87,4 gram dan 112,6 gram. Perbandingan mol P: mol O =87,431 :112,616
19 = 2:5
Jadi, rumus molekul dari senyawa tersebut adalah P2O5
Contoh soal 7:
Suatu senyawa kimia X terdiri dari unsur karbon, hidrogen, dan nitrogen. Jumlah persen unsur karbon, hidrogen, dan nitrogen adalah 60% C, 5% hidrogen, dan 35% N. Mr senyawa X tersebut adalah 80 (Ar: C= 12, H= 1, N= 14). Massa senyawa X adalah 100 gram. Rumus empiris dan rumus molekul senyawa X tersebut adalah…
Jawab:
Massa C: H: N= 60: 5: 35
Perbandingan mol C: mol H: mol N= 5: 5: 35= 2: 2: 1 Maka rumus empiris senyawa tersebut adalah C2H2N (Mr rumus empiris)n= Mr rumus molekul
(C2H2N)n= 80 (24+2+14)n= 80 40n= 80
n =2
Jadi, rumus molekul senyawa tersebut adalah (C2H2N)2= C4H4N2
SOAL LATIHAN
1. Tentukan rumus empiris dari senyawa yang tersusun 31,25 % kalsium, 18,75 % karbon dan sisanya oksigen (Ar Ca= 40, C= 12, O= 16)?
2.
Sebanyak 11 gram suatu senyawa organik dibakar sempurna menghasilkan 44 gram CO2 dan 9 gram H2O (Ar C= 12, O= 16, H= 1). Jika bobot molekul senyawa sama dengan 88. Tuliskan rumus molekulnya?E.
SENYAWA HIDRAT (AIR KRISTAL)
Hidrat merupakan senyawa kristal padat yang di dalamnya terkandung air kristal (H2O). Rumus kimia senyawa kristal padat sudah diketahui, sehingga penentuan rumus hidrat merupakan penentuan jumlah molekul air kristal (H2O) atau nilai x. Penulisan senyawa hidrat secara umum adalah sebagai berikut:
20 Salah satu contoh senyawa hidrat adalah garam kalsium sulfat yang memiliki rumus kimia adalah CaSO4.2H2O, artinya dalam setiap satu mol CaSO4 terdapat 2 mol H2O.Beberapa contoh senyawa hidrat adalah sebagai berikut pada Tabel 1.5. berikut.
Tabel 1.5. Beberapa Contoh Senyawa Hidrat
Nama Senyawa Jumlah Molekul Air
Kristal senyawa hidrat tersebut adalah… (Ar: Cu= 63,5; S= 32; O= 16; H= 1)
Jawab:
Langkah-langkah penentuan rumus hidrat tersebut adalah: 1. Misalkan rumus hidrat CuSO4.xH2O
2. Tuliskan persamaan reaksinya.
3. Tentukan mol zat sebelum dan setelah reaksi.
4. Hitung nilai x, dengan menggunakan perbandingan mol CuSO4: mol H2O CuSO4.xH2O (s) → CuSO4 (s) + xH2O
10 gram 6,4 gram 3,6 gram
Perbandingan, mol CuSO4: mol H2O= 0,02: 0,10. Perbandingan, mol CuSO4: mol H2O= 1: 5
Jadi, rumus kimia hidrat dari tembaga (II) sulfat yaitu CuSO4.5H2O
21 Ada suatu garam berhidrat (BaCl2.xH2O) yang memiliki massa 24,4 gram. Garam tersebut dipanaskan menghasilkan zat yang tersisa adalah 20,8 gram. Rumus kimia dari garam berhidrat tersebut adalah… (Ar: Ba= 137; Cl= 35,5; O= 16; H= 1)
Jawab:
BaCl2.xH2O → BaCl2 + xH2O 24,4 g 20,8 g 3,6 g Perbandingan, mol BaCl2: mol H2O = 0,05: 0,01
= 1: 2
Jadi, rumus kimia dari senyawa hidrat tersebut adalah BaCl2.2H2O.
SOAL LATIHAN
Kadar air kristal dalam suatu hidratdari Na2CO3 sebesar 14,5 %. Tentukan rumus hidratnya! (Ar: Na= 23; C= 12; O= 16; H= 1)
F.
KONSEP MOL
Jika Saudara mereaksikan satu atom karbon (C) dengan satu molekul oksigen (O2), akan terbentuk satu molekul CO2. Akan tetapi sebenarnya yang Saudara reaksikan bukan satu atom karbon dengan satu molekul oksigen, melainkan sejumlah besar atom karbon dan sejumlah besar molekul oksigen. Oleh karena itu, jumlah atom atau jumlah molekul yang bereaksi begitu besarnya, maka untuk menyatakannya, para ahli kimia menggunakan “mol” sebagai satuan jumlah partikel (molekul, atom, atau ion).
Satu mol didefinisikan sebagai jumlah zat yang mengandung partikel zat itu sebanyak atom yang terdapat dalam 12,000 gram atom karbon-12.
Jadi, dalam satu mol suatu zat terdapat 6,022 x 1023 partikel. Nilai 6,022 x 1023 partikel per mol disebut sebagai tetapan Avogrado, dengan lambang L atau N. Dalam kehidupan sehari – hari, mol dapat dianalogikan sebagai “lusin”. Apabila lusin menyatakan jumlah 12 buah, mol menyatakan jumlah 6,022 x 1023 partikel zat.Kata partikel pada NaCl, H2O, dan N2 dapat dinyatakan dengan ion dan molekul, sedangkan pada unsur seperti Zn, C, dan Al dapat dinyatakan dengan atom.
Hubungan antara jumlah mol (n) dengan jumlah partikel, yang secara matematik dapat dinyatakan sebagai berikut.
22 Di mana:
n= jumlah mol
N= bilangan Avogrado
Sehingga dapat dinyatakan pada gambar berikut:
Gambar 1.9. Skema hubungan antara jumlah mol dengan jumlah partikel
1.
Massa Molar (Mr)
Massa satu mol zat dinamakan massa molar (lambang Mr). Besarnya massa molar zat adalah massa atom relative atau massa molekul relative zat yang dinyatakan dalam satuan gram per mol.
Massa molar= Mr atau Ar zat (g/mol)
Berikut ini merupakan tabel beberapa contoh massa molar beberapa zat.
Tabel 1.6. Massa Molar Beberapa Zat
Nama Zat Rumus Ar dan Mr Massa Molar
Oksigen O2 32 32 gram/mol
Karbon C 12 12 gram/mol
Massa suatu zat merupakan perkalian massa molarnya (g/mol) dengan mol zat tersebut (n). Jadi hubungan mol suatu zat dengan massanya dapat dinyatakan sebagai berikut.
Massa molar = massa: mol
23
2.
Volume Molar (Vm)
Volume satu mol zat dalam wujud gas dinamakan volume molar, yang dilambangkan dengan Vm.
Avogrado dalam percobaannya mendapat kesimpulan bahwa 1 L gas oksigen pada 0oC dan tekanan 1 atm mempunyai massa 1,4286 gram atau dapat diyatakan bahwa pada tekanan 1 atm:
1 L gas O2= 1,4286/32 mol 1 L gas O2= 1/22,4 mol 1 mol gas O2= 22,4 L
Berdasarkan Hukum Avogrado dapat disimpulkan sebagai berikut: 1 mol gas O2= 22,4 L
Sesuai dengan Hukum Avogrado yang menyatakan bahwa pada suhu dan tekanan yang sama, volume gas yang sama mengandung jumlah molekul yang sama atau banyaknya mol dari tiap–tiap gas volumenya sama. Berdasarkan hukum tersebut berlaku volume 1 mol setiap gas dalam keadaan standar ( suhu 0 0C dan tekanan 1 atm) sebagai berikut.
Volume gas dalam keadaan standar= 22,4 L.
3.
Volume Gas pada Keadaan Tidak Standar Persamaan Gas Ideal
Apabila gas yang akan diukur bersifat ideal, persamaan yang menghubungkan jumlah mol (n) gas, tekanan, suhu, dan volume yaitu:
Hukum gas ideal: P.V= n.R.T Di mana:
P = tekanan (satuan atmosfir, atm) V = volume (satuan liter, L) n = jumlah mol gas (satuan mol) R = tetapan gas (0,08205 L.atm/mol K) T = suhu mutlak ( satuan Kelvin K)
Dari persamaan gas ideal dapat diturunkan atau dalam bentuk lain menjadi persamaan:
V=n.R.TP P=n.R.TV
24 V=n.R.TP
V=1 mol x 0,08205 L atmmol K x 273 K
1 atm =22,4 L
Contoh soal 10:
Tentukan volume dari 8,8 gram gas CO2 yang diukur pada tekanan 2 atm dan suhu 30 oC!
Dengan konversi gas pada suhu dan tekanan yang sama
25 = 50 L
SOAL LATIHAN
1. Hitung jumlah partikel dari: a. 0,1 mol tembaga
b. 2 mol gas nitrogen dioksida c. 0,25 mol besi
d. 0,5 mol natrium klorida 2. Hitung jumlah mol dari:
a. 1,204 x 1023 atom karbon b. 1,505 x 1022 molekul air c. 3,01 x 1023 atom magnesium
d.
9,03 x 1021 molekul aluminium kloridaG.
KONSENTRASI LARUTAN
1.
Molaritas (M)
Kuantitas zat yang terdapat dalam suatu larutan dapat diketahui dengan menggunakan konsentrasi larutan yang dinyatakan dalam molaritas (M).molaritas tersebut menyatakan banyaknya mol zat dalam 1 liter larutan. Pernyataan tersebut dapat dinyatakan dalam persamaan matematis sebagai berikut:
M=massaM
r x
1000 V Di mana:
M = molaritas (M) Massa = dalam satuan gram
Mr = massa molar (satuan g/mol) V = volume (satuan mL)
Contoh soal 12:
Tentukan molaritas apabila 8 gram NaOH dilarutkan dalam: a. 4 L air
26
Jawab:
Mr NaOH= 40 maka mol NaOH= 8/40= 0,2 mol
a. M = mol x 1000/V= 0,1 x 1000/2000= 0,05 mol/L b. M = massa /Mr x 1000/V
= 8/40 x 1000/500 = 0,4 mol/L
2.
Molalitas (m)
Molalitas (dilambangkan dengan m) menyatakan jumlah mol zat terlarut dalam1000 gram pelarut dan dapat dirumuskan sebagai berikut:
molalitas= 1000 gram pelarutmol zat terlarut , 𝑚
Contoh soal 13:
40 gram metil alkohol (Mr= 32) dilarutkan dalam 1750 gram air. Hitungmolalitas larutan ini!
Jawab:
Jumlah mol zat terlarut= 40/32= 1,25 mol Molalitas= 1,25/1,750= 0,714 m
3.
Mol dan Fraksi Mol
1 mol mengandung sejumlah tertentu molekul-molekul, atom-atom, elektron-elektronatau partikel-partikel khusus yang lain.
Dalam sistem satuan SI, 1 mol mengandung kira-kira 6,023 x 1023 molekul,dan disebut 1 gram mole (dengan notasi gmol). Dari sini kita dapat mencariberapa partikel terdapat dalam 1 kg mol, atau dengan sistim TeknikAmerika/pound mole (dengan notasi 1 lbmol).
1 kg mol= 1000 mol mengandung 6,023 x 1023 molekul. 1 lbmol mengandung 6,023 x 454 x 1023 molekul.
Untuk mengkonversikan sejumlah mole ke massa, digunakan berat molekul n gmol= massa (g)
27 n lbmol= massa (lb)
Mr (lbmollb )
Fraksi mol dan % mol
Fraksi mol merupakan perbandingan mol antara zat terlarut dengan jumlah molsemua komponen.
Fraksi mol A= mol total campuranmol A
% mole A= fraksi mole A x 100 %
Komposisi yang dinyatakan dalam % mole, tidak berubah dengan suhu dengan anggapan tidak ada massa yang hilang dari sistem dan tidak ada reaksi kimia.
SOAL LATIHAN
1.
Berapa gram KOH (Ar K= 39, Ar O= 16, Ar H= 1) yang diperlukan untuk membuat 200 mL larutan 0,15 M?2.
Untuk membuat 25 mL larutan H2SO4 dibutuhkan 10 mL H2SO4 69,5% yang mempunyai massa jenis 1,61 gram/L dan air. Hitung kemolalan larutan ini (Mr H2SO4= 98)!3.
Suatu larutan yang terdiri dari 5,85 gram NaCl (Mr= 58,5); 45 gram air (Mr= 18) dan 2 gram NaOH (Mr= 40). Hitung fraksi mol masing–masing komponen penyusun larutan tersebut!H.
PERHITUNGAN KIMIA
Perhitungan kimia untuk menentukan jumlah pereaksi dan hasil reaksi yang terlibat dalam reaksi harus menggunakan satuan mol. Maksudnya adalah satuan– satuan yang diketahui harus diubah ke dalam bentuk mol. Metode tersebut disebut metode pendekatan mol. Langkah- langkah dalam metode pendekatan mol tersebut dapat dilihat dalam bagan berikut ini:
➢ Tuliskan persamaan reaksi dari soal yang ditanyakan dan setarakan.
➢ Ubahlah semua satuan yang diketahui dari tiap–tiap zat ke dalam mol.
➢ Gunakanlah koefisien reaksi untuk menyeimbangkan banyaknya mol zat reaktan dan produk
28
Contoh soal 14:
Dua mol logam aluminium direaksikan dengan asam klorida secukupnya berdasarkan reaksi
Al (s) + HCl (aq) → AlCl3 (aq) + H2 (g) Jawablah pertanyaan berikut ini:
a. Berapa massa AlCl3 yang terbentuk? b. Berapa volume gas H2 (STP)? c. Berapa partikel H2 yang dihasilkan? (Ar: Al= 27; Cl= 35,5)
Jawab:
2Al (s) + 6HCl (aq) → 2AlCl3 (aq) + 3H2 (g) 2 mol
a. Mol AlCl3 =koefisien AlCl3
koefisien Al x mol Al
Mol AlCl3 =22 x 2 mol
Mol AlCl3 =2 mol
Massa AlCl3 = 2 x Mr AlCl3 = 2 x 133,5 = 267
b. Mol H2 = koefisien H2/koefisien Al x mol Al = 3/2 x 2 mol
= 3 mol
Volume = 3 x 22,4 L = 672 L
c.
Jumlah partikel H2 adalah= 3 x 6,02 x 1023= 18,06 x 1023 partikel.1.
Pereaksi Pembatas
Pada suatu reaksi kimia, perbandingan mol zat–zat pereaksi yang dicampurkan tidak selalu sama dengan perbandingan koefisien reaksinya. Hal tersebut menunjukkan bahwa ada zat pereaksi yang akan habis bereaksi lebih dulu. Pereaksi tersebut dinamakan pereaksi pembatas. Perhatikan reaksi berikut ini:
X + 2Y → XY2
29 zat X direaksikan dengan empat molekul zat Y. setelah reaksi berlangsung, banyaknya molekul zat X yang bereaksi hanya dua molekul dan satu molekul tersisa. Sementara, empat molekul zat Y habis bereaksi. Maka zat Y ini disebut pereaksi pembatas. Pereaksi pembatas merupakan reaktan yang habis bereaksi dan tidak tersisa di akhir reaksi.
Dalam perhitungan kimia, pereaksi pembatas dapat ditentukan dengan cara membagi semua mol reaktan dengan koefisiennya, lalu pereaksi yang mempunyai nilai hasil bagi terkecil merupakan pereaksi pembatas.
Contoh soal 15:
2 mol gas etena, C2H4 direaksikan dengan 3 mol gas oksigen, menghasilkan gas karbon dioksida dan uap air, menurut persamaan reaksi:
C2H4(g) + 3O2(g) ⎯⎯⎯→ 2CO2(g) + 2H2O(g)
Apakah gas C2H4 dan O2 dapat bereaksi semua?
Jawab:
Perbandingan koefisien C2H4: O2 adalah 1: 3
➢ Jika C2H4 habis bereaksi (2 mol), maka diperlukan O2= 3⁄1 x 2 mol= 6mol O2. Karena O2 yang tersedia hanya 3 mol, maka mol O2 tidak memadai (tidak mungkin).
➢ Jika O2 habis bereaksi (3 mol), maka diperlukan C2H4= 1⁄3 x 3 mol= 1 mol, sehingga C2H4 masih tersisa 1 mol. Jadi, O2 habis bereaksi (pereaksi pembatas), sedangkan C2H4 sebagai pereaksi sisa.
SOAL LATIHAN
Sebanyak 36 gram glukosa, C6H12O6 dibakar sempurna menghasilkan gas karbondioksida dan air, sesuai persamaan reaksi berikut:
C6H12O6 (g) +6O2(g) → 6CO2(g) + 6H2O(l). Tentukan:
1. Volume gas oksigen yang diperlukan (STP)
2. Volume udara yang diperlukan, jika kadar oksigen di udara sebesar 20% volume 3. Volume gas CO2, diukur pada 0oC, 1 atm
30
MENGENAL PARA TOKOH PENEMU HUKUM DASAR
KIMIA
1.
Antoine Lavoisier
Sumber: id.wikipedia.org
Gambar 1.10. Antoine laurent lavoisier
Seorang ahli matematika Prancis yang bernama Joseph Louis Lagrange mengatakan sebuah kalimat sesaat setelah Lavoisier dipenggal kepalanya pada tanggal 8 Mei 1794. Kalimat tersebut adalah: “It took them only an instant to cut off that head, and a hundred years may not produce another like it” yang jika diterjemahkan ke dalam bahasa Indonesia berarti: “Hanya perlu sekejap untuk memenggal kepala Lavoisier, namun seratus tahun pun mungkin tidak bisa melahirkannya kembali. Ungkapan dari Lagrange tersebut mengungkapkan sebuah kekaguman akan sosok Lavoisier yang bukan manusia biasa.
31 Pada saat usianya mencapai 32 tahun, Lavoisier diangkat menjadi Komisaris Polisi Kerajaan.Ia diberi tanggung jawab untuk mengelola laboratorium serbuk mesiu. Lavoisier berusahan untuk mengembangkan laboratoriumnya dengan cara merekrut kimiawan–kimiawan muda dari berbagai penjuru Eropa. Lavoisier dan timnya bekerja keras untuk memperbaiki metode pembuatan serbuk mesiu yang berkualitas bagus.Ia dan timnya berhasil meningkatkan kualitas dan kemurnian bahan baku pembuatan mesiu, yaitu sendawa, belerang, dan batu bara. Hasil dari kerja keras mereka menggembirakan, serbuk mesiu yang dihasilkan laboratoriumnya menjadi lebih banyak dan lebih baik dibandingkan sebelumnya. Percobaan tersebut merupakan awal mula Lavoisier berkenalan dengan dunia kimia.Sejak keberhasilannya pada pembuatan serbuk mesiu, Lavoisier semakin senang dan gigih melakukan penelitian di bidang kimia.
Istri Lavoisier, Marie-Anne Pierrette Paulze, mendukung penuh kerja keras dan penelitian suaminya. Marie membantu suaminya untuk menerjemahkan tulisan seorang kimiawan Inggris yang bernama Joseph Prestley. Marie juga terampil dalam menggambar sehingga ia bisa membantu suaminya dalam menggambarkan hasil-hasil penelitian Lavoisier.
Lavoisier dijuluki sebagai Bapak Kimia Modern karena sumbangannya terhadap pengembangan ilmu kimia. Sumbangan terbesarnya adalah keberhasilannya dalam menggabungkan semua penemuan di bidang kimia yang terpish dan berdiri sendiri menjadi suatu kesatuan. Ia membuat kerangka dasar kimia berdasarkan hasil penelitian kimiawan sebelumnya, seperti Joseph Black, Joseph Priestley, Henry Cavendish, dan George Ernst Stahl.
32 peka. Ternyata, terjadi pengurangan massa oksida raksa. Lavoisier menjelaskan alasan berkurangnya massa oksida raksa setelah pemanasan. Ketika dipanaskan, oksida raksa menghasilkan gas oksigen sehingga massanya akan berkurang. Lavoisier juga membuktikan kebalikannya. Apabla sebuah logam dipanaskan di udara, massanya akan bertambah sesuai dengan jumlah oksigen yang diambil dari udara. Kesimpulan Lavoisier ini dikenal dengan nama hukum kekekalan massa. Bunyi hukum tersebut adalah jumlah massa zat sebelum dan setelah reaksi tidak berubah. Dengan adanya penemuan ini, teori flogiston yang dipercayai para ilmuwan kimia selama kurang lebih 100 tahun akhirnya dipatahkan. Lavoisier juga menyatakan proses berkeringat merupakan hasil pembakaran lambat di dalam tubuh.
Lavoisier menuliskan ide–idenya dalam sebuah buku yang berjudul Traite Elementaire de Chimie (Pokok–pokok Dasar Ilmu Kimia).Buku yang dipublikasikan pada tahun 1789 itu juga memuat pendapat Lavoisier mengenai definisi unsur kimia. Lavoisier berpendapat bahwa unsur adalah zat yang tidak dapat diuraikan lagi menjadi zat yang lebih sederhana lagi. Berdasarkan hal tersebut, Lavoisier membuat daftar 33 zat yang termasuk unsur.
33 dunia. Dunia berduka. Salah satu permata ilmu hilang secara sia–sia. Benar ungkapan Lagrange, tetapi yang ada hanya penyesalan.
2.
Amedeo Avogadro
Sumber: id.wikipedia.org
Gambar 1.11. Lorenzo romano amedeo carlo avogadro
Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e di Cerreto yang lahir 9 Agustus 1776 di Torino, Italia adalah seorang ilmuwan Italia.Ia dikenal dalam hal teori molekul, termasuk apa yang dikenal sebagai hukum Avogadro.
Pada tahun 1820, ia menjadi profesor fisika di University of Turin. Setelah kejatuhan Kaisar Prancis Napoleon pada 1815, Piedmont sedang berada di bawah kendali Raja Piedmont-Sardinia, yang berkuasa dari Turin.Tahun 1821 Avogadro aktif dalam gerakan revolusioner melawan Raja Victor Emmanuel I. Akibatnya, ia kehilangan kursinya pada tahun 1823. Avogadro menduduki jabatan yang berurusan dengan statistik, meteorologi, bobot dan ukuran (dia memperkenalkan sistem metrik ke Piedmont) dan merupakan anggota dari Royal Dewan Tinggi Instruksi Publik.
34 Johann Josef Loschmidt pertama kali menghitung nilai bilangan Avogadro, sering disebut sebagai nomor Loschmidt di negara-negara berbahasa Jerman (Loschmidt konstan sekarang memiliki makna lain).
Hukum Avogadro menyatakan bahwa "Gas-gas yang memiliki volume yang sama, pada temperatur dan tekanan yang sama, memiliki jumlah partikel yang sama pula. "Avogadro mengembangkan hipotesis ini setelah Joseph Louis Gay-Lussac telah menerbitkan hukumnya pada volume (dan menggabungkan gas) pada tahun 1808. Salah satu kontribusinya yang paling penting menyatakan bahwa gas terdiri dari molekul, dan molekul ini terdiri dari atom. Misalnya, John Dalton tidak mempertimbangkan kemungkinan ini. Avogadro tidak benar-benar menggunakan kata "atom" sebagai kata-kata "atom" dan "molekul" yang digunakan hampir tanpa perbedaan. Dia percaya bahwa ada tiga jenis "molekul," termasuk "molekul dasar" ("atom").
Komunitas ilmiah tidak memberikan perhatian besar terhadap teorinya, sehingga hipotesis Avogadro tidak segera diterima. André-Marie mencapai hasil yang sama tiga tahun kemudian dengan metode lain. Avogadro dipuji sebagai pendiri teori molekul atom.
35
UJI KOMPETENSI
I.
SOAL PILIHAN GANDA
Pilihlah dengan memberi tanda silang (X) pada huruf a, b, c, d atau e di
jawaban yang tepat!
1. Hukum kekekalan massa yang berbunyi “massa zat sebelum dan setelah reaksi adalah sama”, merupakan hukum yang dikemukakan oleh…
a. Joseph Louis Proust b. Antoine Laurent Lavoisier c. Joseph Gay Lussac d. Dalton
e. Joseph Louis Lagrange
2. Hukum perbandingan berganda yang berbunyi “Apabila dua unsur membentuk lebih dari satu senyawa dan massa salah satu unsur tersebut dibuat tetap, perbandingan massa unsur yang lain dalam senyawa-senyawa tersebut merupakan bilangan bulat dan sederhana”, merupakan hukum dikemukakan oleh…
a. Joseph Louis Proust b. Antoine Laurent Lavoisier c. Joseph Gay Lussac d. Dalton
e. Joseph Louis Lagrange
3. Hukum perbandingan volume yang berbunyi “Pada suhu dan tekanan yang sama, perbandingan volume gas-gas yang bereaksi dan hasil reaksi berbanding sebagai bilangan bulat”, merupakan hukum dikemukakan oleh…
a. Joseph Louis Proust b. Antoine Laurent Lavoisier c. Joseph Gay Lussac d. Dalton
e. Joseph Louis Lagrange
4. Serbuk besi sejumlah 56 gram (Ar Fe=56) direaksikan dengan 64 gram belerang (Ar S=32) sesuai reaksi Fe + S → FeS. Zat yang tersisa sesudah reaksi selesai adalah… a. 8 gram belerang
36 c. 24 gram belerang
d. 32 gram belerang e. 40 gram belerang
5. Contoh aplikasi dari hukum perbandingan gandan yang dicetuskan oleh Dalton adalah…
6. Sebanyak 8 gram hidrogen direaksikan dengan 48 gram oksigen. Hasil reaksi tersebut adalah air sebanyak…gram.
7. Perbandingan massa oksigen dalam senyawa N4O6 dan NO2 adalah… a. 4:3
b. 3:4 c. 2:3 d. 3:2 e. 2:1
37 9. Perbandingan massa unsur besi dan massa unsur belerang adalah 7:4 untuk membentuk besi sulfide. Jika sebanyak 30 gram besi dan 4 belerang dibentuk menjadi senyawa sulfida, massa besi sulfida tersebut adalah…gram.
a. 11 b. 12 c. 13 d. 14 e. 15
10. Apabila suatu zat ditimbang ternyata massanya adalah 65 gram. Setelah zat tersebut bereaksi dengan unsur lain maka massa zat tersebut sekarang adalah…
a. 65 b. 130 c. 195 d. 260 e. 325
11. Hukum yang menyatakan bahwa “Pada suhu dan tekanan yang sama, gas-gas yang volumenya sama mengandung molekul sama” adalah hukum…
a. Lavoisier b. Gay Lussac c. Boyle d. Avogrado e. Dalton
12. DaltonSenyawa berikut ini yang mempunyai jumlah partikel terbesar adalah… a. 10 gram H2O CO2. Volume gas karbondioksida yang dihasilkan adalah…
38 e. 50 liter
14. Satu mol gas Oksigen (O= 16) artinya... a. mempunyai massa 16 gram
b. mempunyai massa 6.1023gram c. mengandung 6.1024 atom d. mengandung 1,2.1024 atom e. mengandung 1,2.1024 molekul
15. Massa Kalsium karbonat (Mr=100) yang mengandung 3,6.1023 atom oksigen adalah ...
16. Jumlah molekul dalam 8 gram SO3 sama dengan jumlah molekul dalam... a. 9 gram H2SO4
b. 8 gram SO2 c. 17 gram NH3 d. 9,8 gram H3PO4 e. 4,4 gram CO2
17. Pada pemanasan 43 gram gips, CaSO4.xH2O diperoleh 34 gram garam anhidrat, Harga x= ...
39
20. Sebanyak 9 gram unsur X bersenyawa dengan 8 gr oksigen membentuk senyawa X2O3. Harga Ar X...
21. Piridin tersusun dari 60% karbon, 5% Hidrogen, dan sisanya Nitrogen. Jika satu gram piridin mengandung 7,5.1021 molekul, rumus molekul Pirimidin...
a. C2H2N b. C4H4N2 c. C5H5N2 d. C5H5N3 e. C6H6N3
22. Senyawa AB3 mengandung 40% masa unsur A. Massa atom A... a. Setengah massa atom B
b. Sepertiga kali massa atom B c. Dua kali massa atom B d. Tiga kali massa atom B e. Sama dengan massa atom B
23. Massa Alumunium Oksida yang dihasilkan dari 72 gram Alumunium dan 72 gram
40
25. Sebanyak 171 gram Alumunium Sulfat (Mr= 342) dan x gram kalsium karbonat (Mr= 100) mengandung massa oksigen yang sama. Harga x...
a. 25 b. 50 c. 100 d. 200 e. 150
26. Banyaknya cuplikan dengan kadar belerang 80% yang pada pembakaran dapat menghasilkan 80 gram SO3 adalah....
a. 20 gram b. 32 gram c. 64 gram d. 80 gram e. 40 gram
27. Diketahui reaksi: Fe + S → FeS Jika 10 g besi dicampur dengan 3,2 g S, massa FeS yang dihasilkan (Ar: Fe= 56; S= 32) yaitu...
41
30. Perhatikan persamaan reaksi berikut! Mg (s) + 2HCl (aq) → MgCl2(aq) +H2(g)
Apabila 4 gram logam Mg dimasukkan ke dalam 10 mL larutan HCl 2 M, maka volume gas H2 yang terbentuk dalam keadaan standar adalah…
(Ar Mg = 24; H = 1; Cl = 35,5)
Jawablah pertanyaan-pertanyaan berikut ini dengan singkat dan jelas!
1. Tulislah persamaan setara untuk masing-masing reaksi berikut!
a. Larutan amonium sulfat dan larutan natium hidroksida membentuk larutan natrium sulfat, gas amonia dan gas.
b. Larutan tembaga (II) sulfat dan larutan natium hidroksida membentuk endapan tembaga (II) hidroksida dan larutan natrium sulfat.
42 4. 12 gram MgSO4 (Mr= 120) dilarutkan kedalam 400 gram air, hitunglah molalitas
larutan yang terjadi!
43
BAB 2
ELEKTROKIMIA
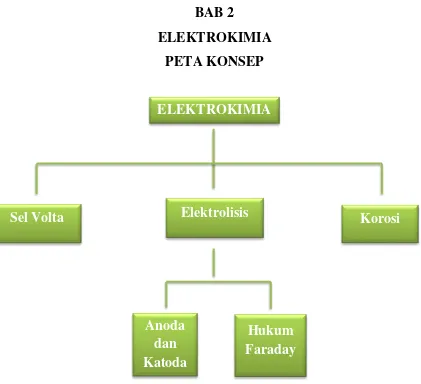
PETA KONSEP
Gambar 2.1. Peta konsep elektrokimia
Setelah mempelajari bab elektrokimia ini, saudara diharapkan dapat menjelaskan tentang sel volta dan proses elektrolisis yang berkaitan dengan anodan dan katoda berdasarkan Hukum Faraday, serta dapat menjelaskan mekanisme peristiwa korosi yang terjadi di kehidupan sehari-hari.
Elektrokimia merupakan cabang ilmu kimia yang mempelajari aspek elektronik dari reaksi kimia. Sel elektrokimia adalah suatu sel yang disusun untuk mengubah energi kimia menjadi energi listrik atau sebaliknya yaitu mengubah energi listrik menjadi energi kimia. Pada sel elektrokimia terdapat dua jenis sel yaitu sel galvani/sel volta dan sel elektrolisis. Kedua sel tersebut akan dipelajari lebih lanjut pada materi berikut.
ELEKTROKIMIA
Anoda
dan
Katoda
Korosi
Elektrolisis
Sel Volta
44
A.
SEL VOLTA
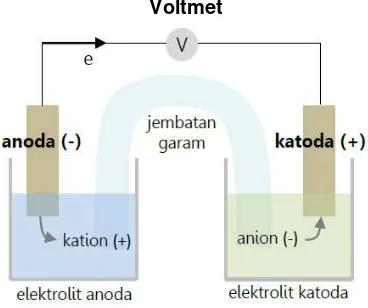
Seorang ilmuwan Itali bernama Luigi Galvani telah melakukan sebuah percobaan. Percobaan yang dilakukan adalah melilit dua logam yaitu kawat besi dan kawat tembaga menjadi satu. Kemudian kedua ujung yang lainnya dikenakan pada kaki kodok dan kaki kodokpun bergerak. Peristiwa itu diberi istilah listrik hewan atau “animal elektricity”. Percobaan galvani ini merupakan asal mula ditemukannya sel kering, sel merkuri, accu, dan sumber tenaga listrik sejenis lainnya. Percobaan galvani ini kemudian diteruskan oleh Alessandro Guiseppe Volta. Sel-sel ini pada prinsipnya mengubah energi kimia menjadi listrik. Karena itu, sel listrik yang dihasilkan disebut sel galvanic atau sel volta. Sel-sel penghasil energi listrik yang sekarang berada dalam tingkat pengembangan ini merupakan sumber penghasil tenaga yang sangat penting dikemudian hari untuk dapat menggantikan sumber daya energi yang tidak dapat diperbaharui.
Sel galvani atau sel volta merupakan salah satu contoh dari sel yang menggunakan prinsip energi kimia yang diubah menjadi energi listrik. Dalam sebuah sel galvani, suatu reaksi oksidasi-reduksi terjadi dalam kondisi tertentu sehingga arus listrik dapat dihasilkan dari sel tersebut. Reaktan-reaktan itu berada dalam dua kompartemen, masing-masing mengandung sebuah elektroda dan suatu elektrolit. Elektroda itu adalah konduktor listrik yang tidak bereaksi dengan larutan elektrolit yanga ada dalam setiap kompartemen. Kedua elektroda itu dihubungkan dengan kawat konduktor, sehingga elektron dapat mengalir dari elektroda satu ke elektroda lainnya. Ion-ion dapat berpindah dari kompartemen yang satu ke kompartemen lainnya melalui suatu elektrolit, yang mungkin mengandung ion-ion yaitu jembatan garam atau tidak mengandung ion-ion yaitu selaput semipermiabel. Jembatan garam (salt bridge) merupakan penyempurna sel yang mengandung larutan garam dalam bentuk koloid agar-agar yang membuat rangkaian menjadi rangkaian tertutup dan menyeimbangkan muatan elektrolit dengan memberi ion positif atau negatif.
45 Bila sebuah logam dimasukkan kedalam larutan yang mengandung ionnya dan kecenderungan ion untuk menjadi logam lebih besar daripada kecenderungan logam masuk kedalam larutan, maka proses pengendapan logam akan terjadi sampai kesetimbangan antara logam dan ion terjadi. Perbedaan potensial antara logam dan larutannya pada konsentrasi 1 Molar disebut potensial elektroda standar dan diberi simbol Eo
Berikut merupakan rangkain dari sel galvani atau sel volta:
Sumber: http://apriliaputri30.blogspot.co.id
Gambar 2.2. Rangkaian sel galvani atau sel volta
Pada Gambar 2.2 diatas terdapat voltmeter guna menentukan besarnya potensial sel. Terdapat jembatan garam untuk menjaga kenetralan muatan listrik pada suatu larutan dan kegunaan lainnya seperti yang sudah dijelaskan sebelumnya. Pada anoda (-) merupakan kutub (-) sumber arus yang mengalami oksidasi karena melepaskan elektron. Sedangkan pada katoda (+) sumber arus yang mengalami reduksi karena menerima elektron.
Dalam reaksi reduksi-oksidasi (redoks) antara Zn dan larutan CuSO4, sebuah atom Zn melepaskan 2 elektronnya sedangkan ion Cu dalam CuSO4 menerima 2 elektron dan membentuk logam tembaga. Bila Zn dan larutan CuSO4 dicampur, reaksi spontan terjadi dengan menghasilkan kalor. Sementara itu, apabila reaksi yang sama dilaksanakan dalam suatu sel elektrokimia maka energi listrik akan terjadi. Perhatikan Gambar 2.3.
46
Zn
Cu
Sumber: http://apriliaputri30.blogspot.co.id/2014/06/
Gambar 2.3. Sel galvani atau sel volta antara zn dan larutan cuso4
Kompartemen sebelah kiri terdiri dari sebatang logam Zn yang disebut elektroda dimasukkan kedalam cairan yang disebut elektrolit. Elektrolit itu dapat berupa larutan garam sulfat dalam air, misalnya K2SO4. Kompartemen sebelah kanan dari sel terdiri dar elektroda logam Cu yang dimasukkan kedalam elektrolit CuSO4. Kedua larutan itu dihubungkan dengan dua cara. Cara yang pertama adalah menghubungkan elektrolit anoda dan elektrolit katoda dengan sebuah jembatan garam, yang juga mengandung elektrolit (dalam hal ini K2SO4), sedangkan cara yang kedua adalah dengan menghubungkan kedua elektroda dengan kawat konduktor.
Cara kerja sel galvani atau sel volta itu adalah sebagai berikut:
Dari teori yang telah dinyatakan diatas, Zn bila dimasukkan kedalam suatu larutan berkecenderungan untuk terurai menjadi ionnya demikian pula yang akan terjadi dengan Cu dengan reaksi sebagai berikut:
Zn Zn2+ + 2 elektron (a)
Cu2+ + 2 elektron Cu (b)
Percobaan menunjukkan bahwa bila rangkaian dipasang seperti Gambar 2.3. di atas ternyata dapat diketahui dari voltmeter bahwa elektron bergerak dari logam Zn ke logam Cu melalui kawat konduktor. Hal ini menunjukkan bahwa Zn yang dimasukkan kedalam elektrolit berkecenderungan untuk memberikan ion Zn2+ kedalam larutan dan meninggalkan elektron-elektronnya pada permukaan Zn. Atau dengan kata lain anoda Zn
47 teroksidasi semakin menipis karena berubah menjadi ion Zn2+ yang larut dalam elektrolit anoda. Hal ini mengganggu kesetimbangan (a) ke kanan karena anoda kelebihan ion positif. Sedangkan pada kompartemen sebelah kanan elektron-elektron dari elektroda Zn tersebut mengganggu kesetimbangan (b) ke kiri sehingga Cu2+ menjadi endapan logam Cu. Atau dengan kata lain katoda Cu tereduksi semakin menebal dan lama kelamaan akan mengendap menjadi logam Cu karena ion logam dari elektrolit katoda menerima elektron yang menyebabkan katoda kelebihan ion negatif. Akibatnya larutan di kompartemen sebelah kiri kelebihan ion positif dan larutan di kompartemen sebelah kanan kelebihan ion negatif, hal ini menyebabkan ketidakseimbangan muatan sehingga reaksi tidak berkelanjutan.
Melalui jembatan garam atau lapisan semipermeabel ion SO42- dapat bermigrasi dari kompartemen kanan ke kiri, sehingga menetralkan kembali larutan. Demikian pula Zn2+ juga dapat bermigrasi dari kompartemen kiri ke kompartemen kanan sehingga mentralkan kembali larutan. Dengan netralnya larutan-larutan itu, maka reaksi kimia dapat berkelanjutan dan listrik dapat dihasilkan secara berkesinambungan. Sehingga reaksi yang terjadi dalam rangkaian sel galvani atau sel volta dapat dituliskan sebagai berikut:
Anoda : Zn Zn2+ + 2 elektron
Katoda : Cu2+ + 2 elektron Cu +
Zn + Cu2+ Zn2+ + Cu
(setarakan mol elektron)
Bagian-bagian dari sel galvani atau sel volta sebagai berikut:
1.
Anoda dan Katoda pada Sel Galvani atau Sel Volta
48
2.
Macam-macam Elektroda pada Sel Galvani atau Sel Volta
a. Elektroda Padat/Logam
Logam padat dijadikan elektroda dan bereaksi. Contoh : Elektroda Fe pada Larutan FeSO4
Elektroda Ni pada H2SO4 b. Elektroda Tidak Padat
Apabila elektroda merupakan elektroda inert (Pt, Au dan Cl), maka zat inilah yang mengalami reaksi sel sesuai aturan sel elektrolisis.
Contoh: ion Fe3+ bertindak sebagai katoda dan tereduksi menjadi Fe2+ apabila katoda sesungguhnya adalah Pt.
3.
Diagram Sel pada Sel Galvani atau Sel Volta
Diagram sel adalah notasi singkat yang menggambarkan terjadinya reaksi pada sel galvani atau sel volta. Dalam sel galvani reaksi-reaksi dalam dua kompartemen menghasilkan energi listrik. Reaksi yang terjadi pada setiap kompartemen disebut reaksi ½ sel. Untuk memberikan gambaran lengkap mengenai sel galvani, beberapa informasi perlu diberikan:
1. Logam yang digunakan sebagai elektroda (macam-macam elektroda);
2. Keadaan larutan (elektrolit) yang berhubungan dengan elektroda (termasuk konsentrasi ion dalam larutan);
3. ½ sel yang mana yang anoda dan ½ sel yang mana yang katoda; 4. Zat mana yang reaktan dan mana yang hasil reaksi.
Sebagai contoh adalah pada gambaR 2.3. dapat dituliskan diagram selnya sebagai berikut:
➢ Pada anoda terdapat elektroda Zn yang mengalami oksidasi Zn Zn2+ + 2e
dan konsentrasi larutan= 1,00 Molar. Diagram ½ sel ini ditulis sebagai berikut: Anoda: Zn / Zn2+ (1,00 M)
➢ Pada katoda terdapat elektroda Cu yang mengalami reduksi Cu2++ 2e Cu
49
• Anoda selalu ditulis disebelah kiri dan katoda disebelah kanan. • Tanda | menunjukkan reaksi yang terjadi pada elektroda
• Tanda || menunjukkan jembatan garam atau selaput semi permeabel. Diagram pada sel galvani/volta dengan elektroda padat:
Reaksi sel : A + Bx+ Ay+ + B Diagram sel : A | Ay+|| Bx+| B
Diagram pada sel galvani/volta dengan elektroda tidak padat:
Reaksi sel : A + Bx+ Ay+ + B (elekroda inert, E: Pt, Au, Cl) Diagram sel : E | A | Ay+|| Bx+| B | E
4.
Potensial Elektroda
a.
Deret Volta
Deret Volta adalah deret elektrokimia/kereaktifan logam yang menunjukkan nilai potensial elektroda standar logam (Eo). Sifat deret volta adalah semakin ke kanan, logam semakin mudah tereduksi (nilai Eo semakin positif) dan semakin ke kiri, logam semakin mudah teroksidasi (nilai Eo semakin negatif). Berikut deret volta yang dimaksud: