LAPORAN PRAKTIKUM
INSTRUMENTASI KIMIA
PH METER
DISUSUN OLEH: NAMA : M.Sukron.F.Husein NIM : 011400389 KELOMPOK : A3NAMA ANGGOTA : 1. Amanda Wilis
2. Hezekiel Karunia Putra PROGRAM STUDI : D-IV Teknokimia Nuklir
SEMESTER : III
ASISTEN : Haries Handoyo, SST
SEKOLAH TINGGI TEKNOLOGI NUKLIR
BADAN TENAGA NUKLIR NASIONAL
YOGYAKARTA 2015
Pengukuran pH dengan Menggunakan pH Meter
A. Tujuan
1. Mempelajari fungsi konsentrasi terhadap sifat keasaman/kebasaan suatu larutan. 2. Mempelajari jalannya titrasi asidimetri/alkalimetri dengan menggunakan pH-meter,
sehingga dapat ditentukan titik ekivalennya.
3. Mempelajari daerah kerja indikator asam/basa dan persentase kesalahannya dibandingkan dengan pH meter.
B. Dasar Teori
1. Pengionan Air
Berdasarkan pengukuran daya hantar listrik menunjukkan bahwa air mengion secara terbatas sesuai dengan persamaan berikut :
2 H2O ↔ H3O+ + OH- atau
H2O ↔ H+ + OH
-Pengukuran daya hantar air murni pada 25oC menunjukkan bahwa susunan ionnya
adalah :
[H3O+] = 1,0 x 10-7 mol/L
[OH-] = 1,0 x 10-7 mol/L
Sehingga tetapan kesetimbangan pengionan air adalah :
2 2 3 O H OH O H Kc Untuk air murni atau larutan yang encer (dengan pelarut air) dianggap bahwa konsentrasi molekul air adalah 55 M, sehingga :
2 3 55 OH O H Kc Kc x (55)2 = [H 3O+][OH-]Karena Kc x (55)2 adalah sama dengan Kw, dan dengan mensubstitusikan konsentrasi
ion hidrogen dan hidroksida, maka dapat dihitung harga Kw sebagai berikut : Kw = [H3O+][OH-]
= (1,0 x 10-7) (1,0 x 10-7)
Tetapan Kw ini disebut hasil kali ion untuk air. Ini menunjukkan dalam air murni atau larutan dalam air apa saja, baik ion hidrogen dan hidroksida harus ada dan hasil kali konsentrasinya harus konstan. Jika konsentrasi salah satu ion diketahui, maka konsentrasi ion yang lain mudah dihitung, karena hasil kali keduanya adalah sama dengan 1,0 x 10-14 (Kw pada 25oC).
Dalam larutan air, sifat asam yang biasa dikaitkan dengan ion hidrogen dan sifat basa yang biasa dikaitkan dengan ion hidroksida. Karena hasil kali konsentrasi molar ion-ion ini konstan, yaitu sebesar 1 x 10-14 maka perlu untuk menyatakan konsentrasi
dari satu ion saja untuk menentukan sifat asam atau basa suatu larutan: Jika [H+] lebih besar dari 1,0 x 10-7 M, larutan bersifat asam
Jika [H+] lebih kecil dari 1,0 x 10-7 M, larutan bersifat basa
Jika [H+] sama dengan 1,0 x 10-7 M, larutan bersifat netral
A. Konsentrasi Ion Hidrogen
Konsentrasi ion hidrogen dalam suatu larutan biasa dinyatakan dengan pH. pH suatu larutan didefinisikan sebagai :
H 1 log pH atau
log H pH Diketahui bahwa : Kw = [H+] [OH-] Maka :- log Kw = - log [H+] – log [OH-]
pKw = pH + pOH
= 14
Pengukuran pH merupakan salah satu prosedur analitis yang sangat penting dan sering digunakan dalam ilmu kimia. Penentuan pH suatu larutan digunakan alat pH-meter.
2. Titrasi dengan Indikator
pH suatu larutan secara kasar dapat ditentukan dengan menggunakan indikator asam basa. Indikator asam basa adalah asam atau basa organik yang mempunyai satu warna jika konsentrasi hidrogen lebih tinggi dari pada suatu harga tertentu dan suatu warna lain jika konsentrasi itu lebih rendah.
NO NAMA TRAYEK pH PERUBAHAN WARNA ASAM BASA 1 2 3 4 5 6 7 8 Metil kuning Dinitrofenol Metil jingga Metil merah Lakmus Fenolftanlein Timolftalein Trinitrobenzena 2 – 3 2,4 – 4,0 3 – 4,5 4,4 – 6,6 6 – 8 8 – 10 10 – 12 12 – 13 Merah Tak berwarna Merah Merah Merah Tak berwarna Kuning Tak berwarna Kuning Kuning Kuning Kuning Biru Merah Ungu Jingga
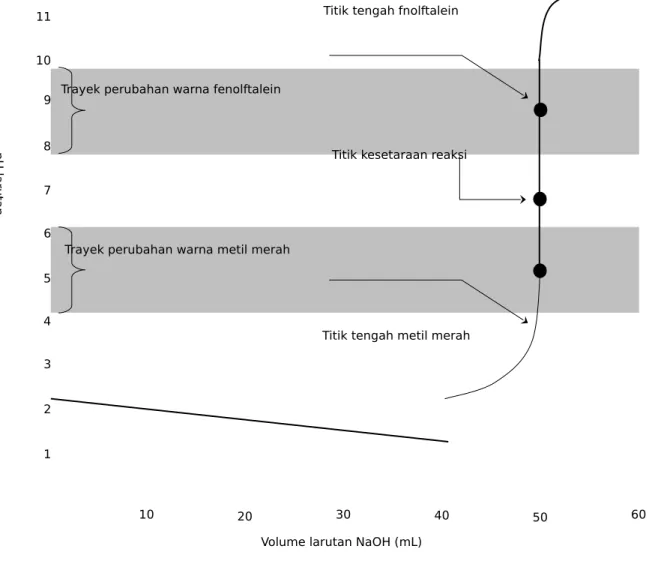
Pemilihan suatu indikator untuk suatu titrasi asam basa tertentu bergantung pada kuat relatif asam dan basa yang digunakan dalam titrasi. Pada suatu titrasi, titik kesetaraan adalah titik dimana tepat cukup satu pereaksi ditambahkan untuk bereaksi dengan pereaksi yang lain. Suatu titik akhir adalah titik pada saat indikator tertentu berubah warna. Secara ideal, dalam suatu titrasi, titik kesetaraan dan titik akhir dari indikator yang dipilih haruslah identik.
Titik kesetaraan reaksi Trayek perubahan warna fenolftalein
Trayek perubahan warna metil merah
Titik tengah fnolftalein
Titik tengah metil merah 7 6 5 4 3 2 1 9 8 10 12 11 10 20 30 40 50 60 p H la ru ta n
Volume larutan NaOH (mL)
Gambar 1. Kurva titrasi 50 mL HCl 0,1 M dengan NaOH 0,1 M
3. Konsep pH
pH adalah derajat keasaman yang digunakan untuk menyatakan tingkat keasaman atau kebasaan yang dimiliki oleh suatu larutan. Ia didefinisikan sebagai kologaritmaaktivitasion hidrogen (H+) yang terlarut. Koefisien aktivitas ion
hidrogen tidak dapat diukur secara eksperimental, sehingga nilainya didasarkan pada perhitungan teoritis. Skala pH bukanlah skala absolut. Ia bersifat relatif terhadap sekumpulan larutan standar yang pH-nya ditentukan berdasarkan persetujuan internasional. pH didefinisikan sebagai minus logaritma dari aktivitas ion hidrogen dalam larutan berpelarut air. pH merupakan kuantitas tak berdimensi.
4. Konsentrasi Ion Hidrogen
Konsentrasi ion hidrogen dalam suatu larutan biasa dinyatakan dengan pH. pH suatu larutan didefinisikan sebagai :
H 1 log pH atau
log H pH Diketahui bahwa : Kw = [H+] [OH-] Maka :- log Kw = - log [H+] – log [OH-]
pKw = pH + pOH
= 14
Pengukuran pH merupakan salah satu prosedur analitis yang sangat penting dan sering digunakan dalam ilmu kimia. Penentuan pH suatu larutan digunakan alat pH-meter.
5. pH-meter
PH meter adalah sebuah alat elektronik yang berfungsi untuk mengukur pH (derajat keasaman atau kebasaan) suatu cairan (ada elektroda khusus yang berfungsi untuk mengukur pH bahan-bahan semi-padat). Sebuah pH meter terdiri dari sebuah elektroda (probe pengukur) yang terhubung ke sebuah alat elektronik yang mengukur dan menampilkan nilai pH.
pH-meter dikelompokkan dalam :
Pembacaan langsung, emf sel yang berisi elektrode kaca dikenakan tahanan tinggi dan arus yang mengalir dalam tahanan itu kemudian digandakan dan diterapkan pada pengukur peka berupa kumparan yang bergerak. Pengukur ini dikalibrasi dalam mV sehingga emf sel terekam langsung. Karena kuantitas yang diukur adalah pH, maka skala itu dikalibrasi dalam satuan pH.
Pengukuran potensiometer, digunakan rangkaian potensiometeri bersama dengan suatu pengganda elektronik dan suatu miliammeter sebagai detektor titik berimbang. Potensiometer itu distandardisasi dengan suatu sel standard yyang terdapat dalam alat tsb, dan kemudian emf sel yang berisi elektrode kaca dikanakan pada potensiometer dan keseimbangan dapat dicapai.
Cara operasi pH-meter untuk tiap-tiap tipe dan merk pH-meter akan berbeda-beda, namun demikian secara umum cara operasional pH-meter adalah sebagai berikut :
1. Nyalakan alat dan biarkan sehingga alat melakukan pemanasan. 2. Set temperaturnya sesuai dengan temperatur larutan.
3. Celupkan elektrode ke dalam larutan standard, dan set skala pembacaan alat sesuai dengan pH larutan standard.
4. Ambil elektrode tersebut kemudian bilas dengan aquadest dan dilap, kemudian celupkan kembali kepada larutan standard yang lain, dan lakukan set kembali. 5. Ambil elektrode, bilas dengan aquadest, dan dilap. Untuk memastikan pembacaan
pH oleh alat telah baik, ulangi standardisasi alat lagi.
6. Setelah pembacaan baik, baru kemudian lakukan pengukuran untuk larutan yang akan diukur pH-nya.
7. Setelah selesai, ambil elektrode yang telah terpasang, bilas dengan aquadest, dan biarkan tercelup dalam aquadest yang baru.
C. Alat dan Bahan - Alat: 1. pH meter 2. Statif 3. Neraca Analitik 4. Sendok sungu 5. Kaca arloji 6. Pipet tetes 7. Pipet volume 25 mL, 50 mL 8. Buret 50 mL 9. Erlenmeyer 250 mL 10. Gelas beaker 100 mL, 250 mL 11. Labu ukur 1000 mL,500 mL 12. Corong 13. Labu semprot 14. Batang pengaduk 15. Magnetik stir
- Bahan: 1. Larutan buffer pH 7 2. H3PO4 0,1 N 3. NaOH 0,2 N 4. NaH2PO4 0,1 N 5. Aquades 6. Indikator MO 7. Indikator MM 8. Indikator PP D. Langkah Kerja
I. Persiapan alat dan bahan. a. Pembuatan H3PO4 0,1 N
1. H3PO4 ditimbang sebanyak 0,816 gram.
2. H3PO4 dilarutkan dalam 250 mL aquadest dengan menggunakan labu ukur.
b. Pembuatan NaOH 0,2 N
1. NaOH ditimbang sebanyak 4 gram.
2. NaOH dilarutkan dalam 500 mL aquadest dengan menggunakan labu ukur. c. Pembuatan NaH2Cl 0,1 N
1. NaH2Cl ditimbang sebanyak 0,47 gram.
2. NaH2Cl dilarutkan dalam 100 mL aquades dengan menggunakan labu ukur.
II. Pengaruh pH terhadap fungsi konsentrasi
1. Alat pH meter distandarisasi terlebih dahulu dengan menggunakan larutan standar yang tersedia yaitu larutan buffer pH 7.
2. Larutan H3PO4 0,1 N sebanyak 100 mL dimasukkan kedalam gelas beaker
dan kemudian diaduk menggunakan cara manual.
3. Setelah diaduk, larutan H3PO4 0,1 N diukur pH-nya menggunakan pH meter.
4. Akuades sebanyak 25 mL ditambahkan kedalam larutan H3PO4 0,1 N tadi.
Kemudian diaduk mengggunakan magnetic stir.
6. Langkah kerja poin 4 dan 5 diulangi sampai memperoleh 4 titik percobaan. 7. Langkan 1 sampai 6 diulang dengan mengganti larutan memakai NaOH 0,2
N dan larutan garam NaH2Cl 0,1 N.
8. Hasil pengamatan dicatat.
III. Penentuan grafik titrasi dengan menggunakan pH-meter
1. Alat pH meter distandarisasi terlebih dahulu dengan menggunakan larutan standar yang tersedia.
2. Alat kerja dirangkai sesuai dengan gambar 2.
3. Larutan H3PO4 0,1 N sebanyak 100 mL dimasukkan kedalam gelas beaker,
dan diukur pH-nya menggunakan pH meter. 4. Larutan NaOH 0,2 N dimasukkan kedalam buret.
5. Larutan H3PO4 0,1 N tadi ditambahkan NaOH sebanyak 1 mL dari buret
sambil terus diaduk dengan magnetik stir. Kemudian diukur pH-nya menggunakan pH meter.
6. Langkah kerja pada poin 5 diulangi dengan terus menambahkan NaOH 0,2 N sebanyak 1 ml hingga pH larutan berubah menjadi 5
7. Penambahan NaOH 0,2 N diubah menjadi 0,5 ml hingga pH berubah menjadi 6
8. Penambahan NaOH 0,2 N diubah kembali menjadi 1 ml hingga pH berubah menjadi 8
9. Penambahan NaOH 0,2 N diubah menjadi 0,5 ml hingga pH berubah menjadi 12
E. Data Pengamatan
1. Pembuatan Larutan
a) Pembuatan Larutan NaOH 0,2 N
NaOH kristal gram menimbang praktik ara gram gram mL mol g gram massa N mLpelarut mol g Mr gram massa N 0501 , 4 sec 4 500 1000 / 40 ) ( 2 , 0 1000 ) / ( ) (
b) Pembuatan Larutan Na2HPO4 0,1 N
gram menimbang praktik ara gram gram mL mol g gram massa N mLpelarut BE gram massa N 4710 , 0 sec 47 , 0 100 1000 3 / 96 , 141 ) ( 1 , 0 1000 ) ( c) Pembuatan Larutan H3PO4 0,1 N gram menimbang praktik ara gram gram mL mol g gram massa N mLpelarut BE gram massa N 8120 , 0 sec 816 , 0 250 1000 3 / 98 ) ( 1 , 0 1000 ) ( 2. Kalibrasi pH Meter AutoCal Merk 1 #1 7,00 20,9 Mv 29,7 0C Slp : -59,2 mV/pH Asy : 18,8Mv Sensor ++
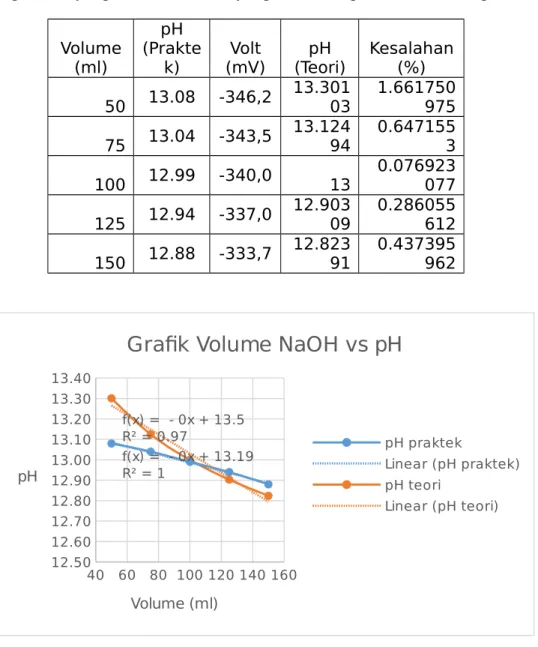
3. Fungsi Konsentrasi terhadap terhadap pH larutan NaOH 0,2 N Volume Basa (mL) pH mV 50 mL 13,08 -346,2 50 mL + 25 mL aquades 13,04 -343,5
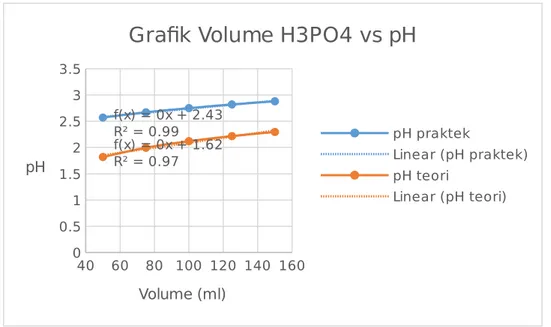
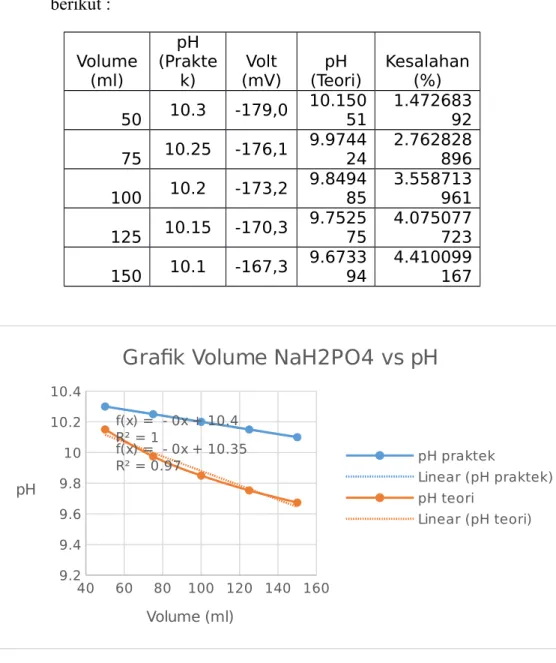
75 mL + 25 mL aquades 12,99 -340,0 100 mL + 25 mL aquades 12,94 -337,0 125 mL + 25 mL aquades 12,88 -333,7 H3PO4 0,1 N Volume Asam (mL) pH mV 50 mL 2,57 285,4 50 mL + 25 mL aquades 2,67 279,4 75 mL + 25 mL aquades 2,75 274,3 100 mL + 25 mL aquades 2,82 270,3 125 mL + 25 mL aquades 2,88 266,8 Na2HPO4 0,1 N Volume Garam (mL) pH mV 50 mL 10,30 -179,0 50 mL + 25 mL aquadest 10,25 -176,1 75 mL + 25 mL aquades 10,20 -173,2 100 mL + 25 mL aquades 10,15 -170,3 125 mL + 25 mL aquades 10,10 -167,3
4. Hubungan antara pH/voltase dengan Volume Peniter Basa Volume Penambahan NaOH 0,1 N (mL) Derajat Keasaman (pH) Voltase (mV) 0 2,57 285,0 1 2,63 281,5 2 2,73 275,7 3 2,83 269,9 4 2,95 262,4 5 3,12 252,3 5,5 3,21 246,7 6 3,33 239,6 6,5 3,46 231,8 7 3,67 219,4 7,5 4,01 198,7 8 5,25 124,9 8,5 6,38 56,1
9,5 6,96 21,7 10,5 7,19 7,4 11,5 7,43 -6,5 12,5 7,64 -19,3 13,5 7,87 -33,3 14,5 8,17 -51,1 15 8,38 -64,0 15,5 8,84 -91,8 16 10,27 -177,6 16,5 11,08 -226,3 17,5 11,46 -249,4 18,5 11,68 -262,4 19,5 11,83 -270,7 20,5 11,94 -277,8 21,5 12,03 -283,2 22,5 12,14 -290,4 F. Perhitungan
1. Pengaruh pH terhadap fungsi konsenterasi a. NaOH 100 ml 0.2 N + Aquadest
N1 x V1 = N2 x V2
0.2 N1 x 100 ml = N2 x 100 ml
N2 = 0.2
pOH = - log (OH+)
= - log (0.2) = 0.69 pH = 14 – pOH
= 14 – 0.69 = 13.31
Kesalahan = ¿hasil teori−hasil praktik∨ ¿ hasil teori
= ¿13.31−13.08∨ ¿ 13.31
¿ x 100%
= 1.6 %
Dengan cara yang sama untuk data yang berbeda diperoleh hasil sebagai berikut : Volume
(ml)
pH (Prakte
k) (mV)Volt (Teori)pH Kesalahan(%) 50 13.08 -346,2 13.30103 1.661750975 75 13.04 -343,5 13.12494 0.6471553 100 12.99 -340,0 13 0.076923077 125 12.94 -337,0 12.90309 0.286055612 150 12.88 -333,7 12.82391 0.437395962 40 60 80 100 120 140 160 12.50 12.60 12.70 12.80 12.90 13.00 13.10 13.20 13.30 13.40 f(x) = - 0x + 13.5 R² = 0.97 f(x) = - 0x + 13.19 R² = 1
Grafik Volume NaOH vs pH
pH praktek Linear (pH praktek) pH teori Linear (pH teori) Volume (ml) pH b. H3PO4 100 ml 0.1 N + Aquadest N1 x V1 = N2 x V2 0.1 N x 100 ml = N2 x 100 ml N2 = 0.1 N M2 = 0.1/3 M
H+ =
√
Kb× M =√
6.9× 10−3×0.13 = 0.0152 M pH = - log H+ = - log 0.0152 M = 1.82Kesalahan = ¿hasil teori−hasil praktik ∨ ¿ hasil teori ¿ x 100% = 2.57−1,82∨ ¿ 2.57 ¿ x 100% = 41.3 %
Dengan cara yang sama untuk data yang berbeda diperoleh hasil sebagai berikut : Volume (ml) pH (Prakte k) Volt (mV) pH (Teori) Kesalahan (%) 50 2.57 285,4 1.819136 41.27585206 75 2.67 279,4 1.995227 33.81933703 100 2.75 274,3 2.120166 29.70682009 125 2.82 270,3 2.217076 27.19455195 150 2.88 266,8 2.296257 25.42148277
40 60 80 100 120 140 160 0 0.5 1 1.5 2 2.5 3 3.5 f(x) = 0x + 1.62 R² = 0.97 f(x) = 0x + 2.43 R² = 0.99
Grafik Volume H3PO4 vs pH
pH praktek Linear (pH praktek) pH teori Linear (pH teori) Volume (ml) pH
c. Larutan garam NaH2OH 100 mL 0.1 N + Aquadest
N1 x V1 = N2 x V2 0.1 N1 x 100 ml = N2 x 100 ml N2 = 0.1 M2 = 0.1/3 M H+ =
√
Kb× M =√
1.8× 10−5×0.13 = 7.75 x 10-4M pH = 14 - (- log [H+]) = 14 – (- log 7.75 x 10-4M) = 10.2Kesalahan = ¿hasil teori−hasil praktik ∨ ¿ hasil teori ¿ x 100% = ¿10.3−10.2∨ ¿ 10.2 ¿ x 100%
= 1.5 %
Dengan cara yang sama untuk data yang berbeda diperoleh hasil sebagai berikut : Volume (ml) pH (Prakte k) Volt (mV) pH (Teori) Kesalahan (%) 50 10.3 -179,0 10.150 51 1.472683 92 75 10.25 -176,1 9.974424 2.762828896 100 10.2 -173,2 9.849485 3.558713961 125 10.15 -170,3 9.752575 4.075077723 150 10.1 -167,3 9.673394 4.410099167 40 60 80 100 120 140 160 9.2 9.4 9.6 9.8 10 10.2 10.4 f(x) = - 0x + 10.35 R² = 0.97 f(x) = - 0x + 10.4 R² = 1
Grafik Volume NaH2PO4 vs pH
pH praktek Linear (pH praktek) pH teori Linear (pH teori) Volume (ml) pH
2. Penentuan grafik titrasi dengan menggunakan pH-meter
Apabila dibuat grafik antara volume NaOH yang ditambahkan vs perubahan pH yang terjadi maka akan terbentuk kurva seperti di bawah ini:
0 5 10 15 20 25 30 35 0 2 4 6 8 10 12 14 f(x) = 0.4x + 0.86 R² = 0.96
Grafik pH
Volume (ml) pHSelain itu juga dapat dilakukan perhitungan untuk membandingkan apakah titik ekuivalen berada di 23 ml untuk Na3PO4, 22 ml untuk Na2HPO4, dan 12 ml untuk
NaH2PO4.
Untuk Na3PO4:
n NaOH = n H3PO4
N NaOH.V NaOH = N H3PO4.V H3PO4
0,2 N.V NaOH = 0,1 N .50 mL. V NaOH = 5 N . mL 0,2 N V NaOH = 25 mL Persen kesalahan = 100% hasil teori hasil praktek
hasil teori = ¿23 mL−25 mL∨ ¿ 50 mL ¿ x 100% = 8 % G. Pembahasan
Pada percobaan pertama dimana dilakukan perbandingan antara konsentrasi dan nilai PH didapat beberapa grafik yang menampilkan bahwa nilai PH memang dipengaruhi oleh konsentrasi. Contohnya pada NaOH dan H3PO4 dimana nilai PH keduanya semakin
mendekati netral seiring dengan berkurangnya konsentrasi (pengenceran). Hal ini dikarenakan jumlah PH tergantung pada konsentrasi H+ yang terdapat pada satu larutan
dalam satuan molar. Konsentrasi pada satuan molar ini akan dipengaruhi oleh pengenceran sehingga penghitungan H+ pun berubah dan nilai PH mendekati netral.
Pada percobaan kedua yaitu pembuatan grafik titrasi antara asam pospat dengan natrium hidroksida dapat terlihat grafik tersebut seperti mempunyai 3 titik ekuivalen. Hal ini terjadi karena asam pospat memiliki 3 atom H atau asam poliprotik sehingga ketiga H ini terurai secara terpisah. Jadi proses pertama adalah pembentukan H2NaPO4 yang
menghasilkan titik ekuivalen pertama. Kemudian terbentuk HNa2PO4 yang menghasilkan
titik ekuivalen ketiga. Dan terakhir terbentuknya garam natrium pospat yang menghasilkan titik ekuivalen yang terakhir. Tetapi titik ekuivalen yang sebenarnya terjadi pada proses titrasi asam pospat dengan natrium hidroksida adalah saat pembentukan garam Na3PO4 dimana secara praktik didapat pada penambahan 23mL NaOH. Karena
pada titik ini kedua larutan mencapai PH ekuivalen nya dan menghasilkan kesetimbangan.
H. Kesimpulan
1. Larutan asam jika diencerkan, maka pHnya akan naik mendekati netral, karena konsentrasi H+ semakin kecil.
2. Larutan basa jika diencerkan, maka pHnya akan turun mendekati netral, karena konsentrasiOH- semakin kecil.
3. Titrasi alkalimetri dapat diamati dengan melakukan titrasi antara H3PO4 dengan
NaOH secara teliti.
4. Titik ekuivalen titrasi H3PO4 dan NaOH memiliki titik ekuivalen membentuk
garam Na3PO4 secara praktik 23 ml dan secara teori 25 ml.
5. Kesalahan volume NaOH sebesar 8 persen. I. Daftar Pustaka.
Anonimus.2015.PH.http://id.wikipedia.org/wiki/PH pada tanggal 17 November 2015
Handoyo, Haries dkk.2006. Petunjuk Praktikum Instrumentasi Kimia: PH METER. Yogyakarta : STTN-BATAN.
Susilowati, Endang.2009.Theory and Aplication of Chemistry: 2.Solo : Tiga Serangkai.
Vogel, Arthur Israel. 1994. Buku Ajar Vogel : Kimia Analisis Kuantitatif Anorganik. Jakarta : Kalman Media Pustaka.s
Yogyakarta, 18 November 2015 Asisten Praktikan,