LAPORAN RESMI PRAKTIKUM KIMIA
TITRASI ASAM BASA
Disusun oleh :
Nama
: Elisabeth Sekar Chrisnamurti
No
: 19
Kelas
: XI-MIA 3
SMA NEGERI 1 WATES
TITRASI ASAM BASA
I.
TUJUAN
Menyelidiki konsentrasi asam cuka pasaran dan basa sampel pada sabun.
II.
MASALAH
Bagaimana melakukan titrasi untuk menyelidiki konsentrasi larutan sampel asam dan sampel basa dengan titrasi asam-basa?
III.
Dasar Teori
Salah satu penerapan reaksi netralisasi adalah titrasi. Titrasi merupakan prosedur yang bertujuan untuk menentukan banyaknya suatu larutan dengan konsentrasi yang telah diketahui agar tepat habis bereaksi dengan sejumlah larutan yang dianalisis (ingin diketahui kadarnya). Titrasi yang mengacu pada sejumlah volume larutan dikenal dengan istilah titrasi volumetrik. Pengukuran volume diusahakan setepat mungkin menggunakan alat buret, pipet gondok, dan pipet volumetrik.
Titrasi yang melibatkan reaksi antara asam dan basa dikenal dengan istilah titrasi asam basaatauasidi alkalimetri. Titrasi dilakukan dengan cara mereaksikan sedikit demi sedikit atau tetes demi tetes larutan basa atau asam melalui buret ke dalam larutan asam atau basa dengan volume tertentu yang terletak dalam labu erlenmeyer (sambil digoyang) sampai keduanya tepat habis bereaksi, ditandai dengan berubahnya warna indikator.
Tepat pada saat warna indikator berubah, penambahan (titrasi) dihentikan dan volumenya dicatat sebagai volume titik akhir titrasi. Larutan yang diletakkan di dalam buret disebut
larutan penitrasi. Indikator yang digunakan pada titrasi asam basa adalah indikator yang mempunyai trayek perubahan warna pada pH sekitar 7, sebab pada saat asam kuat dan basa kuat telah tepat habis bereaksi, pada saat itu pH larutan akan sama dengan 7.
Perubahan warna indikator menandai tepat bereaksinya kedua larutan tidak selamanya tepat seperti perhitungan secara teoritis. Volume larutan penitrasi yang diperoleh melalui perhitungan secara teoritis disebut dengan volume titik ekivalen. Perbedaan volume titik akhir titrasi dengan titik ekivalen disebut dengan kesalahan titrasi. Besar kecilnya kesalahan titrasi ditentukan leh pemilihan indikator. Jika indikatornya semakin tepat, kesalahan titrasinya kecil. Perhitungan untuk penetralan asam dan basa digunakan rumus berikut (bila tepat bereaksi)
IV.
Alat dan Bahan
Alat :
Buret 2 buah
Statif dan klem 2 buah
Corong kaca 2 buah
Labu erlenmeyer 2 buah
Pipet tetes 2 buah
Pipet tetes 2 buah
Gelas kimia 150 mL 2 buah
Bahan :
Larutan standar NaOH 0,1 M
Larutan standar HCl 0,1 M
Larutan sampel cuka pasaran
Larutan sampel sabun
Indikator penolftalein (PP)
V.
Cara Kerja
A. Menentukan konsentrasi asam cuka
1. Merangkai alat untuk titrasi dengan cermat dan hati-hati.
2. Memasukkan larutan standar NaOH 0,1 M ke dalam buret dengan corong sampai tanda skala nol.
3. Memasukkan 5 mL larutan sampel asam cuka yang telah diencerkan ke dalam labu erlenmeyer dan menambahkan 2 (dua) tetes indikator PP.
4. Menitrasi sampel dengan cara membuka kran buret dengan tangan kiri sehingga larutan standar keluar tetes demi tetes.
5. Memegang labu erlenmeyer dengan tangan kanan dan menggoyang pelan-pelan agar larutan penitrasi bercampur dengan baik.
6. Menghentikan titrasi dengan menutup kran buret ketika tepat terjadi perubahan warna pada larutan sampel pada erlenmeyer (titik ekivalen terjadi saat larutan sampel tepat berubah warna menjadi merah muda).
7. Mencatat beberapa mL larutan standar pada buret yang diperlukan. 8. Mengulangi langkah 2 s.d 6 sekali lagi agar diperoleh data yang valid.
B. Menentukan konsentrasi larutan sampel sabun
1. Melakukan prosedur 1 s.d 8 seperti di atas dengan larutan sampel sabun dan larutan standar HCl 0,1 M dengan rangkaian alat yang ada.
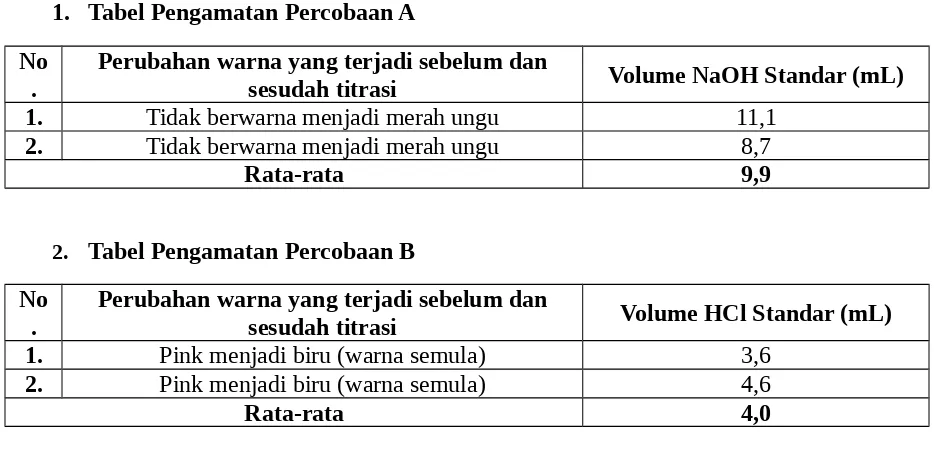
1. Tabel Pengamatan Percobaan A No
.
Perubahan warna yang terjadi sebelum dan
sesudah titrasi Volume NaOH Standar (mL) 1. Tidak berwarna menjadi merah ungu 11,1
2. Tidak berwarna menjadi merah ungu 8,7
Rata-rata 9,9
2. Tabel Pengamatan Percobaan B No
.
Perubahan warna yang terjadi sebelum dan
sesudah titrasi Volume HCl Standar (mL) 1. Pink menjadi biru (warna semula) 3,6
2. Pink menjadi biru (warna semula) 4,6
Rata-rata 4,0
VII. Pembahasan
1. Perubahan warna apa yang terjadi pada larutan sampel dalam erlenmeyer pada percobaan A maupun percobaan B? jelaskan mengapa demikian!
Jawab :
Pada percobaan A terjadi perubahan warna dari tak berwarna menjadi merah ungu karena cuka yang merupakan basa lemah pHnya tidak terbaca oleh penolftalen yang skala pHnya 8,3-10. Lalu cuka yang dititrasi dengan NaOHyang merupakan basa kuat akan berubah warnanya karena terjadi reaksi penetralan.
Sedangkan pada percobaan B, terjadi perubahan warna dari merah ungu menjadi biru (warna sabun semula) karena sabun yang merupakan basa lemah dititrasi oleh HCl yang merupakan asam kuat, maka pH sabun akan turun dan terjadi perubahan warna karena reaksi penetralan juga.
2. Tuliskan reaksi kimia yang terjadi untuk masing-masing percobaan! Jawab :
Percobaan A :
CH3COOH (aq) + NaOH (aq) CH3COONa (aq) + H20 (l)
Percobaan B :
R-COONa (aq) + HCl (aq) R-COOH (aq) + NaCl (aq)
3. Hitung konsentrasi larutan sampel cuka pasaran dan larutan sampel sabun dengan rumus titrasi!
Konsentrasi larutan sampel cuka pasaran (NaOH 0,1 M dengan volume 9,9 ml dan CH3COOH dengan volume 5ml)
n asam = n basa a Va Ma = b Vb Mb
1 × 5 × Ma = 1× 9,9 × 0,1
5 Ma = 0,99
Ma = 0,995
Ma = 0,198 M
Konsentrasi larutan sampel sabun ( R-COONa dengan volume 5 ml dan HCl 0,1 M dengan volume 4 ml)
n asam = n basa a Va Ma = b Vb Mb
1 × 4 × 0,1 = 1 × 5 × Mb
0,4 = 5 Mb
Mb =
0,4 5 Mb = 0,08 M
VIII. Kesimpulan
Dari praktikum yang telah dilakukan, maka dapat diambil kesimpulan bahwa dalam penerapan reaksi penetralan dengan titrasi, bisa diketahui banyaknya larutan atau konsentrasi dengan cara mentitrasinya dengan larutan yang sudah diketahui kadarnya terlebih dahulu. Caranya yaitu dengan meneteskan tetes demi tetes larutan penitrasi ke dalam larutan yang akan dicari tahu kadarnya sambil menggoyangkan tempat (labu erlenmeyer) larutan yang dicari kadarnya sampai tepat habis bereaksi, tandanya yaitu dengan perubahan warna pada indikator. Indikator yang digunakan yang mendekati benar adalah penolftalen karena trayek pHnya ± 7. Setelah itu, untuk mengetahui kadar konsentrasinya dapat digunakan rumus titrasi, yaitu a Va Ma = b Vb Mb.
Dari praktikum tersebut, dapat diketahui bahwa konsentrasi asam cuka pasaran sebesar 0,198 M sedangkan konsentrasi basa sampel pada sabun adalah sebesar 0,08 M.
IX.
Daftar Pustaka
Sudarmo, Unggul. 2013. KIMIA untuk SMA/MA kelas XI. Jakarta : Erlangga.