LAPORAN PRAKTIKUM
KIMIA
Nama
:
Sultan Mufti R. A.
Kelas
:
XI MS 4
Kelompok
:
4
Hari/
Tanggal
:
Senin, 11 April 2016
Judul
Percobaan
:
Titrasi Asam Basa
SMA NEGERI 1 CURUP
KABUPATEN REJANG LEBONG
PROVINSI BENGKULU
A. Judul
Titrasi Asam Basa
B. Tujuan Percobaan
-Menentukan konstentrasi asam maupun basa dengan menggunakan metode titrasi asam basa
-Menggambarkan grafik titrasi asam basa
C. Pendahuluan -Pengertian
Titrasi merupakan suatu metoda untuk menentukan kadar suatu zat dengan menggunakan zat lain yang sudah dikethaui konsentrasinya. Titrasi biasanya dibedakan berdasarkan jenis reaksi yang terlibat di dalam proses titrasi, sebagai contoh bila melibatan reaksi asam basa maka disebut sebagai titrasi asam basa, titrasi redox untuk titrasi yang melibatkan reaksi reduksi oksidasi, titrasi kompleksometri untuk titrasi yang melibatan pembentukan reaksi kompleks dan lain sebagainya. (disini hanya dibahas tentang titrasi asam basa)
Zat yang akan ditentukan kadarnya disebut sebagai “titrant” dan biasanya diletakan di dalam Erlenmeyer, sedangkan zat yang telah diketahui konsentrasinya disebut sebagai “titer” dan biasanya diletakkan di dalam “buret”. Baik titer maupun titrant biasanya berupa larutan. Titrasi merupakan metode analisis kimia secara kuantitatif yang biasa digunakan dalam laboratorium untuk menentukan konsentrasi dari reaktan. Untuk menentukan konsentrasi suatu larutan dengan cara mereaksikan sejumlah volume larutan tersebut terhadap sejumlah volume larutan lain yang konsentrasinya sudah diketahui. Larutan yang konsentrasinya sudah diketahui disebut larutan baku. Larutan yang belum diketahui konsentrasinya ditambahkan beberapa tetes indikator, kemudian ditetesi dengan larutan yang sudah diketahui konsentrasinya. Titik akhir titrasi adalah tepat pada saat terjadi perubahan warna indikator.
Karena pengukuran volum memainkan peranan penting dalam titrasi, maka teknik ini juga dikenali dengan analisis volumetrik. Analisis titrimetri merupakan satu dari bagian utama dari kimia analitik dan perhitungannya berdasarkan hubungan stoikhiometri dari reaksi-reaksi kimia. Sebuah reagen yang disebut sebagai peniter, yang diketahui konsentrasi (larutan standar) dan volumnya digunakan untuk mereaksikan larutan yang dititer yang konsentrasinya tidak diketahui. Dengan menggunakan buret terkalibrasi untuk
menambahkan peniter, sangat mungkin untuk menentukan jumlah pasti larutan yang dibutuhkan untuk mencapai titik akhir.
Titik akhir adalah titik di mana titrasi selesai, yang ditentukan dengan indikator. Idealnya indikator akan berubah warna pada saat titik ekivalensi di mana volum dari peniter yang ditambahkan dengan mol tertentu sama dengan nilai dari mol larutan yang dititer. Dalam titrasi asam-basa kuat, titik akhir dari titrasi adalah titik pada saat pH reaktan hampir mencapai 7, dan biasanya ketika larutan berubah warna menjadi merah muda karena adanya indikator pH fenolftalein..
-Prinsip titrasi asam basa
Titrasi asam basa melibatkan asam maupun basa sebagai titer ataupun titrant. Titrasi asam basa berdasarkan reaksi penetralan. Kadar larutan asam ditentukan dengan menggunakan larutan basa dan sebaliknya.
secara stoikiometri titrant dan titer tepat habis bereaksi). Keadaan ini disebut sebagai “titik ekuivalen”.
Pada saat titik ekuivalent ini maka proses titrasi dihentikan, kemudian kita mencatat
volume titer yang diperlukan untuk mencapai keadaan tersebut. Dengan menggunakan data volume titrant, volume dan konsentrasi titer maka kita bisa menghitung kadar titrant.
-Cara mengetahui titik Ekuivalen
Ada dua cara umum untuk menentukan titik ekuivalen pada titrasi asam basa.
1. Memakai pH meter untuk memonitor perubahan pH selama titrasi dilakukan, kemudian membuat plot antara pH dengan volume titrant untuk memperoleh kurva titrasi. Titik tengah dari kurva titrasi tersebut adalah “titik ekuivalent”.
2. Memakai indicator asam basa. Indikator ditambahkan pada titrant sebelum proses titrasi dilakukan. Indikator ini akan berubah warna ketika titik ekuivalen terjadi, pada saat inilah titrasi kita hentikan.
Pada umumnya cara kedua dipilih disebabkan kemudahan pengamatan, tidak diperlukan alat tambahan, dan sangat praktis.
Indikator yang dipakai dalam titrasi asam basa adalah indicator yang perbahan warnanya dipengaruhi oleh pH. Penambahan indicator diusahakan sesedikit mungkin dan umumnya adalah dua hingga tiga tetes.
Untuk memperoleh ketepatan hasil titrasi maka titik akhir titrasi dipilih sedekat mungkin dengan titik equivalent, hal ini dapat dilakukan dengan memilih indicator yang tepat dan sesuai dengan titrasi yang akan dilakukan.
Keadaan dimana titrasi dihentikan dengan cara melihat perubahan warna indicator disebut sebagai “titik akhir titrasi”.
-Rumus umum titrasi
Pada saat titik ekuivalen maka mol-ekuivalent asam akan sama dengan mol-ekuivalent basa, maka hal ini dapat kita tulis sebagai berikut:
mol-ekuivalen asam = mol-ekuivalen basa
Mol-ekuivalen diperoleh dari hasil perkalian antara Normalitas dengan volume maka rumus diatas dapat kita tulis sebagai:
N
x
V
asam =
N
x
V
basa
Normalitas diperoleh dari hasil perkalian antara molaritas (M) dengan jumlah ion H+ pada asam atau jumlah ion OH pada basa, sehingga rumus diatas menjadi:
n
x
M
x
V
asam =
n
x
V
x
M
basa
Beberapa jenis titrasi diantaranya adalah :
1.Titrasi asam basa : titik akhir titrasi adalah titik pada saat pH reaktan = 7 dan biasanya ketika larutan berubah warna menjadi merah muda karena adanya indikator pH fenolftaelin (contoh).
2.Titrasi konduktometri : konduktivitas larutan bergantung pada beberapa faktor, yaitu konsentrasi, derajat disosiasi, ion valensi, temperatur, dan mobilitas ion suatu larutan. Titik akhir titrasi dicapai ketika nilai konduktansi reaktans berada pada posisi paling rendah, karena penanbahan larutan titrant akan menaikkan nilai konduktansi lagi. Grafik yang terbentuk berbentuk V.
3.Titrasi argentometri : pembentukan endapan dengan ion Ag+. Larutan analit yang telah dibubuhi indikator dicampur dengan larutan standar garam perak nitrat (AgNO3). Dengan mengukur volume larutan standar (titrant) yang digunakan sehingga ion Ag+ tepat
diendapkan, kadar garam larutan analir dapat ditentukan.
4.Titrasi redoks : suatu penetapan kadar reduktor atau oksidator berdasarkan atas reaksi redoks dimana reduktor akan teroksidasi dan oksidator akan tereduksi.
5.Titrasi kompleksimetri, titrasi khusus, dll.Cara Menentukan Konsentrasi Larutan Dalam menentukan konsentrasi suatu larutan, sesuaikanlah dengan jenis reaksinya.Titrasi netralisasi adalah titrasi yang didasarkan pada reaksi antara suatu asam dengan basa. H3O+ + OH– ⇔ 2 H2O
Dalam titrasi ini berlaku hubungan :
jumlah ekivalen asam (H3O+) sama dengan jumlah ekivalen basa (OH–). Larutan baku yang digunakan pada titrasi netralisasi adalah asam kuat atau basa kuat, karena zat-zat tersebut bereaksi lebih sempurna dengan analit dibandingkan dengan jika dipakai asam atau basa yang lebih lemah. Larutan baku asam dapat dibuat dari HCl, H2SO4 atau HClO4, sedangkan larutan baku basa dibuat dari NaOH atau KOH. Larutan baku primer adalah larutan yang konsentrasinya dapat ditentukan dengan perhitungan langsung dari berat zat yang mempunyai kemurnian tinggi, stabil dan bobot ekivalen tinggi kemudian dilarutkan sampai volume tertentu. Sedangkan larutan baku sekunder, konsentrasinyaharus ditentukan terlebih dahulu dengan pembakuan/standarisasi terhadap baku primer. asam basa lemah dengan basa/asam kuat seperti:
Kedua contoh terakhir di atas menggambarkan titrasi garam monofungsional. Garam-garam tersebut dalam air mengalami hidrolisis menghasilkan larutan yang bersifat asam atau basa. Apakah garam-garam ini dititrasi dengan asam atau basa bergantung pada nilai Ka dan Kb. Bila nilai Ka>Kb (larutan lebihbersifat asam), maka garam tersebut dapat dititrasi dengan basa,bila sebaliknya (Ka<Kb), garam tersebut dapat dititrasi dengan asam.Titik ekivalendicapai pada pH larutan CH3COOH atau NH4OH.
- Titik akhir titrasi dan pemilihan indikator
Titik akhir titrasi ditentukan dengan memilih indikator yang warnanya berubah sekitar titik ekivalen. Misalnya pada titrasi larutan garam Na2CO3 dengan larutan HCl, titik ekivalen pertama terjadi pada [H3O+] = √K1K2 nilai pH sekitar 8,35. Jadi indikator yang dapat digunakan adalah fenolftalein (8,1 – 10) yang berubah dari merah menjadi tidak berwarna. Pada titik ekivalen kedua, [H3O+] = √Ka1 nilai pH = 3,17; dan indikator yang sesuai adalah jingga metil. Dengan indikator ini perubahan warna yang diamati kurang tajam. Untuk memperbaiki pengamatan pada titik ekivalen ini, larutan dapat dididihkan terlebih dahulu, sehingga gas CO2keluar dan sifat larutan ditentukan oleh garam NaCl yang tertinggal. Kelebihan asam dititrasi dengan larutan baku basa, dengan demikian dapat digunakan indikator metil jingga.Pada pemilihan indikator harus diperhitungkan pula zat apa yang digunakan sebagai titran (yang diisikan dalam buret). Misalnya pada titrasi larutan HCl dengan larutan NaOH. Jika larutan HCl dipakai sebagai titran, larutan analit bersifat basa, maka indikator fenolftalein yang ditambahkan pada analit berwarna merah. Hilangnya warna merah indikator terjadi pada pH 8,1; sedangkan titik ekivalen titrasi terdapat pada pH 7,0. Jadi hilangnya warna merah terjadi sebelum titik ekivalen tercapai. Karena itu sebaiknya dipakai indikator dengan trayek perubahan warna pada sebelum atau sekitar pH 7,0.
D. Alat dan bahan 1. Alat
No
. Nama alat Gambar Ukuran Jumlah
2. Statip dan klem
3. Corong
4. Gelas ukur
5. Pipet volume
6. Erlenmeyer
2. Bahan
No. Nama Bahan Ukuran Jumlah
1 Larutan NaOH 0,1 M Secukupnya 2 Larutan HCl Yang dicari Secukupnya 3 Indikator Fenolftalein - Secukupnya 4 Akuades - Secukupnya 5 Kertas Putih - Secukupnya
E. Prosedur kerja
1. Masukkan larutan NaOH ke dalam biuret dengan menggunakan corong sampai volume melebihi skala nol buret. Kemudian atur larutan NaOH pada buret tepat pada skala nol.
2. Ambil 10 ml HCl dengan menggunakan pipet gondok/ pipet volume dan masukkan ke dalam erlenmeyer.
3. Setelah itu, tambahkan 3 tetes indikator fenolftalein ke dalam erlenmeyer yang sudah berisi larutan HCl tersebut.
4. Lakukan titrasi dengan meneteskan larutan NaOH dari buret secara perrlahan sampai larutan berubah warna menjadi merah muda (pink)
5. Setelah berubah menjadi warna pink, hentikan titrasi dan catat volume larutan NaOH dalam buret.
6. Ulangi prosedur diatas sebanyak 3 kali.
7. Kemudian hitung konsentrasi larutan HCl dengan menggunakan rumus
V1 x N1 = V2 x N2
F. Hasil pengamatan (HCl-NaOH)
Percobaan Volume HCl yang dititrasi Volume NaOH yang akan digunakan
1 10 ml 13
2 10 ml 12
3 10 ml 12,5
G. Jawablah pertanyaan! Pertanyaan
1. Pada pH berapa titik ekivalen terjadi ? Jelaskan
2. Berapa konsentrasi HCl yang diperoleh ? Jelaskan dengan menggunakan perhitungan !
3. Dapatkah indikator metil merah digunakan dalam titrasi asam basa pada percobaan diatas? Mengapa?
1. Pada pH 7 karena HCl asam kuat dan NaOH basa kuat dan tidak ada kelebihan OH- dan H+ sehingga bersifat netral.
2. Konsentrasi HCl vol. total ¿13+123+12,5
=
37,53=
12,5Dik : HCL V1 = 10 ml NaOH M2 = 0,1 M
NaOH V2 = 12,5
V1 x N1 = V2 x N2 10 x N1 = 12,5 x 0,1
N1 = 12,510x0,1= 0,13
3. Tidak bisa karena indikator metil merah memiliki harga pH 4,2 – 6,3
H. Pembahasan
Dalam percobaan kali ini yaitu mengenai titrasi asam basa dengan tujuan supaya siswa bisa menentukan konsentrasi baik asam maupun basa dengan menggunakan metode titrasi asam basa. Serta supaya siswa juga bisa menggambarkan grafik dari titrasi asam basa tersebut.
Sebelum memulai percobaan, terlebih dahulu kita menghitung konsentrasi HCl yang telah kita praktekkan sebelumnya sesuai dengan prosedur kerja. Untuk menghitung konsentrasi HCl kita menggunakan rumus V1 x N1 = V2 x N2 .
V1 x N1 = V2 x N2
10 x N1 = 12,5 x 0,1
N1 = 12,510x0,1= 0,13
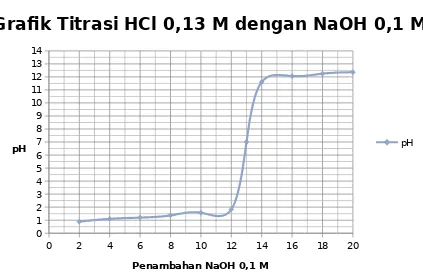
Kemudian setelah mengetahui konsentrasi dari HCl kita diminta untuk membuat grafik titrasi asam basa antara NaOH dan HCl. Namun sebelum membuat grafik, kita harus mencari terlebih dahulu pH dari HCl. Untuk mengetahui hal itu kita dapat mencarinya sebagai berikut.
Diketahui:
M = 0,13 M
Mol HCL = 10 mL X 0,13 M = 1,3 mmol 1. Sebelum penambahan NaOH (0 mL)
= 2 – 0,95 = 1,05
6. Penambahan 10mL NaOH (mol 10mL NaOH = 10 x 0,1 = 1mmol) HCl = 1,3 mmol, NaOH = 1 mol, M = 0,3/ 20 = 0,015 = 1,5 x 10-2
pH = - log H+
= - log 1,5 x 10-2
= 2 – log 1,5 = 2 – 0,17 = 1,83
7. Penambahan 12 mL NaOH (mol 12 mL NaOH = 1,2mmol)
HCl = 1,3 mmol, NaOH = 1,2mmol, M = 0,1/ 22 = 0,0045 = 4,5 x 10-3
8. Penambahan 13mL NaOH (mol 13 mL NaOH = 1,3mmol) HCl = 1,3 mmol, NaOH = 1,3mmol , (TITIK EKIVALEN) pH = 7
9. Penambahan 14mL NaOH (mol 14mL NaOH = 1,4mmol)
10. Penambahan 16 mL NaOH (mol 16mL NaOH = 1,6mmol)
11. Penambahan 18 mL NaOH (mol 18 mL NaOH = 1,8mmol)
HCl = 1,3mmol, NaOH = 1,8mmol, Sisa NaOH = 0,5mmol, M = 0,5/28 = ,0178 =
12. Penambahan 20mL NaOH (mol 20mL NaOH = 2mmol)
HCl = 1,3mmol, NaOH = 2 mmol, Sisa NaOH = 0,7mmol, M = 0,7/30 = 0,023 =
Lampiran
Tabel dan Grafik Titrasi Asam Basa
0 2 4 6 8 10 12 14 16 18 20
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
Grafk Titrasi HCl 0,13 M dengan NaOH 0,1 M
pH
Penambahan NaOH 0,1 M pH
Volume NaOH 0,1 M yang ditambahkan HCL 0,13 MpH pada
2 0,89
4 1,1
6 1,2
8 1,37
10 1,57
12 1,83
13 7
14 11,61
16 12,06
18 12,25