LAPORAN RESMI PRAKTIKUM MATERI dan ENERGI
KONSTANTA KEASAMAN dan TITRASI ASAM BASA
Oleh
NAMA : ANGELIA ASTRIA NIM : 31160048
ASISTEN : YUMECHRIS AMEKAN, S.Si, M. Biotech.
PROGRAM STUDI BIOLOGI
FAKULTAS BIOTEKNOLOGI
UNIVERSITAS KRISTEN DUTA WACANA
BAB I
PENDAHULUAN
A. Latar Belakang
Dalam kehidupan sehari-hari, kita tidak dapat dilepaskan dari larutan asam dan larutan basa. Contohnya dalam budidaya ikan, kita harus mengetahui tingkat keasamaan atau kebasaan pada air yang digunakan dengan menghitung tingkat pH–nya. Kita dapat menghitung tingkat pH-nya apabila kita mengetahui konsentrasi larutan tersebut. Salah satu langkah yang paling efektif dan tepat adalah dengan melakukan titrasi. Penentuan normalitas NaOH dengan larutan standar asam oksalat dan penetapan kadar asam cuka perdagangan selalu dilakukan dengan cara titrasi. Penetapan kadar asam cuka
perdagangan dilakukan untuk mengetahui kebenaran kadar yang tertera pada etiket asam cuka yang dijual di pasaran. Oleh sebab itu, di lakukan praktikum ini untuk memahami prinsip titrasi asam basa.
B. Tujuan
BAB II
LANDASAN TEORI
Asam didefinisikan sebagai senyawa yang mengandung Hidrogen yang bereaksi dengan basa. Basa adalah senyawa yang mengandung ion atau menghasilkan OH-ketika bereaksi dengan air. Basa bereaksi dengan asam untuk menghasilkan garam dan air.)Teori Bronsted memperluas definisi asam dan basa dengan menjelaskan lebih banyak mengenai suatu larutan kimia. Misalnya, teori Bronsted menjelaskan lebih banyak mengenai suatu larutan amonium klorida bersifat asam dan larutan natrium asetat bersifat basa. Dalam teori Bronsted, asam didefinisikan sebagai suatu zat yang dapat memberikan proton kepada zat yang lain . Dalam hali ini , proton adalah atom hidrogen yang kehilangan elektronnya. Basa adalah zat yang menerima proton dari zat lain. Reaksi asam dan basa menghasilkan menghasilkan asam dan basa yang lain (Golberg, 2002).
Menurut Arrhenius asam adalah zat yang bila dilarutkan dalam air terionisasi menghasilkan ion H+ dalam larutannya. Sedangkan basa adalah zat yang bila dilarutkan dalam air terionisasi menghasilkan ion OH-. Menurut lewis, asam adalah suatu spesies yang dapat menerima pasangan elektron bebas (akseptor pasangan elektron) dalam suatu reaksi kimia. Basa adalah suatu spesies yang dapat memberikan pasangan elektron bebas (donor pasangan elektron) (Anonim, 2008).
Titrasi asam basa sering disebut asidimetri-alkalimetri, sedang untuk titrasi atau pengukuran lain-lain sering juga dipakai akhiran –ometri menggantikan –imetri. Kata
metri berasal dari bahasa Yunani dan berarti ilmu, proses atau seni mengukur; i dan o
dalam hubungan dengan metri berarti sama saja, yaitu dengan atau dari (with atau if), akhiran –i berasal dari bahasa Latin dan –o dari bahasa Yunani. Jadi, asidimetri dapat diartikan pengukuran jumlah asam ataupun pengukuran dengan asam (yang diukur jumlah asam atau garam) (Harjadi, 1985).
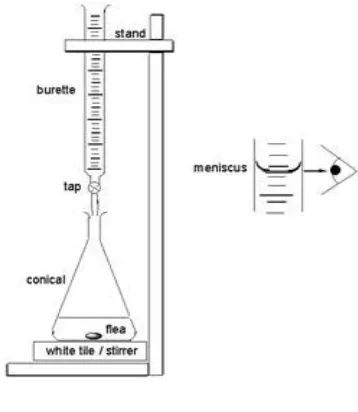
Gambar set alat titrasi
Titrasi asam basa melibatkan asam maupun basa sebagai titer ataupun titrant. Kadar larutan asam ditentukan dengan menggunakan larutan basa atau sebaliknya. Titrant ditambahkan titer tetes demi tetes sampai mencapai keadaan ekuivalen ( artinya secara stoikiometri titrant dan titer tepat habis bereaksi) yang biasanya ditandai dengan berubahnya warna indikator. Keadaan ini disebut sebagai “titik ekuivalen”, yaitu titik dimana konsentrasi asam sama dengan konsentrasi basa atau titik dimana jumlah basa yang ditambahkan sama dengan jumlah asam yang dinetralkan : [H+] = [OH-]. Sedangkan keadaan dimana titrasi dihentikan dengan cara melihat perubahan warna indikator disebut sebagai “titik akhir titrasi”. Titik akhir titrasi ini mendekati titik ekuivalen, tapi biasanya titik akhir titrasi melewati titik ekuivalen. Oleh karena itu, titik akhir titrasi sering disebut juga sebagai titik ekuivalen. Pada saat terjadi perubahan warna indikator, titrasi dihentikan. Indikator berubah warna pada saat titik ekuivalen. Pada saat titik ekuivalen maka mol-ekuivalen asam akan sama dengan mol-ekuivalen basa, maka hal ini dapat ditulis sebagai berikut:
mol-ekuivalen asam = mol-ekuivalen basa
Mol-ekuivalen diperoleh dari hasil perkalian antara normalitas (N) dengan volume, maka rumus diatas dapat ditulis sebagai berikut:
Dengan menggunakan data volume titran, volume dan konsentrasi titer maka bisa dihitung konsentrasi titran tersebut. Larutan yang mempunyai konsentrasi molar yang diketahui, dapat dengan mudah digunakan untuk reaksi-reaksi yang melibatkan prosedur kuantitatif. Kuantitas zat terlarut dalam suatu volume larutan itu, dimana volume itu diukur dengan teliti, dapat diketahui dengan tepat dari hubungan dasar berikut ini:
Mol = liter x konsentrasi molar
atau:
Mmol = ml x konsentrasi molar
Perhitungan-perhitungan stokiometri yang melibatkan larutan yang diketahui molaritasnya bahkan lebih sederhana lagi. Dengan definisi bobot ekuivalen, dua larutan akan bereaksi dengan tepat satu sama lain bila keduanya mengandung gram ekuivalen yang sama. Dalam hubungan ini, kedua normalitas harus dinyatakan dengan satuan yang sama, demikian juga kedua volume (Brady, 1990).
Konsentrasi larutan asam basa sering menggunakan satuan kemolaran (M). Konversi dari suatu kemolaran ke normalitasan adalah mengalikan valensi (n) asam atau basa dengan kemolaran. Sebaliknya dari suatu kenormalan ke satuan kemolaran adalah membagi kemolaran dengan valensi asam atau basa. Konversi ini dapat dirumuskan sebagai berikut:
Dengan rumus :
VA . MA . nA = VB . MB . nB
Keterangan :
VA = Volume sebelum pengenceran
MA = Molaritas sebelum pengenceran
VB = Volume setelah pengenceran
MB = Molaritas setelah pengenceran
nA = Valensi asam
Jenis-jenis titrasi asam basa adalah:
1. Titrasi asam dengan basa kuat
Diakhir titrasi akan terbentuk garam yang berasal dari asam kuat dan basa kuat.
Misal:
HCl + NaOH → NaCl + H2O
2. Titrasi asam lemah dan basa kuat
Pada akhir titrasi terbentuk garam yang berasal dari asam lemah dan basa kuat.
Misal:
asam asetat dengan NaOH.
CH3COOH + NaOH→ CH3COONa + H2O
3. Titrasi basa lemah dan asam kuat
Pada akhir titrasi akan terbentuk garam yang berasal dari basa lemah dan
asam kuat.
Misal : NH4Cl dan HCl
NH4OH + HCl → NH4Cl + H2O
4. Titrasi asam lemah dan basa lemah
Pada akhir titrasi akan terbentuk garam yang berasal dari asam lemah dan
basa lemah.
Misal : asam asetat dan NH4OH
BAB III
METODOLOGI
A. Alat
Alat-alat yang digunakan dalam praktikum ini adalah buret 50 mL 2 buah, neraca analitik 1 buah, pH meter 1 set, labu erlenmeyer 250 mL 6 buah, corong gelas 2 buah, labu ukur 100 dan 250 mL masing 1 buah, pipet gondok 25 dan 10 mL masing-masing 1 buah, pipet ukur 10 mL 1 buah, gelas beker 150 mL 2 buah dan pengaduk 1 buah.
B. Bahan
Bahan-bahan yang digunakan dalam praktikum ini adalah asam oksalat padat 0,63 gram, larutan NaOH 0,1 M, larutan HCl 0,1 M, larutan Na2CO3 0,1 M, larutan asam
cuka/asam asetat perdagangan, larutan asam lemah monobasis (cuplikan) CH3COOH,
indicator fenolftalin dan air suling.
C. Cara Kerja
a. Titrasi Asam Basa
i. Menentukan Normalitas Larutan Naoh
Menimbang 0,63 gram asam oksalat (C2H2O4 ) menggunakan neraca analitik.
Melarutkan 0,63 gram asam oksalat (C2H2O4) dengan air suling sebanyak 100
mL
Memasukan larutan asam oksalat (C2H2O4) 0,05 M kedalam biuret sebanyak
50 mL
Menuangkan 15 mL larutan NaOH ke dalam erlenmeyer dan menambahkan 10 mL air suling dan 3 tetes indicator fenolftalin
ii. Kadar Asam Asetat Perdagangan
b. Konstanta Keasaman
i. Menentukan harga ka1 dan ka2 dari Na2CO3
Mengencerkan 5 mL larutan asam asetat perdagangan dalam labu ukur 250 mL dengan air suling sebanyak 250 mL
Mengambil 10 mL larutan asam asetat hasil pengenceran dan memasukan dalam erlenmeyer ukuran 250 mL dan menambahkan 3 tetes indicator
fenolptalin
Melakukan titrasi dengan larutan NaOH standar hingga terjadi perubahan warna
Melakukan pekerjaan titrasi sebanyak 3 kali dan menghitung volume rata-rata NaOH yang digunakan.
Mengambil 10 mL larutan garam Na2CO3 0,1 M dan menuangkan dalam gelas
beker 150 mL serta mengencerkan dengan air sehingga elektroda pH meter dapat tercelup
Menghidupkan alat pH meter untuk pemanasan
ii. Menentukan Harga Ka dan Massa Molekul Cuplikan Asam Monobasis Murni
Membuat kurva hubungan antara pH larutan vs volume larutan penitrir dan menentukan harga ka1 dan ka2 dengan menggunakan persamaan
pH = pKa dan pH = 12pKa1 + 12pKa2
Menambahkan larutan HCl kedalam larutan Na2CO3 dan mengukur pH
larutan pada setiap penambahan 1 mL HCl.
Menambahkan indicator pp 2 tetes pada larutan garam Na2CO3 dan
mengukur pH-nya.
Mengambil larutan cuplikan yang telah dibuat dari pengenceran 100 kali cuplikan asam murni sebanyak 20 mL
Menambahkan 2 tetes indicator pp dan menyiapkan larutan NaOH ke dalam biuret
Menambahkan larutan NaOH ke dalam larutan asam cuplikan dan mengukur pH larutan setiap penambahan 1 mL
BAB IV
HASIL DAN PEMBAHASAN
A. Titrasi Asam Basa
Indikator pp(fenolftalin) yang digunakan pada titrasi asam basa kali ini merupakan asam monoprotik lemah yang biasa kita sebut Hln. Untuk menjadi indikator yang efektif, Hln dan basa konjugatnya, In- , memiliki warna yang berbeda. Dalam larutan,
asam ini akan terionisasi menjadi:
Hln(aq) ↔ H+(aq) + In-(aq)
Pada awal proses titrasi, larutan asam oksalat 0,05 M yang telah diencerkan di titrasikan pada larutan NaOH yang telah di teteskan indicator fenolftalin sebanyak tiga tetes. Ketika fenolftalin yang berwarna bening dan bersifat asam diteteskan pada NaOH yang basa maka fenolftalin akan terionisasi menjadi ion hidronium dan basa konjugatnya (berwarna ungu). Ion hidroksida pada NaOH akan bereaksi dengan ion hidronium membentuk molekul air (H2O) sehingga ion hidronium pada produk semakin berkurang
dan ion hidronium pada reaktan berpindah ke produk(ke kanan) untuk menggantikan ion hidronium yang semakin berkurang, sehingga reaksi cenderung dominan ke arah kanan ( semakin banyak basa konjugat yang terbentuk) dan menyebabkan larutan NaOH berwarna ungu ketika diteteskan fenolftalin sebanyak tiga tetes.
Hln(aq) + OH-↔ H
2O(aq) + ln-(aq)
Ketika asam oksalat yang bersifat asam ditambahkan pada larutan NaOH yang telah diteteskan fenolftalin sebanyak tiga tetes, maka ion hidronium pada fenolftalin/Hln semakin bertambah dan berlebih. Ion hidronium akan bereaksi dengan basa konjugat In- (
Untuk menentukan kadar asam cuka perdagangan, asam asetat yang telah diencerkan dan ditetesi dengan indicator fenolftalin sebanyak tiga tetes dititrasi dengan larutan NaOH 0,1 M. Fenolftalin yang semula berwarna bening tidak memberikan perubahan warna ketika diteteskan pada asam asetat sebab ion H+ berikatan dengan ion
ln(berwarna ungu) pada fenolftalin sehingga membentuk Hln(berwarna bening). Ketika larutan NaOH yang mengandung ion hidroksida diteteskan pada asam asetat, ion hidroksida akan berikatan dengan ion hidronium membentuk air (H2O) sehingga ion
hidronuim pada asam asetat semakin berkurang. Ion hidronium pada reaktan menggantikan ion hidronium yang hilang karena bereaksi dengan ion hidroksida sehingga reaksi cenderung ke arah produk(kanan) dan menyebabkan semakin banyak ion ln- yang terbentuk (berwarna ungu). Ketika ion hidronuim pada reaktan tidak dapat
mengimbangi jumlah ion ln-(warna ungu) maka akan tampak warna merah jambu.
Ketika asam asetat telah berubah warna merah jambu, inilah yang dikatakan mol NaOH=mol asam asetat perdagangan atau sudah mencapai titik ekivalen.
a. Menentukan normalitas larutan NaOH
i. Konsentrasi asam oksalat sebagai larutan stock primer
Diketahui:
Massa asam oksalat (C2H2O4.2H2O) = 0,63 g
Mr asam oksalat = 126 g/mol
Volume asam oksalat = 100 mL = 0,1 L Molaritas asam oksalat =
(massa asam oksalatMr asam oksalat )/ vol larutan asam oksalat = (1260,63g/molg )/0,1L=
0,005 mol / 0,1 L=0,05 M(konsentrasi asam oksalat)
C2H2O4 → 2H+ +C2O42-
Berdasarkan reaksi di atas, diketahui bahwa asam oksalat memiliki valensi asam 2.
Normalitas asam oksalat = n × M = 2 ek/mol × 0,05 mol/L= 0,1 N.
ii. Penentuan normalitas NaOH
Diketahui:
Volume NaOH saat titrasi = 15 mL
11,67 mL
Normalitas asam oksalat = 0,1 ek/L
Normalitas NaOH pada saat titik ekivalen adalah (N.V)asam = (N.V)basa
(N.v)oksalat = (N.V)NaOH (
0,1 ek/L × Voksalat = NNaOH × 15 mL
NNaOH = (0,1 ek/L × 11,67mL)/15mL
= 0,078 N ≈ 0,08 N b. Menentukan kadar asam asetat perdagangan
i. Menentukan volume asam asetat yang dititrasi = 5 mL dengan pengenceran 50 kali
Volume rata-rata NaOH untuk titrasi = (7,4+10+10,1)/3=9,17 mL Normalitas NaOH = 0,08 N
ii. Penentuan kadar asam asetat perdagangan
Karena dalam titrasi ini, digunakan standar NaOH yang konsentrasinya
±0,1N sehingga larutan asam cuka perlu diencerkan terlebih dahulu
agar konsentrasinya menjadi ±0,1N. Dalam percobaan ini dilakukan 50 kali pengenceran asam cuka ( dari volume 5 mL menjadi 250 mL ) (V× N )NaOH = (V×N)CH3COOH
10 mL × 0,08 N = 10 mL × NCH3COOH
NCH3COOH = 0,08 N
MCH3COOH = NCH3COOH × faktor pengenceran=0,08 × 50= 4 M
Gram CH3COOH = MCH3COOH × MrCH3COOH
= 4 mmol/mL × 60 mg/mmol =240 mg/mL
=0,24 g/mL
=0,24 g/mL × 100% = 24%. B. Konstanta Keasaman
a. Penentuan harga Ka1 dan Ka2 dari Na2CO3
Volume penambahan HCl (mL) pH Na2CO3
awal 12,95 dimiliki asam karbonat yang merupakan asam lemah dibasis sehingga dapat dicari Ka1 dan Ka2nya.
Volume akhir titrasi = volume ekuivalen = 10 mL
pH akhir titrasi = pH ekuivalen = 9,20
Volume pKa2 = setengah dari volume ekuivalen = 5 mL
pKa2 = pH pada saat setengah volume ekuialen = 11,27
Berdasarkan data diatas maka pH dapat diperoleh:
pH Na2CO3
Dari kurva diatas, didapati bahwa pH mengalami penurunan dari 10,12 menjadi 9,20 namun tidak mengalami penurunan secara dratis karena larutan Na2CO3 merupakan asam konjugasi dan bersifat buffer sehinga mampu
mempertahankan pH pada kapasitas tertentu.
b. Penentuan harga Ka dan massa molekul cuplikan asam mononasis murni
Volume penambahan NaOH (mL) pH CH3COOH
18 5,71
pH akhir titrasi = pH ekuivalen =7,53
Dari data volume titrasi NaOH dapat dicari mol NaOH:
pH CH3COOH
Dari data diatas maka massa molekul CH3COOH:
BM = 0,030,02×1,05×0,1×100 = 15,75 g/mol
BAB 5
KESIMPULAN
Titrasi merupakan proses penentuan konsentrasi suatu larutan dengan mereaksikan larutan yang sudah ditentukan konsentrasinya (larutan standar), titrasi asam basa adalah suatu titrasi dengan menggunakan reaksi asam basa (reaksi penetralan). Harga konstanta keasaman (Ka) asam karbonat yang diperoleh adalah 7,41 × 10-8 dan 5,37 × 10-12 . Massa
molekul dari asam mono basis murni adalah 15,75 g/mol. Normalitas larutan NaOH dengan larutan standar asam oksalat (C2H2O4) adalah 0,08 N. Kadar asam cuka
DAFTAR PUSTAKA
Goldberg, D.2002. Kimia Untuk Pemula. Jakarta:Erlangga.
Anonim. 2008. Kimia Dasar 1. Makassar: Universitas Hasanuddin Makassar.
Syukri, S.1999. Kimia Dasar 1. Bandung: ITB.
Harjadi, W.1985. Ilmu Kimia Analitik Dasar. Jakarta:Gramedia.
Keenam.1984. Kimia Untuk Universitas 1 Edisi Keenam. Jakarta: Erlangga.
Brady, James E. 1990. Kimia Universitas Asas dan Struktur Edisi 5. Jakarta: Binarupa Aksara.