LAPORAN PRAKTIKUM TITRASI ASAM BASA
TUJUAN
1. Mempelajari dan memahami titrasi asam basa
2. Menstandarisasi NaOH dengan asam oksalat
3. Menentukan konsentrasi HCl
LANDASAN TEORI
Titrasi asam basa adalah suatu analisa volumetric yang berdasarkan reaksi penetralan , dimana sejumlah volum basa dinetralkan tepat dengan asm ,dan salah satu konsentrasinya telah diketahui.
H+ + OH- H
2O
Analsis dalam titrasi memanfaatkan perubahan besar dalam pH, untuk menetapkan titik kesetaraan tercapai .titik akhir ditunjukkan oleh perubahan warna suatu indikator. indikator merupakan asam basa organik lemah yang mengalami perubahan warna pada pH tertentu dalam suatu titrasi dipilih indikator yang mengalami perubahan warna disekitar titik ekivalen .
Indikator fenolftalin dikenal baik adalah asam dwiprotik dan tak berwarna kemudian berdosiasi menjadi warna merah .tak berwarna dalam suasana asam dan berwarna merah dalam suasana basa ( pH 8,0 – 9,6 ).
ALAT DAN BAHAN
ALAT – ALAT :
Buret 50 mL 1 buah Pipet tetes 3 buah
Pipet gondok 10 mL 2 buah Erlenmeyer 250 mL 2 buah
BAHAN – BAHAN
Oksalat Kristal PP NaOH 0,1 M HCl pekat AquadestLANGKAH KERJA
a. Standarisasi NaOH dengan asam oksalat
1. Buatlah larutan asam oksalat 0,05 N ( teliti )
2. Pipet 10 mL asam oksalat kedalam erlenmeyer
3. Tambahkan 2 tetes indikator PP
4. Titrasi dengan NaOH 0,1 M dari buret sampai timbul warna merah muda yang tak hilang
oleh pengecocokan selanjutnya 5. Ulangi pekerjaan sebanyak 3 kali
6. Hitung kenormalan NaOH selain dapat juga digunakan : Fenol merah : kuning ke merah pH 6,8 – 8,4
Metal merah : merah ke kuning pH 4,3 -6,2 Brom fenol biru : kuning ke biru pH 3,0 -4,6
b. Menentukan konsentrasi larutan HCl
1. Encerkan larutan HCl dalam ukur tepat sampai batas dan kocok dengan sempurna
2. Pipet 10 mL larut tersebut ,masukkan kedalam erlenmeyer
3. Tambahkan 2 tetes indikator PP
4. Titrasi HCl dengan NaOHyang sudah di standarisasiakan
5. Ulangi titrsi sebanyak 3 kali
6. Hitung konsentrasi HCl ( normalitas )
TUGAS
1. Apa yang dimaksud dengan dengan cara –cara perubahan indikator ?
2. Apa yang dimaksud dengan indikator ,titik akhir titrasi dan titik ekivalen ?
3. Apa syarat –syaray yang dapat dipakai dalam suatu reaksi ?
4. Apa yang dimaksud dengan larutan standar primer dan standar skunder ?
5. Apa syarat zat yang dapat dipakai sebagai larutan standar primer ?
PRAKTIKUM KIMIA I. Judul
Titrasi Asam Kuat dengan Basa Kuat. II. Tujuan
Mengetahui kemolaran larutan HCl dengan menggunakan larutan basa kuat.
III. Dasar Teori
Titrasi merupakan suatu metode untuk menentukan kadar suatu zat dengan menggunakan zat lain yang sudah diketahui konsentrasinya. Titrasi asam-basa adalah titrasi yang yang melibatkan asam maupun basa sebagai titer (zat yang telah diketahui konsentrasinya) maupun titrant (zat yang akan ditentukan kadarnya) dan berdasarkan reaksi penetralan asam-basa. Kadar larutan asam ditentukan dengan
menggunakan larutan basa yang telah diketahui kadarnya, dan
sebaliknya, kadar larutan basa dapat diketahui dengan menggunakan larutan asam yang diketahui kadarnya. Titik ekivalen yaitu pH pada saat asam dan basa (titrant dan titer) tepat ekivalen atau secara stoikiometri tepat habis bereaksi.
Ada dua cara umum untuk mengetahui titik ekivalen pada titrasi asam basa:
1. Memakai pH meter.
2. Memakai indikator asam basa. Indikator ditambahkan pada titrant sebelum proses titrasi dilakukan. Indikator ini akan berubah warna ketika titik ekivalen terjadi, dan pada saat itulah titrasi dihentikan. Titik akhir titrasi yaitu pH pada saat indikator berubah warna dan saat itu juga titrasi dihentikan. Pada titrasi asam kuat dengan basa kuat digunakan indikator Fenolftalein (trayek pH 8,3-10) karena
kesalahannya paling kecil. Dalam titrasi ini titik akhir pH>7 dan perubahan warna pada titik akhit titrasi adalah merah.
Untuk mengetahui kemolaran asam kuat (HCl) dapat diketahui setelah mengetahui volum basa kuat (KOH) yang berkurang sampai titik akhir titrasi (reaksi dihentikan). Pada saat titik ekivalen mol basa kuat akan sama dengan mol asam kuat, sehingga kemolaran asam kuat dapat dicari.
IV. Alat dan Bahan
Alat :
1. Statif dan klem 2. Erlenmeyer 3. Biuret 4. Corong 5. Pipet tetes 6. Gelas ukur 7. Gelas kimia 8. Kapas Bahan : 1. HCl 20 mL 2. NaOH 0,1 M 50 mL 3. KOH 0,1 M 100 mL 4. Fenolftalein (PP) V. Langkah Kerja
1. Siapkan alat dan bahan yang diperlukan.
2. Masukkan 20 mL larutan HCl ke dalam gelas ukur.
3. Tuangkan 20 mL larutan HCl tersebut ke dalam erlenmeyer.
4. Tambahkan tiga tetes indikator Fenolftalein (PP) ke dalam larutan HCl tersebut.
5. Masukkan 50 mL larutan NaOH 0,1 M dengan menggunakan gelas kimia ke dalam biuret setelah memastikan biuret sudah terpasang dengan baik pada klem dan telah terpasang corong pada biuret untuk memudahkan penuangan NaOH 0,1 M ke dalam biuret.
6. Perguakan pipet tetes saat skala pada biuret hampir mencapai angka nol, dan pastikan bagian meniskus cekung yang bawah (NaOH 0,1 M) tepat pada angka nol biuret.
7. Menetesi larutan HCl dengan NaOH 0,1 M. Penetesan dilakukan secara hati-hati dan pelan-pelan yaitu tetes demi tetes dan erlenmeyer terus menerus diguncangkan. Penetesan dihentikan saat terjadi
perubahan warna yang tetap pada larutan HCl yaitu merah muda. 8. Mencatat volum NaOH 0,1 M pada biuret yang berkurang (bereksi dengan larutan HCl).
9. Ulangi prosedur di atas menggunakan larutan KOH 0,1 M (disaring menggunakan kapas saat dituang ke dalam biuret) untuk menggantikan NaOH 0,1 M sebanyak dua kali dengan indikator fenolftalein (PP) lima tetes.
VI. Data
No Asam kuat Basa Kuat Nama
Larutan Volum yang digunakan Nama
Larutan Volum awal pada biuret Volum akhir pada biuret Volum yang digunakan
1 HCl 20 mL NaOH 0,1 M 50 mL 15 mL 35 mL 2 HCl 20 mL KOH 0,1 M 50 mL 29 mL 21 mL 3 HCl 20 mL KOH 0,1 M 50 mL 33 mL 17 mL VII. Analisis Data
Volum rerata basa kuat yang digunakan adalah
Keterangan:
Pada percobaan pertama volum NaOH 0,1 M yang digunakan sebanyak 35 mL. Jika dibandingkan dengan volum yang digunakan KOH 0,1 M pada percobaan kedua dan ketiga, volum NaOH memiliki selisih yang cukup jauh, sehingga dalam menghitung rerata volum yang digunakan oleh larutan basa kuat, percobaan pertama dianggap tidak ada (tidak dihitung).
Jumlah mol KOH 0,1 M yang digunakan adalah n KOH = M . V
= 0,1.19 = 1,9 mmol = 0,0019 mol
KOH(aq) + HCl(aq) KCl(aq) + H O(l) 0,1 M x M
19 mL 20 mL
n KOH = 0,0019 mol
koefisien KOH = koefisien HCl, maka n HCl = n KOH
= 0,0019 mol M HCl =
=
= 0,095 M
Kemolaran HCl yang sebenarnya yaitu 0,1 M dan seharusnya volum KOH yang berkurang pada biuret sebanyak 20 mL. Sedangkan dalam percobaan didapat bahwa perhitungan rerata volum KOH yang
0,095 M. Hal ini terjadi karena kurang telitinya mata dalam
membedakan warna yang permanen (tetap) pada titik akhir titrasi.
VIII. Kesimpulan
Dari hasil percobaan yang dilakukan, dapat diketahui bahwa kemolaran larutan HCl adalah 0,095 M.
IX. Daftar Pustaka
Michael Purba. 2007. Kimia untuk SMA Kelas XI Semester 2. Jakarta: Erlangga
Parning dan Horale. 2004. Kimia 2B. Jakarta: Yudhistira
_____. 2008. Titrasi Asam Basa (online). (www.belajarkimia.com, diakses Kamis, 26 Februari 2009 pukul 20.00 WIB)
_____. 2008. Titrasi Asam Kuat-Basa Kuat (online). (www.ico.web.id, diakses Jumat, 27 Februari 2009 pukul 19.30 WIB)
laporan praktikum kimia titrasi asam basa
Percobaan
1. Judul Percobaan : TITRASI ASAM BASA
2. Tujuan Percobaan :
Menentukan Konsentrasi Larutan dengan Menggunakan Larutan Baku 3. Teori Singkat :
Konsentrasi suatu larutan dapat ditentukan berdasarkan konsentrasi zat lain. Larutan yang digunakan untuk menentukan konsentrasi larutan yang lain disebut larutan baku, di mana konsentrasi larutan ini diketahui secara pasti.
Proses penentuan konsentrasi larutan dengan cara ini disebut titrasi. Dan jika pasangan larutan yang digunakan dalam proses ini adalah larutan asam dan basa, maka proses ini disebut titrasi asam – basa. Misalnya, menentukan konsentrasi larutan HCl dengan menggunakan larutan baku NaOH.
Proses titrasi dilakukan dengan penggunaan perangkat alat titrasi seperti pada gambar :
4. Alat dan Bahan :
a. Alat yang digunakan :
Statif
Buret
Gelas Erlemeyer
Pipet tetes
b. Bahan yang digunakan :
Larutan NaOH
Larutan HCl
5. Langkah Kerja :
a) Masukkan 20 mL larutan HCL dan 3 tetes indicator fenolflatelin ke dalam sebuah
Erlenmeyer
b) Isi buret dengan larutan NaOH 0,1 M hingga garis 0 mL
c) Tetesi larutan HCLl dengan laarutan NaOH. Penetesan harus dilakukan secara hati hati dan
erlemeyar terus menerus diguncangkan. Penetesan di hentikian saat terjadi perubahan warna yang tetap, yaitu menjadi merah muda.
d) Ulangi prosedur diatas hingga diperoleh 3 data yang hampir sama.
6. Pengamatan :
No.
Volum larutan HCl
yang digunakan Volum larutan NaOH yangdigunakan
1 20 mL 19 mL
2 20 mL 22 mL
7. Analisi data/pertanyaan :
1) Tentukan volum rata rata larutan NaOH yang digunakan
2) Tentukan jumlah mol NaOH yang digunakan
3) Tentukan jumlah mol HCl berdasarkan perbandingan koefisien reaksi
NaOH(aq) + HCl(aq) NaCl(aq) +
4) Tentukan kemolaran larutan HCl tersebut
5) apa yang anda simpulkan dari kegiatan ini
8. jawaban; 1) 19+22+38 =26,33 3 2) n NaOH n = M . V n = 0,1 x 26,33 = 2,633 3) n HCl = x 2,633 = 2,633 4) M HCl M= = M= 0,13165 M= 0,13 Kesimpulan :
Dari hasil pengamatan dapat disimpulkan bahwa untuk menentukan konsentrasi HCl diperlukan konsentrasi NaOH yang telah ditentukan secara pasti dan volume NaOH sendiri. Di mana volume NaOH ditentukan dari banyaknya NaOH yang diperlukan untuk menjadikan larutan HCl tepat merah pada proses titrasi.
DAFTAR PUSTAKA
Google.com
Purba,Michel.2006kimia .jilid 2b untuk SMA kelas XI semester
2.jakarta:erlangga
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS PAKUANBOGOR 2011 BAB I PENDAHULUAN
1.1. Tujuan Percobaan
Mengetahui titik ekivalen dan titik akhir pada percobaan titrasi.
Mengetahui indikator asam basa.
Mengetahui normalitas zat yang dititrasi.
1.2. Dasar Teori
1.2.1. Titrasi
Titrasi merupakan salah satu cara untuk menentukan konsentrasi larutan
suatu zat dengan cara mereaksikan larutan tersebut dengan zat lain yang diketahui konsentrasinya. Prinsip dasar titrasi asam basa didasarkan pada reaksi nertalisasi asam basa. Titik equivalen pada titrasi asam basa adalah pada saat dimana sejumlah asam tepat di netralkan oleh sejumlah basa. Selama titrasi berlangsung terjadi perubahan pH. pH pada titik equivalen ditentukan oleh sejumlah garam yang dihasilkan dari netralisaasi asam basa. Indikator yang digunakan pada titrasi asam basa adalah yang memiliki rentang pH dimana titik equivalen berada. Pada umumnya titik equivalen tersebut sulit untuk diamati, yang mudah diamati adalah titik akhir yang dapat terjadi sebelum atau sesudah titik equivalen tercapai. Titrasi harus dihentikan pada saat titik akhir titrasi tercapai, yang ditandai dengan perubahan warna indikator. Titik akhir titrasi tidak
selalu berimpit dengan titik equivalen. Dengan pemilihan indikator yang tepat, kita dapat memperkecil kesalahan titrasi. Pada titrasi asam kuat dan basa kuat, asam lemah dan basa lemah dalam air akan terurau dengan sempurna. Oleh karena itu ion
hidrogen dan ion hidroksida selama titrasi dapat langsung dihitung dari jumlah asam atau basa yang ditambahkan. Pada titik equivalen dari titrasi asam ke air, yaitu sama dengan 7.
Pada titrasi juga memerlukan Indikator asam-basa untuk mengetahui konsentrasinya.
Indikator asam-basa adalah senyawa halokromik yang ditambahkan dalam jumlah kecil ke
dalam sampel, umumnya adalah larutan yang akan memberikan warna sesuai dengan kondisi [pH] larutan tersebut.
Tidak semua titrasi membutuhkan indikator. Dalam beberapa kasus, baik reaktan maupun produk telah memiliki warna yang kontras dan dapat digunakan sebagai "indikator". Sebagai contoh, titrasi redoks menggunakan potasium permanganat (merah muda/ungu) sebagai peniter tidak membutuhkan indikator. Ketika peniter dikurangi, larutan akan menjadi tidak berwarna. Setelah mencapai titik ekivalensi, terdapat sisa peniter yang berlebih dalam larutan. Titik ekivalensi diidentifikasikan pada saat munculnya warna merah muda yang pertama (akibat kelebihan permanganat) dalam larutan yang sedang dititer.
Akibat adanya sifat logaritma dalam kurva pH, membuat transisi warna yang sangat tajam; sehingga, satu tetes peniter pada saat hampir mencapai titik akhir dapat mengubah nilai pH secara signifikan, sehingga terjadilah perubahan warna dalam indikator secara langsung. Terdapat sedikit perbedaan antara perubahan warna indikator dan titik ekivalensi yang sebenarnya dalam titrasi. Kesalahan ini diacu sebagai kesalahan indikator, dan besar kesalahannya tidak dapat ditentukan.
Titrasi asam basa disebut juga titrasi adisi alkalimetri. Kadar atau konsentrasi asam basa larutan dapat ditentukan dengan metode volumetri dengan teknik titrasi asam basa. Volumetri adalah teknik analisis kimia kuantitatif untuk menetapkan kadar sampel dengan pengukuran volume larutan yang terlibat reaksi berdasarkan kesetaraan kimia. Kesetaraan kimia ditetapkan melalui titik akhir titrasi yang diketahui dari perubahan warna indicator dan kadar sampel untuk ditetapkan melalui perhitungan berdasarkan persamaan reaksi.
Banyak metode yang dapat digunakan untuk mengindikasikan titik akhir dalam reaksi; titrasi biasanya menggunakan indikator visual (larutan reaktan yang berubah warna). Dalam titrasi asam-basa sederhana, indikator pH dapat digunakan, sebagai contoh adalah fenolftalein, di mana fenolftalein akan berubah warna menjadi merah muda ketika larutan mencapai pH sekitar 8.2 atau melewatinya. Contoh lainnya dari indikator pH yang dapat digunakan adalah metil jingga, yang berubah warna menjadi merah dalam asam serta menjadi kuning dalam larutan alkali.
1.2.2. Larutan Baku
Larutan baku adalah larutan suatu zat terlarut yang telah diketahui konsentrasinya.
Terdapat 2 macam larutan baku, yaitu:
1. Larutan baku primer adalah suatu larutan yang telah diketahui secara tepat konsentrasinya
melalui metode gravimetri. Nilai konsentrasi dihitung melalui perumusan sederhana, setelah dilakukan penimbangan teliti zat pereaksi tersebut dan dilarutkan dalam volume tertentu.
Contoh: K2Cr2O7, AS2O3, NaCl, asam oksalat, asam benzoat. Syarat-syarat larutan baku
primer: – mudah diperoleh, dimurnikan, dikeringkan (jika mungkin pada suhu 110-120 derajat celcius) dan disimpan dalam keadaan murni. – tidak bersifat higroskopis dan tidak berubah berat dalam penimbangan di udara. Zat tersebut dapat diuji kadar pengotornya dengan uji kualitatif dan kepekaan tertentu. Sedapat mungkin mempunyai massa relatif dan massa ekivalen yang besar, sehingga kesalahan karena penimbangan dapat diabaikan. Zat tersebut harus mudah larut dalam pelarut yang dipilih. – reaksi yang berlangsung dengan pereaksi tersebut harus bersifat stoikiometrik dan langsung. kesalahan titrasi harus dapat diabaikan atau dapat ditentukan secara tepat dan mudah.
2. Larutan baku sekunder adalah suatu larutan dimana konsentrasinya ditentukan dengan jalan
pembakuan menggunakan larutan baku primer, biasanya melalui metode titrimetri. Contoh:
AgNO3, KMnO4, Fe(SO4)2 Syarat-syarat larutan baku sekunder: – derajat kemurnian lebih
rendah daripada larutan baku primer – mempunyai BE yang tinggi untuk memperkecil kesalahan penimbangan – larutannya relatif stabil dalam penyimpanan
BAB II
ALAT DAN BAHAN 2.1. Alat yang digunakan
1) Buret 2) Pipet tetes 3) Gelas piala 4) Neraca analitik 5) Spatula 6) Pipet gondok 7) Labu ukur 100 mL 8) Gelas ukur 9) Batang pengaduk 10) Erlenmeyer 11) Statif 12) Corong 13) Klem buret 2.2. Bahan
1) Larutan HCl 0,1 N (Hasil pengenceran)
2) Kristal NaOH
3) Fenolftalin (PP)
4) Akuades
BAB III METODA KERJA 3.1. Pembuatan Larutan NaOH
Ambil Kristal NaOH dengan menggunakan spatula. Timbanglah pada neraca analitik
sebanyak Kristal yang akan dilarutkan ke dalam akuades 100 ml.
Masukkan Kristal NaOH ke dalam gelas piala, larutkan dengan sedikit akuades. Aduklah
sampai larut sempurna.
Masukkan larutan NaOH yang telah encer ke dalam labu ukur menggunakan batang
pengaduk dan corong. Bilaslah gelas piala dengan akuades dan masukan kembali ke dalam akuades, itu bertujuan supaya tidak ada NaOH yang terbuang.
Masuak ke dalam labu ukur dan silarutkan sampai batas dengan menggunakan akuades.
Pengenceran ini harus sekali jadi. Maksudnya jngan sampai menambahkan akuades lebih dari yang diperlukan sebab hal ini akan menimbulkan kesalahan yang cukup besar. Oleh karena itu pengenceran harus dilakukan dengan hati-hati, sedikit demi sedikit. Setelah dekt dengan tanda pada leher labu ukur, dipakai pipet tetes. Tapi sebelumnya bersihkan dahulu leher labu ukur dengan tisu yang diikatkan pada batang pengaduk, setelah bersih baru dimasukan setetes demi setets dengan pipet tetes.
Kocoklah sebanyak 32 kali sampai tercampur rata.
3.2. Titrasi Asam-Basa
Cucilah buret dengan larutan pencuci. Bilaslah dengan larutan standar yang akan dipakai,
yaitu larutan NaOH 0,1 N.
Pakailah pipet gondok untuk mengambil 10 ml HCl 0,1 N yang sudah dibuat dari
pengenceran tadi. Masukkan HCl ke dalam Erlenmeyer. Tambahkan beberapa tetep PP. Erlenmeyer ini harus digoyang-goyangkan perlahan-lahan.
Titrasi diberhentikan ketika penambahan setetes NaOH merubah warna merah sangat muda
yang tak mau hilang pada penggoyangan.
Pekerjaan diulang tiga kali (triplo).
Catat berapa ml larutan standar yang digunakan dengan melihat batas cairan dalam buret. Hitung berapa normalitas larutan yang dititrasi.
BAB IV
HASIL PERCOBAAN 4.1. Hasil Percobaan
4.1.1. Pembuatan larutan NaOH 0,1 N
Pada percobaan pembuatan larutan baku yaitu NaOH 0,1N dibutuhkan NaOH padat sebanyak 0,4 gr. Berikut adalah perhitungannya:
NaOH 0,1N = è mol
= 0,1 N x 1 liter = 0,1 mol
Mol NaOH = è gram
= mol x Mr = 0,1 x 40 = 4 gram
Maka untuk melarutkan NaOH dengan 100 mL akuades dibutuhkan NaOH padat sebanyak:
4 x = 4 gram
4.1.2. Titrasi
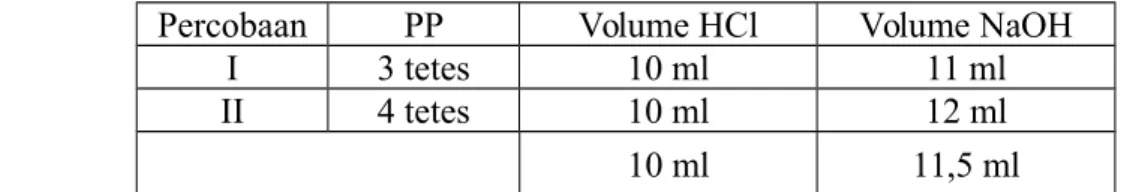
Pada Percobaan yang dilakukan sebanyak 2 kali percobaan (diplo) dengan larutan NaOH 0,1 N, maka didapatkan data dan perhitungan konsentrasi HCl. Berikut data hasil percobaan. Tabel Hasil Percobaan.
Percobaan PP Volume HCl Volume NaOH
I 3 tetes 10 ml 11 ml
II 4 tetes 10 ml 12 ml
10 ml 11,5 ml
Dari hasil pengamatan diatas dihasilkan Normalitas larutan HCl yang ditiitrasi dari zat penitrannya yaitu NaOH 0,1N. Berikut adalah adalah perhitungannya:
V1 N1 = V2 N2
N2 =
Keterangan: V1 = volume larutan asli yang dipakai
N1 = normalitas asli
V2 = volume larutan yang akan dibuat
N2 = normalitas yang akan dibuat
4.2. Pembahasan
Dalam percobaan titrasi asam basa yang telah saya lakukan, (Titrasi HCl dengan zat titran NaOH), didapatkan data sebagai berikut:
Reaksi: HCL(aq) + NaOH(aq) = NaCl(aq) + H2O(l)
Dari reaksi di atas dapat diketahui bahwa perbandingan mol antara HCl dan NaOH sama sehingga untuk menghitung konsentrasi dari larutan HCl yang didasarkan atas hasil
percobaan, maka dapat digunakan persamaan berikut ini:
V1 . M1 = V2 . M2
Keterangan: M1 = molaritas asam (HCL)
M2 = molaritas basa kuat (NaOH)
V1 = volume asam
V2 = volume basa
Dalam percobaan ke-1, HCl 10 ml dimasukkan ke dalam labu Erlenmeyer, kemudian ditambahkan 3 tetes penoftalein. NaOH 0,1 M 50 ml dan dimasukkan ke dalam buret, kemudian dibiarkan menetes setetes demi setetes hingga indikator berubah warna atau titik akhir titrasi tercapai, yaitu pada saat konsentrasi HCl 0,11 M. Sedangkan dalam percobaan ke-2 indikator berubah warna atau titik akhir titrasi tercapai pada saat konsentrasi HCl 0,12 M. Dari selisih diatas terjadi sangat sedikit kesalahan ini dikarenakan karena:
1. Kurang telitinya dalam melakukan proses titrasi
2. Adanya kebocoran pada alat titrasi
3. Kurang memadainya alat titrasi, terletak pada angka ketelitian alat.
4. Kurang tepatnya pada saat pembuatan HCl, dikarenakan pada HCl pekat tidak terdapat.
5. label yangmenunjukan konsentrasi dari HCl.
6. Terjadi perubahan skala buret yang tak konstan.
7. Kurangnya ketelitian dalam memperhatikan perubahan warna indikator.
Berdasarkan teori, larutan asam bila direaksikan dengan larutan basa akan menghasilkan garamdan air. Sifat asam dan sifat basa akan hilang dengan terbentukanya zat baru yang disebut garam yangmemiliki sifat berbeda dengan sifat zat asalnya (dalam percobaan ini adalah NaCl) . Karena hasil reaksinyaadalah air yang memiliki sifat netral yang artinya jumlah ion H+ sama dengan jumlah ion OH- maka reaksiitu disebut dengan reaksi netralisasi atau penetralan.Pada reaksi penetralan, jumlah asam harus ekivalendengan jumlah basa. Untuk itu perlu ditentukan titik ekivalen reaksi.
Titik ekivalen merupakan keadaan dimana jumlah mol asam tepat habis bereaksi dengan jumlahmol basa. Untuk menentukan titik ekivalen pada reaksi asam-basa dapat digunakan indikator asam-basa. Ketepatan pemilihan indikator merupakan syarat keberhasilan dalam menentukan titik ekivalen. Pemilihan indikator didasarkan atas pH larutan hasil reaksi atau garam yang terjadi pada saat titik ekivalen. Salah satukegunaan reaksi netralisasi adalah untuk menentukan konsesntrasi asam atau basa yang tidak diketahui. Penentuan konsentrasi ini dilakukan dengan titrasi asam-basa.
Titrasi merupakan cara penentuan konsentrasi suatu larutan dengan volume tertentu denganmenggunakan larutan yang sudah diketahui konsentrasinya dan mengukur volumenya
secara pasti. Bilatitrasi menyangkut titrasi asam-basa maka disebut dengan titrasi adisi-alkalimetri. Larutan yang telahdiketahui konsentrasinya disebut dengan titran.
Titran ditambahkan sedikit demi sedikit (dari dalam buret) pada titrat (larutan yang dititrasi)sampai terjadi perubahan warna indikator. Saat terjadi perubahan warna indikator, maka titrasi dihentikan.Saat terjadi perubahan warna indikator dan titrasi diakhiri disebut dengan titik akhir titrasi dan diharapkantitik akhir titrasi sama dengan titik ekivalen. Semakin jauh titik akhir titrasi dengan titik ekivalen makasemakin besar kesalahan titrasi dan oleh karena itu, pemilihan indikator menjadi sangat penting agar warna indikator berubah saat titik ekivalen tercapai.
Perubahan warna pada larutan HCl yang diberi beberapa tetes PP yang semula berwarna bening menjadi merah muda disebabkan oleh resonansi isomer elektron. Beberapa indikator mempunyai tetapan ionisasi yang berbeda dan akibatnya akan menunjukkan warna pada range pH yang berbeda.
Pada titrasi asam kuat digunakan indikator fenolftalein (trayek pH 8,3–10) karena
kesalahannya paling kecil. Dalam titrasi ini titik akhir pH >7 dan perubahan warna pada titik akhir titrasi adalah merah muda pekat.
BAB V KESIMPULAN
Dari hasil kegitan praktikum baik dalam pengamatan, perhitungan serta pembahasan dapat ditarik kesimpulan sebagai berikut :
1. Larutan baku dibagi 2, yaitu: larutan primer dan sekunder
2. Larutan baku dibuat dengan menimbang dan dilarutkan dengan pelarut (akuades)
3. Konsentrasi HCl (asam) dapat ditentukan dari proses titrasi dengan mereaksikan HCl (titrat)
dengan NaOH (zat penitrat).
4. Titrasi dihentikan ketika warnanya berubah menjadi merah muda dengan bantuan PP.
5. Volume zat NaOH digunakan untuk menentukan konsentrasi HCl.
DAFTAR PUSTAKA
Khopkar, S. M. 1990. Konsep Dasar Kimia Analitik. Universitas Indonesia, Jakarta. S, Syukri. 1999. Kimia Dasar 1. Bandung: Penerbit ITB.
Purba, Drs. Michael, M.Si. 2002. Kimia 2B untuk SMA kelas XI , Jakarta: Erlangga 2008. Compendium for basal practice in biochemistry. Aarhus University
http://id.wikipedia.org (diakses pada tanggal 23 Oktober 2011)
BAB IV
A. Membuat Larutan NaOH 0,5 M (molar) sebanyak 100 ml
Dengan menimbang 0,2 gram NaOH dalam cawan/ botol timbang dimasukkan ke dalam labu ukur 100 ml, lalu digoyang dan tambahkan aqua dest hingga volume 100 ml. Maka hasil larutan NaOH adalah 0,5 M (molar), dengan menimbang 0,2 gram NaOH.
B. Titrasi
Hasil perhitungan:
1. Penitraan Hcl dengan NaOH 1= 18,40 2. Penitraan Hcl dengan NaOH 2= 18,60
Rumus: V1 x M2 = V2 x M2 a. Diketahui: V1 = 18,60 V2 = 10ml M2 = 0,05 b. Ditanya: M1...? c. Jawab: V1 x M1 = V2 x M2 18,60 x M1 = 10 x 0,05 18,60 x M1 = 0,5 / 18,60 = 0,0268 = 0,03 N. C. Suhu Hasil perhitungan: a. Diketahui:
Na2S2O3 0,1 N = 3ml (3buah test tube)
Hcl 0,1 N = 3ml (3 buah test tube) b. Ditanya:
Waktu terjadi perubahan endapan belerang...? c. Jawab:
a. Pencampuran Hcl + Na2S2O3 pada suhu 50 C dihitung waktu reaksi yang ditandai
dengan timbulnya kekeruhan = 00.00.35.09 detik (35 detik).
b. Pencampuran Hcl dan Na2S2O3 pada suhu 600 C dihitung waktu reaksi yang
ditandai dengan timbulnya kekeruhan = 00.00.02.02 detik (2 detik).
c. Pencampuran Hcl dan Na2S2O3 pada suhu kamar (ruangan) dihitung waktu reaksi
yang ditandai dengan timbulnya kekeruhan = 00.01.10.97 (1 menit 10 detik).
BAB V PENUTUP
A. Kesimpulan
Kesimpulan yang dapat diambil dari percobaan ini adalah :
1. Proses yang digunakan untuk menentukan secara teliti konsentrasi suatu larutan dikenal sebagai standarisasi.
3. Larutan juga dipengaruhi oleh faktor-faktor tertentu yaitu temperatur, sifat pelarut, efek ion sejenis, efek ion berlainan, pH, hidrolisis, pengaruh kompleks, dll.
4. Indikator yang digunakan dalam percobaan titrasi menentukan warna yang akan dihasilkan. Dengan menggunakan indikator yang sesuai maka akan dapat terbaca sifat larutan tersebut.
5. Pembuatan, pengenceran, serta pencampuran suatu zat ataupun larutan membutuhkan adanya ketelitian dan kewaspadaan yang tinggi.
Untuk dapat menghasilkan larutan 0,5 M (molar) sebanyak 100 ml, dilakukan dengan menimbang 0,2 gram NaOH dalam cawan/botol timbang dimasukkan ke dalam labu ukur 100 ml. Kemudian digoyang ditambahkan aqua dest hingga volume 100 ml, Maka hasil larutannya 0,5 M (molar).
Titrasi asam basa bertujuan untuk menentukan kosentrasi suatu larutan asam ataupun basa, dengan larutan basa atau asam yang telah diketahui konsentrasinya sebagai larutan standar. Menghitung dengan menggunakan rumus V1 x M1 = V2 x M2. Reaksi oksidasi reduksi yang terjadi antara asam khlorida dengan natrium thiosulfat menghasilkan endapan belerang. Waktu yang diperlukan untuk terjadinya kekeruhan, yang disebabkan oleh terbentuknya belerang, adalah ukuran dari kecepatan reaksi.
B. Saran
Dengan diadakannya praktikum pembuatan dan pengenceran larutan ini diharapkan para praktikan dapat mengerti cara-cara untuk melakukannya, dan praktikan juga harus dapat memahami semua yang telah di praktikumkan.
Sebagaimana kita sudah mempelajari berbagai cara pembuatan larutan, cara menghitung titrasi dan mengukur kecepatan reaksi yang terjadi antara asam khlorida dengan natrium thiosulfat. Semoga dengan makalah ini bermanfaat khususnya bagi kami dan umumnya bagi para pembaca.
DAFTAR PUSTAKA
Brady, James E., 1999. Kimia Universitas Asas dan Struktur, Binarupa Aksara, Jakarta.
Keenan, C. W, dkk., 1998, Kimia untuk Universitas, Erlangga, Jakarta. Syukri, 1999, Kimia Dasar 2, ITB, Bandung.
Baroroh, Umi L. U. 2004. Diktat Kimia Dasar I. Universitas Lambung Mangkurat. Banjarbaru.
Gunawan, Adi dan Roeswati. 2004. Tangkas Kimia. Kartika. Surabaya. Harjadi, W. 1997. Ilmu Kimia Analitik Dasar. PT. Gramedia. Jakarta.
Khopkar, S. M. 1990. Konsep Dasar Kimia Analitik. Universitas Indonesia: Jakarta.
1.2. Dasar Teori
1.2.1. Titrasi
Titrasi merupakan salah satu cara untuk menentukan konsentrasi
larutan suatu zat dengan cara mereaksikan larutan tersebut dengan zat lain yang diketahui konsentrasinya. Prinsip dasar titrasi asam basa didasarkan pada reaksi nertalisasi asam basa. Titik equivalen pada titrasi asam basa adalah pada saat dimana sejumlah asam tepat di netralkan oleh sejumlah basa. Selama titrasi berlangsung terjadi perubahan pH. pH pada titik equivalen ditentukan oleh sejumlah garam yang dihasilkan dari netralisaasi asam basa. Indikator yang digunakan pada titrasi asam basa adalah yang memiliki rentang pH dimana titik equivalen berada. Pada umumnya titik equivalen tersebut sulit untuk diamati, yang mudah diamati adalah titik akhir yang dapat terjadi
sebelum atau sesudah titik equivalen tercapai. Titrasi harus dihentikan pada saat titik akhir titrasi tercapai, yang ditandai dengan perubahan warna
indikator. Titik akhir titrasi tidak selalu berimpit dengan titik equivalen. Dengan pemilihan indikator yang tepat, kita dapat memperkecil kesalahan titrasi. Pada titrasi asam kuat dan basa kuat, asam lemah dan basa lemah dalam air akan terurau dengan sempurna. Oleh karena itu ion hidrogen dan ion hidroksida selama titrasi dapat langsung dihitung dari jumlah asam atau basa yang ditambahkan. Pada titik equivalen dari titrasi asam ke air, yaitu sama dengan 7.
Pada titrasi juga memerlukan Indikator asam-basa untuk mengetahui konsentrasinya. Indikator asam-basa adalah senyawahalokromik yang ditambahkan dalam jumlah kecil ke dalam sampel, umumnya adalah larutan yang akan memberikan warna sesuai dengan kondisi [pH] larutan tersebut.
Tidak semua titrasi membutuhkan indikator. Dalam beberapa kasus, baik reaktan maupun produk telah memiliki warna yang kontras dan dapat digunakan sebagai "indikator". Sebagai contoh, titrasi redoks menggunakan potasium permanganat (merah muda/ungu) sebagai peniter tidak membutuhkan indikator. Ketika peniter dikurangi, larutan akan menjadi tidak berwarna. Setelah mencapai titik ekivalensi, terdapat sisa peniter yang berlebih dalam larutan. Titik ekivalensi diidentifikasikan pada saat munculnya warna merah muda yang pertama (akibat kelebihan permanganat) dalam larutan yang sedang dititer.
Akibat adanya sifat logaritma dalam kurva pH, membuat transisi warna yang sangat tajam; sehingga, satu tetes peniter pada saat hampir mencapai titik akhir dapat mengubah nilai pH secara signifikan, sehingga terjadilah perubahan warna dalam indikator secara langsung. Terdapat sedikit perbedaan antara perubahan warna indikator dan titik ekivalensi yang sebenarnya dalam titrasi.
Kesalahan ini diacu sebagai kesalahan indikator, dan besar kesalahannya tidak dapat ditentukan.
Titrasi asam basa disebut juga titrasi adisi alkalimetri. Kadar atau konsentrasi asam basa larutan dapat ditentukan dengan metode volumetri dengan teknik titrasi asam basa. Volumetri adalah teknik analisis kimia kuantitatif untuk menetapkan kadar sampel dengan pengukuran volume larutan yang terlibat reaksi berdasarkan kesetaraan kimia. Kesetaraan kimia ditetapkan melalui titik akhir titrasi yang diketahui dari perubahan warna indicator dan kadar sampel untuk ditetapkan melalui perhitungan berdasarkan persamaan reaksi.
Banyak metode yang dapat digunakan untuk mengindikasikan titik akhir dalam reaksi; titrasi biasanya menggunakan indikator visual (larutan reaktan yang berubah warna). Dalam titrasi asam-basa sederhana, indikator pH dapat digunakan, sebagai contoh adalah fenolftalein, di mana fenolftalein akan berubah warna menjadi merah muda ketika larutan mencapai pH sekitar 8.2 atau melewatinya. Contoh lainnya dari indikator pH yang dapat digunakan adalah metil jingga, yang berubah warna menjadi merah dalam asam serta menjadi kuning dalam larutan alkali.
TITRASI ASAM BASA (Nanu)
Dipublikasi pada 11 April 2012 oleh nursajadiaufar
TITRASI ASAM BASA A. Tujuan
- Melakukan titrasi asam basa untuk menentukan konsentrasi suatu larutan. B. Dasar teori
Titrasi merupakan salah satu cara untuk menentukan konsentrasi suatu larutan suatu zat dengan cara mereaksikan larutan tersebut dengan zat lain yang diketahui konsentrasinya. Prinsip dasar titrasi asam basa didasarkan pada reaksi netralisasi asam basa.
Titk eqivalen pada titrasi asam basa adalah pada saat dimana sejumlah asa tepat dinetralakan oleh sejumlah basa. Selama titrasi berlangsung terjadi perubahan pH. pH pada titik eqivalen ditentukan oleh sejumlah garam yang dinetralisasi asam basa. Indicator yang digunakan pada titrasi asam basa adalah yang memilki rentang pH dimana titk eqivalen berada. Pada
umumnya titik eqivalen tersebut sulit untuk diamati, yang mudah diamatai adalah titik akhir yang dapat terjadi sebelum atau setelah titik eqivalen tercapai. Titrasi harus dihentikan pada saat titik akhir titrasi dircapai, yang ditandai dengan perubahan warna indicator. Titik akhir titrasi tidak selalu berimpit dengan titk eqivalen. Dengan pemilihsn indicator yang tepat, kita
dapat memperkecil kesalahan titrasi.
Pada titrasi asam kuat dan basa kuat, asam kuat dan basa kuat kan terurai dengan sempurna. Oleh karena itu ion hydrogen dan ion hidroksida selama titrasi dapat dihitung dari jumlah aam atau basa yang ditambahkan. Pada titik eqivalen dari titrasi asam kuat da basa kuat, pH larutan pada temperature 200C sama dengan pH air, yaitu sama denan 7.
C. Metode
Pada percoban kali ini ditentukan konsentrasi larutan asam menggunakan metode titrasi asam basa.
D. Alat da Bahan 1. Alat
o Buret : 1 buah
o Botol semprot : 1 buah o Corong : 1 buah
o Gelas kimia 250 ml : 1 buah o Gelas Erlenmeyer 250 ml : 2 buah o Pipet gondok : 1 buah
2. Bahan o NaOH 0,05 M o HCl o Fenoftalien o Aquades o Kertas o Tissue/saring E. Langkah kerja
1. Bersihkan buret dan bilas dengan NaOH yang akan dipakai sebanyak 3 kali (± 5 ml), kemudian masukan larutan NaOH kedalam buret menggunakn corong sampai volumenya melebihi skala nol buret, kemudian turunkan volume larutan NaOH pada buret sampai tepat skala nol.
2. Pipet 10 ml larutan asam yang akan ditentukan konsentrasinya dengan menggunakan pipet gondok dan masukkan kedalam labu Erlenmeyer dengan teknik yang benar.
3. Tambahkan aquades kedalam labu Erlenmeyer + 5 ml, untuk membilas larutan yang menempel pada labu Erlenmeyer, tambahkan 3 tetes indicator fenoftalein.
4. lakukan titrasi dengan cara meneteskan larutan NaOH dari buret secara perlahan-lahan tetes demi tetes sampai larutan akan berubah warna.
5. Catat kadaan akhir buret yang menunjukan volume larutan NaOH yang akan dipakai, yakni selisih volume dengan volume akhir.
6. Ulangi percobaan sebanyak dua kali (duplo)
7. Hitung konsentrasi larutan yang telah dititrasi dengan menggunakan rumus. F. Analaisis data
Untuk menentukan konsentrasi asam menggunakan rumus : V1N1 = V2N2
V1 = volume larutan V2 = volume larutan basa
N1 = normalitas larutan asam N2 = normalitas larutan asam G. Hasil pengamatan
Percobaan I
Indikator Warna HCl sebelum titrasi Warna HCl setelah titrasi Fenolftalein Tidak berwarna Merah muda pias
Dan diketahui volume NaOH yang terpakai = 25 ml v.awal NaOH = 50 ml V0 HCL = 10 ML V2 = 12 ml Perrcobaan I V NaOH.N NaOH = VHCL . NHCL 25.0,025 = 10. NHCL 1,25 = 10 NHCL NHCL = 1,25 10 = 0,125 Percobaan II
Indikator Warna HCl sebelum titrasi Warna HCl setelah titrasi Fenolftalein Tidak berwarna Merah muda (ping)
Dan diketahui volume NaOH yang terpakai = 12 ml Persamaan reaksimya : V = 25 ml Pp = 2 tetes Aq = 5 ml Percobaan II P = 25-37 = 12 V NaOH.N NaOH = VHCL . NHCL 12.0,05 = 10 V. NHCL 0,6 = 10. NHCL NHCL2 = 0,6 10 = 0,06
NaOH + HCl NaCl + H2O N = m.a
= 0,05.1 = 0,05
NHCL = 0,125 + 0,06 = 0,185
2 = 0,093
Hasil percobaan I & II
1. pada percobaan yang pertama NaOH 0,05 M dan mempunyai volume 25 ml, selah dititrasi warnanya menjadi pink.
2. pada percobaan yang kedua volume NaOH yang dipakai adalah 12 ml dan warnanya berubah menjadi pink muda.
H. PEMBAHASAN
Pada praktikum kali ini kita membahas tentang titrasi Asam-Basa. Titrasi ini adalah salah satu cara untuk menentukan konsentrasi larutan suatu zat adalah dengan cara mereaksikannya dengan zat lain yang sudah diketahui konsentrasinya. percobaan ini bertujuan untuk melakukan titrasi asam basa untuk menentukan konsentrasi suatu larutan.sedangkan pada pengertian titikk eqivalen pada titrasi asam basa adalah pada saat dimana sejumlah asam tepat dinetralkan oleh sejumlah basa.
Dalam titrasi, larutan yang telah diketahui konsentrasinya yaitu NaOH 0,05 M ditempatkan dalam buret. NaOH disini disebut larutan baku atau larutan standar. Dan larutan yang akan dititrasi/ditentukan konsentrasinya yaitu 10 mL larutan HCl dan 5 mL H2O ditempatkan dalam labu erlenmeyer.
Pada saat praktikum, larutan HCl + H2O di dalam labu enlenmeyer ditetesi dengan 3 tetes indikator fenolftalein. Kemudian erlenmeyer diletakkan di bawah buret yang di dalamnya sudah terisi larutan NaOH 0,05 M. ketika larutan NaOH perlahan-lahan mulai menetes dari buret kedalam erlenmeyer, akan terjadi perubahan warna dari bening menjadi warna merah muda. Terjadinya perubahan warna ini terjadi karena adanya penambahan indikator. Hal ini menunjukan bahwa seluruh HCl telah bereaksi. Reaksi yang terjadi adalah reaksi netralisasi. Persamaan reaksinya adalah sebagai berikut:
NaOH + HCl NaCl + H2O
Sebelum adanya penambahan NaOH kedalam HCl, baik HCl maupun NaOH tidak terlihat adanya perubahan warna. HCl adalah suatu asam kuat yang dapat melepaskan ion H+, persamaan reaksinya adalah sebagai berikut:
HCl H+ +
Cl-Dan NaOH adalah suatu basa kuat yang dapat melepaskan ion OH-, persaman reaksinya adalah sebagai berikut:
NaOH Na+ +
OH-Ketika larutan sudah berubah warna dari yang semula bening berubah menjadi merah muda, penetesan dihentikan. Dari hasil analisis data didapatkan hasil:
Pada percobaan yang pertama didapatkkan selisih volumenya adalah 12 ml, dari percobaan tersebut kita dapat menghitung konsentrasi HCl dengan menggunakan rumus
V1N1 = V2N2
N1 = normalitas larutan asam N2 = normalitas larutan asam
Dari hasil perhitungan didapatkan konsentrasi HCl adalah 0,125 M. cara yang digunakan pada percobaan kedua adalah sama dengan percobaan pertama, konsentrasi HCl tersebut adalah 0,06 M
• Sehingga konsentrasi HCl dapat diketahui yaitu sebesar 0,125 M. berarti mempunyai nilai pH = 2– log 12,5 pada suasana asam.
• Pada percobaan kedua, didapat volume NaOH yang terpakai adalah 12 mL. Sehingga konsentrasi HCl dapat diketahui yaitu sebesar 0,06 M. berarti mempunyai nilai pH = 2 –l og 6 pada suasana asam.
Setelah adanya penambahan NaOH sebanyak 4/5 mL, titik akhir titrasi tercapai. Pada kondisi tersebut, pH larutan bersifat netral dan seluruh HCl telah habis bereaksi sehingga larutan fenolftalein tidak berwarna. Dengan adanya penambahan NaOH menyebabkan nilai pH larutan akan meningkat, sehingga indikator fenolftalein berubah warna menjadi merah muda dan titik akhir titrasi tercapai.
Selain menggunakan perhitungan, pH juga dapat diketahui menggunakan larutan indikator. Indikator asam-basa merupakan suatu zat yang dapat berubah warna pada PH tertentu. Sifat inilah yang dimanfaatkan untuk mengetahui nilai pH suatu larutan.
Harga trayek pH larutan indikator adalah sebagai berikut: Indikator Trayek pH Perubahan Warna
Fenolftalein Metil Ungu Metil Kuning Bromkesol Hijau Metil Merah Bromtimol Biru Kuning Alizarin 8.0 – 9.6 0.5 – 1.5 2.0 – 3.0 3.1 – 4.4 3.8 – 5.4 6.0 – 7.6
10.1 – 12.0 Tidak Berwarna – Merah Kuning – Violet
Merah – Kuning Kuning – Biru Merah – Kuning Kuning – Biru
Tidak Berwarna – Biru I. KESIMPULAN
Dari hasil praktikum dan analisis data dapat disimpulkan bahwa salah satu cara untuk menentukan konsentrasi larutan suatu zat adalah dengan cara titrasi, yaitu mereaksikannya dengan zat lain yang sudah diketahui konsentrasinya.
• Pada percobaan pertama, didapat volume NaOH yang terpakai adalah 25. Sehingga
konsentrasi HCl dapat diketahui yaitu sebesar 0,125M. berarti mempunyai nilai pH = 2 – log 12,5 pada suasana asam.
• Pada percobaan kedua, didapat volume NaOH yang terpakai adalah 12 mL. Sehingga konsentrasi HCl dapat diketahui yaitu sebesar 0,06 M. berarti mempunyai nilai pH = 2 –l og 6 pada suasana asam.
Jadi, setelah adanya penambahan NaOH sebanyak 4/5 mL, titik akhir titrasi tercapai. Pada kondisi tersebut, pH larutan bersifat netral dan seluruh HCl telah habis bereaksi sehingga larutan fenolftalein tidak berwarna. Dengan adanya penambahan NaOH menyebabkan nilai pH larutan akan meningkat, sehingga indikator fenolftalein berubah warna menjadi merah muda dan titik akhir titrasi tercapai.
Cirebon, 11 April 2012
http://nursajadidotcom.wordpress.com http://sesaat-fajar29.blogspot.com