ANALISIS ASAM CUKA DALAM CUKA PERDAGANGAN SECARA TITRIMETRI
Tujuan : Membuat prosedur sederhana dan menentukan kadar asam cuka dalam cuka perdagangan secara titrasi asidi-alkalimetri. Jurusan/Fakultas : Pendidikan Kimia/MIPA
Nama Kelompok : I Gusti Ayu Pratiwi (1113031043)
Made Erna Sukmayani (1213031033) Ni Made Desy Rosita Dewi (1213031043)
I. DASAR TEORI
Studi kuantitatif mengenai reaksi penetralan asam-basa dapat dilakukan dengan menggunakan prosedur yang disebut dengan titrimetri (titrasi). Dalam analisis titrimetri, analit direaksikan dengan suatu pereaksi yang konsentrasinya diketahui dengan tepat untuk bereaksi secara ekivalen. Pereaksi yang digunakan disebut larutan standar dan konsentrasi larutan ditentukan dengan proses yang disebut standarisasi.
Secara garis besar analisis titrimetri dibedakan menjadi empat jenis, diantaranya (Selamat, 2008):
1. Titrasi asam-basa, yaitu titrasi yang menyangkut reaksi penetralan asam-basa.
2. Titrasi redoks, yaitu titrasi yang reaksinya melibatkan perpindahan elektron, dimana terdapat unsur-unsur yang mengalami perubahan tingkat oksidasi.
3. Titrasi presipitimetri, yaitu titrasi yang melibatkan pembentukan endapan.
4. Titrasi kompleksometri, yaitu titrasi yang berdasarkan pada pembentukan senyawa kompleks (ion kompleks atau garam yang sukar mengion).
Berdasarkan larutan standar yang digunakan, titrasi asam basa dibedakan atas dua, yaitu asidimetri dan alkalimetri. Asidimetri dan alkalimetri termasuk reaksi penetralan karena terjadi reaksi antara ion hidrogen yang berasal dari asam dengan ion hidroksida yang berasal dari basa untuk menghasilkan air yang bersifat netral. Penetralan atau reaksi netralisasi melibatkan donor proton (asam) dengan penerima proton (basa).
H+
▸ Baca selengkapnya: mengapa cangkang telur terkelupas setelah direaksikan dengan asam cuka
(2)Titrasi Asidimetri adalah titrasi netralisasi dengan menggunakan larutan standar asam terhadap basa bebas atau basa yang terbentuk dari hidrolisis garam yang berasal dari basa kuat. Sedangkan alkalimetri adalah titrasi asam basa untuk menentukan kadar suatu senyawa-senyawa yang bersifat asam dengan menggunakan larutan standar basa (Selamat, 2004).
Untuk titrasi alkalimetri, proses titrasi dengan larutan standar basa digunakan untuk mentitrasi asam bebas atau asam yang terbentuk dari hidrolisis garam yang berasal dari basa lemah. Sedangkan untuk titrasi asidimetri digunakan larutan standar asam. Dengan demikian titrasi netralisasi menyangkut (Selamat, 2008):
1) titrasi antara asam kuat dengan basa kuat, 2) titrasi asam kuat dengan basa lemah, 3) titrasi asam lemah dengan basa kuat,
4) titrasi asam kuat dengan garam dari basa lemah, 5) titasi basa kuat dan garam dari asam lemah.
Reaksi dalam titrasi dilakukan dengan menambahkan suatu larutan dari buret secara perlahan-lahan sampai jumlah zat yang direaksikan tepat ekivalen satu sama lain. Larutan yang ditambahkan dari buret disebut titran, sedangkan larutan yang ditambahkan titran disebut titrat. Zat yang digunakan sebagai pereaksi dalam titrasi harus memiliki kemurnian yang tinggi. Akan tetapi, ada beberapa zat yang sulit didapat dalam keadaan murni, sehingga harus distandarisasi terlebih dahulu. Standarisasi adalah suatu cara untuk menentukan konsentrasi larutan standar dengan tepat.
Larutan standar dalam titrasi ada yang bersifat primer dan sekunder. Suatu zat dapat dipakai sebagai larutan standar primer jika memenuhi syarat-syarat sebagai berikut (Selamat, 2008):
a. Mudah didapat dalam bentuk murni.
b. Mudah dikeringkan dan tidak bersifat higroskopis. c. Mempunyai berat molekul besar.
d. Dalam bentuk asam atau basa kuat sehingga terdisosiasi tinggi.
Suatu zat yang dapat digunakan sebagai larutan standar, tetapi tidak memenuhi syarat-syarat larutan standar primer disebut sebagai larutan standar sekunder. Larutan standar sekunder dapat digunakan sebagai larutan standar dengan cara menstandarisasi terlebih dahulu dengan
larutan standar primer yang bisa dibuat secara langsung dengan menimbang sejumlah tertentu dalam volume tertentu (dibuat dengan mengencerkan volume tertentu).
Selain itu, dalam titrasi asidi dan alkalimetri ini juga digunakan zat yang dapat mengindikasikan telah tercapainya titik ekivalen yang disebut dengan indikator. Indikator merupakan bahan yang menjadi penunjuk, misalnya zat warna yang warnanya bergantung pada keasaman suatu larutan yang dapat dijadikan penunjuk nilai larutan (Eramedia, 2008). Indikator asam basa merupakan asam organik lemah dan basa organik lemah yang mempunyai dua warna dalam pH larutan yang berbeda. Pada titrasi asam dengan basa, maka indikator yang digunakan adalah asam kedua yang merupakan asam yang lebih lemah dan konsentrasi indikator berada pada tingkat kecil (Adam, 2011).
Titrasi yang dilakukan dengan menambahkan indikator, umumnya perubahan warna atau kekeruhan terjadi karena reaksi antara indikator dengan titran. Warna dalam keadaan asam atau basa dinamakan warna asam atau basa indikator. Setiap indikator memiliki trayek pH yang berbeda-beda, serta warna asam dan basa sesuai dengan jenis indikatornya.
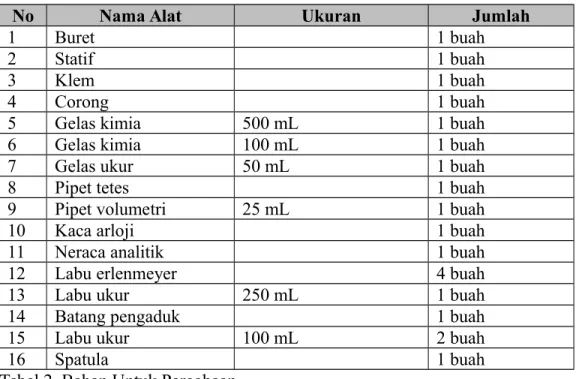
II. ALAT DAN BAHAN Tabel 1. Alat Untuk Percobaan
No Nama Alat Ukuran Jumlah
1 Buret 1 buah
2 Statif 1 buah
3 Klem 1 buah
4 Corong 1 buah
5 Gelas kimia 500 mL 1 buah
6 Gelas kimia 100 mL 1 buah
7 Gelas ukur 50 mL 1 buah
8 Pipet tetes 1 buah
9 Pipet volumetri 25 mL 1 buah
10 Kaca arloji 1 buah
11 Neraca analitik 1 buah
12 Labu erlenmeyer 4 buah
13 Labu ukur 250 mL 1 buah
14 Batang pengaduk 1 buah
15 Labu ukur 100 mL 2 buah
16 Spatula 1 buah
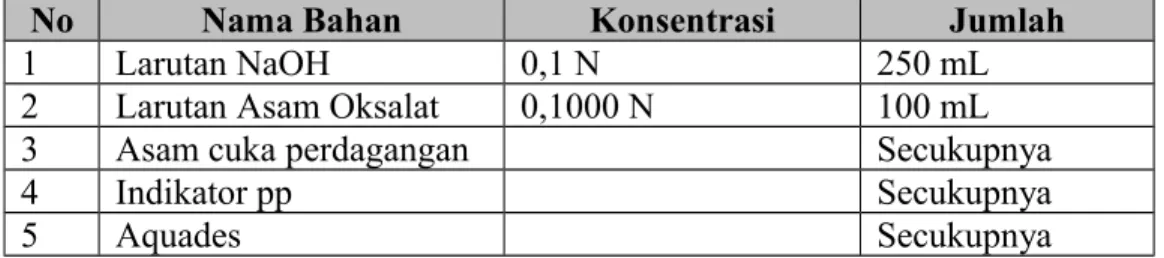
No Nama Bahan Konsentrasi Jumlah
1 Larutan NaOH 0,1 N 250 mL
2 Larutan Asam Oksalat 0,1000 N 100 mL
3 Asam cuka perdagangan Secukupnya
4 Indikator pp Secukupnya
5 Aquades Secukupnya
III. PROSEDUR KERJA DAN HASIL PENGAMATAN
Tabel 3. Prosedur Kerja dan Hasil Pengamatan Analisis Asam Cuka Dalam Cuka Perdagangan Secara Titrimetri
No. Prosedur Kerja Hasil Pengamatan
Standarisasi larutan NaOH 1. Larutan NaOH 0,1 N dibuat sebanyak
250 mL dengan melarutkan sejumlah tertentu NaOH.
2. Larutan H2C2O4 0,1000 N dibuat
3 Sebanyak 10 mL larutan H
2C2O4
0,1000 N ke dalam erlenmeyer dan ditambahkan 3-4 tetes indikator fenolftalein (PP).
4 Titrasi dilakukan dengan menggunakan larutan NaOH yang akan distandarisasi.
5 Volume NaOH (yang digunakan) dicatat dan konsentrasi NaOH ditentukan dalam normalitas. Titrasi dilakukan minimal 3 kali.
Penentuan kadar cuka dalam sampel 1 Sampel asam cuka perdagangan
diencerkan dalam aquades sampai volume 100 mL.
No Titrasi Ke Volume NaOH
1 I mL
2 II mL
3 III mL
2 Sebanyak 10 mL larutan tersebut dimasukkan ke dalam erlenmeyer.
3 Indikator pp ditambahkan ke dalam larutan sebanyak 2-3 tetes.
Titrasi menggunakan larutan NaOH dan volume NaOH yang digunakan dicatat.
No Titrasi Ke Volume NaOH
1 I mL
2 II mL
3 III mL
5 Titrasi dilakukan sebanyak tiga kali dan konsentrasi (persen) cuka dalam sampel ditentukan
Laboran,
I Ketut Lasia, S.Pd, M.Pd NIP. 197212232001121001
Dari hasil percobaan yang dilakukan maka dapat ditarik kesmpulan sebagai berikut: 1. Prosedur percobaan sederhana penentuan kadar asam cuka dalam cuka perdagangan
adalah:
a. Ditentukan konsentrasi asam cuka yang akan dititrasi dengan mengkonversi % asam cuka dari label botol kemasan kedalam normalitas (N). Apabila tidak sesuai dengan
konsentrasi titran (konsentrasi asam cuka terlalu tinggi) bisa dilakukan pengenceran sehingga didapat konsentrasi 0,1 N.
b. Dibuat larutan NaOH dengan konsentrasi 0,1 N.
c. Dibuat larutan standar Asam Oksalat (H2C2O4) dengan konsentrasi 0,1 N.
d. Terlebih dahulu NaOH 0,1 N distandardisasi dengan H2C2O4 0,1 N. Asam oksalat sebagai
titrat, sedangkan NaOH sebagai titran. Indikator yang digunakan dalam titrasi adalah indikator fenolftalein (PP). Konsentrasi NaOH hasil standarisasi dihitung.
e. Dengan menggunakan pipet volume, dipipet 10 mL larutan asam cuka (yang telah dititrasi) dan dimasukkan ke dalam labu erlenmeyer.
f. Ditambahkan 2-3 tetes indikator fenolptalein.
g. Dimasukkan larutan NaOH yang telah distandarisasi sebagai zat peniter (titran) ke dalam buret.
h. Sambil menggoyang-goyangkan labu, diteteskan sedikit demi sedikit larutan NaOH ke dalam labu erlenmeyer dan diamati perubahan warna dari indikator.
i. Titrasi dihentikan ketika titik akhir titrasi dicapai, yang ditandai dengan perubahan warna indikator dari tidak berwarna menjadi merah, pada keadaan netral atau kelebihan sedikit basa.
j. Diulangi titrasi minimal sebanyak 3 kali.
2. Kadar asam cuka dalam cuka perdagangan yang didapatkan melalui percobaan adalah 23,4 %.