Laporan Praktikum Kimia Analisa
Acidi dan Alkalimetri
Disusun oleh : Hasan Djadid Assegaf
1431010056
Laboratorium Pengantar Teknik Kimia I
Program Studi Teknik Kimia
Fakultas Teknologi Industri
Universitas Pembangunan Nasional “Veteran” Jawa
Timur
Tugas Bahasa indonesia
Menyusun Karya Tulis Ilmiah
Laporan Praktikum Kimia Analisa Acidi dan Alkalimetri
Disusun oleh : Hasan Djadid Assegaf
1431010056
Laboratorium Pengantar Teknik Kimia I
Program Studi Teknik Kimia
Fakultas Teknologi Industri
Universitas Pembangunan Nasional “Veteran” Jawa
Timur
DAFTAR ISI II.7 Faktor-faktor kesalahan pada
II.8 Sifat
kuat sebagai titrannya dan sebagai analitnya adalah basa atau senyawa yang bersifat basa. Sedangkan alkalimetri pada prinsipnya adalah analisa titrimetri yang menggunakan basa kuat sebagai titrannya dan analitnya adalah asam atau senyawa yang bersifat asam. Percobaan ini bertujuan untuk membuat larutan standar HCl 0,1 N dan menetapkan konsentrasi larutan tersebut dengan cara standarisasi dengan larutan borax dan natrium karbonat anhidrous, membuat larutan standar primer asam oksalat dan menentukan kadar asam cuka yang diperdagangkan.
Dalam percobaan ini larutan dibuat dengan cara pengenceran kemudian dilakukan titrasi dengan larutan-larutan standar tertentu sehingga didapatkan harga konsentrasi dari larutan hasil pengenceran tersebut. Selain itu dalam percobaan ini digunakan metode titrimetri untuk menganalisa kadar suatu sampel dengan proses asidimetri maupun alkalimetri.
Dari hasil percobaan didapatkan larutan hasil standarisasi HCl adalah 0,0662 N dan 0,867 N dan larutan hasil standarisasi NaOH adalah 0,0113 N, Sedangkan kadar asam cuka yang diteliti adalah 0,24 %, serta kadar NH3 yang terkandung dalam 0,2 gram NH4Cl adalah sebesar 10,75 %
KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT, karena atas berkat dan rahmat-Nya penulis dapat menyelesaikan Laporan Praktikum Kimia Analisa Titrasi Asidi-Alkalimetri dengan sebaik-baiknya dan tepat pada waktunya.
Adapun tujuan dari penulisan laporan ini adalah sebagai syarat untuk menyelesaikan Tugas Mata Kuliah Bahasa Indonesia. Selain itu pembuatan Laporan Praktikum Kimia Analisa ini adalah sebagai bukti hasil dari percobaan-percobaan yang dilakukan saat praktikum, dan untuk melengkapi tugas dari Praktikum Kimia Analisa.
Penulisan laporan ini didasarkan pada hasil percobaan yang dilakukan selama praktikum serta literatur-literatur yang ada baik
dari buku maupun sumber lainnya.
Dengan ini, praktikan juga menyampaikan terima kasih kepada : 1. Orang tua yang telah memberikan dukungan baik materil
maupun spiritual.
2. Kepala Laboratorium Kimia Analisa, Ibu Ir. Dwi Hery Astuti, MT.
3. Asisten-asisten Laboratorium Kimia Analisa, terutama asisten yang menangani modul ini.
4. Rekan-rekan mahasiswa seangkatan yang membantu praktikan dalam pelaksanaan praktikum dan dalam penulisan laporan ini.
Laporan ini merupakan tulisan yang dibuat berdasarkan percobaan yang telah dilakukan. Tentu ada kelemahan dalam teknik pelaksanaan maupun dalam tata penulisan laporan ini. Maka saran-saran dari pembaca dibutuhkan dalam tujuan menemukan refleksi untuk peningkatan mutu dari laporan serupa di masa mendatang.
Surabaya, Mei 2015
BAB I PENDAHULUAN I.1 Latar Belakang
Asidimetri dan alkalimetri merupakan analisis titrimetrik. Analisis titrimetrik adalah salah satu divisi besar dalam kimia analitik dan merupakan salah satu teknik yang akurat terutama dalam orde mmol. Asidimetri adalah pengukuran konsentrasi asam dengan menggunakan larutan baku basa,sedangkan alkalimeteri adalah pengukuran konsentrasi basa dengan menggunakan larutan baku asam. Oleh sebab itu, keduanya disebut juga sebagai titrasi asam-basa. Perhitungan yang tercakup di dalamnya didasarkan pada hubungan stoikiometri dari reaksi kimia yang sederhana.
Metode ini relatif cepat dan dapat diotomatisasi. Mengukur volume larutan adalah jauh lebih cepat dibandingkan dengan menimbang berat suatu zat dengan suatu metode gravimetri. Dalam analisa titrimetrik, zat yang akan dianilisis dibiarkan bereaksi dengan zat lain yang konsentrasinya diketahui dan dialirkan dari buret dalam bentuk larutan, dan konsentrasi larutan yang tidak diketahui ( analit ) kemudian dihitung.
Pada praktikum kimia analisa ini praktikan melakukan percobaan menganalisa kadar Na2CO3 dan NaHCO3 dalam sample serta menganalisa kadar CaCO3 dalam batu
I.2 Tujuan Praktikum
1. Menganalisa kadar Na2CO3 dan NaHCO3 dalam sampel.
2. Standarisasi HCl dengan Na borak 0,1 N untuk menentukan volume standar larutan HCl.
3. Standarisasi NaOH dengan HCl yang telah distandarisasi untuk menentukan volume standar larutan NaOH.
I.3 Manfaat Praktikum
1. Mengetahui bagaimana cara menganalisa kadar Na2CO3 dan NaHCO3 dalam
sampel.
2. Mengetahui bagaimana cara mentritasi yang benar sesuai standarisasi.
BAB II
TINJAUAN PUSTAKA
II.1 Teori Umum
Analisis volumetri atau titrimetri merupakan suatu analisis berdasarkan pengukuran volume larutan dengan konsentrasi yang diketahui, yang diperlukan untuk bereaksi dengan analit (zat yang akan ditentukan). Analisis volumetri atau titrimetri berdasarkan pada reaksi :
aA + tT ↔ Hasil
dimana a molekul analit A bereaksi dengan t molekul pereaksi T (titran).[1]
Jenis metode titrimetri didasarkan pada jenis reaksi kimia yang terlibat dalam proses titrasi. Berdasarkan jenis reaksinya, maka metode titrimetri dapat dibagi menjadi 4 golongan, yaitu: asidi-alkalimetri, oksidimetri, kompleksometri dan titrasi pengendapan.
HA + OH- à A- + H2O (analit asam, titran basa) BOH + H3O+ à B+ + 2H2O (analis basa, titran asam)
Titran umumnya berupa larutan standar asam kuat atau basa kuat, misalnya larutan asam klorida (HCl) dan larutan natrium hidroksida (NaOH).
(Dosen Pengampu Kimia Analisa: 2015)
II.2 Asidi Alkali Metri
Asidimetri dan alkalimetri yaitu 2 macam kelompok dari titrasi netralisasi. Asidimetri dan alkalimetri sering juga disebut dengan titrasi asidimetri dan titrasi alkalimetri.
Larutan standart/larutan baku adalah suatu larutan yang konsentrasinya telah diketahui dengan pasti dan teliti. Dimana, proses penambahan larutan standart ke dalam larutan analit sampai terjadi reaksi sempurna disebut proses titrasi.
(Dosen Pengampu Kimia Analisa: 2015
II.3 Indikator Asam-Basa
Indikator asam-basa adalah zat yang berubah warnanya atau membentuk fluoresen atau kekeruhan pada suatu range (trayek) pH tertentu. Indikator asam-basa terletak pada titik ekuivalen dan ukuran dari pH. Zat-zat indikator dapat berupa asam atau basa, larut, stabil dan menunjukkan perubahan warna yang kuat serta biasanya adalah zat organik. Perubahan warna disebabkan oleh resonansi isomer elektron. Berbagai indikator mempunyai tetapan ionisasi yang berbeda dan akibatnya indikator menunjukkan warna pada range pH yang berbeda.
Indikator Trayek pH Warna
Asam Basa
Kuning metal 2,4 – 4,0 Merah Kuning
Biru bromfenol 3,0 – 4,6 Kuning Biru
Jingga metal 3,1 – 4,4 Jingga Metil
Hijau
bromkresol 3,8 – 5,4 Kuning Biru
Merah metal 4,2 – 6,3 Merah Kuning
Ungu
bromkresol 5,2 – 6,8 Kuning Ungu
Biru bromtimol 6,1 – 7,6 Kuning Biru
Merah fenol 6,8 – 8,4 Kuning Merah
Merah kresol 7,2 – 8,8 Kuning Merah
Biru timol 8,0 – 9,6 Kuning Biru
Fenolftalein 8,2 – 10,0 Tak berwarna Merah
Timolftalein 9,3 – 10,5 Tak berwarna Biru
(Petrucci :2008:62)
Air yang dipakai sehari – hari bukanlah air murni, tetapi mengandung berbagai zat terlarut yang tidak diketahui dengan pasti. Bila mengandung senyawa elektrolit, kemungkinan air akan bersifat asam atau basa, yang ditentukan dengan kertas lakmus.
prganik lemah yang membentuk ion dan berntuk tak-terdisodiasinya menunjukkan warna yang berlainan. Molekul – molekul semacam itu dapat digunakan untuk menetapkan kapan telah ditambahkan cukup titran dan disebut indicator tampak.
Indikator fenolftalein yang dikenal baik adalah asam dwiprotik dan tak berwarna. Mula – mula zat ini tersisosiasi menjadi suatu bentuk tak berwarna dan kemudian dengan kehilangan proton kedua, menjadi ion dengan system konjugasi, timbulah warna merah. Jingga metil, suatu indicator lain yang luas pemakaiannya, adalah suatu basa dan berwarna kuning dalam bentuk molekulnya. Penambahan ipn hifropgen akan menghasilkan kation yang berwarna merah muda.
(Dosen Pengampu Kimia Analisa: 2015)
II.4 Titrasi
Titrasi merupakan metode analisis kimia secara kuantitatif yang biasa digunakan dalam laboratorium untuk menentukan konsentrasi dari reaktan. Karena pengukuran volum memainkan peranan penting dalam titrasi, maka teknik ini juga dikenali dengan analisis volumetrik. Analisis titrimetri merupakan satu dari bagian utama dari kimia analitik dan perhitungannya berdasarkan hubungan stoikhiometri dari reaksi-reaksi kimia
Dalam proses titrasi ada beberapa hal yang perlu diperhatikan, yaitu :
1. Indikator titrasi, yaitu zat kimia lain, analit atau titran yang sengaja ditambahkan pada proses titrasi untuk mengetahui titik ekivalen.
2. Titik Ekivalen/titik akhir teoritis, yaitu saat dimana reaksi tepat berlangsung sempurna.
3. Titik Akhir titrasi, yaitu suatu peristiwa dimana indikator telah menunjukkan warna dan titrasi harus dihentikan.
(James.1999:24)
II.5 Pembuatan Alkali Standar
suatu larutan standar yang dapat dibuat dengan melarutkan suatu bobot yang diketaui dalam volume air tertentu. Baik natrium hidroksida maupun kalium hidroksida adalah teramat higroskopik senantiasa ada serta jumlah tertentu alkali karbonat dan air. Hasil – hasil eksak tak dapat diperoleh dengan adanya karbonat, dengan beberapa indicator, maka dari itu perlulah metode – metode untuk pembuatan larutan yang bebas karbonat.
(Laboran Kimia Analisa UPN ‘VETERAN’ JATIM. 2015)
II.6 Pembuatan Asam Standar
Dua asam, yaitu asam klorida dan asam sulfat, sangat luas digunakan untuk membuat larutan asam standar. Kedua zat ini tersedia secara kormesial sebagai larutan pekat; asam klorida pekat adalah kira – kira 10,5-12M, dan asam sulfat pekat adalah kira – kira 18M. Dengan pengenceran yang sesuai, dapat dengan mudah dibuat larutan dengan kuat kira – kira seberapapun yang dikehendaki.
Asam klorida umumnya lebih disukai, karena kebanyakn klorida dapat larut dalam air. Asam sulfat membentuk garam yang tak dapat larut dengan kalsium dan barium hidroksida; namun untuk titrasi cairan panas atau untuk penetapan yang memerlukan pendidihan beberapa lama dengan asam berlebih, asam sulfat standar lebih disukai.
Asam nitrat jarang digunakan, karena hamper tidak pernah menganduk sedikit asam nitrit, yang mempunyai aksi destruktif terhadap banyak indicator.
1. Pembentukan asam klorida bertitik didih konstan
2. Pembuatan secara langsung asam klorida 0.1 M dari asam bertitik didih konstan
3. Pembuatan asam klorida kira kira 0.1M dan standarisasi
II.7 Faktor-Faktor Kesalahan Pada Percobaan Asidi-Alkalimetri
Pada pecobaan ada beberapa faktor-faktor kesalahan yang
menyebabkan ketidakuratan hasil tirasi yang didapat, antara lain :
1. Kurang telitinya dalam melakukan proses titrasi.
2. Kurang tepatnya pada saat pembuatan larutan NaOH, seperti
pada saat penimbangan
3. Kurangnya ketelitian dalam memperhatikan perubahan warna
4. Terlalu banyak meneteskan indikator pp
(Dosen Pengampu Kimia Analisa: 2015)
II.8 Sifat Bahan 1. Aquadest
Sifat fsika :
a. Rumus molekul : H2O
b. Massa molar : 18.0153 g/mol
c. Densitas dan fase : 0.998 g/cm³ (cariran pada 20 °C) d. Titik didih : 100 °C (373.15 K) (212 °F)
Sifat kimia :
Pada kisaran suhu yang sesuai bagi kehidupan, yakni 0o C (32o F) – 100o C, air berwujud cair.Suhu 0o C merupakan titik beku (freezing point) dan suhu 100o C merupakan titik didih (boiling point) air.
(Wikipedia:2014) 2. Na Borak
A.Sifat fisika :
1. Bentuk : Serbuk kristal putih 2. Tidak berbau
3. Stabil pada suhu serta tekanan normal 4. Energi ionisasi : 1250 kj/mol
5. Kalor jenis : 0,115 kal/gr0C
B.Sifat Kimia :
1 .Larut dalam air
2. Tidak larut dalam alkohol 3.pH 9,5
3. HCl
A. Sifat Fisika a. Massa atom : 36,45
b. Massa jenis : 3,21 gr/cm3. c. Titik leleh : -1010C
d. Energi ionisasi : 1250 kj/mol e. Kalor jenis : 0,115 kal/gr0C
f. Pada suhu kamar, HCl berbentuk gas yang tak berwarna g.Berbau tajam.
(Wikipedia:2014) 4. NaOH
A.Sifat fisika
1. Berbentuk putih padat dan tersedia dalam bentuk pelet, serpihan, butiran ataupun larutan jenuh 50%.
2. Bersifat lembab cair
3.Secara spontan menyerap karbon dioksida dari udara bebas.
4. Sangat larut dalam air dan akan melepaskan panas ketika dilarutkan.
5.Larut dalam etanol dan metanol
6.Tidak larut dalam dietil eter dan pelarut non-polar lainnya
7.larutan natrium hidroksida akan meninggalkan noda kuning pada kain B.Sifat kimia
2. Indikator MO ini berubah warna dari merah pada pH dibawah 3.1 dan menjadi warna kuning pada pH diatas 4.4 jadi warna transisinya adalah orange
B. Sifat Kimia
titik ekivalen tidak tepat memotong pada bagian curam dari kurva titrasi, hal ini disebabakan karena titrasi ini saling menetralkan sehungga akan berhenti pada pH 7.
2. Titrasi Asam lemah oleh Basa kuat. Jelas tidak boleh digunakan karena pada pH + 9. untuk konsentrasi 0,1 M
3. Titrasi Basa lemah oleh Asam kuat, dapat dipakai, tetapi harus hati-hati, titrasi harus dihentikan asal sudah terjadi perubahan warna.
4. Titrasi Garam dari Asam lemah oleh Asam kuat. MO dapat dipakai tetapi titrasi harus dihentikan setelah warna berubah.
(Ripani : 2014)
Natrium Karbonat
A. Sifat Fisika
1. Rumus molekul : Na2CO3
2. Berat molekul : 106 gr/mol 3. Titik lebur, 1 atm : 8510 ⁰C 4. Kelarutan : 7,1 g/100 g H2O
5. Densitas, : 2,533 gr/ ml
6. Panas spesifik, 30 ⁰C : 0,89 cal/ mol 7. Panas penguapan : 7.000 cal/ mol B. Sifat kimia
1. CO2 murni dapat diperoleh dari melakukan pemanasan natrium bikarbonat
pada persamaan berikut
2 NaHCO3 --> Na2CO3 + CO2 + H2O
2. Manfaat utamanya adalah sebagai bahan pendingin dalam pemadam kebakaran serta untuk minuman yang berkarbonat, soda untuk mencuci (Na2CO3.10H2O), soda kue (NaHCO3) dan timbale pemutih
[Pb3(OH) 2(CO3) 2].
(Wikipedia : 2014)
7 Natrium Bikarbonat
1. Rumus molekul : NaHCO3. Dalam penyebutannya kerap disingkat menjadi
bicnat. Senyawa ini termasuk kelompok garam dan telah digunakan sejak lama.
2. Berbentuk kristalyang sering terdapat dalam bentuk serbuk.
3. Natrium bikarbonat larut dalam air.
B. Sifat Kimia
1. NaHCO3 umumnya diproduksi melalui proses Solvay, yang memerlukan
reaksi natrium klorida, amonia, dan karbon dioksida dalam air. NaHCO3 diproduksi sebanyak 100 000 ton/tahun (2001).
2. Soda kue juga diproduksi secara komesial dari soda abu (diperoleh melalui penambangan bijih trona, yang dilarutkan dalam air lalu direaksikan dengan karbon dioksida. Lalu NaHCO3mengendap sesuai persamaan berikut
Na2CO3 + CO2 + H2O → 2 NaHCO3
(Wikipedia : 2014)
8 CaCO3
A. Sifat Fisika
1. Massa molar 100.0869 g/mol 2. Wujud bubuk putih lembut 3. Tidak berbau
4. Massa jenis 2.711 g/cm3 (kalsit), 2.83 g/cm3 (aragonit) 5. Titik lebur 1339 °C (kalsit), 825 °C (aragonit)
6. Titik didih tidak ada (mendekomposisi) 7. Kelarutan dalam air 0.0013 g/100 mL (25°C)
B. Sifat Kimia
3. Terbakar pada suhu 825 °C
BAB III
METODE PRAKTIKUM III.1 Waktu Praktikum
Praktikum Acidi Alkalimetri telah dilakukan pada 7 Mei 2015 pada pukul 08.00 WIB
III.2 Metode Praktikum
Metode yang dinukan dalam praktikum ini yaitu Metode analisis dengan volumetri ataupun titrimetri menggunakan prinsip asam basa adalah asidi alkalimetri. Proses ini digunakan dalam perhitungan untuk menentukan kadar suatu zat berdasarkan perhitungan volume dengan larutan standar yang telah diketahui kadarnya dengan tepat.
III.4 Alat yang digunakan
III.5 Prosedur Percobaan
1. Standarisasi HCl dengan Na Borak 0,1 N
- Ambil 10ml Na Borak 0,1 N masukkan ke dalam erlenmeyer
- Ditambah beberapa tetes indicator MO
- Dititrasi dengan HCl 0,1 N sampai warna menjadi merah orange
- Hitung kebutuhan HCl
NHCl=(V . N)Borak
V(HCl)
2. Standarisasi NaOH dengan HCl yang telah distandarisasi - Ambil 10ml NaOH 0,1 N masukkan ke dalam erlenmeyer
- Ditambah beberapa tetes indicator MO
- Dititrasi dengan HCl sampai warna menjadi merah orange
- Catat volume HCl
- Hitung normalitas NaOH
N(NaOH)=(VV . N)HCl
(N aOH)
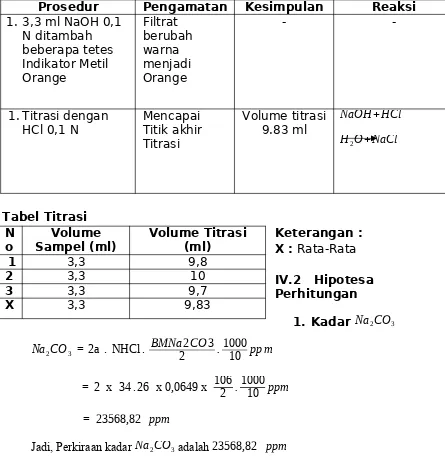
3. Mencari kadar Na2CO3 dan NaHCO3
- Ambil 10ml larutan sampel masukkan ke dalam erlenmeyer
- Ditambah beberapa tetes indicator MO
- Dititrasi dengan HCl sampai warna merah hampir hilang
- Catat volume HCl = a ml
- Tambah indikator MO beberapa tetes
- Titrasi dengan HCl sampai terjadi warna merah orange
- Catat kebutuhan HCl untuk Na2CO3 = b ml
kadar Na 2CO 3 - 2a . NHCl . BMNa22CO3.100010 ppm
kadar Na H CO 3 – (b - a) . NHCl . BMNa HCO 3.100010 ppm
4. Mencari kadar CaCOdalam batu kapur
- Kapur dimasukkan dalam erlenmeyer, tambah larutan HCl 0,5 N diaduk sampai warna menjadi jernih
- Panaskan hingga CO2 hilang
- Setelah dingin tambah beberapa tetes indicator PP dan kelebihan HCl dititrasi dengan NaOH sampai terbentuk warna merah muda
- Hitung kebutuhan NaOH
BAB IV
HASIL PRAKTIKUM
IV.1 Tabel Hasil Praktikum
a. Standarisasi HCl dengan Na Borak 0,1 N
Prosedur Pengamatan Kesimpulan Reaksi
o Sampel (ml)Volume Volume Titrasi(ml)
1 3,3 5,3
2 3,3 5
3 3,3 5,1
b. Standarisasi NaOH dengan HCl yang telah di
HCl 0,1 N Mencapai Titik akhir Titrasi
o Sampel (ml)Volume Volume Titrasi(ml)
1 3,3 9,8
2 3,3 10
3 3,3 9,7
kadar Na H CO3 = (b - a) . NHCl . BMNa H CO3.100010 pp m
= 8,97 x 0,0649 x 84 x 10 pp m = 4390,0853 pp m
Jadi, Perkiraan K adar Na H CO3adalah 4390,0853 pp m
3. K adar CaCO 3
kadar CaCO3 = [(V . N)HCl - (V . N)NaOH] x BMCaCO32 mgra m
kadar CaCO3 = [( 9.83 x 0,1) – ( 3,33 x 0,1)] x 1002 mgra m
kadar CaCO3 = 16,36695 mgram
Jadi, Perkiraan K adar CaCO 3adalah 16,36695 mgram
IV.3 Pembahasan Praktikum
Pada praktikum kali ini dilakukan percobaan Acidi Alkalimetri yang merupakan penentuan Kadar analat dalam suatu analat dengan menggunakan larutan Asam dan Basa yang tidak diketahui konsentrasinya sebagai titran. Pencarian kadar Na2CO3dan NaH CO3akan dititrasi dengan larutan baku HCl
yang telah distandarisasi dengan menggunakan Indikator PP yang memiliki range pH Asam. Dalam pentitrasian dengan HCl akan ditemukan TAT bewarna merah, kemudian tambah indikator MO yang akan merubah larutan menjadi warna Orange, kemudian dititrasi dengan HCl kembali. Dan akhirnya ditemukan kadar bertutut-turut adalah 23568,82 ppmdan 4390,0853 pp m.
Dengan Reaksi :
Na2CO3+2HCl H2CO3+2NaCl
KESIMPULAN & SARAN
V.1 Kesimpulan
1. Asidimetri adalah penetapan kadar suatu larutan Basa dengan standart Larutan asam dengan alat ukurnya 2. Alkalimetri adalah titrasi untuk penetapan kadar suatu
asam dengan larutan stadart basa sebagai alat ukurnya 3. Pada pH akhir titrasi tercapai adalah merupakan bagian
paling pentig, sebab disinilah letak keberhasilan perhitungan stokiometrinya
V.2 Saran
1. Diharapkan praktikan lebih memahami prosedur percobaan agar disaat melakukan praktikum tidak melakukan kesalahan
2. Diharapkan praktikan lebih berhati-hati, teliti dan cermat dalam melakukan titrasi supaya titrasi mencapai titik akhir tirasi yang sempurna
DAFTAR PUSTAKA
_______.2014.http://membagiilmutekim-meirina.blogspot.com/2014/05/ causticsoda.html Dikutip pada tanggal 25 April 2015 pukul 21.59 WIB. Dosen Pengampu Kimia Analisa UPN ‘VETERAN’ JATIM. 2015. Modul Kuliah ASIDI ALKALI METRI. Surabaya : UPN ‘VETERAN’ JATIM
James, Brady.1999.”KIMIA UNIVERSITAS Asas & Sruktur”.Jakarta : Gramedia
MODUL PRAKTIKUM Kimia Analisa UPN ‘VETERAN’ JATIM. 2015. Asidi Alkali Metri.Surabaya : UPN ‘VETERAN’ JATIM
Petrucci, E.2008.KIMIA DASAR Prinsip—prinsip & Aplikasi Modern. Jakarta : Erlangga
PlanetKimia.2013.http://www.planetkimia.com/2013/01/ blengboraks/html Dikutip pada 25 April 2015 pukul 7.40 WIB. Ripani.2014.http://ripanimusyafalab.blogspot.com/2014/02/ indikator-asam-basa.html Dikutip pada 25 April 2015 pukul 7.40 WIB.
Wikipedia. 2014. http://id.m.wikipedia.org/wiki/asam_klorida. Dikutip pada 25 April 2015 pukul 7.42 WIB.
Wikipedia.2014. http: //id . wikipedia.org/ wiki/ Natrium_ karbonat Dikutip pada 25 April 2015pukul 7.40 WIB.
Wikipedia.2014. http://en.wikipedia.org/wiki/Calcium_carbonate Dikutip pada 25 April 2015pukul 7.44 WIB.
Wikipedia.2014. http://id.m.wikipedia.org/wiki/air. Dikutip pada 25 April 2015 pukul 7.42 WIB.
LAMPIRAN Gambar Alat
gelas ukur spatula pipet tetes
Erlenmeyer Tabung reaksi
Beaker glass
Labu Ukur Corong Penjepit