TEMA 4
Larutan asam basa
LARUTAN ASAM DAN BASA
Standar Kompetensi:
q Memahami sifat-sifat larutan asam-basa, metode pengukuran, dan terapannya.
Kompetensi Dasar:
q Mendeskripsikan teori-teori asam-basa dengan menentukan sifat larutan dan mengitung pH larutan.
I. KONSEP ASAM DAN BASA
A. Menunjukkan Asam dan Basa
Larutan asam:
pH < 7
Larutan netral:
pH = 7
Larutan basa:
pH > 7
Sifat Larutan Asam
• berasa masam
• Dalam air terurai menjadi hidrogen (H
+) dan sisa asam (ion negatif).
Seperti teori asam basa menurut Arrhenius, asam dalam air dapat melepaskan ion H
+.
• Sifat korosif dimiliki oleh asam dalam bentuk larutannya.
• Dapat mengubah warna kertas lakmus biru menjadi merah dan pH<7.
Dapat bereaksi dengan logam
• Dapat bereaksi dengan garam karbonat Dapat bereaksi dengan basa
Sifat Larutan Basa
• Berasa pahit
• Dalam air terionisasi menjadi sisa basa (ion logam) dan ion hidroksida (OH
-)
• Jika mengenai kulit akan terasa licin
• Bersifat kaustik
• Dapat mengubah warna kertas lakmus merah menjadi biru dan pH> 7.
• Dapat bereaksi dengan asam menghasilkan garam dan air.
B. Teori Asam-Basa Arrhenius
H Z(aq)
xx H
+(aq) + Z
x-(aq)
Menurut Arrhenius, asam adalah zat yang dalam air melepaskan ion H
+.
Asam Arrhenius dapat dirumuskan sebagai H Z dan dalam air mengalami ionisasi sebagai berikut.
x1. Asam
2. Basa
Menurut Arrhenius, basa adalah senyawa yang dalam air dapat menghasilkan ion hidroksida (OH - ).
Basa Arrhenius merupakan hidroksida logam, dapat dirumuskan sebagai M(OH) , dan dalam air mangion sebagai berikut.
M(OH) (aq)
xM
x+(aq) + xOH
-(aq)
x
Teori Asam Basa Arrhenius
• asam adalah zat yang dalam air dapat terionisasi melepaskan ion hidrogen (H
+) atau ion hidronium (H3O
+),
• sedangkan basa adalah zat yang dalam air dapat terionisasi melepaskan ion hidroksida (OH
-).
• Jadi pembawa sifat asam adalah ion H
+,
• sedangkan pembawa sifat basa adalah ion OH
–.
persamaan reaksi dapat ditulis sebagai berikut.
• HCl (aq) → H
+ (aq) + Cl–(aq)•
• H3PO4(aq) ⇄ 3H
+ (aq) + PO43-(aq)• Jumlah ion H
+yang dapat dihasilkan oleh satu molekul asam disebut valensi asam,
• sedangkan ion negatif yang terbentuk dari asam setelah melepaskan
ion H
+disebut ion sisa asam.
senyawa basa dijelaskan dengan persamaan berikut:
• Ca(OH)2 (aq) → Ca
2+ (aq) + 2OH-(aq)• Al(OH)3 (aq) ⇄ Al
3+ (aq) + 3OH-(aq)• jumlah ion OH
-yang dapat dilepaskan oleh satu molekul basa disebut
valensi basa.
C. Konsep pH, pOH, dan pKw
Tetapan kesetimbangan air (K
w) K
w= [H
+] ´ [OH
-]
Dalam air murni
pH + pOH = pK
wpOH = -log [OH
-]
pH = -log [OH
+]
1. Derajat Ionisasi
Jika zat mengion sempurna, maka derajat ionisasinya = 1.
Jika zat tidak ada yang mengion, maka derajat ionisasinya = 0.
Jika, batas-batas harga derajat ionisasi adalah 0 < α < 1.
Zat elektrolit yang mempunyai derajat ionisasi besar (mendekati 1) disebut elektrolit kuat, sedangkan zata yang derajat ionisasinya kecil (mendekati 0), disebut elektrolit lemah.
α = jumlah zat yang mengion jumlah zat mula-mula
0 £ α £ 1
D. Kekuatan Asam
2. Tetapan Ionisasi Asam (K )a
a = MKa 3. Hubungan (K ) dengan (a)a
HA(aq) H+ (aq) + A-(aq)
K = [H+][A-]
a [HA]
a
Reaksi ionisasi asam lemah valensi satu
Tetapan kesetimbangan untuk ionisasi asam disebut tetapan ionisasi asam dan diberi lambang K .
Reaksi ionisasi basa lemah bervalensi satu
Tetapan kesetimbangan persamaaan untuk ionisasi basa disebut tetapan ionisasi basa (K ).
Hubungan tetapan ionisasi basa dengan derajat ionisasi basa adalah sebagai berikut.
LOH(aq) L+(aq) + OH-(aq)
[L+] ´ [OH-] [LOH]
K =
b
a = MKb
b
E. Kekuatan Asam
F. Menghitung pH Larutan Asam-Basa
1. Asam Kuat
[H
+] = M ´ valensi asam contoh
Berapakah pH dari larutan HCl 0,01M
2. Asam Lemah
Jika tetapan ionisasi asam (a) diketahui NH (aq) H+(aq) + A-(aq)
contoh Jika tetapan ionisasi asam (K ) diketahuia
Asam lemah polivalen (asam bervalensi banyak) mengion secara bertahap
Contoh:
3. Asam Lemah Polivalen
4. Basa Kuat
Contoh:
Berapakah pH larutan Ba (OH)2 0,001 M?
5. Basa Lemah
1. Trayek Perubahan Warna Indikator Asam-Basa
Indikator Trayek Perubahan Warna Perubahan Warna
Lakmus Metil jingga Metil merah Bromtimol biru fenolftalein
5,5 – 8,0 2,9 – 4,0 4,2 – 6,3 6,0 – 7,6 8,3 – 10,0
merah-biru merah-kuning merah-kuning kuning-biru
tidak berwarna-merah
G. Indikator Asam-Basa
2. Menentukan pH dengan Menggunakan Beberapa Indikator
Contoh
Suatu larutan berwarna biru jika ditetesi dengan indikator bromtimol biru (6,0 – 7,6) dan tidak berwarna dengan indikatror fenolftalein (8,3 – 100). Berapa pH larutan itu?
Jawab:
Jika dengan indikator bromtimol biru berwarna biru, berarti pH larutan lebih besar dari 7,6.
Jika dengan indikator fenolftalein tidak berwarna, berarti pH larutan kurang dari 8,3.
Jadi, pH larutan tersebut adalah antara 7,6 – 8,3.
7,6 < pH < 8,3
H. Reaksi Asam dengan Basa
Larutan asam mengandung ion H+ dan suatu anion sisa asam, sedangkan larutan basa mengandung ion OH- dan suatu kation logam.
Apa yang terjadi jika suatu larutan asam dicampurkan dengan suatu larutan basa?
Ion H+ dari asam akan bereaksi dengan ion H- dari basa membentuk air.
Ion negatif sisa asam dan ion positif basa? Akan bergabung membentuk senyawa ion yang disebut garam.
Oleh karena itu, reaksi asam dengan basa disebut juga reaksi penggaraman.
HA(aq) H+ (aq) + A-(aq) LOH(aq) L+ (aq) + OH-(aq)
H+(aq) + OH-(aq) H O(l)
Asam Basa Air
2
Asam + Basa Garam + Air 1. Reaksi Asam dengan Basa
2. Campuran Asam dan Basa
Campuran ekivalen asam dengan basa belum tentu bersifat netral, kecuali campuran asam kuat dengan basa kuat.
• Jika mol H
+= mol OH
-, maka campuran akan bersifat netral.
• Jika mol H
+> mol OH
-, maka campuran akan bersifat asam; dan konsentrasi H dalam campuran ditentukan oleh jumlah H
+yang bersisa.
• Jika mol H
-> mol OH
+, maka campuran akan bersifat
basa; dan kosentrasi ion OH
-dalam campuran
ditentukan oleh jumlah mol ion OH
-yang bersisa.
II. TEORI ASAM-BASA BRONSTED-
LOWRY DAN LEWIS
Teori Asam Basa Bronsted – Lowry
• asam adalah zat yang mampu menyumbangkan (donor) proton (ion H
+) dalam reaksinya
• basa adalah zat yang mampu menerima (akseptor) proton dalam reaksinya.
• Tentukan pasangan asam basa konjugat dari reaksi berikut :
• HCO2H + PO4
3–⇄ HCO2
–+ HPO4
2–• Pasangan asam basa konjugat :
• asam HCO2H dan HCO2–
• basa PO43– dan HPO42–
A. Pengertian Asam dan Basa Menurut Bronsted dan Lowry
Asam Bronsted-Lowry = donor proton Basa Bronsted-Lowry = akseptor proton
B. Pasangan Asam dan Basa Konjungsi
Suatu asam, setelah melepas satu proton, akan membentuk spesi yang disebut basa konjungsi dari asam itu.
asam Basa konjugasi H+ contoh
asam Proton + Basa konjugasi
HCl H + + Cl-
H2O H + + OH-
1. Asam
Basa + H+ Asam konjugasi
Suatu basa, setelah meyerap satu proton akan membentuk satu spesi yang disebut asam konjugasi dari basa itu.
contoh
Basa + Proton Asam konjugasi
H2O + H + H3O+
NH3 + H + NH4+
2. Basa
C. Kekuatan Relatif Asam dan Basa
Asam Basa
Asam Kuat
Asam terlemah
HCIO H SO HCI HNO H O+ H PO H CO NH+ H O NH OH-
CIO - HSO- CI- NO- H O H PO - HCO- NH OH- NH- O2-
Basa terlemah
Basa terkuat 4
2 4
3 3
2 3
3 4
4 2
3
4 4
3 2
4 2
3 3
2
Semakin kuat asam, semakin lemah basa konjungsinya, dan sebaliknya.
K ´ K = Ka b w
D. Teori Asam-Basa Lewis
NH
4+adalah suatu basa karena memberi pasangan elektron, sedangkan ion H
+adalah suatu asam
karena menerima pasangan elektron.
Asam : akseptor pasangan elektron
Basa : donor pasangan elektron
Identifikasi Asam Basa, menggunakan:
• Kertas Lakmus
• Indikator Alami
• Larutan Indikator Buatan
• Alat Indikator
Identifikasi Asam – Basa
Menggunakan Kertas Lakmus
Identifikasi Asam – Basa
Menggunakan Indikator Alami
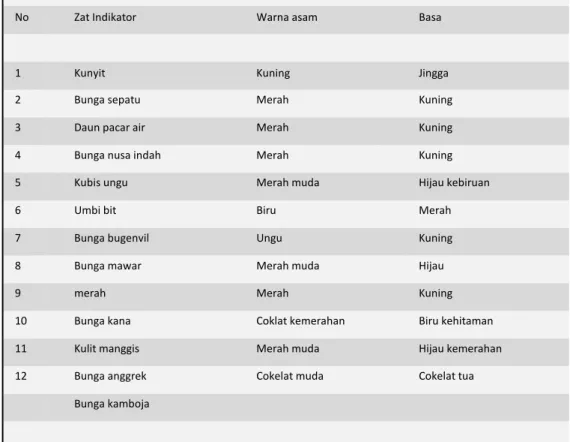
Tabel 4 Beberapa Indikator Alami dan Perubahan Warnanya
No Zat Indikator Warna asam Basa
1 Kunyit Kuning Jingga
2 Bunga sepatu Merah Kuning
3 Daun pacar air Merah Kuning
4 Bunga nusa indah Merah Kuning
5 Kubis ungu Merah muda Hijau kebiruan
6 Umbi bit Biru Merah
7 Bunga bugenvil Ungu Kuning
8 Bunga mawar Merah muda Hijau
9 merah Merah Kuning
10 Bunga kana Coklat kemerahan Biru kehitaman
11 Kulit manggis Merah muda Hijau kemerahan
12 Bunga anggrek Cokelat muda Cokelat tua
Bunga kamboja
Identifikasi Asam – Basa
Menggunakan Larutan Indikator Buatan
Indikator Trayek pH Warna yang dihasilkan dalam Larutan asam larutan basa Fenolftalein (PP) 8,3 – 10,0 Tidak berwarna Merah muda
Bromtimol biru (BTB) 6,0 – 7,6 Kuning Biru
Metil merah (MM) 4;4 - 6,2 Merah Kuning
Metil jingga (MO) 3,1 – 4,4 Merah Kuning
Bromkresol hijau 3,8 – 5,4 Kuning Biru
Bromkresol ungu 5,2 – 6,8 Kuning Ungu
Alizarin kuning(fenol merah) 10,1 – 12,0 Kuning Merah
Identifikasi Asam–Basa Menggunakan Alat
Indikator
Kesetimbangan Air
Derajat keasaman
(pH)
Perhitungan pH suatu larutan tergantung dari kondisi berikut:
• Jika asam sebagai penyedia utama H
+• Jika air sebagai penyedia utama H
+• Jika asam dan air sebagai sumber utama H
+I. Sifat Larutan Garam
K > K : bersifat asam K > K : bersifat basa K = K : bersifat netral
a b
a b
a b
Sifat larutan garam bergantung pada kekuatan relatif asam-basa penyusunnya.
• Garam dari asam kuat dan basa kuat bersifat netral.
• Garam dari asam kuat dan basa lemah bersifat asam.
• Garam dari asam lemah dan basa kuat bersifat basa.
• Garam dari asam lemah dan basa lemah bergantung pada harga tetapan ionisasi asam dan ionisasi basanya (K dan K ).a b
II. Konsep Hidrolis
Sifat larutan garam dapat dijelaskan dengan konsep hidrolisis. Menurut konsep ini, komponen garam (kation atau anion) yang berasal dari asam lemah atau basa lemah bereaksi dengan air (terhidrolisis).
• Garam yang terbentuk dari asam kuat dan basa kuat tidak terhidrolisis.
• Garam yang terbentuk dari asam lemah dan basa kuat mengalami hidrolisis anion.
• Garam yang terbentuk dari asam kuat dan basa lemah mengalami hidrolisis kation.
• Garam yang terbentuk dari asam lemah dan basa lemah mengalami hidrolisis total.
III. MENGHITUNG pH LARUTAN GARAM
1. Garam dari Asam Kuat dan Basa Kuat
2. Garam dari Basa Kuat dan Asam Lemah
3. Garam dari Asam Kuat dan Basa Lemah
4. Garam dari Asam Lemah dan Basa Lemah
Larutannya bersifat netral (pH = 7)
[OH-] = ´ M Ka
Kw
[H+] = ´ M Kb
Kw
[H+] = ´ K Kb Kw a
I. SIFAT LARUTAN PENYANGGA
II. KOMPONEN DAN CARA KERJA
LARUTAN PENYANGGA
Larutan penyangga asam mengandung suatu asam lemah (HA) dan basa konjungsinya (ion A-). Larutan seperti itu dapat dibuat dengan berbagai cara.
a. Mencampurkan asam lemah (HA) dengan garamnya (LA, garam LA menghasilkan ion A- yang merupakan basa konjungsi dari asam HA).
b. Mencampurkan suatu asam lemah dengan suatu basa kuat di mana asam lemah dicampurkan dalam jumlah berlebih.
Campuran akan menghasilkan garam yang menggandung basa konjungsi dari asam lemah yang bersangkutan.
1. Larutan Penyangga Asam
A. Komponen Larutan Penyangga
2. Larutan Penyangga Basa
Larutan penyangga basa mengandung suatu asam lemah (B) dan asam konjungsinya (BH+). Larutan penyangga basa dapat dibuat dengan cara yang serupa dengan pembuatan larutan penyangga asam.
a. Mencampurkan suatu basa lemah dengan garamnya.
b. Mencampurkan suatu basa lemah dengan suatu asam kuat dimana basa lemahnya dicampurkan berlebih.
B. Cara Kerja Larutan Penyangga
1. Larutan penyangga asam Contoh:
Larutan penyangga yang mengandung CH COOH dan CH COO-
Pada penambahan asam:
Ion H+ yang ditambahkan akan bereaksi dengan ion CH COO - membentuk molekul CH COOH.
Pada penambahan basa:
Basa yang ditambahkan itu praktis bereaksi dengan asam CH COOH membentuk ion CH COO- dan air.
3 3
3 3
3 3
CH COOH(aq) CH COO- (aq) + H+(aq)
3 3
CH COO-(aq) + H+(aq) à CH COOH(aq)
3 3
CH COOH(aq) + OH-(aq) à CH COO-(aq) + H O(l)
3 3 2
2. Larutan penyangga basa
Contoh:
Larutan penyangga yang mengandung NH3 dan NH4+
Pada penambahan asam:
Asam yang ditambahkan itu bereaksi dengan basa NH3 membentuk ion NH4+
Pada penambahan basa:
Basa yang ditambahkan itu bereaksi dengan komponen asam membentuk komponen basa dan air.
III. MENGHITUNG Ph LARUTAN
PENYANGGA
B. pH Larutan Penyangga Basa
dengan, K = tetapan ionisasi basa lemah b = jumlah mol basa lemah
g = jumlah mol asam konjugasi
b
A. pH Larutan Penyangga Asam
atau
dengan, K = tetapan ionisasi asam lemah a = jumlah mol asam lemah
g = jumlah mol basa konjugasi
a
Derajat Keasaman (pH) Asam / Basa Kuat
• Berdasarkan reaksinya dengan pelarut, asam dan basa
diklasifikasikan menjadi asam-basa kuat dan asam-basa lemah. Asam dan basa kuat adalah asam dan basa yang terdisosiasi sempurna ( = 1) dalam larutan encer.
• Bila asam kuat HaX terdisosiasi dalam air:
Derajat keasaman (pH) Asam / Basa Lemah
• Asam dan basa lemah adalah asam dan basa yang terdisosiasi sebagian/ tidak sempurna (0 < < 1).
• Tetapan kesetimbangan untuk basa lemah (Kb) dinyatakan sebagai :
IV. FUNGSI LARUTAN
PENYANGGA
Cairan tubuh, baik cairan intrasel maupun cairan luar sel, merupakan larutan penyangga. Sistem penyangga yang utama dalam cairan intrasel adalah pasangan dihirogenfosfat-monohidrogenfosfat (H PO- - HPO2-).
Sistem ini bereaksi dengan asam dan basa sebagai berikut.
Adapun sistem penyangga utama dalam cairan luar sel (darah) adalah pasangan asam karbohidrat-bikarbonat (H CO - HCO-). Sistem ini bereaksi dengan asam dan basa sebagai berikut.
Sistem penyangga di atas menjaga pH darah hampir konstan, yaitu sekitar 7,4.
2 4 4
2 3 3
A. Persamaan Ion
Dalam persamaan ion, zat elektrolit kuat dituliskan sebagai ion-ionnya tak terpisah, sedangkan elektrolit lemah tetap ditulis sebagai molekul atau senyawa netral tak terionkan.
Contoh:
B. Reaksi-Reaksi Asam-Basa
a. Reaksi Oksida Basa dengan Asam
b. Reaksi Oksida Asam dengan Basa
c. Reaksi Amonia dengan Asam
OKSIDA BASA + ASAM GARAM + AIR
OKSIDA ASAM + BASA GARAM + AIR
AMONIA (NH ) +ASAM GARAM AMONIUM3
C. Reaksi-reaksi Pergantian (Dekomposisi) Rangkap
Senyawa AB dan CD dapat berupa asam, basa, atau garam. Reaksi dapat berlangsung apabila AD atau CB atau keduanya memenuhi paling tidak satu dari kriteria berikut.
1. Sukar larut dalam air (mengendap) 2. Merupakan senyawa yang tidak stabil
3. Merupakan elektrolit yang lebih lemah dari AB atau CD AB + CD AD + CB
D. Reaksi Logam dengan Asam Kuat Encer
LOGAM + ASAM KUAT ENCER GARAM + GAS H2 Contoh:
A. Hitungan Stoikiometri Sederhana
Penyelesaian dilakukan menurut langkah-langkah berikut : 1. Menuliskan persamaan setara reaksi.
2. Menentukan jumlah mol zat yang diketahui (yang ditentukan jumlah molnya)
3. Menentukan jumlah mol zat yang ditanyatakan dengan menggunakan perbandingan koefisien.
4. Menyesuaikan jadwaban dengan hal yang ditanyatakan
B. Hitungan Stoikiometri dengan Pereaksi Pembatas
Zat yang habis lebih dahulu itu disebut pereaksi pembatas.
Langkah-langkah yang harus ditempuh adalah sebagai berikut.
1. Tuliskan persamaan setara reaksi.
2. Tentukan jumlah mol zat-zat yang diketahui.
3. Bandingkan jumlah mol masing-masing zat dengan koefisien reaksinya sehingga diketahui pengali yang digunakan.
Pereaksi pembatas adalah zat yang hasil bagi pengalinya paling kecil.
4. Pergunakan pengali terkecil untuk menentukan jumlah mol reaksi hasil reaksi. Tentukan jumlah mol zat yang dinyatakan berdasarkan perbandingan koefisien dengan pereaksi pembatas.
Titik ekivalen : pH pada saat asam dan basa tepat ekivalen.
Titik akhir titrasi : pH pada saat indikator berubah warna.