sto'i/i ierbai:dii5gak pengglj^aai:etilsi;diai*;ii-;t e t h a
-ACETAT DAi: EIILEKGLIK.GL
BIS-(^-AI-*Ii;OETILETER)-tjstra-a c e t a t p a d a pei;e:;TwAi:k a d a r kalsiui.
DEi.bAi: ADAEYA KAGKESIUK SECARA KELATOIIETfJ
SKHIPEI
EI3UAT UKTUi: I-Jn-1E:;'JKI EYARAT-SYARAT l e s c a p a i gELAK
SARJAKA PARKACI PADA FAZUX.TAS PARIIASI • UEIVERSITAS AIELAMGGA
19B7
Oleh
YbLISTIAKl
fF
y
<il
s
058210515 , '
j niRPUSTASLAA*
1-VMXTBRSlTAS AlRi-ANOOA* g U R A B A
Disetujui oleh Penbimbing
CA
KATA PENGARTAR
Dengan nama Allah- Yang Maha Pengasih dan Maha Penyayang..
Puji syukur kami panjatkan kehadapan Tuhan Yang Ma
ha Kuasa atas rahmat yang telah dilimpahkan-Nya, sehing-
ga selesailali tugas kami dalam menyusim skripsi ini un-
tuk memenuhi tugas akhir mencapai gelar Sarjana Parmasi
pada Fakultas Parmasi Universitas Airlangga.
Adapun skripsi yang kami pilih ini berjudul "STUDI
PEEBAiTDIKGAi: PEKGGUNAM ETILENDIAKIN TETRAACITA? DAK ETI
LEKGLIKOL BIS-($ -AKINOETILETER)-TETRAACETAT PADA PENEHTU
AK KADAK KALSIUM DENG AH ADAI.TA IiAGNESIUK SECAKA XELATOME
TRI". Penentuan kadar Kalsium dengan adanya kagnesium i-
ni menggunakan indikator Calcon.
Pada kesempatan ini perkenankanlah kami menj^ampai -
kan rasa terima kasih serta penghargaan kepada yang ter-
hormat ibu Dra. Ky,. M. Soeharsono dan ibu Dra. Ny. Roor
Erma K.S., sebagai pembimbing skripsi kami yang dengan
rela hati telah banyak menyediakan waktu,\tenaga serta
memberi petunjuk dari permulaan hingga akhir skripsi ini,
Juga kami sampaikan rasa terima kasih kepada paniti
a Skripsi Fakultas Parmasi Universitas Airlangga yang te
lah bersusah payah memeriksa, menilai dan memberi saran-
saran perbaikan demi penyelesaian skripsi ini, serta ke-
padc Bapak/lbu dosen yang secara langsung maupun tidak
langsung memberikan saran-sarannya kami sampaikan terima
kasih.
Terima kasih kami sampaikan pula kepada rekan-rekan
mahasiswa yang telah memberikan doron^an dan bantuan ser
ta para peturas laboratorium dan perpustakaan yang telah
banyak membcinta dalam pelaksanaan skripsi ini.
Ilepada Almamater Universitas Airlangga, khususnya
Fakultas Farmasi dimana kami memperoleh asuhan, bimbing-
an dan ilmu selama ini kami sampaikan rasa terima kasih.
Akhirnya semoga Tuhan Yang Maha Kuasa memberi bala-
san yang berlimpah kepada semua pihak yang telah memban-
tu kami dan semoga skripsi ini dapat berguna bagi kita
semua.
DAFIAR ISI
Halaman
ICATA PE1*GAL7T A R ... ... ii
DAFTAR ISI ... ... iv
DAFTAR TABEL ... ... vi
DAFTAR LAEjPIHAIJ ... ' vii
BAB : I . PEUDAEULUAH ... ... 1
II. TINJAUAK PUSTAKA 1. Xeori kelatometri ... 5
2. Macam-macam pembentuk kelat ... ...6
3. Pembentuk kelat unt.uk Ca dan Mg . .. .. 7
4. Konstanta stabilitas kelat logam-EDTA dan logam-EGTA... ... 11
5. Cara menentukan titik akhir titrasi kelatometri... ...12
6. Beberapa cara titrasi kelatometri ... 13
7. Indikator... ... 15
8. Pembakuan larutan pembentuk kelat ... 19
III. METODA PENELITIAH 1 .. Bahan penelitian dan penyediaannya 1.1. Bahan penelitian... .... 21
1.2. Penyediaan bahan penelitian .... 21
2. Metoda penelitian dan pelaksanaan 2.1. .Pembakuan larutan E D T A ... ... 23
2.2. Pembakuan larutan E G T A ... ... 23
Ealaman
2.5. Cara kerja
2.5.1. Penentuan kadar Ca++ de
ngan larutan E D T A ... 23
2. 3- 2. Penentuan kadar Ca++ de ngan larutan E G T A ... 25
2.3.3. Titrasi blanko ... .. 25
2.4. Perh.itungan untuk mendapatkan kembali kadar Kalsium ... .. 25
2.5. Ketoda analisis hasil penelitian. 26 IV. HASIL PEI7ELITIA1C 1 . Kasil perhitungan kadar kalsium... 29
2. Analisa varian ... .. 30
V. PEHBAKASAX ... .. 35
VI. EESIKPULAi'! LASARA1. ... . 38
VII. RIKGEASAE ... ...39
VIII. LAFTAR PUSTAEA... ...40
DAFEAR TABEL
Tabel : halaman
I. Prosentase pendapatan kembali (Recove
ry) Kalsium dengan titran EGTA... 29'
II. Prosentase pendapatan kenbali (Recove
ry) Kalsium dengan titran EDTA ... 30
III. Hasil-hasil percobaan titrasi kelatome
tri dengan titran pembentuk kelat EftIA
dan EGTA ... 31
IV. Hasil perhitungan anava ... 32
DAFTAR LAl'IPIRiJ:
Lanpiran : Halaman
A. Tabel F ... 43
*
B. Tabel t ... 44
C . Pembakuan larutan EDTA dan EGTA .... -45
PEKDAEuLUAl; BAB I
Mineral merupakan salah satu dari bermacam-macam
kebutuhan pokok yang tak kalah pentingnya dalam
menun-jang kelangsungan pr.oses metabolisme dalam tubuh; Heski
pun dibutuhkan hanj'a dalam jumlah kecil, mineral sangat
besar artinya bagi kesehatan tubuh manusia.
Dari bermacam-macam mineral, Kalsium dan Magnesium
sa-ngatlah penting. peranannya. Kalsium terlibat dalam peme
liharaan tulang, fungsi saraf dan penting dalam pembeku
an darah. Jumlah Kalsium seluruimya di dalam tubuh. kira
kira 1 Kg, 99^ diantaranya terdapat dalam tulang. Kadar (9)
normal Kalsium 2,5 nmol/1.
Pengaturan kadar Kalsium di dalam tubuh berkaitan de
ngan hormon kelenjar anak gondok, bila kadar Kalsium me
nurun akan terjadi gangguan fungsi hormon tersebut.
Seorang ibu yang mengalami hipoparatiroidism, maka pada
bayinya akan mengalami hipokalsemia dan sering terjadi
kejang-kejang. Bila keadaan ini berlangsung cukup lama
maka pertumbuhan tulang si anak akan menjadi lemah dan
mempengaruhi kehidupan selanjutnya.
Magnesium juga penting dalam tubuh mengingat peranannya
dalam cairan intraseluler, sebagai kofaktor ensim, ter
libat dalam pengangkutan phosphat, kontraksi otot dan
menjaga stabilitas asam nukleat. Kadar Magnesium di
lam cairan intraseluler danplasma kira-kira 15 dan 0,75
sampai 1,1 mmol/l. Kadar Magnesium seluruhnya di dalam
tubuh kira-kira 1000 mmol, 50^ diantaranya berada dalan
tulang.(5)
Pada keadaan tubuh kekurangan Magnesium, juga akan trer-
jadi kejang-kejang dan kepekaan susunan saraf yang me -
ningkat.
ICalsium dan Magnesium di alam ini sering terdapat
bersama-sama misalnya dalam tanah, air, karang, dolomit,
batu kapur. Kakanan juga banyak mengandung Ca dan Kg mi
salnya susu, agar-agar bubuk, tmnbuhan seperti savi, ba
yam, dan sebagainya. Sediaan farmasi seringkali terda -
pat dalam kombinasi antara Ca dan Kg, misalnya obat- o-
batan-seperti multivitamin, -antasida, sebagai pelincir
dan pengisi tablet, dan sebagainya.
Adanya kombinasi Kalsium dan Magnesium seringkali menim
bulkan kesukaran dalam penentuan kadar Kalsium, -karena
keduanya mempunyai sifat-sifat kimia yang harnpir sama.
Pembentukan endapan dari kedua ion logam tersebut dapat
dipakai sebagai dasar untuk menentukan kadar Ca dan Kg.
Penentuan kadar Kalsium cairan tubuli sangatlah pen
ting untuk menghindari terjadinya keadaan hipokalsemia
ataupun hip6rkalsemia. Demikian . juga dengan 3-Iagnesium
untuk menghindari hipomagnesia.
Penentuan kadar Kalsium dan Kagnesium dapat dilakukan
dengan cara graviraetri, volumetri yaitu kelatometri dan
nar tainpak.
Pada penelitian ini akan dilakukan metoda kelatonctri de
ngan menggunakan penbentuk kelat yang berbeda yaitu EDTA
dan EGTA.
Kadar Ca dan !;g baik di dalani cairan tubuh caupun dal an;
obat-obatan cukup besar, sehingga diharapkan dapat
digu-nakan netoda volumetri disamping itu- alat yang aipakai
sederhana, cudah dilakukan dan keteiitian cukup tinggi.
Penentuan kadar Ca dicauping Mg dengan SDTA maupun
EGTA, terlebih dahulu dilakukan pengendapan terhadap Mg
dengan penanbahan larutan KcOH 15# pH=12,5 menjadi Magne
ciun-hidrokcida, sedang indikator yang dipakai Calcon de
ngan pcrubahan warna dari nerah ©enjadi biru. Hal ini .
terjaai knrena Ksp ■= 1 ,S x 10”^ jauh lebih ke
-cil dari ICsp Ca(0K) 2 = 5,5 x 10~^ maka endapan Kg(0H)2
akan t.?rbentuk lebih dahulu dari pada endapan Ca(OH) 2 *
10 7
Dis&mping itu K stabilitas kelat Ca-EDTA = 1 x 1 0 9 ,
Ca-EGTA =' 1 x 10^ jauh lebih besar dari pada K stab'ili-
tas kelat Kg-EDTA = 1 x 108 ’ 7 dan Mg-EGTA = 1 x 105’2.
Dengan demikian endapan CaCOH^ dapat dititrasi dengan
2DTA maupun EGTA.
Mengingat waktu dan xayilitas yang tersedia naka pe
nelitian dalam skripsi ini fiibataei pada "STUDI PERBAKDI
EG AH PEEGGUNAAJi ETILEHDIA3III; TETRAACETAT DAi: ETIXEI.GIa t
EOL BI S-r ((^ -AJIIlTOETIIiETER) -trETRAACETAT PADA PE1TEIT2UA17 EA-
DAR EALSIUft DSI5GA1. ADAiTTA- J-IAGirESIUh •SECARA EELA20MBTRI" .
fi^g-nesium dipilih kadar ICalsiun lebih besar dari Magfi^g-nesium
sampai perbandingan sama (1:1), dengan pertinbangan per:
bandingan tersebut dianggap mencakup perbandingan KalsI
ud dan Magnesium yang terdapat dalam cairan tubuh, maka
nan dan obat-obatan. Dalam satu penggunaan titran pem -
bentuk kelat, tiap perbandingan ditentukan sebanyak em-
pat kali'percobaan.
Hipotesa penelitian ini ialah untuk mengetahui ada:
nya perbedaan kadar Kalsium yang didapatkan kembali de
ngan adanya Magbesium antara penggunaan EDTA dan EG-TA.
Untuk pengolahan data digunakan Analisa Varian de-
ngah model "Randomized Complete Block Design*' (RCB).
Dari hasil analisa ini dapat diketahui apakah ada perbe
daan yang bermakna antar metoda yang dibandingkan, an -
tar sampel dan antaraksi antara metoda dengan sainpel
percobaan pada batas kepercayaan yang diteiatukan. Bila
ada perbedaan yang bermakna dilanjutkan dengan "Least
Significant Difference” tes untuk membeaakan harga rata
rata satu dengan yang lain,
Dari penelitian ini diharapkan dapat dipilih titran pem
bentuk kelat yang baik untuk penentuan kadar Kalsium de
TIKJAUA1; PUSTAEA
1. Teori Kelatometri.^ 1 1 ^
Teori kompleksometri atau kelatometri berdasar -
kan teori Lewis mengenai asam-basa dan teori Werner •
mengenai senyava koordinasi. Menurut Lev;is basa ada -
lah suatu zat dengan pasangan elektron sunvi yang da
pat mengadakan ikatan koordinasi dengan ion positip.
Sedang asem adalah suatu zat atau ion yang dapat teri
kat pada pasangan elektron sunyi dari basa.
Senyawa komplek didefinisikan sebagai kombinasi dari
molekul-molekul atau ion-ion melalui ikatan koordina-
si dan hasil dari kombinasi tersebut dapat merupakan
molekul atau lebih sering dalam bentuk ion (bermuatan)
misalnya FeSCB*4*, Fe(CK)g” Komplek semacan ini merupa
kan suatu komplek dalam bentuk terbuka (bukan cincin).
Sedang kelat merupakan suatu ligan multidentat yang
dapat mengikat logam dalam bentuk ikatan seperti cin
cin (ring).
Logam merupakan ion pusat, ligannya dinamakan ’’chela
ting agent" yang biasanya terdapat atom N, S dan 0 se
bagai elektron donor kuat.
Komplek yang terjadi dengan ikatan dalam bentuk cin -
cin yang disebut kelat lebih stabil dari pada komplek
yang sama tetapi bukan dalam bentuk cincin (terbuka). BAB II
* Kflcan-cioccir pembentuk kelat. ^7,16)
.... palam titrasi''kelatometri terdapat beberapa se •
nyavrc. ■oer^bentuk - kelat. Kacam pembentuk kelat yang'te*
lali dikenal dapat .dililiat sebagai berikut ..
CE2 E,C-C00" CH--COOE
\ ? / l
E-IvtcH0-CH„iE-E fiiu-CE,-COO~
/ \ \
OOC-CE- E^C-COOE CE„-COCH
c. c, eL
(Di-na EDTA) (NTA)
H00C-CEo E oC-C00H CHo-C00H
\ 2 J ' / 2
N-CH^-OEo-K CHo . K
/ 2 2 \ / \2 / \
E00C-CHo 2 H oC-C00E E 0C 2 CE 2, , . CEo-C00E, 2
(ELTA) H2°x / H * / V 000*
C Z 0 N
* \
CE2-COOE
(CDTA)
h o o c-c e2 E^C-COO"
x + +
E. -K± (CE0)-0-(CH0)-0-(CE0)-N- E
X 2 2 2 \
“00C-CE2 h2c-c o o e
Dari bermacam-macam pembentuk kelat di atas EDTA-lah t
yang banyal: dipakai. Dalara perdagangan pembentuk ke
lat (komplekson) yang umum ada tiga macam yaitu :
komplekson I (ETA), komplekson II (EDTA) dan komplek
son- III (garam Di-natrium EDTA yang serins disebut
EDTA saja). Komplekson lainnj^a yaitu GDTA dan EGTA.
EGTA'cierupakan komplekson yang baru dibanding kom
plekson lainnya.
Pembentuk kelat untuk Ca dan Hr.
Senyawa pembentuk kelat yang sangat baik untul:
penentuan kadar Ca adalah EDTA, CDTA dan EGTA^(16).
- Stabilitas komplek yang dibentuk oleh CDTA dengan
logam lebih besar dari pada EDTA, sehingga dapat di
pakai untuk titrasi larutan yang lebih encer atau-
pun pada pH yang lebih rendali, tetapi reaksi yang
terjadi umumnya lebih lambat, CDTA sering dipakai
dalam penentuan kadar Ca dengan adanya sejumlah be
sar Ba atau sejumlah kecil Sr.
- Sebagai senyawa pembentuk kelat. untuk penentuan ka-^
-dar Ca yang berada bersama'dengan Kg digunakan EDTA
atau EGTA. ...
3.1. Ethylenediamine tetraacetic acid (EDTA) = Ethyle
ne diamine-IC,K1 -tetraacetic acid = Asam edetat =
Trilon B = Versene = Chelaton 3 = Sequestrene =
T - 1 1 T T T ( 3 , 7 , 1 6 )
Lomplekson III.
EDTA merupakan asam poli karboi:silat dengan
HOOC-CKp EpC-COO
\ '
H - I\ - CH p - C H p - K - H
/ d \
“OOC-CH2 k2c-co ob
Dalam persamaan-persamaan reaksi umumnya ditu -
liskan sebagai H^Y karena dalam larutan asamnya
sediri berbentuk zwitter-ion ganda dimana dua
proton yang pertama agak mudah dilepas (pH^=2,18
pK2= 2,73), sedang proton yang ketiga dan keem-
pat terionisasi lemah (pK^= 6,20; pE^= 10,0),
sehingga sering dalam bentuk asamnya.
G-aram Di-natriumnya dikenal sebagai Titriplex .
Ill = Kelaton III yang mengandung dua molekul a
ir hablur (I^KpY. 2E20) paling banyak dipakai,
karena lebih mudah larut dari pada bentuk asam
nya, mudah dimurnikan maupun disimpan dalam ben
tuk larutan.
EDTA merupakan ligan heksadentat, sebab dapat
mengikat logam melalui dua atom Nitrogen dan em
pat atom Oksigen dari gugus karboksil. Pemben
tuk kelat ini dengan ion logam dapat membentuk
senyawa kelat yang stabil, karena atom logam te
rikat di dalam ruangan aiantara atom-atom lain.
( 16) .
Kelat yang terbentuk antara ion logam dengan 1
EDTA mempun3rai struktur yang sama tetapi berbeda
dalam muatannya.
r v ' • 91
t__ •.
-I^E^Y dan dalam larutan terionisasi mcnjadi Na+
dan H^Y- , sehingga reaksi antara Kelaton III de
ngan logam K dapat ditulis sebagai berikut :
Logam valensi II + !'"^+ ---* +
Logam valensi III KgY- + K^+ --- > 17Y~ + 2K+
Logam valensi IV E^Y- + K*+ ---* KY +2?!'
Logam valensi I; “2*™ + ^n+ ---* MY^n~ ^ + 2H+
Jadi dapat dilihat b~hwa selalu 1 gram ion logam
menghasilkan 2gram ion E+ atau 1 gram ion logam
sama dengan 2 gram ekivalen.
3.2. Ethylene glycol bis-((j>-aminoetileter)-E,l\T'-tetra
acetic acid (EGTA). ^5,16»17)
EGTA sama dengan EDTA merupakan asam poli -
karboksilat dengan rumus bangun sebagai berikut:
ooc-ch2 h5c-cooh
\ +
+ ^
H-N±( C1I0) -0- (CH,) o-0- (CH,) ,±lf-K
/ ^ 2 ^ ^ * \
H00C-CH2 E2C-C00_
Dalam persamaam-persamaan reaksi umumnya ditulis
kan sebagai E^Z. E^Z ini mempunyai harga pK1=2,0.
pE2=2,68; pIC-=8,85; pK4
=9,43-Sebelum digunakan sebagai titran pembentuk kelat
dilarutkan dahulu dalam KaOK untuk membentuk ga-
ramnya yang larut dalam air.
Seperti halnya EDTA, EGTA dalam bentuk garaumya
dapat ditulis iTa2H2Z dan dapat terionisasi dalam
larutan menjadi Na+ dan menyerupai Kelaton
dituliskan seperti pads EDTA.
Kelebihan Eelaton II sebagai penitrasi dalam kelatome
tri rnerapunyai sifat. sangat stabil, larut, stoichione-
tris, membentuk kelat 1: 1 dengan berbagai ion logam,
konstanta stabilitas. kelatnya dengan berbagai ion lo-
gam. bermacam-macam pula sehingga secara selekt.ip da -
pat dilakukan pengaturan pH yang diperlukan untuk ti-
trasi. Garam. Di-natriumnya dapat dipakai sebagai zat
baku primer, dengan logam Liembentuk kelat yang mudah
larut dan penentuan titik akhir titrasi dapat diamati
dengan berbagai macam cara.(1)
Suatu contbh struktur kelat logam bivalen (misalnya
11
44 Konstanta stabilitas kelat loram-EDTA dsn logam-EGTA,
Reaksi logam bervalensi n dengan ion EDTA atau de
ngan ion EGTA dapat ditunjukkan sebagai berikut :
Kn+ + y4- i z4- ---^ LIY }(n-4)+ i ( K2 )(n-4) +
( I,'Y )(n_4)+ ( k z )<-n"4) +
K = --- — --- 7— atau K = -- — --- j
---( r. + ) ---( y ) ( i'/+ ) .( z4- )
Konstanta stabilitas (konstanta pembentuk kelat) pada
•pH yang dipilih dapat dihitung dari hubungan K/cCf dima
na cA. adalah perbandingan dari total EDTA yang tidak di
kombinasi (dalam semua bentuk) terhadap bentuk Y^" a -
tau perbandingan dari total EGTA yang tak aikombinasi
(dalam semua bentuk) terhadap bentuk
Jumlah Y^“ dapat dihitung melalui tahapan ionisasi da
ri EDTA, yaitu :
1 . E^Y ---* H+ + IijY- , E 1 = 1,0 x .10"2
2. KjY----» H+ + H2Y= , E2 = 2,0 i lO^
. H p Y- - - - > H+ + H Y5- , IC5 = 6 , 3 x 1 0 ~ 7
4. IIY3 ---> H+ + Y4" , K4 = 5,0 x 10~11
Sedang jumlah Z4- dapat dihitung melalui tahapan ioni-
sasi dari EGTA, yaitu :
1. H 4 Z- - - V E+ + H j Z " , ■ E1 = 1, 0 z 1 0 " 2
2. HjZ"---v H+ + H?Z= , Z 2 = 4,8 x 10~2.
3. H2Z=---» H+ + HZ3- , == 7,1 i 10' 8
4. EZ^---- > H+ + Z4-- , K 4 = 2,7 x 10" 9
Sehingga pada pE basa hampir seluruhnya EDTA dalam ben
tuk EY^~ dan Y^~, sedang EGTA dalam bentuk dan Z^~,
Jadi reaksi antara Kalsium dengan. EDTA atau antara ICal
(1) . EY5 ---^ E+ + Y4- dengan K = K4
( Y4" ) ( II+ ) 4 K4 ( HY3-)
Z, = ---5 --- > ( I4" )=— i—
---4 { HY3 ) ( H+ )
(2). Ca++ + Y4- ---> CaY=
( CaY= ) tab. - ( Ca++ ) ( Y4" .)
(1) dan (2) :
( Ca ) ( H+ )
-^'stab. ( Ca++ ) ( HY’3 ) K4
Harga konstanta stabilitas (dinyatakan sebagai
log K) dari kelat Ca-EDTA adalah 10,7 dan Mg-EDTA'8,7.
Sedang untuk kelat Ca-EGTA dan Hg-SJG-TA adalah 11,0 dan
5,2.
Dengan kenaikan pH larutan, maka ada kecenaerung-
an terjadinya hidroksida dari logam-logam yang sukar
larut, dimana reaksinya dapat ditulis sebagai berikut:
(.MY + n oiI" --- > K(0H)n + Y4"
Besarnya hidroksida dari .( MY tergantung pada
hasil kelarutan dari hidroksida ion logam dan juga kon
stanta stabilitas kelatnya.
Dengan dasar ini maka dapat ditentukan kadar Ca yang
terdapat bersama-sama Mg secara kelatometri. Pada pH
antara 12-13 secara kuantitatip Mg diendapkan sebagai
hidroksidanya sedang Ca tetap dalam bentuk larutan.
Cara menentukan titik akhir titrasi kelatometri. O O
Ada beberapa cara untuk menentukan titik akhir ti
13
Ion. B+ yang teriadi dapat diamati dengan dua ma-
can car a :
- Titrasi asam-baca dengan senakai indikator pH
atau dengan memakai pH-meter.
- Titrasi Jodometri dengan memakai campuran \Joaat
joaida dan yang terjadi dititrasi dengan la
rutan baku thio-sulfat.
5.2. Berdasarkan perubahan konsentrasi ion logam (pH).
Di sini dipakai indikator logam yang dapat bereak
si relatip cepat pada waktu terjadinya pe rub all an
pH.
5.3. Secara instrumental dapat dilakukan dengan titra
si potensiometri, anperometri, kor.duktometri dan
spektrofotometri.
6. Beberapa cara titrasi kelatometri. (1 6)
Titrasi dari larutan ion logam dengan memakai Eom
plekson disebut titrasi kompleksometri atau kelatome-
tri. Ada beberapa tip© reaksi dengan komplekson antara
1 ain :
6.1. Titrasi langsung.
Larutan yang mengandung ion logam didapar pa
da pH tertentu yang sesuai, misalnya pada pH 10
dengan memakai larutan dapar salmiak, kemudian di
titrasi dengan larutan baku (EDTA maupun EGTA).
Titik akhir titrasi diamati dengan memakai indika
tor logam dimana perubahan vramanya berdasarkan
perubahan kadar ion logam (pK). Kadang-kadang se-
tuk mencegah pengendapan dari logam hidroksida.
6 .2. Titrasi tidal-: lan£sun£.
Beberapa ion logam tidak dapat dititrasi se
cara langsung, hal ini mungkin disebabkan oleh
karena :
- mengendap pada pH yang diperlukan untuk titra
si,
- pembentukan kelatnya sangat lambat,
- tidak ada indikator logam yang sesuai.
untuk mengatasi hal ini, larutan yang berisi ion
logam ditambah larutan baku (EDTA atau EGTA) da
lam jumlah berlebih dan tertentu, kemudian dida-
par pada pH yang sesuai. Kelebihan larutan baku
dititrasi kembali dengan larutan baku ion logam.
6.3. Titrasi nengusiran.
Titrasi pengusiran ini dilakukan bila ion
logam tidak atau sedikit sekali bereaksi dengan
indikator .logam atau bila ion logam tersebut mem
bentuk kelat yang lebih stabil dari pada kelat
dengan logam lainnya misal Ca atau'Mg.
Beaksinya dapat ditulis sebagai berikut :
Kn+ + ---» MY(n-4)+ + 2 H+
Ion H+ yang terjadi dapat dititrasi dengan laru
tan baku ITaOH. Titik akhir titrasi dapat diamati
dengan memakai indikator asam-basa atau dengan
cara potensiometri. larutan ion logam yang akan
7. Indikator (4,5,7,16,17)
Pengamatan titik akhir titrasi dapat dilakukan
secara potensio.~:etri atau secara visual juga masih ba
nyak dipakai. Indikator yang digunakan adalah indika
tor logam.
Dalam titrasi kelatometri secara visual ini, pemilih-
an indikator logan cangat penting. Syarat-s.varat yang
harus dipenuhi oleh indikator logam untuk menentukan
titik akhir titrasi secara visual adalah
- Memberikan perubahan varna yan-~ jelas pada titik ak
hir titrasi.
- Kemberikan reaksi warna yang spesipik dan selektip.
- Memberikan komplek kelat antara logam-indikator ha
rus lebih kecil dari pada kelat logam komplekson,
sehingga pada titik akhir titrasi koplekson dapat
mengikat logam dari kelat logam-indikator.
- Indikator bebasnya mempunyai varna yang berlainan
dengan varna dari kelat logam-indikator.
- Indikator harus sangat peka terhadap ion logam se
hingga perubahan varnanya sedekat mungkin dengan ti
tik ekivalennya.
- Syarat-syarat di atas harus dapat dipenuhi pada dae
rah pH dimana titrasi dilakukan.
Indikator logam membentuk kelat dengan ion logam,
dimana varnanya berbeda dengan varna indikator bebas
nya.
!•; + • Ind. * E-InS. (D
Tetapan stabilitanya :
( M-Ind.)
Hj-Ind. ( K ) ( Ind. )
Bila larutan ini dengan titran pembentuk kelat misal-
nya EDTA, maka selama titrasi ion logam yang bebas -
menbentuk kelat dengan EDTA, sampai ion logam yang be
bas telali habis, maka penambahan titran pembentuk ke
lat selanjutnya akan mengikat logam yang berada dalam
bentuk kelat dengan imdikator. Dengan aemikian indika
tor akan dibebaskan kembali dan terjadilah perubahan
varna.
Jadi selama titrasi terjadi reaksi :
11 + EDTA ---V M-EDTA (2)
Tetapan stabilitanya :
( M-EDTA )
LK-SDTA ( m)) ( EDTA. )
Pada dekat titik ekivalen terjadi reaksi :
M-Ind. + EDTA --- > K-EDTA -f Ind. (3)
Reaksi ini hanya akan terjadi bila kelat K-EDTA lebili
.stabil dari pada kelat M-Ind,, dengan kata lain teta
pan stabilitas kelat M-EDTA lebih besar dari pada te
tapan stabilitas kelat M-Ind.
Jadl’EK-EDTA'^ EK-Ind. atau pl"M-EDTA^ pKK-Ind.’ Disamping itu, perubahan wam a indikator dipengaruhi
oleh pH. Misalnya indikator Calcon dapat ditulis de -
ngan K^Ind.", menunjukkan sifat asam-basa sebagai be
P^Ind. * Hind
me rail ■bo.ru mera
Pada pH 7,4-- 13,5 sat warna ini bervrarna biru, dapat
membentulc kelat yang berwarna merah dengan ion-ion lo
gam. Pada penentuan kadar Ca dengan,adanya Lg dapat
diatasi dengan menggunakan indikator Caicon, karena
pH 3rang digunakan untuk titrasi tinggi (pH 12,5).
Perubahan varna indikator logam pada titrasi kelatome
triidapat disebabkan oleh indikator yang dibebaskan
dari kelat logamnya atau perubahan pH d'.ri larutan ,
yang mungkin terjadi sebelum titik ekivalen.
Dengan mengingat hal tersebut di atas maka perlu di -
perhatikan suasana lar.itan untuk mendapatkan titik e-
kivalen yang tepat, Untuk ini larutan harus didapar
sehingga perubahan w a m a yang terjadi han}'a disebab -
Ean oleh bebasnya ion indikator dari kelat logamnya.
Beberapa.macam indikator logam yang dapat untuk menen
tukan kadar Ca :
- Kurexide.
- Eriochrome Black T .(Solochrome Black).
- Patton and Reeder’s indicator.
- Solochrome Dark Blue (caicon).
- Calmagite.
- Calcichrome.
- Past Sulphon Black P.
- Sincon, dan lain-lain.
Indikator logam yang umum dipakai padc- titrasi Ca de
Calcon dan Hurexide digunakan untuk titrasi pada pH
12, 5 ; karena suasana basa kuat ini maka I»Ig akan dien
dapkan sebagai Mg(OH)2. Terjadinya endapan Mg(OH) 2 a-
kan nengadsorpsi wama indikator Kurexide dan kelat
C a-Murexide, sehingga warna pada titik akhir titrasi
tidak begitu jelas dan hasil Ca yang didapat akan le
ft ih sedikit dari keadaan semula. Untuk mengatasi hal
ini perlu ditambah indikator yang lebih banyak.
Berdasarkan hal-hal tersebut di atas lebih baik digu-
nakan Calcon.(14)
* Calcon atau Solochrome Dark Blue.
Calcon juga disebut Eriochrome Blue black R
yang mempunyai Colour Index fto. 202.. Zat wama ini
mempunyai runus bangun sebagai berikut :
OH HO
^-S0~ Ha+
Natrium 1-(2hidroksi-1-naftilazo)-2-naitol-4-sul-
fonat.
Zat warna .ini mempunyai dua gugus fenol yang dapat
terionisasi melepaskan dua atom hidrogen dengan
p&2 = 7,4 dan pK^ = 1 3 , 5 . .
Indikator ini dipakai dalam titrasi- kelatometri un
tuk menentukan kadar Ca disamping Mg. Titrasi ter
sebut harus dilakukan pada pH-sekitar 12,5 untuk
menghindari gangguan dari Kg, karena pada pH ini
I-iolekul yang netral (bentuk Il^Ind.) yang hanya ter ja
di pada media asan) kuat bervrarna hijau, pada pH 7,0
bervrarna merah, pH 10 berwarna biru dan pada pH 13,5
berwarna merah.
Kelatnya dengan Ca bervrarna merah pada pH 12,5 dan pe
rubahan varna pada titik akhir titrasi yaitu dari ne-
rah menjadi biru.
8. Pembakuan larutan -pembentuk kelat.
8.1. Pembakuan larutan EDTA.(3,4,12,16)
Larutan EDTA dapat dibakukan dengan bebera<=> •
pa cara sebagai berikut :
8.1.1. Dengan larutan baku ZnSO,( cara langsung).
Dibuat larutan baku ZnSO^ dengan me-
nimbang kristal Z n S O ^ ^ O dan dilarutkan
dalam air bebas logam, Dipipet larutan ba
ku ZnSO^ dengan volume tertentu, diencer-
kan dengan air bebas logam, ditambah laru
tan dapar salmiak sampai pH 10, ditambah
indikator EBT 50 mg, kemudian dititrasi
dengan larutan EDTA sampai terjadi peruba
han warna dari merah menjadi biru, Bila
larutan ZnSO^ yang dipakai sebagai titran
perubahan warna dari biru menjadi merah.
8.1.2. Dengan larutan baku CaCl^f cara langsung).
Dibuat larutan baku CaCL2 dengan me-
nimbang Ca"C0^ p,a. dilarutkan dalamair be
bas' logam dengan penambahan larutan HC1
RS
hilangkan C02 yang terjadi, keiaudian di
ne tralkan dengan larutan UaOH dan diencer
kan sampai volume tertentu, dipipet laru
tan baku CaCl^ dengan volume tertentu, di
encerkan dengan air bebas logam, kemudian
ditambah larutan NaOIi 4N sampai pH 12,5
dan ditambah indikator Calcon 100 mg.
Eemudian dititrasi dengan larutan EDTA
. sampai terjadi perubahan vam a dari merah
menjadi biru.
8.1.3. Denman larutan baku HgCL„(cara tak Ians-J ^ - - cl
sung).
Dalam pembakuan ini dilakukan titra
si secara tidak langsung, yaitu dilakukan
titrasi dua kali, sehingga dapat diketahu
hi titer dua macam larutan yang dipakai
yaitu EDTA dan MgSO^/MgClg.
8.2. Pembakuan larutan E G T A .(16)
Larutan EGTA dapat dibakukan dengan bebera-
pa cara sebagai berikut :
8.2.1. Dengan larutan baku CaCl^Ccara langsung).
Pembakuan larutan EGTA dengan laru -
tan baku CaCl^ caranya sama dengan pemba
kuan larutan EDTA. Atau- dapat juga diguna
kan indikator Zincon, digunakan dapar sal
CQ miak pH 10 dan ditambah larutan Zn-EGTA,
titrasi diakhiri sampai terjadi perubahan <
Bahan penelitian dan nenyediaannya.
1.1. Lab.au -penelitian.
bahan penelitian yang digunakan jika. tidal:
ainyatakan lain n.erspunyai deraj at kenurnian prc-
analira (p .a.).
- Cal-C-r .
✓
“ iigCO^j 7 H20. - EDTA.
- EGTA.
- Caicon.
- l.aCl.
- l-TaOi:.
1.2. Pen.vediaan bah an penelitian.
1.2.1. Penyediaan air bebas loga^. (aquariem).
1.2.2. Penbuatan larutan baku EDTA 0.05 K .
Bitinbang 18,6100 g Di-natriun EDTA
dilarutkan dalarj air bebas logan nanipai vo
lurr.e satu liter. Penyinpanan larutan ini
sebaiknya aalan botol plactik, botol pirex
atau botol politen, sebab botol biaca akan
dapat nelepaskan kation logam dan anion ke
dalari larutan ZETA. i ~
—>
___ iI aI A:1.2.3* Pembuatan larutan baku EGTA 0.05 K .
Ditinbang 19,0100 g EGTA, dilarutkan
dalaa KaOH 1 K 100 nil, keisu&ian dieneer -
kan dengan air bebas logam sarr.pai volurae
satu liter. Penyimpanan saraa dengan laru
tan £DTA,
1.2.4. Larutan basa untuk titrasi.
. Eitimbang 15 g iiaOH padat, dilarut -
kan dalam 100 nl air bebas logaiL.
1 .2.5* Larutan baku induk 0.5 V-.
Ditiisbang teliti 123,2400 g MgSO^TK^O
dilarutkan dalam 200 ml air bebas logam,
ditambah i ml larutan HC1 6 U, kemudian
ditambah air bebas logam sampai volume sa
tu liter.
1.2.6. Larutan baku indufa Ca+* 0.5 M .
Ditimbang teliti CaCO^ dengan berat
50 ,0 450 g -setelah dipanaskan seteng&h jam
pada 110°C. Kemudian dilarutkan dalsas HC1
aecukupnya, ditambah 50 al air bebas lo -
gas, dididihkan agar GO2 yang terjadi hi^
lang. Larutan ini kerauaian didinginkan,
dinetralkan dengan larutan NaOH 1& dan di
encerkan dengan air bebas logam sampai vo.
luae satu liter.
1.2.7. Indikator Caicon.
rat 10 g. Untuk setiap kali titraci digu
nakan 100 mg,
2. Ketoda penelitian dan pelaksanaan.
Dalam penelitian-penelitian ini dapat dibagi se
bagai borikut :
2.1. Pembakuan larutan EDTA. '
Pembakuan larutan EDTA dengan larutan baku
Ca++ adalah sebagai berikut :
Dipipet larutan baku Ca++ 10,0 ml, ditambah 5 ml
larutian KaOH 15# (diperiksa pH-nya satcpai 12-13
dengan pK-meter) dalam labu erlenmeyer 100 ml,
aitanbah indikator Calcon 2^- 100 mg, kemudian di‘
titrasi dengan larutan EDTA carapai terjaai peru
bahan vrarna dari merah menjadi -biru.
2.2. Pembakuan larutan EGTA.
Pembakuan laruta2: EGTA dengan larutan baku
Ca++, sama dengan.urutan kerja seperti di atas,
dilakukan titrasi dengan memakai indikator Cal
con 2# 100 mg dengan perubahan varna dari merah
■ menjadi biru.
2.3..Cara kerja.
2.3.1. Penentuan kadar Ca~t"f 'dengan larutan EDTA.
Sebelun dilakukan penentuan kadar *\
0a++, terlebih dahulu dibuat larutan baku
kerja sebagai berikut :
- Dipipet larutan baku induk Ca+_i" 10,0. ml
diencerkan dengan air bebas logara sam-
EDTA dan “G-TA) .
- Dipipet larutan baku induk Kg+T> 1, 0 nl,
diencerkan dengan air bebac logan sampai
volume 10 ,0 nl. Eesradian dipipet 1 ,0 nl
ditanbah larutan baku induk Ca++ 1Q,0 nl
diencerkan dengan air bebac logan carpal
volume 10 0 ,0 ml (larutan I).
Dipipet larutan baku induk Ca++ 10-0 nl
ditanbah larutan baku induk ;-g++ 2,0 nl;
diencerkan dengan air bebas logan sanpai
voluse 100,0 nl (larutan II).
- Larutan III, IV, V dan VI perlakuannya
sama seperti larutan II hanya larutan ba
ku induk kg++ yang ditanbahkan berbeda
mulai 4,0 nl; 6,0 nl; 8,0 nl; dan 10f0nl;
kenudian diencerkan dengan air-bebas lo-
gan sanpai volume 10 0 ,0 nl.
Dipipet larutan baku kerja 10,0 cl dimasuk
kan aalau labu erlenneyer 100ml, ditanbah
5 ml larutan ITaOK 15# (diperiksa pll-nya 12
sampai 15 dengan pl.-neter) , ditanbah indi
kator Caicon 2f- 100' s.g, keiaudian dititraci
dengan larutan IDTA e&npai terjadi peruba
han warna dari nerah menjadi biru.
2.3.2. Penentuan kadar Ca~H~ dengan larutan EG?/..
Penentuan kadar Ca+‘r dengan TCGTA sa
ma der-gan urutan kerja di atac,.dilakukan
titrasi dengan larutan EG?A sanpai terja-
di perubahan vam a dari nerah menjadi bi
ru.
( 1 nil 0,1 i: EGTA = 4,008 nr Ca^+ )
2.3.3. Dilakukan titrasi blanko sebagai berikut.
Dipipet 10 ,0 r.l air bebas logar^ di-
nasukkan dalai: labu erlenneyer 100 nl, di
tanbah 5 nl larutan E&OE 15% {• dibuat pH-,
nya 12-13 dengan pH-rceter), ditanbah ir.di
kator Calcon 2% 100 ir.g, dititraci dengan
larutan ZDTA/EGTA sampai terjadi peruba
han vrama dari merah menjadi biru.
2,4. Perhitungan untuk nendapatkan kembali' kadar I'al-
siun dengan adanya #agnesius: secara kelatometri.
Untuk nenghitung ker.bali kadar Kalsium aa-
lair. carapuran dengan Kagnesium digunakan ru~ur
yang diturunkan dari ruaus dasar V^xl^ = V2xK2 :
ci dikurangi volune blanko.
4,006 adalah ekivalenri r-r 0a++ untuk tiap 1 nl 0,1 V. titrar:.
200 adalah pen^encerar. rula.i dari baku induk
sampai volu;_e pada e-aat titraci.
( 2 10 11)
2.5. .:.etoaa analisir nasil penelitian. * ’
Hacil pcnra^atan anal±sis kuantitatip dihi
tung secara etatictik dengan analir.is varian uo-
del "Jiandoruized uor.plete Block Desi£nn (KOI) /
];esain Kandonieasi len.~kap.
Kadar Kalsiun yanc didapat. dari hacil penelitian
dapat dibuat tabel eebacai berikut :
! Titran !
Untuk nenrhitvxr kargra I digunakan ruaus-ruEius :
i=1 3=1 k=1 <r 2
Experimental error : E = - S ^
Kemudian disusun tabel anava untuk ’’Factorial in a
Randomised Complete Block Design” sebagai berikut
TABEL
Jika ditinjau efek dari metoda, sampel percobaan dan
antaraksi antara metoda dengan sampel percobaan, hal
ini dapat diketahui dengan membandingkan harga F per-
hitungan terhadap F tabel. Apabila harga F perhitu -
yang bentakna. Bila hal ini terjadi, perhitungan di-
lanjutkan dengan LSD tes dengan rumus sebagai berikut
LSD = tK:sE (-^7 + 4 - )
Bila selisih harga rata-rata ( I ) lebih besar dari
IiD, maka ada perbeaaan yang bermakna.
Untuk harga rata-rata yang masuk trayek : 100>- + -JLSD
BAB IV
KA3IL PEliELITIAK
1. Hasil perhitungan kadar Kalsium dengan adanya Magnesium
secara kelatometri.
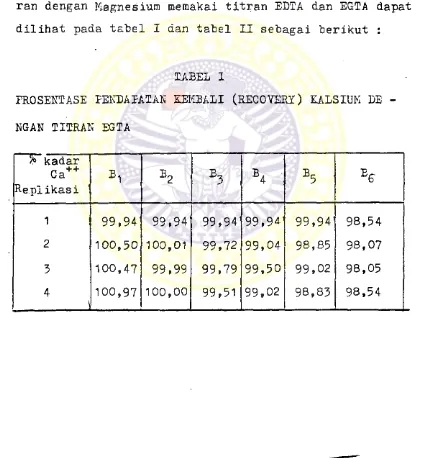
Kadar Kalsium yang didapatkan kembali dalam campu- ran dengan Kagnesium memakai titran EDTA dan EGTA dapat dilihat pada tabel I dan tabel II sebagai berikut :
TABEL 1
PROSENTASE PENDAPATAN EEKBALI (RECOVER!) KALSIUM DE -
NGAN TITRAN EGTA
b kadar
_ ++ Ca
Re.pl ikasi E1 B2 E3 B4 ' B5 %
1 99,94 99,94 99,94 99,94 99,94 98,54
2 100,50, 100,01 99,72 99,04 98,85 98,07
3 100,47 99,99 99,79 99,50 99,02 98,05
4 100,97 100,00 99,51 99,02 98,83 98,54
29 fBRPUSTAtAA*-.. K l U *
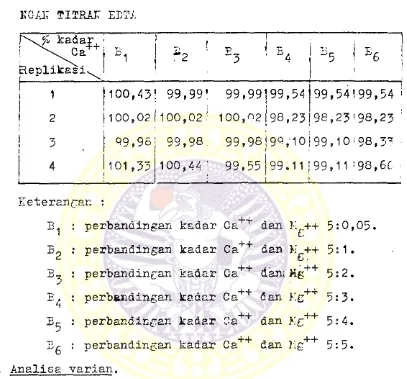
TABEL II
4 101,35 j100,44' 99,55 {99.11
: 99,11 •98,
6C
Keterangar. :
33^ : perbandingan kadar Ca+"r dan M^_++ 5:0,05.
3 0 : perbandingan kadar Ca++ dan >1 ++ 5:1.
C. .
: perbandingan kadar Ca++ dan; Mg++ 5:2.
: perbandingan kadar Ca++ dan Kg++ 5:3.
B^ : perbandingan kadar Ca++ dan >.'£++ 5:4.
Bg : perbandingan kadar Ca++ dan Kg++ 5:5.
r
2. Analisa varian.
lintuk jaesbulrtikan hasil-hajril pengasatan analisa
dihitung pecara statietik dengan analisa varian senu-
rut model "Jtandorsized Complete Block Design” yang da
pat ditabelkan pada tabel III. Sedang hasil perliitu-
TABEL IV
HASIL PERHITUK.GAK ANAVA
Sumber variasi D.F. S.S. M.S. X1 |
Perlakuan A 1 0 0 0
Perlakuan B 5 -23,3.5 4 ,1.6,6 22,34 >
Interaksi AB 5 1 0,4 0,0 8 . -0,383
Kekeliruan Exp. 36 7,52 ' --0,2089
Total 47 31,2523
Dengan melihat hasil-hasil dari tabel tersebut
di atas dapat dinyatakan :
1-) . Untuk antar metoda (M) : Hq adalah = M2.
F tabel pada *<0,05; F ^ ^ & 4,11
Jadi.F perhitungan ^ dari F tabel, sehingga EQ
diterima berarti tidak ada perbedaan yang ber
makna antar metoda.
2). untuk antar sampel (S) :
K q adalah S1 = S2 = .S^ = S4 = = Sg.
F tabel pada <*£0,05; F ^ ^ = 2,48
Jadi F perhitungan ^ P tabel, sehingga Eq dito
lak berarti ada perbedaan yang bermakna antar
sampel.
3). Untuk interaksi antara metoda dan sampel perco
baan.
F tabel pada o<. 0,05; F ^ 36. ) = ?»48
55
na antara metoda dan sampel percobaan.
Dengan adanya perbedaan yang bermakna antar sampel -
tersebut, maka uji perlu ailanjutkan lagi dengan
IISD tes, untuk melihat pasangan harga rata-rata mans
yang bermakna dan mana yang tidak bermakna.
lSD = t V mS* ( )
" ni j
Pada oL 0,05; D.F. = 36 maka t tabel = 2,021
Sehingga ;
LSD =2,021 \| t),2069 ( ± + % ) = -0,6532
Bila selisih dari dua harga rata-rata sampel )>> t,SD
berarti ada perbedaan yang bermakna. Dari harga rata
rata (^) hasil percobaan disusun berurutan mulai har
ga terkecil sampai harga terbesar, sehingga dapat di
lihat ada atau tidaknya perbedaan yang bermakna.
D1 = 1 0 0, 4 4 , Dg. = 9 9 , 0 0 , = 1 0 0, 4 7 , = 9 9 , 3 8
D 2 = : 1 0 0,1 1 , d5 = 9 9 , 0 0 , & 2 = - 9 9 . , 9 8 , &5 = 9 9 , 0 4. D^ = S9 , 8 8 , d6 = 9 8 , 4 4 , q = 9 9 , 7 4 , & 6 = 9 8 ,3 0
-Susunannya adalah :
G6 D6 ■D4 = I)5 G5 G4 G3 3D3 G2 D 2 D 1 G 1
Harga rata-rata (^) total ;
D G
99,478 99,465
Keterangan :
D : titran pembentuk kelat EDTA.
Sedang angka indel: menunjukkan macam kadar yang di -
tentukan.
Karga di atas garis menunjukkan harga rata-rata
sam-pei yang mempunyai selisih lebih kecil dari 0,66 ,
sehingga harga tersebut menunjukkan tidak adanya' per
bedaan yang bermakna.
Untuk mengetahui sampel yang lebih baik diguna
kan batasan yaitu 100^ + £il!.3D atau 100^ + 0,33 * Be
rarti pada range 99,67?* - 100,33# adalah yang pa -
BA B V_ PEH BA H A SA K
Penentuan kadar Kalsium dengan adanya hagnesium se
cara titrasi kelatometri mempunyai tujuan untuk mengeta
hui ada tiaaknya perbedaan yang bermakna antara 'penggu-
naan Etilendiamin tetraacetat dengan Etilenglikol bis-
( -aminoetileter) tetraacetat. Untuk membandingkan ke
dua titran pembentuk kelat ini digunakan Calcon sebagai
indikator. Titrasi dilakukan pada suacana pH tinggi (se
kitar 12,5), untuk menghindari gangguan Magnesium, kare
na pada pH tersebut kagnesium akan diendapkan secara ku
antitatip sebagai hidroksidanya.
Indikator Calcon yang dipakai pada pK tinggi tersebut
m'embentuk kelat dengan Kalsium yang berwarna merah, se
hingga perubahan warna pada titik akhir titrasi yaitu
dari merah menjadi biru.
Di dalam titrasi kelatometri ini yang perlu diper-
hatikan untuk memperkecil kesalahan :
- Bengendapan Magnesium dengan larutan HaOH 155b (pH12,5)
sampai terjadi endapan Kg(0H) 2 yang sempurna perlu
waktu dan pengadukan yang cukup.
- Sampel yang merupakan campuran Kalsium dan Magnesium
setelah ditambah larutan ITaCK 15^ (pH 12,5) akan ter-
jadi suatu bentuk koloidal, sehingga penambahan ti -
tran EDTA / EGTA sedapat mungkin tidak terlalu cepat
dan perlu pengocokan yang kuat untuk menghindari kesa
lahan akibat pelepasan Kalsium dari bentuk kelatnya de
ngan indikator yang agak lama.
- Titik akhir titrasi dihentikan setelah ter jadi wama
biru yang permanen.
Untuk mengolah data hasil penelitian digunakan ana
lisa varian model “Randomized Complete Block Design1', di
pakai model ini karena adanya dua metoda dengan enam ma-
cam perbandingan kadar Kalsium dan Magnesium serta empat
replikasi.
Dari hasil perhitungan anava dapat disimpulkan bahwa pa
da batas kepercayaan 95$ (**C= 0,05) :
- Tidak ada perbedaan yang bermakna antar metoda bila
dilihat secara keseluruhan.
- Tidak ada perbedaan yang bermakna pada perbandingan
Kalsium dan Magnesium 5:0,05; 5:1; 5:2; 5:3; 5:4;
5:5 pada kedua metoda.
- Ada perbedaan yang bermakna antar sampel.
- Tidak ada perbedaan yang bermakna antar interaksi
antara metoda dengan sampel.
Dari perhitungan statistik di atas dapat ditarik suatu
kesimpulan bahwa penggunaan titran pembentuk kelat EDTA
dan EGTA tidak ada perbedaan yang bermakna.
Adanya perbedaan yang bermakna antar sampel ini disebab-
kan karena semakin besar kadar Magnesium pada campuran
tersebut, prosen kadar Kalsium yang didapatkan semakin
Pada campura:: dimana kadar Kalsium jauh lebih besar da
ri pada Magnesium, kesalahan akibat kopresipitasi dapat
diabaikan. Sebaliknya bila kadar Kagnesium semakin be
sar, kopresipitasi sangat menpengaruhi hasil titrasi.
Jadi jelaslah disini bahwa adanya hasil-hasil yang ku:-
rang memuaskan pada titrasi kelatometri ' ini aise
BAD 71
XESIEPULAK DAK SAEAii
1 . ESSIKPULA3?.
Dari hacil penelitian perbandingan penggunaan ti
tran pembentuk kelat Etilendiamin tetraacetat ’dengan;"
Etilenglikol bis-(<*>-aninoetileter) tetraacetat pada
penentuan kadar Kalciun dengan adanya Kagnesiun seca-
ra kelatometri, dapat disimpulkan sebagai berikut :
1.1* Penggunaan EDTA dan EGTA pada'penentuan kadar
Ealcius dengan adanya Magnesium pada perbanding
an 5:0,01; 5:1; 5:2; 5:3; 5:4; 5:5 tidak Eenberi
kan perbedaan yang bermakna pada batas kepercaya
an 95^.
1.2. untuk penentuan kadar Kalsium dengan adanya }:ag-
nesiujn secara kelatoiaetri, bila digunakan indika.
tor Calcon dalaa suasana pH tinggi relatip lebih
Esenguntungkan EDTA dari pada. EGTA.
2. SARAS-SARAK.
Saran-saran yang dapat diutarakan dari hasil pe
nelitian ini adalah sebagai berikut :
2.1. Untuk peaerikeaan rutin disana kadar Ealsium nau
pun Kagnesiun cukup besar dan kadar Kalciun le -
bih besar dari kadar j-iagnesiur: dapat dipilih me-
toda kelatonetri dengan menggunakan titran pern -
BAB VII
RIEGEASAI?
Kalsium dan Magnesium mempunyai siiat-sifat kimia
yang hampir sama, keduanya sering terdapat bersama-sama
baik di alam ataupun pada seaiaan farmasi, seliingga ne. - •
nimbulkan kesukaran dalam menentukan kadar Kalsium. Ter
dapat bermacam-macem cara penentuan kadar Kalsium dengan
adanya Magnesium. Pada penelitian ini digunakan metoda
kelatometri. Adapun tujuannya adalah untuk membandingkan
penggunaan titran pembentuk kelat EDTA dan EGTA pada pe
nentuan kadar Kalsium dengan adanya Magnesium secara ke
latometri.
Perbandingan Kalsium dan Magnesium yang digunakan
diharapkan suaah mencakup perbandingan dalam cairan tu -
buh, makanan dan obat-obatan.
Sampel ( campuran Kalsium dan Magnesium ) ditambah
larutan KaOH 1 pH 12,5 ; ditambah indikator Caicon dan
dititrasi sampai terjaai perubahan warna dari merah men-
jaai biru. Tiap perbandingan dalam satu penggunaan titran
pembentuk kelat ditentukan sebanyak erapat replikasi.
Data hasil penelitian diolah secara statistik menu-
rut analisa.varian dengan model ”Randomized Complete
Block Design". Hasil yang didapatkan, penggunaan EDTA dan
EGTA secara kelatometri tidal: memberikan perbedaan yang
bermakna. Pada perbandingan kadar Magnesium semakin besar,
b a b y i n
BAFTAS PUSTAEA
1. Blaedel W.J, and Meloche V.W., 1963, Elementary Quan
titative Anal3rsist Second edition, Harper and Row Pu
blishers, New York, p. 574-576.
2* Daniel TC.W., 1978, Biostatistics, : A Foundation for
A nalysis ;Ln the Health Sciences, Second edition,
John Wiley end Sons, Inc., U.S.A., p. 203-249.
5. Day R.A.Jr. and Underwood A.L., 1977, Quantitative
A-'nalysis, Third edition, Prentice Hall of India Priva
te limited, l\ew Delhi, p. 132-151.
4. Diehl H. and Ellingboe J., 1960, Azo Dyes'as Indica
tor for Calcium and Magnesium, Analytical Chemistry,
Vol. 32 Ko.9* p. 1120-1123.
5. Hildebrand G.P. and Reilley C.K., 1957, Kev Indicator
for Complexometri Titration of Calcium in Presence of
Magnesium, Analytical Chemistry, Vol.29 No.2, 258-264.
6. Kenny A.D. and Cohn V.H. , 1958, Complexometric Titra
tion of Calcium in the Presence of Magnesium, Analyti
cal Chemistry, Vol.30 Ho.8, p 1366-1368.
7. IColthoff et.al., 1969, Quantitative Chemical Analysis,
lourth edition, The Macmillan Company, London,
p. 803-811.
8. Lewis L.L. and Kelnick L.M., 1960, Determination of
tetra-acetic acid, Analytical Chemistry, Vol.32 No.1,
p. 38-42.
9. Martindal. The Extra Pharmacopoeia, 1982, Twenty-
eighth edition, The Pharmaceutical Press, London,
p. 76-77,81-84.
10.'Kazir >loh. , 1985, Metoda Penelitian, G-halia Indone
sia,'Jakarta, hal. 489-499.
11. Oetle B., 1956, Statistics in Research Basic Con -
cepts and Techniques for Research workers, Second
edition, The Iowa State College, Press-Ames-Iovra,
p. 339-351.
12. Rand K.C. et,al., 1976, Standart Methods for the
Examination of Water and Waste water, Fourteenth
edition, American Public Health Association, Was
hington, p. 189-191.
13. Schmid R.W. and Reilley C.K., 1957, Kew Complexon
for Titration of Calcium in the Presence of Magne
sium, Analytical Chemistry, Vol.29 Eo.,.2, 264-268.
14. Schouwenburg J.Ch.V., 1960, Kicro-EDTA Titration
of Calcium Magnesium Interference, Analytical Che
mistry, Vol.32 3\:o.6,p. 709-711.
15. Schvarzenbach G., 1960, Relationships Between Me
tal Complex Stability and Structure of the Com
pleting Agent, Analytical Chemistry, Vol.32 13o.1,
p. 6-9.
16. Vogel’s, 1978, Textbook of Quantitative Inorganic
Analysis, Fourth edition, Longman, London,
17. Yarbro C.l. and Golby R.L. , 1958, Complexometric Ti
tration of Urinary Calcium and Magnesium, Analyti -
Tabel t.
Remington's Pharmaceutical Sciences, 15 * Ed, Hack
Lanpiran C
Perbakuan larutan- EDTA dan EGTA.
1. Penimbangan larutan CaCO^ :
Replikasi Berat CaCO, (gram) Berat Ca++ C gram)
1 10,0008 4,0047
2 10,0090 4,0080
■3 10,0115 4,0090
4 10,0107 4,0087
Berat CaCO* 1000
Normalitas CaOO, = --- x — — x 2
5 B.H. CaC05 200
Dari larutan baku induk Ca++ dipipet 10,0 ml dilarut
kan dengan air bebas logam ad 100,0 ml. Jadi Normalitas Ca++ untuk pembakuan :
" 1 §6 ' x Normalitas CaCOj 2. Hasil pembakuan larutan EDTA
r~
1 10,0 0,0999 11 ,20 0,0892
2 10,0 o i1-* o o o 11,20 0,0893
3 10,0 0,1000
/ 11,30 0,0885
4 10,0 0,1000 [11,25 0,0889
Normalitas EDTA dihitung dari :
3. Hasil pembakuan larutan EGTA.
1
| Replikasi1 volume
j
| CaCCMmi;I 1 ^
NormalitasI Volume
CaCO, (k; (EGTA(ml
Normalitas EGTA (N)
1 j 1 0, 0
2 | 1 0, 0 ! 3 1 0, 0 ! 4 1 0, 0 I
0 , 0 9 9 9 0 ,1 0 0 0 0,1 0 0 0
. 0 ,1 0 0 0
1 0,15 f 1 0 , 3 0
1 0. 3 0
1 0. 3 0
0 , 0 9 8 4 0 ,0 9 71 * 0, 0 9 71 0,0 9 71
Normalitas EGTA dihitung dari :
Lacpiran D
T - ■'T Y2 T 2
i= 1 j t l k = 1 ^ “ r - a - b '
4 75 0 6 0 ,1 9 - ■ = 4 75 0 6 0 ,1 9 - 4 7 5 0 2 8 ,9 4 31 ,2 5
£ 2
,i = 1 A i T 2
r.b r.a.b
( 2 ?8 7 ,6 ?) 2 + ( 2 ^ 4 ^ ) 2 _ 4 7 5 0 2 8 )9 4 = 0
b 04*b
k ? 1 B k ? 2
r.a r.a.b
(803,64)2+(800,37)2+(79S.50)2-f(793,48)2+(792,13) 2
4.2
+(786,96)--- 475028,94
4.2
475052,27 _ 475028,94 = 23,33
ji b ^
< £- ^ T P
.T=1 k = l .ik_________ T_
r r.a.b
1401j88)2+ (599,94)2+(398<96)2+ (397,50)2+(396,15)2
4
. ( ~ 95.2 0 ) 2 * (4 01 . 76 ) 2+ (4 0 0 . 4 3 )2+ ( 3 9 9 .5 4 ) 2+ ( 3 9 5 . Q 8 )2
+ 4
+ (^ 5 ,9 8 )2+ p 9 ? ,7 6 ) 2 _ 4 7 5 0 2 8 > 9 ,