PENUNTUN PRAKTIKUM
MIKROBIOLOGI
P E T E R N A K A N
Disusun Oleh:
Dr. Ir. YUNILAS, M.P
NIP. 196806111993032001
PROGRAM STUDI PETERNAKAN FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
KATA PENGANTAR
Puji dan Syukur penulis panjatkan kehadirat Allah SWT Tuhan semesta alam
berkah rahmad dan hidayah-Nya penulis telah dapat menyelesaikan buku Modul Praktikum Mikrobiologi Peternakan pada Program Studi Peternakan, Fakultas Pertanian Universitas Sumatera Utara.
Buku ini dibuat sebagai panduan mahasiswa dalam melakukan praktikum Mikrobiologi Peternakan pada Program Studi Peternakan Fakultas Pertanian Universitas Sumatera Utara. Beberapa materi disajikan dengan harapan dapat memperkaya wawasan pengetahuan praktis tentang mikrobiologis khususnya dibidang peternakan. Selain membaca buku ini, mahasiswa diharapkan mencari buku-buku penunjang lain yang berhubungan dengan materi yang di praktikumkan sebagai sumber literatur.
Penulis menyadari buku ini masih banyak kekurangan, oleh karena itu kritik dan saran demi penyempurnaan buku ini dimasa yang akan mendatang sangat diharapkan. Akhir kata penulis berharap buku ini dapat bermanfaat bagi mahasiswa yang akan melakukan praktikum.
Medan, Februari 2017
Penulis
KATA PENGANTAR ……….. i
DAFTAR ISI ………. ii
TATA TERTIB PRAKTIKUM ……….. iii
Latihan 1. Pengenalan Alat ……… 1
Latihan 2. Sterilisasi ………. 9
Latihan 3. Media Pertumbuhan Mikroorganisme...……… 14
Latihan 4. Teknik Isolasi Mikroorganisme ……… 20
Latihan 5. Teknik Biakan Murni ……… 26
Latihan 6. Uji Aktifitas Enzim Secara Kualitatif ………... 32
Latihan 7. Pengamatan Bakteri Secara Mikroskopis ………. 35
Latihan 8. Pengamatan Fungi/Khamir Secara Mikroskopis ………….. 39
Latihan 9. Penghitungan Jumlah Mikroba Menggunakan Metode Angka Lempeng Total (ALT)………..….. 42
Latihan 10. Penghitungan Jumlah Mikroba Mengunakan Haemocytometer……… 46
Latihan 11. Pengaruh Lingkungan Terhadap Pertumbuhan Mikroba …. 49
Latihan 12. Peran Mikroba Pada Bahan Pakan Ternak ……… 54
Latihan 13. Mikrobiologi Pada Produk Peternakan …….……… 57
TATA TERTIB PRAKTIKUM
1 Praktikan wajib hadir 15 menit sebelum praktikum dimulai, mengenakan jas Lab, masker, sarung tangan, sandal.
2 Praktikan dan asisten wajib menguasai materi praktikum yang akan dilakukan.
3 Praktikan tidak diperkenankan memasuki laboratorium sebelum praktikum dimulai.
4 Meja kerja bebas dari peralatan pribadi seperti tas, hand phone, dompet dll. 5 Praktikan dan asisten wajib memahami tentang keselamatan kerja (safety)
laboratorium.
6 Cuci tangan sebelum dan sesudah bekerja dengan antiseptic dan/atau sabun 7 Meja kerja harus disterilisasi sebelum dan sesudah bekerja (tindakan aseptis) 8 Praktikan yang merusak alat atau bahan kimia, baik dilakukan sengaja atau
tidak sengaja, maka kelompok praktikum yang bersangkutan wajib mengganti alat atau bahan kimia tersebut dengan jenis dan kualitas yang sama.
9 Setiap praktikum harus menjaga kebersihan laboratorium dan mengembalikan alat dan bahan yang telah digunakan ke tempat semula dalam kondisi yang seharusnya.
10 Praktikan yang tidak mengikuti praktikum selama 3 (tiga) kali tanpa alasan yang dibenarkan tidak boleh mengikuti praktikum selanjutnya dan dianggap mengundurkan diri dari praktikum.
11 Praktikan wajib menyerahkan laporan praktikum sebelumnya apabila akan mengikuti praktikum berikutnya.
LATIHAN 1
PENGENALAN ALAT
Tujuan:
1. Mengenal peralatan digunakan dalam praktikum mikrobiologi.
2. Mengetahui fungsi dari peralatan yang digunakan secara benar dalam praktikum mikrobiologi.
Pendahuluan
Berbagai alat/peralatan serta mikroskop sangat penting diketahui sebelum
melakukan kegiatan pengamatan di laboratorium mikrobiologi. Masing-masing alat
mempunyai fungsi tersendiri seperti:
1. Tabung reaksi (Reaction Tube / Test Tube)
Di laboratorium mikrobiologi, tabung reaksi berfungsi sebagai wadah
pengenceran, menumbuhkan mikroba dan untuk uji-uji biokimiawi. Tabung reaksi
dapat ditutup dengan kapas, metal, plastik atau aluminium foil. Tabung reaksi dapat
diisi dengan media padat, semi padat dan cair. Tabung reaksi yang diisi media padat
dapat diatur menurut fungsinya dalam dua bentuk, yaitu media agar tegak (deep tube
agar) dan agar miring (slants agar). Agar miring dibuat dengan memperhatikan
kemiringan media yaitu luas permukaan yang kontak dengan udara tidak terlalu
sempit atau tidak terlalu lebar serta jarak media tidak terlalu dekat dengan mulut
tabung karena memperbesar resiko kontaminasi. Media yang diisi pada tabung reaksi
berkisar +1/3 bagian dari tabung.
2. Cawan Petri (Petri Dish)
Cawan petri berfungsi untuk kegiatan isolasi, pemurnian dan membiakkan
(kultivasi) mikroorganisme. Cawan petri terdiri dari berbagai ukuran diameter.
Cawan dengan diameter 15 cm dapat menampung media sebanyak 15-20 ml,
sedangkan cawan berdiameter 9 cm dapat diisi media sebanyak 10 ml.
3. Ose / Jarum Inokulum (inoculating loop)
Jarum inokulum berfungsi untuk memindahkan biakan mikroorganisme
nichrome atau platinum sehingga dapat berpijar jika terkena panas. Jarum inokulasi
ada dalam dua bentuk. Bentuk ujung jarum yang berbentuk lingkaran (loop) dan
disebut ose atau inoculating loop/transfer loop, dan yang berbentuk lurus disebut
inoculating needle/Transfer needle. Inoculating loop cocok untuk melakukan streak
di permukaan agar, sedangkan inoculating needle cocok digunakan untuk inokulasi
secara tusukan pada agar tegak (stab inoculating).
4. Mikropipet (Micropippete) dan Tip
Mikropipet berfungsi untuk memindahkan cairan yang bervolume kecil,
biasanya kurang dari 1000 μl. Ada beberapa pilihan ukuran volume dalam mikropipet, misalnya mikropipet yang dapat diatur volume pengambilannya
(adjustable volume pipette) antara 1μl sampai 20 μl, atau mikropipet yang tidak bisa
diatur volumenya, hanya tersedia satu pilihan volume (fixed volume pipette)
misalnya mikropipet 5 μl. dalam penggunaannya, mikropipet memerlukan tip.
5. Labu Erlenmeyer (Erlenmeyer Flask)
Labu erlenmeyar berfungsi untuk menampung larutan, bahan atau cairan
Labu Erlenmeyer juga dapat digunakan untuk meracik dan menghomogenkan
bahan-bahan sebagai penyususn komposisi media, menampung akuades, kultivasi mikroba
dalam kultur cair, dll. Ada beberapa pilihan berdasarkan volume cairan yang dapat
ditampungnya yaitu 25 ml, 50 ml, 100 ml, 250 ml, 300 ml, 500 ml, 1000 ml, dsb.
6. Beaker Glass
Beaker glass merupakan alat yang memiliki banyak fungsi. Di dalam
mikrobiologi, dapat digunakan untuk preparasi media, menampung akuades dll.
7. Gelas ukur (Graduated Cylinder)
Gelas ukur berfungsi untuk mengukur volume suatu cairan, seperti labu
erlenmeyer, gelas ukur memiliki beberapa pilihan berdasarkan skala volumenya.
8. Batang L (L Rod) disebut juga spreader.
Batang L berfungsi dalam isolasi dan pembiakan mikroba yaitu untuk
menyebarkan cairan di permukaan media supaya mikroba yang tersuspensi dalam
9. Tabung Durham (Durham Tube)
Tabung durham berfungsi untuk menampung hasil fermentasi
mikroorganisme berupa gas. Tabung durham bentuknya seperti tabung reaksi namun
memiliki ukuran lebih kecil dibanding tabung reaksi. Tabung durham itu
ditempatkan terbalik di dalam tabung reaksi yang lebih besar dan tabung ini
kemudian diisi dengan medium cair. Setelah seluruhnya disterilkan dan medium
sudah dingin, maka dapat dilakukan inokulasi. Jika bakteri yang ditumbuhkan dalam
media tersebut memang menghasilkan gas, maka gas akan tampak sebagai
gelembung pada dasar tabung durham.
10.Termometer (thermometer)
Termometer berfungsi untuk mengukur suhu suatu larutan atau ruang
inkubator. Prinsip kerjanya yaitu mengukur suhu sesuai laju air raksa di dalam
thermometer. Termometer adalah batang kaca yang panjangnya 300 mm, diameter
6-7 mm berisi air raksa dan gas, serta dilengkapi dengan skala derajat Celcius.
Apparatus
1. Autoklaf (Autoclave)
Autoklaf merupakan alat pemanas yang digunakan untuk mensterilisasi suatu
alat atau bahan menggunakan uap bersuhu dan bertekanan tinggi (1210C, 15 lbs)
selama kurang lebih 15 menit. Suhu yang tinggi akan membunuh microorganisme.
Autoklaf ditujukan untuk membunuh endospora, yaitu sel resisten yang diproduksi
oleh bakteri, tahan terhadap pemanasan, kekeringan, dan antibiotik. Endospora dapat
dibunuh pada suhu 100 °C, yang merupakan titik didih air pada tekanan atmosfer
normal. Pada suhu 121 °C, endospora dapat dibunuh dalam waktu 4-5 menit, dimana
sel vegetatif bakteri dapat dibunuh hanya dalam waktu 6-30 detik pada suhu 65 °C.
Perhitungan waktu sterilisasi autoklaf dimulai ketika suhu di dalam autoklaf
mencapai 121 °C. Jika objek yang disterilisasi cukup tebal atau banyak, transfer
panas pada bagian dalam autoklaf akan melambat, sehingga terjadi perpanjangan
waktu pemanasan total untuk memastikan bahwa semua objek bersuhu 121 °C untuk
waktu 10-15 menit. Perpanjangan waktu juga dibutuhkan ketika cairan dalam
volume besar akan diautoklaf karena volume yang besar membutuhkan waktu yang
2. Oven
Oven berfungsi untuk sterilisasi kering. Alat-alat yang disterilkan
menggunakan oven antara lain peralatan gelas seperti cawan petri, tabung reaksi, dll.
Sterilisasi kering dengan oven dilakukan dengan cara memanaskan pada suhu 180oC
selama 1 jam.
3. Hot plate stirrer dan Stirre bar
Hot plate stirrer dan Stirrer bar (magnetic stirrer) berfungsi untuk
menghomogenkan suatu larutan dengan pengadukan. Pelat (plate) yang terdapat
dalam alat ini dapat dipanaskan sehingga mampu mempercepat proses homogenisasi.
Pengadukan dengan bantuan batang magnet Hot plate dan magnetic stirrer seri
SBS-100 dari SBS® misalnya mampu menghomogenkan sampai 10 L, dengan kecepatan
sangat lambat sampai 1600 rpm dan dapat dipanaskan sampai 425oC.
4. Pembakar Bunsen (Bunsen Burner)
Bunsen adalah salah satu alat yang berfungsi untuk mensteril. Api yang
menyala dapat membuat aliran udara karena oksigen dikonsumsi dari bawah dan
diharapkan kontaminan ikut terbakar dalam pola aliran udara tersebut. Dalam
sterilisasi jarum ose atau yang lain, bagian api yang paling cocok untuk
memijarkannya adalah bagian api yang berwarna biru (paling panas).
5. Inkubator (Incubator)
Inkubator adalah alat untuk menginkubasi atau memeram mikroba pada
suhu yang terkontrol. Alat ini dilengkapi dengan pengatur suhu dan pengatur waktu.
6. Penangas air (Water bath)
Penangas air berfungsi untuk menyimpan media agar (yang digunakan untuk
analisa dengan teknik tuang/pure plate ) supaya media tetap dalam kondisi leleh/cair,
bisanya suhu diatur pada kisaran 40-45oC. Untuk menjaga air pada penangas air
tidak terkontaminasi mikro organisme maka perlu ditambahkan citric acid 0.3% dan
potassium sorbat 0.1%.
7. pH Meter
pH meter berfungsi untuk mencek derajat keasaman/pH media, karena
8. Timbangan digital / neraca digital
Neraca digital berfungsi untuk menimbang media dan juga sample atau
contoh uji saat preparasi.
9. Biological Safety Cabinet / Laminar Air Flow
Biological Safety Cabinet (BSC) atau disebut juga Laminar Air Flow (LAF)
adalah alat yang berguna untuk bekerja secara aseptis karena BSC mempunyai pola
pengaturan dan penyaring aliran udara sehingga menjadi steril dan aplikasisinar UV
beberapa jam sebelum digunakan.
10. Colony counter
Colony counter adalah alat yang berfungsi untuk mempermudah
perhitungan koloni yang tumbuh setelah diinkubasi di dalam cawan karena adanya
kaca pembesar. Selain itu alat tersebut dilengkapi dengan skala/ kuadran yang sangat
berguna untuk pengamatan pertumbuhan koloni sangat banyak. Jumlah koloni pada
cawan Petri dapat ditandai dan dihitung otomatis yang dapat di-reset.
11. Mikroskop Cahaya (Brightfield Microscope)
Mikroskop Cahaya merupakan salah satu alat untuk melihat sel
mikroorganisme. Kita dapat mengamati sel bakteri yang tidak dapat dilihat dengan
mata telanjang. Pada umumnya mata tidak mampu membedakan benda dengan
diameter lebih kecil dari 0,1 mm.
12. Mikroskop stereo (Zoom Stereo Microscope)
Mikroskop ini berfungsi untuk melihat objek yang membutuhkan perbesaran
tidak terlalu besar. Di Laboratorium Mikrobiologi, mikroskop stereo biasanya
digunakan untuk mengamati secara detail bentuk koloni dan jamur.
Alat-alat lain yang perlu diketahui di laboratorium mikrobiologi: pelobang sumuran, haemositometer, kaca obyek, kaca obyek cekung, shaker incubator, shaker resiprok, vortex, glass pin, kaca penutup, pinset, gelas arloji, disk blank, disk antibiotik, filter bakteri, tabung Durham serta
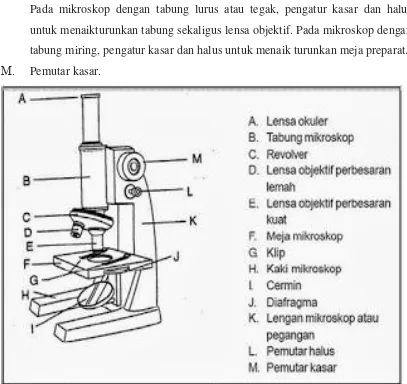
Bagian-Bagian Mikroskop
A. Lensa Okuler mikroskop yaitu: lensa mikroskop yang terdapat di bagian ujung
memperbesar bayangan yang dihasilkan oleh lensa obyektif. Perbesaran
bayangan yang terbentuk berkisar antara 4 sampai 25 kali.
B. Tabung mikroskop yaitu: di bagian atas tabung melekat lensa okuler, dengan perbesaran tertentu (15 kali, 10 kali, dan 15 kali). Dibagian bawah tabung
terdapat alat yang disebut revolver. Fungsi adalah untuk mengatur fokus yang
dapat dinaikkan dan diturunkan dan sebagai penghubung antara lensa obyektif
dan lensa okuler.
C. Revolver yaitu: pada revolver tersebut terdapat lensa objektif. Fungsi revolver adalah mengatur perbesaran lensa objektif dengan cara memutarnya
D. Lensa obyektif perbesaran lemah yaitu: lensa obyektif mikroskop: bekerja dalam pembentukan bayangan pertama. Lensa ini menentukan struktur dan
bagian renik yang akan terlihat pada bayangan akhir. Ciri penting lensa
obyektif adalah memperbesar bayangan obyek dengan perbesaran beraneka
macam sesuai dengan model dan pabrik pembuatnya, misalnya 10 kali, 40 kali,
dan 100 kali dan mempunyai nilai apertura (NA). Nilai apertura adalah ukuran
daya pisah suatu lensa obyektif yang akan menentukan daya pisah spesimen,
sehingga mampu menunjukkan struktur renik yang berdekatan sebagai dua
benda yang terpisah.
E. Lensa obyektif perbesaran kuat
F. Meja mikroskop yaitu: merupakan tempat meletakkan objek (preparat) yang akan dilihat. Objek diletakkan di meja dengan dijepit dengan oleh penjepit.
Dibagian tengah meja terdapat lengan untuk dilewat sinar. Pada jenis
mikroskop tertentu, kedudukan meja tidak dapat dinaik atau diturunkan. Pada
beberapa mikroskop, terutama model terbaru, meja preparat dapat
dinaik-turunkan.
G. Klip
H. Kaki mikroskop.
I. Cermin mikroskop yaitu: mempunyai dua sisi, sisi cermin datar dan sisi cermin cekung, berfungsi untuk memantulkan sinar dan sumber sinar. Cermin datar
digunakan bila sumber sinar cukup terang, dan cermin cekung digunakan bila
sumber sinar kurang. Cermin dapat lepas dan diganti dengan sumber sinar dari
sudah ada sumber cahaya yang terpasang pada bagian bawah (kaki).
J. Diafragma mikroskop yaitu: berfungsi mengatur banyaknya sinar yang masuk
dengan mengatur bukaan iris. Letak diafragma melekat pada diafragma di
bagian bawah. Pada mikroskop sederhana hanya ada diafragma tanpa
kondensor.
K. Lengan mikroskop yaitu: dengan adanya engsel antara kaki dan lengan, maka
lengan dapat ditegakkan atau direbahkan. Lengan dipergunakan juga untuk
memegang mikroskop pada saat memindah mikroskop.
L. Pemutar halus yaitu: komponen ini letaknya pada bagian lengan dan berfungsi
untuk mengatur kedudukan lensa objektif terhadap objek yang akan dilihat.
Pada mikroskop dengan tabung lurus atau tegak, pengatur kasar dan halus
untuk menaikturunkan tabung sekaligus lensa objektif. Pada mikroskop dengan
tabung miring, pengatur kasar dan halus untuk menaik turunkan meja preparat.
M. Pemutar kasar.
Lembaran Pengamatan
LATIHAN 1
PENGENALAN PERALATAN LABORATORIUM MIKROBIOLOGI
Nama/NIM :
Fakultas/Program Studi : Hari/Tanggal : Group/Kelompok :
LATIHAN 2
STERILISASI
Tujuan:
1. Untuk mengetahui beberapa metode sterilisasi alat dan bahan yang digunakan dalam pengamatan mikrobiologis.
2. Untuk mengetahui hal-hal penting sebelum dan sesudah melakukan sterilisasi peralatan dalam pengamatan mikrobiologis menurut metode sterilisasi yang digunakan seperti sterilisasi fisik dan kimiawi.
Pendahuluan
Suatu proses pembebasan suatu bahan atau alat dari semua bentuk organism
hidup disebut sterilisasi. Sterilasi dapat dilakukan secara fisik mekanik dan kimiawi.
Sterilisasi secara fisik adalah sterilisasi yang dilakukan dengan pemanasan dan
penyinaran. Pemanasan (pembakaran) secara langsung seperti pemanasan jarum ose
atau pinset, pemanasan kering dengan menggunkan oven, biasanya untuk sterilisasi
alat-alat seperti tabung reaksi, cawan petri dll. Sedangkan sterilisasi bahan-bahan
yang banyak mengandung air dapat menggunaan autoklaf.
Sterilisasi menggunakan saringan berpori sangat kecil antara 0.22 mikron
sampai 0.45 mikron sehingga mikroba tertahan pada saringan biasa disebut sebagai
sterilisasi mekanik. Cara ini biasanya dilakukan untuk sterilisasi bahan yang tidak
tahan atau peka terhadap panas seperti antibiotik ataupun senyawa enzim.
Pembagian Sterilisasi
1. Sterisasi Fisik a. Pemanasan basah
- Autoklaf: pemanasan dengan uap air dengan suhu 1210C dengan tekanan 15 psi / 2 atm selama 15 menit (pada umumnya)
- Merebus (boiling) - Pasteurisasi
- LTLT (low temperature short time): pemanasan pada suhu 650C selama 30 menit
b. Pemanasan kering
- Pembakaran (incenerasi)
- Oven: pemanasan dengan udara panas pada suhu 1800C selama 2 jam atau pada suhu 2100C selama 30 menit
c. Radiasi (dengan sinar ultra violet) 2. Secara Kimia
a. Penggunaan desinfektan dan anti septik b. Penggunaan pengawet
c. Penggunaan antibiotic
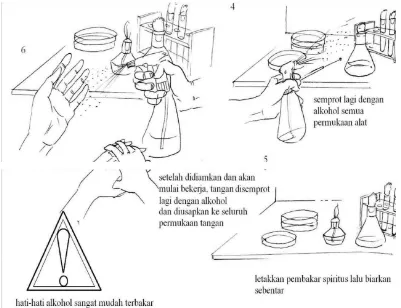
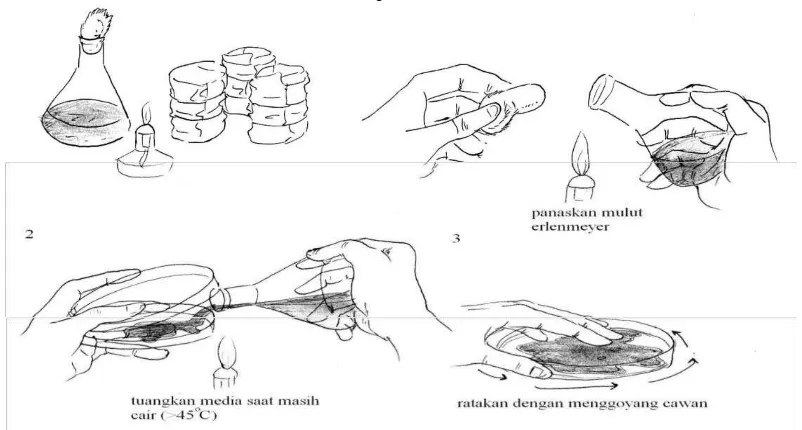
Gambar 2. Sterilkan meja kerja sebelum melakukan kegiatan
3. Secara Mekanik
Filtrasi (penyaringan cairan atau penyaringan udara)
Berdasarkan uraian di atas, maka perlu diadakan praktikum sterilisasi alat dan bahan biakkan guna memberikan pemahaman tentang hal-hal yang berkaitan dengan sterilisasi serta menambah pengetahuan dan keterampilan tentang teknik atau tata cara sterilisasi dalam mkrobiologi.
Bahan dan Alat
Bahan : Aquadesh, kapas, plastik, alkohol 70%, spritus, aluminium foil, kertas label, lakban bening, kain kasa steril, kapas, kertas minyak/layang-layang, selotip, serbet/lap tangan, tali (benang bola), tisu gulung, wipol (desinfektan).
Prosedur Kerja
a. Sterilisasi Kering (menggunakan oven)
1. Menyiapkan cawan petri dan tabung reaksi yang akan disterilkan
2. Mencuci hingga bersih lalu mengeringkan peralatan dengan kain lap halus. 3. Membungkus dengan kertas minyak/layang-layang
4. Diatur suhu 180 0C selama 2 jam atau pada suhu 210 0C selama 30 menit 5. Tekan tombol power
6. Setelah 2 jam atau 30 menit (tergantung suhu yang digunakan), turunkan suhu dan matikan tombol power.
7. Setelah suhu turun, peralatan yang telah disterilkan tersebut diambil dan dikeluarkan dari dalam oven lalu diletakkan di tempat yang bersih.
b. Sterilisasi Basah (menggunakan autoklaf)
1. Menyiapkan cawan petri, tabung reaksi, media agar yang akan disterilkan 2. Mencuci peralatan hingga bersih lalu mengeringkan peralatan dengan kain
lap halus.
3. Membungkus dengan kertas minyak/layang-layang
4. Masukkan semua alat yang sudah disiapkan ke dalam keranjang dan masukkan ke dalam autoclave
5. Tutup dengan rapat dan kunci pintu autoklaf 6. Tekan tombol On
7. Atur suhu 1210C pada tekanan 15 psi (2 atm) selama 15 menit
8. Tekan tombol Enter, sterilisasi akan berakhir pada saat alaram berbunyi. 9. Tekan tombol off, biarkan beberapa menit sampai suhu dalam autoklaf turun. 10.Buka pintu autoklaf dan keluarkan alat dan bahan yang telah disterilkan tadi. c. Sterilisasi Kimiawi
1. Menyiapkan cawan petri dan gelas obyek (terbuat dari bahan gelas). Mencuci hingga bersih lalu mengeringkan peralatan dengan kain lap halus.
2. Menyiapkan larutan alkohol (70%). 3. Menyiapkan kapas steril.
Kerja Aseptis:
1. Sebelum mulai kerja tangan disemprot dengan alcohol 70%
2. Meja dan lingkungan kerja disemprot dengan alcohol
3. Peralatan dan bahan yang sudah disterilkan seperti tabung/cawan/Erlenmeyer
sebaikknya bagian mulut (bagian yang memungkinkan kontaminasi masuk)
dibakar/dilewatkan api terlebih dahulu.
4. Pinset, batang L, spider, dan lain-lain dapat disemprot alcohol terlebih dahulu
lalu dibakar.
5. Jarum inoculum yang sudah dipijarkan harus ditunggu dingin dahulu atau
dapat ditempelkan tutup cawan bagian dalam untuk mempercepat transfer
panas yang terjadi.
6. Usahakan bagian alat yang dipakai dalam kondisi steril didekatkan ke bagian
api.
7. Jika kerja di safety cabinet tidak perlu memakai pembakar Bunsen tapi jika
diluar safety cabinet maka semakin banyak sumber api maka semakin
terjamin kondisi aseptisnya
Pertanyaan:
1. Apa yang dimaksud dengan sterilisasi, steril dan sterilitas? 2. Mengapa peralatan yang akan digunakan harus disterilkan?
LATIHAN 3
MEDIA PERTUMBUHAN MIKROORGANISME
Tujuan:
1. Mengetahui jenis dan fungsi media.
2. Mengetahui cara membuat media pertumbuhan mikroorganisme.
Pendahuluan
Media pertumbuhan mikroorganisme (mikroba) adalah media yang terdiri
dari bahan mengandung berbagai zat-zat makanan (nutrisi) yang diperlukan mikrobia
untuk pertumbuhan dan perkembangannya. Media pertumbuhan mikroba dibutuhkan
mulai dari proses isolasi sampai pada tahap pengamatan pertumbuhan, morfologi,
fisiologi serta identifikasi suatu mikrobia. Media pertumbuhan bagi mikrobia ini
dapat bentuk media cair ataupun media padat.
Bahan penyusun media pertumbuhan mikroba umumnya terdiri dari bahan
dasar seperti air sebagai pelarut dan agar atau gelatin ataupun silica gel yang
berfungsi memadatkan media. Disamping itu, media pertumbuhan mikroba harus
mengandung unsur-unsur (senyawa) yang dibutuhkan oleh mikrobia untuk tumbuh
dan berkembang. Unsur-unsur tersebut terdiri dari unsur makro (C,H,O, N dan P)
dan unsur mikro (Fe, Mg serta vitamin) dan bahan tambahan lainnya seperti phenol
red yang berfungsi sebagai indikator kemasaman media dan antibiotik.
Macam-Macam Media Pertumbuhan 1. Media Berdasar Sifat Fisik
a. Media padat (solid) adalah media yang mengandung agar 1-2% sehingga setelah dingin media menjadi padat.
b. Media setengah padat (semi solid) adalah media yang mengandung agar 0.3 - 0.4% sehingga menjadi sedikit kenyal, tidak padat dan tidak begitu cair.
c. Media cair (liquid) adalah media yang tidak mengandung agar, contohnya adalah NB (nutrient broth), LB (lactose broth).
2. Media Berdasarkan Komposisi
b. Media semi sintesis adalah media yang sebagian komposisinya diketahui secara pasti, misalnya PDA (potato dextrose agar) yang mengandung agar, dekstrosa dan ekstrak kentang.
c. Media non sintesis adalah media yang dibuat dengan komposisi yang tidak dapat diketahui secara pasti dan biasanya langsung diekstrak dari bahan dasarnya, misalya tomato juice agar, brain heart infution agar, pancreatic. 3. Media Berdasarkan Tujuan
a. Media untuk isolasi: Media ini mengandung semua senyawa essensial untuk
pertumbuhan mikroba, misalnya nutrient broth, blood agar.
b. Media selektif/penghambat: Media yang selain mengandung nutrisi juga
ditambahn suatu zat tertentu sehingga media tersebut dapat menekan
pertumbuhan mikroba lain dan merangsang pertumbuhan mikroba yang
diinginkan, seperti Luria bertani medium yang ditambah amphisilin untuk
merangsang e.coli, resisten antibiotic dan menghambat kontaminan yang peka.
c. Media diperkaya (enrichment): Media yang mengandung komponen dasar
untuk pertumbuhan mikroba dan ditambah komponen kompleks seperti darah,
serum, kuning telur. Media diperkaya juga bersifat selektif untuk mikroba
tertentu. Bakteri yang tumbuh pada media ini tidak hanya membutuhkan nutrisi
sederhana untuk berkembangbiak, tetapi membutuhkan komponen kompleks:
blood tellurite agar, bile agar, serum agar.
d. Media untuk peremajaan kultur: Media umum atau spesifik yang digunakan
untuk peremajaan kultur.
e. Media untuk menentukan kebutuhan nutrisi spesifik: Media ini digunakan
untuk mendiagnosis atau menganalisis metabolism suatu mikroba.
f. Media untuk karakterisasi bakteri: Media yang digunakan untuk mengetahui
kemampuan spesifik suatu mikroba. Kadang-kadang indicator ditambahkan
untuk menunjukkan adanya perubahan kimia.
g. Media differsial: bertujuan untuk mengidentifikasi mikroba dari campurannya berdasakan karakter spesifik yang ditunjukkan pada media diffential.
Syarat media biakan:
1 Mengandung nutrisi yang dibutuhkan oleh mikroorganisme yang berkembang.
3 Mengandung oksigen (kultur bakteri aerob) dan pH sesuai.
4 Harus bebas dari mikroba lain dan steril.
Bahan dan Alat
Bahan : Aquadesh, Media Nutrien Agar (NA), Media Nutrien Broth (NB), Media PDA, malt ekstrak agar (MEA), kapas, kertas layang, plastik, alkohol 70%, spritus, kapas steril, aluminium foil, tissu, kertas label.
Alat: Lampu bunsen, cawan petri, tabung reaksi, erlenmeyer, timbangan, hot plate, stirer, batang pengaduk, spatula, autoklaf, beaker glas, jarum ose, mikro pipet, pinset, gelas ukur, rak tabung reaksi, botol aquades, botol semprot/spyer, timbangan digital, autoclave, oven, incubator, lemari pendingin/freezer, stirer, vortex.
Prosedur Kerja
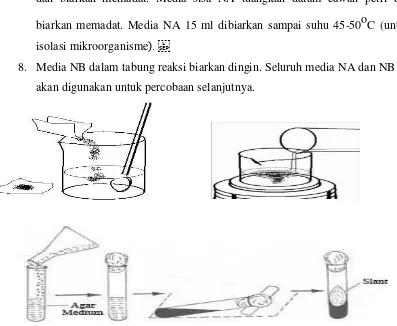
A. Pembuatan Media Umum (cara I):
1. Timbang media NA (Oxoid) dan NB (Oxoid), PDA, MEA sesuai prosedur di kemasan. Media ditimbang secara hati-hati lalu masukkan kedalam Erlenmeyer
2. Media yang ada di erlemnmeyer ditambah aquades dan aduk sampai homogen dengan batang pengaduk
3. Setelah homogen media dipanaskan dengan hati-hati menggunakan penangas/elemen pemanas sambil diaduk sampai media tercampur homogen (ditunjukkan dengan warna yang kuning jernih). Perhatian: pada saat pemanasan jangan sampai terbentuk buih berlebihan sampai meluap! 4. Media NA dituangkan ke dalam tabung reaksi dengan volume tertentu menggunakan pipet volume: 5 ml untuk NA miring, 10 ml untuk NA tegak, lalu diautocklaf. Tutup tabung reaksi dengan penutup tabung (penutupan jangan terlalu rapat!)
5. Media NB dituangkan ke dalam tabung reaksi masing- masing tabung reaksi 8 ml. Tutup tabung reaksi dengan kapas atau penutup tabung (penutupan
jangan terlalu rapat!)
mengoperasikan autoklaf dengan benar!)
7. Setelah diotoklaf: media NA 10 ml dalam tabung reaksi diletakkan tegak pada rak tabung dan biarkan memadat, media NA 5 ml inkubasikan miring dan biarkan memadat. Media sisa NA tuangkan dalam cawan petri dan biarkan memadat. Media NA 15 ml dibiarkan sampai suhu 45-50oC (untuk isolasi mikroorganisme).
8. Media NB dalam tabung reaksi biarkan dingin. Seluruh media NA dan NB ini akan digunakan untuk percobaan selanjutnya.
Gambar 3. Pembuatan media agar
B. Pembuatan Media Umum (cara II):
Bahan yang diperlukan antara lain: kentang sebanyak 100 gram, dektrosa 5
gram, aga 15 gram dan aquadest sebanyak 500 ml
Cara Kerja
1. Kentang dikupas dan iris, lalu cuci bersih dan selanjutnya direbus dengan
aquadest selama 1-2 jam
2. Ekstrak kentang disaring menggunakan penyaring sampai 500 ml
3. Ekstrak kentang ditambah agar dan dektrosa, aduk hingga homogeny serta didihkan diatas kompor atau hot plate stirrer.
dengan pH meter.
5. Masukkan larutan ke dalam erlenmeyer atau dapat langsung dibuat agar pinggan atau agar miring
6. Sterilkan media dengan autoklaf
Nutrien Broth (NB)
Komposisi untuk media NB sama dengan NA tetapi tidak memakai agar
sebagai pemadat. Proses pembuatannyapun lebih sederhana, tidak memerlukan
panas, peptone dan beef extract akan mudah larut sempurna pada air suhu kamar jika
diaduk.
C. Pembuatan Media Selektif:
Media selektif yang dimodifikasi (Yunilas et al., 2013) untuk isolasi bakteri
selulolitik menggunakan: (0,5 g pepton, 0,5 g yeast agar, 0,1 g K2HPO4, 0,02 g
MgSO4. 7H2O, 1 g Na2CO3, 20 g agar, 0,25 g CMC, 0,25 g xylan, 0,25 g lignin,
0,25 g mannan.
Media selektif Czapek Dox Agar (CDA) yang dimodifikasi (Yunilas, 2016)
untuk isolasi fungi selulolitik yaitu: 0,2% NaNO3; 0,05% KCL; 0,05% MgSO4.7H2O; 0.001% FeSO4.7H2O; 0,05% KH2PO4; 0,04% yeast ekstrak; 2% agar dan 1% (masing-masing CMC, xylan, lignin dan manan), streptomisin 0,01 %, pH diatur 4,5.
Prosedur Kerja
1. Timbang semua bahan sesuai formulasinya, lalu masukkan kedalam Erlenmeyer
2. Media yang ada di erlemnmeyer ditambah aquades dan aduk sampai homogen dengan batang pengaduk
3. Setelah homogen media dipanaskan dengan hati-hati menggunakan penangas/elemen pemanas sambil diaduk sampai media tercampur homogen
5. Sterilkan seluruh media dalam tabung reaksi tersebut dengan menggunakan autoklaf selama 15 menit, tekanan 1 atm 121oC. (Pelajari cara mengoperasikan autoklaf dengan benar!)
6. Setelah diotoklaf: media dalam tabung reaksi diletakkan tegak pada rak tabung dan biarkan memadat atau miring dan biarkan memadat.
Pertanyaan:
1. Jelaskan pengertian dan fungsi media pertumbuhan!
2. Mengapa media pertumbuhan yang akan digunakan harus disterilkan?
3. Jelaskan cara membuat media umum untuk pertumbuhan bakteri!
4. Pada pembuatan media selektif ada bahan tertentu dimasukkan, apa tujuan dari
penambahan bahan tersebut?
Lembaran Pengamatan
LATIHAN 3
MEDIA PERTUMBUHAN MIKROORGANISME
Nama/NIM :
Fakultas/Program Studi : Hari/Tanggal : Group/Kelompok :
No. Nama Bahan Formula Metode Sterilisasi
LATIHAN 4
TEKNIK ISOLASI MIKROORGANISME
Tujuan:
1. Mengetahui teknik mengisolasi mikroorganisme dengan benar
2. Mengkarakteristik mikroorganisme yang diisolasi dari lingkungan
Pendahuluan
Mikroorganisme (mikroba) dapat diperoleh dari lingkungan sekitar kita baik
dari air, tanah, udara, substrat berupa bahan pakan ternak serta produk olahannya,
bahan pangan beserta produk olahannya, tanaman maupun hewan. Mikroorganisme
yang diperoleh beragam, dapat berupa bakteri, fungi/kapang, khamir dan sebagainya.
Untuk mendapatkan mikroba murni perlu dilakukan isolasi.
Penyediaan sampel sebagai sumber isolate mikroba dapat diperoleh dengan
berbagai cara. Ada sampel diperoleh langsung dari tanah, kotoran ternak, cairan
rumen ternak, dari bagian tanaman. Ada pengambilan sampel dari produk bahan
pangan seperti air susu, daging, ikan, terasi dll. Ada pengambilan sampel dengan
melakukan proses fermentasi untuk memperoleh mikroorganisme indigenous (MOI)
atau indigenous microorganism (IMO) yang bertujuan memacu proses penguraian
oleh mikroba. Mikroba yang tumbuh dan berkembang dari media MOI inilah yang
akan dijadikan sebagai sumber isolate sesuai tujuan isolasi.
Isolasi mikroorganisme adalah suatu upaya pemindahan mikroba diluar dari
lingkungan alamiahnya untuk mendapatkan biakan murni. Pemisahan
mikroorganisme dari lingkungan bertujuan untuk memperoleh biakan murni yang
sudah tidak bercampur lagi dengan mikroba lainnya. Prinsip dari isolasi mikroba
adalah memisahkan satu jenis mikroba dengan mikroba lainnya yang terdapat pada
suatu substrat atau lingkungan sekitarnya. Sehingga dalam mempelajari ilmu
mikroorganisme kita harus mengerti dan memahami bagaimana mendapatkan
mikroba murni dengan cara mengisolasi dan memisahkan mikrobia tersebut sesuai
dengan tujuannya. Melalui isolasi kita dapat mempelajari morfologi, biologi ataupun
Beberapa faktor yang perlu diperhatikan dalam melakukan isolasi mikroba
yaitu antara lain:
1. Sifat setiap jenis mikroba yang akan diisolasi.
2. Tempat hidup atau asal mikroba tersebut.
3. Medium pertumbuhan yang sesuai.
4. Cara menginokulasi mikroba.
5. Cara menginkubasi mikroba.
6. Cara menguji bahwa mikroba yang diisolasi telah berupa kultur murni dan
sesuai dengan yang dimaksud.
7. Cara memelihara agar mikroba yang telah diisolasi tetap merupakan kultur
murni.
Teknik Isolasi Mikroba
Teknik pengenceran (dilution method)
Suatu sampel dari suatu suspensi yang berupa campuran beragam spesies
diencerkan dalam suatu tabung yang tersendiri. Pengenceran suspense mikroba pada
umumnya dilakukan dengan teknik pengenceran berseri (series of dilution). Dari
hasil pengenceran ini kemudian diambil kira-kira 1 mL untuk diencerkan lebih
lanjut. Jika dari pengenceran yang ketiga ini diambil 0,1 mL untuk disebarkan pada
suatu medium padat, kemungkinan besar kita akan mendapatkan beberapa koloni
yang akan tumbuh dalam medium tersebut, akan tetapi mungkin juga kita hanya akan
memperoleh satu koloni saja.
Teknik micromanipulator
Satu ose bakteri dengan mikropipet yang ditempatkan dalam
micromanipulator, kemudian ditempatkan dalam medium encer untuk dibiakkan.
Proses pemisahan/pemurnian dari mikroorganisme lain perlu dilakukan karena
semua pekerjaan mikrobiologis, misalnya telaah dan identifikasi mikroorganisme,
memerlukan suatu populasi yang hanya terdiri dari satu macam mikroorganisme saja.
Berbagai macam cara dalam mengisolasi mikroba, yaitu:
1. Isolasi pada medium padat
mikroorganisme sehingga diperoleh individu spesies yang dapat dipisahkan dari
organisme lainnya. Setiap koloni yang terpisah yang tampak pada cawan tersebut
setelah inkubasi berasal dari satu sel tunggal.
2. Isolasi pada medium cair
Metode isolasi pada medium cair dilakukan bila mikroorganisme tidak dapat
tumbuh pada agar cawan (medium padat), tetapi hanya dapat tumbuh pada kultur
cair. Metode ini juga perlu dilakukan pengenceran dengan beberapa serial
pengenceran. Semakin tinggi pegenceran peluang untuk mendapatkan satu sel
semakin besar. Pada media cair pertumbuhan mikroba ditandai dengan kekeruhan
mikroba.
3. Isolasi sel tunggal
Metode isolasi sel tunggal dilakukan untuk mengisolasi sel mikroorganisme
berukuran besar yang tidak dapat diisolasi dengan metode agar cawan/medium cair.
Sel mikroorganisme dilihat dengan menggunakan perbesaran sekitar 100 kali.
Kemudian sel tersebut dipisahkan dengan menggunakan pipet kapiler yang sangat
halus ataupun micromanipulator, yang dilakukan secara aseptis.
Bahan dan Alat:
Bahan : Sampel (sumber isolat), Aquadesh, Media Nutrien Agar (NA), Media Nutrien Broth (NB), PDA (ditambah klorampenikol 10 mg/100mL aquadest), kapas, kertas layang, plastik, alkohol 70%, spritus, kapas, aluminium foil, tissu, kertas label, Sumber isolat (ditentukan saat praktikum).
Alat: Lampu Bunsen, Cawan petri, Tabung reaksi, Erlenmeyer, Pipet volumetrik, timbangan, hot plate, stirer, batang pengaduk, spatula, autoklaf, ikubator. Prosedur Kerja:
1. Sampel sebanyak 1 gram dimasukkan kedalam tabung reaksi yang telah berisi aquadest steril mengandung 0,9% NaCl fisiologis, lalu kocok menggunakan vortex supaya homogen.
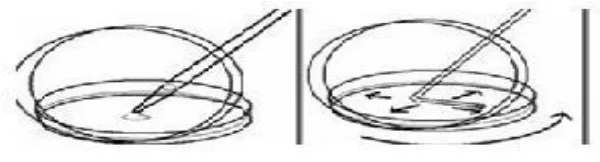
Gambar 4. Teknik pengenceran
3. Hasil seri pengenceran diambil 0,1 mL atau 1 mL, lalu diinokulasi secara aseptic ke dalam cawan petri yang telah dituang media agar (NA, PDA atau media agar selektif) menggunakan metode cawan tuang (pour plate method) atau metode cawan sebar (spread plate method). Diratakan dengan membentuk angka delapan.
Dibiarkan hingga memadat.
Gambar 5. Pour Plate Method
Gambar 6. Spread Plate Method
4. Media yang sudah diinokulasi, diinkubasi selama 24 – 48 jam pada suhu 370C untuk pengamatan mikroba yang tumbuh.
6. Koloni bakteri yang sudah tumbuh pada medium agar umum (selektif) dipindahkan lagi ke medium yang baru untuk mendapatkan isolate murni.
Gambar 7. Morfologi koloni mikroba
7. Pemurnian dilakukan sampai diperoleh koloni tunggal menggunakan metode cawan gores (streak plate). Isolat murni yang telah diperoleh disimpan di dalam agar miring Nutrient Agar (NA).
Pertanyaan:
1. Jelaskan pengertian isolasi dan inokulasi!
2. Jelaskan metode-metode inokulasi!
3. Jelaskan karakteristik pertumbuhan miktoba pada media padat dan media
Lembaran Pengamatan
Hasil dan Pengamatan Pengenceran Suspensi
No. Konsentrasi pengenceran Bakteri (formula)
No. Konsentrasi pengenceran Fungi (formula)
No. Konsentrasi pengenceran Yeast/Khamir (formula)
Hasil dan Pengamatan Morfologi Bakteri, Fungi dan Yeast
No. Kode Isolate
Gambar Warna Isolat
LATIHAN 5
TEKNIK BIAKAN MURNI
Tujuan:
1. Untuk mendapatkan 1 jenis mikroorganisme yang diinginkan 2. Untuk mengetahui prinsip dasar teknik biakan
Pendahuluan
Biakan murni adalah biakan yang hanya terdiri dari satu jenis
mikroorganisme, sedangkan biakan campuran adalah biakan yang terdiri dari
berbagai jenis mikroorganisme. Teknik biakan murni pertama kali dilakukan oleh
Robert Koch pada tahun 1843 – 1910, seorang ahli kebangsaan Jerman. Bakteri yang
dimurnikan adalah bakteri Bacillus anthracis penyebab penyakit antrax pada sapi dan
domba di Eropa pada saat itu.
Biakan murni dari suatu biakan campuran dapat diperoleh dengan beberapa
cara atau metode. Biakan murni diperlukan dalam berbagai metode mikrobiologis,
antara lain digunakan dalam mengidentifikasi mikroba. Untuk mengamati ciri-ciri
kultural morfologi, fisiologi, dan serologi dibutuhkan mikroorganisme yang berasal
dari satu spesies.
Gambar 9. Memindahkan biakan secara aseptis
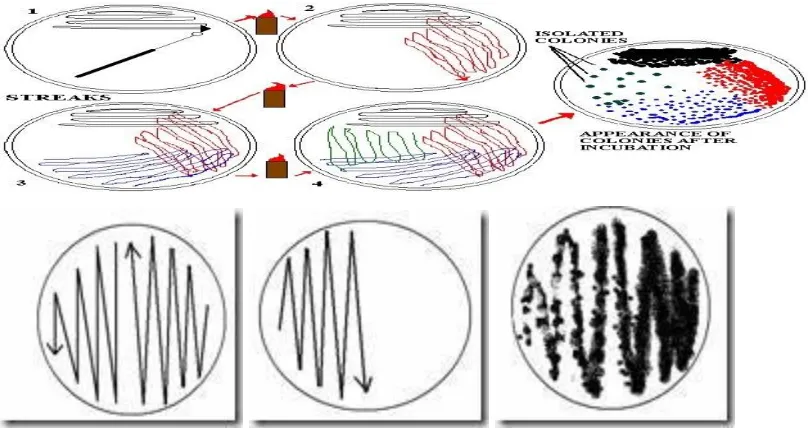
Metode Teknik Biakan Murni
1. Metode cawan gores (streak plate method)
Metode ini mempunyai dua keuntungan, yaitu menghemat bahan dan waktu. metode
cawan gores yang dilaksanakan dengan baik kebanyakan akan menyebabkan
terisolasinya mikroorganisme yang diinginkan. Ada beberapa tipe goresan yaitu:
Gambar 10. Streak PlateMethod secara Goresan Sinambung
Gambar 11. Streak Plate Method secara Goresan T
2. Metode cawan sebar (spread plate method)
Gambar 12. Metode agar sebar dan agar tuang 3. Metode cawan tuang (pour plate method)
Cara ini dasarnya ialah menginokulasi medium agar yang sedang mencair pada temperatur 45-50oC dengan suspensi bahan yang mengandung mikroba, dan menuangkannya ke dalam cawan petri steril. Setelah inkubasi akan terlihat koloni-koloni yang tersebar di permukaan agar yang mungkin berasal dari 1 sel bakteri, sehingga dapat diisolasi lebih lanjut (Jutono dkk, 1980).
Bahan dan Alat
Bahan:
Media NA, PDA, kultur bakteri, kultur jamur, wipol, alcohol. Alat:
Cawan petri, tabung reaksi, pipet serologi, propipet, jarum ose noddle, hockey stick, spatula, vortex, lampu Bunsen, Incubator, Pemanas air.
Prosedur Kerja:
1) Metode Cawan Gores
1. Media agar NA cair dituang ke dalam cawan petri secara aseptis, lalu biarkan memadat.
2. Satu ose bakteri berasal dari biakan campuran diambil kemudian diinokulasi ke dalam media NA tadi dengan cara menggores sesuai tipe goresan yang diinginkan (radian, kuadran, sinambung, tipe goresan T).
3. Media NA yang telah diinokulasi, dibungkus dengan kertas pembungkus, selanjutnya diinkubasi selama 24 jam pada suhu 37 0C.
b) Metode Cawan Tuang
1. Koloni bakteri dari biakan campuran diambil 1 ose secara aseptis lalu dimasukan ke tabung reaksi berisi aquadest steril, kemudian lakukan seri pengeceran 10-2.
2. Hasil pengenceran diambil sebanyak 0,1-1mL dan diinokulasi ke dalam media agar NA cair suhu berkisar 45-500C.
3. Media NA yang sudah diinokulasi tersebut di vortex supaya homogen. 4. Setelah homogen media NA dituang ke dalam cawan petri secara aseptis. 5. Media NA pada cawan petri diratakan dengan cara memutar membentuk
angka delapan, lalu dibiarkan memadat.
6. Media NA yang telah padat dibungkus dengan kertas pembungkus, selanjutnya diinkubasi selama 24 jam pada suhu 37 0C.
7. Amati pertumbuhan bakterinya!
c) Metode Cawan Sebar
1. Media agar NA cair dituang ke dalam cawan petri secara aseptis, lalu biarkan memadat.
2. Siapkan 3 tabung masing masing berisi 10 mL, 9 mL dan 9 mL aquadest. 3. Koloni bakteri dari biakan campuran diambil 1 ose secara aseptis lalu
dimasukan ke tabung reaksi berisi aquadest steril 10 ml, kemudian lakukan seri pengeceran dan dihomogen dengan vortex, hasilnya disebut suspensi. 4. Dari suspense diambil sebanyak 1 ml kemudian diinokulasi pada tabung
reaksi kedua berisi 9 mL aquadest, demikian juga pada tabung selanjutnya. 5. Hasil pengenceran dari tabung 2 dan 3 diambil masing-masing sebanyak 0,1
mL dan diinokulasi ke dalam media agar NA yang telah memadat tadi. 6. Hockey stick disterilkan dengan cara dicelup pada alcohol dan dibakar. 7. Tebarkan/sebarkan kultur bakteri dengan hockey stick secara merata dan
biarkan sampai permukaan agar mengering.
8. Setelah mengering, bungkus dengan kertas pembungkus, selanjutnya diinkubasi selama 24 jam pada suhu 37 0C.
d) Teknik Biakan Murni untuk jamur/fungi
1. Media agar PDA cair dituang ke dalam cawan petri secara aseptis, lalu biarkan memadat.
2. Ambil spora atau meselium dari biakan campuran, kemudian inokulasi secara aseptis ke dalam media PDA dengan cara menotolkannya pada permukaan media.
3. Bungkus dengan kertas pembungkus, selanjutnya diinkubasi selama 24-48 jam pada suhu ruang atau 29 0C.
4. Amati pertumbuhan koloni fungi/jamur!
Pertanyaan:
1. Jelaskan tujuan melakukan biakan murni!
2. Jelaskan beberapa metode yang dapat dilakukan dalam biakan murni!
Lembaran Pengamatan
LATIHAN 5
TEKNIK BIAKAN MURNI
Nama/NIM :
Fakultas/Program Studi : Hari/Tanggal : Group/Kelompok : No. Kode
Isolate
LATIHAN 6
UJI AKTIFITAS ENZIM SECARA KUALITATIF
Tujuan:
1. Mengetahui kemampuan mendegradasi serat melalui uji aktifitas enzim secara kualitatif
2. Dapat menghitung indeks zona bening mikroba terhadap substrat Pendahuluan
Adanya mikroba selulolitik ditunjukkan dengan terbentuknya zona bening di sekeliling isolat. Untuk melihat zona beningnya agar lebih jelas dilakukan uji kualitatif dengan penuangan 5 ml reagen congo red 1% dipermukaan medium selama 24 jam (Khokhar et al., 2012). Semakin luas zona bening dihasilkan menunjukkan semakin tinggi aktifitas selulase yang dihasilkan (Yunilas et al., 2013).
Bahan Dan Alat
Bahan:
Bahan yang digunakan untuk uji aktifitas enzim selulase meliputi: isolat bakteri, alkohol, aquadest, spritus, aluminium foil, sarung tangan, masker, kapas, media agar selektif yang dimodifikasi (Yunilas et al., 2013) menggunakan: (0.5 g
pepton, 0.5 g yeast agar, 0.1 g K2HPO4, 0.02 g MgSO4. 7H2O, 1 g Na2CO3, 20 g
agar, 0.5 g CMC), pH 6.8.
Alat:
Alat yang digunakan dalam penelitian ini meliputi: incubator, autoklaf. mikroskop, erlemeyer, petri disk, tabung reaksi, rak tabung, pipet, micro pipet, stirer, vortex, bunsen, kertas cakram (cakram disk), gelas ukur, becker glass, thermometer, pH meter, hot plate, timbangan digital, oven, jangka sorong, kamera digital.
Prosedur Kerja:
1. Buat suspense bakteri berdasarkan standar Mc Farland 2. Siapkan media agar selektif
5. Inkubasi 24-48 jam, 6. Tetes lugol dan amati
Gambar 13.Diagram alir uji aktifitas enzim lignoselulolitik secara kualitatif (Yunilas et al., 2013)
Diskusi:
1. Apa yang dimksud dengan zona bening (clear zone)? 2. Kenapa terbentuk zona bening?
3. Bagaimana kemampuan isolate bakteri uji yang dilakukan dalam mendegradasi serat ?
4. Jelaskan tentang indek zona bening bakteri uji terhadap substrat! Buat suspensi bakteri, standar Mc Farland
Siapkan media agar selektif
Letakan cakram disk dibagian tengah media
Inokulasi suspensi bakteri pada cakram dist
Inkubasi 24-48 jam suhu 370C
Tetes lugol dipermukaan agar
Lembaran Pengamatan
LATIHAN 6
UJI AKTIFITAS ENZIM LIGNOSELULOLITIK SECARA KUALITATIF
Nama/NIM :
Fakultas/Program Studi : Hari/Tanggal : Group/Kelompok :
No. Kode Isolate
Diameter Isolate (Mm)
Zona Bening (Mm)
LATIHAN 7
PENGAMATAN BAKTERI SECARA MIKROSKOPIS
Tujuan:
- Mengetahui morfologi bakteri secara mikroskopis
- Mengamati dan membedakan struktur yang terdapat dalam sel bakteri Pendahuluan
Melihat dan mengamati bakteri dalam keadaan hidup sangat sulit, karena selain bakteri itu tidak berwarna juga transparan dan sangat kecil. Untuk mengatasi hal tersebutmaka dikembangkan suatu teknik pewarnaan sel bakteri sehingga sel dapat terlihat lebih jelas dan mudah diamati. Oleh karena itu teknik pewarnaan sel bakteri ini merupakan salah satu cara yang paling utama.
Pelaksanaan teknik pewarnaan perlu ketelitian dan kecermatan serta mengikuti prosedur sbb:
1. Mempersiapkan kaca obyek. Kaca obyek ini harus bersih dan bebas lemak untuk membuat apusan bakteri yang akan diwarnai.
2. Mempersiapkan preparat ulas. Preparat yang baik adalah yang tipis dan kering, terlihat seperti lapisan yang tipis. Preparat ini dapat berasal dari cairan atau padat. Teknik pembuatan preparat ulas sbb:
- Kultur biakan diambil 1- 2 lup ose steril dan oles pada permukaan slide. - Tetes 1 – 2 tetes aquadest diatas biakan
Gambar 14. Teknik pembuatan pulasan bakteri dan fiksasi Alat dan Bahan
isolate bakteri, Aquadest, Alkohol, Medium MEA, Medium PDA, kapas, kaca objek, Bunsen, methilen blue, jarum ose, isolate, mikroskop, Masker, 1. Pewarna basa (pewarnaan sederhana)
Prosedur kerja:
1. Buat preparat ulas bakteri yang akan diperiksa, lalu fiksasi
2. Teteskan zat warna metilen blue pada preparat bakteri, dan biarkan selama1 menit 3. Bilas dengan air mengalir dan kering anginkan (jangan dilap atau dihapus)
Gambar 15. Teknik pewarnaan sederhana
2. Pewarna Gram/differensial
Prosedur kerja:
1. Buat preparat ulas lalu fiksasi
2. Hasil fiksasi ditetes larutan kristal violet selama 1 menit setelah itu bilas dengan air kemudian dikering anginkan beberapa saat.
3. Diberi larutan iodin/lugol (mordan) 1-2 tetes selama 30 detik, lalu dibilas dengan larutan pemucat (aseton alkohol) selama 15 detik, kemudian dibilas kembali dengan aquadest.
4. Diberi 1 tetes larutan safranin (zat warna tandingan), dibiarkan selama 1 menit kemudian dibilas dengan aquadest dan dikering anginkan.
5. Amati morfologi dibawah mikroskop cahaya pada perbesaran 1000x. Hasil pengamatan berupa (warna ungu kebiruan menunjukkan bakteri gram positif, sedang warna merah muda menunjukkan gram negatif).
Pertanyaan:
1. Apa yang dimaksud dengan morfologi bakteri secara mikroskopis? 2. Apa tujuan dilakukan pewarnaan sederhana?
3. Apa tujuan dilakukan pewarnaan gram?
Lembaran Pengamatan
LATIHAN 7
PENGAMATAN BAKTERI SECARA MIKROSKOPIS
Nama/NIM :
Fakultas/Program Studi : Hari/Tanggal : Group/Kelompok : No. Kode
Isolat
Metode Pengamatan Morfologi Sel
LATIHAN 8
PENGAMATAN FUNGI/KHAMIR SECARA MIKROSKOPIS
Tujuan:
-Untuk mengetahui morfologi fungi (kapang) atau yeast (khamir)
Pendahuluan
Jamur (fungi) banyak kita temukan disekitar kita. Jamur tumbuh subur terutama di musim hujan karena jamur menyukai habitat yang lembap. Beberapa ahli mikologi membagi jamur menjadi dua kelompok berdasarkan bentuk tubuhnya, yaitu kapang (mold) dan khamir (yeast).
Bahan dan Alat:
Bahan: fungi/yeast hasil isolasi, Aquadest, Alkohol, Medium MEA, Medium PDA,
kapas, KOH 20 %.
Alat: Cawan petri, Hot plate, Ose loop, Handsprayer, mikroskop, Masker, objek
glass, pinset, cover glass, Bunsen, pipet tetes. Prosedur Kerja:
1. Slide kultur (Metode Heinrich’s):
o Buat medium PDA
o Cawan petri yang dilapisi kertas saring yang telah dibasahi dengan sedikit
aquades steril, lalu letakkan 2 buah batang lidi steril dengan ukuran ± 6 cm.
o Letakkan kaca objek steril diatas batang lidi sebagai penyangganya.
o Ambil medium PDA cair dengan pipet tetes lalu teteskankan diatas kaca
objek (1 tetes).
o Ambil isolat fungi dengan jarum ose, lalu menggoreskan secara langsung ke
objek glass sebelum medium PDA memadat.
Gambar 17. Metode Slide kultur (Metode Heinrich’s)
2. Prosedur yang lebih sederhana:
1. Sterilkan cawan petri yang berisi kapas yang di atasnya terdapat object glass dan cover glass.
2. Siapkan media PDA dan dijaga supaya tetap cair.
3. Teteskan media PDA pada object glass secara aseptis lalu tunggu memadat (teteskan jangan terlalu banyak).
4. Belah media yang memadat dengan jarum inokulum yang berujung L.
5. Ulaskan spora jamur yang akan diamati pada belahan tersebut.
6. Tutup dengan cover glass tepat di atas media dan tekan hingga merata.
7. Inkubasi selama 2x24 jam.
8. Amati pertumbuhan miselium dan spora pada object glass dengan perbesaran sedang
Gambar 18. Metode sederhana Pertanyaan :
1. Jelaskan morfologi fungi secara mikroskopis
Lembaran Pengamatan
LATIHAN 8
PENGAMATAN FUNGI SECARA MIKROSKOPIS
Nama/NIM :
Fakultas/Program Studi : Hari/Tanggal : Group/Kelompok :
No. Kode Isolat
LATIHAN 9
PENGHITUNGAN JUMLAH MIKROBA MENGGUNAKAN METODE ANGKA LEMPENG TOTAL (ALT)
Tujuan:
Untuk mengetahui jumlah bakteri pada setiap mL sampel. Penghitungan Angka Lempeng Total bakteri dan fungi.
Pendahuluan
Mikroorganisme adalah makhluk hidup cosmopolitan, terdapat dimana-mana.
Dalam air dan tanah, dalam makanan, hewan dan tumbuhan serta manusia.
Keberadaan dan besarnya populasi mikroorganisme sangat penting untuk diketahui
dan dipelajari karena memiliki karakteristik dan peran yang sangat erat interaksinya
baik dengan lingkungan abiotik maupun lingkungan biotiknya. Besarnya populasi
mikroorganisme dapat menentukan kualitas suatu produk, menentukan tata guna
suatu sumber daya, menentukan tingkat kesuburan suatu lahan dan lain-lain.
Dalam menentukan jumlah bakteri dapat digunakan beberapa cara yaitu:
1. Jumlah bakteri secara keseluruhan (total cell count). Pada cara ini menghitung
jumlah sel yang hidup maupun yang mati.
2. Jumlah bakteri yang hidup (viable count). Pada cara ini menghitung jumlah sel
yang hidup saja.
1. Penghitungan Bakteri Secara Keseluruhan
a. Menghitung langsung secara mikroskopik
Penghitungan jumlah bakteri dalam satuan isi yang sangat kecil. Penghitungan
menggunakan peralatan kaca objek khusus yang bergaris (Petroff-Hauser) berbentuk
bujur sangkar. Jumlah cairan yang terdapat antara kaca objek dan kaca penutup
mempunyai volume tertentu, sehingga satuan isi yang terdapat dalam satu bujur
sangkar juga tertentu.
b. Menghitung dengan cara melihat kekeruhannya
Penghitungan cara ini menggunakan spektrofotometer atau nefelometer. Prinsip
dari Teknik ini adalah banyaknya cahaya yang diabsorbsi sebanding dengan
2. Penghitungan Jumlah Bakteri Hidup
Penghitungan jumlah mikroorganisme dengan cara viable count atau
standard plate count didasarkan pada asumsi bahwa setiap sel mikrootrganisme
hidup dalam suspense akan tumbuh menjadi 1 (satu) koloni setelah diinkubasi dalam
media biakan dan lingkungan yang sesuai. Berdasarkan hal tersebut sering digunakan
istilah colony forming units (CFU/ml) untuk menghitung jumlah mikroorganisme
hidup lempeng agar yang mengandung 30-300 koloni yang digunakan dalam
perhitungan. Lempeng agar dengan jumlah koloni > 300 kemungkinan kesalahan
perhitungan tinggi, lempeng agaer <30 lempeng tidak abash secara statistic hal ini
terjadi karena pengenceran terlalu tinggi.
Contoh perhitungan dilihat pada Table Pengamatan berikut:
Pengenceran Cawan I Cawan II Keterangan
10 -2 150 300 Dipilih koloni cawan I
10 -3 20 25 Dipilih koloni cawan II
Perhitungan:
Kisaran yang paling tepat menghitung koloni pada cawan adalah 25 – 250 koloni per
cawan dalam perhitungan percobaan ini.
Jumlah koloni rata-rata jumlah kedua cawan dikali dengan factor
pengencer
Maka jumlah koloni (angka lempeng total) adalah:
150 + 250 X 1 = 200 X 102 koloni/ml sampel
2 10-2
Bahan dan Alat:
Bahan:
Media PCA, PDA, PDF, sampel, aquades, wipol, alcohol. Alat:
Tabung reaksi, pipet volume 1 ml steril, cawan petri, spidol/label, lampu
bunsen, penangas air.
Prosedur Kerja :
1. Sediakan 6 tabung reaksi masing-masing berisi 9 ml akuades steril,
meletakkan secara berurutan dan beri tanda 1 s/d 6.
10-1,10-2,10-3,…10-6 sampel dengan pengenceran 10-6, dengan cara
memasukkan 1 ml sampel ke dalam tabung reaksi pertama kemudian kocok
sampai homogeny, konsentrasi larutan menjadi 10-1, kemudian mempipet 1
ml larutan dari tabung pertama masukkan ke tabung kedua dan kocok sampai
homogeny, konsentrasi larutan menjadi 10-2 demikian seterusnya sampai
tabung ke enam.
3. Sediakan dua cawan petri steril, meletakkan berurutan dan beri tanda 10-5,10-6
dengan spidol/label.
4. Mengambil larutan dari tabung ke 5 dan ke 6 masing-masing 1 ml dengan
menggunakan pipet steril dan memasukkan ke dalam cawan petri steril yang
sudah diberi tanda.
5. Menyiapkan medium PCA cair dengan suhu 400 – 450C sebanyak 2 tabung
masing-masing berisi 9 ml.
6. Memasukkan media agar ke dalam cawan petri yang berisi larutan sampel,
satu tabung untuk satu petri, menggoyangkan hingga homogeny dengan cara
memutar cawan petri searah jarum jam dan kebalikannya di atas meja,
biarkan hingga dingin dan mengeras.
7. Menginkubasikan pada suhu 220C – 370C selama 24 – 48 jam di dalam
incubator.
8. Menghitung jumlah bakteri yang tumbuh pada setiap pengenceran. Jumlah
bakteri yang ada dalam setiap 1 ml sampel adalah berbanding terbalik dengan
pengenceran, misalnya : hasil perhitungan dari pengenceran 10-6 terdapat 10
koloni maka jumlah bakteri adalah 10 x 106 sel bakteri/ml.
Pertanyaan:
1. Jelaskan pengertian ALT!
Lembaran Pengamatan
LATIHAN 9
PENGHITUNGAN JUMLAH MIKROBA MENGGUNAKAN METODE ANGKA LEMPENG TOTAL (ALT)
Nama/NIM :
Fakultas/Program Studi : Hari/Tanggal : Group/Kelompok :
LATIHAN 10
PENGHITUNGAN JUMLAH MIKROBA MENGGUNAKAN
HAEMOCYTOMETER
Tujuan:
- Untuk mempelajari cara penghitungan mikrobia tertentu menggunakan haemocytometer
Pendahuluan
Populasi (jumlah) mikrobia baik bakteri ataupun fungi dapat dihitung secara
langsung disebut juga penghitungan secara mikroskopis yaitu dengan menghitung
jumlah bakteri dalam satuan isi yang sangat kecil. Alat yang digunakan adalah
Haemocytometer. Jumlah cairan yang terdapat antara coverglass dan alat ini
mempunyai volume tertentu sehingga satuan isi yang terdapat dalam satu bujur
sangkar juga tertentu.
Ruang hitung yang terdapat pada haemocytometer adalah 9 kotak besar
dengan luas 1 mm2. Satu kotak besar di tengah, dibagi menjadi 25 kotak sedang
dengan panjang 0,2 mm. Satu kotak sedang dibagi lagi menjadi 16 kotak kecil.
Dengan demikian satu kotak besar tersebut berisi 400 kotak kecil. Tebal dari ruang
hitung ini adalah 0,1 mm. Sel bakteri yang tersuspensi akan memenuhi volume ruang
hitung tersebut sehingga jumlah bakteri per satuan volume dapat diketahui.
Bahan dan alat:
Biakan murni bakteri atau jamur (yeast) yang telah mengandung spora,
mikroskop, haemocytometer.
Prosedur kerja:
1. Haemocytometer (alat hitung) dibersihkan dengan alkohol 70 % keringkan dengan tissue.
2. Teteskan ± 50 μl suspensi sel yeast (kira-kira 1 tetes) pada parit kaca pada
3. Biarkan sejenak sehingga sel diam di tempat (tidak terkena aliran air dari efek kapilaritas).
4. Letakkan cover glass di atas alat hitung.
5. Letakkan alat hitung pada meja benda mikroskop kemudian cari fokusnya pada perbesaran 40 x10.
6. Lakukan perhitungan secara kasar apakah diperlukan pengenceran atau
tidak.
7. Jika dalam satu kotak sedang terdapat sel-sel yang banyak dan bertumpuk
maka perhitungan akan tidak akurat dan diperlukan pengenceran dengan perbandingan 1:5 atau 1:10.
8. Hitung sampel, paling tidak sebanyak 5 kotak sedang (lebih banyak lebih
baik).
9. Hasil perhitungan dirata-rata kemudian hasil rataan dimasukkan rumus untuk
kotak sedang.
10.Jika dilakukan pengenceran maka jumlah sel/ml dikalikan faktor pengenceran.
Gambar 19 . Kotak-kotak pada haemocytometer
Cara Penghitungan:
Luas kotak sedang Luas kotak sedang = p x l
= 0,2 x 0,2 = 0,04 mm2
Misalnya diperoleh: Volume kotak sedang : 20 sel dalam satu kotak sedang
= 0,04 mm2 x 0,1 mm
maka jumlah sel keseluruhan :
= 0,004 mm3 = 20 x (1/4) x 106
Kotak sedang : Jumlah sel/ml = jumlah sel x 2,5 x 105 Dengan perhitungan yang sama maka diperoleh rumus untuk kotak kecil :
Lembaran Pengamatan
LATIHAN 11
PENGARUH LINGKUNGAN TERHADAP PERTUMBUHAN MIKROBA
Tujuan Praktikum:
1. Untuk mengetahui metode yang digunakan dalam uji pengaruh lingkungan
terhadap pertumbuhan mikroorganisme
2. Untuk mengetahui pembagian mikroorganisme berdasarkan pH, suhu,
tekanan osmotic dan oksigen.
Pendahuluan
Mikroba terdapat di lingkungan sekitar kita dalam jumlah yang sangat banyak
baik di air, tanah, udara, tanaman, hewan serta benda-benda lainnya. Setiap spesies
mikroorganisme memiliki cara tersendiri untuk hidup tergantung daya adaptasi
terhadap lingkungan sekitarnya. Faktor lingkungan ini dapat berupa faktor biotik dan
faktor abiotik. Faktor biotik adalah berasal dari mikrooganisme itu sendiri,
sedangkan faktor abiotik adalah berasal dari faktor luar seperti pengaruh suhu, pH,
tekanan osmose dan lain-lain.
a. Pengaruh suhu
1) Pengaruh suhu rendah
Suhu rendah sampai di bawah suhu minimumnya, menyebabkan bakteri
tidak dapat berkembang biak, pada umumnya tidak segera mematikan
bakteri, bahkan ada yang tahan bertahun-tahun pada suhu minus 70°C (tujuh
puluh derajat Celcius). Bakteri yang pathogen pada manusia umumnya
cepat mati pada suhu 0°C (nol derajat Celcius).
2). Pengaruh suhu tinggi
Suhu tinggi lebih membahayakan kehidupan bakteri dibandingkan dengan
suhu rendah. Bila bakteri dipanaskan pada suhu di atas maksimumnya, akan
segera mati. Semua bakteri, baik yang pathogen maupun tidak, dalam
bentuk vegetatifnya mati dalam waktu 30 (tiga puluh) menit pada suhu 60° -
65°C. Kenyataan ini merupakan dasar tindakan pasteurisasi.
Umumnya asam mempunyai pengaruh buruk terhadap pertumbuhan bakteri.
Kebanyakan bakteri lebih baik hidup dalam suasana netral (pH 7,0) atau sedikit
basa (pH 7,2 - 7,4), tetapi pada umumnya dapat hidup pada pH 6,5 – 7,5.
Bakteri-bakteri yang pathogen pada manusia tumbuh baik pada pH 6,8 – 7,4 yaitu sama
dengan pH darah.
e. Pengaruh O2 dari udara
Untuk melangsungkan hidupnya, manusia dan binatang membutuhkan O2
(oxygen) yang diambil dari udara melalui pernapasan. Fungsi O2 ini sudah jelas,
yaitu untuk pembakaran zat-zat makanan didalam sel-sel jaringan, sehingga
dihasilkan panas dan tenaga.
f. Pengaruh tekanan osmotik
Air ke luar masuk sel bakteri melalui proses osmosis, karena perbedaan tekanan
osmotic antara cairan yang ada di dalam dengan yang di luar sel bakteri.
Bahan dan Alat:
Bahan:
Aquadest steril, Alkohol 70%, Asam Sitrat, Bacillus subtilis, NaOH, Kapas,
Label, Medium PDA/PDB, Kertas karbon, Desinfektan, Antiseptik, Antibiotik
dan Uang logam.
Alat:
Autoklaf, Cawan petri, Inkubator, Lampu spiritus, Tabung reaksi, Rak tabung,
Spoit, Labu Erlenmeyer, Pinset, Pipet tetes dan Peper disk.
Prosedur Kerja:
1). Pengaruh suhu
- Buat suspensi bakteri pada tabung reaksi
- Ambil suspensi menggunakan spoit, kemudian dipindahkan ke tabung reaksi
yang telah berisi medium NB sebanyak 9 ml.
- Tutup dan simpan pada suhu 0-200C (kulkas), 20-500C (enkas), dan 50-1000C
(inkubator).
2). Pengaruh pH
- Ambil suspensi menggunakan spoit, kemudian dipindahkan ke tabung reaksi
yang telah berisi medium NB sebanyak 9 ml.
- Atur pH medium dengan menambahkan NaOH atau HCL sampai pH yang
diingin (3, 7, 9)
- Tutup dan simpan dalam incubator suhu 370C selama 48 jam
3). Tekanan osmotik
- Ambil 4 buah tabung yang sudah berisi media NB atau NA mengandung
NaCL masing-masing 3%, 5%, 10% dan 15%
- Ambil 1ml suspense bakteri masing-masing dimasukkan ke dalam 4 tabung
NB atau inokulasi bakteri pada NA padat dengan cara digores
- Lalu di inkubasi suhu 37 0 C selama 48 jam
- Amati pertumbuhannya
Gambar 25. Inokulasi dan inkubasi mikroba pada berbagai konsentrasi NaCl
Gambar 21. Pertumbuhan pada Agar Tegak
Gambar 22. Pertumbuhan bakteri berdasarkan kebutuhan O2
Gambar 23. Pertumbuhan bakteri berdasarkan kebutuhan O2 pada media cair
Pertanyaan:
1. Jelaskan metode yang dapat digunakan dalam pengujian pertumbuhan
mikroorganisme
2. Jelaskan pertumbuhan mikroba berbagai kondisi pH, suhu, tekanan osmotic
Lembaran Pengamatan
LATIHAN 11
PENGARUH LINGKUNGAN TERHADAP PERTUMBUHAN MIKROBA
Nama/NIM :
Fakultas/Program Studi : Hari/Tanggal : Group/Kelompok :
LATIHAN 12
PERAN MIKROBA PADA BAHAN PAKAN TERNAK
Tujuan:
1. Mengetahui cara membuat fermentasi bahan pakan ternak 2. Mengetahui manfaat mikroba pada bahan pakan ternak 3. Mengetahui mikroba yang berperan dalam proses fermentasi Pendahuluan
Untuk meningkatkan kualitas, palatabilitas, kecernaan serta daya simpan bahan pakan ternak salah satunya dapat dilakukan melalui proses fermentasi. Fermentasi bahan pakan ternak dapat dilakukan menggunakan berbagai mikroorganisme antar lain bakteri, fungi atau yeast/khamir. Fermentasi biasanya dilakukan menggunakan kultur murni dari laboratorium yang disimpan dalam keadaan kering atau dibekukan.
Prosedur kerja:
Pembuatan Pakan Fermentasi
Alat dan Bahan:
Bahan yang digunakan meliputi bahan pakan seperti limbah pertanian atau perkebunan, isolat mikroba sebagai kultur starter seperti bakteri atau fungi, urea, dedak, molasses dan aquades.
Alat yang digunakan dalam penelitian ini meliputi: autoklaf. incubator, rak untuk fermentasi, erlenmeyer, tabung reaksi, pipet, bunsen, gelas ukur, timbangan digital, masker, sarung tangan, sprayer, tali, ember plastik, pisau, label, alat tulis. Prosedur Kerja:
Pembuatan inokulum