commit to user
PENGARUH EKSTRAK ETANOL PROPOLIS TERHADAP
DERAJAT INFLAMASI BRONKUS TIKUS PUTIH
MODEL ASMA ALERGI
SKRIPSI
Untuk Memenuhi Persyaratan
Memperoleh Gelar Sarjana Kedokteran
DESSY SUCI RACHMAWATI
G.0008009
FAKULTAS KEDOKTERAN
UNIVERSITAS SEBELAS MARET
Surakarta
commit to user
commit to user
iii
PERNYATAAN
Dengan ini menyatakan bahwa dalam skripsi ini tidak terdapat karya yang pernah
diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi, dan
sepanjang pengetahuan penulis juga tidak terdapat karya atau pendapat yang
pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu
dalam naskah dan disebutkan dalam daftar pustaka.
Surakarta, 9 Januari 2012
Dessy Suci Rachmawati
commit to user
iv ABSTRAK
Dessy Suci Rachmawati, G0008009, 2012. Pengaruh Ekstrak Etanol Propolis terhadap Derajat Inflamasi Bronkus Tikus Putih Model Asma Alergi, Fakultas Kedokteran, Universitas Sebelas Maret, Surakarta
Tujuan Penelitian : Mengetahui pengaruh ekstrak etanol propolis terhadap derajat inflamasi bronkus pada tikus putih model asma alergi.
Metode Penelitian : Eksperimental laboratorik dengan post test only control
group design menggunakan 35 ekor tikus putih (Rattus norvegicus L) jantan,
dibagi dalam 5 kelompok (kelompok kontrol, asma alergi, antihistamin 2 mg/tikus, ekstrak propolis 100 mg/kg BB, ekstrak propolis 200 mg/kg BB) masing-masing kelompok 7 ekor tikus. Sensitisasi hewan coba hari ke-1 dan 14 secara intraperitonial, dilanjutkan hari ke-21, 23, 25, dan 27 secara aerosol selama 20 menit. Hari ke-28 mencit dikorbankan dan diambil bronkusnya, dibuat preparat dengan pewarnaan Haematoxyllin-Eosin. Data yang diperoleh dianalisis secara statistik dengan Kruskall-Wallis dilanjutkan Mann-Whitney menggunakan program SPSS for Windows Release 16.0. Pada analisis data digunakan batas kemaknaan p < 0,05.
Hasil Penelitian : Derajat inflamasi kelompok kontrol adalah grade 0 (40%) dan
grade 1 (60%). Kelompok asma alergi adalah grade 3 (80%) dan grade 4 (20%).
Kelompok antihistamin 2 mg/tikus adalah grade 1 (80%) dan grade 2 (20%). Kelompok ekstrak propolis 100 mg/kg BB adalah grade 2 (60%), grade 3 (20%),
dan grade 4 (20%). Kelompok ekstrak propolis 200 mg/kg BB adalah grade 1
(40%) dan grade 2 (60%). Tidak terdapat perbedaan bermakna derajat inflamasi kelompok asma alergi dengan ekstrak propolis 100 mg/kg BB (p = 0,174). Terdapat perbedaan bermakna derajat inflamasi kelompok asma alergi dengan ekstrak propolis 200 mg/kg BB (p = 0,006). Derajat inflamasi kelompok ekstrak propolis 100 mg/kg BB dengan ekstrak propolis 200 mg/kg BB perbedaannya tidak bermakna secara statistik (p = 0,059).
Simpulan Penelitian : Ekstrak etanol propolis menurunkan derajat inflamasi bronkus tikus putih model asma alergi.
commit to user
v ABSTRACT
Dessy Suci Rachmawati, G0008009, 2012. The Effect of Ethanol Extract of Propolis with Bronchial Inflammation Grade in White Mouse Asthma Allergic Model, Faculty of Medicine, Sebelas Maret University, Surakarta
Objective : To understand the effect of ethanol extract of propolis with bronchial inflammation grade in white mouse asthma allergic model.
Methods : Experimental laboratory with post test only control group design use 35 male white mouse, divided into five groups (control group, asthma allergic, anti-histamine 2 mg/mouse, propolis extract 100 mg/kg BW, propolis extract 200 mg/kg BW) each group consist of seven mouse. Sample was sensitized on day-1 and day-14 intraperitoneally, continued in day-21, 23, 25, and 27 aerosolly in 20 minutes. In day-28, sample was sacrificed and the bronchus was collected. The bronchial inflammation grade was observed with Haematoxylin-Eosin staining. The obtain data was analyzed statistically with Kruskall-Wallis continued with Mann-Whitney using program SPSS for Windows Release 16.0. The data was analyzed with margin of significance p < 0.05.
Result : The inflammation grade of control group was grade 0 (40%) and grade 1 (60%). Asthma allergic group was grade 3 (80%) and grade 4 (20%). Anti-histamine 2 mg/mouse was grade 1 (80%) and grade 2 (20%). Propolis extract 100 mg/kg BW was grade 2 (60%), grade 3 (20%), and grade 4 (20%). Propolis extract 200 mg/kg BW was grade 1 (40%) and grade 2 (60%). There is no significant difference between asthma allergic group and propolis extract 100 mg/kg BW in bronchial inflammation grade (p = 0,174). There is significant difference between asthma allergic model and propolis extract 200 mg/kg BW (p = 0,006). There is no significant difference between propolis extract 100 mg/kg BW and propolis extract 100 mg/kg BW (p = 0,059).
Conclusion: Ethanol extract of propolis decrease bronchial inflammation grade in white mouse asthma allergic model.
commit to user
vi PRAKATA
Syukur Alhamdulillah ke hadirat Allah SWT atas segala karunia dan rahmat yang dilimpahkan-Nya, sehingga penulis dapat menyelesaikan skripsi dengan judul “Pengaruh Ekstrak Etanol Propolis terhadap Derajat Inflamasi Bronkus Tikus Putih Model Asma Alergi”
Penyusunan skripsi ini dimaksudkan untuk memenuhi salah satu syarat memperoleh gelar Sarjana Kedokteran di Fakultas Kedokteran Universitas Sebelas Maret, Surakarta.
Dalam penyusunan skripsi ini, penulis tidak terlepas dari berbagai hambatan dan kesulitan. Namun berkat berbagai bimbingan dan bantuan, penulis dapat menyelesaikannya. Untuk itu perkenankanlah dengan setulus hati penulis menyampaikan rasa terima kasih kepada:
1. Prof. Dr. Zainal Arifin Adnan, dr., SpPD-KR-FINASIM selaku Dekan Fakultas Kedokteran Universitas Sebelas Maret Surakarta.
2. Tim Skripsi Fakultas Kedokteran Universitas Sebelas Maret, Surakarta. 3. Diding Heri Prasetyo, dr., M. Si. selaku Pembimbing Utama yang telah
memberikan waktu, bimbingan, saran, koreksi dan nasihat kepada penulis. 4. Sarsono, Drs., M. Si. selaku Pembimbing Pendamping yang telah
memberikan banyak bimbingan, pengarahan, dan masukan kepada penulis. 5. R. Prihandjojo Andri P., dr., M.Si selaku Penguji Utama yang telah berkenan menguji sekaligus memberikan banyak saran dan koreksi bagi penulisan skripsi ini.
6. Sri Hartati H., Dra., Apt., S.U. selaku Penguji Pendamping yang telah berkenan menguji dan memberikan saran yang berarti bagi penulisan skripsi ini.
7. Segenap Staf Laboratorium Biokimia FK UNS, Laboratorium Histologi FK UNS atas bantuannya selama penelitian dan penyusunan skripsi. 8. Ayah, Ibu, Kakak, serta keluarga penulis yang senantiasa memberikan
dukungan kepada penulis dalam mengerjakan skripsi.
9. Teman-teman dan semua pihak yang tidak dapat disebutkan satu per satu yang telah membantu proses penelitian dan pengerjaan skripsi ini.
Penulis menyadari bahwa penyusunan skripsi ini masih jauh dari sempurna, oleh karena itu penulis mengharapkan kritik dan saran yang membangun. Semoga skripsi ini bermanfaat bagi ilmu kedokteran pada khususnya dan masyarakat pada umumnya.
Surakarta, 9 Januari 2012
commit to user
b. Komposisi kimia propolis... 7
c. Flavonoid………...…... 8
2. Asma alergi……... 15
3. Bronkus... 20
4. Derajat inflamasi bronkus... 22
5. Sensitisasi hewan coba model asma alergi…... 26
B. Kerangka Pikiran……...……... 31
1. Kerangka pikiran konseptual... 31
2. Kerangka pikiran teoritis... 32
C. Hipotesis... 33
BAB III. METODE PENELITIAN... 34
commit to user
viii
H. Penentuan Dosis Perlakuan………... 38
I. Rancangan Penelitian... 39
J. Alat dan Bahan Penelitian... 40
K. Jalannya Penelitian…... 41
L. Teknik Analisis Data... 43
BAB IV. HASIL PENELITIAN... 45
A. Hasil Penelitian... 45
B. Analisis Data... 52
BAB V. PEMBAHASAN... 54
BAB VI. SIMPULAN DAN SARAN... 58
A. Simpulan... 58
B. Saran... 58
commit to user
ix
DAFTAR GAMBAR
Halaman
Gambar 2.1. Struktur Molekul CAPE... 10
Gambar 2.2. Struktur Molekul Chrysin... 11
Gambar 2.3. Struktur Molekul Galangin... 12
Gambar 2.4. Struktur Molekul Kuersetin…... 13
Gambar 2.5. Histologi Bronkus………... 21
Gambar 2.6. Neutrofil Segmen…………... 22
Gambar 2.7. Eosinofil………... 23
Gambar 2.8. Limfosit………... 24
Gambar 2.9. Basofil………... 25
Gambar 2.10. Makrofag………... 26
Gambar 2.11. Skema Kerangka Pikiran Konseptual……….. 31
Gambar 3.1. Skema Rancangan Penelitian……… 39
Gamabr 3.2. Skema Alur Penelitian………... 43
Gambar 4.1. Gambaran Histologis Bronkus Grade 0 pada Kelompok K1………. 45
Gambar 4.2. Gambaran Histologis Bronkus Grade 1 pada Kelompok K1... 46
Gambar 4.3. Gambaran Histologis Bronkus Grade 3 pada Kelompok K2………... 46
Gambar 4.4. Gambaran Histologis Bronkus Grade 4 pada Kelompok K2………... 47
Gambar 4.5. Gambaran Histologis Bronkus Grade 1 pada Kelompok K3………... 47
Gambar 4.6. Gambaran Histologis Bronkus Grade 2 pada Kelompok K3………... 48
Gambar 4.7. Gambaran Histologis Bronkus Grade 3 pada Kelompok K4………... 48
Gambar 4.8. Gambaran Histologis Bronkus Grade 4 pada Kelompok K4………... 49
Gambar 4.9. Gambaran Histologis Bronkus Grade 1 pada Kelompok K5………... 49
commit to user
x
DAFTAR TABEL
Halaman
commit to user
xi
DAFTAR GRAFIK
Halaman
Grafik 4.1. Prosentase Derajat Inflamasi pada Kelompok Kontrol (K1)... 50 Grafik 4.2. Prosentase Derajat Inflamasi pada Kelompok Asma Alergi
(K2) ……….. 51 Grafik 4.3. Prosentase Derajat Inflamasi pada Kelompok Asma Alergi +
Antihistamin (K3) ………..………... 51 Grafik 4.3. Prosentase Derajat Inflamasi pada Kelompok Asma Alergi +
Propolis Dosis 100 mg/kg BB (K4) …..……..…... 51 Grafik 4.3. Prosentase Derajat Inflamasi pada Kelompok Asma Alergi +
commit to user
xii
DAFTAR LAMPIRAN
Lampiran 1. Prosedur Pembuatan Ekstrak Etanol Propolis Lampiran 2. Jadwal Penelitian
Lampiran 3. Tabel Jumlah dan Prosentase Derajat Inflamasi Bronkus pada Masing- Masing Kelompok Perlakuan
Lampiran 4. Tabel Hasil Uji Kruskall-Wallis Lampiran 5. Tabel Hasil Uji Mann-Whitney
Lampiran 6. Tabel Konversi Dosis Manusia dan Hewan
Lampiran 7. Tabel Daftar Volume Maksimal Larutan Sediaan Uji yang Dapat Diberikan pada Berbagai Hewan
commit to user
BAB I
PENDAHULUAN
A. Latar Belakang Masalah
Penyakit alergi sering dijumpai di masyarakat, yang bisa menimbulkan
kerusakan jaringan pada hampir semua organ tubuh, termasuk kulit, saluran
napas dan saluran pencernaan (Tanjung & Yunihastuti, 2006). Alergi terjadi
akibat respon imun berlebihan bila ada kontak terhadap alergen
(Baratawidjaja, 2006). Apabila reaksi alergen terjadi di dalam bronkiolus
paru maka akan menyebabkan asma (Guyton & Hall, 2007).
Angka kejadian asma bervariasi di berbagai negara, tetapi terlihat
kecenderungan bahwa penderita penyakit ini meningkat jumlahnya. Menurut
data organisasi kesehatan dunia (WHO), penyandang asma di dunia mencapai
100-150 juta orang. Jumlah ini diduga terus bertambah sekitar 180 ribu orang
per tahun (Arief, 2009).
Proses alergi dimulai dengan pajanan alergen-alergen yang ditangkap
oleh Antigen Presenting Cell (APC) (Baratawidjaja, 2006). Hasil olahan
alergen oleh APC selanjutnya akan dipresentasikan ke sel Cluster of
Differentiation 4+ (CD4+) T-helper 2 (Th2) (Nairn & Helbert, 2002). Sel
CD4+ Th2 akan menghasilkan interleukin (IL) 4 dan IL-13 yang memacu sel
B (sel-sel plasma) untuk menghasilkan imunoglobulin (Ig) E (Abbas &
Lichtman, 2003). Interleukin 5 juga dihasilkan oleh sel CD4+ Th2 yang akan
commit to user
terbentuk akan berikatan dengan sel mast dan menyebabkan degranulasi sel
mast. Sel mast yang terdegranulasi akan melepaskan mediator-mediator
inflamasi yang dapat menyebabkan spasme bronkus, edema, peningkatan
sekresi mukus, dan konstriksi otot polos bronkus seperti histamin, leukotrien,
dan prostaglandin. Faktor kemotaktis seperti IL-5 dan Tumour Necrosis
Factor (TNF) α juga dilepaskan oleh sel mast (David et al., 2006). Faktor
kemotaktis ini akan memacu infiltrasi sel-sel radang seperti eosinofil,
limfosit, makrofag, neutrofil, dan basofil ke dalam jaringan bronkus (Abbas
& Lichtman, 2003). Infiltrasi sel-sel radang menunjukan terjadinya inflamasi
pada bronkus (Sundaru & Sukamto, 2006).
Kortikosteroid, teofilin, agonis β2-adrenergik, leukotrien modifier, anti
IgE sering digunakan dalam pengobatan asma. Namun, obat-obat ini
memiliki efek samping menghambat pertumbuhan atau meningkatkan resiko
eksaserbasi asma berat (Nelson et al., 2006).
Salah satu pengobatan asma yang saat ini sedang dikembangkan adalah
dengan menggunakan obat herbal (Handayani, 2001). Oleh karena itu,
pembuktian manfaat obat tradisional melalui uji klinik yang didukung dengan
penelitian imunologis perlu digalakkan (Djauzi, 2003).
Propolis merupakan herbal yang bisa dimanfaatkan dalam terapi asma
alergi. Senyawa terpenting dalam propolis adalah flavonoid. Salah satu
flavonoid yang terkandung dalam propolis adalah caffeic-acid dan kuersetin
(Kosalec et al., 2004). Caffeic-acid merupakan Ca-antagonis, sehingga
mediator-commit to user
mediator inflamasi setelah sel mast terjadi Ca influks (Kuby, 1997).
Sedangkan kuersetin sebagai mast cell stabilizer (Duke, 2009) akan
menguatkan efek penghambatan degranulasi sel mast. Dengan dihambatnya
degranulasi sel mast, maka sekresi vasoaktif amin seperti histamin, mediator
lipid, serta sitokin yang berperan dalam proses inflamasi pada reaksi alergi
akan berkurang.
Dengan sejumlah aktivitas biologis yang ditunjukkan oleh propolis
tersebut, maka peneliti tertarik melakukan penelitian untuk mengetahui
pengaruh propolis terhadap derajat inflamasi bronkus tikus model asma
alergi dan apakah propolis memiliki potensi untuk dikembangkan menjadi
terapi adjuvant dalam penatalaksanaan asma alergi.
B. Rumusan Masalah
Adakah pengaruh ekstrak etanol propolis terhadap derajat inflamasi
bronkus pada tikus putih model asma alergi?
C. Tujuan Penelitian
Untuk mengetahui pengaruh ekstrak etanol propolis terhadap derajat
commit to user
D. Manfaat Penelitian
1. Manfaat Teoritis
Penelitian ini diharapkan memberikan informasi ilmiah tentang
pengaruh propolis terhadap penatalaksanaan asma alergi khususnya
derajat inflamasi bronkus.
2. Manfaat Praktis
Penelitian ini diharapkan menjadi langkah awal untuk penelitian
lebih lanjut dalam pemanfaatan propolis sebagai obat anti asma alergi,
commit to user
BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
1. Propolis
a. Pengertian Umum
Lebah menghasilkan beberapa produk seperti madu, royal jeli, polen
dan propolis. Propolis sebagai kompleks resin yang dikumpulkan lebah
madu dari berbagai sumber tanaman untuk kemudian dicampur dengan
air liurnya, sehingga menghasilkan produk lebah yang bermanfaat
(Marcucci et al., 2001; Salatino et al., 2005). Secara penampakan fisik
(warna), aroma, dan komposisi kimiawi propolis terlihat bervariasi
tergantung dari berbagai faktor. Warnanya mungkin putih kekuningan
(krem), kuning, hijau, coklat terang atau gelap. Beberapa sampel
memiliki tekstur rapuh keras, sedangkan sampel lainnya mungkin elastis
dan kenyal. Propolis berasal dari bahasa Yunani, pro yang berarti
pertahanan dan polis berarti kota. Dengan demikian menyiratkan bahwa
propolis sebagai produk yang terlibat dalam pembelaan terhadap
masyarakat lebah (Salatino et al., 2005), yang digunakan oleh lebah
dalam pembuatan, pemeliharaan, perlindungan dan mensterilkan sarang
lebah (Marcucci et al., 2001).
Faktor-faktor biologik, zona geografis dan lingkungan dapat
commit to user
2009). Beberapa penelitian melaporkan bahwa komposisi propolis
dipengaruhi oleh banyak faktor, seperti sumber bunga (jenis tanaman)
untuk madu, musim dan faktor-faktor lingkungan (seperti jenis tanah,
iklim, faktor genetik, dan metode pengolahan). Dengan kata lain,
kemungkinan efek-efek yang berhubungan dengan kesehatan sangat
tergantung asal-usulnya (Baltrusaityte et al., 2007).
Komposisi propolis sangat kompleks. Unsur utamanya adalah lilin
lebah, resin dan senyawa volatil. Lebah mensekresikan lilin lebah,
sedangkan resin dan senyawa volatil berasal dari tanaman. Aktivitas
biologis propolis ditentukan oleh zat tanaman ini berasal. Oleh karena itu,
meskipun propolis jelas merupakan produk binatang, proporsi yang cukup
besar dari komponen-komponennya yang berperan dalam menentukan
aktivitas biologis berasal dari tanaman. Resin merupakan kandungan yang
kebanyakan ditemukan dalam ekstrak alkohol dikonsumsi oleh orang dari
berbagai negara sebagai makanan pelengkap atau obat alternatif (Salatino
et al., 2005). Beberapa senyawa telah diidentifikasi dalam propolis,
terutama resin (50%), lilin (30%), minyak esensial (10%), serbuk sari
(5%), dan senyawa organik lainnya (5%) (Sivasubramaniam & Seshadri,
commit to user
b.Komposisi Kimia Propolis
Komposisi kimia propolis disajikan pada tabel 2.1.
Tabel 2.1. Komposisi Kimia Propolis
Kelas komponen Jumlah Group Komponen
Resin 45-55% Flavonoid, asam fenolat dan esternya
Lilin dan asam lemak 25-53% Sebagian besar dari lilin lebah dan beberapa dari tanaman Minyak essensial 10% Senyawa volatile
Protein 5% Protein kemungkinan berasal dari polen dan amino bebas
Senyawa organik lain dan mineral
5% 14 macam mineral yang paling terkenal adalah Fe dan Zn, sisanya seperti Au, Ag, Cs, Hg, La, dan Sb. Senyawa lain seperti keton, laktan, kuinon, asam benzoate dan esternya, gula, vitamin B3.
(Sivasubramaniam & Seshadri, 2005).
Senyawa yang terkandung dalam propolis, secara garis besar
dikelompokkan dalam tiga kelompok yaitu (i) flavonoid (flavonol, flavon,
flavanon, dan hidroflavonol), (ii) turunan cinnamic acid, dan (iii)
terpenoid. Flavonol (kaempferide, kaempferol, galangin, isorhamnetin,
rhamnetin, myricetin, fisetin dan rutin), flavon (apigenin, acacetin,
baicalein, chrysin, luteolin dan tectochrysin), flavanon (pinocembrin,
sakuranetin dan isosakura-netin), turunan cinnamic acid (ferulic acid,
p-coumaric acid dan caffeic acid) dan terpenoids (tt-farnesol,
β-caryophyllene, terpineol dan syringaldehyde) (Sivasubramaniam &
Seshadri, 2005; Lotfy, 2006). Senyawa-senyawa tersebut memiliki peran
commit to user
imunomodulator, antimikrobial, antioksidan, antiinflamasi, antifungal,
antiprotozoa, antiparasit dan antiproliferatif (Banskota et al., 2001; Koo
et al., 2002; Ahn et al., 2004; Lotfy, 2006; El-Bussuony & Abouzid,
2010). Sehingga banyak digunakan sebagai ”obat” secara umum pada
sistem kardiovaskuler dan darah (anemia), alat pernapasan (untuk
berbagai infeksi), perawatan gigi, dermatologi (regenerasi jaringan, ulkus,
eksim, penyembuhan luka-terutama luka bakar, mikosis, infeksi selaput
lendir dan lesi ), pengobatan kanker, perbaikan dan penunjang sistem
imunitas, saluran pencernaan (ulkus dan infeksi), hepatoprotektor dan lain
sebagainya (Sivasubramaniam & Seshadri, 2005).
c. Flavonoid
Flavonoid banyak terkandung dalam buah, sayuran, minuman yang
berasal dari tanaman, dan dalam sejumlah makanan suplemen maupun
obat-obatan herbal (Moon et al., 2006). Flavanoid juga dikenal sebagai
bioflavanoid memiliki kelas beragam, secara alami disusun dari polifenol
tanaman yang memiliki berbagai aktivitas biologis penting dalam terapi.
Secara kimiawi dikenal ada 12 kelas flavonoid yaitu flavon, isoflavon,
flavan, flavanon, flavanol flavanolol, anthosianidin, katekhin,
leuko-anthrosianidin, khalkon, dihidrokhalkon, dan auron. Jenis-jenis
commit to user
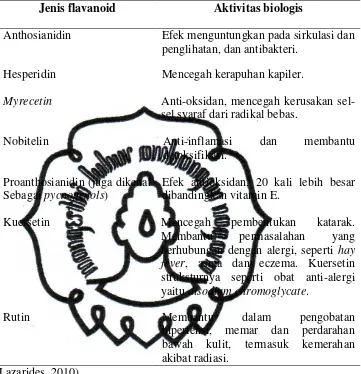
Tabel 2.2. Jenis Flavonoid dan Aktivitas Biologisnya
Jenis flavanoid Aktivitas biologis
Anthosianidin Efek menguntungkan pada sirkulasi dan penglihatan, dan antibakteri.
Hesperidin Mencegah kerapuhan kapiler.
Myrecetin Anti-oksidan, mencegah kerusakan
sel-sel syaraf dari radikal bebas.
Nobitelin Anti-inflamasi dan membantu
detoksifikasi.
Proanthosianidin (juga dikenal Sebagai pycnogenols)
Efek antioksidan, 20 kali lebih besar dibandingkan vitamin E.
Kuersetin Mencegah pembentukan katarak.
Membantu permasalahan yang berhubungan dengan alergi, seperti hay
fever, asma dan eczema. Kuersetin
struksturnya seperti obat anti-alergi yaitu disodium chromoglycate.
Rutin Membantu dalam pengobatan
hipertensi, memar dan perdarahan bawah kulit, termasuk kemerahan akibat radiasi.
(Lazarides, 2010)
Flavanoid banyak digunakan sebagai makanan suplemen untuk
meningkatkan kesehatan dan mencegah penyakit, karena sangat aman dan
toksisitasnya rendah (Moon et al., 2006). Beberapa ribuan flavanoid
tanaman telah diidentifikasi dan kadar kemaknaan biologis dari
bioflavanoid dalam manusia ditunjukkan pada konsumsi 1 gram/hari.
Secara umum dianggap bersifat non-toksik (Heo et al., 2001). Flavonoid
dilaporkan memperlihatkan aktivitas biologik yang luas, termasuk
commit to user
Flavonoid juga menunjukkan antioksidan, agregasi trombosit, fragilitas
dan permeabilitas kapiler, dan menghambat aktivitas sistem enzim
termasuk siklooksigenase dan lipoksigenase (Viuda-Martos et al., 2008).
Selain itu flavonoid berpotensi untuk pencegahan atau pengobatan
arthritis, kardiovaskuler, dan beberapa kanker, termasuk kanker payudara
(Murray et al., 2006).
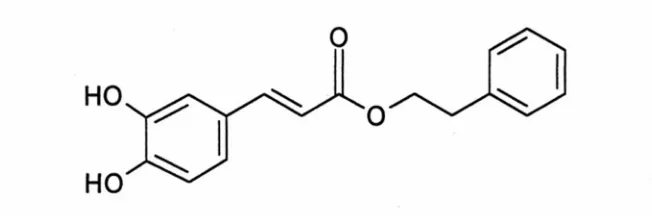
1) Caffeic acid phenethyl ester.
Caffeic acid phenethyl ester (CAPE) merupakan antioksidan fenolik,
yang memperlihatkan sejumlah efek farmakologik dan biologik termasuk
aktivitas antiinflamasi (Jung et al., 2008), antiviral dan antitumor (Orsolic
et al., 2005). CAPE merupakan penghambat yang poten dan spesifik
terhadap aktivasi Nuclear Factor (NF)-κB (Fitzpatrick et al., 2001).
Peningkatan reactive oxygen species (ROS) maupun aktivitas NF-κB
pada pemberian ovalbumin (OVA) inhalasi, maupun diminimalkan
dengan pemberian CAPE. Hal ini mengindikasikan stres oksidatif
memiliki fungsi penting dalam patogenesis asma bronkial dan CAPE
dapat digunakan sebagai terapi pembantu dalam penatalaksanaan asma
bronkial (Jung et al., 2008).
commit to user
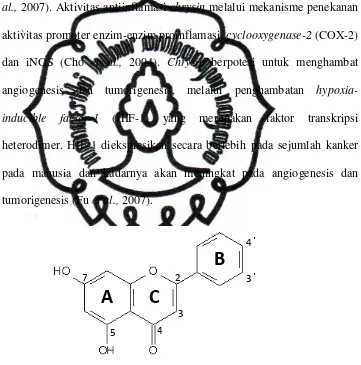
2) Chrysin
Chrysin (5,7-dihydroxyflavone) adalah senyawa flavon alami yang
ditemukan pada tanaman. Beberapa penelitian terkini menunjukkan
chrysin memiliki banyak aktivitas biologis, seperti antiinflamasi,
antikanker, dan antioksidan (Cho et al., 2004; Harris et al., 2006; Fu et
al., 2007). Aktivitas antiinflamasi chrysin melalui mekanisme penekanan
aktivitas promoter enzim-enzim proinflamasi, cyclooxygenase-2 (COX-2)
dan iNOS (Cho et al., 2004). Chrysin berpotesi untuk menghambat
angiogenesis dan tumorigenesis, melalui penghambatan
hypoxia-inducible factor-1 (HIF-1) yang merupakan faktor transkripsi
heterodimer. HIF-1 diekspresikan secara berlebih pada sejumlah kanker
pada manusia dan kadarnya akan meningkat pada angiogenesis dan
tumorigenesis (Fu et al., 2007).
Gambar 2.2. Struktur Molekul Chrysin (diambil dari Harris et al., 2006)
A
C
B
7
5
2
4 3
3΄
commit to user
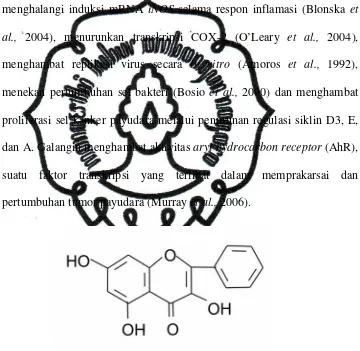
3) Galangin
Galangin (3,5,7-trihydroxyflavone) termasuk salah satu kelas
flavonoid yang dikenal sebagai flavonol. Galangin adalah komponen
utama propolis lebah madu yang memiliki aktivitas antiinflamasi
(Borrelli et al., 2002). Aktivitas biologis galangin yang lain adalah
menghalangi induksi mRNA iNOS selama respon inflamasi (Blonska et
al., 2004), menurunkan transkripsi COX-2 (O’Leary et al., 2004),
menghambat replikasi virus secara in vitro (Amoros et al., 1992),
menekan pertumbuhan sel bakteri (Bosio et al., 2000) dan menghambat
proliferasi sel kanker payudara melalui penurunan regulasi siklin D3, E,
dan A. Galangin menghambat aktivitas aryl hydrocarbon receptor (AhR),
suatu faktor transkripsi yang terlibat dalam memprakarsai dan
pertumbuhan tumor payudara (Murray et al., 2006).
Gambar 2.3. Struktur Molekul Galangin
(diambil dari http://common.wikimedia.org/wiki/Category:Flanonols)
4) Kuersetin
Kuersetin (3,3’,4’,5,7-pentahydroxyflavone), merupakan flavonoid
commit to user
bawang, brokoli, apel, teh, coklat, dan anggur merah. Kuersetin adalah
flavonoid utama yang banyak ditemukan pada makanan yang dikonsumsi
manusia., di USA diperkirakan asupan kuersetin berkisar 25 mg/hari
(Nanua et al., 2006).
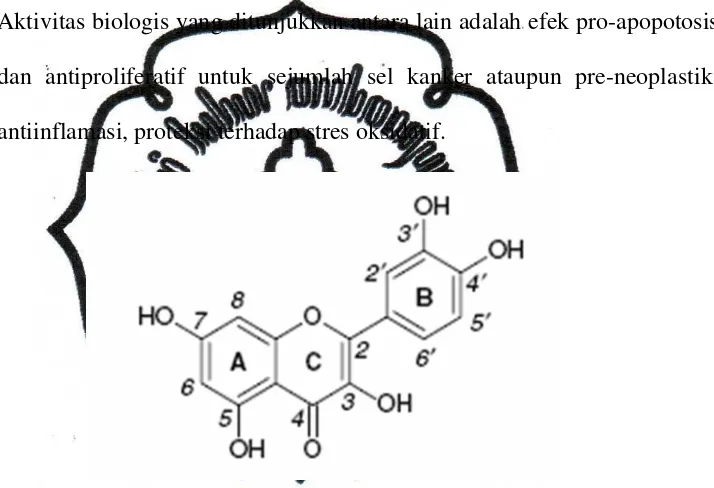
Oleh karena itu, kuersetin memiliki aktivitas biologis yang beragam.
Aktivitas biologis yang ditunjukkan antara lain adalah efek pro-apopotosis
dan antiproliferatif untuk sejumlah sel kanker ataupun pre-neoplastik,
antiinflamasi, proteksi terhadap stres oksidatif.
Gambar 2.4. Struktur Molekul Kuersetin (diambil dari Santos et al., 2008)
Pemanfaatan kuersetin untuk kesehatan, antara lain :
a) Manfaat kuersetin pada penyakit saluran nafas.
Manfaat potensi kuersetin dalam pengobatan penyakit saluran
nafas, karena beberapa penelitian telah menunjukkan efek
penghambatan pada produksi sitokin atau kemokin dalam kultur sel.
Kuersetin dapat mengurangi produksi nitric oxide (NO) yang diinduksi
commit to user
Kuersetin sangat mengurangi aktivasi mitogen-activated protein
kinases (MAPK) dan NF-κB, suatu kompleks faktor transkripsi yang
sangat berperan dalam ekspresi gen-gen proinflamasi (Cho et al.,
2003). Kuersetin juga memiliki efek penghambatan terhadap aktivasi
sel mast dan pelepasan histamin, TNF-α, IL-6, dan IL-8 (Kimata et al.,
2005). Kuersetin menghambat induksi IL-8 dan monocyte
chemotractant protein (MCP)-1 oleh TNF-α pada kultur sel synovial
manusia. EM-X, suatu campuran mengandung kuersetin berasal dari
fermentasi beras yang tidak dipoles, papaya, dan rumput laut,
memperlihatkan penghambatan ekspresi IL-8 yang diinduksi TNF-α
pada kultur sel epitel alveolar manusia (Deiana et al., 2002).
Hasil-hasil penelitian tersebut konsisten paa suatu gagasan yang
memperlihatkan bahwa kuersetin dapat mengurangi inflamasi saluran
nafas pada paisen asma.
b) Manfaat kuersetin pada sistem kardiovaskuler.
Flavonoid dapat memperbaiki fungsi endotel dan akhirnya
menyebabkan efek kardiovaskuler yang menguntungkan. Kuersetin
dapat meningkatkan status NO dan mengurangi konsentrasi
endotelin-1 dan dengan demikian dapat memperbaiki fungsi endotel (Loke et al.,
2008). Konsumsi makanan yang kaya akan kuersetin akan menurunkan
commit to user
c) Manfaat kuersetin sebagai antioksidan.
Sehubungan dengan aktivitas antioksidan, antitumor dan
antiinflamasi, kuersetin banyak diteliti pada sejumlah model kanker
sebagai agen kemoprotektif. Kuersetin memperlihatkan penghambatan
berbagai macam kanker, seperti kanker prostat, cervix, paru, payudara
dan kolon. Penelitian terbaru telah mengungkapkan bahwa kuersetin
menghambat proliferasi sel dengan menyebabkan apoptosis dan/atau
menahan siklus sel (Lee et al., 2006). Kuersetin merupakan
antioksidan yang kuat, sebab kuersetin dapat mengikat logam-logam,
menangkap radikal bebas, dan menghambat xanthine oxidase dan lipid
peroxidation secara in vitro (Vulcain et al., 2005).
2. Asma Alergi
Alergi adalah suatu keadaan hipersensitivitas yang diinduksi oleh
pajanan antigen tertentu yang menimbulkan reaksi imunologi yang
berbahaya pada pajanan berikutnya (Dorland, 2002). Alergi juga merupakan
suatu kondisi inflamasi yang disebabkan adanya alergen dan dapat
menimbulkan reaksi imun yang merugikan. Sensitisasi alergen dapat
memicu timbulnya inflamasi. Paparan berulang dari alergen dapat lebih
mengaktifkan proses inflamasi (Lockey & Bukanzt, 1999). Alergi bersifat
spesifik pada tiap individu, tidak menular, dan dapat muncul bila terpapar
commit to user
Asma alergi termasuk reaksi hipersensitivitas tipe 1, yaitu
hipersensitivitas cepat (Sacher & Mc Pherson, 2000). Reaksi alergi
diperantarai oleh IgE, tetapi sel B dan sel T memerankan peranan yang
penting dalam perkembangan antibodi (Anand, 2007). Apabila reaksi alergi
terlokalisasi di bronkiolus maka akan timbul asma (Sherwood, 2001).
Asma adalah penyakit inflamasi yang disebabkan oleh reaksi
hipersensitivitas segera maupun fase lambat secara berulang yang
mengakibatkan trias klinikopatologis obtruksi jalan napas intermiten dan
reversibel, inflamasi bronkus kronis dengan eosinofil, serta hipertrofi otot
polos bronkus dan hipereaktifitas terhadap bronkokonstriktor (Abbas &
Lichtman, 2003).
Terjadinya alergi dimulai dengan pajanan awal terhadap alergen
tertentu (Robbins, 2007). Ketika alergen masuk tubuh secara inhalasi dan
ditangkap oleh APC, diproses lalu dipresentasikan ke sel T CD4+. Sel T CD4+ dapat berdiferensiasi menjadi dua sel efektor, yaitu sel CD4+ Th1 dan sel CD4+ Th2. Ketidakseimbangan antara sel CD4+ Th1 dan sel CD4+ Th2 merupakan faktor yang sangat berpengaruh terhadap terjadinya penyakit
imunologi, termasuk penyakit alergi, dimana pada kasus alergi sel T CD4+ akan berdiferensiasi menjadi sel CD4+ Th2 (Anand, 2004; Baratawidjaja, 2006). Sel CD4+ Th2 berperan dalam menimbulkan inflamasi yang menjadi dasar dari penyakit asma. Sel–sel ini mensekresikan IL-4, IL-5, IL-9, IL-10
commit to user
Interleukin 4, IL-5, IL-6 dan IL-13 merangsang pertumbuhan,
proliferasi, diferensiasi, dan pematangan sel B menjadi sel plasma dan
memproduksi IgE. IL-5 berfungsi merangsang pertumbuhan dan diferensiasi
eosinofil serta sekresi berbagai sitokin. Sedangkan IL-4 bersama IL-10 dan
IL-13 berperan dalam merangsang pertumbuhan sel mast (Li-Weber &
Krammer, 2003 ; Janeway, 2004 ; Kresna, 2001).
Sel mast mempunyai reseptor IgE dengan afiniti yang tinggi. Proses
perlekatan IgE pada sel mast disebut sensitisasi. Setelah tersensitisasi, sel
mast mempengaruhi reaksi inflamasi (Abbas & Licthman, 2003).
Proses inflamasi pada asma alergi meliputi inflamasi akut dan inflamasi
kronik
a. Inflamasi akut
1) Reaksi fase awal (early phase reaction)
Apabila terjadi paparan ulang oleh alergen maka produksi IgE
spesifik akan meningkat dan terbentuk ikatan antara alergen dengan
dua atau lebih IgE pada sel mast yang disebut sebagai croos-linking
(Abbas & Litchman, 2003). Ikatan IgE tersebut menyebabkan
peningkatan influks ion kalsium yang memudahkan sel mast dan
basofil untuk melepaskan berbagai performed mediators. Diantaranya
adalah histamin, yang menyebabkan kontraksi bronkus, vasodilatasi
dan peningkatan permeabilitas vaskular (Mangatas dkk., 2006).
Terikatnya histamin pada endotel menyebabkan konstriksi sel yang
commit to user
Lichtman, 2003). Bocornya protein akan merangsang penebalan
dinding saluran napas dan pembentukan sumbatan dalam bentuk
eksudat yang terdiri dari campuran protein plasma dengan mukus,
sel-sel radang, dan berbagai komponen inflamasi. Eksudasi plasma
merusak integritas epitel saluran napas dan berakibat pengelupasan
epitel saluran napas (Mangatas dkk., 2006). Pada sistem imun,
histamin meningkatkan sekresi sitokin CD4+ Th2 seperti IL-4, IL-5,
IL-10, dan IL-13 serta menghambat produksi sitokin CD4+ Th1 yaitu
IL-2, IL-12, dan interferon (IFN)γ (Guntur, 2004).
2) Reaksi fase lambat (late phase reaction)
Fase ini timbul setelah 6-9 jam paparan alergen dan meliputi
pengerahan dan aktivasi dari sel-sel eosinofil, sel T, basofil, neutrofil,
dan makrofag. Sel-sel tersebut diaktivasi oleh sitokin-sitokin yang
diproduksi pada inflamasi sebelumnya. Interleukin 3, IL-5, dan
Granulocyte-Macrophage Colony-Stimulating Factor (GM-CSF) akan
memacu produksi dan aktivasu eosinofil; sedangkan TNF α akan
meningkatkan ekspresi molekul adesi endotel terhadap leukosit seperti
E-Selection dan Intracellular Adhesion Molecule-1 (ICAM-1)
(Mangatas dkk., 2006; Janeway et al., 2005).
Reaksi fase lambat ditandai oleh retensi selektif sel T pada saluran
nafas, ekspresi molekul adhesi, serta pelepasan newly generated
mediators yaitu derivat asam arakhidonat. Fosfolipid sel mast,
commit to user
sumber asam arakhidonat yang sintesisnya memerlukan bantuan enzim
fosfolipase. Termasuk dalam newly generated mediators di antaranya
adalah prostaglandin (PG), tromboksan (TX), leukotrien (LT), dan
platelet activating factors (PAF) (Mangatas dkk., 2006).
LTC4, LTD4, dan TXA2 bersifat sebagai bronkokontriktor poten,
sedangkan PGA2α, PGD2, dan PAF menyebabkan bronkokonstriksi,
meningkatkan permebilitas vaskular dan sekresi mukus. Dalam
konsentrasi tinggi, PAF juga menyebabkan agregasi trombosit dan
pembentukan mikrotrombus. Hal ini terus menerus terjadi sehingga
reaksi fase lambat semakin lama semakin kuat (Mangatas dkk., 2006).
b. Inflamasi kronik
Survival sel inflamasi pada saluran nafas lebih tinggi lagi oleh
adanya peningkatan molekul adhesi seperti ICAM dan VCAM (Vascular
Cell Adhesion Molecule) yang melekatkan sel-sel radang pada saluran
nafas (Mangatas dkk., 2006). Karakteristik inflamasi kronik asma alergi
adalah sebagai berikut:
1) Pengelupasan epitel saluran nafas (airway epithelial shedding).
Akibat reaksi inflamasi, terjadi pembengkakan, vakuolisasi,
hilangnya silia epitel, penambahan jumlah sel goblet, serta
pengelupasan sebagian epitel saluran nafas. Penyebab pengelupasan
epitel diperkirakan adalah eksudasi plasma, berbagai mediator toksik
seperti radikal bebasoksigen, TNF-α, hasil degranulasi sel mast,
commit to user
dari sel mast. Penyebab lainnya adalah gangguan adhesi antar sel
(Mangatas dkk., 2006).
Akibat pengelupasan epitel, terjadi hiperresponsivitas bronkus,
peningkatan permeabilitas mukosa saluran nafas, dan penurunan
jumlah enzim endoprotease netral, seperti substansi P, yang berfungsi
mendegradasi sitokin proinflamasi (Mangatas dkk., 2006).
2) Aktivasi sel epitel
Sel epitel saluran nafas turut berperan dalam reaksi inflamasi
asma alergi. Reaksi inflamasi ini bertujuan memperbaiki kerusakan
jaringan epitel akibat asma. Sel epitel yang teraktivasi melepaskan
berbagai mediator, antara lain 15-hydroxyeicotetraenoic acid
(15-HETE), PGE2, fibronektin, eotaksin. Selain itu,terjadi peningkatan
ekspresi berbagai pertanda inflamasi seperti molekul adhesi, nitrit
oxide synthetase (NOS) dan endotelin (Mangatas dkk., 2006).
3. Bronkus
Bronkus terdiri atas bronkus primer atau ekstrapulmonal dan bronkus
sekunder atau intrapulmonal. Bronkus intrapulmonal merupakan hasil
percabangan dari bronkus ekstrapulmonal sehingga ukurannya lebih kecil.
commit to user
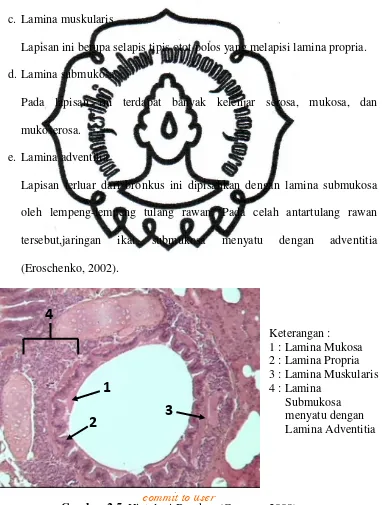
a. Lamina mukosa
Lapisan ini terdiri atas epitel bertingkat semu silindris silia.
b. Lamina propria
Merupakan lapisan tipis di bawah lamina mukosa. Terdiri atas jaringan
ikat halus dengan banyak serat elastin.
c. Lamina muskularis
Lapisan ini berupa selapis tipis otot polos yang melapisi lamina propria.
d. Lamina submukosa
Pada lapisan ini terdapat banyak kelenjar serosa, mukosa, dan
mukoserosa.
e. Lamina adventitia
Lapisan terluar dari bronkus ini dipisahkan dengan lamina submukosa
oleh lempeng-lempeng tulang rawan. Pada celah antartulang rawan
tersebut,jaringan ikat submukosa menyatu dengan adventitia
(Eroschenko, 2002).
Gambar 2.5. Histologi Bronkus (Gregory, 2009)
4
1
2
commit to user
4. Derajat Inflamasi Bronkus
Inflamasi atau peradangan bronkus merupakan faktor patofisiologi yang
penting pada asma alergi. Banyak sel inflamasi terlibat dalam patogenesis
asma meskipun peran tiap sel yang tepat belum pasti. Rahmawati dkk.
(2003) menyebutkan sel inflamasi yang terlibat dalam patogenesis asma
meliputi sel mast, makrofag, neutrofil, eosinofil, limfosit T, basofil, dan
platelet.
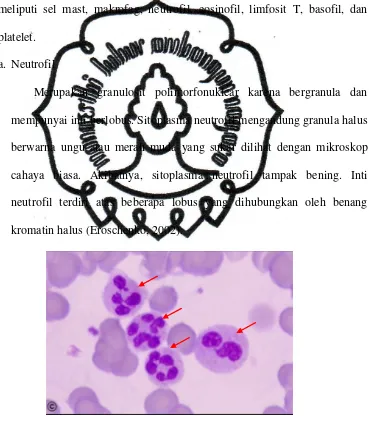
a. Neutrofil
Merupakan granulosit polimorfonuklear karena bergranula dan
mempunyai inti berlobus. Sitoplasma neutrofil mengandung granula halus
berwarna ungu atau merah muda yang sukar dilihat dengan mikroskop
cahaya biasa. Akibatnya, sitoplasma neutrofil tampak bening. Inti
neutrofil terdiri atas beberapa lobus yang dihubungkan oleh benang
kromatin halus (Eroschenko, 2002).
commit to user
b. Eosinofil
Eosinofil diproduksi oleh sel progenitor dalam sumsum tulang dan
diatur oleh IL-3, IL-5, dan GM-CSF (Rahmawati dkk., 2003). Sel ini
biasanya mudah dikenali pada apusan darah karena sitoplasmanya
dipenuhi granula eosinofilik (merah muda terang) besar (Jancquira &
Carneiro, 2005). Granul interselular ini merupakan sumber protein
proinflamasi seperti major basic protein (MBP), eosinophil derived
neurotoxin, peroksidase dan protein kationik (Mangatas dkk., 2006). Inti
eosinofil khas bipolar namun kadang-kadang ada lobus ketiga yang kecil
(Jancquira & Carneiro, 2005).
Gambar 2.7. Eosinofil (Nivaldo, 2009)
c. Limfosit
Limfosit merupakan leukosit granuler. Limfosit tidak atau hampir
tidak memiliki granula sitoplasma, dengan inti bulat sampai berbentuk
commit to user
gelap mengisi hampir seluruh sitoplasma dan sitoplasma itu tampak
sebagai daerah basofilik sempit di sekitar inti. Sitoplasma agranuler,
tetapi dapat mengandung sedikit granula azurofilik. Pada limfosit besar,
sitoplasma basofiliknya lebih banyak di sekitar inti, dan intinya lebih
besar dan lebih pucat serta mengandung satu atau dua nukleoli (Baldy,
2006).
Gambar 2.8. Limfosit (Nivaldo, 2009)
d. Basofil
Granula pada basofil tidak sebanyak pada eosinofil, tetapi ukuran
granulanya lebih bervariasi, tidak begitu berhimpitan dan terpulas biru tua
atau coklat. Meskipun intinya tidak berlobi banyak dan terpulas basofilik
pucat, umumnya basofil terhalangi oleh kepadatan granula (Eroschenko,
commit to user
Gambar 2.9. Basofil (Nivaldo, 2009)
e. Makrofag
Makrofag memiliki ciri morfologis dengan spektrum luas
berdasarkan keadaan aktivitas fungsional dan jaringan yang dihuni.
Makrofag bergerak dengan mempergunakan gerakan amuboid. Dengan
mikroskop elektron terlihat permukaan makrofag tidak teratur, kaki palsu
yang terjulur ke segala arah. Membran plasma berlipat-lipat dan
mengandung tonjolan dan lekukan. Nukleus mengandung kromatin padat,
berbentuk bulat besar, nukleoli tidak mencolok, sitoplasma terpulas gelap
dan sedikit mengandung vakuol kecil yang terpulas secara supravital
dengan merah netral. Makrofag dapat ditemukan pada mukosa,
submukosa, dan alveoli yang diaktivasi oleh mekanisme IgE-dependent
commit to user
Gambar 2.10. Makrofag (Caceci, 2009)
5. Sensitisasi Hewan Coba Model Asma Alergi
Terdapat beberapa spesies binatang yang digunakan sebagai binatang
model asma, diantaranya adalah mencit, tikus, marmut, musang, anjing,
kambing, monyet, dan kuda (Shin et al., 2009).
Ovalbumin (OVA) digunakan sebagai sensitisasi, OVA komponen
utamanya adalah putih telur, secara struktural adalah serpin (sejenis protein).
Ovalbumin merupakan fosfoglikoprotein monomer dengan berat molekul 43
hingga 45 kD dan bersifat asam pada titik isoelektrik (Huntington & Stein,
2001). Ovalbumin memiliki peran dalam peningkatan Ig E secara spesifik.
Mayoritas model yang sekarang digunakan adalah mencit yang disensitisasi
dengan OVA secara intraperitoneal (i.p), yang dalam penggunaannya sering
bersama-sama dengan adjuvant sel Th2, seperti alumunium hidroksida (Kips
et al., 2003; Diding dkk., 2007).
Alumunium hidroksida(Al(OH)3), merupakan alumunium yang paling
commit to user
beberapa vaksin karena perannya dalam menginduksi respon Th2 (Petrovsky
& Aguilar, 2004).
Dalam penelitian untuk mensensitisasi hewan coba menggunakan
mencit C57BI/6J diimunisasi dengan suntikan OVA 8µg i.p. yang
diencerkan dengan jel Al(OH)3 (1 mg) dalam 0,5 ml Phosphat Buffer Saline
(PBS), dan diulangi pada hari ke-14. Sedangkan pemaparan BALB/C
dengan 10 µg OVA memberikan kadar tertinggi IgE dan IgG1 (Walter,
2002). Penelitian lain untuk membuat asma alergi, maka mencit disensitisasi
dengan menginjeksikan secara i.p. 10 µg OVA yang dilarutkan ke dalam
2.25 mg Al(OH)3 dalam 100 µl saline pada hari 0 dan 14. Pada hari
ke-35, 39, dan 42, mencit dipapar dengan inhalasi OVA aerosol selama 20
menit. Aerosol menggunakan nebulizer cairan OVA (10 mg/ml) dalam
saline menggunakan Pari LC Star nebulizer (Pari Respiratory Equipment,
Richmond, VA) yang digerakan kompresor udara dengan flow rate 6L/min.
Untuk protokol penelitian pemaparan antigen akut (kurang lebih 1 bulan)
maupun kronik (lebih dari 2 bulan), mencit diimunisasi secara subcutan
(s.c.) pada hari ke-0, 7, 14, dan 21 dengan 25 µg OVA (grade V;
Sigma-Aldrich, St. Louis, MO) yang dilarutkan pada 1 mg alumunium hidroksida
(Sigma-Aldrich) dalam 200 µl PBS.
a. Mencit model asma alergi akut
Sifat dari model inflamasi akut dipengaruhi oleh pilihan strain,
alergen, dan protokol sensitisasi dan paparan. Alergen yang umumnya
commit to user
relatif tidak mahal, tidak berbahaya, dapat dimurnikan, dan memiliki
epitop yang mendominasi respon imun. (Shin et al., 2009).
Protokol sensitisasi pada model inflamasi akut biasanya
membutuhkan pemberian alergen secara sistemik yang multiple dengan
penambahan adjuvant (Nials & Uddin, 2008). Adjuvant seperti
alumunium hydroksida [Al(OH)3] diketahui menginduksi perkembangan
fenotip Th2 oleh sistem imun ketika dipapar antigen (Nials & Uddin,
2008; Shin et al., 2009; Brewer et al., 1999).
Protokol tanpa adjuvant juga dapat dilakukan, tetapi membutuhkan
alergen dalam jumlah yang lebih banyak. Setelah sensitisasi (14-21 hari),
jalan napas mencit dipapar dengan alergen, biasanya selama beberapa
hari. Alergen dapat diinhalasi menggunakan formulasi nebulizer
(aerosol), atau dengan intratrakeal (i.t) atau intranasal (i.n) (Nials &
Uddin, 2008). Paparan pada model inflamasi akut ini disebut dengan
paparan alergen primer (Shin et al., 2009).
Protokol untuk yang akut adalah pemaparan OVA secara intranasal
(i.n) (20 µg dalam 50 µl PBS) diberikan pada hari ke-26, 28, 30, dan 35,
dan mencit dikorbankan pada hari ke-36 (Hopfenspriger et al., 2002).
Paparan primer pada model inflamasi akut memperlihatkan
perubahan seperti asma di klinik seperti peningkatan kadar IgE,
inflamasi jalan napas, hiperplasia sel goblet, hipertrofi epitel, AHR yang
spesifik stimulus, dan pada beberapa model bronkokonstriksi fase cepat
commit to user
maka tidak dijumpai beberapa lesi yang ada pada asma kronik pada
manusia, seperti inflamasi kronik pada dinding jalan napas dan
remodelling jalan napas. Terlebih lagi, beberapa proses berjalan singkat,
dan pada beberapa model, inflamasi jalan napas dan AHR berkurang
setelah beberapa minggu dari paparan alergen terakhir. Oleh karena itu,
model paparan akut lebih cocok digunakan untuk meneliti proses yang
mendasari inflamasi jalan napas akut dan AHR (Nials &Uddin, 2008).
b. Mencit model asma alergi kronik
Tujuan pembuatan model inflamasi kronik adalah untuk
memperlihatkan perubahan yang terjadi seperti pada asma di klinik,
seperti AHR yang persisten dan remodelling jalan napas, dan juga
memungkinkan evaluasi obat baru sebagai rancangan terapi daripada
sebagai rancangan profilaksis (Nials & Uddin, 2008). Selain itu,
keuntungan dari protokol ini adalah kemampuannya untuk memonitor
perubahan parameter inflamasi (Shin et al., 2009). Paparan kronik
alergen dilakukan dengan memaparkan secara berulang jalan napas
dengan alergen kadar rendah sampai selama 12 minggu (Nials & Uddin,
2008). Sedangkan Shin et al. (2009) menuliskan paparan untuk model
asma kronik (paparan sekunder) diberikan 2-6 minggu setelah paparan
primer ketika eosinofilia jalan napas dan AHR menurun sampai baseline
level. Pemaparan kronik alergen memperlihatkan perubahan-perubahan
seperti asma pada manusia, termasuk alergen dependent sensitisasi, Th2
commit to user
mukosa jalan napas, AHR, remodelling jalan napas seperti hiperplasia
sel goblet, hipertrofi epitel, dan fibrosis subepitelial atau peribronkiolar
(Nials & Uddin, 2008).
Sedangkan protokol untuk yang kronik, mencit yang telah
mendapatkan pemaparan OVA i.n pada hari ke-26, 28, 30 seperti pada
protokol akut dan kemudian dilanjutkan dengan pemberian pemaparan
OVA i.n dua minggu sekali. Untuk melakukan pemberian i.n, mencit
diberikan anestesi dengan isoflurane (Isosol TM; Abbott Laboratories,
North Chicago, IL) (Ikeda, 2003). Sedangkan pada penelitian Cho et al.,
2004, mencit diimunisasi i.p. pada hari ke-0 dan 12 dengan 50 µg OVA
(grade V; Sigma-Aldrich, St. Louis, Missouri, USA) dilarutkan pada 1
mg alum (Sigma-Aldrich) dalam 200 µl normal saline. Pemaparan OVA
i.n (20 µg/ 50 µl dalam PBS) diberikan pada hari ke-26, 29, dan 31 di
bawah, anestesi dengan isoflurane (Vedco lnc., St. Joseph, Missouri,
USA) dan kemudian diulangi dua minggu sekali selama 3 bulan. Mencit
dikorbankan 24 jam setelah akhir pemaparan OVA terakhir (Cho et al.,
commit to user
Gambar 2.11. Skema Kerangka Pikiran Konseptual
Keterangan:
: memacu : menghambat
Ovalbumin
Rekruitmen dan aktivasi sel-sel inflamasi (sel mast, makrofag, neutrofil, eosinofil,
commit to user
2. Kerangka Pikiran Teoritis
Ovalbumin sebagai alergen masuk ke tubuh, ditangkap oleh Antigen
Presenting Cell (APC). Kemudian diproses dan dipresentasikan ke sel T
CD4+ atau sel Th0. Sel Th0akan berdiferensiasi menjadi sel CD4+ Th1 dan sel CD4+ Th2. Kerja dua sel tersebut bersinergi, dimana sel CD4+ Th2 berperan sebagai respon imun humoral yang akan mensekresikan antibodi
(IgE). Sedangkan sel CD4+ Th1 berperan dalam respon imun seluler, yang akan menghasilkan sitokin-sitokin proinflamasi seperti IL-1β, IL-2, IL-6, dan
TNF-α. TNF-α bersifat proteolitik, sehingga akan melisiskan sejumlah sel-sel
termasuk sel saluran nafas. Debris lisis sel ini akan menimbulkan stres
oksidatif / Reactive Oxygen Species (ROS), yang akan menambah beratnya
reaksi asma alergi.
Ovalbumin melalui sel CD4+ Th2 memicu produksi sel mast. Apabila
ada paparan ulang oleh alergen, maka akan terjadi cross-linking antara IgE
dengan alergen pada permukaan sel mast. Cross-linking ini akan memacu
reaksi alergi di mana terjadi degranulasi sel mast yang melepaskan
mediator-mediator proinflamasi seperti histamin, leukotrien, dan prostaglandin.
Dihasilkannya mediator-mediator proinflamasi ini akan memicu reaksi
inflamasi pada bronkus di mana terjadi aktivasi dan perekrutan eosinofil.
Propolis mengandung CAPE yang mampu menghambat aktivasi NF-κB
pada proses inflamasi. Selain itu, CAPE memiliki aktivitas biologis sebagai
Ca-antagonis. Ca-antagonis ini akan menghambat Ca influks sehingga
commit to user
sebagai antioksidan, kandungan ini dapat menghambat stress oksidatif yang
akan mengurangi terjadinya reaksi inflamasi pada asma alergi. Kuersetin
yang terkandung dalam propolis memiliki aktivitas biologis yang akan
memperkuat membran sel mast sehingga membran sel mast tidak mudah
terdegranulasi dan menghambat pelepasan histamin, TNF-α dan IL-6.
Dengan demikian, pemberian ekstrak etanol propolis dapat menurunkan
progresivitas alergi saluran nafas yang ditunjukkan dengan penurunan derajat
inflamasi bronkus.
C. Hipotesis
Ekstrak etanol propolis menurunkan derajat inflamasi bronkus tikus
commit to user
BAB III
METODE PENELITIAN
A. Jenis Penelitian
Jenis penelitian ini adalah penelitian eksperimental laboratorik, post test
only control group design.
B. Lokasi penelitian
Penelitian dilaksanakan di Laboratorium Biokimia dan Laboratorium
Histologi Fakultas Kedokteran Universitas Sebelas Maret. Pada bulan Mei
sampai dengan September 2011.
C. Subjek Penelitian
Subjek penelitian berupa tikus putih (Rattus norvegicus L) jantan
dengan berat badan ± 200 gram, dan berumur 4 - 6 minggu. Tikus putih
diperoleh dari Unit Pengembangan Hewan Coba Universitas Setia Budi
Surakarta.
D. Teknik Sampling
Pengambilan sampel dilakukan secara incidental sampling. Jumlah
commit to user
Keterangan:
k: jumlah kelompok
n: jumlah sampel dalam tiap kelompok
Dalam penelitian ini, subjek dibagi menjadi 5 kelompok. Berdasarkan rumus
Federer di atas, didapatkan jumlah subjek masing-masing kelompok sebagai
berikut:
( k-1) (n-1) ≥ 15
(5-1) (n-1) ≥ 15
4 (n-1) ≥ 15
4n ≥ 19
n ≥ 4,75≈ 5
Jadi tiap kelompok minimal terdiri dari 5 ekor tikus putih. Pada penelitian
kali ini kami menggunakan 7 ekor tikus putih per kelompok.
E. Identifikasi Variabel Penelitian
1. Variabel bebas : Ekstrak etanol propolis
2. Variabel terikat : Derajat inflamasi bronkus
3. Variabel perancu
a. Dapat dikendalikan : gizi, makanan dan minuman, galur, umur, dan
jenis kelamin hewan coba.
b. Tidak dapat dikendalikan : kondisi psikologis, sistem kekebalan
commit to user
F. Skala Variabel
1. Ekstrak etanol propolis : skala nominal
2. Derajat inflamasi bronkus : skala ordinal
G. Definisi Operasional Variabel Penelitian
1. Ekstrak etanol propolis
Propolis lebah pada penelitian ini diperoleh dari peternak lebah di
daerah Kecamatan Kerjo, Kabupaten Karanganyar, Surakarta, Jawa
Tengah. Ekstraksi dilakukan dengan metode perkolasi. Propolis
dimasukkan dalam alat perkolator, kemudian ditambah dengan Etanol
80%, lalu didiamkan. Setelah itu ditambahkan tetes demi tetes Etanol
80% sampai filtrat yang didapatkan jernih. Setelah didapatkan filtrat,
kemudian diuapkan dengan vacuum rotary evaporator pemanas water
bath suhu 70oC. Dari proses tersebut didapatkan ekstrak kental.
Kemudian untuk mendapatkan ekstrak propolis, ekstrak kental tersebut
dituang dalam cawan porselin dan dipanaskan dengan water bath sambil
terus diaduk.
Ekstrak etanol propolis (EEP) menunjukkan aktivias antiinflamasi
baik akut ataupun kronik. EEP dosis 50 mg/kg BB/hari/oral dan 100
mg/kg BB/hari/oral menunjukkan aktivitas antiinflamasi kronik,
sedangkan dosis 200 mg/kg BB/hari/oral menunjukkan aktivitas
commit to user
2. Derajat inflamasi bronkus
Bronkus tikus yang akan dibuat preparat diperoleh pada hari ke-28
atau pada akhir percobaan, dengan mengorbankan tikus, diambil jaringan
bronkus utama di dekat percabangan (bifurcation) sepanjang 1,5 cm
kemudian direndam dalam larutan formalin buffer 10% selama 10 jam,
setelah itu dibuat blok parafin. Selanjutnya dibuat potongan serial
terhadap blok parafin tersebut untuk dibuat slide. Setelah itu dilakukan
pewarnaan Haematoxyllin-Eosin (HE) untuk melihat derajat
inflamasinya. Preparat bronkus diamati dengan mikroskop cahaya
perbesaran 100 kali dalam satu lapang pandang. Derajat inflamasi pada
bronkus yang didapatkan dari modifikasi oleh Myou et al. (2003) dibagi
menjadi 4 derajat yaitu:
0 = Tidak ada infiltrasi sel radang
1 = Infiltrasi sel radang sedikit
2 = Infiltrasi sel radang ke-1 lapisan dinding bronkus
3 = Infiltrasi sel radang hingga 2-4 lapisan dinding bronkus
4 = Infiltrasi sel radang hingga >4 lapisan dinding bronkus
3. Sensitisasi tikus model asma alergi
Tikus diadaptasikan selama satu minggu. Kemudian dilakukan
penimbangan untuk menentukan dosis dan dilakukan perlakuan. Untuk
membuat model tikus asma alergi maka tikus disensitisasi pada hari ke-1
commit to user
ml Al(OH)3. Hari ke-14 disensitisasi ulang menggunakan 1 ml
OVA/tikus/i.p dari 2,5 mg OVA yang dilarutkan pada 10 ml aquabides.
Pemaparan OVA aerosol dalam aquabides (10:1) selama 20 menit
dengan nebulizer kecepatan 6 L/menit diberikan pada hari ke-21, 23, 25
dan 27. Hari ke-28 tikus dikorbankan, jaringan bronkus dan serum
dikoleksi.
H. Penentuan Dosis Perlakuan
1. Pemberian anti histamin generasi III
Antihistamin generasi III yang digunakan dalam penelitian ini adalah
Telfast® 120 mg yang mengandung Fexofenadine. Faktor konversi
manusia (dengan berat badan ±70 kg) ke tikus (dengan berat badan ± 200
gr) adalah 0,018 (Suhardjono, 1995). Sehingga dosis yang diberikan
kepada tikus
120 x 0,018 = 2,16 mg ≈ 2 mg
Dalam penelitian ini dosis anti histamin yang diberikan ialah 1
ml/tikus/hari.
2. Pemberian propolis
Dosis propolis yang diberikan pada tikus adalah 100 mg/kg
BB/hari/oral. Oleh karena tikus yang digunakan dalam penelitian ini
mempunyai berat badan ± 200 gram, maka didapatkan perhitungan
commit to user
200gr
1000gr 挐 100mg 20mg/tikus/hari/oral
Untuk mengetahui berapa banyak dosis per oral yang diberikan untuk tiap
tikus, maka dapat dihitung sebagai berikut :
V1
Sehingga untuk dosis 100 mg/kg BB/hari setiap tikus mendapatkan dosis
per oral 0,5 ml. Sedangkan untuk dosis 200 mg/kg BB/hari setiap tikus
mendapatkan dosis per oral 1 ml.
I. Rancangan Penelitian
commit to user
Keterangan :
S : Jumlah tikus yang digunakan
K1 : Kelompok kontrol
K2 : Kelompok asma alergi
K3 : Kelompok asma alergi + antihistamin 2 mg/tikus/hari/oral
K4 : Kelompok asma alergi + ekstrak propolis dengan dosis 100mg/kg
BB/tikus/oral
K5 : Kelompok asma alergi + ekstrak propolis dengan dosis 200mg/kg
BB/tikus/oral
E1 : Derajat inflamasi bronkus K1
E2 : Derajat inflamasi bronkus K2
E3 : Derajat inflamasi bronkus K3
E4 : Derajat inflamasi bronkus K4
E5 : Derajat inflamasi bronkus K5
J. Alat dan Bahan Penelitian
1. Alat penelitian
a. Kandang hewan percobaan (20 cm x 30 cm x 15 cm)
b. Timbangan
c. Spuit injeksi 5 ml
d. Sonde tikus 5 ml
e. Labu ukur 25 ml
commit to user
g. Minor set
h. Deck glass
i. Nebulizer
j. Mikroskop cahaya
2. Bahan penelitian
a. Ekstrak propolis
b. Aquabides
c. Pakan tikus BR I
d. OVA
e. Antihistamin generasi III
f. Formalin buffer 10%
g. Al(OH)3
h. Blok paraffin
i. Pewarna HE
K. Jalannya Penelitian
1. Sebelum perlakuan
a. Hewan uji diadaptasi dengan kondisi laboratorium tempat penelitian
selama kurang lebih 1 minggu.
b. Hewan uji dikelompokkan secara acak menjadi 5 kelompok.
commit to user
2. Pemberian Perlakuan
a. Sejak hari ke-1 sampai hari ke-7 kelompok K1, K2, K3, K4 dan K5
diberi diet standar. Masing-masing diberi perlakuan yang berbeda.
b. Antihistamin untuk kelompok 3 dan ekstrak propolis untuk kelompok
4 dan 5 diberikan setiap hari.
c. Sensitisasi 1 ml OVA/tikus/i.p dari 2,5 mg OVA yang dilarutkan pada
7,75 ml Al(OH)3 dilakukan pada hari ke-1. Dan pada hari ke-14
disensitisasi ulang menggunakan 1 ml OVA/tikus/i.p dari 2,5 mg
OVA yang dilarutkan pada 10 ml aquabides.
d. Hari ke-21, 23, 25, dan 27 tikus dipapar dengan ovalbumin aerosol
dari 50 mg ovalbumin dalam 5 ml aquabides dengan alat nebulizer
kecepatan 6 l / menit selama 20 menit.
3. Setelah perlakuan
Dua puluh empat jam setelah paparan terakhir, semua tikus
dikorbankan menggunakan teknik cervical dislocation. Bronkus tikus
diambil dan dibuat preparat dengan pengecatan HE. Preparat diamati
commit to user
4. Alur Penelitian
Gambar 3.2. Skema Alur Penelitian
L. Teknik Analisis Data
Data hasil penelitian berupa grade histologis saluran napas, dianalisis
secara statistik dengan menggunakan uji Kruskall-Wallis dan dilanjutkan Tikus Putih
Tikus dikorbankan dengan teknik cervical dislocation
Bronkus tikus diambil dan dibuat preparat dengan pengecatan HE
commit to user
dengan Post Hoc Test yaitu Mann-Whitney menggunakan program Statistical
Product and Service Solution (SPSS) 16.0 for Windows.
Kruskall-Wallis adalah uji non parametrik untuk membandingkan
perbedaan mean lebih dari dua kelompok dengan syarat kedua variabel
adalah skala kategorikal, sedangkan Mann-Whitney digunakan untuk
commit to user
BAB IV
HASIL PENELITIAN
A. Derajat Inflamasi Bronkus
Pada akhir penelitian ini, semua tikus dikorbankan menggunakan teknik
cervical dislocation. Bronkus masing-masing tikus diambil dan dibuat
preparat dengan pengecatan HE. Preparat diamati menggunakan mikroskop
cahaya dengan perbesaran 1000 kali untuk menentukan derajat inflamasinya.
Penilaian derajat inflamasi pada bronkus menggunakanan sistem grading
Myou et al. (2003).
Hasil pengamatan mikroskopis derajat inflamasi bronkus dengan
perbesaran 1000 kali pada masing-masing kelompok disajikan pada gambar di
bawah ini.
commit to user
Gambar 4.2. Gambaran Histologis Bronkus Grade 1 pada Kelompok K1 Keterangan : Sel radang sedikit dan hanya mencapai lamina mukosa.
Sel radang ditunjuk oleh arah panah
Gambar 4.3. Gambaran Histologis Bronkus Grade 3 pada Kelompok K2 Keterangan : Sel radang mencapai lamina propria hingga lamina submukosa.
commit to user
Gambar 4. 4. Gambaran Histologis Bronkus Grade 4 pada Kelompok K2 Keterangan : Sel radang mencapai lamina adventitia (lebih dari empat
lapisan). Sel radang ditunjuk oleh arah panah
Gambar 4.5. Gambaran Histologis Bronkus Grade 1 pada Kelompok K3 Keterangan : Sel radang sedikit dan hanya mencapai lamina mukosa.
commit to user
Gambar 4. 6. Gambaran Histologis Bronkus Grade 2 pada Kelompok K3 Keterangan : Sel radang banyak ditemukan pada lamina mukosa.
Sel radang ditunjuk oleh arah panah
Gambar 4.7. Gambaran Histologis Bronkus Grade 3 pada Kelompok K4 Keterangan : Sel radang mencapai lamina propria hingga lamina submukosa.
commit to user
Gambar 4. 8. Gambaran Histologis Bronkus Grade 4 pada Kelompok K4 Keterangan : Sel radang mencapai lamina adventitia (lebih dari empat
lapisan). Sel radang ditunjuk oleh arah panah
Gambar 4.9. Gambaran Histologis Bronkus Grade 1 pada Kelompok K5 Keterangan : Sel radang sedikit dan hanya mencapai lamina mukosa.
commit to user
Gambar 4.10. Gambaran Histologis Bronkus Grade 2 pada Kelompok K5 Keterangan : Sel radang banyak ditemukan pada lamina mukosa.
Sel radang ditunjuk oleh arah panah
Berdasarkan data yang diperoleh dapat dibuat histogram grading
inflamasi bronkus tikus pada tiap-tiap kelompok perlakuan.
Grafik 4.1. Prosentase Derajat Inflamasi pada Kelompok Kontrol (K1) 0%
20% 40% 60% 80% 100%
0 1 2 3 4
40%
60%
0% 0% 0%
commit to user
Grafik 4.2. Prosentase Derajat Inflamasi pada Kelompok Asma Alergi (K2)
Grafik 4.3. Prosentase Derajat Inflamasi pada Kelompok Asma Alergi + Antihistamin (K3)
Grafik 4.4. Prosentase Derajat Inflamasi pada Kelompok Asma Alergi + Ekstrak Propolis Dosis 100 mg/kg BB (K4)
commit to user
Grafik 4.5. Prosentase Derajat Inflamasi pada Kelompok Asma Alergi + Ekstrak Propolis Dosis 200 mg/kg BB (K5)
B. Analisis Data
Data yang diperoleh dalam tabel 4.1 selanjutnya dianalisis secara
statistik menggunakan uji Kruskall-Wallis untuk mengetahui ada tidaknya
perbedaan rerata lebih dari dua kelompok. Hasil uji Kruskall-Wallis yang
didapat (p = 0,001) menunjukan adanya perbedaan yang bermakna (p < 0,05)
pada sedikitnya dua kelompok perlakuan. Untuk mengetahui kelompok mana
yang memiliki perbedaan, maka harus dilanjutkan dengan Post Hoc Test yaitu
commit to user
Tabel 4.1. Hasij Uji Statistik Mann-Whitney Antarkelompok
Kelompok Perlakuan Nilai p Kemaknaan
K1 dengan K2 0.006 Signifikan
K1 dengan K3 0.093 Tidak signifikan
K1 dengan K4 0.007 Signifikan
K1 dengan K5 0.031 Signifikan
K2 dengan K3 0.005 Signifikan
K2 dengan K4 0.174 Tidak signifikan
K2 dengan K5 0.006 Signifikan
K3 dengan K4 0.014 Signifikan