49
BAB IV
SPEKTROSKOPI SINAR-X
4.1 Pendahuluan4.1.1 Deskripsi Singkat
Pada bagian ini hendak dibahas spektroskopi dan proses terjadinya sinar-X, fotoelektron, dan elektron Auger beserta beberapa aplikasinya.
4.1.2 Relevansi
Mahasiswa dapat mereview lagi proses terjadinya sinar-X termasuk efek fotolistrik inner elektron, di mata kuliah Fisika Modern. Aplikasi spektroskopi sinar-X ini sangat berguna untuk identifikasi bahan atau unsur material padat. Di dunia industri spektroskopi sinar-X juga berkembang pesat, terutama untuk identifikasi dan uji kualitas suatu bahan. Di dunia medis, aplikasi sinar-X berguna untuk pencitraan dan diagnostik.
4.1.3 Kompetensi
4.1.3.1 Standar Kompetensi
Setelah mempelajari bagian ini, mahasiswa dapat menjelaskan konsep dasar sinar-X karakteristik, Bremsstrahlung, elektron auger, sinar-X fluoresensi, spektroskopi sinar-X, beserta aplikasinya.
4.1.3.2 Kompetensi Dasar
Setelah mempelajari pokok bahasan ini mahasiswa dapat:
Menjelaskan perbedaan proses terjadinya sinar-X Bremsstrahlung dan sinar-X karakterisitik.
Menentukan jenis unsur dari deret sinar-X K, L, M
Menggunakan hukum Moseley untuk menentukan dan mengidentifikasi unsur
Menjelaskan proses terjadinya sinar-X fluoresensi,
Menjelaskan proses terjadinya absorpsi sinar-X oleh bahan,
Menentukan batas-batas tepi absorpsi sinar-X pada suatu bahan,
Menjelaskan proses terjadinya fotoelektron,
Menjelaskan proses terjadinya elektron Auger,
Menentukan energi ikat suatu unsur dari proses elektron Auger,
Menyebutkan dan menjelaskan beberapa contoh aplikasinya
50
4.2.1 Emisi Sinar-X
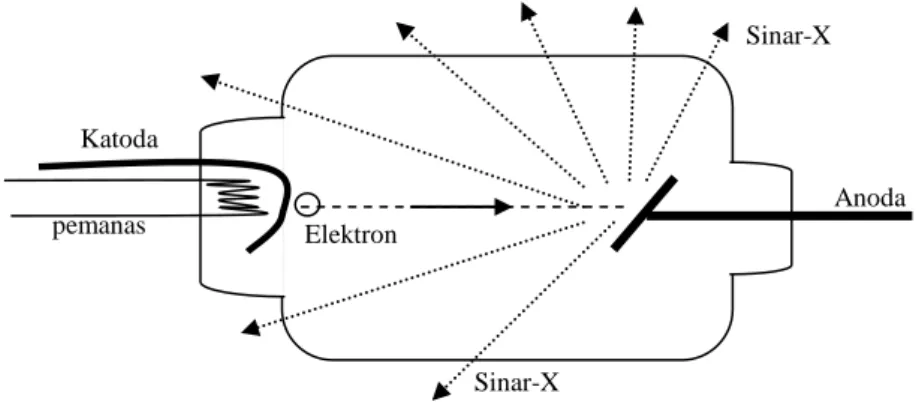
Sinar-X dapat dihasilkan bila suatu material padat ditembaki dengan elektron energi tinggi (orde 1 keV sampai 100 keV). Gambar 4.1 menunjukkan skema prinsip kerja peralatan penghasil sinar-X. Pancaran radiasi sinar-X dari pesawat sinar-X ini mempunyai daya tembus yang cukup tinggi, dan dapat dideteksi misal, dengan mengenakan pancaran foton itu pada plat film.
Gambar 4.1 prinsip kerja peralatan penghasil sinar-X. Dalam tabung hampa, katoda yang dipanasi menghasilkan elektron bebas. Beda potensial yang tinggi antara katoda dan anoda memaksa elektron bebas dari katoda dipercepat sehingga menumbuk anoda. Akibat tumbukan dengan elektron dengan atom-atom pada anoda, maka dihasilkan sinar-X.
4.2.1.1 Bremsstrahlung
Radiasi sinar-X yang dipancarkan dari pesawat sinar-X biasanya terdiri dari radiasi yang kontinyu (Bremsstrahlung) dan radiasi yang diskrit (karakteristik). Bremsstrahlung terjadi akibat elektron berenergi tinggi berinteraksi dengan atom, terutama medan inti. Akibatnya, kecepatan elektron mengalami perubahan arah dan pengurangan, atau dengan kata lain terjadi perlambatan. Menurut teori elektrodinamika, elektron yang mengalami percepatan atau perlambatan menghasilkan radiasi elektromagnetik yang nilainya kontinyu dari nol sampai suatu nilai maksimum. Skema proses pembentukan Bremsstrahlung dapat dilihat pada gambar 4.2.
Gambar 4.2 Skema terjadinya Bremsstrahlung. Elektron dengan energi awal E0 memasuki inti
atom (menumbuk material) sehingga mengalami pembelokkan dan perlambatan. Akibatnya diemisikan foton dalam bentuk sinar-X kontinyu atau yang dikenal dengan Bremsstrahlung.
Elektron dengan energi mula-mula E0
dipercepat menumbuk suatu material. Akibat pengaruh medan inti atom (nomor atom Ze) penyusun material itu, maka elektron mengalami pembelokan dan perlambatan. Akibatnya dihasilkan foton berenergi hf yang tidak lain adalah sinar-X
Anoda Katoda pemanas Elektron Sinar-X Sinar-X -e, E0 -e, E<E0 hf Ze
51 kontinyu atau yang dikenal dengan Bremsstrahlung. Elektron yang telah mengalami pembelokan energinya berkurang menjadi E. Energi foton atau sinar-X bernilai dari 0 – hfmaks, dengan fmaks berkaitan dengan energi maksimum sinar-X tergantung dari
besarnya beda potensial yang dikenakan, melalui persamaan
hf hfmaks = hc/min (4.1)
4.2.1.1 Sinar-X Karakteristik
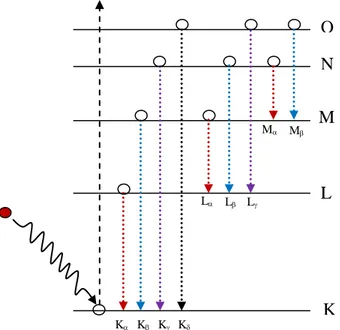
Radiasi sinar-X diskrit atau karakteristik dihasilkan dari transisi elektron yang mengisi kekosongan ruang elektron bagian dalam (terutama tingkat energi bagian dasar). Elektron bagian dalam yang ditembaki menggunakan elektron energi tinggi terlempar ke luar (atom tidak hanya tereksitasi, biasanya juga terionisasi). Kekosongan ruang pada bagian dalam ini segera terisi oleh elektron bagian atas disertai pelepasan energi tinggi dalam bentuk sinar-X. Karena energi ini bersesuaian dengan jarak antar level antara elektron yang jatuh ke orbit yang kosong, maka energi sinar-X bersifat diskrit atau karakteristik. Tingkat atom yang berbeda-beda, menghasilkan sinar-X diskrit ini juga berbeda-beda, sehingga memberikan nilai khas untuk unsur atau elemen dari bahan yang diselidiki. Gambar 4.3 menunjukkan skema transisi terjadinya sinar-X karakteristik.
Gambar 4.3 skema emisi sinar-X karakteristik.
Elektron berenergi tinggi menumbuk elektron dalam, pada kulit K, sehingga elektron kulit K terlempar ke luar mengakibatkan kekosongan pada kulit ini. Dalam keadaan tereksitasi atau terionisasi, elektron kulit L mengisi kekosongan tersebut disertai
K L M N O K K K K L L L M M
52 pancaran radiasi gelombang elektromagnetik dalam bentuk sinar-X. Kulit L yang sekarang kosong, bergantian, diisi oleh elektron kulit M disertai pancaran sinar-X yang lain, demikian seterusnya sehingga terdapat deret atau spektrum garis sinar-X yang diemisikan. Deret sinar-X yang dihasilkan akibat transisi ke kulit K disebut sinar-X K, K, K, K, dan seterusnya. Demikian pula deret sinar-X yang terjadi
akibat transisi ke kulit L disebut L, L, L, L, dan seterusnya, sesuai dengan label
kulit transisi level terakhir. Intensitas spektrum sinar-X K, dan K, biasanya mudah
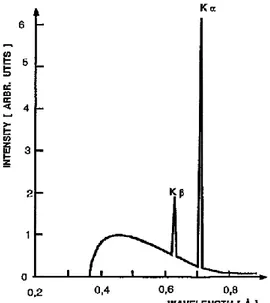
diamati. Gambar 4.4 adalah contoh spektrum sinar-X kontinyu dan karakteristik.
Gambar 4.4 contoh spektrum sinar-X kontinyu dan karakteristik menggunakan sebuah target dari bahan Mo yang dibombardir oleh elektron berenergi 35 keV (gambar disadur langsung dari referensi 1).
Tingkat-tingkat energi elektron bagian dalam tidak dipengaruhi oleh sifat lingkungan kimia dari atom-atom, sehingga emisi sinar-X karakteristik ini cocok untuk analisis unsur. Hubungan panjang gelombang sinar-X yang diemisikan merupakan fungsi nomor atom dari unsur target yang mengemisikan sinar-X, melalui hukum Moseley
-½
= C(Z - ) (4.1),
dengan C dan adalah konstanta-konstanta karakteristik dari spektrumnya. Karena
= c/, maka hukum Moseley pada persamaan 4.1 dapat ditulis lagi menggunakan besaran frekuensi
½ = A(Z – Z
0) (4.2),
dengan A dan Z0 konstanta. Nilai Z0 = 1 untuk sinar-X dari deret K, dan Z0 = 7,4
53 Contoh Soal:
1. Sebuah tabung televisi menggunakan tegangan pemercepat elektron sebesar 20 kV. Tentukan: (a) energi maksimum, dan (b) panjang gelombang minimum sinar-X yang dihasilkan.
Jawab:
Elektron dalam tabung televisi mempunyai energi kinetik 20 keV, dan bila ditumbukkan pada suatu target akan menghasilkan foton berupa sinar-X dengan (a) energi maksimum sebesar E = 20 keV, dan (b) panjang gelombang minimum foton sinar-X adalah = c/ = hc/h = 12,4 keV Å/20 keV = 0,62 Å.
2. Pada persamaan Moseley ½ = A(Z – 1), Manakah yang lebih besar, nilai A untuk K atau K?
Jawab:
Mengingat transisi K lebih besar dari K maka nilai A untuk K yang lebih besar.
3. Tentukan panjang gelombang sinar-X K untuk unsur Mo (Z = 42). Jawab:
Dari persamaan Moseley, ½ = A(Z – 1) = 4,97107 (42 – 1) = 2,04109.
= c/ = 3108/(2,04109)2 = 0,721 Å
4. Sebuah eksperimen mengukur panjang gelombang beberapa unsur dengan hasil sebagai berikut: Fe 1,94 Å; Co 1,79 Å; Ni 1,66 Å; Cu 1,54 Å. Tentukanlah nomor atom dari unsur-unsur tersebut. Asumsikan panjang gelombang foton yang dihasilkan termasuk dalam deret K.
Jawab:
Dari persamaan Moseley, -½ = C(Z – ) , didapat Z = (c/)½ C-1 + . Untuk deret K,
= 1, dan C = A/c½. Untuk A = 4,97107 Hz½ dan c½ = (3108)½ , maka Z dapat dihitung dengan hasil pada tabel berikut:
Unsur Fe Co Ni Cu
(Å) 1,94 1,79 1,66 1,54
Z 26 27 28 29
Metode lain untuk menghasilkan sinar-X adalah sinar-X fluoresensi. Sebuah target ditembak dengan sumber radiasi sinar-X, sehingga dihasilkan sinar-X yang baru namun energinya lebih rendah dari energi sinar-X sumber. Dengan kata lain, target menyerap sinar-X primer dan mengemisikan sinar-X sekunder. Salah satu cara untuk menentukan energi sinar-X yang dihasilkan adalah dengan
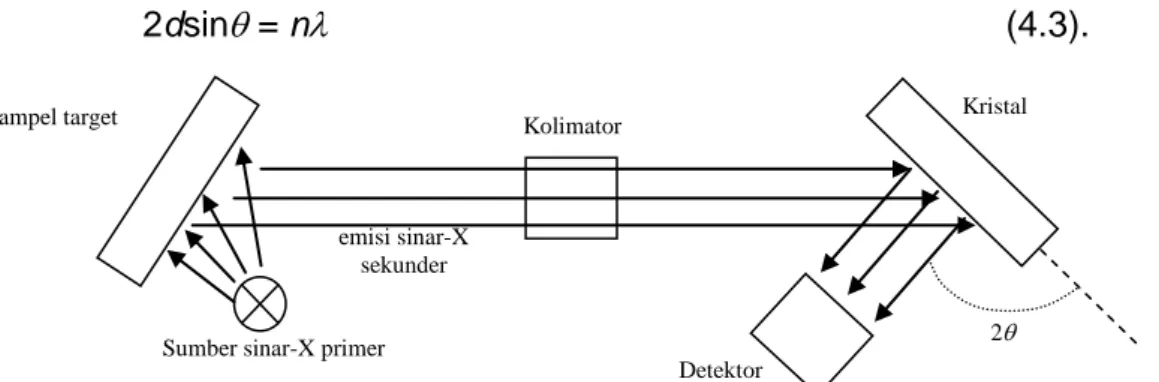
54 menggunakan spektrometer Fluoresensi sinar-X (gambar 4.5). Alat ini menggunakan prinsip difraksi Bragg, dimana sampel target yang ditembaki dengan sumber sinar-X menghasilkan sinar-X sekunder yang kemudian terkolimasi menuju kristal. Radiasi ini dapat ditangkap oleh detektor bila memenuhi hukum Bragg
2dsin = n (4.3).
Gambar 4.5 skema spektrometer sinar-X fluoresensi. Difraksi Brrag digunakan untuk menentukan sinar-X fluoresensi (sekunder).
Pada persamaan 4.2, n adalah orde difraksi, panjang gelombang sinar-X, d jarak bidang Bragg, dan sudut difraksi. Kristal yang digunakan dalam difraksi Bragg biasanya sudah diketahui jarak antar bidang Braggnya. Misalnya NaCl (d = 0,56 nm) atau LiF (d = 0,4 nm). Sistem untuk mensejajarkan sinar-X disebut sebagai kolimator yang terdiri dari plat logam tipis (50 m) yang disusun sejajar dengan jarak 0,5 mm. Sinar-X fluoresensi sangat cocok sebagai alat untuk mendeteksi elemen-elemen yang ada pada sampel berbentuk padat atau serbuk, berdasarkan energi dan intensitas yang terekam oleh detektor.
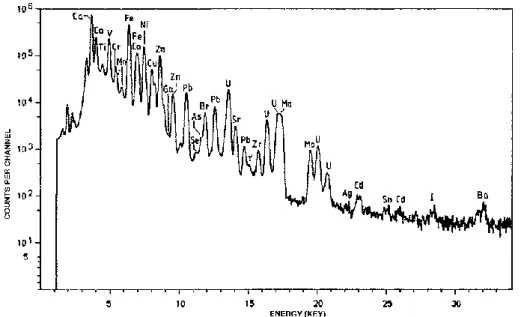
Sinar-X karakteristik dapat pula dihasilkan melalui partikel berat yang dipercepat semacam proton, kemudian dihantamkan pada sampel target, sehingga atom-atom target tereksitasi atau terionisasi, dan akhirnya dihasilkan sinar-X diskrit seperti yang sudah-sudah. Teknik semacam ini biasanya dinamakan PIXE (Particle-induced X-ray Emission). Kebolehjadian terjadinya kekosongan kulit pada elektron bagian dalam sangat tinggi bila digunakan proton berenergi beberapa MeV, sehingga sensitivitasnya lebih baik daripada teknik sinar-X fluoresensi. Hampir sebagian unsur (kecuali unsur ringan) dapat dideteksi dengan metode ini sampai batas konsentrasi 1 ppb. Detektor yang digunakan biasanya menggunakan material Si(Li), dimana tegangan yang terukur sebanding dengan energi sinar-X yang terdeteksi. Gambar 4.6 contoh spektrum sinar-X dengan teknik PIXE.
2 Kristal
Detektor Sampel target
Sumber sinar-X primer emisi sinar-X
sekunder
55 Gambar 4.6 contoh spektrum sinar-X dari material air laut dengan teknik PIXE.
Gambar disadur langsung dari referensi 1.
Banyak aplikasi dari penggunaan sinar-X kharakteristik ini, misal di bidang medis, lingkungan, pabrik semikonduktor dan monitoring sains forensik. Misal dengan memilih salah satu panjang gelombang, distribusi intensitasnya digunakan untuk pencitraan unsur-unsur yang berbeda-beda pada rambut manusia. Selain itu, dengan berbagai energi eksitasi, dapat dimanfaatkan untuk pengukuran kandungan logam-logam berat dalam kasus cemaran udara.
Contoh soal:
Pada kristal NaCl, diketahui jarak bidang Bragg sama dengan 2,82Å. Bila difraksi Bragg orde pertama terjadi untuk sinar-X K pada sudut 16, tentukan panjang
gelombang sinar-X tersebut. Jawab:
Dari persamaan 4.3, 2d sin = n maka = 2 d sin untuk n = 1 sebagai difraksi orde kesatu. Dengan memasukkan nilai d = 2,82 Å dan = 16, didapat = 1,54 Å.
4.2.2 Absorpsi Sinar-X
Salah satu aspek penting selain emisi sinar-X adalah absorpsi sinar-X. Dengan menggunakan sinar-X kontinyu, sampel menyerap energi sebagai fungsi panjang gelombang. Proses yang paling dominan terhadap serapan sinar-X adalah efek fotolistrik, efek Compton, dan produksi pasangan. Hanya saja untuk produksi pasangan, energi sinar-X harus lebih dari 1 MeV. Bila energi kurang dari 1 MeV,
56 intensitas sinar-X direduksi oleh dua proses saja, yakni efek fotolistrik (paling dominan) dan efek Compton. Intensitas sinar-X I setelah melewati suatu bahan sejauh x diberikan oleh persamaan
I = I0 e-kx (4.4)
dengan I0 intensitas sebelum melalui bahan, dan k koefisien serapan bahan yang
tergantung dari atom-atom penyusun bahan dan energi sinar-X. Elektron-elektron pada atom target mengalami eksitasi atau ionisasi sehingga menciptakan banyak level-level yang kosong. Semakin besar energi sinar-X, semakin besar elektron terionisasi sehingga menciptakan emisi elektron sampai batas ionisasinya. Dengan kata lain, absorpsi sinar-X terus berkurang dengan bertambahnya energi sampai menyamai energi ikat elektron dalam. Sampai batas ini elektron tiba-tiba mengalami efek fotolistrik yang berakibat meningkatnya koefisien absorpsi secara tajam. Pada level ini tercipta sebuah tepi absorpsi yang bersesuaian dengan energi ikat atom-atom target. Semakin besar energi sinar-X, maka nilai ambang emisi elektron akan terlampaui dan mengakibatkan terjadinya tepi absorpsi yang lain sesuai dengan level-level elektron dalam atom. Gambar 4.7 menunjukkan contoh tepi absorpsi sinar-X.
Gambar 4.7 contoh tepi absorpsi sinar-X. LI, LII, dan LIII adalah efek struktur halus pada level L.
Intensitas absorpsi berkurang secara drastis dengan bertambahnya energi sinar-X. Hal ini tercermin pada nilai koefisen absorpsi k. Pada gambar 4.5 terlihat bahwa koefisien absorpsi k sebanding dengan -3. Kenaikan nilai k yang sangat tajam terjadi pada energi ikat masing-masing elektron dalam dan karenanya menciptakan tepi-tepi absorpsi. Dengan mengukur energi-energi dari tepi absorpsi K, L, M dan seterusnya, dapat diperoleh energi ikat elektron bagian dalam. Karena tiap-tiap atom mempunyai nilai energi ikat yang berbeda-beda maka absorpsi sinar-X dapat dimanfaatkan untuk identifikasi unsur-unsur pada sampel padatan.
k K LI LII LIII M k -3
57 Aplikasi lain dari sinar-X adalah pencitraan medis, mikroskop sinar-X dan juga lithografi. Pada pencitraan medis berfungsi sebagai diagnostik organ-organ dalam tubuh makhluk hidup. Pada mikroskop sinar-X, diperoleh pencitraan untuk obyek-obyek nano yang lebih menguntungkan dari pada mikroskop optik konvensional. Sedangkan sinar-X untuk lithografi, berfungsi pada pembuatan alat-alat mikro elektronik di industri elektronik yang lebih menguntungkan dari pada menggunakan sinar UV, yakni resolusi yang diperoleh lebih tinggi.
4.2.3 Spektroskopi Fotoelektron
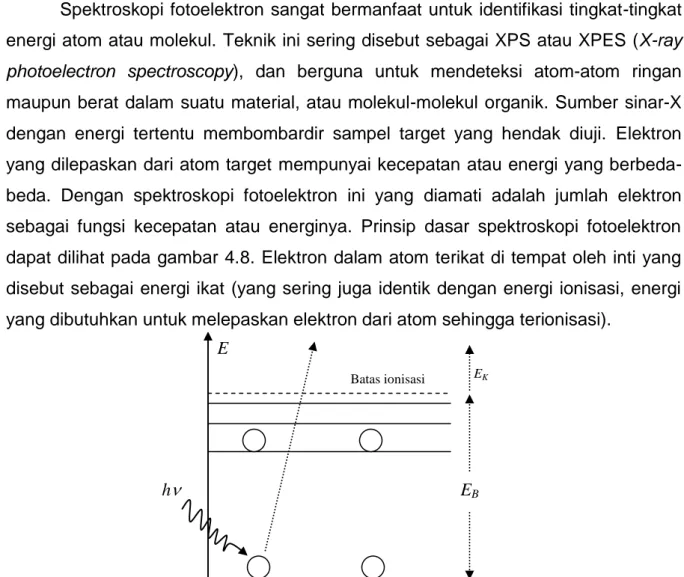
Spektroskopi fotoelektron sangat bermanfaat untuk identifikasi tingkat-tingkat energi atom atau molekul. Teknik ini sering disebut sebagai XPS atau XPES (X-ray photoelectron spectroscopy), dan berguna untuk mendeteksi atom-atom ringan maupun berat dalam suatu material, atau molekul-molekul organik. Sumber sinar-X dengan energi tertentu membombardir sampel target yang hendak diuji. Elektron yang dilepaskan dari atom target mempunyai kecepatan atau energi yang berbeda-beda. Dengan spektroskopi fotoelektron ini yang diamati adalah jumlah elektron sebagai fungsi kecepatan atau energinya. Prinsip dasar spektroskopi fotoelektron dapat dilihat pada gambar 4.8. Elektron dalam atom terikat di tempat oleh inti yang disebut sebagai energi ikat (yang sering juga identik dengan energi ionisasi, energi yang dibutuhkan untuk melepaskan elektron dari atom sehingga terionisasi).
Gambar 4.8 prinsip fotoelektron. Beberapa elektron digambarkan sebagai bulatan pada tingkat-tingkat energi tertentu.
Pada gambar, foton sinar-X dengan energi tertentu h menumbuk elektron pada bagian dasar. Elektron tersebut terpental sehingga atom terionisasi. Energi foton yang ditembakkan berkaitan dengan energi ikat elektron EB dan energi kinetik EK
saat elektron terlepas, oleh persamaan
EB
EK Batas ionisasi
E
58
EK = h - EB (4.5).
Pada kasus ini dianggap sebagian energi pental atom diabaikan. Sedangkan energi ikat EB tidak lain adalah selisih energi akhir Ef, dikurangi energi awal, Ei,
EB = Ef – Ei (4.6).
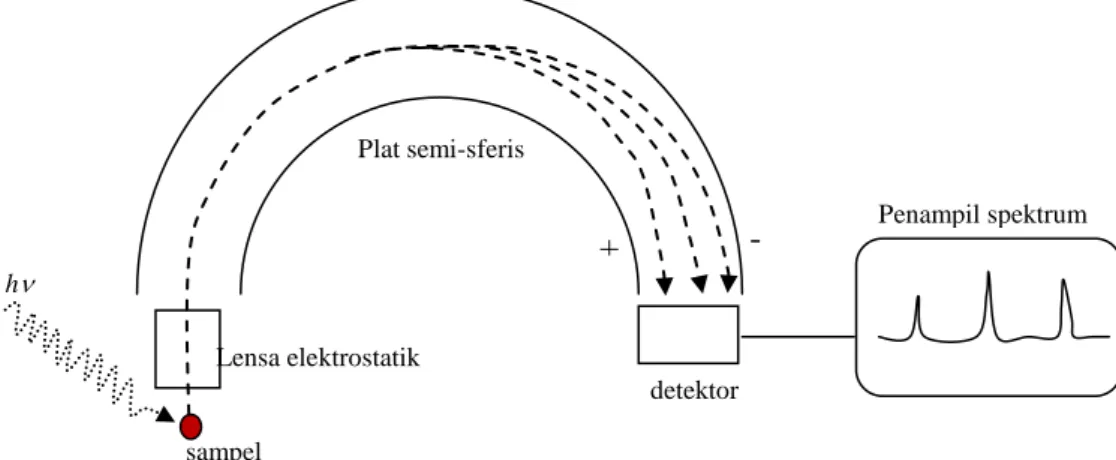
Contoh prinsip kerja peralatan yang menggunakan XPES dapat dilihat pada gambar 4.9 berikut.
Gambar 4.9 prinsip kerja spektrometer fotoelektron. Sampel ditembaki dengan foton berenergi tertentu. Elektron yang ke luar dilewatkan lensa elektrostatis memasuki plat elektrostatis semi-sferis. Energi elektron yang berbeda-beda tertangkap dengan detektor dan ditampilkan pada spektrum.
Contoh Soal:
1. Uranium mempunyai tepi absorpsi K sebesar 0,107 Å dan panjang gelombang K sama dengan 0,126 Å. Tentukan panjang gelombang untuk tepi absorpsi L.
Jawab:
Tepi absorpsi K tidak lain adalah energi ikat untuk kulit K, sebesar EBK = hc/BK =
12,4/0,107 = 115,9 keV. Sedangkan tepi absorpsi L diberikan oleh EBL = hc/BL
atau BL = hc/EBL. Skema transisinya dapat dilihat pada gambar berikut.
Dari transisi terlihat bahwa EBK – EBL = EL – EK dengan EL – EK tidak lain adalah
energi sinar-X K yang besarnya sama dengan hc/K = 12,4/0,126 = 98,4 keV. n = n = 1 n = 2 K = 0,126 Å EBK = 0,107 Å EBL = ? EK EL h sampel Lensa elektrostatik Plat semi-sferis detektor Penampil spektrum + -
59 Maka diperoleh tepi absorpsi L: EBL = 115,9 – 98,4 = 17,5 keV. Dengan demikian
panjang gelombang tepi absorpsi L adalah BL = hc/EBL = 0,709 Å.
2. Sebuah bahan dengan tepi absorpsi K sebesar 0,15 Å disinari dengan foton yang panjang gelombangnya 0,1 Å. Hitunglah energi kinetik elektron dari efek fotolistrik yang dihasilkan oleh kulit K.
Jawab:
Energi ikat elektrok kulit K adalah EBK = hc/BK = 12,4/0,15 = 82,7 keV. Energi
foton sebesar E = hc/ = 12,4/0,1 = 124 keV ini diserap oleh elektron kulit K, sisa energi diubah menjadi energi kinetik elektron maksimum sebesar Ekin = E – EBK
= 124 – 82,7 = 41,3 keV.
3. Sebuah foton dengan panjang gelombang 0,5 Å menumbuk material, sehingga dihasilkan fotoelektron dari kulit K dan teramati bergerak dalam lintasan lingkaran berjari-jari 23 mm dalam medan magnet 210-2 T. Tentukan energi ikat elektron kulit K tersebut.
Jawab:
Kecepatan elektron ditentukan dari gaya sentripetal elektron yang bergerak melingkar melalui persamaan mv2/r = qvB atau v = (q/m)Br. Dengan memasukkan nilai r, B dan q untuk muatan elektron diperoleh energi kinetik elektron Ekin = ½ mv2 = 2,9710-15 J = 18,6 keV.
Energi foton adalah E = hc/ = 12,4/0,5 = 24,8 keV.
Energi ikat elektron kulit K adalah EBK = E – Ekin = 24,8 – 18,6 = 6,2 keV. 4.2.4 Spektroskopi Elektron Auger
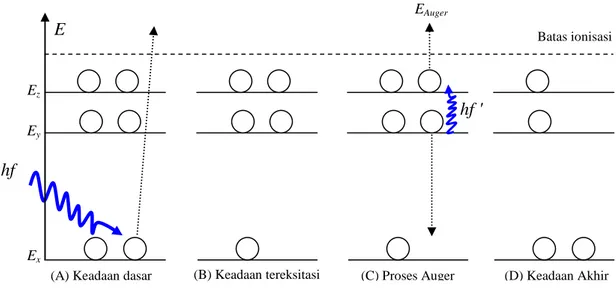
Elektron Auger terjadi berkaitan dengan elektron bagian dalam dari suatu atom. Proses terjadinya elektron Auger dapat dijelaskan seperti pada gambar 4.10 berikut. Gambar 4.10 (A), elektron pada keadaan dasar dengan energi Ex menerima
berkas foton sebesar h, sehingga elektron terpental yang berakibat atom dalam keadaan tereksitasi atau terionisasi seperti terlihat pada gambar 4.10 (B). Setelah itu terjadi proses elektron Auger, gambar 4.10 (C), elektron pada energi Ey mengisi
kekosongan tingkat energi Ex, sambil melepaskan energi dalam bentuk foton. Energi
foton ini segera diserap atau diterima oleh elektron bagian atas, Ez, sehingga
elektron terpental ke luar, yang akhirnya dinamakan elektron Auger dengan energi kinetik sebesar EAuger dipenuhi oleh persamaan
60 Gambar 4.10 Proses terjadinya elektron Auger
Gambar 4.10 (D) adalah keadaan akhir sesaat setelah terjadi proses elektron Auger, atom dalam keadaan terionisasi. Terlihat bahwa energi elektron Auger tak berkaitan langsung dengan energi foton datang yang ditembakkan ke sampel. Merujuk pada gambar 4.3 sebelumnya dan persamaan 4.5 dapat dikatakan bahwa elektron Auger sangat erat kaitannya dengan energi ikat elektron. Dengan Ey – Ex = EK, serta EB
energi ikat elektron pada level Ez, maka energi kinetik elektron Auger dapat ditulis
lagi menjadi
EAuger = EK - EB (4.8).
Kebolehjadian elektron Auger ternyata semakin besar untuk atom-atom ringan, sedangkan untuk atom-atom berat semakin kecil. Bila proses yang terjadi melibatkan kulit K untuk Ex, dan kulit L untuk Ey dan Ez, maka proses disebut elektron Auger
KLL. Lihat gambar 4.9.
Gambar 4.9 skema proses elektron Auger KLL
Contoh soal:
Pada atom Zn (Z = 30), energi ionisasi (energi ikat) dari elektron kulit K dan L masing-masing adalah 9,659 keV dan 1,021 keV. Tentukan energi kinetik elektron Auger yang diemisikan dari kulit L oleh foton sinar-X K.
L
K
Auger
h
(A) Keadaan dasar
EAuger Batas ionisasi E hf Ez Ey Ex
(B) Keadaan tereksitasi (C) Proses Auger (D) Keadaan Akhir
61 Jawab:
Energi elektron Auger diberikan oleh persamaan 4.8 EAuger = EBL - EK dengan EBL =
1,021 keV, EBK = 9,659 keV, dan EK = EBK – EBL = 8,638 keV. Diperoleh EAuger = EK
- EBL = 8,638 – 1,021 = 7,617 keV. 4.3 Latihan
1. Sebuah atom target dibombardir menggunakan elektron yang dipercepat melalui beda potensial 100 kV. Tentukan, berapa panjang gelombang minimal foton sinar-X yang dapat dipancarkan?
2. Seberkas sinar-X karakteristik K dipancarkan dengan panjang gelombang 0,786
Å. Tentukan usur sampelnya.
3. Dengan menggunakan model atom Bohr, buktikan bahwa nilai A pada hukum Moseley untuk sinar-X K diberikan oleh AK = 4,97107 Hz½ , dan untuk sinar-X
L diberikan oleh AL = 2,14107 Hz½.
4. Tepi absorpsi untuk unsur Y (Z = 39) adalah 0,7277 Å. Untuk memperoleh emisi sinar-X deret K, diperlukan sedikitnya potensial pemercepat elektron sebesar 17,039 kV. Tentukan nilai h/e dari data tersebut.
5. Tingkat-tingkat energi K, L, dan M untuk unsur Cu, Ni, dan Co diberikan pada tabel berikut. Radiasi K dari unsur Cu hendak difilter menggunakan bahan Ni
dan Co. Manakah bahan yang lebih efektif sebagai filter? Unsur Z EK (keV) EL (keV) EM (keV)
Cu 29 - 8,979 - 0,931 - 0,074 Ni 28 - 8,333 - 0,855 - 0,068 Co 27 - 7,709 - 0,779 - 0,060
4.4 Tes formatif (Pilihlah satu jawaban yang paling tepat).
1. Manakah dari unsur-unsur berikut yang paling mungkin menghasilkan radiasi sinar-X?
a. He b. Li c. C d. O e. Na
2. Diperlukan sebuah sampel padat sebagai target agar diemisikan sinar-X. Maka diperlukan sumber eksitasi berupa ...
a. Sumber sinar UV b. Sumber netron termal
62 c. Sumber elektron berenergi 1 – 100 eV
d. Sumber proton berenergi 1 – 10 keV e. Sumber sinar gamma
3. Manakah dari pernyataan berikut yang paling tepat sehingga sinar-X dapat diemisikan?
a. Elektron yang tereksitasi atau terionisasi adalah elektron terluar b. Elektron yang tereksitasi atau terionisasi elektron bagian dalam c. Elektron tidak harus tereksitasi ataupun terionisasi
d. Netron yang ditembaki sehingga ke luar dari atom e. Proton yang ditembaki sehingga proton terpental
ke luar
4. Perhatikan transisi pada gambar berikut. Jenis sinar-X yang dihasilkan pada proses ini adalah ...
a. K b. K c. L d. L e. M
5. Pada gambar berikut menampilkan puncak-puncak sinar-X karakteristik. Urutan yang paling tepat untuk puncak A, B, C, dan D berturut-turut adalah ...
a. K, K, K, L
b. L, K, K, K,
c. L, K, K, K,
d. K, K, K, L,
e. K, K, K, L,
6. Bila terjadi struktur halus, maka jumlah garis spektrum untuk sinar-X K adalah ...
a. 1 b. 2 c. 3 d. 4 e. 5
7. Transisi sinar-X untuk jenis L pada unsur Ca (Z = 20) adalah 30,1 Å. Nilai
konstanta A (dalam satuan SI) pada hukum Moseley adalah ...
a. 2,29106 b. 2,51106 c. 2,29107 d. 2,51107 e. 2,51108 8. Seberkas sinar-X yang diemisikan dari bahan tembaga mempunyai K = 1,54 Å,
K = 1,39 Å, dan tepi absorpsi BK = 1,38 Å. Foton tersebut melewati selembar
nikel yang mempunyai K = 1,66 Å, K = 1,50 Å, dan tepi absorpsi BK = 1,49 Å. L K M N I A B C D
63 Berapa panjang gelombang sinar-X yang dipancarkan dengan intensitas terbesar?
a. 4,03 Å b. 8,05 Å c. 4,03 nm d. 8,05 nm e.805Å
9. Pada persamaan Moseley, bagaimana kaitan antara konstanta C dan A? Diketahui c adalah laju cahaya dalam ruang hampa.
a. C = A c½, b. C = A/c½, c. C = Ac, d. C = A/c, e. C = A c ¼.
10. Pada suatu unsur, manakah yang lebih besar, energi ikat EBK atau energi
sinar-X EK?
a. EBK > EK
b. EK > EBK
c. EK EBK
d. Keduanya selalu sama
e. Bisa sama, bisa tidak (lebih kecil atau lebih besar)
11. Akibat radiasi sinar-X pada sampel, elektron diemisikan oleh sampel kemudian diteruskan melalui plat elektrostatis berbentuk semi sferis. Bila teramati tiga spektrum A, B, dan C, manakah
urutan energi dari kecil ke besar yang paling tepat?
a. A, B, C b. C, B, A c. B, A, C d. B, C, A
e. Ketiga elektron
energinya sama besar
12. Pada unsur Os dengan Z = 76, tepi absorpsi K dan L masing-masing 0,168 Å dan 1,17 Å. Berapa panjang gelombang sinar-X jenis K yang diemisikan?
a. 0,0196 Å b. 0,396 Å c. 0,196 Å d. 1,96 Å e. 19,6 Å h sampel Plat semi-sferis A + - B C
64 13. Pada unsur Ta (Z = 73) diketahui emisi sinar-X jenis K pada panjang
gelombang 0,216 Å dan tepi absorpsi L adalah 1,25 Å. Energi tepi absorpsi K sama dengan ... a. 0,674 keV b. 6,74 keV c. 67,4 keV d. 674 keV e. 6740 keV
14. Energi kinetik elektron Auger yang diemisikan oleh sinar-X K dari kulit L dari tepi absorpsi K 0,827 Å terukur sebesar 10,2 keV. Energi sinar-X K sama dengan ... a. 0,126 keV b. 0,63 keV c. 1,26 keV d. 6,3 keV e. 12,6 keV
15. Salah satu manfaat spektroskopi sinar-X adalah... a. Menentukan jarak antar molekul
b. Identifikasi unsur-unsur ringan pada molekul gas di suatu ruang c. Diagnostik organ tubuh bagian dalam
d. Komunikasi radio
e. Radar berfrekuensi tinggi
4.5 Umpan Balik
Apabila mampu menjawab minimal 8 (delapan) soal dengan benar, anda dianggap sudah menguasai pokok bahasan ini.
Tindak Lanjut
Mahasiswa diharapkan mereview struktur Molekul pada Bab III untuk mempelajari Bab V tentang spektroskopi Infra Merah.
4.6 Rangkuman
Emisi sinar-X dapat dihasilkan oleh tembakan-tembakan radiasi foton berupa sinar gamma atau sinar-X dan dapat juga tembakan-tembakan pada sampel menggunakan partikel berupa elektron atau proton energi tinggi. Radiasi sinar-X
65 yang kontinyu disebut Bremsstrahlung dan yang diskrit dinamakan sinar-X karakteristik. Emisi sinar-X diskrit oleh transisi ke kulit K disebut sinar-X K, K, dan
K, transisi ke kulit L disebut L dan L dan seterusnya. Emisi sinar-X oleh sampel
yang ditembaki dengan sumber sinar-X, disebut sinar-X fluoresensi, dengan energi yang diemisikan lebih rendah dari energi primernya. Dua proses yang berperan pada absorpsi sinar-X adalah efek fotolistrik dan Compton, dengan proses yang paling dominan adalah efek fotolistrik. Koefisien absorpsinya berkurang drastis dengan bertambahnya energi sinar-X pangkat tiga. Batas-batas dinsing absorpsi K, L, M dan sebagainya berkaitan dengan energi ikat elektron dalam pada kulit K, L, M dan seterusnya. Spektroskopi fotoelektron merupakan perkembangan dari efek radiasi sinar-X pada bahan. Identik dengan itu pula dapat dihasilkan elektron Auger. Transisi elektron ke kulit K, menghasilkan energi berupa foton namun diserap oleh elektron di tingkat atas, misal L, M dst. Elektron kulit L atau M ini terpental ke luar dan disebut sebagai elektron Auger. Aplikasi spektroskopi, selain dapat digunakan untuk identifikasi unsur-unsur dalam suatu bahan, juga berkembang laus di dunia industri logam, elektronika, forensik dan juga dunia medis, misal untuk diagnostik organ tubuh bagian dalam.
4.7 Kunci Jawaban Latihan dan Tes Formatif
Jawaban Tes Formatif
1. e 2. e 3. b 4. b 5. e 6. b 7. d 8. b 9. a 10. a 11. a 12. C 13. c 14. e 15. c
DAFTAR PUSTAKA
1. Sune Svanberg, Atomic and Molecular Spectroscopy, Springer Verlag, 1991
2. Colin N. Banwell & Elaine M. McCash, Fundamental of Molecular Spectroscopy, McGraw-Hill, 1994.
3. Anne P. Thorne, Spectrophysics, ELBS, 1988.
4. Haken & Wolf, Molekülphysik und Quantenchemie, Springer, 1997.
SENARAI
Elektron bagian dalam (inner): elektron pada kulit K, L, M atau N dalam sebuah atom
66 Bremsstrahlung: radiasi sinar-X yang dihasilkan akibat elektron cepat
diperlambat oleh medan di sekitar inti. Energi foton ini bersifat kontinyu
Sinar-X Kharakteristik: radiasi sinar-X diskrit yang dihasilkan oleh transisi elektron pada tingkat-tingkat energi dalam suatu atom atau unsur berat.
Sinar-X K, K: Sinar-X kharakteristik hasil dari transisi elektron dari kulit L ke
K (K), dan dari kulit M ke K (K)
Sinar-X L, L: Sinar-X kharakteristik hasil dari transisi elektron dari kulit M ke
L (L), dan dari kulit N ke L (L)
Sinar-X Fluoresensi: Sinar-X yang dihasilkan dari suatu sampel akibat dibombardir oleh X lain. Sinar-X yang diemisikan lebih rendah dari sinar-X sumber.
Absorpsi sinar-X: serapan intensitas sinar-X oleh suatu bahan
Tepi Absorpsi: batas energi absorpsi oleh akumulasi serapan intensitas sinar-X dalam suatu bahan yang naik secara drastis akibat efek fotolistrik. Tepi absorpsi bersesuaian dengan energi ikat elektron dalam pada kulit K, L, M dan seterusnya.
Spektroskopi Fotoelektron: emisi elektron bagian dalam akibat suatu material disinari dengan foton atau partikel energi tinggi
Elektron Auger: transisi elektron ke kulit dasar, mengakibatkan emisi elektron di kulit bagian atasnya.