LAPORAN PRAKTIKUM REKAYASA PROSES LAPORAN PRAKTIKUM REKAYASA PROSES PENGOLAHAN PANGAN DAN HASIL
PENGOLAHAN PANGAN DAN HASIL PERTANIANPERTANIAN
PERUBAHAN TEKSTUR DAN WARNA PADA WORTEL DENGAN
PERUBAHAN TEKSTUR DAN WARNA PADA WORTEL DENGAN
VARIASI SUHU 60°C, 70°C, 80°C, DAN 90°C
VARIASI SUHU 60°C, 70°C, 80°C, DAN 90°C PADA PEMANASAN
PADA PEMANASAN
SELAMA 10, 20, 30,40, DAN 50
SELAMA 10, 20, 30,40, DAN 50 MENIT MENGGUNAKAN
MENIT MENGGUNAKAN
UNIVERSAL TESTING MACHINE (UTM) DAN
UNIVERSAL TESTING MACHINE (UTM) DAN LOVIBOND
LOVIBOND
TINTOMETER
TINTOMETER
Disusun oleh : Disusun oleh : Olivia
Olivia Witrahno Witrahno Golongan Golongan II II / / 10 10 10/297348/TP/0967810/297348/TP/09678 Laurencia
Laurencia Lola Lola Karlina Karlina Golongan Golongan II II / / 10 10 10/297405/TP/0968410/297405/TP/09684 Tri
Tri Agung Agung Widyarizki Widyarizki Golongan Golongan II II / / 10 10 10/297406/TP/0968510/297406/TP/09685 Mustiko
Mustiko Warih Warih Golongan Golongan II II / / 10 10 10/297415/TP/0968610/297415/TP/09686 Chrisnila
Chrisnila Andriani Andriani Golongan Golongan II II / / 10 10 10/297417/TP/0968710/297417/TP/09687 Daniel
Daniel Yonan Yonan Golongan II Golongan II / / 10 10 10/297527/TP/0970210/297527/TP/09702
LABORATORIUM REKAYASA PANGAN DAN PENGOLAHAN HASIL PERTANIAN LABORATORIUM REKAYASA PANGAN DAN PENGOLAHAN HASIL PERTANIAN
JURUSAN TEKNOLOGI PANGAN DAN HASIL PERTANIAN
JURUSAN TEKNOLOGI PANGAN DAN HASIL PERTANIAN
FAKULTAS TEKNOLOGI PERTANIAN
FAKULTAS TEKNOLOGI PERTANIAN
UNIVERSITAS GADJAH MADA
UNIVERSITAS GADJAH MADA
YOGYAKARTA
YOGYAKARTA
2013
2013
PERUBAHAN TEKSTUR PADA WORTEL DENGAN VARIASI SUHU 60°C, PERUBAHAN TEKSTUR PADA WORTEL DENGAN VARIASI SUHU 60°C,
70°C, 80°C, DAN 90°C PADA PEMANASAN SELAMA 10, 20, 30,40, DAN 70°C, 80°C, DAN 90°C PADA PEMANASAN SELAMA 10, 20, 30,40, DAN 5050
MENIT MENGGUNAKAN UNIVERSAL TESTING
MENIT MENGGUNAKAN UNIVERSAL TESTING MACHINE (UTM)MACHINE (UTM)
I.
I. TUJUANTUJUAN
Menentukan nilai K, Ea, nilai D, dan nilai Z pada perubahan tekstur sampel wortel Menentukan nilai K, Ea, nilai D, dan nilai Z pada perubahan tekstur sampel wortel dengan perlakuan pemanasan suhu 60°C, 70°C, 80°C, dan 90°C selama 10, 20, dengan perlakuan pemanasan suhu 60°C, 70°C, 80°C, dan 90°C selama 10, 20, 30, 40, dan 50 menit menggunakan Universal Testing Machine (UTM)
30, 40, dan 50 menit menggunakan Universal Testing Machine (UTM)
II.
II. LANDASAN TEORILANDASAN TEORI
Kinetika dapat didefinisikan sebagai suatu ilmu yang terlibat dalam Kinetika dapat didefinisikan sebagai suatu ilmu yang terlibat dalam mempelajari kecepatan reaksi kimia beserta mekanisme reaksinya. Pemahaman mempelajari kecepatan reaksi kimia beserta mekanisme reaksinya. Pemahaman yang baik terhadap mekanisme reaksi kimia yang didukung dengan kemampuan yang baik terhadap mekanisme reaksi kimia yang didukung dengan kemampuan menghitung konstanta kecepatan akan memfasilitasi dalam pemilihan kondisi menghitung konstanta kecepatan akan memfasilitasi dalam pemilihan kondisi proses yang terbai
proses yang terbaik.k.
Kinetika reaksi dapat dinyatakan sebagai nilai K. Nilai K menunjukkan Kinetika reaksi dapat dinyatakan sebagai nilai K. Nilai K menunjukkan konstanta reaksi yang menunjukkan kecepatan reaksi. Nilai K makin besar maka konstanta reaksi yang menunjukkan kecepatan reaksi. Nilai K makin besar maka reaksi semakin cepat. Penambahan panas mempercepat tercapainya energi aktivasi reaksi semakin cepat. Penambahan panas mempercepat tercapainya energi aktivasi yang juga mempercepat reaksi perubahan tekstur pada sampel (wortel). Variasi yang juga mempercepat reaksi perubahan tekstur pada sampel (wortel). Variasi suhu maupun waktu juga sangat berpengaruh dalam perubahan tersebut (Anonim suhu maupun waktu juga sangat berpengaruh dalam perubahan tersebut (Anonim 1, 2012).
1, 2012). Nilai D
Nilai D merupakan merupakan waktu ywaktu yang diang diperlukan perlukan untuk untuk membunuh membunuh 90% mikrob90% mikrobiaia pada
pada suhu suhu tertentu tertentu (Stumbo, (Stumbo, 1973). 1973). Makin Makin tinggi tinggi suhu suhu memberikan memberikan nilai nilai D D yangyang makin kecil (Richardson, 2001). Pada praktikum, nilai D diasosiasikan terhadap makin kecil (Richardson, 2001). Pada praktikum, nilai D diasosiasikan terhadap waktu yang diperlukan untuk menurunkan satu
waktu yang diperlukan untuk menurunkan satu log cyclelog cycle tekstur yang nilainyatekstur yang nilainya ditera menggunakan alat
ditera menggunakan alat Universal Testing MachineUniversal Testing Machine (UTM). Nilai Z adalah suhu(UTM). Nilai Z adalah suhu yang diperlukan untuk menurunkan nilai D sebesar satu
yang diperlukan untuk menurunkan nilai D sebesar satu log cyclelog cycle. Nilai Z. Nilai Z biasanya
biasanya diasosiakan diasosiakan sebagai sebagai peningkatan peningkatan suhu suhu guna guna mempercepat mempercepat prosesproses destruksi mikrobia. Untuk mencapai hal ini, biasanya ditentukan terlebih dahulu destruksi mikrobia. Untuk mencapai hal ini, biasanya ditentukan terlebih dahulu nilai D pada suhu tertentu, lalu dicari delta suhunya pada keadaan satu
waktu yang diperlukan (Anonim 2, 2012). Pada praktikum, nilai Z adalah suhu waktu yang diperlukan (Anonim 2, 2012). Pada praktikum, nilai Z adalah suhu yang diperlukan untuk menurunkan nilai D tekstur sebesar satu
yang diperlukan untuk menurunkan nilai D tekstur sebesar satu log cyclelog cycle..
Adapun faktor – faktor yang mempengaruhi laju atau kinetika reaksi, yakni : Adapun faktor – faktor yang mempengaruhi laju atau kinetika reaksi, yakni : 1.
1. Aktivitas AirAktivitas Air Panas
Panas kering kering resistensi resistensi umumnya umumnya jauh jauh lebih lebih tinggi tinggi dari dari yang yang untuk untuk kondisikondisi basah, namun dengan pe
basah, namun dengan pengalengan konvenngalengan konvensional sangat jarang sional sangat jarang di gunakan.di gunakan. 2.
2. pH pH
pH kurang
pH kurang dari 4,5 dari 4,5 (tinggi asam produk)(tinggi asam produk), proses pasteurisasi y, proses pasteurisasi yang ang relatifrelatif ringan.
ringan. 3.
3. lipid dan bahan berminyak (dielektrik)lipid dan bahan berminyak (dielektrik) 4.
4. spesies ionspesies ion 5.
5. kekuatan ionkekuatan ion 6.
6. tingkat oksigentingkat oksigen 7.
7. asam organik dan antibiotikasam organik dan antibiotik
(Hersom and Hulland (1980) dan Vas (1970). (Hersom and Hulland (1980) dan Vas (1970).
III.
III. METODE PERCOBAANMETODE PERCOBAAN A. A. AlatAlat • • PisauPisau • • PenggarisPenggaris •
• Waterbath (heater)Waterbath (heater) •
• Universal Testing MachineUniversal Testing Machine (UTM) (UTM)
B. B. BahanBahan • • WortelWortel • • AirAir C.
C. Cara kerjaCara kerja
Pertama – tama wortel dipotong ukuran (3x2x1) cm sebanyak 21 potong. Pertama – tama wortel dipotong ukuran (3x2x1) cm sebanyak 21 potong. Kemudian penyiapan waterbath untuk masing – masing variasi suhu, yaitu 60°C, Kemudian penyiapan waterbath untuk masing – masing variasi suhu, yaitu 60°C, 70°C, 80°C, dan 90°C. Setelah selesai penyiapan, wortel yang telah dipotong 70°C, 80°C, dan 90°C. Setelah selesai penyiapan, wortel yang telah dipotong dimasukkan dalam masing – masing waterbath yang berbeda suhu. Dilakukan dimasukkan dalam masing – masing waterbath yang berbeda suhu. Dilakukan pengamatan
wortel dan diuji dengan Universal Testing Machine (UTM). Juga dilakukan pengujian sampel wortel sebelum dipanaskan ke waterbath dan dianggap sebagai
menit ke-0.
Hasil pengukuran tekstur dengan UTM selanjutnya dianalisis untuk dapat diperoleh nilai K dan Ea menggunakan Microsoft Excel, serta nilai D dan nilai Z dengan plotting data menggunakan kertas semilog.
IV. ANALISIS DATA
Teori kinetika selama pemanasan atau penurunan jumlah mikrobia selama pemanasan mengikuti persamaan :
C k dt dC
.
=!
...(1)Persamaan (1) di atas dapat diubah dalam bentuk :
dt k C dC
.
=!
...(2)Jika persamaan (2) di atas diintegralkan, maka diperoleh :
!
=!
" C C t dt k C dC 0 0(
ln 0) ( )
. 0 lnC C k t t!
=!
!
!
...(3) t k C C "ln = .! ln 0 ...(4) t k C C ! " = . ln 0 ...(5) t k C C e ! " = . log 0 ...(6) t k e C C " ! = . 0 ...(7)Metode Penentuan Konstanta Kinetika Reaksi
Perlu diketahui konsentrasi awal dan konsentrasi pada tiap selang waktu pada suhu tertentu. Dengan persamaan k t
C C ! " = . ln 0
, dapat dibuat garis linier ln(C/C0)
vs waktu (t) pada grafik Cartesius.
Dari grafik di atas, dapat diketahui nilai K pada suhu tertentu. Metode Kecepatan Reaksi dengan Persamaan Arrhenius
Penurunan konsentrasi (mikrobia maupun zat gizi) dipengaruhi oleh faktor misalnya, suhu, tekanan, dan laju reduksi. Dalam kinetika kimia, persamaan Arrhenius digunakan untuk menggambar laju atau konstanta laju.
RT E
e A
k =
.
! ...(8)Nilai A dapat dieliminasi, sehingga diperoleh : Persamaan Arrhenius : RT E e e r e e k k ! " #+ = log log log ...(10) RT E r k e k ! " # =
.
...(11)!
Ln (C/C0) Waktu (t) Slope = -k T R E k k r 1 . ln ln = # " ! …(9) y a b xWaktu (menit) Jumlah mikrobia ! " # $ % &! &" &!' &!# &!( &!$ D-value 4 menit Temperatur Jumlah mikrobia ! " # $!$ $!" z-value 10 C! %
Metode Penentuan D-value dan Z-value
D-value adalah waktu yang dibutuhkan untuk membunuh 90% mikroorganisme pada suhu tertentu atau waktu yang diperlukan untuk menurunkan 1 log cycle
mikroorganisme (Stumbo, 1973). Pada grafik semilog dapat diperoleh garis:
Berdasarkan definisi di atas, dapat diperoleh persamaan di bawah ini.
D t N N
!
log = log 0 ...(12) N N t D log log 0!
= ...(13) D t N N ! =10 0 ...(14)Z-value adalah suhu yang diperlukan untuk menurunkan D-value sebanyak 1 log cycle (Stumbo, 1973). Pada grafik semilog, dapat diperoleh garis:
Hubungan D-value dan Z-value dengan Teori Kinetika
Selain menggunakan grafik di atas, nilai D dapat dicari menggunakan cara lain. Saat D-value tercapai maka mikroorganisme atau konsentrasi yang tersisa adalah 10% (Stumbo, 1973).
Dengan menggunakan persamaan (7) dan (14):
kt D t e! ! = 10 ...(15) kt D t
!
=!
ln10 ...(14) D k = ln10 ...(15) D k = 2.303 ...(16) k D = 2.303 ...(17)V. HASIL DAN PEMBAHASAN
Tujuan dari percobaan ini adalah menentukan nilai K, nilai Ea, nilai-D, dan nilai-Z terhadap perubahan tekstur pada sampel wortel yang dipanaskan dengan variasi suhu 60°C, 70°C, 80°C, dan 90°C selama 10, 20, 30, 40, dan 50 menit.
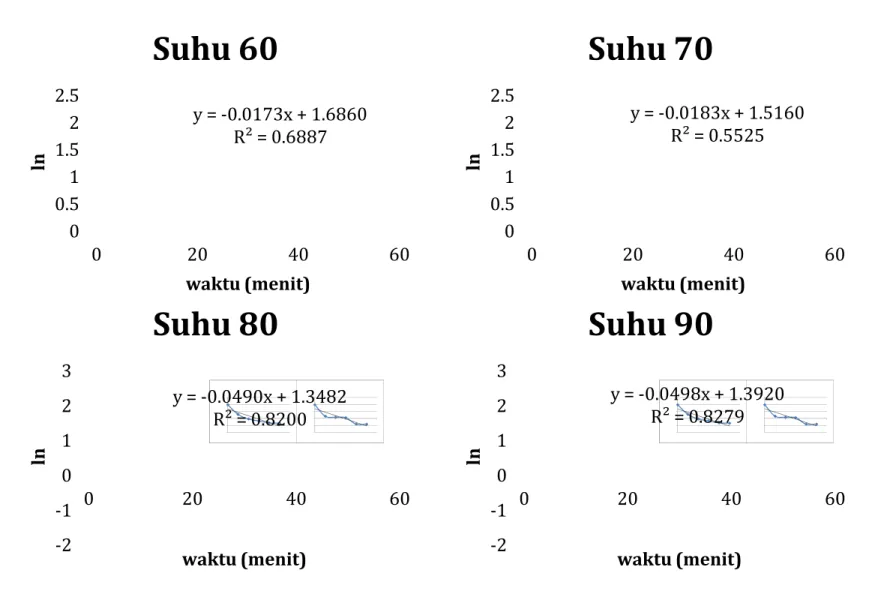
a) Penentuan nilai K (konstanta kinetika reaksi) Tabel 1. Nilai K Suhu (K) K (menit-1) 333 0.0173 343 0.0183 353 0.0490 363 0.0498
Nilai K merupakan konstanta reaksi yang menunjukkan kecepatan reaksi. Makin besar nilai K, makin cepat reaksi berlangsung. Pada hasil percobaan menunjukkan makin tinggi suhu, nilai K juga meningkat (nilai K pada 363K > 353K > 343K > 333K). Hasil ini s udah sesuai dengan teori.
b) Penentuan nilai Ea (Energi Aktivasi)
Ea atau energi aktivasi merupakan energi minimum yang diperlukan untuk terjadinya suatu reaksi. Jika energi minimum tidak tercapai maka tidak terjadi reaksi. Digunakan konsep Arrhenius dimana reaksi antara dua komponen terjadi jika terjadi tumbukan satu dengan yang lainnya. Jika tumbukan tersebut melewati energi minimum yang diperlukan untuk terjadinya suatu reaksi maka tumbukan tersebut akan menghasilkan komponen baru. Pada suhu rendah hanya sebagian kecil fraksi yang ikut berpartisipasi pada tumbukan sampai terjadinya suatu reaksi. Jika suhu meningkat maka energi molekul meningkat sampai di atas energi aktivasi minimum sehingga reaksi berjalan lebih cepat.
Dalam percobaan, diperoleh nilai Ea sebesar 41.765,7009 Joule/mol. Faktor yang berpengaruh terhadap nilai Ea dalam percobaan ini adalah ketebalan bahan. Semakin tebal bahan, kecepatan transfer panas turun, nilai Ea semakin besar. Nilai Ea yang membesar menunjukkan bahwa semakin banyak energy minimum yang dibutuhkan untuk melakukan reaksi. Jika dilakukan pada suhu rendah, reaksi akan berjalan lambat. Sementara pada suhu tinggi, reaksi akan berjalan lebih cepat karena energi molekul yang bertumbukan satu sama lain semakin besar. Pengaruh Energi Aktivasi (Ea) terhadap percobaan ini adalah terjadinya perubahan tekstur pada wortel. Bila Ea yang digunakan kecil, maka perubahan (penurunan tekstur) sebanyak 1 log cycle juga makin rendah. Dan sebaliknya bila Ea besar, maka penurunan tekstur 1 log cycle makin tinggi.
c) Penetuan nilai D
Nilai D adalah waktu yang diperlukan untuk menurunkan sifat tekstural berupa kekerasan sebanyak 1 logcycle pada sampel wortel dengan suhu (T)
tertentu. Berikut hasil nilai D.
Tabel 2. Nilai D Suhu (ºC) Nilai D grafik (menit) Nilai D rumus (menit) 60 128,5 133,1214 70 76,5 125,8470 80 80 47,0000 90 50 46,2450
Dari tabel hasil percobaan diatas, diperoleh data bahwa makin tinggi suhu, makin kecil nilai D (berbanding terbalik). Hal ini sudah sesuai dengan teori, bahwa semakin tinggi suhu yang digunakan dalam proses, semakin sedikit waktu yang dibutuhkan untuk menurunkan sifat tekstural dalam konteks ini kekerasan sebanyak 1 log cycle. Bila dibandingkan nilai D antara metode grafik dengan metode rumus/perhitungan, terdapat perbedaan yang cukup signifikan. Perhitungan nilai D rumus akan lebih akurat dibandingkan dengan nilai D grafik. Penentuan nilai D grafik bersifat subyektif tergantung pada ketelitian dalam mem-plotting titik dan membuat grafik.
Hubungan nilai D dengan konstanta kinetika reaksi yakni berbanding terbalik. Bila kenaikan nilai K berbanding lurus dengan kenaikan suhu dan kenaikan suhu berbanding terbalik dengan nilai D, maka nilai D berbanding terbalik pula dengan nilai K. Kecepatan reaksi meningkat seiring bertambahnya suhu, menyebabkan waktu yang dibutuhkan untuk menurunkan sifat kekerasan dari tekstur sebanyak 1 log cycle lebih singkat sehingga nilai D makin kecil.
d) Penentuan nilai Z
Nilai Z merupakan kisaran atau batasan suhu yang dibutuhkan untuk menurunkan jumlah mikrobia sebanyak 1 logcycle. (Estiasih & Ahmadi, 2009). Hasil nilai Z percobaan sebagai berikut.
Tabel 3. Nilai Z Nilai Z grafik (K) Nilai Z rumus (K) 69,5 55,5555
Dari hasil percobaan di atas diperoleh nilai Z rumus lebih kecil dibandingkan dengan nilai Z grafik. Perbedaan ini juga diakibatkan adanya pem-plottingan grafik secara subjektif.
Hubungan nilai D dengan nilai Z yaitu, makin meningkatnya suhu mengakibatkan turunnya nilai D yang diikuti penurunan nilai Z juga.
VI. KESIMPULAN
1. Nilai K pada suhu : 333K = 0,0173 menit-1; 343K = 0,0183 menit-1; 353K = 0,0490 menit-1; 363K = 0.0498 menit-1
2. Nilai Ea = 41.765,7009 Joule/mol
3. Nilai D metode grafik suhu 60°C = 128,5 menit; suhu 70°C = 76,5 menit; suhu 80°C = 80 menit; suhu 90°C = 50 menit. Sedangkan nilai D metode rumus atau perhitungan suhu 60°C = 133,1214 menit; suhu 70°C = 125, 8470 menit; suhu 80°C = 47 menit; suhu 90°C = 46,2450 menit
Keseluruhan : nilai D rumus > nilai D grafik 4. Nilai Z grafik = 69,5 K dan Z rumus = 55,5555 K
V. DAFTAR PUSTAKA
Hersom, A. C., & Hulland, E. D. 1980. Canned foods. Thermal processing and microbiology (7th Edition). Edinburgh: Churchill Livingstone.
Richardson, P. 2001. Fruit Process: Nutrition Product and Quality Management 2nd edition. Aspec Publication: Gaitthersburg.
Stumbo. 1973. Thermobacteriology in Food Processing . Academic Press: London. Vas, K. 1970. Problems of thermal processing. J. Appl. Bact., 33, 157–166.
Anonim1. 2012. F-Value. http://www.ellab.com/Applications/F-Value.aspx. diakses pada hari Sabtu, tanggal 20 Maret 2013 pukul 20.29 WIB
Anonim2. 2012. Kinetika kimia. http://www.chem-is-try.org/materi_kimia/kimia-smk/kelas_x/kinetika-kimia-definisi-laju-reaksi-dan-hukum-laju/. Diakses pada 20 Maret 2013 pukul 20.47 WIB
VI. LEMBAR PENGESAHAN
Yogyakarta, 21 Maret 2013
Mengetahui, Praktikan,
Asisten,
( ) (Olivia Witrahno)
(Laurencia Lola Karlina)
(Tri Agung Widyarizki)
(Mustika Warih)
(Chris Nila Andriani)
VII. LAMPIRAN Tabel Hasil Percobaan
Suhu °C Waktu (menit) 0 10 20 30 40 50 60 7.1308 3.0710 4.0544 3.1366 2.8027 2.3591 70 7.1308 2.6383 2.8356 2.1632 2.0408 2.4444 80 7.1308 1.7674 0.9128 0.6891 0.5217 0.5094 90 7.1308 1.3695 1.1784 1.1045 0.4285 0.4447 Tabel Hasil ln Suhu °C Waktu (menit) 0 10 20 30 40 50 60 1.9644 1.1220 1.3998 1.1431 1.0306 0.8583 70 1.9644 0.9701 1.0422 0.7716 0.7133 0.8936 80 1.9644 0.5695 -0.0912 -0.3724 -0.6507 -0.6745 90 1.9644 0.3144 0.1642 0.0994 -0.8475 -0.8104
# $ %&'&()*+ , ('-.-& /0 $ &'-..) & &'1 ( ('1 2 2'1
& 2& 3& -&
! " $%&'(
)*+",'-.(/( 01
# $ %&'&(.*+ , ('1(-& /0 $ &'1121 & &'1 ( ('1 2 2'1& 2& 3& -&
! " $%&'(
)*+",'-.(/( 21
# $ %&'&34&+ , ('*3.2 /0 $ &'.2&& %2 %( & ( 2 *& 2& 3& -&
! " $%&'(
)*+",'-.(/( 31
# $ %&'&34.+ , ('*42& /0 $ &'.2)4 %2 %( & ( 2 *& 2& 3& -&
! "
$%&'(
)*+",'-.(/( 41
Grafik waktu vs Ln pada masing-masing suhu:
Nilai K didapatkan dari –b dari persamaan y=bx+a dari grafik t vs ln diatas :
suhu (K) 1/T K ln K
333 3.003x10- 0.0173 -4.0570 343 2.2155x10- 0.0183 -4.0008 353 2.8329x10- 0.0490 -3.0159 363 2.7548x10- 0.0498 -2.9997
# $ %15&2*'.343+ , (&'4*24 /0 $ &'.2)2 %3'1 %3 %*'1 %* %2'1 %2 %('1 %( %&'1 &
&'&&2) &'&&2)1 &'&&2. &'&&2.1 &'&&24 &'&&241 &'&&* &'&&*&1
567 89 !" :
Dari tabel di atas, dibuat grafik 1/T vs ln K untuk menentukan nilai Ea
Nilai Ea = -b * R, -b didapatkan dari persamaan di atas, maka nilai Ea = 41765.7009 Joule/mol
Untuk menentukan nilai D pada masing – masing suhu, digunakan rumus :! !
!!!"! ! , sehingga diperoleh : • D333= !!!"! ! !!"#$ = 133.1214 • D343= !!!"! ! !!"#$ = 125.8470 • D353= !!!"! ! !!"#! = 47.0000 • D363= !!!"! ! !!"#$ = 46.2450
Setelah mendapat nilai D untuk masing
– masing suhu, nilai D di log-kan :
suhu (°C) D Log D
60 133.1214 2.1242
70 125.8470 2.0998
80 47.0000 1.6721
# $ %&'&(.(+ , *'233& /0 $ &'.2)2 & &'1 ( ('1 2 2'1
& 2& 3& -& .& (&&
; < = > .(/(
)?@-.(/( 89 ;<= >
6787 9: ;<= > ;?@ABC D6787 9: ;<= >ESetelah itu, diplotting suhu vs log D :
Dari persamaan tersebut, dicari nilai X1 dan X2 dengan rumus :! !
!!! ! ; dengan nilai untuk y1 = 1 dan y2 = 2. • X1 = !! !! !!"#! ! !!""# ! !"#
!
!"## • X2 = !!!!! !!"#!! ! !!""# ! !"!
!!"# Sehingga nilai Z : Z = 124.6722 – 69.1167 = 55.5555 KPERUBAHAN WARNA PADA WORTEL DENGAN VARIASI SUHU (60,70,80,dan 90oC) PADA PEMANASAN SELAMA 0,10,20,30,40,DAN 50
MENIT MENGGUNAKAN LOVIBOND TINTOMETER
I. TUJUAN
Mengetahui nilai konstanta reaksi (k), energi aktivasi (Ea), nilai D dan nilai Z pada penurunan intensitas warna merah dan kuning pada sampel wortel ( Daucus
carota) dengan Lovibond Tintometer dengan pemanasan suhu 60°C, 70ºC, 80°C, 90ºC selama 10,20,30,40,dan 50 menit.
II. LANDASAN TEORI
Kinetika reaksi dapat dinyatakan sebagai nilai K. Nilai K menunjukkan konstanta reaksi yang menunjukkan kecepatan reaksi. Nilai K makin besar maka reaksi semakin cepat. Penambahan panas mempercepat tercapainya energi aktivasi yang juga mempercepat reaksi perubahan warna maupun tektur pada sampel nanas. Variasi suhu maupun waktu memegang peranan penting dalam perubahan tersebut (Anonim1, 2012).
Nilai D adalah waktu yang diperlukan untuk membunuh 90% mikrobia pada suhu tertentu (Stumbo, 1973). Makin tinggi suhu memberikan nilai D yang makin kecil (Richardson, 2001). Pada praktikum, nilai D diasosiasikan terhadap waktu yang diperlukan untuk menurunkan satu log cycle warna yang nilainya ditera menggunakan alat ( Lovibond meter).
Nilai Z adalah suhu yang diperlukan untuk menurunkan nilai D sebesar satu log cycle. Nilai Z biasanya diasosiakan sebagai peningkatan suhu guna mempercepat proses destruksi mikrobia. Untuk mencapai hal ini, biasanya ditentukan terlebih dahulu nilai D pada suhu tertentu, lalu dicari delta suhunya pada keadaan satu log cycle waktu yang diperlukan (Anonim 2, 2012). Pada praktikum, nilai Z adalah suhu yang diperlukan untuk menurunkan nilai D tekstur
Faktor - Faktor yang mempengaruhi kinektika reaksi:
1
.
Aktivitas airPanas kering resistensiumumnya jauh lebih tinggi dari yang untuk kondisi basah, namun dengan pengalengan konvensional sangat
jarang di gunakan.
2
.
pHpH kurang dari 4,5 (tinggi asam produk), proses pasteurisasi yang relatif
ringan
3
.
lipid dan bahan berminyak bahan dielektrik4
.
spesies ion5
.
kekuatan ion6
.
tingkat oksigen7
.
asam organik dan antibiotik.(Hersom andHulland (1980) dan Vas (1970)
.
Menurut sumber lain, laju reaksi dipengaruhi oleh beberapa faktor, antara lain luas permukaan sentuh, suhu, katalis, molaritas, dan konsentrasi. Luas permukaan sentuh memperbesar kemungkinan kontak antara media, sehingga reaksi dapat berjalan secara serempak pada waktu yang bersamaan. Suhu tinggi menyebabkan partikel semakin aktif bergerak, sehingga terjadi lebih banyak tumbukan yang menyebabkan reaksi berlangsung. Katalis menyediakan alternative lain yang energy aktivasinya lebih rendah untuk media bereaksi. Molaritas dan konsentrasi memegang peranan dalam laju reaksi karena hubungannya dengan jumlah partikel yang terlarut. Makin banyak partikel artinya makin banyak kesempatan untuk bereaksi (Anonim 3, 2012).
III. METODE PERCOBAAN A. Alat
Lovibond tintometer 1 buah
Waterbath suhu 60,70,80,dan 90º 1 buah (masing-masing)
Kuvet 1 buah Nampan 1 buah Penjepit 1 buah Pisau 2 buah B. Bahan Wortel 21 potong Air secukupnya C. Cara Kerja
Dalam pengujian warna, yang pertama dilakukan yaitu mengupas dan memotong sampel wortel menjadi potongan-potongan kecil berbentuk balok dengan ukuran 3x2x1 cm (panjang x lebar x tinggi). Wortel untuk pengujian warna ini dibagi menjadi 21 potong.
Sampel dimasukkan ke dalam waterbath dengan suhu 60°C, 70°C, 80°C, 90 °C. Setiap waterbath diisi dengan 10 buah sampel untuk mewakili hasil pengujian pada variabel waktu yaitu 10,20,30,40,dan 50 menit. Sehingga, pada setiap waktu yang ditentukan tersebut diambil 2 buah sampel dari waterbath. Dari dua sampel tersebut, satu sampel untuk pengujian tekstur dan satu buah untuk warna, termasuk satu buah sampel yang digunakan sebagai kontrol sehingga tidak dilakukan pemanasan.
Tahap berikutnya yang dilakukan yaitu pengamatan waktu setiap 10 menit selama 50 menit, sampel diambil dan dianalisa warna dengan Lovibond tintometer. Dengan analisa ini, dapat diketahui pengaruh suhu dan waktu tertentu terhadap perubahan warna sampel. Penggunaan Lovibond dilakukan dengan pengecekan chamber untuk memastikan tidak ada sampel yang tertinggal pada
pemastian halon white standard bersih dan posisi sudah tepat. Sampel dimasukkan ke kuvet (kira-kira 1/3 kuvet), tempatkan di depan halon white standart dan sample chamber lid ditutup. Lalu amati sampel pada lubang yang terbagi menjadi dua bagian yaitu sample colour (kiri) dan matched colour (kanan). Yang harus dilakukan yaitu mengubah skala baik skala merah maupun kuning sehingga matched colour sesuai dengan sample colour. Setelah sampel diamati dan warna telah sesuai, skala merah dan kuning dicatat.
Hasil pengukuran yang diperoleh selanjutnya akan digunakan metode perhitungan sehingga diperoleh nilai k dan Ea. Sedangkan nilai D dan Z diperoleh
dari grafik semilog.
IV. ANALISIS DATA
Menurut Singh (2001), teori kinetika untuk degradasi zat gizi selama pemanasan atau penurunan jumlah mikrobia selama pemanasan mengikuti kinetika orde pertama yang memiliki persamaan:
C k dt dC
.
=!
...(1)Persamaan (1) di atas dapat diubah ke dalam bentuk:
dt k C dC
.
=!
...(2)Jika persamaan (2) di atas diintegralkan maka diperoleh persamaan:
!
=!
" C C t dt k C dC 0 0 ...(3)(
ln 0) ( )
. 0 lnC!
!
C = k t!
t!
...(3) t k C C "ln = .! ln 0 ...(4) t k C C ! " = . ln 0 ...(5) t k C C e ! " = . log 0 ...(6)t k e C C ! " = . 0 ...(7)
Metode Penentuan Konstanta Kecepatan Reaksi
Untuk menentukan konstanta kecepatan reaksi, harus diketahui konsentrasi awal dan konsentrasi pada tiap selang waktu tertentu pada suhu tertentu. Dengan
persamaan k t C C ! " = . ln 0
, dapat dibuat garis linier ln (C/C0) vs t pada grafik
Cartesius.
Dari grafik di atas dapat diketahui nilai k pada suhu tertentu. Hubungan Kecepatan Reaksi dengan Persamaan Arrhenius
Penurunan konsentrasi mikrobia atau zat gizi dipengaruhi oleh faktor-faktor luar bahan, misalnya suhu, tekanan, laju reduksi. Dalam kinetika kimia, persamaan
Arrhenius digunakan untuk menggambarkan konstanta laju.
RT E
e A
k =
.
! ...(8)Nilai A dapat dieliminasi, hingga diperoleh persamaan: Persamaan Arrhenius ...(9) y a b x RT E e e r e e k k ! " #+ = log log log ...(10) RT E r k e k ! " # =
.
...(11)F@ DGHG
&E
!
%I $ :F<JA
T R E k k r ln .1 ln = # " !Metode PenentuanEnergi Aktivasi
Dari beberapa k pada setiap variasi suhu tertentu, maka dapat digambarkan grafik hubungan nilai k dengan suhu. Dari persamaan
T R E k k t 1 . ln ln 0 ! " = , energi
aktivasi dapat dicari dengan membuat garis linier ln k vs 1/T.
R adalah konstanta gas, sebesar 8.314.10-3 kJ/mol.K, sehingga dari persamaan garis di atas dapat dicari nilai energi aktivasinya.
Ea= b*R B= slope
Metode Penentuan D-value dan Z-value
D-value adalah waktu yang dibutuhkan untuk membunuh 90% mikroorganisme pada suhu tertentu atau waktu yang diperlukan untuk menurunkan 1 log cycle
mikroorganisme (Stumbo, 1973). Pada grafik semilog dapat diperoleh garis:
Waktu (menit) Jumlah mikrobia ! " # $ % & ! & " & !' & !# & !( & !$ D-value 4 menit
F@ I
(HK
D(HLE
%MNH/ $ :F<JA
F@ I
&Berdasarkan definisi di atas, dapat diperoleh persamaan di bawah ini. D t N N
!
log = log 0 ...(12) N N t D log log 0!
= ...(13) D t N N ! =10 0 ...(14)Z-value adalah suhu yang diperlukan untuk menurunkan D-value sebanyak 1 log cycle (Stumbo, 1973). Pada grafik semilog, dapat diperoleh garis:
Temperatur Jumlah mikrobia ! " # $ !$ $ !" z-value 10 C! %
Hubungan D-value dan Z-value dengan Teori Kinetika
Selain menggunakan grafik di atas, nilai D dapat dicari menggunakan cara lain. Saat D-value tercapai maka mikroorganisme atau konsentrasi yang tersisa adalah 10% (Stumbo, 1973).
Dengan menggunakan persamaan (7) dan (14):
kt D t e! ! = 10 ...(15) kt D t
!
=!
ln10 ...(14) D k = ln10 ...(15) D k = 2.303 ...(16) k D = 2.303 ...(17)V. HASIL DAN PEMBAHASAN
A. WARNA MERAH
Tabel hasil nilai k
Nilai k merupakan konstanta reaksi. Nilai konstanta reaksi ini menunjukkan kecepatan reaksi sehingga semakin besar nilai-nya, semakin cepat reaksi terjadi. Seharusnya semakin tinggi suhu, nilai k yang diperoleh juga semakin besar. Hal ini disebabkan pada suhu rendah hanya sebagian kecil fraksi yang ikut berpartisipasi pada tumbukan sampai terjadinya suatu reaksi. Jika suhu meningkat, maka energi molekul meningkat sampai diatas minimum energi aktivasi sehingga reaksi berjalan lebih cepat. Juga sesuai dengan konsep Arrhenius dalam persamaan :! ! !"!!
!!"
!"! dengan R adalah konstanta gas ideal
(8.314 J/moloK); T adalah suhu (K); Ea adalah energi aktivasi (J/mol) dan k o
adalah konstanta Arrhenius. Hubungan antara konstanta kecepatan reaksi dengan suhu adalah eksponensial sehingga perubahan suhu akan berpengaruh sangat besar terhadap konstanta kecepatan reaksi (k).
Berdasarkan tabel, diperoleh hasil dengan nilai k yang berubah dan tidak beraturan pada setiap kenaikan suhu. Pada suhu 333,343,dan 353 K nilai konstanta reaksi yang diperoleh justru semakin menurun. Sedangkan pada 363 K, nilai k diperoleh meningkat dibanding sebelumnya. Hasil ini menunjukkan kecepatan reaksi di awal peningkatan suhu justru menurun, kemudian pada suhu 363 K kecepatan meningkat. Sehingga, hasil percobaan yang diperoleh tidak sesuai dengan teori (menyimpang) karena seharusnya semakin meningkatnya suhu dan makin lama waktu, makin tinggi kecepatan reaksi untuk pengurangan warna karena makin lama kontak dengan panas, bahan lebih mudah kehilangan warna.
Suhu (K) 1/T k 333 3.003 x 10-3 1.788 x 10-3 343 2.9154 x 10-3 - 2.6863 x 10-3 353 2.8329 x 10- - 6.7971 x 10 -363 2.7548 x 10- - 4.0766 x 10
-Adanya penyimpangan ini dapat disebabkan perbedaan persepsi dalam menentukan kesamaan warna pada Lovibond tintometer. Setiap orang memiliki persepsi berbeda, sehingga hasil yang diperoleh kurang akurat dan bersifat subjektif. Hal ini akan mempengaruhi skala warna yang diperoleh, yang akan juga mempengaruhi perhitungan dan diperoleh nilai k negatif. Nilai k yang negatif ini menyebabkan perhitungan selanjutnya untuk menghitung nilai D, Z, dan Ea tidak dapat dilakukan.
Ea (energi aktivasi) adalah energi minimum yang diperlukan untuk terjadinya suatu reaksi. Jika energi minimum tidak tercapai maka tidak terjadi reaksi. Digunakan konsep Arrhenius dimana reaksi antara dua komponen terjadi jika terjadi tumbukan satu dengan yang lainnya. Jika tumbukan tersebut melewati energi minimum yang diperlukan untuk terjadinya suatu reaksi maka tumbukan tersebut akan menghasilkan komponen baru. Pada reaksi yang lambat, tumbukan terjadi lambat sehingga tidak semua tumbukan akan terjadi suatu reaksi.
Energi aktivasi ditentukan dengan mengambil slope dari grafik yang menggambarkan hubungan 1/T (sumbu x) dan ln k (sumbu y), yang dikalikan dengan nilai R. Namun dalam percobaan nilai Ea tidak dapat ditentukan karena nilai k yang negatif sehingga perhitungan untuk mendapatkan nilai ln k tidak dapat dilanjutkan. Ea akan mempengaruhi reaksi pada bahan. Semakin kecil Ea, maka semakin kecil energi yang diperlukan untuk menurunkan warna sebanyak 1 log cycle. Semakin besar Ea, maka semakin besar pula energi yang diperlukan untuk menurunkan warna sebanyak 1 log cycle.
Nilai D adalah waktu yang diperlukan untuk menurunkan nilai intensitas warna pada sampel wortel sebanyak 1 logcycle suhu (T) tertentu. Nilai D ditentukan dengan rumus D = 2,303/k. Sehingga dapat dikatakan nilai D berbanding terbalik dengn nilai k. Hal ini menunjukkan jika semakin besar nilai D maka semakin kecil nilai k. Atau semakin lama waktu yang diperlukan untuk menurunkan intensitas warna sebesar 1 log cycle semakin kecil nilai konstanta kecepatan reaksi untuk menurunkan intensitas warna pada suhu tertentu.
Nilai Z adalah jumlah suhu yang diperlukan untuk menurunkan nilai D sebanyak 1 log cycle. Nilai Z ini dapat diperoleh dengan 2 cara yaitu dengan metode perhitungan dan metode grafik (dengan kertas semilog).
Tabel hasil nilai D
Suhu (ºC ) D (menit)- grafik D (menit)-perhitungan
60 93
-70 101
-80 170
-90 65
-Berdasarkan tabel, diperoleh pada metode perhitungan, nilai D tidak dapat ditentukan. Hal ini disebabkan nilai k yang negatif, dan perhitungan tidak dapat dilanjutkan. Sehingga nilai Z yang berhubungan dengan D (dari persamaan yang menyatakan hubungan log D dan suhu) juga tidak dapat ditentukan dengan perhitungan. Sedangkan dengan metode grafik, nilai D yang diperoleh tidak dapat ditentukan tren nya. Hal ini karena semakin tinggi suhu pemanasan, nilai D naik pada suhu 60,70,dan 80 ºC, lalu mengalami penurunan pada suhu 90ºC. Hal ini
tidak sesuai teori, seharusnya nilai D akan semakin kecil dengan seiring dengan meningkatnya suhu. Hal ini disebabkan semakin tinggi suhu kecepatan reaksi akan semakin tinggi dan waktu yang diperlukan untuk menurunkan intensitas warna semakin sedikit/singkat. Dengan demikian seharusnya urutan nilai D yang diperoleh adalah D 60ºC>D 70ºC>D 80ºC>D 90ºC. Nilai Z dengan grafik diperoleh sebesar 94.5°C.
Nilai Z merupakan suhu yang diperlukan untuk menurunkan nilai D sebanyak 1 log cycle. Sedangkan D merupakan waktu yang diperlukan untuk menurunkan intensitas warna sebanyak 1 log cycle pada masing masing variasi suhu. Hubungan keduanya yaitu dalam penentuan nilai Z diperlukan nilai D pada masing-masing variasi suhu. Selanjutnya melalui plotting dapat dilihat penurunan nilai D seiring meningkatnya suhu pemanasan sehingga dapat ditentukan berapa rentang suhu yang diperlukan untuk menurunkan nilai D sebesar 1 log cycle.
B. WARNA KUNING Tabel hasil nilai k :
Nilai k merupakan konstanta reaksi. Nilai konstanta reaksi ini menunjukkan kecepatan reaksi sehingga semakin besar nilai-nya, semakin cepat penurunan warna terjadi. Hubungan antara konstanta kecepatan reaksi dengan suhu adalah eksponensial sehingga perubahan suhu akan berpengaruh sangat besar terhadap konstanta kecepatan reaksi.
Pada percobaan diperoleh tiga nilai k yang negatif, yaitu pada suhu 343,353,dan 363 K. Nilai yang negatif ini menunjukkan bahwa semakin lama waktu pemanasan, kecepatan reaksi makin rendah. Hal tersebut tidak sesuai dengan teori, seharusnya semakin lama waktu reaksi, makin tinggi kecepatan reaksi untuk pengurangan warna karena makin lama kontak dengan panas, bahan lebih mudah kehilangan warna. Adanya penyimpangan ini dapat disebabkan perbedaan persepsi dalam menentukan kesamaan warna pada Lovibond tintometer. Setiap orang memiliki persepsi berbeda, sehingga hasil yang diperoleh kurang akurat dan bersifat subjektif. Hal ini akan mempengaruhi skala warna yang diperoleh, yang akan juga mempengaruhi perhitungan dan diperoleh nilai k negatif. Nilai k yang negatif ini menyebabkan perhitungan selanjutnya untuk menghitung nilai D, Z, dan Ea tidak dapat dilakukan.
suhu (K) 1/T k 333 3.003 x 10-3 0.0184 343 2.9154 x 10-3 -0.0268 353 2.8329 x 10-3 -0.0459 363 2.7548 x 10-3 -2.4154 x 10-3
Energi aktivasi ditentukan dengan mengambil slope dari grafik yang menggambarkan hubungan 1/T (sumbu x) dan ln k (sumbu y), yang dikalikan dengan nilai R. Namun dalam percobaan nilai Ea tidak dapat ditentukan karena nilai k yang negatif sehingga perhitungan untuk mendapatkan nilai ln k tidak dapat dilanjutkan. Ea akan mempengaruhi reaksi pada bahan. Semakin kecil Ea, maka semakin kecil energi yang diperlukan untuk menurunkan warna sebanyak 1 log cycle. Semakin besar Ea, maka semakin besar pula energi yang diperlukan untuk menurunkan warna sebanyak 1 log cycle.
Tabel nilai D
Suhu (ºC ) D (menit)- grafik D (menit)-perhitungan
60 36
-70 60
-80 51.5
-90 66.85
-Berdasarkan tabel, diperoleh pada metode perhitungan, nilai D tidak dapat ditentukan. Hal ini disebabkan nilai k yang negatif, dan perhitungan tidak dapat dilanjutkan. Sehingga nilai Z yang berhubungan dengan D (dari persamaan yang menyatakan hubungan log D dan suhu) juga tidak dapat ditentukan dengan perhitungan. Sedangkan dengan metode grafik, nilai D yang diperoleh tidak dapat ditentukan tren nya. Di awal yaitu pada 70ºC nilai D mengalami peningkatan, kemudian pada suhu 80ºC menurun, namun meningkat lagi pada suhu 90ºC. Hal ini tidak sesuai teori, seharusnya nilai D akan semakin kecil dengan seiring dengan meningkatnya suhu. Hal ini disebabkan semakin tinggi suhu kecepatan reaksi akan semakin tinggi dan waktu yang diperlukan untuk menurunkan intensitas warna semakin sedikit/singkat. Dengan demikian seharusnya urutan nilai D yang diperoleh adalah D 60ºC > D 70ºC > D 80ºC > D 90ºC. Nilai Z pada warna kuning dengan grafik diperoleh sebesar 165°C.
Nilai Z merupakan suhu yang diperlukan untuk menurunkan nilai D sebanyak 1 log cycle. Sedangkan D merupakan waktu yang diperlukan untuk menurunkan intensitas warna sebanyak 1 log cycle pada masing masing variasi
suhu. Hubungan keduanya yaitu dalam penentuan nilai Z diperlukan nilai D pada masing-masing variasi suhu. Selanjutnya melalui plotting dapat dilihat penurunan nilai D seiring meningkatnya suhu pemanasan sehingga dapat ditentukan berapa rentang suhu yang diperlukan untuk menurunkan nilai D sebesar 1 log cycle.
KETERKAITAN ANTAR 3 ACARA :
Keterkaitan antara ketiga acara dalam praktikum ini yaitu bahwa pada acara distribusi panas medium yang digunakan adalah air dan steam. Setelah diperoleh hasilnya, media pemanas yang baik adalah steam. Hal ini karena steam memiliki pengikatan panas yang tinggi dibanding air. Pada sterilisasi pemanasan tidak boleh dilakukan terlalu lama, oleh karena itu pada acara sterilisasi media pemanas yang digunakan adalah steam. Distribusi panas akan mempengaruhi sterilisasi karena faktor media mempengaruhi kecepatan sterilisasi. Sterilisasi menggunakan steam yang dilakukan pada sampel wortel akan mempengaruhi sifak fisik wortel sebagai sampel. Dan faktor dari pemanasan dengan menggunakan berbagai suhu dan waktu akan berdampak pada sifat fisik dari sampel akan diamati pada praktikum kinetika reaksi. Kinetika reaksi akan mempengaruhi proses sterilisasi
karena semakin tinggi nilai Z, semakin kecil nilai Lethal Rate-nya. Pada acara kinetika reaksi, dapat diketahui konstanta laju perubahan tekstur dan warna.
VI. KESIMPULAN
a) Warna Merah
• Nilai k warna merah pada suhu 333 K = 1,788 x 10-3, suhu 343 K =
-2,6863 x 10-3, suhu 353 K= -6,7971 x 10-3, suhu 363 K = -4,0766 x 10-3. Urutan intensitas nilai k warna merah pada sampel wortel pada suhu 353 K < 363 K < 343 K < 333 K.
• Nilai Ea tidak dapat ditentukan karena terdapat nilai k yang negatif.
• Berdasarkan plotting grafik, diperoleh nilai D warna merah yaitu D80°C
(170 menit) > D70ºC (101 menit) > D60°C (93 menit) > D90º (65 menit). Sedangkan berdasarkan perhitungan tidak dapat ditentukan karena terdapat nilai k yang negatif.
• Berdasarkan plotting grafik, nilai Z yang diperoleh adalah 94.5°C.
Sedangkan berdasar perhitungan tidak dapat ditentukan karena terdapat nilai k yang negatif.
b) Warna Kuning
• Nilai k warna kuning pada suhu 333 K = 0,0184, suhu 343 K = -0,0268,
suhu 353 K = -0,0459, suhu 363 K = -2,4154 x 10-3. Urutan intensitas nilai k warna Kuning pada sampel wortel adalah pada suhu 363 K < 353 K < 343 K < 333 K.
• Nilai Ea tidak dapat ditentukan karena terdapat nilai k yang negatif.
• Berdasar plotting grafik semilog, diperoleh nilai D warna kuning pada
D90°C (66.85 menit) > D70ºC (60 menit) > D80°C (51.5 menit) > D60º (36 menit). Sedangkan dengan metode perhitungan, nilai D tidak dapat ditentukan karena terdapat nilai k yang negatif.
• Berdasar plotting grafik, nilai Z yang diperoleh adalah 165ºC. Sedangkan
berdasar perhitungan tidak dapat ditentukan karena terdapat nilai k yang negatif.
VII. DAFTAR PUSTAKA
Anonim1. 2012. Kinetika kimia. http://www.chem-is-try.org/materi_kimia/kimia-smk/kelas_x/kinetika-kimia-definisi-laju-reaksi-dan-hukum-laju/. Diakses pada 21 Maret 2013 pukul 16.00 WIB.
Anonim 2. 2012. Z Value. http://en.wikipedia.org/wiki/Z-value. Diakses pada 21 Maret 2013 pukul16.10 WIB.
Anonim3. 2012. Laju Reaksi. http://id.wikipedia.org/wiki/Laju_reaksi. Diakses pada 21 maret 2013, 17.00
Hersom, A. C., & Hulland, E. D. 1980. Canned foods. Thermal processing and microbiology (7th Edition). Edinburgh: Churchill Livingstone.
Richardson, P. 2001. Fruit Process: Nutrition Product and Quality Management 2nd edition. Aspec Publication: Gaitthersburg.
Singh, R.P. 2001. Introduction to food Engineering . California:Academic Press
.
Stumbo, C. R. 1973. Thermobacteriology in food processing (2nd Edition). NewYork:Academic Press.
VIII. LEMBAR PENGESAHAN
Yogyakarta, 21 Maret 2013
Mengetahui, Praktikan,
Asisten,
( ) (Olivia Witrahno)
(Laurencia Lola Karlina)
(Tri Agung Widyarizki)
(Mustika Warih)
(Chris Nila Andriani)
IX. LAMPIRAN (Metode Perhitungan) Warna Merah Suhu Waktu 0 10 20 30 40 50 60 7 10 10 8 7 8 70 7 10 10 8 8 10.1 80 7 8.2 9 9 10 10 90 7 10 10 7 10 10 Suhu ln hasil 0 10 20 30 40 50 60 1.9459 2.3026 2.3026 2.0794 1.9459 2.0794 70 1.9459 2.3026 2.3026 2.0794 2.0794 2.3125 80 1.9459 2.1041 2.1972 2.1972 2.3026 2.3026 90 1.9459 2.3026 2.3026 1.9459 2.3026 2.3026 y = bx + a k = -b Suhu 60°C y = (-1.788 x 10-3)x + 2.154 k = 1.788 x 10-3 Suhu 70°C y = (2.6863 x 10-3) x + 2.1032 k = - 2.6863 x 10-3 Suhu 80°C y = (6.7971 x 10-3)x + 2.0050 k = - 6.7971 x 10-3 Suhu 90°C y = (4.0766 x 10-3)x + 2.0818 S k= - 4.0766 x 10-3
Suhu (K) 1/T k ln k 333 3.003 x 10- 1.788 x 10- - 6.3267 343 2.9154 x 10- - 2.6863 x 10- -353 2.8329 x 10- - 6.7971 x 10- -363 2.7548 x 10- - 4.0766 x 10-
- Nilai D, Z, dan Ea tidak bisa ditentukan karena nilai k bernilai negatif.
Grafik (suhu vs ln hasil)
Grafik 1/T vs ln k tidak dapat digambar karena perhitungan yang tidak dapat dilanjutkan (nilai k negatif sehingga ln k tidak dapat dihitung).
:787 -& O # $ %&'&&(.+ , 2'(13 :787 )& O # $ &'&&2)+ , 2'(&*2 :787 .& O # $ &'&&-.+ , 2'&&1 :787 4&O # $ &'&&3(+ , 2'&.(. &
( 2 *
& (& 2& *& 3& 1& -&
! " $ % & ' ! $%&'(
)*+",'-A%B"% C+B%/ D EB%F,& $%&'( 89 !"
/%9,!
:787 -& :787 )& :787 .& :787 4& ;?@ABC D:787 -&E ;?@ABC D:787 -&E ;?@ABC D:787 .&EWarna Kuning Suhu Waktu 0 10 20 30 40 50 60 3 99.9 30 9 9.9 4.2 70 3 5 9 9 4.1 22 80 3 4 8 4.9 99 12 90 3 9 9.9 9 3 7 Suhu ln hasil 0 10 20 30 40 50 60 1.0986 4.6402 3.4012 2.1972 2.2925 1.4315 70 1.0986 1.6094 2.1972 2.1972 1.4110 3.0910 80 1.0986 1.3863 2.0794 1.5892 4.5951 2.4849 90 1.0986 2.1972 2.2925 2.1972 1.0986 1.9459 y = bX + a k = -b Suhu 60°C y = -0.0184x + 2.9660 k = 0.0184 Suhu 70°C y = 0.0268x + 1.2650 k= - 0.0268 Suhu 80°C y = 0.0459x + 1.0579 k= - 0.0459 Suhu 90°C y = (5.9888. 10-3x) + 1.8265 k= - 5.9888. 10-3
Suhu (K) 1/T k ln k 333 3.003 x 10-3 0.0184 -3.9954
343 2.9154 x 10-3 -0.0268
-353 2.8329 x 10- -0.0459
-363 2.7548 x 10- -2.4154 x 10-
- Nilai D, Z, dan Ea tidak dpat ditentukan karena nilai k negatif. Grafik (suhu vs ln hasil)
Grafik 1/T vs ln k tidak dapat digambar karena perhitungan yang tidak dapat dilanjutkan (nilai k negatif sehingga ln k tidak dapat dihitung).
:787 -&O # $ %&'&(..+ , 2'4.&3 :787 )&O # $ &'&2-.+ , ('2-1
:787 .&O # $ &'&314+ , ('&1)4 :787 4&O # $ &'&&23+ , (')33-& &'1 ( ('1 2 2'1 * *'1 3 3'1 1
& (& 2& *& 3& 1& -&
! " $ % & ' ! $%&'(
)*+",'-A%B"% :(","= D EB%F,& $%&'( 89 !" /%9,!
:787 -& :787 )& :787 .& :787 4& ;?@ABC D:787 -&E ;?@ABC D:787 )&E ;?@ABC D:787 .&E