1 DISERTASI
PEMBENTUKAN TANAMAN TRIPLOID JERUK SIAM SIMADU (Citrus nobilis Lour) MELALUI KULTUR ENDOSPERMA
MIA KOSMIATIN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
RINGKASAN
MIA KOSMIATIN. Pembentukan Tanaman Triploid Jeruk Siam Simadu (Citrus nobilis
Lour.) melalui Kultur Endosperma. Dibimbing oleh AGUS PURWITO, GUSTAAF
ADOLF WATTIMENA, IKA MARISKA.
Buah tanpa biji merupakan salah satu kriteria yang diperlukan untuk dapat meningkatkan kualitas buah jeruk. Perakitan tanaman jeruk Siam tanpa biji dapat dilakukan dengan membentuk tanaman triploid. Pembentukan tanaman triploid melalui persilangan interploidi belum dapat dilakukan karena belum tersedianya tanaman jeruk tetraploid. Tanaman jeruk triploid tidak mampu membentuk embrio fertil, sehingga dapat digunakan sebagai alternatif produksi buah tanpa biji. Secara in vitro, perakitan tanaman triploid dapat dilakukan dengan meregenerasikan jaringan endosperma yang secara alami triploid. Regeneran dari jaringan endosperma diharapkan juga merupakan tanaman triploid.
Tujuan akhir dari penelitian ini adalah mendapatkan tanaman triploid jeruk Siam Simadu yang diperoleh dari kultur jaringan endosperma. Ada 4 tahapan penelitian yang dilakukan untuk memperoleh tanaman jeruk Siam Simadu triploid.
Studi perkembangan endosperma sebagai eksplan dalam kultur endosperma Siam Simadu. Penelitian dilakukan untuk mengetahui tahapan perkembangan endosperma yang dapat dikulturkan secara in vitro. Bahan tanaman yang diamati adalah buah muda yang berumur 2-14 minggu setelah antesis. Pengamatan dilakukan terhadap morfologi buah, preparat segar dan kering dari biji. Hasil penelitian menunjukkan bahwa endosperma dapat diisolasi dari buah yang berumur 10-14 minggu setelah antesis. Jaringan pada tahapan ini sudah mengalami selulerisasi dan secara bertahap membentuk jaringan endosperma yang kompak dan dapat diisolasi serta dipisahkan dari embrio zigotik dan embrio nuselar. Pada minggu ke-14 setelah antesis, jaringan endosperma habis terserap oleh embrio, lapisan endosperm yang tertinggal hanya di bagian periferal yang menempel pada integumen dalam. Perkembangan embrio nuselar yang tidak serempak dan masih terbentuk sampai minggu ke-13 setelah antesis, dan jaringan haploid yang tidak terdegradasi dapat menjadi kontaminan pada kultur endosperma.
Induksi embriogenesis somatik dan pembentukan tanaman triploid dari berbagai tahapan perkembangan jaringan endosperma jeruk Siam Simadu (Citrus nobilis Lour). Penelitian dilakukan untuk mendapatkan teknik in vitro yang dapat meregenerasikan jaringan endosperma membentuk tanaman triploid. Bahan tanaman yang digunakan adalah jaringan endosperma yang berumur 10-14 minggu setelah antesis yang diisolasi secara aseptik dengan bantuan mikroskop binokular perbesaran 40x. Hasil penelitian menunjukkan bahwa jaringan endosperma yang berumur 11-13 minggu setelah antesis dapat diinduksi pembentukan kalusnya dengan respon terbaik diperlihatkan oleh endosperma yang berumur 13 minggu setelah antesis dan dikulturkan pada medium MS modifikasi vitamin MW dengan penambahan 0.1 mg L-1 biotin atau 500 mg L-1 sumber N-organik (ekstrak malt atau kasein hidrolisat). Kalus yang dihasilkan dari jaringan endosperma ploidinya miksoploid sehingga regenerasinya dilakukan dengan embriogenesis somatik untuk menghindari terbentuknya tanaman miksoploid. Pendewasaan embrio somatik terbaik dilakukan pada media tanpa penambahan zat pengatur tumbuh tetapi lebih padat (dari 2.5 menjadi 3 mg L-1 phytagel). Pada media yang dipadatkan, embrio somatik dewasa berkembang normal dan embrio somatik dapat berkecambah sehingga tidak diperlukan media khusus untuk perkecambahan. Planlet disubkultur pada media dengan penambahan 2.5 mg L-1 GA3 untuk memanjangkan tunasnya. Penambahan kinetin eksogen diperlukan untuk menekan pertumbuhan kalus embriogenik yang terbentuk pada pangkal tunas meskipun tidak dapat meningkatkan pertambahan tinggi tunas.
Perbanyakan klonal tunas in vitro yang diregenerasikan dari jaringan endosperm jeruk Siam Simadu. Penelitian dilakukan untuk mendapatkan formulasi media dan populasi tunas in vitro yang diregenerasikan dari jaringan endosperma. Bahan tanaman yang digunakan adalah tunas pucuk yang diperoleh dari embriogenesis somatik yang diinduksi dari jaringan endosperma. Tunas pucuk dikulturkan pada media regenerasi dan diamati pembentukan tunas normal dan pembentukan tunas adventif secara langsung. Hasil penelitian menunjukkan bahwa pada media MT, pertumbuhan tunas abnormalnya lebih tinggi dibandingkan media MS modifikasi vitamin MW. Penambahan Kinetin, BA dan NAA pada kedua media dasar yang dicoba hanya mampu menginduksi sedikit pembentukan tunas adventif dan bukunya sehingga dilakukan kembali perbanyakan klonal dengan menambahkan TDZ pada media MS modifikasi. Penambahan 0.1 mg L-1 TDZ dan 1 mg L-1 kinetin pada medium perbanyakan, dapat meningkatkan rerata pembentukan tunas adventif 2.15±1.34 dan buku 2.90±1.51.
Keragaman sitologi dan morfologi tunas in vitro yang diregenerasikan dari jaringan endosperma jeruk Siam Simadu. Penelitian dilakukan untuk mengevaluasi keragaman dari tunas in vitro yang diinduksi dari jaringan endosperma dan untuk mengetahui populasi tunas triploid yang diperoleh. Bahan tanaman yang digunakan adalah 52 tunas in vitro normal yang berhasil diperoleh dari meregenerasikan jaringan endosperma. Pengamatan keragaman sitologi dilakukan terhadap tingkat ploidi dan jumlah kromosom dari tunas in vitro. Tingkat ploidi ditentukan dengan mengukur kandungan DNA pada inti dari jaringan daun in vitro menggunakan flow cytometry. Penghitungan jumlah kromosom dilakukan dengan metode
squash yang dilakukan pada ujung akar in vitro. Keragaman morfologi diamati pada bentuk
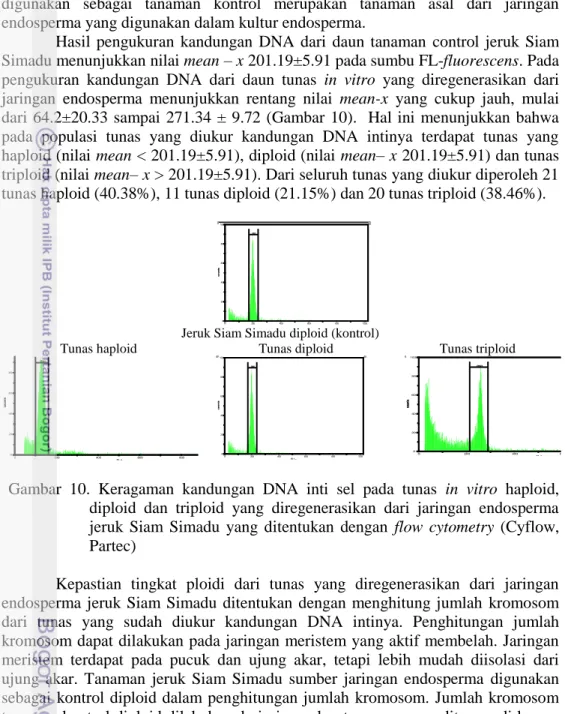
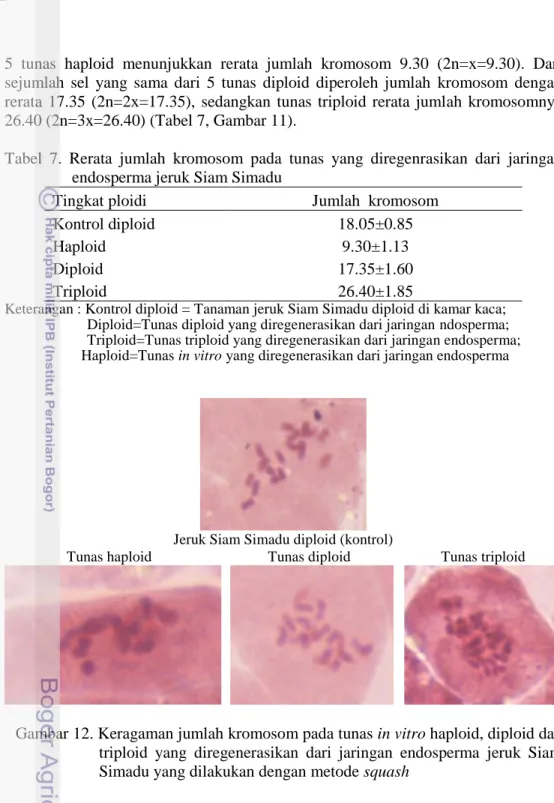
daun dan stomata daun. Tanaman kontrol untuk seluruh pengamatan adalah tanaman jeruk Siam Simadu diploid dan tunas in vitro jeruk Siam Simadu. Hasil pengamatan menunjukkan bahwa dari 52 tunas in vitro yang diregenerasikan dari jaringan endosperma diperoleh 21 tunas haploid, 11 diploid dan 20 triploid. Penentuan tingkat ploidi dapat dilakukan dengan menghitung jumlah kromosom, kandungan DNA inti dan jumlah kloroplas pada sel penjaga.
Kata kunci : Citrus nobilis Lour., jeruk Siam Simadu, embriogenesis somatik, tanaman jeruk haploid, jeruk tanpa biji
SUMMARY
MIA KOSMIATIN. Triploid Plant Formation of Tangerine (Citrus nobilis Lour) Var Simadu Through Endosperm Culture. Supervised by AGUS PURWITO, GUSTAAF ADOLF WATTIMENA, IKA MARISKA.
Seedless fruit is one of the criteria necessary to improve the quality of citrus. Traditionally, formation of seedless citrus plant is difficult due to the barriers of sterility gametes which are owned by gene sources of seedless citrus to be transfer to Simadu tangerine. The formation of a triploid plant from a interploidy crossing could not be done because tetraploid citrus plants is not available. Triploid citrus is unable to form the fertile seeds, so it can be used as an alternative to the production of seedless fruits. In vitro, formation of triploid plant can be aimed by regenerate endosperm tissue that is naturally triploid. Shoots obtained from endosperm tissue expected also to be a triploid plant.
The aim of this research was to obtain triploid Simadu tangerine derived from culture of endosperm tissue. There were four stages of research conducted to accomplish the research objective.
Study of Developmental stage of endosperm tissue of Simadu tangerine. Research conducted to determine the developmental of endosperm tissue that could be cultured in
vitro. Plant materials observed was a young fruit from 2 to 14 weeks after anthesis (WAA).
The observation was made against fruit morphology, fresh and preserved slice of seeds. The observation was performed with a stereo and inverted microscope. The results showed that endosperm tissues could be isolated from the fruit of 10-14 weeks after anthesis. This tissue had formed cell walls and gradually form compactendosperm tissues and could be isolated and separated from zygotic and nucellar embryos.
Induction of somatic embryogenesis and formation of triploid plants derived from
varied developmental stages of endosperm tissue of Simadu tangerine (Citrus Nobilis Lour). Research conducted to obtained in vitro technique that could be regenerated endosperm tissue to forming triploid plants. A plant material was an endosperm tissue that was isolated from 10-14 WAA fruit. Endosperm tissues isolated with a binocular microscope with 40x magnification. The results showed that the endosperm tissues from 11-13 WAA could be induced the formation of embryogenic callus with best response shown by endosperm tissue that was 13 WAA and cutured on MS medium modified by MW vitamine. Mixoploid Calli was resulted from the endosperm tissues so the regeneration should be done by somatic embryogenesis. Somatic embryogenesis could be avoiding formation of mixoploid plants. Maturation of somatic embryos cultured on solid medium and 3 g L-1 phytagel without addition of plants growth regulators. Plantlets sub cultured on the same media with the addition of 2.5 mg L-1 GA for shoots elongation.
Clonal Multiplication of in vitro shoots that regenerated from endosperm tissue of Simadu tangerine. The research was done to obtain the medium formulation and population of in vitro shoots that regenerated from endosperm tissue. Plant material was shoots that obtained from the somatic embryogenesis derived from endosperm of tissue. Shoots cultured on multiplication medium and observed formation of normal shoots and directly of adventives shoots. The results showed that the MT medium (medium for in vitro culture of citrus), was growth of abnormal shoots higher than a MS medium by vitamin MW modified. Addition of Kinetin, BA and NAA on both basic media only slightly induces the formation of adventitious shoots and its node, consequently shoot multiplication was cultured on MS medium and MW modified vitamins with the addition of thidizuron. On this medium, there
was increased of adventitious shoots formation and nodes, successively 2.15±1.34 and 2.90±1.51.
Cytology and morphology variation of in vitro shoots derived from Simadu tangerine endosperm tissues. Research conducted to evaluated variation of in vitro shoots derived from endosperm tissue and amount of triploid shoots. Plants material were 52 in
vitro normal shoots derived from endosperm tissues.The cytology variation measured were
the ploidy level and chromosome number of in vitro shoots. Determination of ploidy level was determined by measuring of nuclear DNA content of in vitro leaves by flow cytometry (Partec Cyflow). Chromosome counting was done by squash method on the tip of the in
vitro root. Morphology variables observed was in vitro leaves and stomata. Control plant
used for the observation was diploid plant of Simadu tangerine and in vitro shoots derived from nucellar embryo sprouts. The observation showed thatfrom 52 regenerated shoot from endosperm tissues there were: 21 haploid (40.38%), 11 diploid (21.15%) and 20 triploid shoots (38.46%). Determination of ploidy level were done by counting of chromosome, nuclear DNA and chloroplast number of stomata guard cells.
Till the end of this dissertation writing, the embryonic cells of endosperm tissues keep on regenerate shoots. Continously sub cultured of embryos and abnormal shoots at eight weeks interval on medium free plant growth regulators will produce normal shoots. It showed that endosperm tissue culture could be produced more than 52 normal shoots.
Key words : Citrus nobilis Lour., Simadu tangerine, somatic embryogenesis, citrus haploid plants, seedless citrus
PRAKATA
Rasa syukur senantiasa dipanjatkan penulis kehadirat Illahi Rabbi, atas izin-Nya penulis dapat menyelesaikan penelitian dan penulisan disertasi. Adapun judul disertasi adalah Pembentukan Tanaman Triploid Jeruk Siam Simadu (Citrus nobilis
Lour) melalui Kultur Endosperma.
Ucapan terimakasih dan penghargaan setingi-tingginya penulis sampaikan kepada yang terhormat Dr. Ir. Agus Purwito, MSc.Agr, Prof. Dr. Ir. Gustaaf Adolf Wattimena, MSc.Agr dan Prof(R). Dr. Ir. Ika Mariska, APU, atas dedikasi, curahan waktu, tenaga, buah pikiran, nasehat-nasehat serta arahan-arahannya terutama semangat yang terus dikobarkan dari awal perencanaan sampai selesainya penulisan disertasi ini. Ucapan terimakasih juga disampaikan kepada Kepala Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian dan Kepala Badan Litbang Pertanian yang sudah memberikan izin dan beasiswa kepada penulis untuk menempuh pendidikan di Sekolah Pascasarjana IPB. Tidak lupa saya haturkan penghargaan yang tidak terhingga kepada kedua orang tua, bapak HE Kosasih dan mamah Hj R Tedjaningsih, suami dan anak-anak ku tersayang, Dr. Ali Husni, MSi, Aphylla Planifolia Harp, Aulia Floribunda Harp dan Muhammad Houzni Rafsanzani Harp, Kakak-kakak dan adik-adikku Iwan Ahmad Koswandi, Dr. Tatan Kostaman, MU, Yandi Kosmayadi dan Isman Kosmantara yang senantiasa memberikan doa, semangat, perhatian dan dukungannya kepada penulis selama ini. Tidak lupa penulis berterimakasih kepada teman-teman di Kelti Biologi Sel dan jaringan BB BIOGEN atas bantuan, dukungan dan pengertiannya selama penulis bekerja dan mengerjakan disertasi ini. Kepada pak Ujang Hafid (Laboratorium Sitologi dan Histologi, LIPI) yang sudah memberikan bantuan dalam penelitian disertasi ini. Kepada teman-teman seangkatan PBT 2010, Sri Suhesti, Ela, Arvita, Jijah, Mey, Ismail, Roberdi, Parlin, Jolanda, Asri Dewi, Redi, Juli, Dyah dan seluruh teman PBT, terimakasih atas kebersamaannya selama perjuangan ini, serta semua pihak yang tidak bisa disebutkan satu per ssatu.
Akhir kata, kekurangan-kekurangan dalam penulisan disertasi ini adalah kekurangan penulis semata. Namun demikian, penulis berharap disertasi ini bermanfaat bagi para pembaca dan perkembangan ilmu pengetahuan dan teknologi pada umumnya.
Bogor, Juli 2013 Mia Kosmiatin
DAFTAR ISI ABSTRACT i RINGKASAN ii PRAKATA Iii PENDAHULUAN Latar Belakang Tujuan Penelitian
Ruang Lingkup Penelitian Dampak dan Manfaat Penelitian
1 1 2 2 3
STUDI PERKEMBANGAN ENDOSPERMA SEBAGAI EKSPLAN DALAM KULTUR ENDOSPERMA JERUK SIAM SIMADU
Pendahuluan Bahan dan Metode Hasil dan Pembahasan Kesimpulan 4 4 4 5 7
INDUKSI EMBRIOGENESIS SOMATIK DAN PEMBENTUKAN TUNAS TRIPLOID DARI BERBGAI TAHAPAN PERKEMBANGAN JARINGAN ENDOSPERMA JERUK SIAM SIMADU (Citrus Nobilis Lour)
Pendahuluan Bahan dan Metode Hasil dan Pembahasan Kesimpulan 10 10 11 12
23
PERBANYAKAN KLONAL TUNAS IN VITRO YANG DIREGENERASIKAN DARI JARINGAN ENDOSPERMA
Pendahuluan Bahan dan Metode Hasil dan Pembahasan Kesimpulan 23 23 24 25 30
KERAGAMAN SITOLOGI DAN MORFOLOGI TUNAS IN VITRO YANG DIREGENERASIKAN DARI JARINGAN ENDOSPERMA
Pendahuluan Bahan dan Metode Hasil dan Pembahasan Kesimpulan 31 31 32 32 41 PEMBAHASAN UMUM 42
KESIMPULAN DAN SARAN 47
PENDAHULUAN Latar Belakang
Buah jeruk tanpa biji (seedless) merupakan salah satu karakter utama yang mempengaruhi daya saing di pasar global (pasar lokal maupun internasional). Jeruk Siam (Citrus nobilis Lour.) termasuk dalam kelompok jeruk dengan jumlah kromosom 2n=2x=18. Jeruk ini cukup mendominasi pertanaman jeruk di Indonesia (Kuntarsih 2007). Jeruk Siam Simadu merupakan jeruk Siam lokal yang hampir mendekati kategori tipe jeruk yang sesuai dengan kriteria konsumen dan pasar dunia untuk dikonsumsi dalam keadaan segar tetapi mempunyai biji yang relatif banyak (>15/buah) sehingga kalah bersaing dengan jeruk impor.
Untuk meningkatkan daya saing terhadap buah jeruk impor, maka diperlukan perbaikan kualitas jeruk lokal unggul sehingga dapat diterima dan dapat bersaing di pasar global. Perbaikan kualitas jeruk lokal yang sudah memiliki rasa dan warna yang sesuai dengan kriteria konsumen dan pasar, dapat dilakukan dengan merakit tanaman jeruk lokal tersebut menjadi jeruk seedless (tanpa biji). Menurut Roose (2009) keberadaan biji dalam buah menjadi halangan dalam melepas jeruk mandarin baru meskipun dengan kualitas rasa dan warna yang tinggi. Banyaknya jumlah biji per buah merupakan salah satu penghalang dalam persaingan global buah jeruk.
Perakitan tanaman jeruk tanpa biji dengan memanfaatkan tingkatan ploidi triploid merupakan salah satu alternatif teknologi yang dapat digunakan untuk memperbaiki kualitas buah jeruk. Cara ini dapat dilakukan dengan merakit tanaman jeruk Siam Simadu tipe baru dengan ploidi triploid (2n =3x=27). Tanaman triploid ini secara teoritis sulit membentuk biji. Kualitas buah tanaman triploid meningkat karena tidak berbiji, lebih besar, dan lebih produktif (Habashy et al. 2004).
Dengan teknik in vitro, regenerasi endosperma yang secara alami triploid memiliki kapasitas yang cukup tinggi untuk mendapatkan tanaman triploid (Hoshino et al. 2011; Thomas dan Chatuverdi 2008; Thomas et al. 2000). Produksi tanaman triploid melalui kultur endosperma memiliki keunggulan karena lebih mudah dan mempersingkat waktu untuk mendapatkan tanaman triploid (Gruis et al. 2007). Perolehan tanaman triploid dari kultur endosperma hasil polinasi yang terkontrol dapat digunakan sebagai strategi dalam pemuliaan jeruk, dan selanjutnya diperbanyak secara vegetatif.
Keberhasilan regenerasi jaringan endosperma sangat ditentukan oleh tahapan perkembangan endosperma dan sistem regenerasinya. Hampir seluruh tanaman berbunga mempunyai embryo sac (kantung embrio) dengan tipe poligonum sehingga menghasilkan endosperma triploid. Endosperma jeruk bertipe inti bebas (nuclear) (Ladaniya, 2008) dimana pada awal perkembangannya inti sel endosperma primer membelah secara cepat dalam beberapa siklus tanpa diikuti dengan pembentukan dinding sel sehingga membentuk sel tunggal dengan multi inti (Dumas dan Rogowsky 2008). Dinding sel baru terbentuk setelah siklus
pembelahan inti endosperma terpenuhi dan diikuti dengan fase mitotik. Pada fase inilah jaringan endosperma dapat dikulturkan secara in vitro dan diregenerasikan baik secara langsung maupun tidak langsung untuk membentuk tanaman triploid.
Untuk mendapatkan buah jeruk Siam Simadu tanpa biji, dapat dilakukan dengan pendekatan kultur endosperma. Endosperma jeruk yang secara alami triploid pada tahapan perkembangan yang tepat, dikulturkan pada formulasi media yang tepat akan mampu diinduksi untuk membentuk kalus embriogenik triploid yang dapat diregenerasikan menjadi tunas atau embrio somatik-ES dengan tingkat ploidi triploid juga. Kepastian perolehan tanaman triploid dilakukan dengan mengukur kandungan DNA pada inti sel yang dikuatkan dengan menghitung jumlah kromosom secara manual dan mengamati morfologi daun dan stomata.
Tujuan Penelitian
Tujuan keseluruhan penelitian ini adalah untuk mendapatkan tanaman jeruk Siam Simadu tanpa biji dengan tingkat ploidi triploid yang dihasilkan melalui kultur endosperma. Empat percobaan dilakukan untuk mencapai tujuan tersebut, setiap kegiatan percobaan bertujuan :
- Mendapatkan informasi tahapan perkembangan endosperma jeruk yang dapat membentuk kalus embriogenik dengan tingkat ploidi triploid
- Mendapatkan formulasi media yang tepat untuk meregenerasikan jaringan endosperma membentuk kalus embriogenik yang dapat diregenerasikan membentuk embrio somatik atau tunas triploid
- Mendapatkan formulasi media untuk perbanyakan klonal jeruk yang diregenerasikan dari jaringan endosperma
- Mendapatkan informasi keragaman morfologi daun dan evaluasi tingkat ploidi dari tunas yang berhasil diregenerasikan dari jaringan endosperma Ruang Lingkup Penelitian
Penelitiaan dilakukan dalam empat rangkaian kegiatan percobaan yang berturutan yaitu :
1. Studi perkembangan jaringan endosperma jeruk siam yang respon dalam kultur in vitro untuk pembentukan kalus embriogenik dan regenerasinya
2. Kultur endosperma
3. Perbanyakan klonal tunas triploid;
4. Evaluasi keragaman sitologi dan morfologi tunas jeruk triploid;
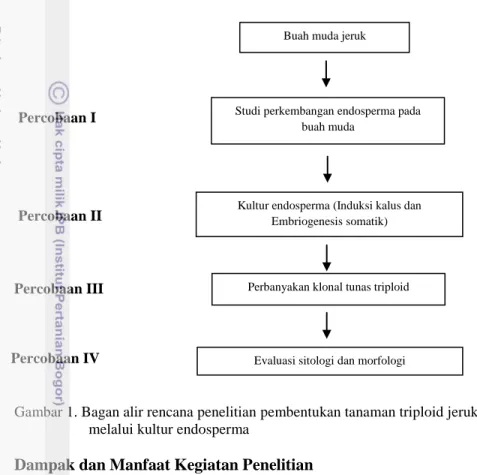
Adapun bagan alur rangkaian percobaan untuk mendapatkan tanaman triploid jeruk Siam Simadu dapat dilihat dalam Gambar 1. :
Gambar 1. Bagan alir rencana penelitian pembentukan tanaman triploid jeruk Siam Simadu melalui kultur endosperma
Dampak dan Manfaat Kegiatan Penelitian
Dengan diperolehnya tanaman jeruk Siam Simadu triploid akan mampu menyediakan buah jeruk tanpa biji sehingga dapat meningkatkan daya saing jeruk lokal Indonesia baik dipasar lokal maupun global. Tanaman jeruk triploid secara teoritis tidak dapat membentuk biji karena ketidakseimbangan perpasangan kromosom saat pembentukan gamet. Tersedianya varietas jeruk Siam Simadu yang mempunyai daya saing dipasaran akan berdampak terhadap peningkatan animo masyarakat, khusunya petani jeruk untuk kembali menanam jeruk sehingga areal pertanaman jeruk akan bertambah luas dan produksi nasional dapat kembali meningkat. Dengan meningkatnya produksi buah jeruk nasional yang mampu bersaing akan dapat mencukupi kebutuhan pasar domestik dan bahkan dapat kembali bersaing di pasar internasional yang pada akhirnya akan bermanfaat dalam meningkatkan penghasilan petani jeruk sehingga profesi petani dapat menarik generasi muda untuk kembali bertani di lahan pertanian.
Studi perkembangan endosperma pada buah muda
Buah muda jeruk
Kultur endosperma (Induksi kalus dan Embriogenesis somatik)
Perbanyakan klonal tunas triploid
Evaluasi sitologi dan morfologi
Percobaan IV Percobaan III
Percobaan II Percobaan I
STUDI PERKEMBANGAN ENDOSPERMA PADA BUAH MUDA JERUK SIAM (Citrus nobilis Lour.) var. Simadu
PENDAHULUAN
Fertilisasi ganda (double fertilization) merupakan fenomena reproduksi pada
Angiospermae yang sangat unik dan terjadi pada hampir seluruh tanaman tinggi
yang berbunga (Berger 1999). Pada tanaman dikotil, fertilisasi ganda meliputi 2 proses fusi yaitu 1 sel sperma dengan sel telur yang akan membentuk zigot. Fusi yang lain adalah antara 1 sel sperma dengan 2 inti polar/sentral dan membentuk inti endosperma primer (Berger 2003). Endosperma akan berkembang menjadi jaringan yang berperan sebagai nourishing tissue dan pelindung embrio (Hoshino et al. 2011; Berger 2003; Berger 1999; Russel 1992). Jaringan endosperma ini poliploid dan umumnya triploid pada tanaman dengan tipe kantung embrio poligonum (Faure 2001).
Secara umum perkembangan endosperma meliputi syncytium - pembelahan inti yang cepat tanpa pembentukan dinding sel (cellularization-selulerisasi). Fase
syncytium kemudian diikuti dengan pembentukan sel inti tunggal melalui proses
selulerisasi (Kranz dan Kumlehn 1999; Clore et al. 1996). Sel inti tunggal endosperma mengalami diferensiasi menjadi jaringan fungsional sebagai nourishing
tissue bagi embrio. Pada sebagian besar dikotil, sel-sel endosperma akan habis saat
embrio matang (Berger, 1999).
Pada jeruk Siam keberadaan endosperma tidak sampai ke pemasakan biji, karena tingginya derajat poliembrioni yang terbentuk dari jaringan nuselar sehingga endosperma diserap secara cepat selama perkembangan embrio zigotik dan nuselar (Ladaniya, 2008). Embrio zigotik dan embrio nuselar bersaing untuk mendapatkan nutrisi. Kultur endosperma memerlukan eksplan jaringan/sel-sel endosperma yang sempurna sehingga dapat diinduksi regenerasinya baik secara langsung maupun tidak langsung. Hal ini menyebabkan perlunya diketahui saat terbentuknya sel-sel endosperma yang sempurna sampai endosperma habis diserap embrio atau mengalami degenerasi.
BAHAN DAN METODE Bahan Tanaman
Bahan tanaman yang digunakan dalam penelitian ini adalah tanaman jeruk Siam Simadu yang berumur 5 tahun yang diperoleh dari Balai Penelitian Jeruk dan Buah sub tropika lainnya, Batu, Jawa Timur. Tanaman jeruk ditanam di rumah kaca BB BIOGEN, Cimanggu, Bogor.
Metode Penelitian
Induksi pembungaan pada tanaman jeruk Siam Simadu dilakukan dengan cekaman kering pada tanaman induk. Pengamatan dilakukan terhadap buah, biji, endosperma dan embrio (zigotik dan nuselar) yang berumur 2 sampai 14 minggu setelah antesis-MSA. Pengamatan perkembangan endosperma dan embrio (zigotik
dan nuselar) dilakukan pada preparat segar dan kering sesuai dengan Berlyn dan Miscke (1976). Pengamatan dan pengukuran dilakukan dengan bantuan mikroskop
inverted medan terang (Olympus) dan mikroskop stereo (Olympus).
HASIL DAN PEMBAHASAN
Fertilisasi pada jeruk Siam Simadu terjadi 4 sampai 7 hari setelah antesis yang ditandai dengan terbentuknya gelang/lingkaran cokelat pada bagian pangkal bunga.
Pertumbuhan buah mulai terlihat 2 MSA, ditandai dengan luruhnya sisa tangkai putik dan peningkatan diameter buah (Tabel 1). Perkembangan ovul mulai dapat diamati pada buah 3 MSA (Gambar 2). Ovul-biji mulai terlihat jelas pada karpel buah yang berumur 4 minggu setelah antesis. Sel-sel yang mengisi bakal biji sel bentuknya seragam, diduga merupakan jaringan nuselus. Kantung embrio mulai terlihat pemanjangannya pada buah 4-5 MSA yang berkembang dengan arah pertumbuhan pada bagian mikropil ke kalaza. Pemanjangan ini berlangsung terus sampai 7 MSA, pemanjangan ini merupakan endosperm/embryo sac haustorium yang akan memberi ruang untuk perkembangan endosperma. Pembentukan haustorium ini juga terlihat pada perkembangan endosperma almon (Martinez-Garcia et al. 2012)
Sampai buah 7 MSA, embrio masih berbentuk zigot dan terdapat pada bagian mikropil, sementara dibagian kalaza terlihat beberapa sel yang berbeda dengan sel maternal yang ada disekitarnya. Diduga kumpulan sel ini merupakan proliferasi sel-sel antipodal pada kantung embrio yang tidak mengalami degradasi. Pada umumnya sel-sel antipodal pada biji yang membentuk endosperma, terdegradasi setelah terjadinya fertilisasi ganda seperti pada beberapa family
Fabaceae (Riahi et al. 2003). Proliferasi sel antipodal pada kantung embrio jeruk
Siam Simadu diduga terjadi karena pada saat itu, endosperma masih belum terbentuk sempurna. Pada saat jaringan endosperma mulai berfungsi sebagai
nourishing tissue bagi embrio, umumnya sel-sel antipodal terdegradasi, tetapi pada
buah jeruk Siam Simadu, sel-sel antipodal ini tetap hidup. Kumpulan sel antipodal ini tetap terlihat sampai buah 13 MSA yang dapat diamati pada irisan melintang biji pada bagian kalaza.
Selulerisasi inti endosperma mulai berlangsung pada buah 9 MSA, pada tahap ini terlihat sel-sel endosperma yang sudah mengalami selulerisasi memiliki dinding sel yang masih tipis. Sel-sel endosperma masih belum banyak karena sebagian besar masih merupakan inti-inti tanpa dinding sel, yang secara kasat mata terlihat sebagian cairan dalam biji. Pada preparat kering terlihat adanya rongga kosong dalam ruang biji, hal ini terjadi karena sel berinti banyak sulit untuk dapat terfiksasi dengan teknik Berlyn dan Miksche (1976). Jaringan endosperma mulai mengalami selulerisasi pada daerah sekitar embrio (bagian mikropil) yang akan berkembang membentuk endosperma mikropil dan pada dinding integumen membentuk lapisan endsperma periferal. Secara kasat mata pembentukan jaringan
endosperma ini ditandai dengan mengentalnya cairan dalam biji, yang terlihat mengelilingi embrio zigotik dan nuselar. Proses selulerisasi pada sel-sel endosperma jeruk Siam Simadu berlangsung bertahap hingga 13 MSA yang ditandai menghilangnya cairan pada biji dan terbentuknya jelly kompak yang mengelilingi embrio. Proses selulerisasi ini menyerupai selulerisasi endosperm pada
A. demanvendicus (Riahi et al. 2003).
Pada buah yang berumur 11-13 MSA, jaringan endosperma strukturnya sudah mengental seperti jelly dan mudah diisolasi dengan bantuan mikroskop binokuler sederhana (portable), sehingga pemisahan endosperma dan embrio dapat dilakukan secara aseptik dalam laminar air flow cabinet. Hal ini menjadi penting apabila isolasi endosperma dan embrio ditujukan untuk pengkulturan endosperma secara in vitro untuk menghindarkan kontaminan dari jaringan yang bukan jaringan triploid.
Setelah 14 MSA, pada hampir seluruh buah yang diamati, jaringan endoperma yang berbentuk jelly sudah tidak terlihat lagi pada biji. Pada bagian integumen dalam biji terlihat adanya lapisan tipis transparan, lapisan ini merupakan sisa jaringan endosperma yang membentuk endosperma periferal. Lapisan ini terbentuk pada awal selulerisasi sehingga pada fase ini sel-sel nya sudah menua dan mulai mengalami degenerasi (penuaan) dengan terakumulasinya etilen pada jaringan endosperma (Lombardi et al. 2012; Berger 1999). Hal ini juga terlihat pada saat lapisan endosperma ini dikulturkan tidak memberikan respon ketika diinduksi pembelahan selnya (data tidak ditampilkan). Tingginya akumulasi etilen pada sel-sel endosperma menghambat induksi pembelahan sel.
Setelah fertilisasi, zigot mengalami dormansi dan pecah/berakhir pada saat jaringan endosperm terbentuk (Riahi et al. 2003). Pada saat sel-sel endosperma terbentuk dan sudah berdiferensiasi menjadi nourishing tissue bagi embrio, proses embryogenesis zigotik akan dimulai. Pada jeruk Siam Simadu, diferensiasi endosperma manjadi nourishing tissue terlihat pada buah 9 MSA. Hal ini ditandai dengan berkembangnya embrio zigotik membentuk globular tahap awal dengan ukuran 156 ± 0.3 µm yang terlihat di bagian mikropil dan dikelelilingi oleh sel-sel endosperma. Embrio nuselar belum terlihat pada tahap perkembangan ini baik diamati dengan preparat segar ataupun pada preparat kering.
Pada buah 10 MSA, jaringan endosperma mulai terbentuk meskipun belum membentuk jaringan endosperma yang sempurna, fungsi endosperma sebagai
nourishing tissue bagi embrio mulai terlihat jelas. Hal ini ditandai dengan kecepatan
perkembangan proembrio zigotik membentuk globular dan mulai terinduksinya perkembangan proembrio nuselar. Hal ini sesuai dengan Kepiro dan Roose (2007), yang menyatakan bahwa perkembangan dan pertumbuhan embrio nuselar jeruk baru terjadi setelah jaringan endosperma terbentuk. Perkembangan embrio nuselar ini sangat pesat, terlihat perkembangan embrio nuselar yang sudah terbentuk dan induksi pembentukan embrio nuselar baru yang terus berlangsung hingga 13 MSA, sehingga pada buah tersebut terdapat beberapa embrio dengan perkembangan yang berbeda-beda. Pada buah 14 MSA sulit membedakan embrio zigotik dan nuselar.
Pada fase setelah selulerisasi sempurna (13 MSA), respon endosperma jeruk Siam Simadu untuk diinduksi regenerasi secara tidak langsung (melalui
pembentukkan kalus) memberikan hasil yang paling baik dibandingkan dengan jaringan endospserma yang lebih muda atau lebih tua (data tidak ditampilkan). Menurut Berger (1999), endosperma mengalami fase diferensiasi begitu selesai melewati fase selulerisasi, sehingga pada fase ini endosperma akan lebih mudah untuk diinduksi regenerasinya secara in vitro. Hal ini sesuai dengan yang dinyatakan oleh Kranz dan Kumlehn 1999; Bhojwani (1984); Johri dan Bhojwani (1965) bahwa endosperma dapat dikulturkan secara in vitro dan pertumbuhannya menjadi tidak terdeterminasi sehingga memungkinkan untuk diinduksi regenerasi sel-sel.
Sel-sel antipodal tidak mengalami degradasi sampai jaringan endosperma terbentuk sempurna (13 MSA). Saat jaringan endosperma dikulturkan, sel-sel antipodal terbawa dan dapat diinduksi pembelahan selnya saat dikultutrkan secara
in vitro (data tidak ditampilkan). Hal ini berpotensi terjadi kontaminasi jaringan
sel-sel haploid dalam kultur endosperma yang triploid. Potensi kontaminan juga mungkin terjadi diakibatkan oleh proembrio nuselar yang berukuran kurang dari 16 sel, sehingga sulit dipisahkan hanya dengan bantuan mikroskop binokuler sederhana.
KESIMPULAN
Endosperma jeruk Siam Simadu mengalami selulerisasi (pembentukan dinding sel) mulai 9 MSA dan selesai pada 13 MSA. Pada 11-13 MSA, perkembangan jaringan endosperma sudah mulai sempurna dan membentuk struktur jaringan yang kompak seperti jelly sehingga mudah untuk diisolasi dan dipisahkan dari embrio zigotik dan nuselar. Jaringan endosperma habis diserap oleh embrio pada 14 MSA dan hanya tersisa lapisan endosperma periferal yang merupakan jaringan endosperma yang mengalami degenerasi.
Perkembangan embrio zigotik terlihat 9 MSA, sementara embrio nuselar mulai berkembang pada 10 MSA setelah jaringan endosperma berfungsi sebagai
nourishing tissue bagi embrio. Perkembangan embrio nuselar lebih cepat dari
embrio zigotik sehingga pada buah 14 MSA perkembangannya hampir sama dengam embrio zigotik, dan jumlahnyapun masih terus bertambah.
Sel-sel antipodal pada kantung embrio tidak mengalami degradasi sampai 13 MSA dan embrio nuselar dapat mengkontaminasi jaringan endosperma bila dikulturkan secara in vitro.
haploid - - - -
Embrio nuselar - - - -
Embrio zigotik - - - -
-zigot - - - -
endosperm - - Syncytium Syncytium Syncytium
Kantung embrio - -
Nuselus/jaringan maternal pada ovul
- menipis menipis tipis
Ovul-
3 4 5 7 8 9 10 12 13 14
Minggu setelah antesia-MSA
Tabel 1. Tahapan perkembangan endosperma pada buah jeruk Siam Simadu, 2-14 minggu setelah antesis.
Umurbuah (MSA)
Ukuran yang teramati Keterangan
Buah (cm) Biji (mm) Embrio ( m) Endosperma
2 0.3±0.1 - - - Embrio = zigot, endosperma = PEM
3 0.5±0.1 - - - Embrio = zigot, endosperma = PEM
4 0.9±0.2 0.03±0.0 - Cair Embrio = zigot, endosperma = PEM, multinukleat
5 1.2±0.2 0.05±0.0 - Cair Embrio = zigot, endosperma = PEM, multinukleat
6 1.3±0.1 0.5±0.2 - Cair Embrio = zigot, endosperma = PEM, multinukleat
7 1.5±0.2 0.7±0.1 - Cair Embrio = zigot, endosperma = PEM, multinukleat
8 1.7±0.1 2.0±0.4 - Cair Proembrio zigotik awal, endosperma= selulerisasi
9 2.0±0.2 3.0±0.7 156± 0.3(z) Cair Globular zigotik, sel-sel endosperma mulai terlihat dinding sel
10 2.1±0.2 4.0±0.7 250±20.1 (z)
138± 74.2(n)
Jelly Hati zigotik, embrio nuselar globular awal, jaringan endosperma terbentuk disekitar embrio
11 2.4±0.1 5.5±-0.4 558± 18.8 (z)
265± 19.9(n)
Jelly Torpedo zigotik, embrio nuselar globular, jaringan endosperma hampir memenuhi ruang biji
12 3.0±0.2 6.0±0.6 882± 49.7(z)
351± 16.7(n)
Jelly Kotiledon zigotik, embrio nuselar lebih dari satu dengan perkembangan yang berbeda,jaringan endosperma hampir memenuhi ruang biji
13 3.3±0.1 7.0±0.6 940±34.1 (z)
539± 20.3(n)
Jelly Kotiledon zigotik, jaringan endosperma memenuhi ruang biji
14 3.5±0.1 7.0±0.7 1865± 7.5(z)
1369± 21.2(n)
Tidak ada Kotiledon zigotik, proembrio nuselar, jaringan endosperma terlihat disekitar integumen dalam
Keterangan : - MSA = Minggu Setelah Antesis ; PEM = Primary endosperm mass
- z=embrio zigotik; n=embrio nuselar
INDUKSI EMBRIOGENESIS SOMATIK DAN PEMBENTUKAN TUNAS TRIPLOID DARI BERBGAI TAHAPAN PERKEMBANGAN JARINGAN
ENDOSPERMA JERUK SIAM SIMADU (Citrus Nobilis Lour) PENDAHULUAN
Jeruk adalah salah satu jenis komoditas hortikultura penting dengan permintaan yang cukup tinggi di Indonesia. Produksi jeruk lokal Indonesia pada tahun 2011 mencapai 1,807,808 ton (BPS 2012), meskipun demikian saat ini produktivitas dan daya saingnya terhadap buah jeruk impor masih sangat rendah. Sampai 2012, nilai impor jeruk tertinggi dibanding dengan impor komoditas hortikultura lainnya (BPS 2012). Rendahnya daya saing jeruk lokal terutama disebabkan oleh kualitas jeruk lokal yang lebih rendah dari jeruk impor. Kualitas buah jeruk sangat ditentukan oleh rasa, warna, kulit mudah dikupas dan jumlah biji/buah (Karp 2007). Jeruk Siam Simadu merupakan jeruk lokal dengan rasa manis segar, warna dan kulit buah seperti mandarin tetapi jumlah bijinya masih tinggi, lebih dari 15 biji/buah.
Produksi buah jeruk tanpa biji dapat dilakukan dengan merakit tanaman jeruk dengan ploidi triploid. Tanaman triploid sulit untuk membentuk biji. Pada tanaman yang produksinya terletak pada daging buah (vegetatatif), tanaman triploid lebih bernilai ekonomi karena dapat memperbaiki mutu dan kualitas buahnya. Kualitas buah tanaman triploid meningkat karena tidak berbiji, lebih besar, dan lebih produktif (Habashy et al. 2004; Thomas dan Chaturvedi 2008).
Fenomena perubahan tingkat ploidi sangat jarang ditemukan pada tanaman jeruk. Tanaman triploid juga sulit diperoleh dari persilangan tradisional karena memerlukan tetua tetraploid dan diploid yang secara genetik dapat disilangkan.
Sebagian besar Angiospermae memiliki kantung embrio tipe poligonum. Endosperma pada tipe ini merupakan jaringan tanaman yang secara alami memiliki ploidi triploid karena merupakan hasil penggabungan antara 2 inti polar (betina) dan satu inti sperma (jantan) (Hamamura et al. 2012; Berger 1999). Pada jeruk, jaringan endospermanya termasuk kelompok endosperma berinti bebas-nuclear endosperm (Ladaniya, 2008). Saat awal perkembangannya inti edosperma primer akan membelah tanpa diikuti selulerisasi. Endosperma kemudian mengalami selulerisasi, mitosis, diferensiasi dan degenerasi.
Pembentukan tanaman dari sel-sel/jaringan endosperma yang secara alami triploid lebih mudah dan mempersingkat waktu untuk mendapatkan tanaman triploid (Gruis et al. 2007).
Keberhasilan kultur endosperma untuk mendapatkan tanaman triploid sangat dipengaruhi oleh tahap perkembangan endosperma sebagai eksplan dan sistem regenerasinya. Salah satu faktor terpenting adalah tingkat perkembangan endosperma yang digunakan sebagai eksplan yang berespon baik terhadap kultur in
vitro. Pada tanaman jeruk, endosperma muda digunakan sebagai eksplan pada
kultur endosperma jeruk besar (Wang dan Chang 1978; Yang et al. 2000; Gmitter et
Faktor keberhasilan perolehan tanaman triploid ditentukan juga oleh teknik regenerasinya. Induksi embriogenesis somatik dari jaringan endosperma memerlukan teknik dan formulasi medium yang khusus karena sifat yang unik dari jaringan tersebut. Pada jeruk manis jaringan endosperma yang diisolasi dari buah 12-14 MSA dapat diinduksi pembentukan kalusnya (Gmitter et al. 1990) tetapi tidak ada laporan regenerasi pembentukan tunas triploidnya. Endosperma yang diisolasi dari biji hasil persilangan jeruk grape fruit dan pamelo berhasil diinduksi pembentukan kalus embriogeniknya, meskipun masih belum dapat memperoleh tunas yang normal (Yang et al. 2000).
Tujuan penelitian ini adalah untuk mendapatkan tahapan perkembangan jaringan endosperma jeruk Siam Simadu yang dapat diisolasi dan dikultur in vitro serta teknik regenerasinya melalui embriogenesis somatik (formulasi media induksi kalus embriogenik, pendewasaan dan perkecambahan serta pemanjangan planlet) sehingga diperoleh tunas triploid
BAHAN DAN METODE Bahan Penelitian
Bahan tanaman yang digunakan dalam penelitian ini adalah tanaman jeruk Siam Simadu yang berumur 5 tahun.
Metode Penelitian Kultur endosperma
Induksi pembentukan kalus
Bahan tanaman yang dikulturkan adalah jaringan endosperma. Isolasi
jaringan endosperma dilakukan pada buah yang berumur 10-14 MSA. Biji dikeluarkan dari buah yang sudah disterilkan. Isolasi endosperma dari biji muda dilakukan dalam laminar air flow cabinet dengan bantuan mikroskop binokuler dan dikulturkan pada media Husni et al. (2010). Eksplan kemudian diinkubasi dalam ruang dengan penyinaran ± 600 lux, 16 jam/hari, pada suhu 21-25 oC.
Penelitian dilakukan dengan rancangan acak lengkap dengan perlakuan 5 umur endoseperma (10, 11, 12, 13, 14 MSA), setiap perlakuan diulang 8 kali. Setiap ulangan terdiri dari 4 jaringan endosperma. Pengamatan dilakukan terhadap persentase pembentukan kalus dan penampakan biakan.
Optimasi pembentukan kalus
Bahan tanaman yang digunakan adalah endosperma yang berumur 13 MSA. Media yang dipergunakan adalah media Husni et al. (2010) yang diperkaya dengan penambahan 0.1 mg L-1 biotin; 500 mg L-1 ekstrak malt (EME); 500 mg L-1 kasein hidrolisat (CH); 500 mg L-1 EME + 0.1 mg L-1 biotin; 500 mg L-1 CH + 0.1 mg L-1 biotin.
Penelitian dilakukan dengan rancangan acak lengkap dengan perlakuan 5 media induksi pembentukan kalus yaitu biotin: EME: CH: EME+biotin; CH+biotin. Ulangan setiap perlakuan adalah 3 kali, setiap ulangan terdiri dari 3 jaringan
endosperma. Pengamatan dilakukan terhadap persentase pembentukan kalus embriogenik.
Regenerasi kalus embriogenik yang diinduksi dari jaringan endosperma melalui embriogenesis somatik
Kalus embriogenik yang mengandung embrio somatik (ES) fase globular disubkultur pada media pendewasaan. Formulasi media yang dicobakan untuk mendewasakan struktur globular adalah media dasar MS yang dimodifikasi dengan vitamin MW. Perlakuan yang dicoba adalah formulasi media pendewasaan dengan penambahan 0; 0.5; 1.0; 1.5; 2.0; 2.5 mg L-1 ABA, 250 mg L-1 glutamin, 7 mg L-1 biotin dan 0.5 g L-1 Phytagel. Biakan diinkubasi pada ruang kultur dengan intensitas cahaya ±1000 lux, 16 jam/hari pada suhu 21-25oC.
Penelitian dirancang dengan Rancangan Acak Lengkap dengan perlakuan 9 media pendewasaan embriosomatik yaitu media dengan penambahan 0; 0.5; 1.0; 1.5; 2.0; 2.5 mg L-1 ABA, 250 mg L-1 glutamin, 7 mg L-1 biotin dan 0.5 g L-1 Phytagel. Masing-masing perlakuan diulang 4 kali dengan eksplan satu populasi (± 0.1 g) kalus embriogenik dari media proliferasi kalus tanpa penambahan zat pengatur tumbuh-ZPT. Pengamatan dilakukan terhadap total pembentukan ES, jumlah ES globular, jumlah ES dewasa (fase hati, torpedo, kotiledon), jumlah ES berkecambah, persentase pendewasaan, visual ES, kecambah somatik dan kalus yang terbentuk.
Pemanjangan Plantlet
Bahan tanaman yang digunakan dalam tahapan penelitian ini adalah kecambah somatik (planlet) yang diperoleh dari regenerasi kalus. Bahan tanaman dikulturkan pada media pemanjangan planlet yaitu media dasar MS yang dimodfikasi dengan formulasi vitamin MW yang diperkaya dengan 2.5 mg L-1 GA3
dan dikombinasikan dengan 0; 1; 3 mg L-1 kinetin. Bagian tunas dikulturkan pada media pemanjangan dan diinkubasi pada ruang kultur dengan intensitas cahaya ±1000 lux, 16 jam/hari pada suhu 21-25 oC.
Penelitian dirancang dengan Rancangan Acak Lengkap dengan perlakuan 3 taraf konsentrasi kinetin 0; 1; 3 mg L-1 pada media pemanjangaan tunas. Masing-masing perlakuan diulang 9 kali. Pengamatan dilakukan terhadap jumlah dan tinggi tunas, jumlah buku, jumlah daun, jumlah embrisomatik sekunder persentase pembentukan ES sekunder, kalus embriogenik dan akar yang terbentuk.
HASIL DAN PEMBAHASAN Kultur Endosperma
Induksi kalus embriogenik dari jaringan endosperma jeruk siam Simadu
Pada jeruk Siam Simadu berdasarkan perkembangan dan pertumbuhan biji, diketahui bahwa jaringan endoperma dapat diisolasi dari buah yang berumur 10-14 MSA. Sebagian besar jaringan endosperma pada tahap ini, sudah merupakan sel sempurna dengan satu inti dan dinding sel yang sempurna sehingga berpeluang dapat diinduksi pembelahan selnya membentuk populasi sel/kalus.
Jaringan endosperma diisolasi dari buah jeruk Siam Simadu yang berumur 11, 12 dan 13 MSA dapat diinduksi untuk membentuk kalus dan dikulturkan pada media Husni et al. (2010). Hal yang sama dilaporkan oleh Gmitter et al (1990)
pada endosperma jeruk manis, grape fruit dan pommelo endosperma diisolasi dari buah yang berumur 12-14 MSA. Persentase pembentukan kalus tertinggi diperoleh dari eksplan jaringan endosperma yang diisolasi dari buah berumur 13 MSA (Tabel 2).
Tabel 2. Respon jaringan endosperma jeruk Siam Simadu dari berbagai umur endosperma (10-14 MSA) pada media induksi kalus
Umur endosperma (MSA) Kalus (%)
10 0
11 34.38ab
12 21.88b
13 53.13a
14* 0
Keterangan : * jaringan endosperma diisolasi dari jaringan tipis tembus pandang dari bagian integumen dalam; MSA= Minggu Setelah Antesis; Angka yang diikuti dengan huruf yang sama pada kolom yang sama menunjukkan hasil yang tidak berbeda nyata pada α= 0.05 berdasarkan uji DMRT
Jaringan endosperma yang diisolasi dari biji yang berumur 10 MSA tidak mampu menginduksi pembentukan kalus. Hal ini diduga karena sel-sel endosperma masih belum sempurna membentuk dinding sel dan masih banyak inti tanpa dinding sel. Pembelahan sel, baru dapat diinduksi apabila dinding sel sudah terbentuk (Berger 1999).
Jaringan endosperma yang diisolasi dari biji yang berumur 14 MSA merupakan endosperma periferal, sebagian besar endosperma sudah terserap habis untuk pertumbuhan embrio. Jaringan endosperma periferal mulai terdegenerasi dengan mengakumulasi etilen pada selnya (Lombardi et al. 2012; Berger 1999). Tingginya akumulasi etilen pada sel-sel endosperma dapat menghambat induksi pembelahan sel.
Optimasi pembentukan kalus embriogenik
Optimasi pembentukan kalus embriogenik dari jaringan endosperma dilakukan dengan menggunakan jaringan endosperma 13 MSA. Peningkatan pembentukan kalus embriogenik dilakukan dengan memperkaya media dasar induksi kalus (Husni et al. 2010) dengan menambahkan vitamin (biotin) dan sumber N-organik (CH atau EME) yang diperlakukan secara tunggal maupun kombinasi vitamin dan sumber N-organik. Hasil penelitian menunjukkan bahwa peningkatan pembentukan kalus embriogeniknya hingga 100% diperoleh dari media dasar yang diperkaya dengan 0.1 mg L-1 vitamin biotin (Gambar 3). Penambahan biotin atau sumber N-organik (EME atau CH) yang ditambahkan secara tunggal ke dalam media induksi kalus embriogenik, responnya tidak berbeda nyata. Biotin (vitamin H) merupakan salah satu koenzim pada enzim yang menjadi katalisator dalam
sintesa protein yang berperan dalam embriogenesis somatik, sehingga meskipun konsentrasi rendah, dapat mempengaruhi sintesa protein tersebut.
Gambar 3. Persentase kalus embriogenik yang terbentuk dari jaringan endosperma yang diisolasi dari buah berumur 13 minggu setelah antesis pada media MS modifikasi dengan penambahan biotin dan sumber N organik. biotin=0.1 mg L-1; Ekstrak malt = 500 mg L-1; Kasein Hidrolisa=500 mg L-1; Ektrak malt+biotin= 500 mg L-1 +0.1 mg L-1; Kasein Hidrolisa+biotin= 500 mg L-1 +0.1 mg L-1. Angka yang diikuti dengan huruf yang sama menunjukkan hasil yang tidak berbeda nyata pada = 0.05 berdasarkan uji DMRT
Penambahan EME dan CH pun tidak berbeda nyata dalam menginduksi pembentukan kalus embriogenik (Gambar 3). Hal ini disebabkan CH dan EME termasuk dalam golongan yang sama yaitu sebagai sumber N-organik yang mudah diserap oleh tanaman. Ketersediaan N-organik yang tinggi dalam medium dapat mempercepat akumulasi protein dalam sel yang dibutuhkan untuk membentuk kalus embriogenik (Deo et al. 2010). Penambahan sumber N-organik (CH dan EME) pada tanaman Dianthus dapat meningkatkan 1.5 kali pembentukan ES (Pareek dan Kothari, 2003).
Hal yang berbeda tejadi apabila penambahan bahan tersebut dikombinasikan, pembentukan kalusnya lebih rendah daripada perlakuan tunggalnya. Pada beberapa spesies tanaman seperti jambu biji (Rai et al. 2008) penambahan bahan organik yang dikombinasikan dengan vitamin dapat meningkatkan induksi embriogenesis somatik, tetapi pada endosperma jeruk Siam Simadu penambahan kombinasi bahan organik (CH atau EME) dan vitamin biotin memberikan hasil yang lebih rendah dibandingkan dengan penambahan secara tunggal. Hal ini diduga terjadi karena biotin yang berperan sebagai koenzim dalam sintesa protein akan meningkatkan sintesa protein. Kombinasi biotin dengan sumber N-organik akan mengakibatkan akumulasi protein yang berlebihan dalam sel sehingga justru menghambat proses embriogenesis.
Kepastian pembentukan kalus embriogenik yang dihasilkan dari sel-sel endosperma atau sel-sel lain dilakukan dengan mengukur ploidi kalus dengan flow
cytometry (Cyflow cytometry, Partec). Hasil pengukuran menunjukkan bahwa
populasi sel embriogenik miksoploid, yang merupakan campuran antara populasi sel haploid, diploid dan triploid. Hal ini menunjukkan bahwa sel-sel yang berproliferasi tidak hanya berasal dari sel-sel endosperma saja, sehingga perlu dilakukan regenerasi melalui embriogenesis somatik untuk dapat meregenerasikan satu sel menjadi tanaman lengkap. Hal ini perlu dilakukan untuk memastikam tanaman yang diperoleh tidak miksoploid tetapi merupakan tanaman jeruk Siam Simadu triploid.
Pendewasaan dan Perkecambahan Struktur Embriosomatik
Pendewasaan ES merupakan proses yang sangat penting dan sangat menentukan keberhasilan embriogenesis somatik untuk menghasilkan embrio normal yang siap dikecambahkan. Formulasi media sangat menentukan karena apabila tidak sesuai maka sel-sel yang sudah terdiferensiasi untuk membentuk embrio akan kembali membentuk sel-sel yang tidak terdiferensiasi atau terus membentuk ES sekunder (Gray 2005). Pendewasaan ES melibatkan perubahan akumulasi ABA dalam setiap fase embriogenesis (Preeti et al. 2004; Label dan Lelu 2000), sehingga sering ditambahkan ABA eksogen pada formulasi media untuk perkecambahan. Pada perkembangan embrio zigotik terdapat fase desikasi (stress air) yang dialami embrio untuk dapat mengakumulasi ABA (Dodeman et al. 1997). Simulasi proses ini secara in vitro dapat dilakukan dengan menambahkan osmotikum, meningkatkan pemberian sukrosa (Robichaud et al. 2004; Rai et al. 2008), PEG (Robichaud et al. 2004; Find 1997) atau dengan meningkatkan konsentrasi bahan pemadat medium (Peran-Quesada et al. 2003; Marquez-Martin et
al. 2011).
Pendewasaan ES yang diinduksi dari jaringan diploid jeruk Siam Simadu memerlukan ABA (Husni et al. 2010) untuk medorong proses pendewasaan ES secara serempak. Embrio somatik globular yang terbentuk pada kalus embriogenik umumnya siap untuk didewasakan bila memperlihatkan perubahan warna dari putih susu menjadi hijau.
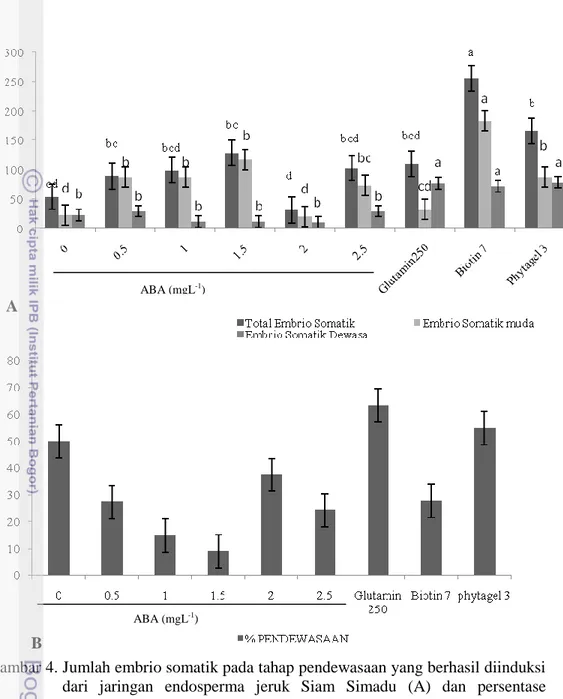
Perkembangan ES globular mulai terlihat setelah minggu ke-4 pengkulturan dalam media pendewasaan. Setelah 8 minggu pengkulturan seluruh kalus embriogenik menunjukkan kemampuan untuk membentuk embrio globular dan embrio dewasa (hati, torpedo, kotiledon) pada seluruh formulasi media yang dicobakan dengan jumlah yang beragam (Gambar 4A.). Hasil pengolahan statistik, standar deviasi respon eksplan populasi sel (kalus) embriogenik terhadap formulasi media juga menunjukkan keragaman, meskipun eksplan sebelumnya disub kultur pada formulasi proliferasi tanpa ZPT untuk menyeragamkan eksplan awal.
Rerata jumlah ES tertinggi diperoleh eksplan yang dikulturkan pada media dengan penambahan kasein hidrolisat dan biotin yang mencapai rerata total ESnya sebanyak 255 (Gambar 4A.) dan berbeda nyata untuk seluruh formulasi media yang lain. Meskipun pembentukan ESnya tinggi, ES yang terbentuk morfologinya tidak
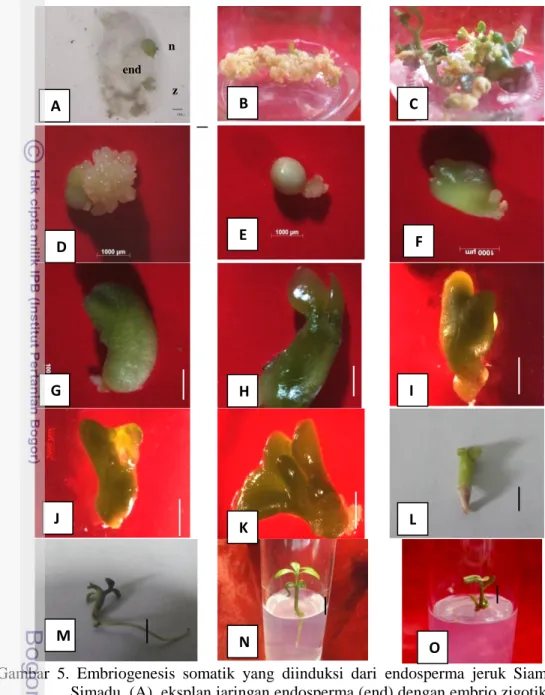
normal dengan ukuran jauh lebih besar dari ES yang lainnya (Gambar 5). Meskipun ES ini juga memperlihatkan proses pendewasaan, tetapi ukurannya tetap lebih besar dan tidak ada yang berkecambah. Berbeda pada tanaman Dianthus (Pareek dan Kothari 2003) kombinasi bahan organik kasein hidrolisat dengan biotin mampu meningkatkan keberhasilan perolehan ES dewasa. Pada kalus embriogenik yang diinduksi dari jaringan endosperma ternyata kombinasi ini dapat meningkatkan pembentukan ES tetapi pertumbuhannya terlalu cepat sehingga ukurannya sangat besar. Menurun Shellhammer dan Meinke (1990) kerusakan sintesa biotin menyebabkan perkembangan embriogenesis yang tidak lengkap. Ketidaknormalan ini dapat dipicu karena kekurangan atau kelebihan biotin dalam proses embriogenesis tersebut. Ketidaknormalan ES muncul diduga disebabkan oleh akumulasi protein simpanan yang berlebih akibat aktivitas biotin sebagai koenzim bagi enzim pensintesa protein simpanan dan ketersediaan sumber N-organik yang mudah diserap tanaman (Dodeman et al. 1997). Akumulasi protein simpanan yang berlebih akan menghambat akumulasi protein LEA (Late Embryogenesis Abundant) yang berperan dalam pendewasaan ES sehingga ES menjadi tidak normal.
Pembentukan ES yang juga cukup banyak (166.25) dan berbeda nyata dengan formulasi media dengan penambahan ABA, adalah media MS modifikasi dengan formulasi vitamin media MW tanpa penambahan ZPT dengan meningkatkan konsentrasi phytagel (sebagai bahan pemadat media) lebih tinggi dari media yang biasa yaitu dari 2.5 g L-1 menjadi 3 g L-1 phytagel. Berbeda dengan perkembangan ES yang terbentuk pada media dengan penambahan biotin dan kasein hidrolisat, ES yang dihasilkan pada media ini pertumbuhan dan perkembangannya normal bahkan beberapa ES dewasa dapat langsung berkecambah pada media yang sama (Gambar 4A. dan Tabel 3).
Persentase pendewasaan pada media tanpa penambahan ZPT juga cukup tinggi mencapai, 54.84% bahkan 14.06% diantara ES dewasa yang terbentuk dapat langsung berkecambah (Gambar 4B, Tabel 3). Salah satu ciri fase pendewasaan pada embrio adalah menurunnya kandungan air pada embrio, sehingga media dengan ketersediaan air yang rendah dapat meningkatkan pendewasaan ES. Media dengan peningkatan konsentrasi bahan pemadat akan menurunkan potensial matriks media sehingga ketersediaan air untuk diserap berkurang (ES terdehidrasi). Menurut Martin-Marquez et al. (2011) dan Peran-Quesada et al. (2004), pengaturan air berpengaruh positif terhadap pendewasaan ES alpukat dan sangat efektif dilakukan dengan meningkatkan konsentrasi pemadat medium bukan dengan PEG ataupun osmotikum. Hal ini juga terjadi pada pendewasaan ES yang diinduksi dari jaringan endosperma jeruk Siam Simadu dimana penambahan PEG tidak menginduksi pendewasaan ES tetapi kalus embriogenik berkembang menjadi kalus yang tidak terdiferensiasi (data tidak ditampilkan).
Gambar 4. Jumlah embrio somatik pada tahap pendewasaan yang berhasil diinduksi dari jaringan endosperma jeruk Siam Simadu (A) dan persentase pendewasaannya (B), 8 mingu setelah dikulturkan pada media MS modifikasi vitamin MW. Data disajikan dalam rerata; angka rerata yang diikuti dengan huruf yang sama tidak berbeda nyata pada α=0.05 dengan uji DMRT
A
B
ABA (mgL-1)
Gambar 5. Embriogenesis somatik yang diinduksi dari endosperma jeruk Siam Simadu. (A). eksplan jaringan endosperma (end) dengan embrio zigotik (z) dan nuselar (n), bar=100 µm. (B). Kalus embriogenik. (C). Pendewasaan dan perkecambahan embrio somatik. (D) Massa proembriogenik. (E) Globular. (F) Hati. (G) Torpedo. (H) Kotiledon, bar D-H = 1000 µm. (I) Hati abnormal. (J) Torpedo abnormal. (K) Kotiledon abnormal, bar I-K = 2000 µm/ (L-N). Kecambah somatik (plantlet) normal, (O) plantlet abnormal. bar L-O =1 cm
z n A end B C D E F G H I J K L M N O
Tabel 3. Respon embrio somatik tahapan globular yang diinduksi dari jaringan endosperma jeruk Siam Simadu pada media pendewasaan MS modifikasi vitamin MW, 8 minggu setelah dikulturkan MS modifikasi
Media (mg L-1)
Visual embrio somatik dewasa
Visual plantlet Visual kalus
EME500+ABA 0 Normal Belum berkecambah kalus remah kuning kecoklatan
EME500+ABA 0.5 Normal Belum berkecambah kalus remah, kuning kehijauan
EME500+ABA1.0 Normal Belum berkecambah kalus remah, kuning kehijauan
EME500+ABA 1.5 Normal Belum berkecambah kalus remah, kuning kehijauan
EME500+ABA 2.0 Normal Belum berkecambah kalus remah, kuning kehijauan
EME500+ABA 2.5 Normal Belum berkecambah kalus remah, kuning kehijauan
CH250+glut7 Tidak normal,
embrio raksasa
Tidak normal, embrio raksasa
kalus remah, putih kekuningan, sedikit
CH250+biotin7 Tidak normal,
embrio raksasa
Belum berkecambah kalus remah, kuning kehijauan
EME500+ph 3000 Normal Normal kalus remah, kuning kehijauan
Keterangan : EME = Ekstrak malt; ABA= Absicic acid; CH = kasein hidrolisat; glut=Glutamin; Ph = Phytagel
Persentase pendewasaan ES tertinggi dicapai eksplan yang dikulturkan pada media MS modifikasi dengan penambahan glutamin dan kasein hidrolisat, tetapi ES yang dihasilkan morfologinya tidak normal (raksasa, kotiledon menebal dan lebih dari 2) bahkan yang berhasil berkecambah juga menghasilkan kecambah abnormal dengan daun yang menebal (Gambar 5 J, K, O). Pada embriogenesis kelapa sawit penambahan asam amino dan sumber N-organik (Garin et al. 2000; Sghaier et al. 2008) dapat meningkatkan perolehan ES dan perkecambahan yang normal. Pada jeruk, kombinasi asam amino (glutamin) dan sumber N-organik (kasein hidrolisat) dapat meningkatkan persentase pendewasaan ES tetapi tidak menghasilkan embrio dan kecambah yang normal (Gambar 4B, Tabel 3). Munculnya ketidaknormalan morfologi ES yang dihasilkan diduga disebabkan oleh akumulasi N yang tinggi dalam medium akibat penambahan glutamin dan kasein hidrolisa. Glutamin merupakan salah satu jenis asam amino yang sering ditambahkan secara eksogen karena mudah diserap oleh eksplan dari media sehingga bila dikombinasikan dengan sumber N organik lain maka diduga akumulasi protein terutama protein simpanan akan berlebih dan menghambat proses pendewasaan. Hal yang sama juga terjadi pada emberiogenesis somatik chesnut ketika pendewasaan dilakukan pada media yang ditambah dengan asam amino glutamin (Robichaud et al. 2004)
Pada umumnya pendewasaan ES banyak dilakukan dengan menambahkan ABA pada formula mediumnya (Corredoira et al. 2003; Label dan Lalu 2000) karena ABA berperan sebagai komponen untuk menahan perkecambahan dini, meningkatkan akumulasi protein, lemak dan pati cadangan (Sghaier 2008), meningkatkan toleransi desikasi sehingga konversi untuk perkecambahan tinggi (Robichaud et al. 2004), meningkatkan vigoritas, viabilitas embrio (Capuana dan Debergh 1997). Pada embriogenesis somatik yang diinduksi dari jaringan endosperma jeruk Siam Simadu, penambahan ABA tidak memberikan hasil
pendewasaan ES yang lebih baik dibandingkan dengan media tanpa ABA. Meskipun demikian penambahan ABA dapat membentuk ES yang morfologinya normal (Tabel 3). Pada saat akhir pendewasaan ES, diduga keberadaaan ABA menghambat aktivitas enzim LEA untuk mengakumulasi proteinnya sehingga protein simpanan lebih tinggi menyebabkan terbentuknya ES sekunder. Pada ES yang diinduksi dari jaringan endosperma, proses desikasi embrio tidak memerlukan ABA eksogen tetapi lebih sesuai dilakukan dengan cara meningkatkan konsentrasi pemadat medium.
Pada pendewasaan ES yang dilakukan pada media MS modifikasi vitamin MW, perkecambahan terjadi pada media yang sama. Hal ini memungkinkan untuk mengecambahkan ES dengan melakukan sub kultur berulang pada media tersebut. Pemanjangan Plantlet
Kecambah somatik yang diperoleh dari penelitian regenerasi kalus, diinduksi pemanjangan tunasnya. Kecambah dipotong bagian akar atau bakal akarnya, kemudian dikulturkan pada media pemanjangan tunas. Pemotongan bagian akar atau bakal akar ini diperlukan karena umumnya pertumbuhan akar akan lebih cepat daripada tunas, sehingga pemanjangan tunas akan terhambat.
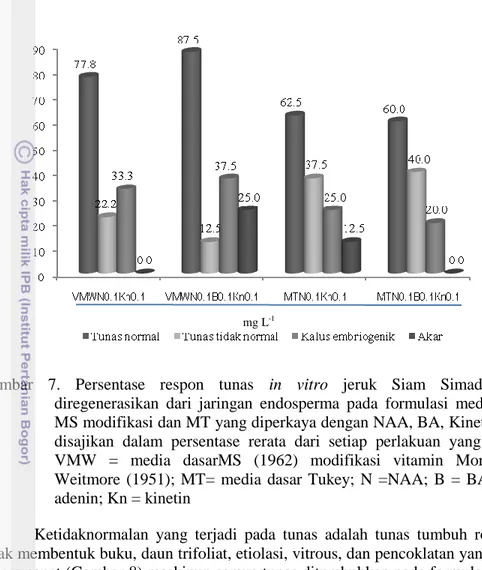
Keragaman eksplan sampai tahap ini masih menunjukkan keragaman yang tinggi yang ditunjukkan dengan tingginya standar deviasi dari rerata setiap parameter yang diamati. Untuk setiap parameter yang diamati terlihat bahwa formulasi media MS yang dimodifikasi vitaminnya tanpa penambahan kinetin memberikan hasil terbaik dan berbeda nyata dengan media yang ditambah dengan kinetin (Gambar 6). Pada embriogenesis somatik yang diinduksi dari jaringan diploid jeruk perkecambahan dan pemanjangan tunas umum pada media dengan penambahan GA3 (Husni et al. 2011; Kunitake et al. 1991; Kayim dan Koc, 2006;
Le at al. 1999; Kotsias dan Rousou 2001). Hal ini terjadi karena GA3 aktif dalam
menginduksi pemanjangan sel dan terutama pada sel-sel ruas batang, sehingga terjadi pemanjangan tunas.
Penambahan kinetin justru menurunkan secara nyata pembentukan jumlah tunas, tinggi tunas, jumlah buku dan jumlah daun (Gambar 6), bahkan tunas yang dihasilkan morfologinya tidak normal. Hal ini berbeda dengan laporan Gill et al. (1995) dan Bahrany (2002) yang mengkombinasikan penambahan GA3 dengan
kinetin dapat memacu pemanjangan tunas jeruk yang diregenerasikan dari jaringan diploid. Kinetin merupakan ZPT yang berperan dalam pembelahan sel untuk menginisiasi pembentukan tunas sehingga ketika dikombinasikan dengan GA3 tidak
Gambar 6. Pertambahan tinggi planlet yang diinduksi dari jaringan endosperma jeruk Siam Simadu pada media MS modifikasi dengan penambahan 2.5 mg L-1 GA3 dan Kinetin (0;1;3 mg L-1), 6 minggu setelah kultur.
Angka rerata yang diikuti dengan huruf yang sama tidak berbeda nyata pada α=0.05 dengan uji DMRT
Pembentukan ES sekunder dari kecambah somatik/planlet yang diinduksi dari jaringan endosperma terbentuk mulai minggu ke empat setelah kultur. Pada media tanpa penambahan kinetin, 44.44% biakan mampu membentuk ES sekunder. Media dengan penambahan kinetin juga mampu membentuk embrio somatik sekunder tetapi persentasenya lebih rendah dari media dengan tanpa penambahan kinetin (Tabel 4).
Pada media pemanjangan ini juga, pada pangkal tunasnya terbentuk kalus embriogenik yang cukup tinggi sampai 88.89% dan menurun dengan meningkatnya konsentrasi kinetin yang ditambahkan. Penurunan persentase pembentukan kalus embriogenik disebabkan oleh berubahnya kesetimbangan ZPT endogen akibat penambahan kinetin eksogen dalam media kultur.
Tabel 4. Respon pembentukan embrio somatik sekunder dari embrio somatik yang diinduksi secara tidak langsung dari jaringan endosperma jeruk Siam Simadu
Media (mg L-1) Es sekunder (%) Kalus embriogenik (%) Keterangan GA32.5+Kn 0 44.44±3.18 88.89±0.33 Tunas normal
GA32.5 +Kn 1 22.22±0.70 66.67±0.50 Tunas normal
GA32.5 +Kn 3 33.33±2.40 22.22±0.44 Tunas tidak normal
KESIMPULAN
Jaringan endosperma jeruk yang dapat diisolasi dari buah muda dan dapat diinduksi pembentukan kalus berasal dari buah/biji yang berumur 11-13 MSA dengan hasil terbaik diperoleh dari jaringan yang berumur 13 MSA.
Media MS modifikasi vitamin MW dapat digunakan untuk menginduksi pembentukan kalus dari jaringan endosperma jeruk Siam Simadu, optimasi pembentukan kalus embriogenik dilakukan dengan menambahkan secara tunggal biotin, atau sumber N organik (ekstrak malt atau kasein hidrolisa).
Pendewasaan embrio somatik yang diinduksi dari jaringan endosperma terbaik dengan morfologi embrio somatik normal diperoleh dari media MS modifikasi tanpa penambahan zat pengatur tumbuh dengan peningkatan konsentrasi pemadat dari 2.5 menjadi 3 g L-1 Phytagel. Perkecambahan embrio somatik dapat dilakukan pada formulasi media yang sama dengan pendewasaan.
Pemanjangan kecambah somatik terbaik dilakukan pada media MS modifikasi dengan penambahan 2.5 mg L-1 GA3. Pada media pemanjangan
terbentuk ES sekunder dan kalus embriogenik pada pangkal planlet yang dapat dikurangi dengan menambahkan kinetin kedalam medium pemanjangan
PERBANYAKAN KLONAL TUNAS IN VITRO JERUK SIAM SIMADU YANG DIREGENERASIKAN DARI JARINGAN ENDOSPERMA
PENDAHULUAN
Pemuliaan tanaman secara in vitro dapat dilakukan dengan menggunakan berbagai sumber sel sebagai eksplan. Keragaman yang terdapat dalam setiap sel dapat diekspresikan pada seluruh bagian tanaman dengan memanfaatkan teknik regenerasi melalui embriogenesis somatik (Gray 2005). Teknik ini memungkinkan untuk meregenerasikan satu sel yang berbeda dengan sel disekelilingnya menjadi tanaman lengkap yang membawa perubahan dari sel tersebut.
Keragaman dari sel-sel yang beregenerasi membentuk tanaman lengkap tidak memungkinkan untuk memperoleh ulangan dari sel-sel yang diregenerasikan, sehingga untuk pengujian lebih lanjut diperlukan satu tahapan untuk menyiapkan populasi ulangan yang seragam Pengulangan yang seragam dapat diperoleh dengan memperbanyak secara klonal planlet yang diperoleh dengan menggunakan eksplan tunas pucuk atau buku dengan bakal tunas.
Jaringan endosperma adalah jaringan yang tersusun dari sel-sel dengan ploidi triploid dengan tingkat keragaman yang tinggi karena perkembangan sel-sel endosperma yang berbeda-beda (Berger 2003; Cossegal et al. 2007). Pada jeruk Siam Simadu, kultur endosperma dapat terkontaminasi oleh jaringan lain dengan ploidi haploid dan diploid. Jaringan diploid berasal dari proembrio nuselar. Jaringan haploid yang mengkontaminasi kultur endosperma dapat berasal dari sel-sel antipodal atau sel sinergid yang tidak terdegradasi setelah fertilisasi ganda terjadi. Dengan keberadaan kontaminan dari jaringan lain dan keragaman sel-sel endosperma, maka sistem regenerasi yang memungkinkan untuk mengekspresikan keragaman tersebut adalah embriogenesis somatik. Embriogenesis somatik memungkinkan untuk memperoleh tanaman yang berasal dari satu sel, sehingga diharapkan ploidinya triploid dan keragaman dari sel endosperma dapat terkespresi pada tanaman triploid yang dihasilkan.
Perbanyakan klonal dengan eksplan tunas pucuk atau buku satu tunas merupakan salah satu teknik perbanyakan yang dapat mempertahankan sifat dari tanaman induknya. Hal ini dimungkinkan karena tunas yang tumbuh merupakan tunas aksilar dimana meristemnya sudah berkembang dalam tanaman itu sendiri, sehingga tidak perlu menginduksi pembentukan meristem baru. Pada umumnya formulasi media yang dapat meningkatkan pertumbuhan tunas aksilar adalah media dasar MS yang diperkaya dengan sitokinin. Meskipun demikian sumber eksplan yang berbeda biasanya memberikan respon yang berbeda pula terhadap formulasi media yang diperkaya dengan zat pengatur tumbuh-ZPT. Media dasar yang digunakan untuk perbanyakan klonal jeruk biasanya menggunakan media dasar MT (Khan et al. 2009; Wu et al. 2009; Maul et al. 2006; Kayim dan Koc 2006; Song dan Deng, 2006; Hao et al. 2004; Almeida et al. 2003;Yao et al. 1996; Gil et al. 1995; Kunitake et al. 1991), tetapi pada embriogenesis somatik jeruk Siam Simadu