BAB 2
TINJAUAN PUSTAKA
2.1. Diabetes Melitus 2.1.1. Definisi
Istilah diabetes merujuk pada kelainan metabolisme yang diakibatkan dari berbagai jenis etiologi, biasa nya ditandai dengan kejadian kronik hiperglikemia serta kelainan pada metabolisme karbohidrat, lemak, dan protein. Kelainan terserbut bisa disebabkan oleh kelainan pada sekresi insulin, kerja insulin, atau keduanya. Efek yang ditimbulkanya bisa berupa kerusakan, disfungsi, dan kegagalan dari berbagai organ tubuh. Diabetes melitus bisa timbul dengan karakteristik gejala berupa polydipsia (banyak minum), polyuria (banyak kencing), dan polyphagia (banyak makan), dapat juga diikuti dengan gejala pengelihatan kabur, dan penurunan berat badan. Pada kondisi yang parah, dapat timbul ketoasidosis, atau hyperosmolar nonketotic yang akan berkembang menjadi stupor, coma, bahkan kematian. Biasanya gejala tidak terlalu parah, atau bahkan tidak ada, dan berakibat pada ketidaktahuan pasien akan penyakit yang dideritanya. Kondisi ini menyebabkan perubahan fungsional tubuh hingga akhirnya tahap akhir kerusakan organ sebelum diagnosis dapat ditegakan. Tahap lanjut meliputi kerusakan progresif dari organ-organ seperti retinopathy dengan kemungkinan kebutaan, nephropathy yang berlanjut pada gagal ginjal, dan neuropathy dengan resiko munculnya ulcer kaki hingga tahap amputasi. Dapat pula muncul gangguan anotomik nervus sistem dan fungsi seksual. Orang dengan diabetes berisiko terkena penyakit jantung, pembuluh darah tepi serta pembuluh darah cerebral ( WHO, 1970 ).
2.1.2. Epidemiologi
ini akan berlanjut mencapai 552 juta penderita pada tahun 2030, yang artinya sekitar 1 dari 10 orang dewasa adalah penderita Diabetes Mellitus (Mufanda eat al, 2015).
Beragam penelitian tentang trend diabetes menjelaskan bahwa ada peningkatan signifikan prevalensi pada kedua daerah perkotaan dan pedesaan termasuk pria dan wanita dengan resiko yang sama. Hal tersebut diakibatkan perubahan demografi (peningkatan kelompok usia tua), urbanisasi, dan perubahan gaya hidup yang beresiko tinggi seperti merokok, obesitas, jarang bergerak (physical inactivity) (Mufanda eat al, 2015).
Menurut data organisasi Persatuan Rumah Sakit di Indonesia (PERSI) , sekitar 14 juta orang menderita DM pada tahun 2006. Dan hanya sekitar 80% yang sadar akan penyakitnya, dan hanya sekitar 30% yang melakukan pengobatan secara teratur. Menurut beberapa penelitian epidemiologi, prevalensi DM berkisar antara 1,5% sampai 2,3%, kecuali Manado yang cenderung lebih tinggi, yaitu 6,1% (Mendrofa, 2012).
2.1.3. Klasifikasi dan Etiologi
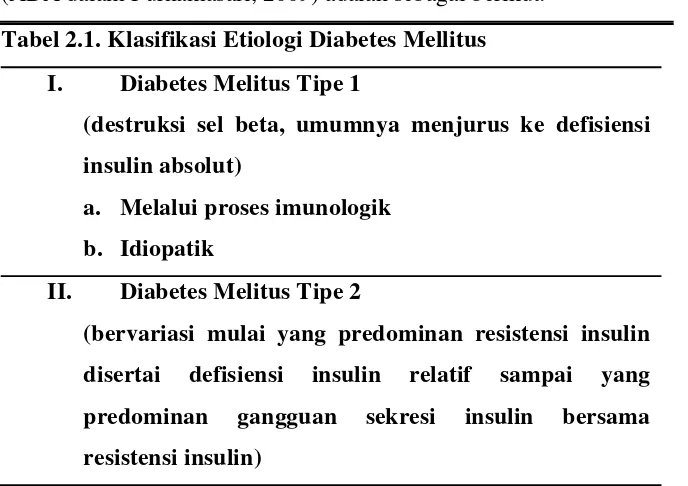
Klasifikasi etiologis DM berdasarkan American Diabetes Association
(ADA dalam Purnamasari, 2009) adalah sebagai berikut: Tabel 2.1. Klasifikasi Etiologi Diabetes Mellitus
I. Diabetes Melitus Tipe 1
(destruksi sel beta, umumnya menjurus ke defisiensi insulin absolut)
a. Melalui proses imunologik b. Idiopatik
II. Diabetes Melitus Tipe 2
III. Diabetes Melitus Tipe Lain
a. Defek genetik fungsi sel beta akibat mutasi pada: - Kromosom 20, Hepatocyte Nuclear Transcription
Factor (HNF) 4α (dahulu MODY 1)
- Kromosom 12, HNF-1α (dahulu MODY 3) - Kromosom 7, Glukokinase (dahulu MODY 2) - Kromosom 13, Insulin Promoter Factor (IPF) 1
(dahulu MODY 4)
- Kromosom 17, HNF-1β (dahulu MODY 5) - Kromosom 2, Neuro DI (dahulu MODY 6) - DNA mitokondria
- lainnya
b. Defek genetik kerja insulin: resistensi insulin tipe A, leprechaunism, sindrom Rabson Mendenhall, diabetes lipoatrofik, lainnya
c. Penyakit Eksokrin Pankreas: pankreatitis, trauma/pankreatektomi, neoplasma, fibrosis kistik, hemokromatosis, pankreatopati fibro kalkulus, lainnya
d. Endokrinopati: akromegali, sindrom Cushing, feokromositoma, hipertiroidisme somatostatinoma, aldosteronoma, lainnya
e. Karena obat/ zat kimia: vacor, pentamidin, asam nikotinat, glukokortikoid, hormone tiroid, diazoxid, agonis β adrenergic, tiazid, fenitoin, interferon alfa, protease inhibitor, clozapine, beta bloker, lainnya f. Infeksi: rubella kongenital, CMV, lainnya
g. Imunologi (jarang): sindrom Stiff-man, antibodi anti reseptor insulin, lainnya
Klinefelter, sindrom Turner, sindrom Wolfram’s, ataksia Friedreich’s, Chorea Huntington, sindrom Laurence-Moon-Biedl, distrofi miotonik, porfiria, sindrom Prader Willi, lainnya
IV. Diabetes Gestasional
2.1.4. Faktor Risiko
Menurut Suyono (2007), DM di Indonesia akan terus meningkat disebabkan beberapa faktor antara lain :
a. Faktor keturunan (genetik)
b. Faktor kegemukan atau obesitas (IMT > 25 kg/m2 )
- Perubahan gaya hidup dari tradisional ke gaya hidup barat - Makan berlebihan - Hidup santai, kurang gerak badan c. Faktor demografi
- Jumlah penduduk meningkat – Urbanisasi - Penduduk berumur di atas 40 tahun meningkat d. Kurang gizi (Mendrofa, 2011).
2.1.5. Patogenesis
Pada DM tipe 1 atau lebih dikenal dengan nama Insulin Dependent Diabetes Mellitus (IDDM), terjadi karena kerusakan sel β pankreas (reaksi autoimun). Sel β pankreas merupakan satu-satunya sel tubuh yang menghasilkan insulin yang berfungsi untuk mengatur kadar glukosa dalam tubuh. Autoimun merupakan salah satu penyebab tersering dari DM, dan sebagian kecil disebabkan oleh non autoimun. Proses autoimun biasanya dipicu oleh suatu infeksi atau stimulus lingkungan. Akibat dari proses autoimun tersebut hampir tidak terdapat insulin dalam sirkulasi darah, glukagon plasma plasma meningkat dan sel-sel β pancreas gagal merespons peningkatan glukosa dalam darah. Sering sekali dijumpai kondisi ketoasidosis pada pasien penderita DM tipe 1. Oleh karena itu pemberian insulin penting untuk memperbaiki dalam penatalaksanaan DM tipe 1.
Bila telah terjadi kerusakan lebih dari 80% pada sel β pankreas maka gejala DM
Pada saat terjadinya diabetes melitus tergantung insulin, sebagian besar sel
β pankreas sudah rusak hampir pasti karena autoimun. Ada beberapa serangkaian
kondisi yang setidaknya dimiliki penderita yang berperan dalam munculnya penyakit ini, yaitu : 1) Harus ada kerentanan genetik terhadap penyakit ini. 2) Keadaan lingkungan biasanya memicu proses ini pada individu yang memiliki kerentanan genetik. Infeksi virus juga diyakini sebagai suatu pemicu, meskipun ada agen noninfeksius yang dapat berperan didalamnya. 3) Peradangan pankreas yang disebut insulitis. Biasanya ditemukan sel monosit/makrofag dan limfosit T teraktivasi yang menginfiltrasi sel-sel pulau langerhans. 4) Perubahan atau
transformasi sel β sehingga dikenali sebagai sel asing oleh sel imun. 5)
Selanjutnya adalah perkembangan respon imun. Karena sel β pankreas dikenali tubuh oleh sel asing, sehingga terjadi respon imun yang akan menghancurkan sel
β pankreas melalui pembentukan antibodi anti sitotoksik dan bekerja sama dengan sel imun seluler. Terkadang DM tipe satu dapat berkembang melalui pengaruh lingkungan saja, contohnya pada peminum vacor (racun tikus) atau DM tipe satu juga dapat berkembang tanpa melalui pengaruh lingkungan misalnya pada genetik murni. Namun urutan patogenetiknya biasanya adalah predisposisi genetik – pengaruh lingkungan – insulitis – perubahan sel beta menjadi sel asing – aktivasi sistem imun – pengerusakan sel beta – diabetes melitus (Foster, 2000).
DM tipe 2 memiliki ciri-ciri berupa defek pada sekresi dan resistensi dari insulin, yang kemungkinan keduanya turut berperan dalam munculnya manifestasi klinis, karena individu dengan obesitas dan resistensi insulin yang nyata dapat mempunyai toleransi glukosa yang normal. Mungkin individu ini tidak
mempunyai lesi sel β. Hal ini menunjukkan bahwa defek utama terletak pada sel penghasil insulin. Massa sel β intak pada DM tipe 2, yang berlawanan dengan DM tipe 1, namun jumlah sel α mengalami peningkatan sehingga rasio glukagon
dibanding insulin meningkat. Hal ini juga yang mendukung keadaan hiperglikemik pada DM tipe 2 (Foster, 2000).
disekresi bersama dengan insulin) di pankreas pada DM tipe 2 yang merupakan suatu pertanda bahwa terjadi peningkatan produksi insulin akibat resistensi. Penelitian pada hewan menunjukkan ada pengaruh amilin (bentuk jamak: amiloid) terhadap resistensi insulin, namun kesimpulan amilin dapat menyebabkan resistensi insulin masih belum dapat disimpulkan (Foster, 2000).
Tanpa memandang mekanisme resistensi insulin, konsekuensi fisiologisnya masih belum jelas. Tidak ada kelainan utama baik pada ambilan glukosa oleh sel atau metabolisme oksidatif menjadi CO2, air dan laktat. Blok metabolik utama terjadi pada sintesis glikogen (metabolisme nonoksidatif). Metabolisme nonoksidatif glukosa yang terganggu, seperti pada hiperinsulinemia dan resistensi insulin, dapat terlihat pada individu nonobes, relatif normoglikemik dengan DM tipe 2 (Foster, 2000).
DM tipe 2 mempunyai onset usia diatas 40-an tahun, atau lebih tua, dan biasanya tidak menunjukkan gejala ketoasidosis. Kebanyakan penderita memiliki berat badan berlebih (overwheight). Atas dasar inilah maka penderita dibagi menjadi 2 kelompok yaitu : (1) kelompok obes dan (2) kelompok non-obes. Kemungkinan menderita DM tipe 2 menjadi meningkat berkali-kali lipat jika berat badan bertambah sebanyak 20% dari berat badan ideal dan usia meningkat 10 tahun atau diatas 40 tahun (Mendrofa, 2012).
Gejala muncul secara perlahan dan biasanya ringan (bahkan terkadang membutuhkan waktu bertahun-tahun untuk muncul) serta progresivitas gejala berjalan lambat. Ketoasidosis biasanya tidak muncul, kecuali pada kasus tertentu yang disertai stress atau infeksi. Kadar insulin menurun atau bahkan tinggi, namun tidak bekerja efektif (Arisman dalam Mendrofa, 2012).
2.1.6. Fisiologi dan Patofisiologi 2.1.6.1. Struktur kimia insulin
retikulum endoplasma kasar, kemudian diangkut kedalam aparatus golgi dan dikemas dalam granula-granula tempat dimana proinsulin akan dihidrolisis menjadi insulin dan suatu peptida-C dengan menghilangkan empat asam amino penghubung (Nolte, 2007).
Insulin dan peptida-C disekresikan dalam jumlah yang ekuimolar sebagai respon terhadap semua agan perangsang insulin bersama sebagian proinsulin yang tidak terhidrolisis. Proinsulin diduga memiliki efek hipoglikemik, tetapi belum diketahui apakah protein-C memiliki efek fisiologis. Granula di dalam sel B meyimpan insulin dalam bentuk kristal yang mengandung dua atom seng dan enam molekul insulin. Secara keseluruhan manusia menyimpan sebanyak 8 mg insulin, atau sekitar 200 unit biologis (Nolte, 2007).
2.1.6.2. Sekresi insulin
Insulin disekresikan dari sel B pankreas dengan laju basal yang rendah dan laju basal yang rendah dan dengan laju yang jauh lebih tinggi bila terstimulasi dengan berbagai rangsangan, khususnya glukosa. Stimulan lain yang juga dikenal seperti gula (misalnya, manosa), asam amino tertentu (misalnya, leusin, arginin), dan aktivitas nervus vagus. Dalam gambar di bawah diperlhatkan bahwa hiperglikemia menyebabkan peningkatan kadar ATP intrasel yang akan menutup kanal kalium sehingga terjadilah suatu depolarisasi. Depolarisasi tersebut akan membuka kanal kalsium. Efluks kalsium intrasel akan mencetuskan eksositasi dari insulin (Nolte, 2007).
2.1.6.3.Insulin dalam sirkulasi
Kadar insulin basal pada manusia adalah 5-15 µU/mL (30-90 pmol/L), dengan kadar puncak sekitar 60-90 µU/mL (360-540 pmol/L) pada waktu makan (Nolte, 2007).
2.1.6.4. Reseptor insulin
Setelah beredar di sirkulasi, insulin kemudian berdifusi dalam jaringan dan berikatan pada reseptor khusus pada membran jaringan, seperti pada hati, otot, dan jaringan adiposa. Reseptor tersebut mengandung dua heterodimer yang terikat secara kovalen, dan masing-masing mengandung subunit α yang merupakan
daerah pengenal dan seluruhnya terdapat di luar membran, serta subunit β yang
menembus ketebalan membran sel. Subunit β mengandung protein kinase yang akan aktif setelah serangkaian proses mulai dari pengikatan insulin pada subunit
α, hingga terjadilah suatu konformasi yang mendekatkan lengkung katalitik subunit β sitoplasmik yang berhadapan. Hal tersebut kemudian memfasilitasi
fosforlisasi timbal balik residu tirosin pada subunit β dan aktifitas tirosin kinase
kemudian diarahkan pada protein sitoplasma (Martha, 2007).
Protein plasma yang difosforilasi oleh reseptor tirosin kinase aktif adalah docking protein, yaitu substrat reseptor insulin-1 sampai -6. Setelah fosforilasi tirosin terjadi di sejumlah tempat kritis , molekul IRS berikatan dan mengaktifkan kinase lain yang terpenting adalah fosfatidilinositol-3 kinase yang menimbulkan fosforilasi lebih lanjut atau berikatan pada suatu protein adaptor seperti protein pengikat reseptor faktor pertumbuhan-2, yang mentranslasikan sinyal insulin menjadi suatu faktor pelepas nukleotida guanin hingga akhirnya mengaktifkan protein ras pengikat GTP, dan sistem protein kinase yang teraktifkan-mitogen (MAPK). Tirosin kinase tertentu yang terfosforilasi IRS memiliki spesifisitas pengikatan dengan molekul hilir berdasarkan motif atau sekuens 4-5 asam amino di sekitar-nya yang mengenali domain src homolog 2 yang spesifik pada protein lain. Jaringan fosforilasi ini dalam sel merupakan perantara kedua insulin dan menimbulkan berbagai efek, termasuk tranlokasi transporter glukosa (terutama GLUT-4) ke membran sel sehingga menyebabkan peningkatan ambilan glukosa, peningkatan aktifitas glikogen sintase dan peningkatan pembentukan glikogen, berbagai efek terhadap sintesis protein, lipolisis, dan lipogenesis, dan aktivasi faktor transkripsi yang memacu sintesis DNA dan pembelahan serta pertumbuhan sel. Jalur IRS-2 berkaitan dengan mitogenesis dan proliferasi sel (Nolte, 2007).
Beberapa agen hormonal tertentu seperti glukokortikoid dapat menurunkan afinitas insulin terhadap reseptornya. Namun, kelebihan hormon pertumbuhan meningkatkan sedikit afinitas insulin terhadap reseptornya.
Penyimpangan pada fosforilasi serin dan treonin dalam subunit β reseptor insulin
atau molekul IRS dapat menimbulkan resistensi insulin dan penekanan (down regulation) reseptor fungsionalnya (Nolte, 2007).
2.1.6.5. Efek insulin terhadap targetnya
Insulin berperan penting pada proses biologis tubuh terutama fungsinya dalam meningkatkan simpanan lemak dan glukosa dan mempengaruhi pertumbuhan sel serta fungsi metabolik berbagai jaringan (Sherwood, 2009).
otot rangka dan hati; 3) Insulin menghambat penguraian glikogen menjadi glukosa (glikogenolisis), maka insulin cenderung bertindak dalam mempertahankan cadangan karbohidrat; 4) Insulin menurunkan pengeluaran glukosa dari hati dengan menghambat glukoneogenesis, perubahan asam amino menjadi glukosa. Karena itu insulin mengurangi kadar glukosa dari darah dengan mendorong penyerapan glukosa oleh sel (Sherwood, 2009).
Zat-zat lain yang mempengaruhi pengeluaran insulin dari pankreas adalah asam amino, asam lemak bebas, badan keton, glukagon, sekretin, dan obat sulfonilurea tolbutamid dan gliburid yang diresepkan pada penderita DM tipe 2, obat ini bekerja dengan menghambat kanal k+ yang peka terhadap atp (Bender, 2009).
Secara sederhana efek insulin pada lemak bersifat anabolik, yaitu menyerap lemak dari darah dan merangsang pembentukan trigliserida, serta menghambat penguraian lemak (lipolisis). Hal ini juga sama pada protein, insulin juga bersifat anabolik seperti merangsang penyerapan asam amino dari darah ke dalam sel, merangsang pembentukan protein dari asam amino, dan menghambat penguraian protein (Sherwood, 2009).
Dilihat dari lingkup kerjanya, GLUT-4 merupakan satu-satunya jenis pengangkut jenis pengangkut glukosa yang berespons terhadap insulin. GLUT-4 akan dikeluarkan dari membran jika terdapat insulin, berbeda dengan jenis GLUT lainya. Sel-sel yang bergantung dengan insulin akan mempertahankan insulin dalam vesikel-vesikel intrasel dan akan disisipkan ke membran jika dibutuhkan. Sehingga peningkatan sekresi insulin akan meyebabkan penyerapan glukosa 10 sampai 30 kali lipat oleh sel-sel dependen insulin (Sherwood, 2009).
Hati atau hepar juga tidak membutuhkan GLUT-4 dalam penyerapan glukosa, namun hepar merupakan suatu organ yang penting dalam pengaturan homeostasis glukosa tubuh. Insulin dalam hal ini dapat meningkatkan metabolisme glukosa. Peninggian kadar glukosa darah puasa, lebih ditentukan oleh peningkatan produksi glukosa endogen yang berasal dari proses glukoneogenesis dan glikogenolisis di jaringan hepar. Dalam hal ini, insulin berperan menginhibisi proses pembentukan glukosa endogen yang berlebihan. Semakin tinggi tingkat resistensi insulin, semakin rendah kemampuan inhibisinya terhadap proses glikogenolisis dan glukoneogenesis, dan semakin tinggi tingkat produksi glukosa dari hepar (Manaf, 2006).
2.1.6.6. Patofisiologi Diabetes Melitus
Pada diabetes mellitus, defisiensi atau resistensi hormon insulin menyebabkan kadar gula darah menjadi tinggi akibat menurunnya ambilan glukosa oleh jaringan otot dan adiposa serta peningkatan pengeluaran glukosa oleh hati. Dikarenakan sifat glukosa yang dapat menarik cairan, maka penderita cenderung untuk lebih banyak buang air kecil (poliuri). Hal ini kemudian mengakibatkan dehidrasi akibat air dibuang dalam jumlah banyak, sehingga menyebabkan rasa haus dan selalu ingin minum (polidipsia). Dikarenakan sel jaringan tidak pernah atau kurang mendapatkan suplai glukosa dari luar, maka volume dan masa sel-sel tubuh menjadi menyusut serta mengirimkan sinyal terus ke otak untuk merangsang pusat lapar, dan menyebabkan penderita cenderung untuk makan terus-menerus (polifagi) ( Arsono, 2005).
Defisiensi insulin dapat terjadi melalui 3 jalan, yaitu : 1) rusaknya sel-sel β pankreas karena pengaruh tertentu dari luar (virus, zat kimia tertentu, dll) ataupun dari dalam (autoimmune); 2) Desensitasi reseptor glukosa pada kelenjar pankreas; 3) Desensitasi atau kerusakan reseptor insulin (down regulation) di jaringan perifer (Arsono, 2005).
klinis yang biasa. Pertama, glukosa plasma tetap normal meskipun terlihat resistensi insulin meskipun kadar insulin meningkat. Pada fase kedua resistensi insulin cenderung memburuk, ditandai dengan intoleransi glukosa dalam bentuk hiperglikemia setelah makan meskipun konsentrasi insulin meningkat setelah makan. Pada fase ketiga, resistensi insulin tidak berubah, tetapi sekresi insulin menurun, menyebabkan hiperglikemia puasa dan diabetes yang nyata. Berdasarkan penemuan Foster (2000) resistensi insulin adalah hal yang pertama muncul yang kemudian diikuti respon tubuh untuk mensekresikan lebih banyak insulin sebagai respon terhadap resistensi sehingga muncul kondisi hiperinsulinemia. Namun hiperinsulinemia (dan kemungkinan amilin) itu sendiri dapat menyebabkan resistensi insulin. Hipotesis yang dijelaskan melibatkan sintesis lemak terstimulasi insulin dalam hati dengan transpor lemak (melalui lipoprotein kepadatan sangat rendah / VLDL) menyebabkan penyimpanan lemak sekunder dalam otot. Peningkatan oksidasi lemak akan mengganggu pengambilan glukosa dan sintesis glikogen. Penurunan pelepasan insulin yang terlambat dapat disebabkan oleh efek toksik glukosa terhadap pulau langerhans atau secara langsung melalui efek genetik yang mendasari. Sebagian besar pasien NIDDM adalah obes, dan diyakini obesitas itu sendiri menyebabkan resistensi insulin. Namun penderita NIDDM yang tidak obese dapat mengalami hipersekresi insulin dan pengurangan kepekaan insulin sehingga dibuktikan bahwa obesitas itu sendiri bukan merupakan satu-satunya penyebab resistensi insulin (Foster, 2000).
Pada kehamilan terjadi resistensi insulin fisiologis akibat peningkatan hormon-hormon kehamilan (human placental lactogen/HPL, progesterone, kortisol, prolaktin) yang mencapai puncaknya pada trimester ketiga kehamilan. Tidak jauh berbeda dengan patofisiologi DM tipe 2 , pada DMG juga terjadi gangguan sekresi insulin oleh sel β pankreas yaitu berupa : 1) autoimun, 2) kelainan genetik, dan 3) resistensi insulin kronik. Xiang mengungkapkan dalam studinya bahwa para wanita yang memiliki DMG mengalami gangguan
(1,6%-3,8%), dan sekitar 5% dari populasi DMG diketahui memiliki defek sel β seperti mutasi pada glukokinase (Adam, 2009).
Resistensi insulin selama kehamilan merupakan mekanisme adatif tubuh untuk menjaga asupan nutrisi ke janin (fisiologis). Sementara resistensi insulin kronik terjadi pada wanita yang memiliki obesitas. Wanita dengan DMG kebanyakan memiliki kedua jenis resistensi (fisiologis dan kronik) sehingga manifestasi klinisnya lebih berat dibandingkan kehamilan normal. Kondisi ini akan segera membaik segera setelah partus dan akan kembali normal setelah masa nifas, dimana konsentrasi HPL sudah menurun (Adam, 2009).
2.1.7. Diagnosis Diabetes Melitus
Berbagai keluhan dapat ditemukan pada penyandang DM. Kecurigaan adanya DM perlu dipikirkan apabila terdapat keluhan klasik DM, antara lain (PERKENI dalam Purnamasari, 2009).
a. Keluhan klasik DM berupa : poliuria, polifagia, dan penurunan berat badan yang tidak dijelaskan sebabnya.
b. Keluhan lain dapat berupa : lemah badan, kesemutan, gatal, mata kabur dan disfungsi ereksi pada laki-laki serta pruritus vulva pada perempuan.
Selain dengan keluhan, diagnosa DM harus ditegakkan berdasarkan pemeriksaan kadar glukosa darah dengan cara enzimatik dengan bahan darah plasma vena. Penggunaan bahan darah utuh (whole blood), vena ataupun kapiler sesuai kondisi dengan memperhatikan angka-angka kriteria diagnostik yang berbeda sesuai pembakuan WHO. Sedangkan untuk tujuan pemantauan hasil pengobatan dapat dilakukan dengan menggunakan pemeriksaan glukosa darah kapiler (PERKENI dalam Purnamasari, 2009).
Tabel 2.2. Kriteria diagnosis DM (Purnamasari, 2009)
1. Gejala klasik DM + glukosa darah sewaktu ≥200 mg/dl (11,1 mmol/L)
Glukosa darah sewaktu merupakan hasil pemeriksaan sesaat pada suatu hari tanpa memperhatikan waktu makan terakhir
2. Atau, gejala klasik DM + glukosa plasma puasa ≥126 mg/dl (7,0 mmol/L) Puasa diartikan pasien tidak mendapat kalori dalam waktu sedikitnya 8 jam.
3. Glukosa plasma puasa 2 jam pada TTGO ≥ 200 mg/dl (11,1 mmol/L)
TTGO dilakukan dengan standar WHO, menggunakan beban standar yang setara dengan 75 gram glukosa anhidrus (mengandung 1 molekul air hidrat) yang dilarutkan kedalam air.
Tabel 2.3. diagnosis menurut ADA,
Diagnosis DM menurut ADA (2012) dapat ditegakkan melalui salah satu cara berikut,
1. HbA1c ≥6,5%. Tes ini harus dilakukan di laboratorium yang
menggunakan metode bersertifikat serta sudah distandarisasi.
2. Glukosa plasma puasa (Fasting Plasma Glucose = FPG) ≥ 126 mg/dl
(7,0 mmol/l). Puasa didefinisikan sebagai tidak adanya asupan kalori selama minimal 8 jam.
3. Glukosa plasma 2 jam ≥ 200 mg/dl (11.1mmol/l) selama tes toleransi glukosa oral (TTGO). Tes harus dilakukan seperti yang dijelaskan oleh WHO yaitu menggunakan glukosa dengan beban 75 g dilarutkan dalam air.
4. Pada pasien dengan gejala klasik hiperglikemia atau krisis hiperglikemia,
2.1.8. Komplikasi Diabetes Melitus 2.1.8.1. Komplikasi Akut
Komplikasi akut yang sering dialami penderita DM adalah kontrol gula darah, yaitu berupa hiperglikemia/ketoasidosis dan hipoglikemia. Apabila kadar insulin sangat menurun pasien mengalami hiperglikemia dan glukosuria berat penurunan lipogenesis, peningkatan lipolisis dan peningkatan oksidasi asam lemak bebas disertai pembentukan badan keton (asetoasetat, hidroksibutirat, dan aseton) yang dapat menurunkan pH darah sehingga terjadilah asidosis. Asidosis merupakan kondisi yang berbahaya, dan bila tidak segera ditolong dapat menyebabkan koma dan kematian. Selain itu glikosuria dan ketonuria yang jelas dapat mengakibatkan diuresis osmotik dengan hasil akhir kehilangan dehidrasi dan kehilangan elektrolit. Hal ini dapat menyebabkan hipotensi dan syok (jarang terjadi), yang juga dapat mneyebabkan penderita koma dan meninggal (Schteingart, 2002).
Hiperglikemia, hiperosmolar, koma nekrotik (HHNK) merupakan komplikasi akut lain yang sering terjadi pada penderita DM tipe 2 usia lanjut. Bukan karena defisiensi absolut, tetapi relatif dan muncul tanpa ketosis. Hiperglikemia ditandai dengan kadar glukosa yang lebih dari 600 mg/dl. Kondisi ini menyebabkan hiperosmolaritas, diuresis osmotik, dan dehidrasi berat. Pasien dapat segera meninggal jika tidak ditolong, dan angka mortalitas sebesar 50%. Biasa dilakukan penanganan berupa terapi cairan pengganti beserta elektrolit dan insulin regular (Schteingart, 2002).
berbahaya karena dapat menyebabkan kerusakan otak permanen bahkan kematian (Schteingart, 2002).
2.1.8.2. Komplikasi kronik
Komplikasi kronik diabetes melitus terutama disebabkan gangguan integritas pembuluh darah, yaitu penyakit mikrovaskuler dan makrovaskuler dan biasanya berkaitan dengan perubahan metabolik seperti hiperglikemia. Tiga kelainan patogenesis yang berhubungan dengan komplikasi kronik diabetes melitus adalah : glikosilasi non enzimatik, perubahan glukosa pada jalur poliol, dan aktivasi protein kinase C. Kerusakan vaskuler merupakan gejala yang khas bagi DM, dikenal dengan nama angiopati diabetika. Makroangiopati (kerusakan makrovaskuler) biasanya muncul sebagai gejala klinik berupa penyakit jantung iskemik dan pembuluh darah perifer. Adapun mikroangiopati (kerusakan mikrovaskuler) memberikan manifestasi berupa retinopati, nefropati, dan neuropati (Arsono, 2005).
2.2. Penyakit Ginjal Kronik
2.2.1. Definisi dan Klasifikasi Penyakit Ginjal Kronik
Berdasarkan panduan dari KDOQI (Kidney Disease Outcomes Quality Initiative) tahun 2002, penyakit ginjal kronik didefinisikan sebagai kerusakan ginjal atau penurunan Glomerulal Filtration Rate (GFR) kurang dari 60 mL/min/1.73 m² selama lebih dari 3 bulan. Gagal ginjal merupakan kelainan patologis pada ginjal, yang ditandai dengan abnormalitas pada darah dan urin pada hasil lab. Hal serupa juga dikemukakan oleh lee pada 2015 lalu, yaitu dengan tambahan albuminuria lebih dari 30 mg/24 jam.
75%. Riwayat pasien seperti hypertensi, diabetes, tampilan ginjal yang mengecil pada foto polos mungkin dapat membantu mengindikasikan penyakit. Penyakit ginjal dapat mengarah pada kerusakan yang irreversibel (william, 2008).
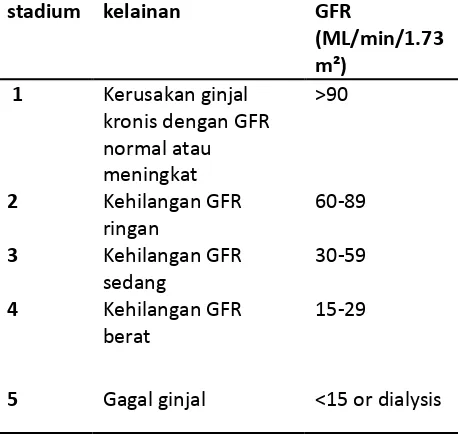
Tabel 2.4. Derajat keparahan penyakit ginjal berdasarkan GFR (KDOQI, 2002)
Klasifikasi penyakit telah dibuat berdasarkan derajat penurunan laju filtrasi glomerulus, yang akan disajikan pada tabel di atas.
2.2.2. Epidemiologi Gagal Ginjal
Di Amerika jumlah penderita penyakit gagal ginjal yang telah diobati dengan dialisis dan transplantasi meningkat dari 340.000 orang pada 1999, menjadi 651.000 orang pada tahun 2010 (Andrew et al, 2013).
Berdasarkan penelitian lain disebutkan bahwa angka insidensi gagal ginjal sekitar 330 kasus per 1 juta penduduk. 128.000 diantaranya diberi penatalaksanaan transplantasi ginjal, sisanya masih dengan dialisis. Kasus kejadian ini berkaitan dengan diabetes melitus (William, 2008).
2.2.3. Etiologi Gagal Ginjal Kronik
Berbagai jenis kelainan dapat memiliki hubungan dengan kejadian gagal ginjal. Bisa secara langsung menyebabkan kelainan atau primary renal process (glumerulonefritis, pyelonefritis, congenital hypoplasia), atau secara tidak langsung (secondary, misalnya berkaitan dengan sistemik sperti diabetes melitus, lupus erythematosus) dapat bertanggung jawab. Ketika muncul suatu injury atau kerusakan, sisa nefron yang masih normal bekerja lebih keras untuk mengatasi beban ginjal. Progresi dari penyakit akan terus berkembang hingga ke stadium selanjutnya. Ditambah lagi dengan jika penderita mengalami dehidrasi, infeksi suatu agen, hypertensi maupun diabetes, maka dapat dipastikan gagal ginjal akan semakin parah (William, 2008).
Meskipun memiliki banyak penyebab, gagal ginjal mirip satu dengan yang lain, dan jika didefinisikan secara sederhana adalah defisiensi jumlah total nefron yang berfungsi dan kombinasi gangguan yang tidak dapat ditelakkan lagi (Wilson, 2002).
Berikut disajikan tabel berupa etiologi PGK,
Tabel 2.5. Etiologi Penyakit Ginjal Kronik (Wilson, 2002). Klasifikasi Penyakit Penyakit
Penyakit Infeksi Tubulointersitial
Pielonefritis kronik atau refluks nefropati
Penyakit Peradangan Glomerulonefritis
Penyakit Vaskular Hipertensif
Nefrosklerosis benigna Nefrosklerosis maligna Stenosis arteri renalis Gangguan Jaringan Ikat Lupus eritematous sistematik
Gangguan Kongenital dan Herediter
Penyakit ginjal polikistik Asidosis tubulus ginjal
Penyakit Metabolik Diabetes melitus Gout
Hiperparatiroidisme Amiloidosis
Nefrotopati Toksik Penyalahgunaan analgesik nefropati timah
Nefropati Obstruktif Traktus urinarius bagian atas : batu, neoplasma, fibrosis,
retroparitoneal.
Traktus urinarius bagian bawah : hipertropi prostat, striktur uretra, anomali kongenital leher vesika
urinaria dan uretra.
2.2.4. Patogenesis Gagal Ginjal Kronik
Mekanisme tepat yang mengakibatkan kemunduran fungsi ginjal secara progresif masih belum jelas, tetapi faktor-faktor yang memainkan peran penting sudah diketahui, yang mencakup cidera immunologi yang berlangsung terus menerus sehingga menimbulkan radang glomerulus yang akhirnya menimbulkan jaringan parut (Bergstein, 2012).
Secara umum, perjalanan klinis gagal ginjal dibagi menjadi 3 stadium. Stadium pertama adalah penurunan cadangan ginjal, dengan kadar kreatinin serum dan urea masih normal, di sini penderita belum mengeluhkan apa-apa (asimptomatik). Tetapi jika diberikan beban kerja berat pada ginjal atau dengan penelitian GFR secara teliti, maka gangguan / kelainan mungkin dapat ditemukan (Wilson, 2002).
(nilai GFR 25% dari nilai normal). Azotemia biasanya masih ringan ( dengan pengecualian terhadap kondisi infeksi, dehidrasi, dan gagal jantung ). Insufisiensi ginjal pada stadium ini menyebabkan poliuria dan nokturia yang diakibatkan oleh gangguan pemekatan, namun penderita mungkin belum memperhatikan gejala ini. Nokturia didefinisikan sebagai pengeluaran urin pada malam hari sebanyak 700 ml, atau pasien terbangun sebanyak beberapa kali untuk buang air kecil pada malam hari. Poliuria adalah peningkatan urine yang terjadi secara terus menerus dan lebih dari 1500 ml per hari. Insufisiensi ginjal biasanya lebih besar pada penderita kelainan tubulus, sehingga pada gagal ginjal pada stadium ini tidak lebih dari 3 liter perhari (Wilson, 2002).
Stadium ketiga adalah stadium terakhir gagal ginjal (ESRD) dengan kerusakan nefron ginjal lebih dari 90%, atau kira-kira 200.000 nefron yang masih tersisa. GFR bernilai 10% dari normal dan bersihan kreatinin sekitar 5-10 ml per menit aau kurang. Nilai BUN dan kreatinin serum meningkat dengan sangat mencolok sebagai respon terhadap GFR yang sangat rendah. Gejala mungkin cukup parah karena ginjal tidak mampu lagi mempertahankan homeostasis cairan dan elektrolit dalam tubuh (asidosis metabolik, anuria, edema, hipertensi, retinopati, dsipnea, anemia hemolisis, mual muntah, dan lain-lain). Urin menjadi isoosmotis dengan plasma sehingga berat jenis tetap pada 1,010. Pasien menjadi oliguria (urin output kurang dari 500 ml per hari ) bahkan bisa menjadi anuria, dikarenakan kegagalan glomerulus memproduksi urin, meskipun penyakit mula-mula menyerang tubulus (Wilson, 2002).
Meskipun stadium penyakit dapat dibagi menjadi 3, namun tidak ada batas-batas yang jelas antara stadium tersebut. Bentuk hiperbolik grafik azotemia yang dihasilkan dengan membandingkannya dengan nilai GFR memperlihatkan bahwa penyakit ini berkembang secara perlahan-lahan, dan makin lama makin cepat (Wilson, 2002).
2.2.5. Patofisiologi Umum Gagal Ginjal Kronik.
terjadi kerusakan nefron pada gagal ginjal, namun beban jumlah zat yang harus dikeluarkan untuk mempertahankan homeostasis adalah tidak berubah, sehingga sisa nefron yang ada bekerja dengan keras dan mengalami hipertrofi untuk menyelesaikan pekerjaannya. Terjadi hiperfiltrasi atau peningkatan daya dorong filtrasi sehubungan dengan dilatasi arteriola aferen dan vasokontriksi arteriola eferen akibat angiotensin II. Mekanisme kompensasi ini cukup efektif untuk mempertahankan keseimbangan homestasis cairan dan elektrolit hingga derajat tertentu sekaligus memelihara fungsi ginjal (Bergstein, 2012).
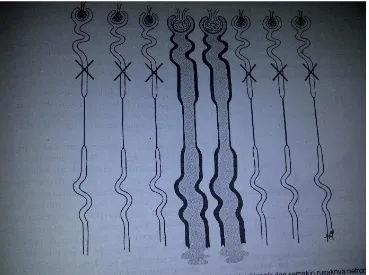
Gambar 2 dibawah memperlihatkan 6 dari 8 buah nefron yang hancur dan 2 sisanya mengalami hipertrofi (Wilson, 2002).
Gambar 2.3. 2 dari 8 nefron yang rusak mengalami hipertrofi (Wilson, 2002).
beban ekskresi, mengakibatkan lingkaran setan peningkatan aliran darah glomerulus dan hiperfiltrasi (Bergstein, 2012).
Jika kerusakan sudah mencapai sekitar 75% masa nefron maka beban kerja nefron yang demikian tinggi mengakibatkan ketidakseimbangan glomerulus-tubulus (keseimbangan laju filtrasi dan reabsorbsi glomerulus-tubulus) tidak dapat lagi dipertahankan. fleksibilitas baik pada ekresi maupun konservasi zat terlarut dan air menjadi berkurang. Dengan sedikit mengkonsumsi makanan dapat mengubah keseimbangan yang rawan tersebut, karena makin rendah GFR maka semakin besar perubahan kecepatan ekspresi per nefron dan selanjutnya hilangnya kemampuan nefron untuk memekatkan dan mengencerkan urine menyebabkan berat jenis urine tetap pada 1,010 atau 285 mOsm (sama dengan plasma) hal inilah yang kemudian menimbulkan poliuria dan nokturia. Perlu di ingat bahwa orang normal dapat memekatkan urinenya hingga 4 kali nilai plasma, sehingga urine nya menjadi lebih pekat dan secara otomatis air yang dikeluarkan pun lebih sedikit, hal itu juga bergantung dari apa yang dia makan. Sementara pada penderita gagal ginjal maka untuk mengeluarkan zat terlarut 600 mOsm (285 mOsm/L pada orang gagal ginjal) maka dia akan kehilangan air sebanyak 2 liter (Wilson, 2002).
Proteinuria menetap dan hipertensi sistemik karena sebab apapun dapat merusak dinding kapiler glomerulus secara langsung, mengakibatkan sklerosis glomerulus dan permulaan cidera hiperfiltrasi (Bergstein, 2012).
2.2.6. Diagnosa dan Temuan Klinis 2.2.6.1. Pemeriksaan fisik dan inspeksi
perikarditis, kelainan neurologik seperti astriksis, perubahan status mental, dan neuropati perifer hanya ditemukan pada stadium akhir gagal ginjal (ESRD). Jika ginjal teraba mungkin disebabkan oleh penyakit ginjal polikistik. Gangguan pada mata (retinopati) biasanya berkaitan dengan sindroma metabolik (William, 2008).
2.2.6.2. Anamnesa
Pada 20% kasus riwayat orang tua dan genetik mungkin berpengaruh terhadap timbulnya penyakit. Namun perlu juga ditanyakan riwayat penyakit infeksi ginjal terdahulu pada pasien, serta riwayat konsumsi obat dan kemungkinan riwayat keracunan ( misal timbal) (William, 2008).
2.2.6.3. Pemeriksaan lab dan lanjutan
Penegakan pasti penyakit ginjal kronik memerlukan beberapa pemeriksaan lab, mulai dari pemeriksaan analisa urine dan analisa darah.
Pada analisis urin, terjadi peningkatan volume urin yang tergantung dari derajat keparahan. Jumlah air dan garam yang normal pada urin kemungkinan disebabkan oleh kelainan ginjal polikistik dan penyakit interstitial. Saat nilai GFR sudah mencapai 5% nilai normal, (ESRD) volume pengeluaran urine bisa menurun menjadi oliguria. Akibat terjadinya retensi garam pada pengeluaran urin, maka penderita mengalami edema secara luas. Proteinuria, leukosituria, sedimen urin dapat ditemukan pada urinalisa yang merupakan pertanda penyakit ginjal kronik (William, 2008).
tempat konversi vitamin D2 menjadi bentuk aktif yaitu D3, maka jumlah vitamin D aktif yang dibutuhkan tubuh berkurang, hal ini juga akan menyebabkan hiperparatiroidisme, dan kerusakan tulang (osteomalasia, dan ostitis fibrosa sistika). Asam urat terkadang meningkat, tetapi dalam kasus ini jarang menimbulkan batu ginjal atau gout (William, 2008).
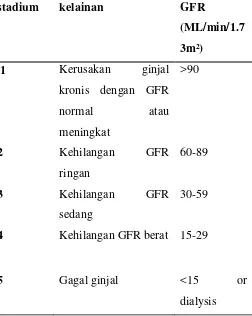
Tabel 2.6. Derajat keparahan gagal ginjal berdasarkan GFR (KDOQI, 2002).
Di atas adalah tabel diagnosis gagal ginjal berdasarkan panduan dari KDOQI tahun 2002. Di bawah penjelasan mengenai nilai proteinuria dan albuminuria pada penyakit ginjal kronik yang juga bersumber dari KDOQI (2002).
stadium kelainan GFR
(ML/min/1.7 3m²)
1 Kerusakan ginjal
kronis dengan GFR
normal atau
meningkat
>90
2 Kehilangan GFR
ringan
60-89
3 Kehilangan GFR
sedang
30-59
4 Kehilangan GFR berat 15-29
5 Gagal ginjal <15 or
Tabel 2.7. Keterangan mengenai kadar protein dan albumin pada urine normal dan pada proteinuria dan albuminuria (KDOQI, 2002).
Metode Pengambilan Urine Normal Microalbuminuria Albuminuria atau
Proteinuria Total
Protein
Pengeluaran urine selama 24 jam <300 mg/hari NA >300 mg/hari
Spot Urine Dipstick <30 mg/dL NA >30 mg/dL
Spot Urine ratio protein dan kreatinin <200 mg/g NA >200 mg/g
Albumin Pengeluaran urine 24 jam <30 mg/hari 30-300 mg/hari >300 mg/hari
Spot Urine Albumin Dipstick <3mg/dL >3 mg/dL NA
Spot Urine Ratio Albumin dan
Kreatinin
<17 mg/g (pria)
<25 mg/g (wanita)
17-250 mg/g (pria)
25-355 mg/g
(wanita)
250 mg/g (pria)
>355 mg/g
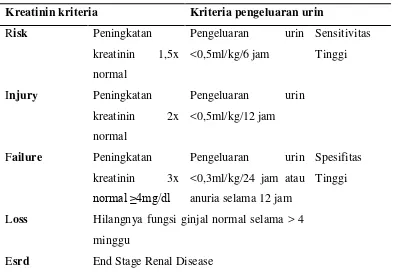
Untuk penyakit ginjal akut terdapat suatu kriteria yang menjelaskan tentang diagnosis nya, yaitu RIFLE kriteria,
Tabel 2.8. RIFLE kriteria untuk penyakit ginjal akut (KDIGO, 2012). Kreatinin kriteria Kriteria pengeluaran urin
Risk Peningkatan
Esrd End Stage Renal Disease
Untuk menghitung GFR dapat digunakan rumus Kockcroft-Gault sebagai berikut: LFG (ml/mnt/1,73m2 ) = (140-umur) x berat badan *)
72 x kreatinin plasma (mg/dl) *) Pada perempuan dikalikan 0,85 (Reenosha, 2014).
Pemeriksaan foto polos renal dapat memperlihatkan ukuran ginjal yang mengecil, dan korteks ginjal yang menipis. Pemeriksaan foto polos pada tulang memperlihatkan pertumbuhan tulang terhambat, osteomalasia (renal rickets), atau ostitis fibrosa. Dapat dijumpai vaskular kalsifikasi. Pasien dengan penyakit ginjal polikistik memperlihatkan pembesaran ukuran ginjal yang bervariasi antara ginjal dan dijumpai gambaran kista (William, 2008).
sindroma uremik, hipertensi, atau bisa disebabkan secara langsung oleh nefron sklerosis. Pemeriksaan biopsi renal tidak dianjurkan pada pasien karena berkaitan dengan peningkatan morbiditas, khususnya perdarahan (William, 2008).
Tabel 2.9. Kriteria untuk penyakit ginjal kronik (KDIGO, 2013).
Kriteria untuk penyakit ginjal kronik ( kerusakan fungsi atau struktur ginjal yang berhubungan lebih dari 3 bulan )
Indikator kerusakan ginjal Albumin Excretion Rate (AER
≥30 mg/24 jam; Albumin
Creatinin Ratio (ACR≥30
mg/g[≥3mg/mmol])
Kelainan sedimentasi urin
Kelainan elektrolit dan lain-lain
dikarenakan gangguan tubulus ginjal
Kelainan struktur pada
jaringan/histologi
Kelainan yang terdeteksi melalui
foto (imaging)
Riwayat transplantasi ginjal
2.3. Nefropati Diabetik 2.3.1. Definisi Nefropati Diabetik.
Nefropati diabetik (gagal ginjal yang disebabkan oleh diabetes) didefinisikan sebagai sindroma klinis pada pasien diabetes melitus yang ditandai dengan albuminuria menetap (>300 mg/24 jam atau >200 mg/menit) pada pemeriksaan minimal dua kali dalam waktu 3 sampai 6 bulan (Hendromartono, 2009).
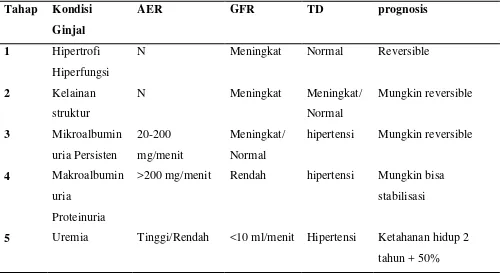
Mogensen membagi perjalanan penyakit atau kelainan ginjal pada diabetes melitus menjadi 5 tahapan (Hendromartono, 2009).
Tahap 1. Terjadinya hipertrofi dan hiperfiltrasi pada saat diagnosis ditegakan. Laju filtrasi glomerulus (GFR) dan ekskresi albumin melalui urine meningkat.
Tahap 2. Belum nampak kelainan yang berarti selain peningkatan GFR, ekskresi albumin melalui urine dan tekanan darah tampak normal, meskipun mulai nampak penebalan membrana basalis yang tidak spesifik pada histopatologis. Terdapat pula peningkatan volume mesangium fraksional.
Tahap 3. Ditemukan mikroalbuminuria atau nefropati inspisien. GFR dpat meningkat atau menurun sampai derajat normal. Laju ekskresi albumin dalam urine adalah 20-200 ig/menit (30-300 mg/24 jam). Tekanan darah mulai meningkat dan didapatkan peningkatan ketebalan membrana basalis dan volume mesangium fraksional dalam flomerulus.
Tahap 4. Merupakan tahap nefropati yang sudah lanjut. Perubahan histologis juga lebih jelas, serta timbul hipertensi pada sebagian besar pasien. Sindroma nefrotik sering ditemukan pada tahap ini. Laju GFR menurun sebesar 10 ml/menit/tahun dan penurunan ini berhubungan dengan tingginya tekanan darah.
Tabel 2.10. Tahapan Nefropati Diabetik (Mogensen dalam Hendromartono, 2009) Tahap Kondisi
Ginjal
AER GFR TD prognosis
1 Hipertrofi Hiperfungsi
N Meningkat Normal Reversible
2 Kelainan struktur
N Meningkat Meningkat/
Normal
Mungkin reversible
3 Mikroalbumin uria Persisten
20-200 mg/menit
Meningkat/ Normal
hipertensi Mungkin reversible
4 Makroalbumin uria
Proteinuria
>200 mg/menit Rendah hipertensi Mungkin bisa stabilisasi
2.3.2. Patofisiologi Nefropati Diabetes.
Mekanisme terjadinya peningkatan GFR pada nefropati diabetik masih belum terlalu jelas, tetapi kemungkinan disebabkan oleh dilatasi arteriol aferen oleh efek tergantung glukosa, yang diperantarai oleh hormon vasoaktif, IGF-1,
Nitric Oxide, prostaglandin dan glukagon. Efek langsung dari hiperglikemia adalah rangsangan hipertrofi sel, sintesis matriks ekstraseluler, serta produksi TGF-β yang diperantarai oleh aktivasi protein kinase-C (PKC) yang termasuk dalam serin-threonin-kinase yang memiliki fungsi pada vaskular seperti kontraktilitas, aliran darah, proliferasi sel, dan permeabilitas kapiler. Hiperglikemia kronik dapat menyebabkan terjadinya glikasi nonenzimatik asam amino dan protein (reaksi Mallard dan Browning). Pada awalnya glukosa akan mengikat residu amino secara non-enzimatik menjadi basa Schiff glikasi, lalu terjadi penyusunan ulang untuk mencapai bentuk yang lebih stabil tetapi masih reversible yang disebut sebagai produk amadori. Jika proses ini berlanjut terus akan terbentuk Advance Glycation End-Products (AGEs) yang bersifat irreversible (Hendromartono, 2009). Ketika (AGEs) terbentuk, mereka dapat merubah struktur dan fungsi molekul-molekul (enzim / protein) pada tempat-tempat seperti dinding arterial, mesangium, dan membran basal glomerulus. AGEs bekerja dengan pengikatan pada reseptor spesifiknya Receptor Advance Glycation End-Products (RAGEs) di beberapa sel khususnya pedocytes, endotelial, dan otot polos. Hal tersebut menimbulkan beragam konsekuensi buruk yang membahayakan seperti aktivasi reactive oxygen species (ROS), pelepasan sitokin inflamasi seperti tumor necrosis factor alpha(TNF α) dan interleukin (IL)-1 and 6, aktivasi faktor transkripsi seperti NF-κB, dan ekspresi molekul adhesion dan growth factors seperti Connective Tissue Growth Factor (CTGF) atau TGF-β (Rodriguez, et al, 2012).
kerusakan ginjal juga akan mendorong sklerosis pada ginjal pasien diabetes. Penelitian pada hewan menunjukkan adanya vasokonstriksi arteriol akibat kelainan renin/angiotensin sistem. Diperkirakan bahwa hipertensi yang timbul pada diabetes disebabkan oleh spasme arteriol eferen intrarenal atau intrglomerulus (Hendromartono, 2009).
Secara ringkas, faktor-faktor etiologis timbulnya penyakit ginjal diabetes adalah :
1. Kadar gula darah yang kurang terkendali (gula darah puasa >140-160 mg/dl[7,7 mmol/l]),
2. Faktor genetik,
3. Kelainan hemodinamik seperti peningkatan aliran darah ginjal dan GFR, serta peningkatan tekanan intraglomerulus,
4. Hipertensi sistemik,
5. Sindrom resistensi insulin (sindroma metabolik), 6. Peradangan,
7. Perubahan permeabilitas pembuluh darah,
8. Gangguan metabolik (kelainan metabolisme poliol, pembentukan advanced glycation end products, peningkatan sitokin),
9. Pelepasan growth factors,
10.Kelainan metabolisme karbohidrat/lemak/protein,
11.Kelainan struktural (hipertrofi glomerulus, ekspansi mesangium, penebalan membrana basalis),
12.Gangguan ion pumps (peningkatan Natrium, hidrogen pump dan penurunan kalsium-ATPase pump),
13.Hiperlipidemia,
14.Aktivasi protein kinase C (Hendromartono, 2009).
dehydrogenase menggunakan NAD+ .
sebagai kofaktor. Kenyataannya adalah enzim aldosa reduktase itu sendiri menyebabkan kerusakan jaringan melalui mekanisme lain yang melibatkan Protein Kinase C (PKC) dan protein glycosylation. Sorbitol merupakan alcohol hydrophilic yang tidak dapat berdifusi bebas menembus membran sel dan jika terkumpul dalam sel maka dapat menyebabkan kerusakan. Molekul fruktosa yang terbentuk bisa di fosforilasi menjadi fruktosa-3 fosfat, dan kemudian dipecah menjadi 3-deoxyglucasone, keduanya merupakan bahan yang berperan erat dalam pembentukan advance glycation end products (AGEs) (Rodriguez, et al, 2012).
Penggunaan berlebihan NADPH sebagai kofaktor oleh aldose reductase
kemungkinan mengurangi kemampuan proses lain yang melibatkan NADPH sebagai kofaktor misalnya glutathione reductase, yang merupakan suatu enzim penting dalam menanggulangi ROS dalam tubuh. Di sisi lain penggunaan NAD+ oleh sorbitol dehydrogenase mengarah pada peningkatan rasio NADH/NAD+ , yang sebelumnya telah dikenal dengan kondisi “pseudohypoxia”
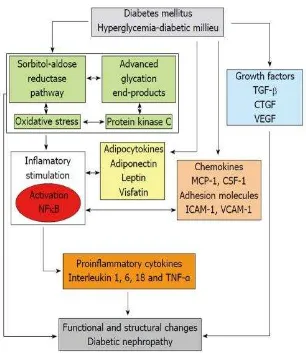
Berikut disajikan skema mengenai patofisologi inflamasi timbulnya diabetik nefropati :