MANGGA BACANG (Mangifera foetida L.) DAN INFUSA
LIDAH BUAYA (Aloe vera L.) TERHADAP
Escherichia coli SECARA IN VITRO
ARDI
NIM I11112040
SKRIPSI
PROGRAM STUDI PENDIDIKAN DOKTER
FAKULTAS KEDOKTERAN
UNIVERSITAS TANJUNGPURA
PONTIANAK
i
NASKAH PUBLIKASI
UJI AKTIVITAS ANTIBAKTERI KOMBINASI INFUSA DAUN
MANGGA BACANG (Mangifera foetida L.) DAN INFUSA
LIDAH BUAYA (Aloe vera L.) TERHADAP
Escherichia coli SECARA IN VITRO
ARDI
NIM I11112040
SKRIPSI
PROGRAM STUDI PENDIDIKAN DOKTER
FAKULTAS KEDOKTERAN
UNIVERSITAS TANJUNGPURA
PONTIANAK
iii
UJI AKTIVITAS ANTIBAKTERI KOMBINASI INFUSA DAUN MANGGA BACANG (Mangifera foetida L.) DAN INFUSA
LIDAH BUAYA (Aloe vera L.) TERHADAP Escherichia coli SECARA IN VITRO
Ardi1, Siti Khotimah2, Ita Armyanti3
Intisari
Latar Belakang: Infeksi merupakan penyakit yang disebabkan oleh mikroorganisme. Escherichia coli merupakan salah satu mikroorganisme penyebab penyakit infeksi dan merupakan bakteri yang telah resisten terhadap banyak antibiotik. Penelitian menunjukkan bahwa mangga bacang (Mangifera foetida L.) dan lidah buaya (Aloe vera L.) merupakan tanaman yang mengandung metabolit sekunder bersifat sebagai antibakteri. Tujuan: Penelitian ini bertujuan untuk mengetahui aktivitas antibakteri, kandungan senyawa metabolit sekunder dan konsentrasi efektif kombinasi infusa daun Mangifera foetida L. dan Aloe vera L. dalam menghambat pertumbuhan Escherichia coli. Metodologi: Daun Mangifera foetida L. dan Aloe vera L. dibuat menjadi infusa dengan pelarut akuades. Skrining fitokimia dilakukan dengan menggunakan metode uji tabung. Uji aktivitas antibakteri menggunakan metode difusi sumuran dengan konsentrasi 50%, 100%, dan 200%. Kontrol positif yang digunakan adalah siprofloksasin 5 µg/sumuran dan kontrol negatif yang digunakan adalah akuades. Hasil: Metabolit sekunder yang terkandung dalam kombinasi infusa daun Mangifera foetida L. dan Aloe Vera L. adalah fenol, saponin, tanin, dan kuinon. Kombinasi infusa daun Mangifera foetida L. dan Aloe vera L. tidak menghambat pertumbuhan Escherichia coli. Kesimpulan:
Kombinasi infusa daun Mangifera foetida L. dan Aloe vera L. tidak memiliki aktivitas antibakteri terhadap Escherichia coli.
Kata Kunci: Antibakteri, Kombinasi Infusa, Escherichia coli.
1) Program Studi Pendidikan Dokter, Fakultas Kedokteran, Universitas Tanjungpura Pontianak, Kalimantan Barat
2) Program Studi Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Tanjungpura Pontianak, Kalimantan Barat
3) Dapertemen Farmakologi, Fakultas Kedokteran, Universitas Tanjungpura Pontianak, Kalimantan Barat
IN VITRO ANTIBACTERIAL ACTIVITY OF COMBINATION OF Mangifera foetida L. AND Aloe vera L.
WATER EXTRACTS AGAINST Escherichia coli
Ardi1, Siti Khotimah2, Ita Armyanti3
Abstract
Background: Infection is a disease caused by microorganisms. Escherichia coli is one of the microorganisms that causes infection and it has resistant to many antibiotics. Some studies have shown that Mangifera foetida L. and Aloe vera L. have secondary metabolites with antibacterial effect. Objective: The aim of this study is to investigate antibacterial activity, secondary metabolites, and effective inhibitory concentration of combination of Mangifera foetida L. and Aloe vera L. extracts against Escherichia coli. Method: Mangifera foetida L. leaf and Aloe vera L. were combined into water extracts with distilled water solvent. Phytochemical screening was performed by test tube method. Antibacterial activity was measured using well diffusion method inmixture’s concentrations of 50%, 100% and 200%. The positive control was ciprofloxacin 5 µg/well, while the negative control was distilled water. Result: Secondary metabolites contained in the combined extract were phenol, saponin, tannin, and quinone. The combination did not inhibit the growth of Escherichia coli. Conclusion:
Combination of Mangifera foetida L. and Aloe vera L. extracts do not have antibacterial activity against Escherichia coli.
Keywords: Antibacteria, infuse combination, Escherichia coli.
1) Medical School, Faculty of Medicine, Tanjungpura University, Pontianak, West Kalimantan.
2) Departement of Biology, Faculty of Mathematics and Natural Science, Tanjungpura University, West Kalimantan.
3) Department of Pharmacology, Medical School, Faculty of Medicine, Tanjungpura University, Pontianak, West Kalimantan.
1
PENDAHULUAN
Infeksi merupakan invasi dan multiplikasi mikroorgnisme atau parasit dalam jaringan tubuh yang bisa bersifat asimtomatik ataupun simtomatik baik terlokalisasi atau sistemik.1 Penyakit infeksi di negara-negara berkembang masih menempati urutan pertama dari penyebab sakit di masyarakat.2 Infeksi saluran kemih (ISK) merupakan infeksi tersering kedua setelah infeksi saluran nafas atas.3 Pada umumnya infeksi saluran kemih lebih sering terjadi pada wanita daripada pria.
Escherichia coli merupakan bakteri patogen utama infeksi pada rawat jalan ataupun rawat inap. Sekitar 85% penyebab infeksi saluran kemih (ISK) serta sekitar 50% infeksi nosokomial di masyarakat penyebabnya merupakan E. coli. Infeksi oleh E. coli merupakan salah satu infeksi yang terbanyak ditemukan yaitu sebanyak 34,85%.4 E. coli penghasil extended spectrum beta lactamase (ESBL) telah banyak mengalami resistensi khususnya antibiotik golongan beta laktam, yaitu 10% terhadap seftriakson dan sefotaksim , 20% terhadap sefpodoksim, 7,78% terhadap seftazidim, dan 12,22% terhadap aztreonam.5
Meningkatnya berbagai kasus infeksi serta resistensi bakteri mendesak dilakukannya penelitian untuk menemukan obat antibakteri baru. Seperti yang kita ketahui, Indonesia sangat kaya dengan berbagai spesies flora yang merupakan sumber bahan baku obat. Salah satu upaya yang diperlukan untuk mengoptimalkan kekayaan alam tersebut adalah dilakukannya penelitian berupa identifikasi dan evaluasi terhadap jenis tumbuhan yang dapat digunakan sebagai alternatif obat
Menurut penelitian-penelitian terdahulu, terdapat data yang menunjukkan potensi daun mangga bacang dan lidah buaya sebagai suatu sumber pengobatan alami. Penelitian yang dilakukan oleh Nuryanto A (2014) mendapatkan bahwa ekstrak etanol daun mangga bacang dapat menghambat pertumbuhan bakteri E. coli.6 Penelitian Isabela (2009),
menyatakan bahwa ekstrak lidah buaya mampu menghambat
itu Aloe barbadensis Miller dan Aloe chinensis Baker mampu menghambat pertumbuahan E. coli.8 Penelitian lain yang dilakukan oleh Ariyanti NK dkk (2012) mendapatkan bahwa ekstrak kulit daun lidah buaya (Aloe barbadensis Miller) memiliki kemampuan menghambat pertumbuhan bakteri Staphylococcus aureus dan bakteri E. coli.9
Salah satu kandungan metabolit sekunder lidah buaya adalah antrakuinon yang ternyata mampu berperan sebagai antibakteri yang bersifat bakteriostatik.8 Penelitian yang dilakukan oleh Nuryanto A (2014) menyatakan bahwa di dalam mangga bacang terkandung senyawa metabolit sekunder seperti fenol, flavonoid, tanin, saponin, alkaloid, dan steroid yang mampu menghambat pertumbuhan bakteri E. coli.6 Berdasarkan efek antibakteri masing-masing senyawa metabolit sekunder yang terkandung dalam kedua tanaman tersebut, maka bila dilakukan kombinasi akan menimbulkan efek sinergistik berupa penekanan terhadap pertumbuhan bakteri (efek bakteriostatik).
Berdasarkan alasan tersebut, penulis melakukan penelitian lebih lanjut mengenai aktivitas antibakteri kombinasi infusa daun mangga bacang (Mangifera foetida .L) dan lidah buaya (Aloe vera L.) terhadap E. coli.
METODOLOGI Bahan Uji
Bahan yang digunakan dalam penelitian ini adalah daun mangga bacang dan lidah buaya. Penyediaan daun mangga bacang berasal dari pohon mangga rumahan di Jalan Karya Sosial No.10, Kecamatan Pontianak Selatan, Kabupaten Pontianak, Kalimantan Barat. Penyediaan tanaman lidah buaya diambil dari Aloe Vera Center yang berada di Jalan Budi Utomo Kecamatan Pontianak Utara, Kalimantan Barat. Bakteri yang digunakan dalam penelitian ini adalah kultur murni E. coli yang merupakan koleksi dari Unit Laboratorium Kesehatan Pontianak.
Bahan Kimia
Bahan kimia yang digunakan pada penelitian ini adalah akuades, kain kasa, kapas, cotton bud, kertas kraft, kertas saring Whatman no. 1, plastik
3
wrapping, siprofloksasin 5 µg/disk (sebagai kontrol positif), spiritus, pereaksi Mayer, pereaksi Dragendorff, kalium iodida (KI), magnesium (Mg), asam klorida (HCl) pekat, asam Klorida (HCl) 2 N, besi (III) klorida (FeCl3) 1%, asam asetat glasial (CH3COOH), NaOH 2N, H2SO4 pekat,
NaCl 2% dan 0,9%, H2O2 3%, larutan gelatin, Nutrient Agar (NA), Nutrient
broth, Mueller-Hinton Agar (MHA), standar Mc. Farland no. 0,5, Triple Sugar Iron Agar, Eosin Methylen Blue Agar, Medium tryptophan Broth, Medium Nutrient Broth, karbol fuksin, lugol, giantien violet, etanol 70%, minyak emersi.
Alat
Alat yang digunakan pada penelitian ini antara lain baskom, plastik tahan panas, pisau, wadah plastik, lemari pendingin, blender, penjepit tabung, ball filler, sendok tanduk, hot plate, timbangan analitik, sendok stainless, oven, inkubator, krusibel porselen, desikator, corong kaca, pinset, Biological Safety Cabinet (BSC), autoklaf, labu ukur 25 ml dan 10 ml, gelas ukur 50 ml dan 10 ml, vial, Erlenmeyer, Beaker glass, tabung reaksi, rak tabung, stop watch, gunting, jangka sorong, batang pengaduk, object glass, cover glass, cawan petri, pipet tetes, penggaris, prevorator, jarum ose, mikroskop, termometer, panci stainless, tip dan mikropipet, pembakar bunsen.
Prosedur Penelitian
Pengujian daya hambat kombinasi infusa daun mangga bacang (Mangifera foetida L.) dan lidah buaya (Aloe vera L.) terhadap pertumbuhan bakteri E. coli dilakukan dengan metode difusi sumuran . Tahapan awal yang dilakukan yakni Media Mac Conkey Agar ditanamkan bakteri uji dan diinkubasi selama 24 jam pada suhu 37°C, kemudian koloni bakteri uji yang telah terbentuk di ambil dengan jarum ose dan disuspensikan dengan cara dimasukkan ke dalam tabung berisi 10 ml NaCl 0,9% steril.
Tahapan selanjutnya yaitu suspensi yang telah terlebih dahulu disiapkan dengan mengikuti standar 0,5 Mc Farland sebanyak 1 ml
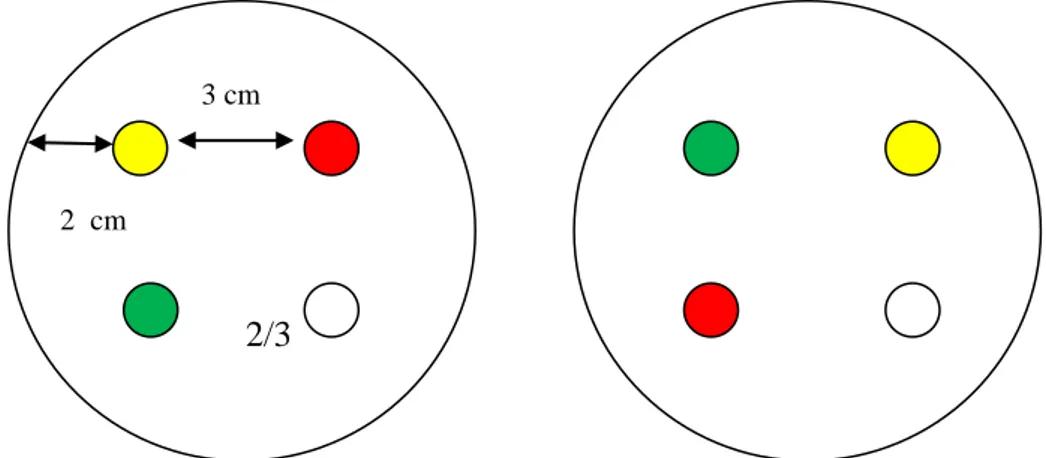
dimasukkan ke dalam cawan petri steril dan dituangkan media Muller Hinton sebanyak 15 ml. Campuran ini dihomogenkan dengan cara digoyang-goyang dan media dibiarkan memadat. Setelah itu ambil pipet pasteur steril yang telah dimodifikasi dengan dibuat diameternya menjadi 5 mm, pipet ini akan digunakan untuk membuat sumur pada media agar. Pada sumur ini akan diisi infusa kombinasi dari tiap konsentrasi yang akan diuji, kontrol positif serta kontrol negatif akuades dengan menggunakan mikropipet. Penempatan sumur pada media agar memiliki syarat tersendiri yaitu setiap sumur harus memiliki jarak yang sama (2 cm dari tepi cawan dan jarak antar sumur 3 cm) serta kedalamanya 2/3 dari tebalnya disk/cakram. Setelah seluruh proses selesai, semua cawan petri tersebut dimasukkan ke dalam inkubator dengan suhu 37°C. Pengamatan zona hambat yang terbentuk akan diamati pada jam ke-24. Zona hambat yang tampak pada setiap agar, kemudian diukur dengan menggunakan jangka sorong.10 Sketsa letak sumur pada MHA dapat dilihat pada Gambar 1.
2/3
2 cm
3 cm
5
HASIL DAN PEMBAHASAN Skrining Fitokimia
Tabel 1. Hasil Skrining Fitokimia Kombinasi Infusa Daun Mangga Bacang (Mangifera foetida L.) dan lidah buaya ( Aloe vera L.).
No. Pemeriksaan Pereaksi Hasil Keterangan
1. Alkaloid Meyer Tidak terbentuk
endapan putih
-
Wagner Tidak terbentuk
endapan coklat
- Dragendroff Tidak terbentuk
endapan orange - 2. Senyawa fenol Air panas, FeCl3 1% Terbentuk warna ungu sampai biru +
3. Flavonoid Mg, HCl Tidak terbentuk
warna merah - 4. Triterpenoid CH3COOH, H2SO4 Tidak terbentuk warna merah - 5. Steroid CH3COOH, H2SO4 Tidak terbentuk warna biru atau ungu - 6. Saponin Aquadest panas Terbentuk busa yang bertahan lebih dari 10 menit + 7. 8. Tanin Kuinon FeCl3 5% NaOH 15% Terbentuk warna biru tua Terbentuk
warna kuning
sampai merah
+ +
Sumber: Data Primer, 2015
Keterangan:
(+) : Hasil positif, terdapat kandungan senyawa (-) : Hasil negatif, tidak terdapat kandungan senyawa
Karakterisasi Bakteri Uji
Karakterisasi bakteri uji menggunakan beberapa metode. Hasil pengamatan pewarnaan gram didapatkan bakteri uji berwarna merah dan berbentuk basil pendek yang menunjukkan bahwa bakteri uji merupakan gram negatif. Hasil uji dengan Eosin Methylen Blue Agar (EMBA) didapatkan kompleks warna ungu dengan kemilau hijau metalik yang
merupakan ciri khas bakteri Enterik seperti E. coli.12 Hasil tes indol didapatkan terbentuknya cincin berwarna merah setelah dilakukan penambahan pereaksi kovaks yang menunjukkan hasil positif.13 Hasil uji Triple Sugar Iron Agar didapatkan perubahan warna menjadi kuning pada butt maupun slant medium, serta dihasilkan gas O2 yang ditandai dengan
terbentuknya gelembung udara.14 Hasil karakterisasi bakteri uji dapat dilihat pada Gambar 2.
Gambar 2. Hasil Kareakterisasi Bakteri Uji (A) Pewarnaan Gram, (B) Pembiakan pada Eosin Methylen Blue Agar, (C) Uji Indol, (D) Pembiakan pada Triple Sugar Iron Agar (DataPrimer, 2015)
Uji Aktivitas Antibakteri
Tabel 2. Hasil Uji Aktivitas Antibakteri Kombinasi Infusa Daun Mangga Bacang (Mangifera foetida L.) dan Lidah Buaya (Aloe vera L.) Terhadap Pertumbuhan E. coli.
No. Konsentrasi (%)
Diameter Zona Hambat (mm) Rata-rata
(mm) Pengulangan Ke- I II III IV V 1 2 3 4 5 50% 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 36,98 37,01 37,65 37,67 37,68 0 0 0 0 0 0 0 0 37,398 0 100% 200% Kontrol (+) Kontrol (-)
Sumber: Data Primer, 2015 Keterangan: (0): Tidak terdapat zona hambat
Uji aktivitas antibakteri dilakukan melalui beberapa tahapan meliputi peremajaan bakteri, pembuatan suspensi bakteri uji, pembuatan variasi konsentrasi kombinasi infusa daun mangga bacang dan lidah buaya,
7
persiapan kontrol positif dan kontrol negatif, serta proses perlakuan uji berupa pemberian infusa dan kontrol ke dalam medium yang telah diinokulasikan koloni bakteri. Kombinasi infusa yang digunakan dibuat dalam tiga macam konsentrasi yaitu 50%, 100%, dan 200%. Masing-masing konsentrasi infusa diujikan dengan lima kali pengulangan menggunakan lima cawan petri yang berbeda.
Kontrol negatif yang digunakan dalam penelitian ini adalah akuades steril dan tidak memberikan efek antibakteri. Kontrol positif yang digunakan adalah siprofoksasin dengan konsentrasi sebesar 5µg/disk. Pemilihan siprofloksasin sebagai kontrol positif karena merupakan antibiotik yang mempunyai daya antibakteri yang sangat kuat terhadap E. coli.15 Hasil uji efek antibakteri dengan kontrol positif didapatkan rata-rata diameter zona hambat yang terbentuk sebesar 37,398mm yang diukur menggunakan jangka sorong. Berdasarkan Clinical and Laboratory Standards Institute (CLSI) tahun 2013, diameter zona hambat sebesar 37,398mm dari siprofloksasin terhadap E.coli masih tergolong sensitif kuat.16
Hasil uji aktivitas antibakteri dengan menggunakan kombinasi infusa daun mangga bacang dan lidah buaya tidak memiliki aktivitas antibakteri terhadap E. coli yang ditunjukkan dengan tidak terbentuknya zona bening di sekitar sumuran. Hasil uji aktivitas antibakteri kombinasi infusa daun mangga bacang dan lidah buaya, kontrol positif, dan kontrol negatif dapat dilihat pada Gambar 3.
(a) (b)
Gambar 3.(a) Kontrol Positif (panah hitam), Kontrol Negatif (panah biru), Konsentrasi 50% (panah orange), Konsentrasi 100% (panah merah), Konsentrasi 200% (panah hijau), (b) Pengukuran Diameter Kontrol Positif Dengan Jangka Sorong (Data Primer, 2015).
Hasil uji aktivitas antibakteri kombinasi infusa daun mangga bacang dan lidah buaya tidak memiliki aktivitas antibakteri dapat dipengaruhi oleh beberapa faktor yaitu faktor teknis, faktor biologis, daya difusi ekstrak, kandungan senyawa antibakteri, konsentrasi ekstrak, dan virulensi dari jenis bakteri yang digunakan.17,18
Faktor teknis dalam penelitian merupakan faktor yang dapat dikendalikan oleh peneliti.18 Faktor teknis meliputi fase pertumbuhan, besar inokulum, pemilihan media, lama inkubasi dan suhu lingkungan.17,19 Inokulum yang digunakan sudah disesuaikan dengan standar McFarland 0,5 atau setara dengan 1x108 bakteri/mL yang telah dikonfirmasi menggunakan spektrofotometri. Media yang digunakan untuk uji aktivitas antibakteri ini adalah agar Muller Hinton dengan metode sumuran. Lama inkubasi adalah 24 jam dengan suhu 37°C. Semua faktor teknis dalam penelitian ini telah dikendalikan oleh peneliti.
Faktor biologis dalam penelitian merupakan faktor yang tidak dapat dikendalikan oleh peneliti meliputi persisters dan resistensi.16 Persisters berasal dari sel-sel yang dorman atau bereplikasi dengan lambat sehingga
9
tidak dapat dibunuh oleh zat antibakteri. Faktor persisters telah dikendalikan dengan melakukan penggunaan inokulum yang tidak melebihi 24 jam atau inokulum pada fase logaritmik. Resistensi tidak dapat dikendalikan dalam penelitian karena merupakan adaptasi bakteri untuk bertahan hidup.20 Resistensi pada penelitian ini tidak terjadi karena kontrol positif yang digunakan yaitu siprofloksasin menghasilkan zona hambat rata-rata sebesar 37,398mm.
Pemilihan pelarut yang digunakan menjadi hal yang penting dalam daya difusi ekstrak dalam menyari senyawa antibakteri. Pelarut yang sering digunakan untuk menyari senyawa aktif antimikroba yaitu pelarut metanol, etanol dan air.21 Pelarut air merupakan senyawa yang paling polar dengan indeks polaritas sebesar 10,2, pelarut metanol dengan indeks polaritas 5,1 dan etanol 4,3.22 Pemilihan pelarut didasarkan pada prinsip like dissolves like, yaitu senyawa yang nonpolar akan mudah larut dalam pelarut nonpolar sedangkan senyawa polar akan larut pada pelarut polar. Akuades yang digunakan sebagai pelarut bersifat polar, sehingga diharapkan dapat menarik senyawa metabolit yang bersifat polar dalam larutan uji. Pelarut yang digunakan pada penelitian ini berhasil menyari metabolit sekunder berupa fenol, saponin, tanin, dan kuinon namun tidak memberikan efek antibakteri. Tidak adanya efek antibakteri pada penelitian ini diduga salah satu faktor penyebabnya adalah pelarut air tidak cukup kuat untuk menyari senyawa antibakteri dalam jumlah yang cukup seperti penelitian yang dilakukan oleh Nuryanto A (2014) menggunakan pelarut etanol dan berhasil menarik metabolit sekunder berupa fenol, flavonoid, tanin, saponin, alkaloid, dan steroid yang mampu menghambat bakteri E. coli.6
Senyawa aktif fenol pada penelitian ini tidak memberikan aktivitas antibakteri terhadap E. coli diduga karena fenol yang tersari tidak cukup banyak dan juga dipengaruhi oleh struktur kimianya. Struktur fenol yang berperan sebagai antibakteri adalah gugus –OH dan cincin beta.23
Gugus hidroksil pada fenol memiliki jumlah yang berbeda-beda pada setiap
pelarut yang digunakan sehingga mempengaruhi sifat antibakteri yang dimiliki oleh setiap senyawa.24 Jumlah gugus hidroksil yang terdapat pada asam hydroxycinnamic pada senyawa asam fenolik dapat mempengaruhi aktivitas antibakteri.25 Fenol yang terdiri dari berbagai senyawa juga memperlihatkan hasil bahwa setiap senyawa fenol menunjukan aktivitas yang berbeda-beda terhadap beberapa bakteri uji yang digunakan.26
Saponin pada penelitian ini tidak memberikan aktivitas antibakteri terhadap E. coli diduga karena jumlah saponin yang tersari tidak cukup banyak dan juga dipengaruhi oleh struktur kimianya. Kekuatan saponin sebagai antibakteri dipengaruhi oleh konsentrasi dan jumlah rantai gula pada struktur aglikon. Saponin dengan konsentrasi tinggi dapat membuat membran sel berlubang dan mengganggu permeabilitasnya. Konsentrasi rendah dari saponin hanya berinteraksi dengan membran sel tanpa merusaknya.27
Tanin pada penelitian ini tidak memberikan aktivitas antibakteri terhadap E. coli diduga karena jumlah tanin yang tersari tidak cukup banyak dan juga dipengaruhi oleh struktur kimianya. Tempat tumbuh tanaman, jumlah gugus hidroksil dan struktur yang berbeda-beda dan pada tanin berhubungan dengan aktivitas antibakteri yang dihasilkan.28 Penelitian ini juga didukung oleh Colak (2010) bahwa golongan senyawa tanin seperti asam tanin memiliki aktivitas antibakteri yang dipengaruhi oleh jumlah gugus hidroksil.29 Perbedaan tanaman dan bakteri yang digunakan juga dapat mempengaruhi aktivitas tanin sebagai antibakteri.30 Kuinon memiliki kisaran antimikroba yang sangat luas karena disamping merupakan radikal bebas, juga dapat membentuk kompleks dengan asam amino nukleofilik dalam protein sehingga dapat menyebabkan protein kehilangan fungsi. Kuinon bereaksi dengan protein adesin bulu-bulu sel, polipeptida dinding sel, dan eksoenzim yang dilepaskan melalui membran.23 Kuinon pada penelitian ini tidak memberikan aktivitas antibakteri terhadap E. coli diduga karena jumlahnya yang tersari tidak cukup banyak dan juga kuinon hasil penyarian memiliki
11
intensitas zat antibakteri yang sedikit atau kurangnya potensi dari zat yang tertarik untuk membunuh bakteri.
Konsentrasi ekstrak yang digunakan juga mempengaruhi efek antibakteri yang dihasilkan. Semakin tinggi konsentrasi ekstrak yang digunakan maka akan semakin banyak jumlah senyawa antibakteri yang tersari sehingga mempermudah penetrasi senyawa antibakteri ke dalam sel bakteri dan semakin besar zona hambat yang akan tebentuk. Konsentrasi tertinggi yang digunakan dalam penelitian ini sudah cukup tinggi yaitu 200%, tetapi tidak efektif untuk menghambat pertumbuhan bakteri E. coli. Faktor konsentrasi yang digunakan sangat menentukan efek antibakteri yang ditimbulkan oleh zat antibakteri. Penelitian yang dilakukan Siska (2015) dengan tumbuhan yang sama yaitu daun mangga bacang melalui teknik ekstraksi infundasi dengan pelarut air menunjukkan adanya efek antibakteri oleh infusa daun mangga bacang dengan konsentrasi efektif sebesar 120mg/ml.34 Faktor lain terkait tumbuhan yang digunakan adalah tempat pengambilan sampel. Hal ini ditunjukkan oleh tidak adanya efek antibakteri yang terbentuk oleh infusa mangga bacang yang diambil dari Jalan Karya Sosial No. 10, Kecamatan Pontianak Selatan, Kabupaten Pontianak, Kalimantan Barat yang digunakan dalam penelitian ini. Sebaliknya, pada penelitian Siska (2015) infusa daun mangga bacang yang diambil dari desa Wajok, Kecamatan Siantan, Kabupaten Pontianak memberikan efek antibakteri yang cukup signifikan terhadap E. coli.34
Faktor virulensi dari jenis bakteri yang dihambat juga dapat mempengaruhi hasil pengujian aktivitas antibakteri. Faktor virulensi bakteri menggambarkan kekuatan suatu strain dalam pertahanan terhadap pajanan zat antibakteri. Struktur dan faktor virulensi E. coli meliputi membran luar polisakarida (LPS) disebut antigen O, polisakarida pada permukaan sel membentuk kapsul yang tegas atau suatu lapisan yang tipis yang disebut antigen K, dan flagel yang digunakan bakteri untuk bergerak melewati dinding sel disebut antigen H. Kebanyakan E. coli
bertipe 1 dengan fimbrae dipermukaannya.31 Berdasarkan komponen penyusun dinding selnya, bakteri gram negatif memiliki struktur yang lebih kompleks daripada bakteri gram positif sehingga lebih sulit untuk dihambat oleh senyawa antibakteri dibandingkan dengan bakteri gram positif.32 Membran terluar pada bakteri gram negatif merupakan suatu sawar yang mencegah molekul polar besar untuk memasuki sel. Molekul polar yang kecil, termasuk banyak antibiotik, memasuki sel melalui saluran protein yang disebut porin.33
13
DAFTAR PUSTAKA
1. Dorland WAN. Kamus kedokteran dorland. ed. 31. Terj. Elseria RN et al. Jakarta: EGC. 2010. hal. 1090.
2. Nelwan RHH. Pemakaian antimikroba secara rasional di klinik. Dalam: Noer S, editor. Buku ajar ilmu penyakit dalam. 2002. Jakarta : Balai Penerbit FKUI: 537-40.
3. Smyth EG, O'Connell N. Complicated urinary tract infection. Drugs & therapy perspectives. 2004. 11(1): 63-6.
4. Karowsky JA et al. 2010. Multidrug resistant urinary tract isolates of Escherichia coli: prevalence and patient demographics in the United states in 2009. Antimicrob agents chemother 2009; 45(5) : 1402-06. 5. Yanuarti AF. Prevalensi Escherichia coli penghasil extended spectrum
beta lactamase [skripsi]. Yogyakarta: Fakultas Kedokteran Universitas Gadjah Mada. 2010.
6. Nuryanto A. Uji aktivitas antibakteri ekstrak etanol daun mangga bacang (Mangifera Foetida L.) terhadap Escherichia coli secara in vitro [Skripsi]. Universitas Tanjungpura. 2014.
7. Isabela A. Pengaruh ekstrak lidah buaya (Aloe vera L) terhadap pertumbuhan Pseudomonas aeruginosa pada pasien osteomielitis bangsal cempaka rumah sakit ortopedi Prof.Dr. R.Soeharso surakarta in vitro [Abstrak]. UPT Perpustakaan Universitas Sebelas Maret. Solo. 2009.
8. Rahayu ID. Aloe barbadensis Miller dan Aloe chinensis Baker sebagai antibiotik dalam pengobatan Etnoveteriner unggas secara in vitro. 2006. Jurnal Protein 13(1).
9. Ariyanti NK, Darmayasa IBG, Sudirga SK. Daya hambat ekstrak kulit daun lidah buaya (Aloe barbadensis Miller) terhadap pertumbuhan bakteri Staphylococcus aureus ATCC 25923 dan Escherichia coli ATCC 25922. Vol XVI. 2012. hal. 1-2, 4.
10. Septian R. Uji aktivitas antimikroba ekstrak kulit buah mangga (Garcinia mangostana L) terhadap pertumbuhan Staphylococcus aureus pada agar muller hinton [Skripsi]. Jakarta: FKUI. 2013.
11. Waluyo L. Mikrobiologi umum edisi revisi. Penerbit Universitas Muhammadiyah Malang. Malang. 2007.
12. Lal A, Cheeptham N. Eosin methylen blue agar plates protocol[serial terdapat di internet].2007[disitasi pada tanggal 25 Oktober 2015]. Tersedia di dalam: http://www.microbelibrary.org/library/laboratory-test/2869-eosin-methylen-blue-agar-plates-protocol.
13. MacWilliams MP. Indole test protocol [serial terdapat di internet]. 2013 [disitasi pada tanggal 25 Oktober 2015]. Tersedia dalam: http://www.microbelibrary. org/ component/resource/laboratory-test/3202-indole-test-protocol.
14. Fankhauser DB. Triple sugar iron agar and its use. University Cincinnati Clermont College. Batavia. 2001.
15. Setiabudy R. Farmakologi dan terapi. Edisi 5: Golongan kuinolon dan fluorokuinolon. 2012. Balai Penerbit FKUI. Jakarta. Hal: 719-20.
16. Clinical and Laboratory Standards Institute. M100-S23 performances standards for antimicrobial susceptibility testing: Twenty-third informational suplement. Vol 33. No 1. 2013. hal: 44-8.
17. Brooks GF, Butel JS, Morse SA. Mikrobiologi kedokteran jawetz, Melnick & Adelberg. Alih bahasa: Hartanto H, Elferia RN. Jakarta: EGC. 2007. Ed: 23.
18. Clinical and Laboratory Standartd Institute (CLSI). Performance standards for antimicrobial disk susceptibility tests: Approved standard-eleventh edition. Vol 32. No 1. 2012.
19. CLSI. Methods for determining bacterial activity of antibacterial agents. Vol 19. No 8. 1999.
20. Choffnes ER, David AR, Alison M. Antibiotic resistance. The National Academic Press. 2010.
15
21. Das K, Tiwan RKS, Shrivastava DK. Technique for evaluation of medicinal plant products as antimicrobial agent: Current methods and future trends. Journal of Medicinal Plants Research. Vol 4. No 2. 2010. p. 104-11.
22. Snyder CR, Kirkland JJ, Glajach JL. Practical HPLC methods development 2nd edition. John Wiley and Sons, Lnc. New York. 1997. p. 722-3.
23. Cowan MM. Plant product as antimicrobial agent. Clinical Microbiology Reviews. 1999. 12(4): 564–82.
24. Pambayun R, Gardjito M, Sudarmadji S, Kuswanto KR. Kandungan fenol dan sifat antibakteri dari berbagai jenis ekstrak produk gambir (Uncaria gambir Roxb.). Majalah Farmasi Indonesia. 2007. 18(3): 141 – 6.
25. Sanchez-Maldonado AF, Schieber A, and Ganzle MG. Structure– function relationships of the antibacterial activity of phenolic acids and their metabolism by lactic acid bacteria. Journal of Applied Microbiology. 2011.
26. Alves MJ, et al. Antimicrobial activity of phenolic compounds identified in wild mushrooms. SAR Analysis and Docking Studies. Journal of Applied Microbiology. 2013.
27. Hasan NA, Nawahwi MZ, Malek HA. Antimicrobial avtivity of Nigella sativa seed extract Sains Malaysiana.2013. 42(2): 134-7.
28. Geissman TA. Flavonoid compounds, tannins, lignins and related compounds. New York: Elsevier Press. 1963. p. 265.
29. Colak SM, Yapici BM, Yapici AN. Determination of antimicrobial activity of tannic acid in pickling process. Romanian Biotechnological. Vol 15. No 3. 2010.
30. Min BR, et al. Comparative antimicrobial activity of tannin extracts from perennial plants on mastitis pathogens. Academic Journals. 2008. 31. Ryan K, Ray C. Sherries medical microbiology an introduction to
32. Pelezar MJ, and Chan ECS. Dasar-dasar mikrobiologi (I). Jakarta: UI Press. 2006.
33. Goodman & Gilman. Kemoterapi penyakit mikroba. Dalam: Brunton L, Blumenthal D, Parker K, Buxton I, editor. Manual farmakologi dan terapi. Jakarta: EGC. 2010. Hal: 672-3.
34. Siska. Efek Infusa Daun Mangga Bacang (Mangifera foetida L.)
Sebagai Antimikroba Terhadap Bakteri Enterik (Famili
Enterobactericeae) Pada Tikus Putih (Rattus norvegicus) Galur Sprague Dawley Dengan Kekurangan Energi Protein (KEP) [Skripsi]. Universitas Tanjungpura. 2015.