BAB 2
TINJAUAN PUSTAKA
2.1 Daun Benalu Tumbuhan Coklat (Dendrophthoe flosculosa Danser)
Daun benalu tumbuhan coklat memiliki bunga berwarna kuning tua sampai merah
kecoklatan. Daun tersebar dan berlawanan; helaian daun melonjong atau bundar
telur, memiliki panjang 8-21 cm dan lebar 3-9 cm, panjang tangkai daun 3-6 (-10)
mm, ujung daun menirus dan meruncing, dan pangkal daun menirus atau membaji
dan permukaan atas sedikit berkilau atau mengkilap dan permukaan daun buram.
Pertulangan daun menyirip dengan tulang lateral nyata pada kedua sisi.
Perbungaan tandan dengan 30-60 bunga, panjang sumbu perbungaan 15-80 mm,
dengan panjang pedisel 1,5 – 2,5 mm. Mahkota 5 merus, panjang 23-26 mm,
ramping dan pada bagian ujungnya tumpul, merah oranye atau kuning oranye,
membentuk tabung dengan panjang 16-19 mm.
Penyebaran Dendrophthoe flosculosa Danser meliputi Malaysia dan Sumatera. Ekologi dan habitatnya tumbuh pada ketinggian 0 – 1550 m dpl
(Barlow, 1997).
2.1.1 Sistematika Tumbuhan Benalu Coklat
Daun Benalu Coklat (Dendrophthoe flosculosa Danser)
Kingdom : Plantae
Divisi : Magnoliophyta
Class : Magnoliopsida
Ordo : Santalales
Famili : Loranthaceae
Genus : Dendrophthoe
2.2Senyawa flavonoida
Flavonoid merupakan kelompok senyawa bahan alam terbesar turunan dari
1,3-difenilpropana yang tersebar secara luas pada tumbuhan tingkat tinggi namun juga
dapat ditemukan pada tumbuhan tingkat rendah, termasuk alga. Kebanyakan
flavonoid berwarna kuning, juga memberikan warna kuning pada bunga-bunga
dan buah-buahan, yang mana biasanya ditemukan sebagai glikosida. Sebagian
besar flavonoida berpotensi sebagai senyawa antioksidan (Sarker, 2007).
Senyawa flavonoida terdapat pada semua bagian tumbuhan termasuk
daun, akar, kayu, kulit, tepung sari, bunga, buah dan biji. Kebanyakan flavonoida
berada dalam tumbuh-tumbuhan kecuali alga. Flavonoida juga terdapat pada
hewan. Flavanoida tersebar pada tumbuhan angiospermae, klorofita, fungi
briofita (Markham, 1988).
Flavonoid memiliki potensi sebagai anti inflamasi, antitumor, antimikroba
dan antivirus. Banyak obat-obatan tradisional dan tanaman obat mengandung
flavonoid sebagai senyawa bioaktif.Sifat antioksidan flavonoid terdapat di
buah-buahan segar dan sayuran yang diperkirakan berpotensi untuk pencegahan
penyakit kanker dan jantung (Sarker, 2007).
Kandungan flavonoid yang tinggi terdapat pada epidermis daun dan kulit
buah-buahan yang berperan penting sebagai metabolit sekunder.Pada tumbuhan,
flavonoid terlibat dalam beragam proses seperti perlindungan UV, pigmentasi,
2.2.1 Struktur Dasar dan Penomoran Senyawa Flavonoida
Golongan flavonoida dapat digambarkan sebagai deretan senyawa C6 – C3 – C6.
Yang berarti bahwa kerangka atom karbonnya terdiri atas dua gugus C6 yang
dihubungkan oleh rantai alifatik tiga-karbon seperti pada gambar 2.1 di bawah ini
:
C C C
A B
Gambar 2.1 Kerangka dasar senyawa flavonoida
Flavonoid memiliki ciri khas adanya cincin piran yang menghubungkan
rantai tiga karbon dengan salah satu dari cincin benzena (Robinson, 1995).
Sistem penomoran untuk turunan flavonoid dapat dilihat pada gambar 2.2 sebagai
berikut:
O
A
B 1
2
3 4 5
6 7
8
1'
2' 3'
4'
5' 6' C
9
10
Gambar 2.2 Sistem Penomoran Flavonoid
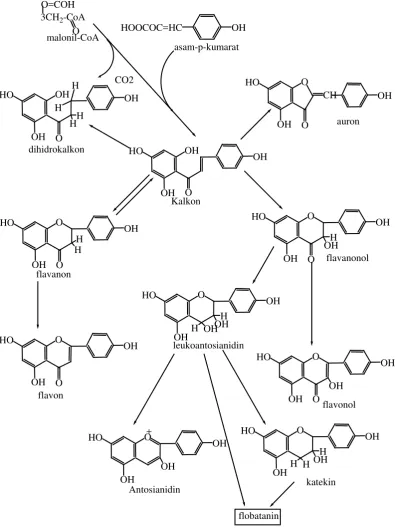
2.2.2 Jalur Metabolisme Flavonoida
Prazat utama flavonoid sudah diketahui dari berbagai hasil percobaan perunutan
tetapi jalur yang lebih rinci belum diketahui secara pasti. Fenilalanina amonia
liase merupakan enzim utama yang mengendalikan masuknya metabolit ke jalur
flavonoid. Percobaan perunutan memastikan bahwa cincin A flavonoid berasal
dari penyambungan kepala-ke-ekor tiga molekul asetat, tetapi ada dua mekanisme
yang berlainan untuk penutupan cincin.
Senyawa C6-C3 misalnya fenilalanina, asam sinamat, dan asam ferulat
merupakanprazat yang efisien untuk cincin B dan rantai C3. Pada tahap tertentu
modifikasi cincin B dapat terjadi sebelum kondensasi dengan atom pada cincin A,
namun kebanyakan modifikasi terjadi pada aras C15. Jalur metabolisme flavonoid
dapat dilihat dengan jelas pada gambar 2.3.
Dalam spesies tumbuhan tertentu terdapat flavonoid yang berbeda – beda
dengan pola hidroksilasi cincin yang sama, perbedaannya hanya pada metilasi,
glikosilasi, dan struktur bagian C3. Hal ini menunjukkan bahwa terdapat senyawa
antara C-15 yang umum yang diubah menjadi berbagai flavonoid setelah pola
hidroksilasi cincin terbentuk. Akan tetapi, berbagai jenis gugus hidroksil ini
tampaknya dimasukkan pada tahap yang berlainan dalam sintesis (Robinson,
O
2.2.3 Klasifikasi Senyawa Flavonoida
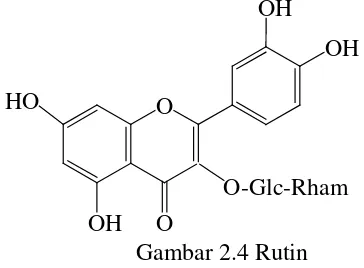
1. Flavonoida O-glikosida
Flavonoida biasanya terdapat sebagai flavonoid O-Glikosida. Pada
senyawa tersebut satu gugus hidroksil flavonoid atau lebih yang terikat
pada satu gula atau lebih dengan ikatan hemiasetal yang tak tahan asam
Pengaruh glikosilasi menyebabkan flavonoid menjadi kurang reaktif
dan lebih mudah larut dalam air. Sifat terakhir ini memungkinkan
penyimpanan flavonoid di vakuola sel (Markham, 1988). Salah satu
contohnya yaiu Rutin pada gambar 2.4 (Sarker, dkk. 2007).
2. Flavonoida C-glikosida
Gula juga dapat terikat pada atom karbon flavonoid dan dalam hal ini
gula tersebut terikat langsung pada inti benzene dengan suatu ikatan
karbon-karbon (Markham, 1988). Contoh dari flavonoida C-glikosida
dapat dilihat pada gambar 2.5 yaitu Isovitexin (Sarker, dkk. 2007).
O OH
O
OH
Gambar 2.4 Rutin HO
OH
O-Glc-Rham
O OH
HO O
OH
O HO
HO
OH HO
3. Flavonoida Sulfat
Flavonoid flavonoid lain yang mudah larut dalam air yang mungkin
ditemukan hanya flavonoida sulfat. Senyawa ini mengandung satu ion
sulfat atau lebih yang terikat pada hidroksil fenol atau gula. Secara
teknis senyawa ini sebenarnya bisulfat karena terdapat sebagai garam,
yaitu flavon-O-SO3-K (Markham, 1988).
4. Biflavonoid
Biflavonoid adalah flavonoid dimer flavonoid yang biasa terlibat yaitu
biasanya flavon dan flavanon secara biosintesis mempunyai pola
oksigenasi yang sederhana dan ikatan antar flavonoid yaitu ikatan
karbon-karbon atau ikatan eter contoh pada gambar 2.6 Amentoflavon (
Markham, 1988). Biflavonoid terdapat hampir khusus dalam
gimnospermae tetapi kadang-kadang dapat juga ditemukan dalam
angiospermae (Harbone, 1987).
5. Aglikon Flavonoida
Aglikon flavonoid mempunyai atom karbon atom asimetrik dan dengan
demikian menunjukkan sifat keaktifan optik (yaitu memutar bidang
polarisasi-datar). Yang termasuk dalam golongan ini adalah flavanon,
dihidroflavonol, katekin, pterokarpan, rotenoid, dan beberapa
biflavonoid (Markham, 1988).
O OH
HO O
OH
O OH
HO O
OH
Gambar 2.6 Amentoflavon 3'
Flavonoida dapat dikelompokkan berdasarkan keragaman pada rantai C3 yaitu
1. Flavonol
Flavonol dapat dikatakan sebagai flavonoid yang paling tersebar luas
dan tersebar di seluruh kingdom tumbuhan kecuali alga dan fungi
(Gambar 2.7) . Flavonol seperti myricetin, quercetin, isorhamnetin dan
kaemperol pada umumnya ditemukan dalam bentuk o-glikosida
(Robinson, 1995)
2. Flavon
Flavon (Gambar 2.8) memiliki struktur yang sangat mirip dengan
flavonol (Crozier, 2006). Flavonol dan flavon paling tersebar luas dari
semua senyawa fenolik (Cseke, dkk. 2006). Hanya ada 2 flavon umum
yaitu apigenin dan luteolin. Flavon juga terdapat dalam bentuk glikosida
tetapi jenisglikosidanya lebih sedikit daripada jenis gikosida pada
flavonol (Harbone, 1987). O O
OH
Gambar 2.7 Flavonol
O O
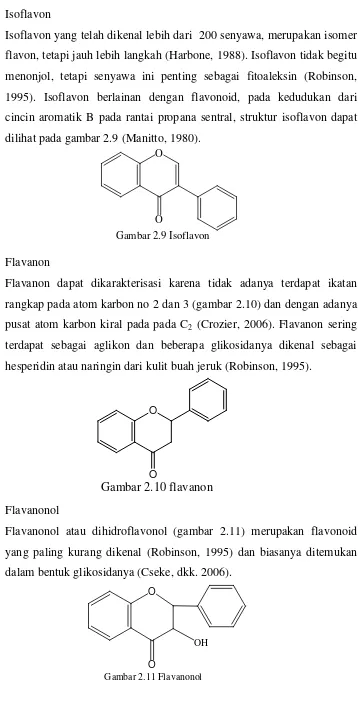
3. Isoflavon
Isoflavon yang telah dikenal lebih dari 200 senyawa, merupakan isomer
flavon, tetapi jauh lebih langkah (Harbone, 1988). Isoflavon tidak begitu
menonjol, tetapi senyawa ini penting sebagai fitoaleksin (Robinson,
1995). Isoflavon berlainan dengan flavonoid, pada kedudukan dari
cincin aromatik B pada rantai propana sentral, struktur isoflavon dapat
dilihat pada gambar 2.9 (Manitto, 1980).
4. Flavanon
Flavanon dapat dikarakterisasi karena tidak adanya terdapat ikatan
rangkap pada atom karbon no 2 dan 3 (gambar 2.10) dan dengan adanya
pusat atom karbon kiral pada pada C2 (Crozier, 2006). Flavanon sering
terdapat sebagai aglikon dan beberapa glikosidanya dikenal sebagai
hesperidin atau naringin dari kulit buah jeruk (Robinson, 1995).
5. Flavanonol
Flavanonol atau dihidroflavonol (gambar 2.11) merupakan flavonoid
yang paling kurang dikenal (Robinson, 1995) dan biasanya ditemukan
dalam bentuk glikosidanya (Cseke, dkk. 2006).
O O
Gambar 2.9 Isoflavon
O O
Gambar 2.10 flavanon
O O
OH
6. Antosianin
Antosianin merupakan pewarna paling penting dan paling tersebar luas
dalam tumbuhan (Harbone, 1988). Antosianin ialah pigmen daun bunga
merah sampai biru yang biasa ( meskipun apigeninidin kuning),
banyaknya sampai 30% bobot kering dalam beberapa bunga. Tidak
seperti golongan flavonoid lainnya antosianin selalu terdapat sebagai
glikosida. Salah satu contoh antosianin dari paku – pakuan misalnya
luteolinidin dapat dilihat pada gambar 2.12 (Robinson, 1995).
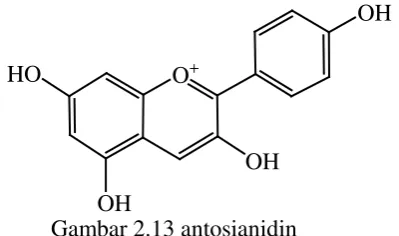
7. Antosianidin
Antosianidin merupakan aglikon antosianin yang terbentuk bila
antosianin dihidrolisis dengan asam (Harbone, 1988) dimana secara luas
tersebar dalam kingdom plantae dan jelas terdapat dalam jaringan bunga
dan buah. Antosianidin (gambar 2.13) ini bertanggung jawab dalam
meberikan warna merah,biru, dan ungu. Antosianidin juga ditemukan
dalam di daun, batang, biji dan jaringan akar dan memiliki peran penting
dalam menarik serangga dalam penyerbukan.
O+
OH HO
OH
H
OH
H
Gambar 2.12 Luteolinidin
O+
OH
OH HO
OH
8. Auron
Auron berupa pigmen kuning emas terdapat dalam bunga tertentu dan
bryofita (gambar 2.14). Dikenal hanya lima aglikon , tetapi pola
hidroksilasi senyawa ini umumnya serupa dengan pola pada flavonoid
lain dalam larutan basa senyawa ini menjadi merah rose. Beberapa
contoh auron yaitu leptosin, aureusidin, sulfuretin, dan sulfuretin
(Robinson, 1995)
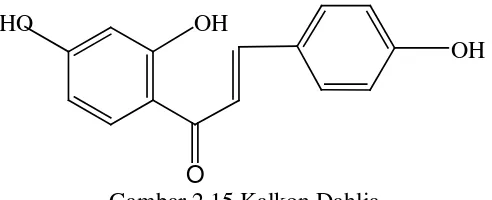
9. Kalkon
Kalkon merupakan zat warna kuning pada bunga, kadang terdapat pada
jaringan lain. Sifat khas kalkon memberikan warna merah dengan
ammonia (Sirait, 2000). Struktur salah satu kalkon dari sumber
tumbuhan dahlia pada gambar 2. 15 (Robinson, 1995) O
Gambar 2.14 auron
O
Gambar 2.15 Kalkon Dahlia
HO OH
2.2.3 Sifat Kelarutan Flavonoida
Senyawa flavonoid termasuk senyawa polar, karena mempunyai sejumlah gugus
hidroksil ataupun suatu gugus gula. Hal ini memungkinkan flavonoid dapat larut
dalam pelarut polar seperti etanol (EtOH), metanol (MeOH), butanol, aseton,
dimetilsulfoksida (DMSO), dimetilformamida (DMF), air dan lain-lain.
Flavonoid yang berupa aglikon merupakan golongan polifenol yang
memiliki sifat senyawa fenol yaitu bersifat agak asam, Keberadaan gugus gula
yang terikat pada flavonoid (glikosida) cenderung menyebabkan flavonoid lebih
mudah terlarut dalam air. Namun hal sebaliknya tidak berlaku pada aglikon yang
kurang polar seperti isoflavon, flavanon, dan flavon serta flavonol yang
termetoksilasi cenderung lebih mudah larut dalam pelarut seperti eter dan
kloroform (Markham, 1988).
2.3Skrining Fitokimia
Banyak reagen yang dapat digunakan untuk mengetahui keberadaan dari
flavonoid, meskipun beberapa juga akan bereaksi positif dengan senyawa
polifenol. Reagen yang biasa digunakan adalah :
1. Shinoda Test, yaitu dengan menambahkan serbuk magnesium pada ekstrak
sampel dan beberapa tetes HCl pekat. Menghasilkan warna orange, pink,
merah sampai ungu akan terjadi pada senyawa flavon, flavonol, turunan
2,3-dihidro dan xanton.
2. H2SO4(p), flavon dan flavonol akan memberikan perubahan larutan kuning
pekat. Kalkon dan auron menghasilkan larutan berwarna merah atau merah
kebiru-biruan. Flavanon memberikan warna orange sampai merah.
3. NaOH 10% , menghasilkan larutan biru violet (Sarker, et al 2006).
2.4 Teknik Pemisahan
Teknik pemisahan memiliki tujuan untuk memisahkan komponen yang akan
ditentukan berada dalam keadaan murni, tidak tercampur dengan
komponen-komponen lainnya. Ada 2 jenis teknik pemisahan:
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya
perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran
yang akan dipisahkan.
2. Pemisahan fisika adalah suatu teknik pemisahan yang didasarkan pada
perbedaan-perbedaan kecil dari sifat-sifat fisik antara senyawa-senyawa
yang termasuk dalam satu golongan (Muldja, 1995).
2.4.1 Ekstraksi
Terdapat sejumlah metode ekstraksi, yang paling sederhana adalah ekstraksi
dingin (dalam labu besar berisi biomassa), dengan cara ini bahan kering hasil
gilingan diekstraksi pada suhu kamar secara berturut-turut dengan pelarut yang
kepolarannya makin tinggi. Keuntungan utama cara ini adalah metode ekstraksi
yang mudah karena ekstrak tidak dipanaskan sehingga kemungkinan kecil bahan
alam terurai. Penggunaan pelarut dengan peningkatan kepolaran secara berurutan
memungkinkan pemisahan bahan alam berdasarkan kelarutannya (dan
polaritasnya) dalam ektraksi. Hal ini sangat mempermudah proses isolasi.
(Heinrich et al, 2010).
Beberapa metode ekstraksi dapat digunakan untuk mengekstrak suatu
konstituen dalam suatu bahan tanaman, yang diantaranya adalah maserasi,
perkolasi, ekstraksi sokletasi, ekstraksi pelarut bertekanan, ekstraksi dengan
refluks, dan destilasi uap. Dalam ekstraksi padat-cair, bahan tanaman ditempatkan
dalam sebuah wadah, dan dibiarkan terjadi kontak dengan pelarut. Proses yang
terjadi dari seluruh proses dinamis tersebut dapat diuraikan menjadi beberapa
tahap, yaitu tahap pertama pelarut akan berdifusi ke dalam sel, kemudian pelarut
akan melarutkan metabolit, dan pada proses akhir pelarut akan berdifusi keluar
Ekstraksi dianggap selesai bila tetesan terakhir memberikan reaksi negatif
terhadap senyawa yang diekstraksi. Untuk mendapatkan larutan ekstrak pekat,
biasanya pelarut ekstrak diuapkan dengan menggunakan alat rotari evaporator
(Harborne, 1987).
2.4.2 Partisi
Metode pemisahan yang mungkin paling sederhana adalah partisi, yang banyak
digunakan sebagai tahap awal pemurnian ekstrak. Partisi menggunakan dua
pelarut tak bercampur yang ditambahkan kedalam ekstrak tersebut, hal ini dapat
dilakukan secara terus menerus dengan menggunakan dua pelarut yang tak
bercampur yang kepolarannya meningkat.
Partisi biasanya dilakukan melalui dua tahap :
1. Air/petroleum eterringan (heksana) untukmenghasilkanfraksi
nonpolar di lapisanorganik
2. Air/diklorometanatau air/kloroformatau
air/etilasetatuntukmembuatfraksiagak polar di lapisanorganik.
Inimerupakanmetodepemisahan yang
mudahdanmengandalkankelarutanbahanalamdanbukaninteraksifisi
kdengan medium lain (Heinrich et al, 2010).
Prinsip kerja dari partisi yaitu menggunakan prinsip ekstraksi cair-cair.
Ketika fase diam dilapisi dengan suatu penunjang yang berbentuk padatan atau
sering disebut dengan suatu penyangga seperti di kromatografi kolom yang
menggunakan selulosa yang dilapisi dengan air atau plat yang digunakan pada
kromatografi lapis tipis yaitu silika yang menggunakan adsorben yaitu air, fase
diam yang digunakan dibuat berdasarkan pemisahan yang bisa dibawa fase gerak
yang berupa zat organik. Fase gerak yang berupa cairan secara kimia akan
2.4.3 Hidrolisa
Hidrolisis merupakan pemecahan ikatan kimia akibat adanya reaksi oleh air
(Cairns, 2004). Hidrolisis glikosida flavonoid dapat dilakukan dengan tiga metode
yaitu hidrolisis asam, hidrolisis basa dan hidrolisis dengan bantuan enzim
(Markham, 1988). Ketiga metode hidrolisis tersebut memiliki kegunaan
masing-masing. Hidrolisis asam banyak digunakan untuk melepaskan residu gula terikat
dan aglikon flavonoid. Hidrolisis enzim digunakan untuk mengidentifikasi gula
spesifik dan posisi ikatan, sedangkan hidrolisis basa digunakan untuk
menghilangkan asam ester organik pada flavonoid (Tomas-Barberan & Farreres,
2012).
Flavonoid umumnya terdapat dalam tumbuhan, terikat pada gula sebagai
glikosida dan aglikon flavonoid yang mungkin terdapat dalam satu tumbuhan
dalam beberapa bentuk kombinasi glikosida. Pemilihan metode hidrolisis
didasarkan pada bentuk glikosida flavonoid, gula penyusun glikosida dan tempat
berikatan gula dengan aglikon. Perbedaan kecepatan hidrolisis glikosida
bergantung pada jenis gula dan tempat berikatan gula dengan aglikon (Bohm,
1998). Harborne (1965) mengkategorikan glikosida menjadi 3 kategori yaitu
mudah dihidrolisis, lambat dihidrolisis dan tahan asam.
Prosedur yang digunakan untuk hidrolisis asam dari flavonoid glikosida
adalah, sebanyak 2 mg sampel flavonoid glikosida dicampur dengan asam klorida
6% sebanyak 5 ml dengan jumlah metanol yang sangat sedikit pada sampel untuk
membuat proses hidrolisis menjadi sempurna. Larutan dipanaskan selama 45
menit lalu didinginkan, kemudian ekstrak sepenuhnya dilarutkan dengan eter.
Penguapan dari larutan akan mengendapkan ramnosa dan glukosa. Lapisan eter
setelah dikeringkan dengan menggunakan natrium sulfat akan didapatkan aglikon
2.4.4 Kromatografi
Saat ini kromatografi adalah teknik pemisahan yang paling umum dan sering
digunakan dalam bidang kimia analisis dan dimanfaatkan untuk analisis baik
secara kualitatif dan kuantitatif atau bahkan analisis preparatif. Teknik
kromatografi telah berkembang dan digunakan untuk memisahkan dan
mengkuantifikasi komponen-komponen yang kompleks, baik organik maupun
anorganik (Sudjadi, 2007).
Semua teknik kromatografi pada dasarnya menggunakan dua fasa, yaitu
fasa tetap dan fasa bergerak. Pemisahan tergantung pada gerakan relatif dari
kedua fasa tersebut. Kromatografi dapat digolongkan sesuai dengan sifat dari fasa
tetap, jika berupa zat padat dikenal sebagai kromatografi serapan (absorption chromatography) dan jika berupa zat cair dikenal sebagai kromatografi partisi (partition chromatography) (Sastrohamidjojo, 1985).
Proses Sorpsi
Sorpsi merupakan proses pemindahan solut dari fasa gerak ke fasa diam,
sedangkan proses sebaliknya pemindahan solut dari fasa diam ke fasa gerak
disebut desorpsi. Keduanya terjadi secara terus-menerus selama pemisahan karena
sistem kromatografi berada dalam keadaan kesetimbangan dinamis.
Solut akan terdistribusi diantara dua fasa yang sesuai dengan perbandingan
distribusinya untuk menjaga keadaan yang setimbang. Beberapa mekanisme yang
terlibat pada proses sorpsi yaitu adsorpsi, partisi, pertukaran ion, dan eksklusi
Adsorben
Silika gel merupakan jenis adsorben (fase diam) yang penggunaannya
paling luas. Permukaan silika gel terdiri atas gugus Si-O-Si dan gugus silanol
(Si-OH). Gugus silanol bersifat sedikit asam dan polar sehingga dapat membentuk
ikatan hidrogen dengan solut-solut yang agak polar sampai sangat polar.
Adanya air dari atmosfer yang diserap oleh permukaan silika gel mampu
mendeaktifkan permukaannya karena air akan menutup sisi aktif silika gel. Hal ini
dapat diatasi dengan memanaskan pada suhu 1050C, meskipun demikian
reprodusibilitasnya sulit dicapai kecuali jika suhu dan kelembapan benar-benar
dijaga secara hati-hati. Semakin polar solut maka akan semakin tertahan kuat ke
dalam adsorben silika gel ini (Sudjadi, 1986).
Silika gel dapat diaktivasi dengan cara dipanaskan pada suhu 110ºC
selama 24 jam. pH dari silika gel yang telah diaktivasi adalah 4. Di samping itu,
silika gel juga dapat di nonaktifkan (reactivation) dengan cara pemanasan pada suhu 110ºC selama 24 jam (Armarego, dkk. 2012).
2.4.4.1 Kromatografi Lapis Tipis
Kromatografi lapis tipis dikembangkan oleh Ismailoff dan Schraiber pada tahun
1938. Metode ini sederhana, sensitif, kecepatan pemisahan tinggu dan mudah
untuk memperoleh kembali senyawa-senyawa yang terpisahkan (Khopkar,1990).
Dalam kromatografi lapis tipis, fase diamnya merupakan penjerap
berukuran kecil dengan diameter partikel antara 10-30µm. Semakin kecil ukuran
partikel fase diam, maka semakin baik kinerja efisiensi dan resolusi kromatografi
lapis tipis. Fase gerak yang dikenal sebagai pelarut pengembangan bergerak
sepanjang fase diam akibat adanya pengaruh kapiler pada pengembangan secara
Pemilihan fase gerak yang digunakan pada kromatografi lapis tipis
tergantung pada solut yang dianalsis dan fase diam yang digunakan
(Sumarno,2001).
Kromatografi lapis tipis digunakan untuk dua tujuan pertama sebagai
metode untuk memperoleh hasil kualitatif, kuantitatif atau preparatif dan yang
kedua yaitu untuk menentukan sistem pelarut yang akan digunakan pada
kromatografi kolom atau kromatografi cair kinerja tinggi. Dengan menggunakan
kromatografi lapis tipis, pemisahan yang dilakukan pada senyawa yang berbeda
seperti senyawa organik alam, senyawa organik sintetik, kompleks
anorganik-organik, dapat dilakukan dalam beberapa menit dan peralatan yang digunakan
juga tidak mahal dan jumlah cuplikan yang rendah dalam beberapa mikrogram
dapat ditangani. Kelebihan dari metode kromatografi lapis tipis ini yaitu
pemakaian pelarut dan cuplikan yang jumlahnya sedikit (Gritter,1991).
Fase diam yang digunakan dalam kromatografi lapis tipis berupa fase
polar seperti silika gel, kiselguhr, alumina (aluminium oksida), magnesium silikat
dan selulosa, dan fase non polar (fase terbalik) seperti fase diam dari silika. Bila
fase diam telah ditentukan maka pemilihan fase gerak yang akan digunkan
berpedoman pada kekuatan elusi dari fase gerak tersebut (Sumarno,2001).
2.4.4.2 Kromatografi Kolom
Pada kromatografi kolom, campuran yang akan dipisahkan diletakkan berupa pita
pada bagian atas kolom penjerap yang berada dalam tabung kaca. Pelarut sebagai
fasa gerak dibiarkan mengalir melalui kolom karena aliran yang disebabkan oleh
gaya berat atau didorong dengan tekanan. Pita senyawa pelarut bergerak melalui
kolom dengan laju berbeda, memisah, dan dikumpulkan berupa fraksi ketika
2.4.4 Kristalisasi
Kristalisai adalah pengendapan kristal dari larutan yang terbuat dari bahan
tertentu. Selama proses pembentukan kristal, molekul akan cenderung menjadi
melekat kristal tumbuh terdiri dari jenis yang sama molekul karena cocok dalam
kisi kristal untuk molekul struktur yang sama daripada molekul yang lain. Jika
proses kristalisasi diperbolehkan untuk terjadi dalam mendekati – kondisi
kesetimbangan, preferensi molekul untuk deposit pada permukaan terdiri dari
molekul seperti akan menyebabkan peningkatan dalam kemurnian bahan kristal.
Sehingga proses rekristalisasi adalah salah satu metode yang paling penting
tersedia bagi ahli kimia untuk pemurnian padatan ( Pasto, 1992 ).
2.4.5 Rekristalisasi
Amorf yang diperoleh dari hasil isolasi dilarutkan kembali dengan EtOAc, diaduk
hingga semua amorf larut sempurna. Kemudian ditambahkan n – heksana secara
perlahan – lahan hingga pembentukan kembali senyawa yang lebih murni dari
sebelumnya dan jatuh di dasar wadah. Didekantasi larutan bagian atas wadah.Lalu
diuapkan sisa pelarut dari amorf hingga diperoleh kristal yang benar – benar bebas
dari pelarut (Jacobs, 1974).
2.5 Teknik Spektroskopi
Teknik analisis spektroskopi berasaskan antaraksi radiasi elektromagnet dengan
komponen atom atau molekul yang menghasilkan fenomena bermakna sebagai
parameter analisis. Pada spektroskopi pembangkit sinyal adalah hasil antaraksi
energi radiasi elektromagnet dengan elektron dalam atom/molekul analit.
Teknik spektroskopi antaraksi radiasi elektromagnet dengan komponen
2.5.1 Spektrofotometer UV-Vis
Spektrofotometer UV-Vis merupakan pengukuran panjang gelombang dan
intensitas sinar ultraviolet dan cahaya tampak yang diabsorbsi oleh sampel.
Spektrofotometer UV-Vis umumnya digunakan untuk menentukan jenis
kromofor, ikatan rangkap terkonyugasi, serta menganalisis senyawa organik
secara kuantitatif dengan menggunakan hukum Lambert-Beer (Dachriyanus,
2004).
Spektrofotometer serapan ultraviolet juga digunakan untuk menentukan
jenis flavonoid dan menentukan pola oksigenasi. Selalin itu juga berguna untuk
menentukan kedudukan gula atau metil yang terikat pada salah satu gugus
hidroksi fenol berdasarkan penambahan pereaksi (pereaksi geser) kedalam suatu
larutan cuplikan dan mengamati pergeseran puncak serapan yang terjadi.
Spektrum flavonoid biasanya ditentukan dalam larutan dengan menggunkan
pelarut metanol atau etanol (EtOH). Spektrum yang khas dari flavonoid ini terdiri
atas dua maksimal pada rentang 240-285 nm (pita II) dan 300-550 nm (pita I)
(Markham,1988).
2.5.2 Spektrofotometer Inframerah (FT-IR)
Spektrofotometer inframerah umumnya digunakan untuk menentukan gugus
fungsi senyawa organik dan mengetahui informasi struktur suatu senyawa
organik dengan membandingkan daerah sidik jarinya.
Pengukuran spektrum inframerah dilakukan pada daerah cahaya tengah
Karakteristik frekuensi vibrasi IR dipengaruhi oleh perubahan yang sangat
kecil pada molekul sehingga sulit untuk menentukan struktur yang hanya
berdasarkan pada data IR saja (Dachriyanus, 2004).
2.5.3 Spektrometer Resonansi Magnetik Proton (1H-NMR)
Spektrometer resonansi magnetik inti (Nuclear Magnetic Resonance), yang disingkat sebagai NMR, merupakan instrumen yang sangat penting untuk
memperoleh informasi senyawa kimia, juga dapat menyelesaikan dan
memecahkan masalah atau informasi yang sebelumnya sulit untuk diperoleh.
Struktur yang dianalisis dengan menggunakan NMR akan memberikan
informasi mengenai lingkungan kimia atom hidrogen, jumlah atom hidrogen
dalam setiap lingkungan da struktur gugusan yang berdekatan dengan setiap atom
hidrogen (Cresswell,1982).
Senyawa yang paling lazim digunakan sebagai acuan dalam NMR ini
adalah tetrametilsilana (TMS), dimana senyawa ini mempunyai beberapa
kelebihan yaitu lamban secara kimia, larut dalam kebanyakan pelarut organik.
TMS akan memberikan puncak serapan yang tajam tunggal serta menyerap pada
medan yang lebih tinggi daripada hampir semua proton organik
(Silverstein,1986).
NMR mempunyai peranan penting dalam ilmu kimia. Hal ini setidaknya
disebabkan oleh dua faktor. Pertama, penerapan NMR yang terbaru merupakan
hasil peningkatan selama beberapa tahun terakhir. Kedua, spektrometer NMR
merupakan instrumen yang tersedia di pasaran dan berkembang terus, tentunya
juga memenuhi standar sensitivitas, fleksibilitas, efisiensi, kecanggihan
komputasi, dan harga yang sesuai. Peningkatan NMR lainnya dapat dilihat dalam
hal spektrum NMR zat padat, NMR multi-dimensi zat cair, dan kemampuan untuk