JURNAL TERNAK Vol. 01 No.01 Th.2010
1
KERAGAMAN DNA MIKROSATELIT BM415 DAN BM4621 PADA DOMBA KOMPOSIT (SUMATRA X BARBADOS BLACKBELLY X ST. CROIX)
Ratna Kumala Dewi
Dosen Fakultas Peternakan Universitas Islam Lamongan
Abstract
The forming of composite breed sheep were expected to able adapted with damp and tropical environment, reproduction during the year and have good growth rate. The genetic variations of composite sheep form to be analysed in this research using microsatellite DNA marker. This research was to determine the allele variation of microsatellite DNA in composite sheep by PCR (Polymerase Chain Reaction) using primers BM415 and BM4621 and the relation among litter size, litter weight at lambing and at weaning, and genotype frequency in each primer. The PCR products were visualized on PAGE 8% (Polyacrilamid Gel Electrophoresis) using silver staining. The result showed that composite breed sheep population exhibited the high genotype variation, high allele variation and high heterozigosity. Loci BM415 showes 11 genotypes which identified 9 alleles, were dominated EI (22,73%) and E (21,01%). Loci BM4621 showes 11 genotypes which identified 11 alleles, DI and GK genotypes and G allele show high frequency (17,05% and 20,45% repectively). BM415 and BM4621 loci showe heterozigosity value of 0,851437 and 0,892905. The average heterozigosity between two locies were 0,872171. Heterozigosity and average heterozigosity value showed that the composite sheep population in Stasiun Percobaan Cilebut, Balai Peternakan Bogor has high variability. Genotype was not significantly different (P>0,05) with litter size, litter weight at lambing and at weaning.
Keywords : crossbreed, composite sheep, microsatellite, allele variation
PENDAHULUAN
Kebutuhan daging di Indonesia meningkat dari tahun ke tahun, hal ini disebabkan oleh makin tingginya kesadaran masyarakat akan pentingnya kebutuhan protein hewani. Salah satu sumber protein hewani berasal dari daging domba, disamping daging ternak lainnya sepeti daging sapi, kerbau, kambing, ayam dan lain-lain. Populasi domba di Indonesia berkisar 7 juta ekor per tahun (BPS, 2001), angka ini jarang mengalami peningkatan atau penurunan yang terlalu besar karena sebagian besar domba di Indonesia dipelihara dalam peternakan rakyat. Hal ini menyebabkan performa dan populasi domba relative rendah sehingga berpengaruh terhadap rendahnya produksi daging dalam negeri. Hal ini juga dikarenakan mutu genetik domba local yang masih rendah serta manajemen pemeliharaan yang masih tradisional sehingga diperlukan usaha yang terus menerus untuk meningkatkan mutu genetic ternak lokal, dalam hal ini ternak domba.
Salah satu cara untuk meningkatkan produksi daging adalah melalui program persilangan (crossbreeding). Persilangan dapat dilakukan dengan perkawinan dua bangsa domba atau lebih. Dalam program persilangan, perlu diperhatikan pengendalian terhadap penyebaran domba hasil persilangan. Penyebaran yang tidak terkendali dapat mengakibatkan hilangnya kemurnian seluruh populasi bangsa domba yang disilangkan. Domba Sumatera merupakan salah satu domba lokal yang mempunya produktifitas dan prolifikasi yang
tinggi, namun mempunyai laju pertumbuhan dan bobot hidup dewasa yang rendah. Untuk memperbaiki kekurangan ini, persilangan dengan domba prolifik tropis lainnya yang diiringi dengan perbaikan manajemen pemeliharaan adalah cara yang paling baik. Domba Barbados Blackbelly dan St. Croix adalah bangsa domba yang dianggap cukup baik dalam pembentukan domba komposit persilangan tiga bangsa). Selain prolifik, pertambahan bobot hidup dan bobot dewasanya yang tinggi, juga merupakan bangsa domba tipe rambut yang dharapkan dapat menghilangkan wool pada domba Sumatera yang merupakan penyebab cekaman panas, secara genetik.
Kemajuan potensi genetik akan lebih cepat tercapai jika program pemuliaan dilakukan dengan crossbreeding yang diirngi dengan seleksi. Seleksi yang baikdiharapkan dapat meningkatkan dan menjaga keragaman mutu genetik karena dengan keragaman yang tinggi pengaruh gen-gen resesif yang memberikan efek negatif dapat ditekan. Program persilangan dan seleksi yang dilakukan sekarang ini memerlukan waktu yang relatif cukup lama, hal ini disebabkan kedua program pemuliaan tersebut memerlukan pencatatan produksi dan reproduksi yang sangat akurat. Meskipun telah dilakukan perbaikan sifat melalui crossbreeding, namun sifat-sifat yang menguntungkan yang dimiliki domba belum diketahui, sehingga studi molecular genetik dibutuhkan dalam upaya mengetahui sifat-sifat ekonomis secara cepat dan akurat. Salah satu bidang ilmu bioteknologi
JURNAL TERNAK Vol. 01 No.01 Th.2010
2
yang berkembang adalah studi mengenai keragaman genetic pada tingkat DNA. Bermacam-macam teknik telah ditemukan untuk mempelajari keragaman DNA, diantaranya adalah analisi polimorfisme runutan DNA, polimorfisme situs restriksi dan mikrosatelit.
Dibandingkan penanda DNA yang ada pada saat ini, mikrosatelit memiliki berbagai keuntungan dalam analisis genom, antara lain karena jumlahnya yang sangat berlimpah di dalam genom, memiliki informasi keragaman yang sangat tinggi dan relative lebih mudah diproduksi dan dianalisi terutama setelah keberhasilan mengamplifikasi lokus menggunakan teknologi PCR (Polymerase Chain Reaction). Polimorfisme mikrosatelit yang tinggi akibat mutasi dan rekombinasi menjadikannya sebagai penanda molekuler yang baik untuk mempelajari struktur genetic suatu populasi. Berdasarkan informasi diatas, penelitian ini bertujuan untuk mendeteksi variasi keragaman genetic domba komposit (Sumatera x Barbados Blackbelly x St. Croix) yang berada di Balai Penelitian Ternak Bogor dengan menggunakan mikrosatelit BM415 dan BM4621 yang terletak di kromosom 6.
MATERI DAN METODE
Lokasi dan Waktu
Penelitian ini dilakukan selama lima bulan, mulai bulan Februari sampai Juni 2005. Lokasi penelitian meliputi (1) Balai Penelitian Ternak Bogor, (2) Laboratorium Zoologi, Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor
Materi
1. Domba
Domba komposit (Sumatera x Barbados Blackbelly x St. Croix) yang digunakan dalam penelitian ini berjumlah 96 ekor dan merupakan domba lepas sapih yang terdapat di Balai Penelitian Ternak Bogor. Dari 96 ekor sampel darah yang diambil, hanya digunakan 93 sampel karena terdapat 3 sampel darah domba Barbados Cross.
2. Penanganan dan Pengambilan Sampel
Bahan yang digunakan dalam pengambilan sampel adalah alkohol 70%, es dan kapas. Alat yang digunakan yaitu jarum vacutainer, tabung vakum berantikoagulan (10 ml) dan termos es.
3. Pengambilan Data Sekunder
Data sekunder domba komposit (Sumatera x Barbados Blackbelly x St. Croix) diambil dari Balai Penelitian Ternak Bogor untuk bobot lahir, bobot sapih, tanggal lahir, informasi tentang tetua ; dan tipe kelahiran domba yang diambil sebagai sample.
4. Ekstraksi DNA
Bahan yang digunakan adalah 5 M NaCl; 1 mM EDTA (etilendiamin tetraasetat); NaCl 0,9%; NaCl 0,2%; proteinase K (5 mg/ml); 1 x STE (sodium tris EDTA); 10% SDS (sodium dodesil sulfat); fenol; kloroform; iso amil alkohol; etanol absolut; etanol 70% dan buffer TE (tris EDTA) 80%.
Alat yang digunakan adalah tabung vaccutainer (penampung darah); tabung eppendorf (0,5 ml dan 1,5 ml); pipet mikro Eppendorf (10µ-1 ml), tips Eppendorf;
vortex mixer; vacum desicator; alat sentrifugasi makro
dan mikro; refrigerator dan freezer (40C; -200C); sarung tangan plastik dan kertas tissue.
5. Primer
Primer adalah molekul pendek utas tunggal DNA yang akan menempel pada DNA cetakan di tempat yang spesifik. Sekuen primer BM415 dapat dilihat pada Lampiran 1 dan untuk primer BM4621 pada Lampiran 2. karakteristik primer yang digunakan dalam penelitian ini disajikan pada Tabel 2 berikut:
Tabel 2. Karakteristik Primer BM415 dan BM4621
Lokus Motif Ukuran (pb) TA (0C) Sekuen Primer (5’-3’) BM415 BM4621 (GT)19 (CA)14 142-169 135-157 52 58 F=GCTACAGCCCTTCTGGTTTG G=GAGCTAATCACCAACAGCA AG F=CAAATTGACTTATCCTTGGC TG G=TGTAACATCTGGGCTGCATC
Sumber : Bishop et al. (1990)
Keterangan : F = forward, R = reverse, TA = temperatur annealing
6. Amplifikasi DNA Mikrosatelit dengan Teknik
Polymerase Chain Reaction
Bahan yang digunakan adalah sampel DNA (10-100 ng), campuran 10x buffer PCR dan MgCl2 (Boehringer),
pasangan primer (1,5 pmol), enzim Taq polimerase (promega) (1,5 unit) dan buffernya, dNTP 2 mM, MgCl 2 mM dan air destilata steril. Alat yang digunakan adalah tabung PCR, mesin thermocycler (TaKaRa PCR Thermal Cycler MP4), alat sentrifugasi, vortex, pipet mikro Eppendorf 2 µl, lemari es dan Vortex mixer. 7. Elektroforesis
Bahan yang digunakan adalah air destilata (DW) steril, Akrilamida 30%, 5 x TBE, TEMED (tetra methylendiamine) dan APS (ammonium persulfat) 10%,
Loading dye, dan marker. Alat yang digunakan adalah
dua buah kaca untuk cetakan gel, pipet berskala, tabung reaksi, sisir khusus untuk sumur, pipet mikro Eppendorf 2µl dengan tipsnya dan voltase.
JURNAL TERNAK Vol. 01 No.01 Th.2010
3
8. Pewarnaan
Bahan yang digunakan adalah DW, CTAB (cetyltrimetil ammonium bromide) 0,2 gram/200 ml DW, NH4OH 2,4
ml/200 ml DW, larutan yang terdiri dari AgNO3 0,32
gram/200 ml; 0,08 NaOH 10 N; 0,8 ml NH4OH dalam
200 ml DW, larutan 4 gram Na2CO3 dengan 0,1 ml
formaldehide dan asam asetat glasial 1%. Alat yang digunakan adalah nampan, gelas ukur, labu erlenmeyer dan water-bath shaker.
Prosedur
1. Penanganan dan Pengambilan Sampel
Sampel darah diambil melalui vena jugularis
menggunakan jarum Vacutainer sebanyak 5 ml dan di masukan e dalam tabung vakum yang telah diberi koagulan. Kemudian disimpan dalam termos es dan suhunya dipertahankan sekitar 4 ºC sampai dilakukan ekstrasi DNA.
2. Pengambilan Data Sekunder
Data sekunder domba komposit (Sumatra x Barbados Blacbelly x St. Croix) diambil dari Balai Penelitian Ternakak Bogor unuk bobot lahir, bobot sapih, tanggal lahir domba, informasi tentang induk betina dan jantan domba serta tipe kelahiran domba yan diambil sebagai sampel . Informasi selengkapnya tentang data dombah bisa dilihat pada Lampiran 3.
3. Ekstraksi DNA
Darah disentrifugasi pada kecepatan 3500 rpm selama 10 menit yang akan membentuk tiga lapisan dari atas sampai bawah yaitu plasma, buffy coat (sel darah putih berinti) dan sel darah merah yang tidak berinti sel. Buffy
coat dipindahkan kedalam tabung baru menggunakan
pipet pasteur, kemudian dicuci dengan NaCl 0,2% dan 1 Mm EDTA lalu dikocok hingga tercampur merata tanpa terlihat endapan didasar tabung lagi dan dilakukun pemutaran dengan alat sentrifusa dengan kecepatan 3500 rpm selama dua puluh menit. Pencucian dilanjutkan yaitu dengan memasukkan NaCl 0,9% dan 1mM EDTA kedalam tabung dan dilakukan pemutaran kembali dengan alat sentrifusa dengan kecepatan 3500 rpm selama sepuluh menit. Sel darah putih yang sudah dicuci diambil sebanyak 1ml dan dimasukkan kedalam tabung baru, kemudia kedalam tabung tersebut ditambahkan 350 µl 10% SDS. Campuran ini dikocok pelan-pelan selama dua jam pada suhu 55 ºC. DNA dimurnikan dengan metode fenol-klorofom, yaitu dengan menambahkan 40 µl 5 M NaCl dan 400 µl fenol dan klorofom iso amil alkohol (24:1), kemudian diputar perlahan di suhu 27 ºC dengan kecepatan 500 rpm selama dua jam dan dilanjutkan dengan diputar dengan kecepatan 7000 rpm selama 5 menit yang akan menghasilkan supernatan
dengan urutan dari bagian atas adalah DNA, protin dan fenol. DNA dipindahkan kedalam tabung baru dengan menggunakan pipet eppendorf dan ditambahkan 40 µl 5 M NaCl dan 800 µl etanol absolut yang berfungsi untuk mengendapkan DNA kemudian diinkubasi selama semalam minimal tiga jam pada suhu -20 ºC. Endapan yang dihasilkan dilakukan pencucian dengan menambahkan 400 µl, 70% etanol kemudian diputar dengan kecepatan 8000 rpm selama 5 menit, kemudian etanol dibuang dan diuapakan dengan menggunakan pompa vakum. DNA kemudian dilarutkan dengan 100 µl 80%, buffer TE.
4. Amplifikasi DNA Mikrosatelit dengan Teknik
Polymerase Chain Reaction (PCR)
Reaksi PCR dilakukan menurut metode sambrook et al. (1989) yang telah dimodifikasi yaitu melakukan pencampuran yang merata 100 ng/µl DNA 1,5 µl cetakan dengan campuran 1,5 ml 10 × PCR Gold buffer 1,25 µl; 25 Mm MgCl2 1 µl, 2 Mm Dntp 1 µl, 0,43 µl pasangan prmer 0,5 µl U/ µl enzim tag polimerase 0,6 µl dan air steril sampai volume tabung PCR 12,5 µl. Kemudian tabung PCR ini diinkubasi. Suhu annealing yang dipergunakan menurut bishop et al . (1994), sedangkan prosedur inkubasi pada mesin thermocycler (TaKaRa PCR Thermal Cycler MP4) diprogram menurut metode sumbrook et al. (1989) yang telah dimodifikasi (Gambar 2) dan dijadikan metode khusus yang biasa dipergunakan di Labolatorium Zoologi, Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor dengan prosedur sebagai berikut:
a) Tahap I : denaturasi awal pada suhu 94ºC selama 5 menit
b) Tahap II : 30 kali siklus yang tiap siklusnya terdiri atas :
Denaturasi pada suhu 94ºC selama 55 detik
Penempelan primer pada suhu 58ºC selama 1 menit, Pemanjangan molekul DNA pada suhu 72ºC selama 1 menit 10 detik;
c) Tahap III : pemanjangan akhir molekul DNA pada suhu 72ºC selama sepuluh menit.
JURNAL TERNAK Vol. 01 No.01 Th.2010
4
5. Prosedur Elektroforesis
DNA mikrosatelit produk PCR dipisahkan dngan teknik elektroforesis gel poliakrialimida 8% yang dilajutkan dengan pewarnaan perak. Sebanyak 2 µl produk PCR dicampur dengan Loading dye (Bromthymol blue 0,01%,Xylene Cyanol 0,01% dan gliserol 50%). Elektroforesis dilakukan selama 100 menit pada tegangan konstan 165 volt atu sampai pewarnaan Bromthymol blue mencapai bagian bawah gel. Gel dipindahkan dalam nampan larutan pewarna perak. 6. Pewarnaan Perak
Pewarnaan dilakukan dengan metode pewarnaan perak (silver staining) menurut Togelstrom (1992). Metode ini secara singkat dapat dijelaskan sebagai berikut: gel dimasukkan kedalam larutan buffer CTAB 0,2 gram /200 ml air destilata selama 8 menit sambil digoyang menggunakan water-bath shaker (Gambar 3). Setelah larutan dibuang dicuci dengan air destilata (DW) Selama 2×2 menit. Air tersebut dibuang dan ditambahkan larutan NHOH (2,4 ml NH4OH/200 ml air destilata) selama 6 menit sambil digoyang. Larutan yang ditambah tersebut dibuang dan kemudian ditambahkan larutan perak nitrat (AgNO3) yang merupakan larutan yang terdiri dari 0,32 g AgNO3; 0,08 ml NaOh 10 N; 0,8 ml NH4OH dalam 200 ml air destilata selama 10 menit dan digoyang. Kemudian gel dicuci kembali dengan air destilata selama 2×2 menit setelah larutan sebelumnya di buang. Untuk memunculkan pita, gel direndam dalam larutan yang terdiri dari 4 g Na2CO3 dan 0,1 ml formaldehid dalam 200 ml air destilata. Setelah pita muncul, larutan asam asetat glasial 1% dalam 200 ml air destilata dimasukkan untuk menghentikan reduksi perak, selanjutnya gel dapat dipindahkan ke plastik mika kemudian bisa dipres dengan alat pengepres (chiller) (Gambar 4)
7. Metode Pendeteksian Polimorfisme
Dari hasil elektroforesis akan diketahui polimorfisme dari alel-alel yang tampak sehingga dapat ditentukan panjang DNA mikrosatelit masing-masing ternak domba yaitu dengan cara pita-pita DNA yang mencul diatas gel poliakrialimida dianggap sebagai alel dan bersifat kodominan, yaitu kedua alel bisa muncul bersamaan. Jika ada dua pita maka heterozigot dan jika ada satu pita maka homozigot. Untuk memudahkan skoring pita yang lebih dekat ke sisi positif (sisis bawah sumur) diberi sandi A dan selanjutnya B, C, dan seterusnya. Asumsi yang mendukung yaitu semua pita yang memiliki laju sama merupakan alel yang homolog (Nei, 1987). Jika peta DNA ganda menunjukkan bahwa alel tersebut heterozigot dan pita DNA tunggal adalah homozigot.
Analisis Data
Frekuensi masing-masing alel setiap lokus mikro satelit dihitung berdasarkan rumus Nei (1987) :
Xi = (2nij + ∑nij) / (2N) Keterangan : j ≠ 1
Xi = fkuensi alel ke-i
nij = jumlah individu untuk genotip AiAj nii = jumlah individu utuk genotip AiAi n = jumlah alel
N = Jumlah sampel
Dengan asumsi bahwa semua genotipe lokus-lokus mikrosatelit bersifat kodominan.
Derajat heterozigositas (ĥ) dihitung berdasarkan frekuensi alel pada tiap lokus DNA mikrosatelit dengan rumus Nei (1987) sebagai berikut :
ĥ = 2n (1-∑xi²) / (2n-1) Keterangan :
xi = frekuensi alel lokus ke-i n = jumlah alel
ĥ = heterozigositas lokus
Ragam heterozigositas (Vsl(ĥ)) diantara individu dalam satu kesatuan frekuensi alel poulasi pada tiap okus DNA mikrosatelit dapat dihtung dengan rumus sebagai berikut :
Vsl(ĥ) = 2 {2(2n-2){∑xi³-(∑xi²)²}+∑xi²-(∑xi²)²} 2n(2n-1)
JURNAL TERNAK Vol. 01 No.01 Th.2010
5
Dan standar error (SE) diperoleh dari akar ragam heterozigositas.
Rataan heterozigositas (Ĥ) dari semua lokus DNA mikrosatelit yang diuji (r) dihitung dengan rumus sebagai berikut :
Ĥ = ∑ ĥj / r
Keterangan : ĥj = derajat heterozigositas untuk lokus ke-i
r = jumlah lokus yang diuji Ĥ = rataan heterozigositas
Respon tipe kelahiran, berat lahir dan berat sapih terhadap genotip masing-masing individu pada tiap lokus mikrosatelit ditunjukkan melalui analisis ragam RAL
dengan prosedur GLM (General Linear Model). Masing-masing lokus mikrosatelit merupakan variabel bebas, sedangkan tipe kelahiran, berat lahir dan berat sapih adalah variabel terikat sebagai respon terhadap genotip individu pada tiap lokus mikrosatelit tersebut. Model analisis ragam untuk RAL (Gaspersz, 1991) diabstraksikan sebagai berikut :
Yij = µ + τi + ɛij Dimana : µ = nilai tengah populasi
τi = pengaruh genotip terhadap tipe kelahiran, berat lahir dan bobot sapih
ɛij = pengaruh galat percobaan
HASIL DAN PEMBAHASAN Amplifikasi DNA Mikrosatelit
Sampel yang digunakan dalam penelitian ini adalah 96 ekor domba komposit Sumatra (Sumatra x Barbados Blackbelly x St. Croix) yang berada di Stasiun Percobaan Balai Penelitian Ternak, Cilebut, Bogor, dengan tahun kelahiran antara tahun 2002-2003 yang merupakan domba lepas sapih. Dari 96 sampel darah yang diambil, hanya diguakan 93 sampel karena terdapat tiga sampel darah domba Barbados Cross. Jumlah sampel yang berhasil diamplifikasi menggunakan primer BM415 adalah 66 sampel (70,09%). Terdapat 27 sampel untuk primer BM4621 yang tidak teramplifikasi, hal ini dimungkinkan primer tersebut tidak dapat menempel pada daerah komplemennya atau juga bisa disebabkan pencampuran bahan PCR yang kurang sempurna. Kondisi suhu penempelan (annealing) juga sangat menentukan baik tidaknya proses amplifikasi. Suhu
annealing yang tepat dapat ditentukan setelah dilakukan
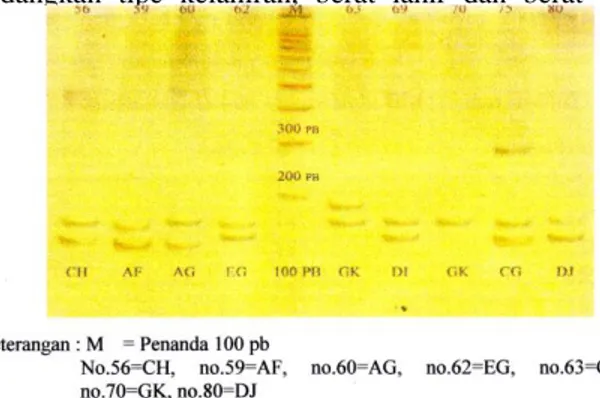
proses PCR optimasi. Suhu annealing untuk primer BM415 adalah sebesar 53ºC dan suhu annealing untuk primer BM4621 adalah sebesar 52ºC. Pola pita DNA mikrosatelit pada lokus BM415 dan lokus BM4621 disajikan pada Gambar 5 dan Gambar 6.
Pada lokus BM415 semua sampel adalah sampel heterozigot (Gambar 4) . Pada lokus BM4621, semua sampel yang terdapat pada Gambar 5 memilik dua pita (heterozigot) pada masing-masing sampel. Individu mempuyai dua pita menunjukkan individu tersebut mewarisi satu pita dari induk dan satu pita dari bapak, sedangkan individu yang homozigot mewarisi pita yang sama dari induk maupun dari bapak. Pita target dapat terlihat setelah dilakukan proses pewarnaan perak (silver
staining) pada gel acrylamide. Pada kedua lokus
mikrosatelit BM415 dan BM4621 selain pita target terdapat pula pita tambahan yang terlihat diatas atau dibawah pita target dengan menggunakan bantuan penanda 100 pb. Munculnya pita tambahan ini kemungkinan disebabkan oleh adanya utas DNA yang terpeleset ketika dilakukan perbaikan terhadap kesalahan basa, terjadi pengurangan atau penambahan jumlah motif ulangan atau unit runutan mikrosatelit tersebut (Muladno, 1994). Fikri (2002) menyatakan bahwa faktor penggunaan suhu annealing dari primer yang masih belum sesuai untuk mengamplifikasi pita target, dapat juga menyebabkan munculnya pita tambahan. Pita target dari kedua lokus mikrosatelit BM415 dan BM4621 kemudian diukur panjangnya. Perbedaan alel dari tiap individu (contoh, pita target yang panjangnya 137 pb beralel A, sedangkan pita targer yang panjangnya 145 pb beralel B, dan seterusnya). Ukuran alel mikrosatelit BM415 dan BM4621 dapat dilihat pada Tabel 2.
Tabel 3. Ukuran Alel Lokus Mikrosatelit BM415 dan BM4621
Jenis Alel Lokus BM415 (pb) Lokus BM4621 (pb)
A B C D E F G 137 145 153 158 163 166 168 144 147 150 153 156 166 169
JURNAL TERNAK Vol. 01 No.01 Th.2010
6
H I J K 174 179 - - 172 175 178 191Ukuran alel lokus BM415 berkisar antara 137-179 pb dan lokus BM4621 ukuran alelnya berkisar antara 144-191 pb. Keragaman ukuran alel tersebut diduga disebabkan adanya perbedaan jumlah salinan motif, silang dalam dan silang luar serta genetik drift dapat menyebakan terjadinya keragaman tersebut (Goldstein dan Pollock, 1997). Sedangkan menurut Moxon dan Will (1999), keragaman mikrosatelit diduga disebabkan oleh rekombinasi tidak seimbang saat replikasi DNA yang berakibat pada penarikan dan pengurangan jumlah nukleotida. Perbedaan ukuran DNA mikrosatelit pada masing-masing lokus mengakibatkan adanya keragaman.
Keragaman Alel Mikrosatelit
Hasil pewarnaan perak menunjukkan jumlah alel yang dihasilkan dari proses PCR beragam. Hasil analisa menunjukkan lokus mikosatelit BM4621 lebih beragam dibanding lokus BM415. Pada lokus BM4621 didapatkan 11 alel sedangkan lokus BM415 ditemukan 9 alel. Fikri (2002) menyatakan, bahwa jumlah alel yang muncul tidak hanya dipengarui oleh jumlah sampel yang digunakan, tetapi juga dipengaruhi oleh bangsa dan sistem perkawinan yang dilakukan. Lokus BM415 menghasilkan 9 macam alel. Ukuran alel terendah adalah sebesar 137 pb, sedangkan yang tertinggi sebesar 179 pb. Hasil ini berbeda dengan yang ditemukan oleh USDA (2004) yang menemukan 6 alel pada lokus ini pada ternak sapi. Hasil yang berbeda ini dimungkinkan terjadi karena adanya rekombinasi yang tidak seimbang saat replikasi DNA yang berakibat pada penarikan dan pengurangan jumlah nukleotida (Moxon dan Will, 1999) dan jenis ternak yang digunakan. Kesembilan alel tersebut diberi tanda abjad A hingga I sesuai dengan ukuran alelnya (Tabel 3). Frekuensi masing-masing alel untuk lokus BM415 disajkan pada Tabel 4.
Tabel 4. Frekuensi Alel, Jumlah Alel dan Frekuensi Genotip pada Lokus BM415 dan BM4621
Lokus Sampel Terampili fikasi Jumlah dan Frekuensi Genotip (%) Jumlah Alel Frekuensi Alel (%) BM415 66 AA = 1 (1,52%) AB = 2 (3,03%) AC = 9 (13,64) AG = 1 (1,52%) BB = 1 (1,52%) BC = 4 (6,06%) BD = 5 (7,58%) BE = 14 (21,21%) DI = 7 (10,61%) EI = 15 (22,73%) FH = 7 (10,61%) 10 A = 9,85 B = 20,45 C = 9,85 D = 9,09 E = 21,97 F = 5,30 G = 0,76 H = 5,30 I = 16,67 BM4621 88 AB = 1 (1,14%) AF = 6 (6,82%) AG = 7 (7,95%) BE = 10 (11,36%) CG = 7 (7,95%) CH = 10 (11,36%) 11 A = 7,95 B = 6,25 C = 9,66 D = 13,64 E = 10,23 F = 3,98 DI = 15 (17,05%) DJ = 9 (10,23%) EF = 1 (1,14%) EG = 7 (7,95%) GK = 15 (17,05%) G = 20,45 H = 5,68 I = 8,52 J = 5,11 K = 8,52
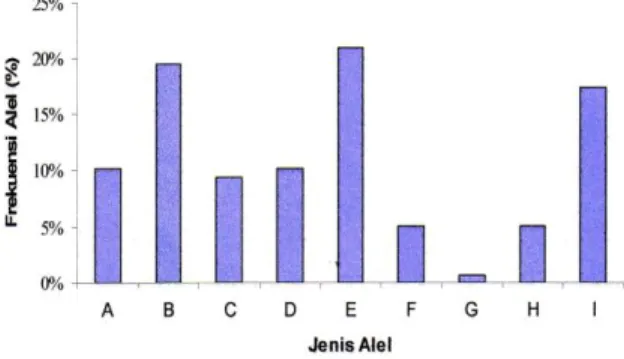
Hasil yang ditunjukkan oleh Tabel 4 menunjukkan bahwa alel E dan alel B cenderung mendominasi alel lainnya, yang berarti bahwa kemungkinan tertua dari domba trsebut beralel E dan B. Hal tersebut menjadikan mikrosatelit dapat digunakan sebagai perinci yang akurat untuk menguji hubungan kekerabatan antar indiviu dalam populasi, maupun untuk pemeriksaan asal-usul keturunan. Distribusi frekuensi alel pada lokus BM415 (n = 66) disajikan pada Gambar 7.
Genotip yang dapat dideteksi pada lkus BM415 ada 11 macam genotip, yaitu AA, AB, AC, AG, BB, BC, BD, BE, DI, EI, dan FH. Frekuensi masing-masing genotip dari yang tertinggi sampai yang terendah adalah 22,06% (EI), 20,59% (BE), 13,24% (AC dan DI), 10,29% (FH), 7,35% (BD), 5,88% (BC), 2,94% (AB), dan 1,47% (AA, AG dan BB) (Tabel 4). Genotip EI merupakan genotip dengan frekuensi tertinggi. Hal tersebut berarti bahwa sebagian besar domba komposit sumatra yang dianalisa bergenotip EI (berasal dari tertua yang beralel E dan I). Sampel yang dapat diamplifikikasi pada lokus BM4621 menghasilkan 11 alel, Ukuran alel terendah berukuran 144 pb diberi tanda abjad A dan ukuran alel tertinggi berukuran 191 pb diberi tanda abjad K (Tabel 4). Hasil ini berbeda dengan yang ditemukan oleh USDA (2004) yang menemukan 10 alel pada lokus BM4621 dengan ukuran alel minimum 135 pb dan maksimum 157 pb pada ternak sapi. Perbedaan hasil yang didapat dari penelitian ini dengan penelitian sebelumnya dimungkinkan terjadi karena adanya perbedaan jumlah salinan motif, selain itu terjadinya pergeseran DNA dan faktor mutasi (Goldstein dan polock, 1997) dan juga perbedaan jenis ternak yang digunakan sebagai sampel. Jenis dan frekuensi alel serta jenis genetip lokus BM4621 disajikan pada Tabel 4.
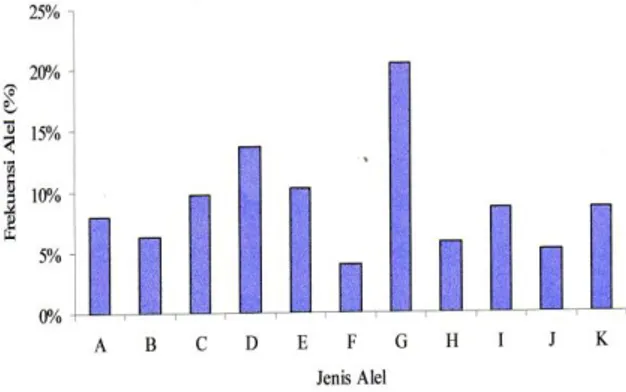
Tabel 4 menunjukkan bahwa frekuensi alel tertinggi pada lokus bm4621 adalah alel G, yaitu sebesar 20,45%
JURNAL TERNAK Vol. 01 No.01 Th.2010
7
dan frekuensi alel terendah adalah alel F sebesar 3,98% (Gambar 7).
Gambar 8 menunjukkan bahwa alel G cenderung mendominasi pada lokus BM4621. Hal ini menandakan bahwa sebagian besar domba komposit sumatra yang dianalisa berasal dari tertua yang beralel G pada lokus BM4621. Jenis genotip yang terdapat pada lokus BM4621 ada 11 macam, yaitu AA, AB, AF, AG, BE, CG, CH, DI, DJ, EF, EG dan Gk. Frekuensi masing-masing genotip dari yang tertinggi sampai yang terendah adalah 17,05% (DI dan GK 11,36% (BE dan CH), 10,23% (DJ), 7,95% (AG, CG dan EG), 6,82% (AF), 1,14% (AB dan EF) (Tabel 4). Genetip DI dan GK merupakan genotip dengan frekuensi tertinggi yaitu sebesar 17,05%. Hal ini berarti sebagian besar dombah komposit Sumatra yang dianalisa bergenotip DI dan GK (berasal dari tetua yang beralel D, I, G dan K).
Nilai Heterozigositas dan Rataan Heterozigositas
Heterozigositas merupakan ukuran keragaman genetik hewan di dalam populasi yang dihitung berdasarkan frekuensi alel pada setiap lokus. Nilai heterozigositas dan rataan heterozigositas pada lokus BM415 dan BM4621 beradasarkan jumlah sampel yang digunakan ditampilkan pada Tabel 5.
Tabel 5. Heterozigositas (ĥ) dan Rataan Heterozigositas (Ĥ) Lokus BM415 dan BM4621
Lokus ĥ + Standar error Jumlah Alel
BM415 BM4621 0,851437 0,892905 + + 0,0313 0,0256 9 11 Ĥ 0,872171 + 0,02845
Lokus BM415 memiliki nilai heterozigositas 0,851437 dan lokus BM4621 memiliki nilai heterozigositas
0,892905. Menurut Bishop et al (1994) nilai heterozigositas lokus BM415 pada ternak sapi sebesar 0,46 dan pada lokus BM4621 sebesar 0,73. Perbedaan nilai heterozigositas ini bisa disebabkan jenis dan jumlah ternak yang digunakan sebagai sampel (Fikri, 2002). Hasil ini sesuai dengan yang dilaporkan oleh Crawford
et al (1995), bahwa keanekaragaman genetik domba
lebih besar daripada sapi. Menurut Nei (1997) nilai heterozigositas ditentukan oleh jumlah sampel, jumlah dan frekuensi alel. Hal ini sesuai dengan hasil penelitian, bahwa nilai heterozigositas pada lokus BM4621 lebih besar daripada lokus BM415 karena jumlah sampel yang diamplifikasi, jumlah dan frekuensi alel pada lokus BM4621 lebih besar daripada lokus BM415. Hal ini didukung pula oleh hasil penelitian Prahasta (2001) yang menyebutkan bahwa semakin banyak jumlah alel yang terdeteksi pada suatu lokus semakin besar pula nilai heterozigositas yang di dapat.
Menurut Nei (1987) dibutuhkan minimal 20-30 sampel pada satu lokus untuk menduga rataan heterozigositas. Pada penelitian ini menggunakan 93 sampel untuk setiap lokus, dengan jumlah sampel ini bisa digunakan untuk menduga rataan heterozigositas. Rataan heterozigositas untuk lokus BM415 dan BM4621 adalah sekitar 0,872171. Besarnya nilai heterozigositas dan rataan heterozigositas dari kedua lokus mengindikasikan bahwa sifat-sifat yang dimiliki domba komposit Sumatra ini masih sangat beragam, baik sifat yang unggul maupun yang jelek, sehingga masih berkemungkinan besar untuk dilakukan program seleksi sebagai tahap pemantapan performa produksi domba ini. Nilai heterozigositas dan rataan heterozigositas yang besar ini dapat di jadikan langkah awal untuk melakukan program pemuliaan dengan menggunakan mikrosatelit BM415 dan BM4621 sebagai penanda untuk melakukan program seleksi.
Hubungan Genotip dengan Tipe Kelahiran, Berat Lahir dan Bobot Sapih
Respon tipe kelahiran,berat lahir dan bobot sapih terhadap genotip masing-masing individu pada tiap lokus mikrosatelit ditunjukkan melalui analisis ragam dengan menggunakan prosedur GLM. Hasil analisa statistik pada masing-masing individu tidak mempunyai perbedaan yang signifikan (P>0,05) terhadap tipe kelahiran,berat lahir dan bobot sapih. Hal ini menunjukkan bahwa genotip tidak berhubungan dengan tipe kelahiran,berat lahir dan bobot sapih pada kedua lokus yang digunakan. Berarti pula bahwa lokus BM415 dan BM4621 yang terletak di kromosom 6 tidak dapat digunakan sebagai penanda (marker) khusus sifat kuantitatif (QTL = Quantitative Trait Loci) pada domba komposit, yaitu terkait untuk sifat produksi susu seperti yang diduga sebelumnya. Hasil yang berbeda ditemukan oleh Ashwell et al. (1998), yang menyatakan bahwa lokus BM415 di kromosom 6 dapat digunakan sebagai
JURNAL TERNAK Vol. 01 No.01 Th.2010
8
penanda untuk sifat produksi susu khususnya presentase protein dan lemak pada sapi FH Amerika. Sedangkan lokus BM4621 di gunakan sebagai penanda untuk menganalisa hubungan filogenetik pada berbagai jenis domba Spanyol (Arranz et al., 2001).
Hasil penelitian ini menunjukkan bahwa genotip masing-masing individu tidak berhubungan dengan tipe kelahiran, berat lahir dan bobot sapih (P>0,05) pada lokus BM415 maupun BM4621. Hal ini berarti masih perlu banyak dilakukan penelitian lanjutan dengan menggunakan lebih banyak lokus dan kromosom yang lain untuk mendeteksi adanya lokus yang dapat digunakan sebagai penanda sifat kuantitatif, seperti sifat produksi susu, kualitas karkas dan sifat yang lain.
KESIMPULAN
Pada lokus BM415, teramplifikasi 66 sampel dari 93 sampel, terdapat sebelas genotip dan sembilan alel dengan ukuran 137-179 pb yang didominasi oleh genotip EI (22,06%) dan alel E (21,01%). Pada lokus BM4621, teramplifikasi 88 sampel dari 93 sampel, terdapat sebela geotip dan sebelas alel ukuran 144-191 pbyang didominasi oleh genotip DI dan GK (17,05%) dan alel G (20,45%). Populasi domba komposit di Stasiun Percobaan Cilebut, Balai Peternakan Bogor memiliki nilai heterozigositas 0,851437 untuk lokus BM415 dan 0,892905 untuk lokus BM4621 dengan rataan heterozigositas 0,81217. Genotip masing-masing individu tidak mempunyai hubungan (p>0,05) dengan tipe kelahiran, berat lahir dan bobot sapih pada lokus BM415 dan BM4621.
Perlu dilakukan penelitian lanjutan dengan menggunakan lebih banyak lokus dan ternak pada kromosom yang lain untuk mendeteksi adanya lokus yang dapat digunakan sebagai penanda sifat kuantitatif, seperti sifat produksi susu, kualitas karkas dan sifat menguntungkan yang lain.
REFERENSI
Arranz, J.J., Y. Bayon , F. San Primitivo. 2001. Genetic
variation at mikrosatellite loci in Spanish Sheep. Small Ruminant J. 39 : 3-10.
Ashwell, M.S., Y Da, C.P Van Tassel, P.M Vanraden, R.H. Miller, C.E. Jr. Rexroad. 1998. Detection of putatife loci affecting milk production and composition health and type traits in a United States Holstein population. Dairy Sci. J. 81 : 3309-3314
Bennet, P.2000. Microsatellites. J. Clin Pathol. 53: 177-183.
Bishop, M.D.,S.M. Kappes, J.W. Keele, R.T. Stone, S.I.F. Sunden, G.A. Hawkinds, S. Tolodo, R. Fries, M.D. Grosz, J. Yoo, and C.W. Beattie. 1994. A genetic linkage map for cattle. Genetics 136, 619-639.
Badan Pusat Statistic Nasional. 2001. Populasi berbagai Jenis Ternak di Indonesia. http:/www.bps.go.id/sector.agri/ternak/tabel 3.shtml. [22 Agustus 2005].
Broad, T.E., H. Hayes dan S.E. Long. 1997. Cytogenetics: Physical chromosome maps. In “The Genetic of Sheep”. (Eds. L.R. Piper dan A. Ruvinsky) pp. CAB International, London.Ciampolini, R., K.M Goudarzi, D.Vaaiman, C. Dillman, E. Mzzanti, Jean Louis Foulley, H. Leveziel and D. Cianci. 1995. Individual multilocus genotypes using mikrosatellitic polymorphisme to permit the annalisis of genetics variability within and between Italian beef cattele breeds. Journal Animal Scienci. 73:3259-3268.
Crawford, A.M, K.G. Dodds, A.J. Ede, C.A. Piersion, G.W. Montgomery, H.G. Garmonsway, A.E. Beattie, K. Davies, J.F. Maddox, S.W. Kappes. 1995. An autosmal genetic linkage map of the sheep genome. Genetics. 140: 703-724.
Departemen Pertanian. 2002. Badan Penelitian dan Pengembangan Pertanian. http://www.ltbang.deptan.go.id. [2 Agustus 2005].
Devendra, C.and G.B. Mclory. 1982. Goat and Sheep Production in The Tropics. 1st Edit. Oxford University Prees , Oxford.
Fikri, M.2002. Variasi alel DNA mikrosatelit BM143 dan BM888 brdasarkan nilai pemulaian tertaksir pada sapi Fries Holand (FH) di BPT HMT baturraden. Skripsi. Fakultas Peternakan, Institut Prtanian Bogor, Bogor.
Fletcher, I. C., B. Gunawan , D.J.S. Hetzel, Bakrie, N.G. Yates and T.D. Chaniago. 1985. Comparison of lambs production from indegonus and axcotic x indogenus awea in Indonesia. Tropical Animal Health. 17:127-134.
Gasperz, V. 1991. Metode Perancangan Percobaan. Penerbit Armico Bandung.
Gatenby, R. M., M. Doloksaribu, G.E. Bradford, E. Romjali, A.Batubara dan I. Mirza. 1997. Comparisson of Sumatra sheep ang three Hair sheep croosbreds. II. Reproductive performances of f1 ewes. Small Rumminant Research 25 (1997) : 161-167.
JURNAL TERNAK Vol. 01 No.01 Th.2010
9
Goldstein, D.B., R. Linnares, L.L C-Sforza and M.W. Feldman. 1995. An evaluation of genetic distances for use with mikrosatellite loci. Genetics. 139: 463-471.
Golstein, D.B. and D.D. Pollock. 1997. Launcing Mikrosatellite : A rivew of mutation processes and metoes of phylogenetic inferent. Journal of Heredity. 88 : 35-342.
Hutagalung, R.1995. Penampilan domba Jantan ai Sumatra Utara dengan menggunakan rangsum yang terdiri dari paspalium dilatium, molasses dan urea dengan tiga macam sumbe mineral. Skripsi, fakultas . Peternakan. Institut Peternakan Bogor. Iniguestz, L., E.G. Bradford and I. Innou. 1990. Sheep
breddin plan for intergladet tree crooing and sheep production system. Dalam : Iniguest L. and M. D. Sanchesz (Ed.). Sheep Breeding Plans For Integraded Tree Croppin and small Rumminant Production System. Pp : 155-171. Procceding of a workshop on Research Support Program. Annual Repport 1990-1991 . 5:303-317.
Lehmann, T., W.A Hawley and F.H. Collins. 1996. An evaluation of evaluationary constraints of mikrosatellite loci using nul alleles Genetics. 144: 1155-1163.
Maskur. 2001. Mikrosatelit sebagai Penanda Molekur dalam Analisis Genom. Tesis Fakultas Peternakan. Institut Pertanian Bogor, Bogor. Maso, I.L.1980. White Virgin island sheep. Dalam :
Mason I. L. (ED.). Polific Tropical Sheep. Pp. 29-30. FAO Animal Production and Health Paper. National. Roma.
Merkens dan soemiat. 1962. Sumbangan Pengetahuan tentang Peternakan di Indonesia. Domba dan K ambing. Terjemahan : R.P. Utojo dan S.Adisoemarto. Lembaga ilmu pengetahuan Indonesia, Jakarta.
Minvielle, F., B.B. Kayang, M. Miw, A. Vignal, D.Gouricon, A. Neau .j.l.Monvoisin, S. Ito.2005. Microsattelite mapping of QTL affecting growth, egg production, toic immobility and body temperature of Japanese quail. BMC Genomics J. 6.6:81-86.
Moxon, E.R. and C. Wills. 1999. DNA Mikrosatellites: Agest of Evalution? Scientific American. USA. Muladno. 1994. DNA Markr for pig gane mapping . A
thesis submitted to faculty of Ariculture in fulfilment of the requinment for the degree of
doctor of Philosopy. The University of Sydney,
Australia. 201 p.
Muladno. 2000. Teknologi Manipulasi DNA. Fakultas Peternakan. Institut Pertanian Bogor, Bogor. Nei, M. 1987. Molecular Evolutionery Genetics.
Columbia University Pres, New York.
Prahasta, P. 2001. Derajat Heterozigositas DNA Mikrosatelit pada populasi Sapi Fries holland (FH). Fakultas Peernakan Institut Pertanian Bogor, Bogor.