ANALISIS KUALITATIF KANDUNGAN KIMIA
TUMBUHAN TEMBELEKAN (
Lantana camara
L.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh: Novita Cahyadi NIM: 048114137
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
ii
ANALISIS KUALITATIF KANDUNGAN KIMIA
TUMBUHAN TEMBELEKAN (
Lantana camara
L.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh: Novita Cahyadi NIM: 048114137
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
v
H
ALA
M
A
N
P
E
R
S
E
M
B
A
H
A
N
Everyday in our life is a
wonderful day if we learn to
thanks GOD for what HE has given us....
The key to happiness is having
dreams; the key to success is making them come true…
TUHAN TIDAK BERJANJI
LANGIT SELALU BIRU
BUNGA DI SEPANJANG JALANMU LAUTAN TANPA GELOMBANG
TAPI . . .
IA BERJANJI
BESERTA KITA MENDAMPINGI KITA
DALAM SEGALA KEADAAN!!!
Kupersembahkan karya kecilku ini teruntuk:
JESUS- MY SAVIOR
Bunda MARIA
Papah
dan
Mamah tercinta
OH Arief
dan
Andri
vi
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH
UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya Mahasiswa Universitas Sanata Dharma :
Nama : Novita Cahyadi Nomor Mahasiswa : 048114137
Demi pengembangan ilmu pengetahuan, saya memberikan kepada perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul : Analisis Kualitatif Kandungan Kimia Tumbuhan Tembelekan (Lantana camara L.) beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memerikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal 29 Mei 2008
Yang menyatakan
vii
PRAKATA
Puji dan syukur penulis haturkan kepada Tuhan Yang Maha Esa yang telah melimpahkan rahmat dan berkatnya untuk menyelesaikan penelitian dan penulisan skripsi yang berjudul analisis kualitatif kandungan kimia tumbuhan tembelekan (Lantana camara L.). Penelitian ini dilakukan untuk memenuhi salah satu syarat tugas akhir untuk mencapai gelar sarjana ilmu Farmasi bidang studi Farmasi Universitas Sanata Dharma Yogyakarta.
Penulis telah banyak mendapat bantuan baik moral maupun spiritual dan dukungan yang berupa bimbingan, dorongan, sarana, maupun fasilitas dari berbagai pihak dalam penulisan skripsi ini, oleh karena itu penulis ingin mengucapkan terima kasih kepada:
1. Ibu Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Ibu Yustina Sri Hartini, M.Si., Apt. selaku dosen pembimbing atas bimbingan dan pengarahan selama penelitian sampai penyusunan skripsi.
3. Bapak Yohanes Dwiatmaka, M.Si. selaku dosen pembimbing atas bimbingan dan pengarahan selama penelitian sampai penyusunan skripsi.
4. Ibu Erna Tri Wulandari, M.Si., Apt. selaku dosen penguji yang telah memberikan masukan dan saran dalam penyusunan skripsi ini.
viii
6. Papah dan Mamah, Oh Arief serta Andri atas cinta, pengorbanan, dukungan, semangat, dan doa nya yang tak pernah berhenti.
7. Mas Wagiran, Mas Sigit, Mas Sarwanto selaku staf laboratorium Farmakognosi Fitokimia . Terima kasih atas bantuan yang diberikan.
8. Nike, Chika, Apri, Lala, Yasinta, sahabat dalam berbagi suka dan duka. 9. Lia, Lanny, diAnink, Mellissa, Indah, Renny, Nike, Yohana, ci Meta, ci Listy,
ci Ricka, ci Maria, Chika, Selvi, Ratih, Wiwit, dan teman-teman kost DEWI lainnya. Terima kasih atas kebersamaan dan kekompakkannya selama ini. 10.Mas Wondo, Lia, Apri. Terima kasih atas kerja sama dan bantuannya selama
penelitian.
11.Andrew. Terima kasih atas bantuannya selama penelitian, dukungan serta doanya yang telah diberikan selama ini.
12.Teman-teman angkatan 2004, khususnya kelas C dan FKK. Terima kasih atas kebersamaan dan kerja samanya selama ini.
13.Pihak lain yang tidak dapat disebutkan satu persatu oleh penulis.
Penulis menyadari masih ada kekurangan dalam penyusunan skripsi ini, maka penulis sangat mengharapkan saran dan kritik yang membangun dari berbagai pihak demi kemajuan dan kesempurnaan penelitian yang telah dilakukan. Semoga skripsi ini memberikan manfaat bagi kita semua.
Yogyakarta, 1 April 2008
ix
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah. Sejauh penelusuran pustaka yang telah saya lakukan, tidak ditemukan hasil penelitian mengenai analisis kualitatif kandungan kimia tumbuhan tembelekan (Lantana camara L.).
Yogyakarta, 1 April 2008
Penulis,
x
DAFTAR ISI
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
PERNYATAAN KEASLIAN KARYA ... vi
KATA PENGANTAR ... vii
DAFTAR ISI ... ix
DAFTAR TABEL……….xiii
DAFTAR GAMBAR………xiv
DAFTAR LAMPIRAN……….xv
DAFTAR SINGKATAN DAN LAMBANG………...xvi
INTISARI……….………..………xviii
ABSTRACT………xix
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
xi
2. Keaslian penelitian ... 3
3. Manfaat penelitian ... 3
B. Tujuan Penelitian ... 3
BAB II. PENELAAHAN PUSTAKA... 4
A. Pemeriksaan kandungan Tanaman ... 4
B. Tumbuhan Tembelekan ... 4
1. Keterangan botani ... 4
2. Nama daerah... 4
3. Deskripsi tumbuhan ... 5
4. Kandungan kimia ... 5
5. Kegunaan... 6
C. Pengeringan ... 6
1. Pengeringan alamiah ... 6
2. Pengeringan buatan ... 7
D. Analisis kualitatif kandungan kimia... 7
E. Uraian Tentang Kandungan Kimiawi ... 8
1. Alkaloid ... 8
2. Flavonoid ... 9
3. Tanin ... 11
4. Antrakinon ... 12
5. Saponin ... 14
6. Glikosida Jantung ... 14
xii
G. Keterangan Empiris...17
BAB III. METODE PENELITIAN... 18
A. Jenis dan Rancangan Penelitian ... 18
B. Variabel Penelitian dan Definisi ... 18
1. Variabel penelitian ... 18
2. Definisi operasional ... 18
C. Bahan Penelitian... 20
1. Bahan utama ... 20
2. Bahan kimia ... 20
D. Alat atau Instrumen Penelitian ... 21
E. Tata Cara Penelitian ... 21
1. Determinasi tumbuhan tembelekan ... 21
2. Penyiapan bahan... 21
3. Uji identifikasi kimiawi... 22
4. Uji tabung ... 23
5. Uji KLT ... 26
F. Analisis Hasil ... 29
BAB IV. HASIL DAN PEMBAHASAN ... 30
A. Determinasi Tumbuhan ... 30
B. Pengumpulan dan Pengeringan Organ serta Pembuatan Serbuk ... 30
C. Identifikasi Kimiawi Tumbuhan Tembelekan ... 32
D. Uji Tabung Tumbuhan Tembelekan ... 35
xiii
F. Uji Kualitatif Tumbuhan Tembelekan dengan KLT ... 41
1. Identifikasi antrakinon ... 43
2. Identifikasi saponin ... 47
3. Identifikasi tanin... 51
4. Identifikasi kardenolida ... 54
5. Identifikasi flavonoida ... 57
BAB V. KESIMPULAN DAN SARAN ... 62
A. Kesimpulan ... 62
B. Saran ... 62
DAFTAR PUSTAKA ... 63
LAMPIRAN ... 65
xiv
DAFTAR TABEL
Tabel I Hasil identifikasi kimiawi tumbuhan tembelekan ... 32
Tabel II Hasil uji tabung tumbuhan tembelekan ... 35
Tabel III Data kromatogram pemeriksaan antrakinon tumbuhan tembelekan dengan fase diam silika gel GF 254 dan fase gerak etilasetat:metanol:air (100:13,5:10) v/v ... 44
Tabel IV Data kromatogram pemeriksaan saponin tumbuhan tembelekan dengan fase diam silika gel GF 254 dan fase gerak kloroform:metanol (95:5) v/v ... 48
Tabel V Data kromatogram pemeriksaan tanin tumbuhan tembelekan dengan fase diam silika gel GF 254 dan fase gerak etil asetat:asam format:asam asetat:air (100:11:11:27) v/v ... 52
Tabel VI Data kromatogram pemeriksaan kardenolida tumbuhan tembelekan dengan fase diam silika gel GF 254 dan fase gerak etil asetat:metanol:air (100:13,5:10) v/v ... 55
xv
DAFTAR GAMBAR
Gambar 1. Struktur umum flavonoida ... 10
Gambar 2. Struktur umum antrakinon ... 14
Gambar 3. Skema pembuatan larutan percobaan untuk KLT ... 26
Gambar 4. Skema penyarian alkaloida untuk KLT ... 28
Gambar 5. Kromatogram tumbuhan tembelekan untuk pemeriksaan antrakinon dengan jarak pengembangan 10 cm ... 45
Gambar 6. Kromatogram tumbuhan tembelekan untuk pemeriksaan saponin dengan jarak pengembangan 10 cm ... 50
Gambar 7. Kromatogram tumbuhan tembelekan untuk pemeriksaan tanin dengan jarak pengembangan 10 cm ... 53
Gambar 8. Kromatogram tumbuhan tembelekan untuk pemeriksaan kardenolida dengan jarak pengembangan 10 cm ... 56
xvi
DAFTAR LAMPIRAN
Lampiran 1. Surat keterangan determinasi tumbuhan tembelekan ... 65
Lampiran 2. Foto tumbuhan tembelekan ... 66
Lampiran 3. Foto daun tumbuhan tembelekan ... 66
Lampiran 4. Foto batang tumbuhan tembelekan ... 66
Lampiran 5. Foto bunga tumbuhan tembelekan ... 67
Lampiran 6. Foto buah tumbuhan tembelekan ... 67
Lampiran 7. Foto akar tumbuhan tembelekan ... 67
Lampiran 8. Foto serbuk daun tumbuhan tembelekan ... 68
Lampiran 9. Foto serbuk batang tumbuhan tembelekan ... 68
Lampiran 10. Foto serbuk bunga tumbuhan tembelekan... 68
Lampiran 11. Foto serbuk buah tumbuhan tembelekan... 69
Lampiran 12. Foto serbuk akar tumbuhan tembelekan ... 69
Lampiran 13. Foto hasil kromatogram KLT identifikasi antrakinon ... 70
Lampiran 14. Foto hasil kromatogram KLT identifikasi kardenolida ... 71
Lampiran 15. Foto hasil kromatogram KLT identifikasi saponin ... 72
Lampiran 16 Foto hasil kromatogram KLT identifikasi tanin... 73
xvii
DAFTAR SINGKATAN DAN LAMBANG
1. AlCl
3 = aluminium klorida
2. b/v = berat/volume 3. CaCl
2 = kalsium klorida
4. cm = centimeter 5. FeCl3 = besi (III) klorida
6. g = gram 7. H2SO4 = asam sulfat
8. HCl = asam klorida
9. KLT = Kromatografi Lapis Tipis 10.KOH = kalium hidroksida
11.LP = Larutan Pereaksi 12.m = meter
13.mg = miligram 14.MgCl
2 = magnesium klorida
15.MgSO
4 = magnesium sulfat
16.ml = mililiter 17.NaHCO
3 = natrium bikarbonat
18.NaOH = natrium hidroksida 19.nm = nanometer
xviii 21.UV = ultraviolet
22.v/v = volume/volume 23.°C = derajat Celcius 24.% = persen
xix
INTISARI
Penggunaan tanaman obat dalam pengobatan tradisional berkembang di masyarakat berdasarkan pengalaman dan tradisi yang ada di daerah tersebut. Tembelekan (Lantana camara L.) merupakan tanaman obat yang banyak digunakan. Tembelekan dimanfaatkan untuk menghilangkan pembengkakan/tumor, rematik, tetanus, malaria, sebagai antiseptik, antitoksik, dan perangsang muntah. Penelitian ini bertujuan untuk melakukan analisis kualitatif kandungan kimia daun, batang, bunga, buah, dan akar tumbuhan tembelekan sehingga dapat diketahui kandungan kimiawi dari daun, batang, bunga, buah, dan akar tumbuhan tembelekan.
Penelitian ini merupakan penelitian non eksperimental karena tidak ada perlakuan pada subjek uji. Bahan yang digunakan adalah serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan. Penelitian terhadap golongan senyawa kimia yang terkandung di dalamnya dilakukan secara kualitatif dengan identifikasi kimiawi, uji tabung, dan kromatografi lapis tipis.
Hasil penelitian menunjukkan bahwa daun dan bunga tumbuhan tembelekan mengandung senyawa golongan flavonoida dan saponin, sedangkan pada batang, buah, dan akar tumbuhan tembelekan mengandung senyawa golongan saponin dan tanin.
xx
ABSTRACT
The usage of medical plants in traditional treatment grows in a society based upon experiences and traditions which exist in certain regions. Tembelekan (Lantana camara L.) is one of medical plants that are often used. Tembelekan can be used to heal swelling/tumor, rheumatic, tetanus, malaria, antiseptic medicine, antitoxic, and vomiting stimulation. The research was aimed to do qualitative analysis chemical compounds of leaf, stem, flower, fruit, and root of tembelekan plant so that it can detect the chemical compounds in leaf, stem, flower, fruit, and root of tembelekan plant.
The research was a non experimental research, because there was no treatment on subject. The materials that used were dry leaf powder, stem, flower, fruit, and root of tembelekan plant. Research on chemical compounds category that contained in the leaf, stem, flower, fruit, and root of tembelekan plant was done qualitatively by includes chemical identification, tube test, and thin layer chromatography.
The result of the research showed that tembelekan plant contain flavonoid, saponin, and tannin. The leaf and flower were containing flavonoid and saponin, whereas the stem, fruit, and root were containing saponin and tannin.
1
BAB I
PENGANTAR
A. Latar Belakang
Indonesia merupakan salah satu negara yang mempunyai sumber daya alam yang potensial, salah satunya adalah tanaman obat. Tanaman obat memiliki aktivitas untuk menyembuhkan penyakit karena adanya senyawa kimia tertentu yang terkandung dalam tanaman. Senyawa kimia yang terkandung dalam tanaman obat yang biasanya memiliki aktivitas biologi yaitu golongan alkaloida, kardenolida, bufadienolida (glikosida jantung), flavonoida, antrakinon, saponin, tanin (polifenolat), minyak atsiri, glikosida sianogenik, dan lain-lain (Nugroho, 2003; Robinson, 1991).
mengetahui kandungan senyawa kimia tertentu yang memiliki aktivitas dalam tumbuhan perlu dilakukan analisis kualitatif kandungan kimia pada tumbuhan.
Penelitian terhadap seluruh organ tumbuhan tembelekan belum banyak dilakukan, beberapa penelitian hanya terhadap organ tertentu seperti daun yang pernah diteliti oleh Soelastri (Widowati, et al., 1994) dan Asterina (1994), oleh karena itu penulis melakukan analisis kualitatif kandungan kimia terhadap daun, batang, bunga, buah, dan akar tumbuhan tembelekan untuk dapat mengetahui kandungan kimia dalam tiap organ. Analisis kualitatif kandungan kimia ini dilakukan dengan identifikasi kimiawi, uji tabung, dan kromatografi lapis tipis. Metode ini dapat digabungkan dan dapat dilakukan survei tumbuhan untuk mendapatkan kandungan yang berguna untuk pengobatan (Fransworth, 1996). Pada penelitian ini dilakukan uji terhadap ada tidaknya senyawa golongan flavonoida, antrakinon, saponin, tanin, kardenolida, alkaloida, dan minyak atsiri. Maka diharapkan analisis kualitatif kandungan kimia dapat digunakan sebagai langkah awal untuk mengetahui kandungan senyawa kimia tertentu yang memiliki
aktivitas dalam tiap organ tumbuhan tembelekan.
1. Perumusan masalah
Apakah terdapat golongan senyawa flavonoida, antrakinon, saponin, tanin, kardenolida, alkaloida, dan minyak atsiri dalam daun, batang, bunga, buah, dan akar tumbuhan tembelekan?
2. Keaslian penelitian
Berdasarkan hasil penelusuran pustaka, ternyata telah dilakukan penelitian terhadap daun tembelekan antara lain penelitian farmakognosi dan kandungan kimia dari daun Lantana camara oleh Soelastri (Widowati, et al. 1994); dan pemeriksaan flavonoid dan verbaskosid daun Lantana camara L. oleh Asterina (1994). Tetapi sejauh penelusuran pustaka analisis kualitatif kandungan kimia tumbuhan tembelekan belum pernah dilakukan.
3. Manfaat penelitian
a. Manfaat praktis dari penelitian ini yaitu dapat memberikan informasi mengenai golongan senyawa yang terkandung dalam daun, batang, bunga, buah, dan akar tumbuhan tembelekan.
b. Manfaat teoritis dari penelitian ini adalah sebagai dasar bagi peneliti yang lain dalam upaya mengembangkan penelitian ilmiah tentang tumbuhan tembelekan.
B. Tujuan Penelitian
4
BAB II
PENELAAHAN PUSTAKA
A. Pemeriksaan Kandungan Tanaman
Secara umum obat herbal berasal dari seluruh bagian tanaman (aerial part) atau daun. Obat yang diambil dari tanaman sebaiknya ditentukan tidak
hanya dari species mana diperoleh tetapi juga bagian tanaman mana yang digunakan. Oleh karena itu, obat dapat dikatakan dipalsukan / dicampuri jika bagian tanaman lain termasuk (misalnya seluruh bagian tanaman sebagai pengganti daun) (Heinrich, 2004).
Penggantian daun dengan seluruh bagian tumbuhan pada species yang sama merupakan masalah yang umum terjadi. Hal ini menyebabkan obat sering mengandung lebih atau sedikit kandungan aktif lainnya, sehingga pemeriksaan terhadap kandungan dibutuhkan untuk ditentukan bukan hanya pada species namun juga tiap bagian tanaman (Heinrich, 2004).
B. Tumbuhan Tembelekan
1. Keterangan botani
Tembelekan (Lantana camara L.) termasuk dalam familia Verbenaceae (Van Steenis, 1975).
2. Nama daerah
Sumatera : tembelekan, kembang telek, bunga pagar, kayu singapur, tahi ayam Jawa : kembang telek, oblo, puyengan, pucengan, tembelek, tembelekan,
Sunda : kembang satek, saliyara, saliyare, tahi hayam, tahi kotok, cente Madura : kamanco, mainco, tamanjho (Hembing, 2000)
3. Deskripsi tumbuhan
Tembelekan kadang tumbuh liar atau ditanam sebagai tanaman hias dan tanaman pagar. Tumbuhan asal Amerika tropis ini bisa ditemukan dari dataran rendah sampai 1.700 m dpl., pada tempat terbuka yang terkena sinar matahari atau agak ternaung. Perdu, tegak, atau agak memanjat, tinggi 0,5-4 m, berbau. Batang berkayu, bercabang banyak, ranting bentuk segi empat, berduri, berambut. Daun tunggal, berhadapan, bundar telur, ujung runcing, pangkal tumpul, tepi bergerigi, pertulangan menyirip, kedua permukaan berambut, perabaan kasar, panjang 5-8 cm, lebar 3,5-5 cm, warnanya hijau tua. Perbungaan majemuk berbentuk bulir, mahkota bagian dalam berambut, warna putih, merah muda, jingga, kuning, dan sebagainya (Dalimartha, 1999).
4. Kandungan kimia
5. Kegunaan
Akar berkhasiat mengatasi influenza disertai demam tinggi, TBC kelenjar, rematik, memar, tumor, keputihan, kencing nanah, gondongan, dan neurodermatitis. Bunga berkhasiat mengatasi TBC paru dengan batuk darah, dan mengatasi sesak nafas. Daun berkhasiat mengatasi sakit kulit, gatal, bisul, luka, batuk, rematik, memar dan bengkak (Dalimartha, 1999).
C. Pengeringan
Pengeringan dimaksudkan untuk mendapatkan simplisia yang tidak mudah rusak, sehingga dapat disimpan dalam waktu yang lebih lama. Pengeringan dapat mengurangi kadar air dan menghentikan reaksi enzimatik sehingga penurunan mutu atau perusakan simplisia dapat dicegah (Anonim, 1987). Air yang masih tersisa dalam simplisia pada kadar tertentu dapat menjadi media pertumbuhan kapang dan jasad renik. Pada tumbuhan yang masih hidup pertumbuhan kapang dan reaksi enzimatik yang merusak itu tidak terjadi karena adanya keseimbangan antara proses-proses metabolisme, yaitu proses sintesis, transformasi dan penggunaan isi sel.
Pada dasarnya dikenal dua cara pengeringan, yaitu: 1. Pengeringan alamiah
b. Pengeringan alamiah dengan diangin-anginkan dan tidak dipanaskan dengan sinar matahari langsung. Cara ini terutama digunakan untuk mengeringkan bagian tanaman yang lunak seperti bunga, daun dan sebagainya, dan mengandung senyawa aktif mudah menguap.
2. Pengeringan buatan
Prinsipnya adalah sebagai berikut: udara dipanaskan oleh suatu sumber panas seperti lampu, kompor, mesin disel atau listrik, udara panas dialirkan dengan kipas ke dalam ruangan atau lemari yang berisi bahan yang akan dikeringkan yang telah disebarkan di atas rak-rak pengering (Anonim, 1985).
D. Analisis Kualitatif Kandungan Kimia
E. Uraian Tentang Kandungan Kimiawi
a. Alkaloid
Alkaloid adalah senyawa basa nitrogen organik yang terdapat dalam tumbuhan, akan tetapi beberapa alkaloid seperti ergometrina, fisostigmina, kafeina mempunyai lebih besar dari satu nitrogen dalam setiap molekulnya dapat sebagai amin primer, amin sekunder (Mursyidi, 1990).
Kebanyakan alkaloid menunjukkan aktivitas fisiologis tertentu. Alkaloid seringkali beracun bagi manusia dan banyak yang mempunyai kegiatan fisiologi yang menonjol, jadi digunakan dalam bidang pengobatan (Harborne, 1987).
Peran alkaloid bagi tumbuhan, antara lain sebagai zat racun yang melindungi tumbuhan dari gangguan serangga dan hewan, produk akhir reaksi detoksifikasi hasil metabolisme, faktor pengatur pertumbuhan, dan persediaan unsur hidrogen yang diperlukan bagi tumbuhan.
Kebanyakan alkaloid berupa zat padat, rasa pahit dan sukar larut dalam air, tetapi mudah larut dalam kloroform, eter, dan pelarut organik yang relatif non polar dan tidak dapat dicampur dengan air. Sebaliknya, garam alkaloid larut dalam air tetapi tidak larut dalam pelarut organik.
Identifikasi alkaloid dengan reaksi warna dapat dilakukan dengan menimbang 500 mg serbuk simplisia yang kemudian ditambah 1 ml asam klorida 2 N dan 9 ml air, dipanaskan di atas penangas air selama 2 menit, didinginkan dan disaring. Dengan penambahan 2 tetes Bouchardat LP, jika tidak terjadi endapan maka serbuk tidak mengandung alkaloid. Jika dengan penambahan Mayer LP terbentuk endapan menggumpal berwarna putih atau kuning yang larut dalam metanol P dan dengan Bouchardat LP terbentuk endapan berwarna coklat sampai hitam, maka ada kemungkinan terdapat alkaloid (Anonim, 1989).
Alkaloid dapat dideteksi dengan metode kromatografi lapis tipis. Pereaksi penampak bercak yang digunakan Dragendroff, iodoplatinat, dan Marquis. Di bawah sinar UV, alkaloid tampak berwarna kuning, biru, dan biru terang dari struktur masing-masing (Harborne, 1987).
b. Flavonoid
Flavonoid adalah senyawa fenol alam yang terdapat dalam hampir semua tumbuhan dari bangsa Algae hingga Gymnospermae. Pada tumbuhan tinggi, flavonoid terdapat baik dalam bagian vegetatif maupun dalam bunga sebagai pigmen bunga (Robinson, 1991).
Flavonoid adalah golongan senyawa alam yang strukturnya terdiri dari 2 cincin aromatik yang dihubungkan oleh atom karbon membentuk rangka dengan sistem C6-C3-C6. Kelas-kelas yang berlainan dalam golongan
O A B 7 6 5 7 3 2 8 1 1' 3' 2' 4 5' 6'
Gambar 1. Struktur umum flavonoida
Flavonoid baik dalam bentuk aglikon maupun glikosida dapat diekstraksi dengan etanol 70%. Pada proses partisi dengan eter, bentuk aglikon akan masuk kedalam lapisan eter dan bentuk glikosida terdapat dalam lapisan air. Warna flavonoid berubah jika ditambahkan basa atau amonia, sehingga mudah dideteksi pada kromatogram atau dalam larutan flavonoid menjadi sistem aromatik terkonjugasi yang menunjukkan pita serapan kuat pada daerah spektrum UV dan cahaya tampak (Harborne, 1987). Di bawah UV 365 nm bercak berwarna kuning dengan pereaksi aluminium klorida, dan terdeteksi langsung dengan UV 254 nm ditandai dengan terjadinya pemadaman dan berfluoresensi biru/ungu pada UV 365 nm (Mursyidi, 1990).
Identifikasi khas flavonoid dapat dilakukan dengan terlebih dahulu membuat larutan dari 0,5 g serbuk dengan 10 ml metanol P menggunakan alat pendingin balik selama 10 menit. Larutan disaring saat masih panas melalui kertas saring kecil berlipat, kemudian filtrat diencerkan dengan 10 ml air. Setelah dingin filtrat yang telah diencerkan ditambahkan dengan 5 ml eter minyak tanah P, dikocok dengan hati-hati, dan didiamkan. Lapisan metanol
(95%) P, ditambahkan 0,5 g serbuk seng P dan 2 ml asam klorida 2 N, setelah itu didiamkan selama 1 menit. Larutan ditambahkan 10 tetes asam klorida P, jika dalam waktu 2 sampai 5 menit terjadi warna merah intensif, maka menunjukkan adanya flavonoid (glikosida-3-flavonol) (Anonim, 1989).
c. Tanin
Tanin terdapat luas dalam tumbuhan berpembuluh, dalam Angiospermae terdapat khusus dalam jaringan kayu. Letak tanin terpisah dari
protein dan enzim sitoplasma (Harborne, 1987).
Tanin merupakan jenis kandungan kimia pada tumbuhan yang bersifat fenol, mempunyai rasa sepat dan mempunyai kemampuan menyamak kulit. Secara umum tanin mempunyai sifat larut dalam air dan alkohol, dapat mengendapkan larutan gelatin, albumin dan protein. Tanin juga akan melarutkan alkaloid (Robinson, 1995).
Secara kimia terdapat dua jenis utama tanin yang tersebar tidak merata yaitu tanin terhidrolisis dan tanin terkondensasi. Tanin terhidrolisis sering kali berupa campuran rumit terdiri atas beberapa asam fenolat yang berlainan teresterkan ke posisi berbeda pada molekul gula (Harborne, 1988). Tanin terhidrolisis biasanya berupa senyawa amorf, higroskopis, berwarna coklat kuning yang larut dalam air terutama air panas, membentuk larutan koloid (Robinson, 1995).
Tanin terkondensasi terdapat dalam tumbuhan paku-pakuan dan
Gymnospermae, terutama pada jenis tumbuhan berkayu. Tanin ini secara
galokatekin yang membentuk senyawa dimer dan kemudian oligomer karena bila direaksikan dengan asam panas, beberapa ikatan karbon penghubung satuan terputus dan dibebaskanlah monomer antosianidin (Harborne, 1987).
Makin murni tanin, makin kurang kelarutannya dalam air, dan makin mudah diperoleh dalam bentuk kristal. Tanin larut pula, setidak-tidaknya sampai batas tertentu, dalam pelarut organik yang polar, tetapi tak larut dalam pelarut organik non polar seperti benzena atau kloroform. Larutan tanin dalam air dapat diendapkan dengan penambahan asam mineral atau garam (Robinson, 1991).
Identifikasi khas tanin dapat dilakukan dengan salah satu uji tanin yang paling dikenal yaitu dengan pengendapan gelatin. Kepekaan reaksi dapat ditingkatkan dengan menyesuaikan pH menjadi sekitar 4 dan menambahkan natrium klorida sedikit. Reaksi endapan lain dengan amina atau ion logam sering dipakai untuk pencirian tanin seperti senyawa fenol lainnya, dengan besi (III) klorida menghasilkan warna violet-biru (Robinson, 1991).
d. Antrakinon
Golongan kinon terbesar terdiri atas antrakinon. Beberapa antrakinon merupakan zat warna penting dan yang lain merupakan percahar. Keluarga tumbuhan yang kaya akan senyawa sejenis ini adalah Rubiaceae, Rhamnaceae, Poligonaceae (Robinson, 1995).
dengan membentuk larutan violet merah. Banyak antrakinon yang terdapat sebagai glikosida dengan bangun gula terikat dengan salah satu gugus hidroksil fenolik (Robinson, 1995).
Antrakinon dapat dideteksi dengan metode KLT. Pereaksi penampak bercak yang digunakan pereaksi kalium hidroksida etanolik. Pada sinar UV 254 nm terjadi pemadaman. Di bawah sinar UV 365 nm berfluoresensi kuning atau merah coklat (Wagner, 1984).
Untuk identifikasi turunan antrakinon reaksi Borntrager dipakai secara rutin. Sedikit senyawa yang tak diketahui dididihkan dalam larutan kalium hidroksida encer selama beberapa menit. Ini tidak hanya menghidrolisis glikosida tetapi mengoksidasi juga antron atau antranol menjadi antrakuinon. Lalu larutan basa didinginkan, diasamkan dan diekstraksi dengan benzena. Lapisan benzena tidak berwarna dan fase larutan basa menjadi merah apabila mengandung kuinon (Robinson, 1991).
O
O
8
5 4 3 2 1
6 7
Gambar 2. Struktur umum antrakinon
e. Saponin
Saponin adalah senyawa aktif yang menimbulkan busa jika dikocok dalam air dan dalam konsentrasi yang rendah sering menyebabkan hemolisa sel darah merah (Robinson, 1991).
Dalam larutan yang sangat encer, saponin sangat beracun untuk ikan. Tumbuhan yang mengandung saponin telah digunakan sebagai racun ikan selama beratus-ratus tahun. Beberapa saponin bekerja sebagai antimikroba (Robinson, 1991).
Identifikasi khas pada saponin dapat dilakukan dengan cara pembuihan, yaitu dengan memasukkan 0,5 g serbuk yang diperiksa ke dalam tabung reaksi dengan ditambah 10 ml air panas. Setelah dingin larutan dikocok selama 10 detik. Apabila terbentuk buih yang mantap selama tidak kurang dari 10 menit setinggi 1 cm sampai 10 cm, dan pada penambahan setetes asam klorida 2 N buih tidak hilang, maka menunjukkan adanya saponin (Anonim, 1989).
f. Glikosida jantung
racun panah (Robinson, 1991). Glikosida jantung jarang digunakan untuk jamu karena beracun (Soedibyo, 1998).
Glikosida jantung ditemukan dalam beberapa keluarga tumbuhan yang sama sekali tidak berikatan satu sama lain seperti Apocynaceae, Liliaceae, Moraceae dan Ranunculaceae. Glikosida jantung biasanya mempunyai sifat peluruh air seni (diuretik) yang berakibat menurunkan tekanan darah dan mengobati bengkak (Soedibyo, 1998). Keberadaan senyawa ini dalam tumbuhan memberi perlindungan kepada tumbuhan tersebut dari gangguan beberapa serangga (Robinson, 1991).
Senyawa golongan kardenolida dapat dideteksi dengan sinar UV 254 nm, 365 nm dan disemprot dengan pereaksi asam sulfat. Apabila dilihat pada UV 254 nm, senyawa kardenolida berfluoresensi sangat lemah, sedangkan pada UV 365 nm tidak berfluoresensi. Setelah disemprot dengan
asam sulfat dan dipanaskan pada suhu 100°C selama 3-5 menit akan berfluoresensi biru, coklat, hijau dan kekuningan pada UV 365 nm, sedangkan pada visibel berwarna coklat atau biru (Wagner, 1984).
F. KLT ( Kromatografi Lapis Tipis )
yang berisi larutan pengembang (fase gerak) yang sesuai dan pemisahan akan terjadi selama perambatan kapiler (pengembangan), selanjutnya senyawa yang tidak berwarna harus ditampakkan (dideteksi) (Stahl, 1985).
awal
titik
dari
depan
garis
jarak
awal
titik
dari
bercak
pusat
titik
jarak
Rf
=
Jarak pengembangan senyawa pada kromatografi dinyatakan dalam angka Rf atau hRf, dimana angka tersebut dapat digunakan untuk identifikasi senyawa yang dianalisis (Stahl, 1985).
1. Penyerap (fase diam) mempunyai panjang 200 mm dengan lebar 200 atau 100 mm. Untuk analisis tebalnya 0,1 sampai 0,3 mm; biasanya 0,2 mm. Beberapa macam bahan penyerap yang digunakan dalam kromatografi lapis tipis antara lain:
a. Silika gel
Penyerap ini banyak digunakan, umumnya ditambah bahan pengikat misalnya kalsium sulfat (gypsum) dan silika gel ini dikenal sebagai silika gel G. Dalam keadaan tertentu untuk memudahkan identifikasi ditambahkan zat yang berfluoresensi dan fase diam ini dikenal dengan silika gel GF.
b. Selulosa
c. Alumina
Penyerap ini jarang digunakan karena bereaksi asam, netral dan basa sehingga perlu penanganan khusus.
2. Fase gerak ialah medium pembawa yang terdiri dari satu atau beberapa pelarut. Fase ini bergerak dalam fase diam, yaitu suatu lapisan berpori karena adanya gaya kapiler. Umumnya fase gerak sifatnya berlawanan dengan fase diam. Apabila fase diam polar maka fase gerak non polar. Begitu pula sebaliknya. Yang digunakan adalah pelarut bertingkat mutu analitik dan bila diperlukan sistem pelarut multi komponen, maka harus berupa suatu campuran sederhana yang terdiri atas maksimal tiga komponen (Stahl, 1985).
3. Deteksi bercak
Identifikasi bercak pada kromatogram dilakukan di bawah lampu ultraviolet pada panjang gelombang 254 nm dan 365 nm ditandai dengan ada atau tidaknya warna. Untuk menampakkan bercak senyawa yang intensitasnya lemah dapat digunakan reaksi penyemprot yang sesuai (Autheroff, Kovar, 1981).
G. Keterangan Empiris
18
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian yang dilakukan merupakan jenis penelitian non eksperimental dengan rancangan deskriptif komparatif.
B. Variabel Penelitian dan Definisi Operasional
1. Variabel penelitian
a. Variabel pengacau terkendali, yaitu faktor pengeringan tumbuhan pada oven suhu 40ºC, tempat pengumpulan tumbuhan tembelekan, dan umur tumbuhan tembelekan.
b. Variabel pengacau tidak terkendali, yaitu kondisi lingkungan tempat tumbuh tumbuhan tembelekan.
2. Definisi operasional
a. Analisis kualitatif kandungan kimia adalah analisis untuk mengetahui kandungan kimia dari daun, batang, bunga, buah, dan akar tumbuhan tembelekan yang meliputi senyawa golongan flavonoida, antrakinon, saponin, tanin, kardenolida, alkaloida, dan minyak atsiri.
permukaan bawah tanah yang dipotong dengan ukuran tertentu, yang setelah dicuci dengan air mengalir dan dikeringkan pada oven dengan suhu
40°C kemudian diserbuk menggunakan blender dan diayak.
c. Uji identifikasi kimiawi organ tumbuhan tembelekan adalah uji yang dilakukan dengan cara meneteskan pereaksi tertentu pada serbuk organ tumbuhan tembelekan untuk mengetahui kandungan kimia dalam organ tumbuhan tembelekan melalui pengamatan warna yang terbentuk. Warna yang timbul spesifik terhadap pereaksi tertentu.
d. Uji tabung organ tumbuhan tembelekan adalah uji yang dilakukan di dalam tabung reaksi dengan cara menyari serbuk organ tumbuhan tembelekan, kemudian disaring dan pada filtrat hasil penyarian ditambahkan pereaksi tertentu, untuk mengetahui kandungan kimia dalam organ tumbuhan tembelekan melalui pengamatan warna yang terbentuk. e. Kromatografi Lapis Tipis organ tumbuhan tembelekan adalah metode
C. Bahan Penelitian
1. Bahan utama
Bahan yang digunakan adalah serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan.
2. Bahan kimia
Bahan-bahan yang digunakan meliputi pereaksi kimia untuk uji tabung, identifikasi kimiawi, uji kualitatif secara KLT dan eluen yang digunakan untuk KLT serta pereaksi penampak bercak atau noda pada lempeng KLT.
a. Bahan untuk identifikasi kimiawi, antara lain asam sulfat P, asam sulfat 10 N, larutan natrium hidroksida P 5% b/v, amoniak 25% P, larutan kalium hidroksida P 5 % b/v, dan larutan besi (III) klorida P 5% b/v.
b. Bahan untuk uji tabung, antara lain aquadest, asam klorida 1%, Dragendorff, Mayer, serbuk natrium karbonat, asam cuka 5%, kalium hidroksida 0,5 N, hidrogen peroksida, asam asetat glasial, toluena, besi (III) klorida, natrium klorida 2%, gelatin 1%, asam 3,5-dinitrobenzoat, kalium hidroksida 1 N dalam metanol, dan kloroform.
c. Bahan yang digunakan dalam pembuatan larutan percobaan KLT meliputi petroleum eter; kloroform-asam asetat; metanol-kloroform-asam asetat; metanol-air, HCl 1%, Dragendorff, NaHCO3. Bahan yang digunakan
kimia yang digunakan untuk penampak bercak yaitu amonia, AlCl3, KOH
etanolik, Liebermann-Burchard, vanilin asam sulfat, besi (III) klorida, pereaksi asam sulfat, dan pereaksi Dragendorff KLT LP.
D. Alat atau Instrumen Penelitian
Alat yang digunakan pada proses penelitian meliputi: a. Alat untuk pembuatan simplisia kering (oven).
b. Alat untuk pembuatan serbuk meliputi blender, ayakan tepung.
c. Alat untuk uji tabung dan pemeriksaan KLT meliputi neraca analitik (Mettler Toledo AB 204), Waterbath (Memert), vortex (Dijkstra), lampu UV 254 nm dan 365 nm, mikro pipet, alat penyemprot dan seperangkat alat-alat gelas (Pyrex).
E. Tata cara penelitian
1. Determinasi tumbuhan tembelekan
Determinasi tumbuhan dilakukan untuk memastikan bahwa tumbuhan yang digunakan Lantana camara L.. Determinasi dilakukan di Laboratorium Kebun Obat, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta dengan menggunakan buku acuan (Van Steenis, 1975).
2. Penyiapan bahan
yaitu batang dari cabang yang dipotong-potong dengan panjang tertentu, bunga yang diambil yaitu bunga mekar berwarna oranye, buah yang diambil yaitu buah yang masak dan berwarna hijau tua, sedangkan pada akar yang diambil yaitu akar dari permukaan bawah tanah yang dipotong dengan ukuran tertentu. Daun, batang, bunga, buah, dan akar tumbuhan tembelekan yang telah dikumpulkan dicuci bersih dengan air mengalir dan diangin-anginkan kemudian dikeringkan di dalam oven pada suhu 40ºC sampai kering (mudah dipatahkan). Daun, batang, bunga, buah, dan akar yang telah dikeringkan diserbuk dengan menggunakan blender, kemudian diayak lalu disimpan di tempat yang kering.
3. Uji identifikasi kimiawi
a. Serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan ditambah dengan 5 tetes asam sulfat P, kemudian diamati warna yang terjadi.
b. Serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan ditambah dengan 5 tetes asam sulfat 10 N, kemudian diamati warna yang terjadi.
c. Serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan ditambah dengan 5 tetes natrium hidroksida P 5% b/v dalam metanol, kemudian diamati warna yang terjadi.
e. Serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan ditambah dengan 5 tetes besi (III) klorida P 5% b/v, kemudian diamati warna yang terjadi.
f. Serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan ditambah dengan 5 tetes kalium hidroksida P 5% b/v, kemudian diamati warna yang terjadi.
4. Uji tabung
a. Uji pendahuluan
Serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan (2 g) ditambah air (10 ml), dipanaskan selama 30 menit diatas air mendidih, kemudian larutan disaring melalui kapas. Suatu larutan yang berwarna kuning sampai merah menunjukkan adanya senyawa yang mengandung kromofor, dengan gugus hidrofilik. Pada penambahan larutan kalium hidroksida (beberapa tetes), warna larutan menjadi lebih intensif. b. Uji alkaloida
Keberadaan alkaloida dari basa tertier dan kuartener dapat ditunjukkan dengan penambahan serbuk natrium karbonat sampai pH 8-9, kemudian dicampur dengan kloroform (4 ml) dan diaduk pelan-pelan. Setelah kloroform memisah kemudian diambil dan ditambah asam cuka 5% sampai pH 5, diaduk lalu dipisahkan lapisan atas dengan pipet. Setelah itu pereaksi Dragendorff (5 tetes) ditambahkan pada lapisan atas. Terbentuknya endapan menunjukkan adanya alkaloida dari basa kuartener. Kemudian lapisan bawah ditambah asam klorida 1% (10 tetes) dan diaduk, maka akan terbentuk 2 lapisan. Lapisan atas diambil serta ditambahkan pereaksi Dragendorff (2 tetes), apabila terbentuk endapan maka menunjukkan adanya alkaloida dari basa tertier.
c. Uji antrakinon
Serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan (300 mg) dipanaskan selama 2 menit dengan kalium hidroksida 0,5 N (10 ml) dan larutan hidrogen peroksida (1 ml). Setelah dingin, suspensi disaring melalui kapas. Filtrat (5 ml) ditambah asam asetat glasial (10 tetes) sampai pH 5, lalu ditambahkan toluena (10 ml). Lapisan atas (5 ml) dipisahkan dengan dipipet dan dimasukkan ke dalam tabung reaksi, kemudian ditambah kalium hidroksida 0,5 N. Warna merah yang terjadi pada lapisan air (basa) menunjukkan adanya antrakinon. d. Uji polifenol
penangas air mendidih, kemudian disaring panas-panas. Setelah dingin larutan ditambah 3 tetes pereaksi besi (III) klorida. Apabila terjadi warna hijau-biru maka menunjukkan adanya polifenolat.
e. Uji tanin (zat samak)
Serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan (2 g) dipanaskan dengan air (10 ml) selama 30 menit di atas penangas air mendidih, kemudian disaring. Filtrat (5 ml) ditambah larutan natrium klorida 2% (1 ml), apabila terjadi suspensi atau endapan disaring melalui kertas saring, kemudian filtrat ditambah larutan gelatin 1% (5 ml). Apabila terbentuk endapan maka menunjukkan adanya tanin.
f. Uji kardenolida
Filtrat (2 ml) dari hasil pemanasan serbuk tumbuhan (2 g) dengan air (10 ml) selama 30 menit di atas penangas air tadi ditambah 3,5-dinitro benzoat (0,4 ml) dan kalium hidroksida 1 N (0,6 ml) dalam metanol. Terjadinya warna biru-ungu menunjukkan adanya kardenolida (glikosida jantung). Untuk penegasan lebih lanjut, filtrat yang lain (2 ml) dicampur dengan kloroform (2 ml). Lapisan atas diambil dengan pipet, lapisan bawah ditambah 3,5-dinitro benzoat (0,5 ml). Apabila terjadi warna biru ungu maka menunjukkan adanya kardenolida.
g. Uji saponin
dibiarkan dalam posisi tegak selama 30 menit, apabila terbentuk buih setinggi 3 cm dari permukaan cairan maka menunjukkan adanya saponin. h. Uji minyak atsiri
Sebanyak 10 g serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan ditambah 20 ml eter, dikocok dan disaring, kemudian filtrat dikeringuapkan. Apabila sedikit berbau aromatik, residu dilarutkan dengan sedikit etanol dan diuapkan lagi sampai kering. Apabila terjadi bau aromatik spesifik menunjukkan adanya minyak atsiri.
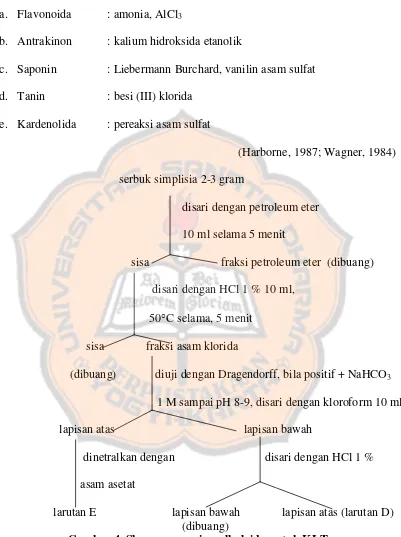
5. Uji KLT
Serbuk simpleks (2-3 gram)
disari dengan petroleum eter 10 ml, 50°C selama 5 menit
sisa fraksi petroleum eter (disingkirkan) disari dengan kloroform-asam asetat (99:1),
10 ml, 50°C selama, 5 menit
sisa fraksi CHCl3-HAc (larutan A)
disari dengan metanol-kloroform-asam asetat (49,5:49,5:1),
10 ml, 50°C selama 5 menit
sisa fraksi CHCl3-MeOH-HAc (larutan B)
disari dengan metanol:air (1:1) 10 ml, 50°C selama 5 menit
sisa (dibuang) fraksi metanol-air (larutan C)
Larutan A : antrakinon, flavonoida
Fase diam : silika gel GF 254, selulosa
Fase gerak: n-butanol, asam asetat, air (4:1:5) v/v etil asetat, metanol, air (100:13,5:10) v/v Larutan B : glikosida antrakinon, saponin, tanin
Fase diam : silika gel GF 254
Fase gerak : etil asetat, asam formiat, asam asetat, air (100:11:11:27) v/v etil asetat, metanol, air ( 100:13,5:10) v/v
kloroform, metanol (95:5) v/v
Larutan C : kardenolida, saponin, glikosida antrakinon, glikosida flavonoida Fase diam : silika gel GF 254, selulosa
Fase gerak : etil asetat, metanol, air ( 100:13,5:10) v/v kloroform, metanol (95:5) v/v
n-butanol, asam asetat, air (4:1:5) v/v fase atas Larutan pembanding yang digunakan:
a. Flavonoida : larutan rutin 0,05 % dalam metanol
b. Antrakinon : larutan Rhei Radix (0,5 g) dipanaskan 5 menit dalam metanol (5 ml), saring, filtrat diuapkan sampai 0,5 ml. c. Saponin : larutan Liquiritae Radix (2 g), direfluks dengan etanol
75% (10 ml) selama 10 menit.
d. Tanin : larutan asam tanat 0,05 % dalam etanol 70 % (10 ml) e. Kardenolida : larutan digoksin lanatosida C 5 mg dalam 2 ml metanol
Pereaksi semprot yang digunakan: a. Flavonoida : amonia, AlCl3
b. Antrakinon : kalium hidroksida etanolik
c. Saponin : Liebermann Burchard, vanilin asam sulfat d. Tanin : besi (III) klorida
e. Kardenolida : pereaksi asam sulfat
(Harborne, 1987; Wagner, 1984) serbuk simplisia 2-3 gram
disari dengan petroleum eter 10 ml selama 5 menit
sisa fraksi petroleum eter (dibuang) disari dengan HCl 1 % 10 ml,
50°C selama, 5 menit
sisa fraksi asam klorida
(dibuang) diuji dengan Dragendorff, bila positif + NaHCO3
1 M sampai pH 8-9, disari dengan kloroform 10 ml lapisan atas lapisan bawah
dinetralkan dengan disari dengan HCl 1 % asam asetat
larutan E lapisan bawah lapisan atas (larutan D) (dibuang)
Gambar 4. Skema penyarian alkaloida untuk KLT
Sistem KLT yang digunakan: Fase diam : silika gel GF 254
Fase gerak : kloroform : aseton : dietilamina (5:4:1) toluen : etil asetat : dietilamina (70:20:10)
Larutan pembanding yang digunakan: nikotin, skopolamin, sinkonin, teofilin Pereaksi semprot : Dragendorff KLT LP
(Anonin, 1987; Wagner, 1984)
F. Analisis Hasil
Penelitian dilakukan dengan penelitian secara kualitatif, yaitu analisis kualitatif kandungan kimia daun, batang, bunga, buah, akar tumbuhan tembelekan dengan identifikasi kimiawi, uji tabung, dan KLT. Pada uji identifikasi kimiawi dan uji tabung, kandungan kimia dalam daun, batang, bunga, buah, dan akar tumbuhan tembelekan dapat diketahui dengan pengamatan warna yang terbentuk dari reaksi antara senyawa yang ada dengan pereaksi yang digunakan. Pada KLT, kandungan kimia dalam daun, batang, bunga, buah, dan akar tumbuhan tembelekan terlihat pada profil kromatografi lapis tipisnya dengan menilai warna dan harga Rf nya.
awal
titik
dari
depan
garis
jarak
30
BAB IV
HASIL DAN PEMBAHASAN
A. Determinasi Tumbuhan
Determinasi tumbuhan dimaksudkan untuk memperoleh kepastian jenis tumbuhan yang digunakan. Determinasi dilakukan dengan cara mencocokkan herbarium dan ciri-ciri morfologi tumbuhan tembelekan yang digunakan dalam penelitian menggunakan buku acuan (Van Steenis, 1975). Berdasarkan hasil determinasi yang dilakukan dapat dipastikan bahwa tumbuhan yang diteliti merupakan Lantana camara L. (tembelekan) (lampiran 1).
B. Pengumpulan dan Pengeringan Organ serta Pembuatan Serbuk
tidak langsung dan dapat juga menggunakan alat pengering. Pada penelitian ini pengeringan menggunakan oven pada suhu 40ºC agar bahan simplisia tidak tercemar oleh pengotor dari luar, misalnya debu. Selain itu, dengan menggunakan oven pengeringan akan lebih merata dan lebih cepat tanpa dipengaruhi oleh keadaan cuaca. Suhu yang digunakan yaitu 40ºC karena bahan simplisia biasanya dikeringkan pada suhu 30ºC sampai 90ºC, tetapi suhu yang terbaik adalah tidak melebihi 60ºC (Anonim, 1985).
Pengeringan dapat dihentikan jika kadar air yang terkandung dalam simplisia kurang dari 10% karena reaksi enzimatis yang dapat menguraikan senyawa aktif sudah tidak berlangsung (Anonim, 1985). Selain itu daun, batang, bunga, buah, dan akar tumbuhan tembelekan yang sudah kering juga dapat diketahui dengan meremas daun, batang, bunga, buah, dan akar tumbuhan tembelekan sampai dapat hancur atau mudah dipatahkan. Jika kadar air masih tinggi maka daun, batang, bunga, buah, dan akar tumbuhan tembelekan tersebut masih lembab dan jika diremas tidak hancur atau tidak mudah dipatahkan.
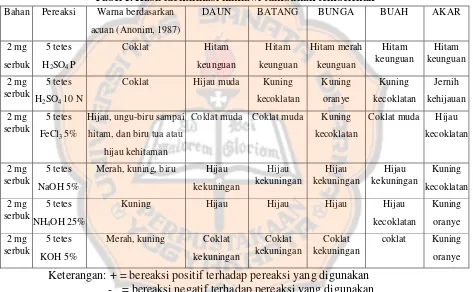
C. Identifikasi Kimiawi Tumbuhan Tembelekan
Identifikasi kimiawi tumbuhan dilakukan untuk mengetahui senyawa kimia yang terkandung di dalam tumbuhan dengan mengamati warna yang terbentuk dari reaksi antara zat aktif yang ada dengan pereaksi yang digunakan. Masing-masing zat akan menimbulkan warna yang spesifik terhadap pereaksi tertentu (Tabel I).
Tabel I. Hasil identifikasi kimiawi tumbuhan tembelekan
Keterangan: + = bereaksi positif terhadap pereaksi yang digunakan - = bereaksi negatif terhadap pereaksi yang digunakan
Penambahan asam sulfat P pada serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan adalah untuk mengoksidasi zat-zat yang terkandung di dalam serbuk daun, batang, bunga, buah, dan akar. Hasil pengamatan pada serbuk daun, batang, buah, akar berwarna hitam keunguan, sedangkan pada serbuk bunga berwarna hitam merah keunguan. Pada penambahan asam sulfat 10 N dimaksudkan untuk mengoksidasi senyawa kimia yang terkandung di dalam
Bahan Pereaksi Warna berdasarkan
acuan (Anonim, 1987)
DAUN BATANG BUNGA BUAH AKAR
2 mg
serbuk
5 tetes
H2SO4 P
Coklat Hitam
keunguan Hitam keunguan Hitam merah keunguan Hitam keunguan Hitam keunguan 2 mg serbuk 5 tetes
H2SO4 10 N
Coklat Hijau muda Kuning
kecoklatan Kuning oranye Kuning kecoklatan Jernih kehijauan 2 mg serbuk 5 tetes
FeCl3 5%
Hijau, ungu-biru sampai
hitam, dan biru tua atau
hijau kehitaman
Coklat muda Coklat muda Kuning
kecoklatan
Coklat muda Hijau
kecoklatan
2 mg serbuk
5 tetes
NaOH 5%
Merah, kuning, biru Hijau
kekuningan Hijau kekuningan Hijau kekuningan Hijau kekuningan Kuning kecoklatan 2 mg serbuk 5 tetes
NH4OH 25%
Kuning Hijau Hijau Hijau Hijau
kecoklatan Kuning oranye 2 mg serbuk 5 tetes KOH 5%
Merah, kuning Coklat
kekuningan
Coklat kekuningan
Coklat kekuningan
coklat Kuning
serbuk daun pada konsentrasi yang lebih encer. Hasil pengamatan setelah pemberian asam sulfat 10 N diperoleh warna hijau muda pada serbuk daun, pada serbuk batang dan buah berwarna kuning kecoklatan, serbuk bunga berwarna kuning oranye, dan pada serbuk akar berwarna jernih kehijauan. Pada tumbuhan tembelekan, hanya serbuk batang dan buah yang menunjukkan warna kecoklatan. Warna coklat yang terbentuk karena asam sulfat bersifat destruktif terhadap gugus yang mengandung karbon. Sedangkan pada serbuk daun, bunga, dan akar yang tidak berwarna coklat berarti pada penambahan asam sulfat tidak bersifat destruktif terhadap gugus yang mengandung karbon.
Penambahan larutan besi (III) klorida P 5% b/v dilakukan untuk mengidentifikasi adanya senyawa fenolik dan tanin. Apabila ditambahkan larutan tersebut senyawa fenolik akan memberikan warna hijau, ungu, biru sampai hitam dan tanin akan memberikan warna biru tua atau hijau kehitaman (Anonim, 1987). Dari data yang diperoleh pada serbuk daun, batang, buah memberikan warna coklat muda, serbuk bunga memberikan warna kuning kecoklatan, dan pada serbuk akar memberikan warna hijau kecoklatan yang berarti hanya serbuk akar tumbuhan tembelekan yang mengandung senyawa fenolik.
akar berwarna kuning kecoklatan, yang berarti serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan mengandung derivat antrakinon.
Penambahan amonia 25% pada identifikasi tanaman bertujuan untuk mengidentifikasi adanya senyawa fenolik. Apabila ditambahkan amonia senyawa fenolik akan memberikan warna kuning (Wagner, 1984). Dari uji yang dilakukan pada serbuk daun, batang, bunga memberikan warna hijau, pada serbuk buah memberikan warna hijau kecoklatan, sedangkan pada serbuk akar menunjukkan warna kuning oranye, yang berarti hanya serbuk akar tumbuhan tembelekan yang mengandung senyawa fenolik.
Penambahan larutan kalium hidroksida 5% b/v bertujuan untuk mengidentifikasi adanya senyawa antrakinon dan derivatnya. Reaksi positif jika warna yang dihasilkan merah untuk antrakinon dan kuning untuk derivatnya (Anonim, 1987). Dari data yang diperoleh, pada serbuk daun, batang, bunga memberikan warna coklat kekuningan, pada serbuk buah memberikan warna coklat, sedangkan pada serbuk akar memberikan warna kuning oranye. Hal ini berarti serbuk daun, batang, bunga, dan akar tumbuhan tembelekan mengandung senyawa derivat antrakinon.
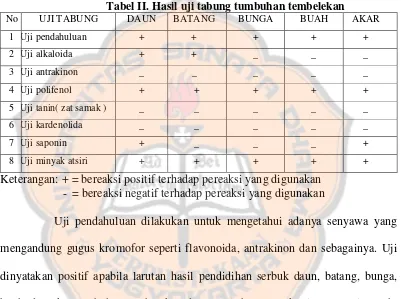
D. Uji Tabung Tumbuhan Tembelekan
Uji tabung dilakukan untuk mengetahui kandungan kimia suatu tumbuhan melalui pengamatan warna yang terbentuk oleh karena adanya reaksi antara zat aktif yang ada dengan pereaksi yang digunakan. Masing-masing zat akan memberikan warna yang spesifik terhadap pereaksi tertentu (Tabel II).
Tabel II. Hasil uji tabung tumbuhan tembelekan
No UJI TABUNG DAUN BATANG BUNGA BUAH AKAR
1 Uji pendahuluan + + + + +
2 Uji alkaloida + + _ _ _
3 Uji antrakinon _ _ _ _ _
4 Uji polifenol + + + + +
5 Uji tanin( zat samak ) _ _ _ _ _
6 Uji kardenolida _ _ _ _ _
7 Uji saponin + _ _ _ +
8 Uji minyak atsiri + + + + +
Keterangan: + = bereaksi positif terhadap pereaksi yang digunakan - = bereaksi negatif terhadap pereaksi yang digunakan
Uji pendahuluan dilakukan untuk mengetahui adanya senyawa yang mengandung gugus kromofor seperti flavonoida, antrakinon dan sebagainya. Uji dinyatakan positif apabila larutan hasil pendidihan serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan dengan air berwarna kuning sampai merah. Dari uji yang dilakukan diperoleh larutan berwarna coklat dan terdapat warna merah setelah penambahan larutan kalium hidroksida. Ini berarti di dalam serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan terdapat senyawa yang mengandung gugus kromofor.
Uji terhadap antrakinon dilakukan dengan menggunakan larutan kalium hidroksida 0,5 N, hidrogen peroksida, asam asetat glasial, dan toluena. Serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan dipanaskan dengan larutan kalium hidroksida 0,5 N dan hidrogen peroksida dalam penangas air selama 2 menit. Pemanasan dengan larutan kalium hidroksida 0,5 N bertujuan untuk menghidrolisis glikosida antrakinon menjadi aglikonnya, yaitu antrakinon. Sedangkan larutan hidrogen peroksida berfungsi untuk mengoksidasi bentuk tereduksi dari antrakinon yaitu antron, oksantron dan diantron menjadi antrakinon. Setelah dingin suspensi serbuk daun, batang, bunga, buah, dan akar disaring dan filtratnya ditambah dengan asam asetat glasial sampai pH 5 lalu ditambah toluena untuk memisahkan lapisan air dengan fase pelarut organik. Reaksi dinyatakan positif apabila pada lapisan air berwarna merah setelah ditambahkan kalium hidroksida 0,5 N. Dari uji yang dilakukan diperoleh hasil negatif yaitu berwarna jernih yang berarti di dalam serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan tidak mengandung antrakinon.
batang, bunga, buah, dan akar tumbuhan tembelekan menunjukkan reaksi positif terhadap adanya senyawa polifenol.
Serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan dipanaskan dengan air pada penangas air untuk mengetahui adanya kandungan tanin. Penambahan natrium klorida 2% pada filtrat hasil pendidihan serbuk dengan air bertujuan untuk mengendapkan campuran tanin. Apabila terjadi endapan disaring melalui kertas saring. Pada hasil uji serbuk daun menghasilkan warna coklat tua dan terbentuk endapan, namun pada serbuk batang, bunga, buah, dan akar tidak terbentuk endapan. Dari uji dengan penambahan natrium klorida 2% apabila terbentuk endapan maka endapan disaring dan dilakukan penambahan larutan gelatin 1% pada filtrat. Adanya tanin dapat diketahui jika pada larutan terbentuk endapan. Serbuk batang, bunga, buah, dan akar setelah penambahan natrium klorida 2% tidak terbentuk endapan sehingga tidak dilakukan penambahan larutan gelatin 1%. Hanya pada serbuk daun saja yang dilakukan penambahan larutan gelatin 1%, dan setelah disaring menghasilkan larutan berwarna cokat tua keruh namun tidak terbentuk endapan. Hal ini menunjukkan bahwa serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan tidak mengandung tanin.
biru-ungu menunjukkan adanya glikosida jantung (kardenolida). Untuk penegasan lebih lanjut adanya kardenolida, filtrat dicampur dengan kloroform. Lapisan atas diambil dengan pipet, lapisan bawah ditambah 3,5-dinitro benzoat. Terjadinya warna biru ungu menunjukkan adanya kardenolida. Dari uji yang dilakukan tidak didapatkan larutan berwarna biru ungu yang berarti pada serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan tidak mengandung kardenolida.
Pemeriksaan terhadap adanya saponin dilakukan dengan mengocok serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan yang telah diberi air. Hasil menunjukkan reaksi positif apabila terbentuk buih yang stabil dari permukaan cairan setinggi kurang lebih 3 cm. Saponin memiliki gugus hidrofil dan hidrofob yang seimbang sehingga bila dicampur dengan air lalu dikocok bagian hidrofob akan membentuk buih seperti sabun. Dari uji yang dilakukan pada serbuk daun menimbulkan larutan jernih muda kehijauan dan terbentuk buih, pada serbuk batang menimbulkan larutan kuning kecoklatan namun tidak terbentuk buih, pada serbuk bunga dan buah menimbulkan larutan coklat muda tidak terbentuk buih, sedangkan pada serbuk akar menimbulkan larutan putih keruh dan terbentuk buih. Maka dapat diketahui hanya serbuk daun dan akar tumbuhan tembelekan yang mengandung saponin.
aromatik yang berarti serbuk daun, batang, bunga, buah, dan akar tumbuhan tembelekan mengandung minyak atsiri.
Dari data yang diperoleh pada uji tabung maka dapat diketahui bahwa pada serbuk daun tumbuhan tembelekan mengandung senyawa yang mengandung kromofor (flavonoida, antrakinon, dsb), alkaloida, saponin, senyawa polifenol, dan minyak atsiri. Serbuk batang tumbuhan tembelekan mengandung senyawa yang mengandung kromofor (flavonoida, antrakinon, dsb), alkaloida, senyawa polifenol, dan minyak atsiri. Serbuk bunga dan buah tumbuhan tembelekan mengandung senyawa yang mengandung kromofor (flavonoida, antrakinon, dsb), senyawa polifenol, dan minyak atsiri. Sedangkan pada serbuk akar tumbuhan tembelekan mengandung senyawa yang mengandung kromofor (flavonoida, antrakinon, dsb), saponin, senyawa polifenol, dan minyak atsiri.
Hasil yang diperoleh ada yang berbeda dengan literatur misalnya pada akar tumbuhan tembelekan tidak mengandung flavonoida (Dalimartha, 1999). Hal ini mungkin disebabkan karena perbedaan tempat tumbuh, tahap perkembangan (ontogeni), dan keturunan. Adanya ketiga faktor tersebut dapat menyebabkan perbedaan kadar kandungan kimia suatu tumbuhan (Tyler, Brady, Robbers, 1988).
E. Penyarian Serbuk Simplisia
kepolarannya dari yang bersifat non polar hingga pelarut yang bersifat lebih polar, karena sifat kandungan kimia berbeda-beda, terdapat kandungan kimia yang larut dalam pelarut polar seperti glikosida flavonoida, glikosida antrakinon, dan saponin, namun terdapat juga kandungan kimia yang larut dalam pelarut yang kurang polar seperti aglikon flavonoida atau aglikon antrakinon. Larutan yang diperoleh adalah larutan A (fraksi kloroform-asam asetat), larutan B (fraksi metanol-kloroform-asam asetat), dan larutan C (fraksi metanol-air). Masing-masing pelarut secara selektif akan memisahkan senyawa-senyawa dalam simplisia (Sudjadi, 1998). Untuk uji alkaloid larutan percobaan yang digunakan adalah larutan D (untuk uji alkaloid tertier) dan larutan E (untuk uji alkaloid kuartener). Pada penelitian ini larutan D dan E tidak dilakukan karena uji dengan Dragendorff pada fraksi asam klorida memberikan hasil yang negatif.
F. Uji Kualitatif Tumbuhan Tembelekan dengan KLT
Setelah dilakukan analisis kualitatif kandungan kimia daun, batang, bunga, buah, dan akar tumbuhan tembelekan dengan identifikasi kimiawi dan uji tabung, dilanjutkan dengan analisis kualitatif kandungan kimia secara KLT untuk memperoleh gambaran mengenai kandungan senyawa kimia yang terdapat dalam daun, batang, bunga, buah, dan akar tumbuhan tembelekan. Menggunakan KLT karena pada metode ini memiliki beberapa kelebihan dibandingkan kromatografi lain yaitu tidak memerlukan biaya yang besar, waktu relatif singkat, jumlah sampel yang dibutuhkan sedikit, dan pengerjaannya sederhana.
sebanyak 3 totolan dengan menggunakan pipet 5 μl, karena pada jumlah totolan tersebut sudah menghasilkan bercak yang tampak memisah dengan baik dan tidak mengekor. Setelah penotolan dilakukan, lempeng KLT kemudian dielusi dalam bejana yang telah jenuh dengan fase gerak yang digunakan. Fase gerak yang digunakan sesuai dengan golongan senyawa yang diidentifikasi. Untuk mengetahui bejana telah jenuh, diperlukan kertas saring sesuai dengan tinggi bejana. Kertas saring dimasukkan dalam bejana, bejana dikatakan jenuh jika kertas saring sudah terbasahi dengan sempurna oleh fase gerak. Penjenuhan ini bertujuan agar perambatan optimal. Jarak rambat elusi yaitu 10 cm dan apabila fase gerak telah melampaui maka lempeng diangkat dan dibiarkan kering terlebih dahulu untuk selanjutnya dideteksi. Deteksi dilakukan secara langsung dengan sinar tampak (visibel), di bawah sinar ultraviolet (UV) pada panjang gelombang 254 nm dan 365 nm, dan dengan menggunakan pereaksi-pereaksi yang spesifik, yang dapat menunjukkan dengan lebih jelas senyawa yang diidentifikasi.
Pada KLT hasil yang diperoleh hanya dapat memberikan informasi pendahuluan mengenai golongan senyawa yang mungkin terkandung dalam daun, batang, bunga, buah, dan akar tumbuhan tembelekan. Analisis kualitatif kandungan kimia secara KLT dilakukan untuk mengetahui adanya kandungan senyawa golongan flavonoida, antrakinon, saponin, tanin, kardenolida, alkaloida, dan minyak atsiri.
sinar ultraviolet 254 nm karena terjadinya pemancaran kembali sinar pada molekul yang telah menyerap energi setelah terjadi absorbsi. Sedangkan pada identifikasi flavonoida fase diam yang digunakan yaitu selulosa dan tidak digunakan silika gel GF 254 karena pada silika gel GF 254 mengandung gypsum (CaSO4). Flavonoida dapat membentuk kompleks dengan kalsium (Ca) dan terikat
pada fase diam silika gel GF 254 sehingga dapat mengganggu elusi.
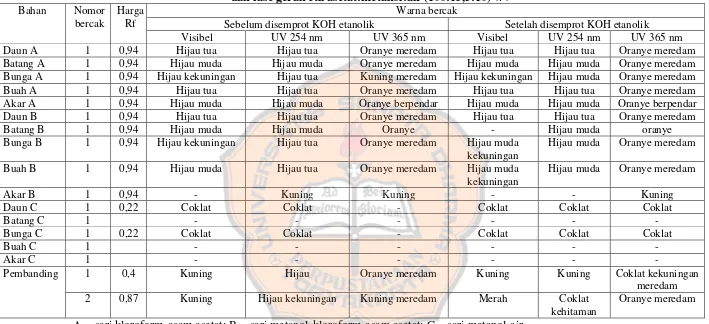
1. Identifikasi antrakinon
44
dan fase gerak etil asetat:metanol:air (100:13,5:10) v/v
Bahan Nomor
bercak
Harga Rf
Warna bercak
Sebelum disemprot KOH etanolik Setelah disemprot KOH etanolik
Visibel UV 254 nm UV 365 nm Visibel UV 254 nm UV 365 nm
Daun A 1 0,94 Hijau tua Hijau tua Oranye meredam Hijau tua Hijau tua Oranye meredam
Batang A 1 0,94 Hijau muda Hijau muda Oranye meredam Hijau muda Hijau muda Oranye meredam
Bunga A 1 0,94 Hijau kekuningan Hijau tua Kuning meredam Hijau kekuningan Hijau muda Oranye meredam
Buah A 1 0,94 Hijau tua Hijau tua Oranye meredam Hijau tua Hijau tua Oranye meredam
Akar A 1 0,94 Hijau muda Hijau muda Oranye berpendar Hijau muda Hijau muda Oranye berpendar
Daun B 1 0,94 Hijau tua Hijau tua Oranye meredam Hijau tua Hijau tua Oranye meredam
Batang B 1 0,94 Hijau muda Hijau muda Oranye - Hijau muda oranye
Bunga B 1 0,94 Hijau kekuningan Hijau tua Oranye meredam Hijau muda
kekuningan
Hijau muda Oranye meredam
Buah B 1 0,94 Hijau muda Hijau tua Oranye meredam Hijau muda
kekuningan
Hijau muda Oranye meredam
Akar B 1 0,94 - Kuning Kuning - - Kuning
Daun C 1 0,22 Coklat Coklat - Coklat Coklat Coklat
Batang C 1 - - - -
Bunga C 1 0,22 Coklat Coklat - Coklat Coklat Coklat
Buah C 1 - - - -
Akar C 1 - - - -
Pembanding 1 0,4 Kuning Hijau Oranye meredam Kuning Kuning Coklat kekuningan
meredam
2 0,87 Kuning Hijau kekuningan Kuning meredam Merah Coklat
kehitaman
Oranye meredam
Gambar 5. Kromatogram tumbuhan tembelekan untuk pemeriksaan antrakinon dengan jarak pengembangan 10 cm
Keterangan:
Fase diam : silika gel GF 254
Fase gerak : etil asetat : metanol : air (100:13,5:10) v/v Deteksi : sinar tampak setelah disemprot KOH etanolik
1. Sampel daun A : larutan sari kloroform-asam asetat daun tumbuhan tembelekan 2. Sampel batang A : larutan sari kloroform-asam asetat batang tumbuhan tembelekan 3. Sampel bunga A : larutan sari kloroform-asam asetat bunga tumbuhan tembelekan 4. Sampel buah A : larutan sari kloroform-asam asetat buah tumbuhan tembelekan 5. Sampel akar A : larutan sari kloroform-asam asetat akar tumbuhan tembelekan 6. Sampel daun B : larutan sari metanol-kloroform-asam asetat daun tumbuhan
tembelekan
7. Sampel batang B : larutan sari metanol-kloroform-asam asetat batang tumbuhan tembelekan
8. Sampel bunga B : larutan sari metanol-kloroform-asam asetat bunga tumbuhan tembelekan
9. Sampel buah B : larutan sari metanol-kloroform-asam asetat buah tumbuhan tembelekan
10. Sampel akar B : larutan sari metanol-kloroform-asam asetat akar tumbuhan tembelekan
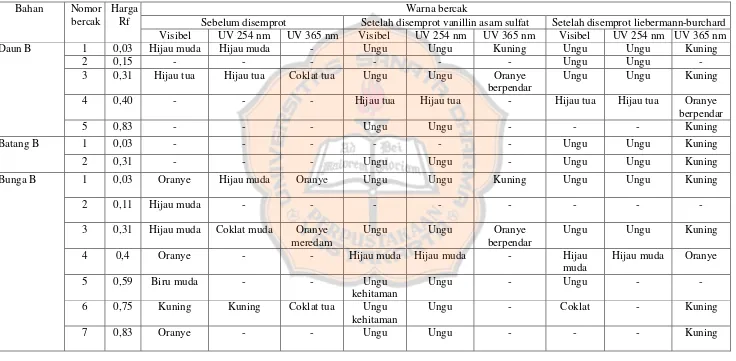
2. Identifikasi saponin
Senyawa golongan saponin dapat dideteksi dengan pereaksi Liebermann Burchard dan vanilin asam sulfat yang kemudian dipanaskan pada suhu 100ºC selama 5-10 menit. Digunakan pereaksi Liebermann Burchard karena terjadi reaksi substitusi H pada gugus hidroksi dari glikosida saponin dengan gugus CH3COO-, menyebabkan energi yang dibutuhkan untuk melakukan transisi
elektron ke tingkat eksitasi menjadi lebih kecil dan panjang gelombang menjadi lebih panjang, sehingga intensitas warna meningkat, dan digunakan vanilin asam sulfat karena dapat mengoksidasi senyawa dengan melepaskan air sehingga akan terjadi perpanjangan ikatan rangkap terkonjugasi yang akan mengintensifkan pembentukan warna. Bercak menunjukkan hasil positif apabila setelah disemprot terbentuk bercak berwarna biru atau biru hijau untuk saponin steroida dan berwarna merah, merah muda, atau ungu untuk saponin triterpenoida (Fransworth, 1996).
48
Tabel IV. Data kromatogram pemeriksaan saponin tumbuhan tembelekan dengan fase diam silika gel GF 254 dan fase gerak kloroform:metanol (95:5) v/v
Bahan Nomor
bercak
Harga Rf
Warna bercak
Sebelum disemprot Setelah disemprot vanillin asam sulfat Setelah disemprot liebermann-burchard
Visibel UV 254 nm UV 365 nm Visibel UV 254 nm UV 365 nm Visibel UV 254 nm UV 365 nm
Daun B
1 0,03 Hijau muda Hijau muda - Ungu Ungu Kuning Ungu Ungu Kuning
2 0,15 - - - Ungu Ungu -
3 0,31 Hijau tua Hijau tua Coklat tua Ungu Ungu Oranye
berpendar
Ungu Ungu Kuning
4 0,40 - - - Hijau tua Hijau tua - Hijau tua Hijau tua Oranye
berpendar
5 0,83 - - - Ungu Ungu - - - Kuning
Batang B 1 0,03 - - - Ungu Ungu Kuning
2 0,31 - - - Ungu Ungu - Ungu Ungu Kuning
Bunga B 1 0,03 Oranye Hijau muda Oranye Ungu Ungu Kuning Ungu Ungu Kuning
2 0,11 Hijau muda - - - -
3 0,31 Hijau muda Coklat muda Oranye
meredam
Ungu Ungu Oranye
berpendar
Ungu Ungu Kuning
4 0,4 Oranye - - Hijau muda Hijau muda - Hijau
muda
Hijau muda Oranye
5 0,59 Biru muda - - Ungu
kehitaman
Ungu - Ungu - -
6 0,75 Kuning Kuning Coklat tua Ungu
kehitaman
Ungu - Coklat - Kuning
49
Buah B 1 0,03 Hijau muda Ungu oranye Ungu Ungu Kuning Ungu Ungu Kuning
2 0,15 - - - Ungu Ungu -
3 0,31 Hijau muda Hijau muda Oranye
meredam
Ungu Ungu Oranye
berpendar
Ungu Ungu
4 0,4 - - - Hijau muda Hijau muda - Hijau
muda
<