PEMODELAN DAN SIMULASI REAKTOR UNGGUN TETAP UNTUK REAKSI DEKOMPOSISI KATALITIK METANA
TESIS
FEBRINI CESARINA 0906496056
FAKULTAS TEKNIK
PROGRAM STUDI TEKNIK KIMIA DEPOK
HALAMAN JUDUL
PEMODELAN DAN SIMULASI REAKTOR UNGGUN TETAP UNTUK REAKSI DEKOMPOSISI KATALITIK METANA
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh gelar MAGISTER TEKNIK KIMIA
FEBRINI CESARINA 0906496056
FAKULTAS TEKNIK
PROGRAM STUDI TEKNIK KIMIA DEPOK
Puji dan syukur kehadirat Allah SWT yang telah memberikan rahmat dan karunia-Nya yang besar sehingga laporan tesis ini dapat dibuat. Penulisan laporan tesis ini dilakukan dalam rangka memenuhi salah satu syarat untuk mencapai gelar Magister Teknik Program Studi Teknik Kimia pada Fakultas Teknik Universitas Indonesia. Pada halaman ini, penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada semua pihak yang telah membantu, yaitu kepada:
1. Dr. rer. nat. Ir. Yuswan Muharam, M.T., selaku dosen pembimbing yang telah begitu banyak meluangkan waktu, tenaga dan pikiran serta memberikan dukungan dan kesabaran.
2. Dr. Ir. Praswasti PDK Wulan, M.T., yang telah membantu dalam memberikan saran penelitian dan juga selaku tim penguji.
3. Kamarza Mulia, Ph.D dan Prof. Dr. Ir. Slamet, M.T, selaku tim penguji. 4. Ir. Mahmud Sudibandriyo, MSc., Ph.D, selaku pembimbing akademis
yang telah mendukung dan membantu dalam hal akademik. 5. Seluruh dosen-dosen Teknik Kimia UI.
6. Seluruh angkatan magister teknik kimia 2009 yang telah menemani kuliah bersama.
7. Seluruh keluarga besar, terutama kepada Mama, Papa, A'Abie, dan Ni'Rasti yang telah senantiasa memberikan semangat dan dorongan.
8. Calon keluarga baru-ku, Yay, T'Meity, Om'Mency, dan Remmy. 9. Mas Sriyono dan Mba Yanti.
10.Semua pihak yang tak bisa penulis sebutkan satu persatu yang juga telah memberikan banyak bantuan.
Terakhir, penulis juga memohon maaf yang sebesar-besarnya terhadap semua kesalahan baik dalam penulisan laporan tesis ini, maupun terhadap perkataan yang kurang berkenan. Semoga laporan tesis ini dapat bermanfaat bagi perkembangan ilmu pengetahuan. Amin.
Depok, 11 Januari 2012 Penulis
Nama : FEBRINI CESARINA Program Studi : TEKNIK KIMIA
Judul : PEMODELAN DAN SIMULASI REAKTOR UNGGUN TETAP
UNTUK REAKSI DEKOMPOSISI KATALITIK METANA Dekomposisi katalitik metana merupakan salah satu metode yang paling sering digunakan dalam memproduksi carbon nanotube (CNT). Penggunaan reaktor unggun tetap untuk reaksi dekomposisi katalitik metana cukup banyak diminati karena desainnya yang sederhana dan ekonomis. Agar kinerja reaktor yang optimal dapat diperoleh, perlu dilakukan serangkaian uji coba terhadap pengaruh dari berbagai kondisi operasi melalui pemodelan dan simulasi. Pada penelitian ini, dibentuk suatu pemodelan dan simulasi reaktor unggun tetap untuk reaksi dekomposisi katalitik dengan memvariasikan berbagai parameter operasi yang dapat mempengaruhi kinerja reaktor. Konversi metana dan yield hidrogen yang dapat dicapai pada saat reaksi 60 menit adalah sebesar 34.4% dan 42.7%. Kenaikan pada tekanan, laju alir, komposisi umpan dan radius partikel akan memperkecil konversi dan yield, sementara kenaikan pada temperatur umpan berlaku sebaliknya. Kondisi operasi yang memberikan konversi dan yield terbesar, yaitu 43.3% dan 51.5%, adalah pada saat temperatur umpan sebesar 1023 K dengan radius partikel sebesar 0.10 mm.
Kata kunci:
Pemodelan reaktor unggun tetap, dekomposisi katalitik metana, carbon nanotube dan model pertumbuhan carbon nanotube.
Name : FEBRINI CESARINA
Study Program : MASTER OF CHEMICAL ENGINEERING
Title : MODELLING AND SIMULATION OF FIXED BED
REACTOR FOR CATALYTIC DECOMPOSITION OF METHANE REACTION
Catalytic decomposition of methane (CDM) is one of the most popular method used in producing carbon nanotube (CNT). The use of fixed bed reactor in catalytic reaction is common for its simple design and low prices. In order to get an optimal condition to the reactor, observing which parameters gives influence most to the reactor is needed to be done by modelling and simulation. This thesis is proposed a modelling and simulation of fixed bed reactor for catalytic decomposition of methane by varying the values of operating parameters which influence the reactor performance. The methane conversion dan hydrogen yield obtained at 60 minutes reaction are 34.4% dan 42.7%. The increasing feed pressure, velocity, particle radius and composition decrease conversion and yield significantly, while the decreasing feed temperature results in opposite. An optimal condition obtained when using feed temperatur at 1023 K and radius particle at 0.10 mm, which gives highest conversion and yield, 43.3% and 51.5% in result.
Keywords:
Modelling of fixed bed reactor, catalytic decomposition of methane, carbon nanotube and growth modelling of carbon nanotube.
HALAMAN JUDUL ... i
HALAMAN PERNYATAAN ORISINALITAS ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS ... v
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR GAMBAR ... xi
DAFTAR TABEL ... xiii
DAFTAR SIMBOL ... xiv
BAB 1 PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Rumusan Masalah ... 2 1.3 Tujuan Penelitian ... 2 1.4 Batasan Penelitian ... 2 1.5 Sistematika Penulisan ... 3
BAB 2 TINJAUAN PUSTAKA ... 5
2.1 Carbon Nanotube ... 5
2.2 Reaksi Dekomposisi Katalitik Metana ... 6
2.2.1 Katalis ... 7
2.2.2 Kondisi Operasi ... 8
2.3 Kinetika Pertumbuhan Carbon Nanotube [4]... 8
2.4 Reaksi Katalitik di Permukaan ... 11
2.5 Reaktor Katalitik Unggun Tetap ... 13
2.6 Pemodelan dan Simulasi ... 14
2.7 Aplikasi Comsol ... 17
BAB 3 METODE PENELITIAN... 20
3.1 Diagram Penelitian ... 20
3.2 Prosedur Penelitian ... 20
3.2.1 Studi Literatur ... 20
3.2.2 Pengembangan Model Matematik... 21
3.2.3 Pembuatan Geometri dalam Comsol ... 21
3.2.4 Penyusunan Model dalam Comsol ... 21
3.2.5 Verifikasi Model ... 21
3.2.6 Simulasi ... 22
3.2.7 Analisa... 22
BAB 4 PEMODELAN REAKTOR ... 23
4.1 Pemodelan Skala Reaktor ... 23
4.2 Pemodelan Lapisan Film (Antar Fasa) ... 28
4.2.1 Neraca Massa Lapisan Film ... 28
4.2.2 Neraca Energi Lapisan Film... 28
4.3 Pemodelan Skala Partikel ... 29
4.3.1 Neraca Massa Skala Partikel ... 29
4.3.2 Neraca Energi Skala Partikel ... 30
4.4 Kondisi Batas ... 31
4.4.1 Kondisi Batas Skala Reaktor ... 31
4.4.2 Kondisi Batas Skala Partikel ... 32
4.5 Parameter Perpindahan ... 32
4.5.1 Koefisien Difusi (DAB, De) ... 33
4.5.2 Koefisien Perpindahan Massa (kc) ... 34
4.5.3 Kecepatan Interstisi (u) ... 34
4.5.4 Konduktivitas Termal (k) ... 35
4.5.5 Koefisien Perpindahan Panas (hp) ... 36
4.5.6 Kapasitas Panas (Cp) ... 36
4.5.7 Densitas () ... 37
4.5.8 Viskositas () ... 37
4.6 Pemodelan dengan Comsol Multiphysics 3.5 ... 38
BAB 5 HASIL SIMULASI ... 39
5.1 Hasil Simulasi ... 39
5.1.1 Profil Konsentrasi ... 40
5.1.2 Profil Temperatur ... 44
5.1.3 Profil Tekanan ... 45
5.1.4 Konversi dan Yield ... 46
5.2 Pengaruh Berbagai Parameter Proses ... 47
5.2.1 Pengaruh Tekanan Umpan ... 48
5.2.2 Pengaruh Suhu Umpan ... 49
5.2.3 Pengaruh Laju Alir Umpan ... 51
5.2.4 Pengaruh Komposisi Umpan... 52
5.2.5 Pengaruh Panjang Reaktor ... 54
5.2.6 Pengaruh Radius Partikel ... 55
BAB 6 PENUTUP ... 58 6.1 Kesimpulan ... 58 6.2 Saran ... 58 DAFTAR REFERENSI ... 59 LAMPIRAN ... 63 L.1 Inisialisasi ... 63 L.2 Pembuatan Geometri ... 65
L.4.2 Skala Partikel ... 70
L.5 Penentuan Kondisi Batas ... 72
L.5.1 Skala Reaktor ... 72
L.5.2 Skala Partikel ... 74
L.6 Meshing ... 76
L.7 Penghitungan Solusi Persamaan ... 76
Gambar 2.1. Mekanisme pertumbuhan CNT. [10] ... 9
Gambar 2.2. Beberapa kemungkinan reaksi dekomposisi pada methane cracking. [10] ... 10
Gambar 2.3. Tahapan reaksi katalitik. [11] ... 11
Gambar 2.4. Difusi melalui lapisan batas [11]. ... 12
Gambar 2.5. Klasifikasi Model Reaktor Unggun Tetap (Iordanidis, 2002)... 14
Gambar 2.6. Tampilan depan aplikasi Comsol Multiphysics. ... 18
Gambar 3.1. Diagram Alir Penelitian. ... 20
Gambar 4.1. Kontrol Volume Skala Reaktor [13]. ... 24
Gambar 4.2. Kontrol Volume Skala Partikel [13]... 29
Gambar 5.1. Profil Konsentrasi CH4 di Sepanjang Reaktor pada t=60 menit. ... 40
Gambar 5.2. Profil Konsentrasi CH4 di Katalis pada t=60 menit. ... 41
Gambar 5.3. Profil Konsentrasi CH4 Arah Radial di Katalis saat x=0.1, pada t=60 menit. ... 41
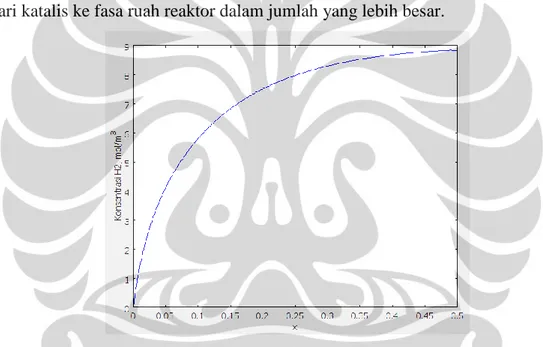
Gambar 5.4. Profil Konsentrasi H2 di Sepanjang Reaktor pada t=60 menit. ... 42
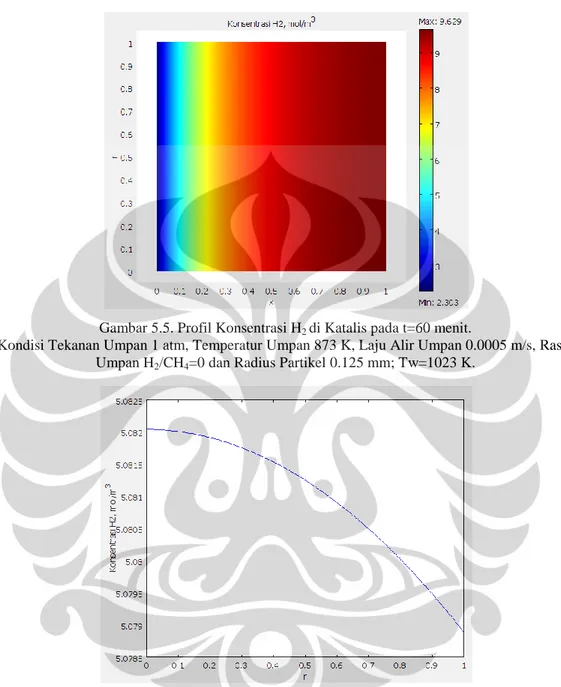
Gambar 5.5. Profil Konsentrasi H2 di Katalis pada t=60 menit. ... 43
Gambar 5.6. Profil Konsentrasi H2 Arah Radial di Katalis saat x=0.1, pada t=60 menit. ... 43
Gambar 5.7. Profil Konsentrasi Karbondi Katalis pada t=60 menit. ... 44
Gambar 5.8. Profil Temperatur di Sepanjang Reaktor pada t=60 menit. ... 45
Gambar 5.9. Profil Temperatur di Katalis pada t=60 menit. ... 45
Gambar 5.10. Profil Tekanan di Sepanjang Reaktor pada t=60 menit. ... 46
Gambar 5.11. (a) Konversi CH4 dan (b) Yield H2 di Akhir Reaktor pada t=60 menit. ... 47
Gambar 5.12. Konversi CH4 di Sepanjang Reaktor untuk Tekanan Umpan yang Berbeda. ... 48
Gambar 5.13. Yield H2 di Sepanjang Reaktor untuk Tekanan yang Berbeda. ... 49
Gambar 5.14. Konversi CH4 di Sepanjang Reaktor untuk Suhu Umpan yang Berbeda. ... 50
Gambar 5.15. Yield H2 di Sepanjang Reaktor untuk Suhu Umpan yang Berbeda. ... 50
Gambar 5.17. Yield H2 di Sepanjang Reaktor untuk Laju Alir Umpan yang
Berbeda. ... 52 Gambar 5.18. Konversi CH4 di Sepanjang Reaktor untuk Komposisi Umpan yang
Berbeda. ... 53 Gambar 5.19. Yield H2 di Sepanjang Reaktor untuk Komposisi Umpan yang
Berbeda. ... 53 Gambar 5.20. Konversi CH4 di Sepanjang Reaktor untuk Panjang Reaktor yang
Berbeda. ... 54 Gambar 5.21. Yield H2 di Sepanjang Reaktor untuk Panjang Reaktor yang
Berbeda. ... 55 Gambar 5.22. Konversi CH4 di Sepanjang Reaktor untuk Radius Partikel yang
Berbeda. ... 56 Gambar 5.23. Yield H2 di Sepanjang Reaktor untuk Radius Partikel yang Berbeda.
Tabel 1. Perbandingan berbagai kinerja reaktor untuk produksi CNT. ... 13 Tabel 2. Nilai Berbagai Parameter Operasi... 39
Ci = konsentrasi spesi i mol/m
T = temperatur K
P = tekanan Pa
= pentak-dimensi -
u = kecepatan m/s
Ap = luas permukaan partikel per satuan volume 1/m
DAB = difusi campuran m2/s
De = difusi efektif m2/s
kc = koefisien perpindahan massa m/s
k = konduktivitas termal W/m.K
hP = koefisien perpindahan panas W/m2.K
Cp = kapasitas panas J/kg.K
Mr = molekular relatif kg/mol
= densitas kg/m3
= viskositas kg/m.s
= porositas bed -
L = panjang reaktor m
rr = radius reaktor m
z = posisi arah aksial di reaktor m
rp = radius partikel m
r = posisi arah radial di katalis m
Re = bilangan Reynold -
Sh = bilangan Sherwood -
Sc = bilangan Schmidt -
Nu = bilangan Nusselt -
Pr = bilangan Prandtl -
H = entalpi reaksi J/mol
Ri,p = laju reaksi spesi i di partikel mol/m3.s
R = konstanta gas J/mol.K
1.1 Latar Belakang
Kemajuan teknologi nanokarbon selama dekade terakhir telah melahirkan suatu produk bernilai tinggi, yaitu nanokarbon bentuk tubular atau yang dikenal sebagai Carbon Nanotube (CNT). Keberadaan CNT mulai dilirik di berbagai industri karena struktur dan sifatnya yang unik, seperti berkekuatan tinggi melebih baja, keras seperti intan dan ringan seperti alumunium. Aplikasi CNT pada industri besar meliputi industri otomotif dan semikonduktor, bahkan dengan metode sintesa tertentu, CNT dapat berperan sebagai penyimpan H2 dengan
kemurnian yang tinggi.
Diawal penemuannya, CNT disintesis dengan menggunakan metode arc discharge pada temperatur operasi di atas 2000C. Namun seiring dengan berkembangnya zaman, tuntutan akan metode dengan kebutuhan energi yang rendah pada temperatur yang rendah pun dibutuhkan. Salah satunya yaitu reaksi dekomposisi katalitik metana atau Catalytic Decomposition of Methane (CDM). Reaksi yang memecah metana menjadi hidrogen (H2) dan karbon (C) ini mampu
menghasilkan hidrogen dengan kemurnian tinggi dan materi karbon dalam bentuk CNT yang juga bermutu tinggi. Selain itu, reaksi ini juga membutuhkan kebutuhan energi yang cukup rendah sebesar 75 kJ/mol pada temperatur yang lebih rendah dibandingkan arc discharge, dengan persamaan reaksi sebagai berikut
CH4 → C + 2H2 ; ∆H298 = +75 kJ/mol
Untuk memproduksi CNT melalui reaksi dekomposisi katalitik metana membutuhkan katalis yang berfungsi sebagai tempat tumbuhnya CNT. Penggunaan Ni-Cu-Al sebagai katalis mulai banyak dikembangkan karena memberikan konversi dan yield yang besar. Nikel dipilih sebagai inti aktif karena memiliki solubilitas yang tinggi, sementara penambahan promoter tekstural Alumunium (Al) dan promoter struktural Tembaga (Cu) dilakukan dalam usaha mencegah terjadinya sintering dan menurunkan titik leleh Nikel.
Pada reaksi-reaksi yang bersifat katalitik, reaktor unggun tetap masih menjadi pilihan karena desainnya yang ekonomis dengan konversi dan yield yang cukup besar. Agar kinerja reaktor yang optimal dapat dicapai, dibutuhkan serangkaian uji coba terhadap parameter operasi, baik dari segi kinetika reaksi maupun fenomena perpindahan. Namun uji coba yang dilakukan di laboratorium membutuhkan waktu dan biaya yang tidak sedikit. Oleh karena itu, dibutuhkan pemodelan dan simulasi yang dapat merepresentasikan kondisi asli di reaktor selama proses reaksi.
Dalam penelitian ini, dilakukan pemodelan dan simulasi reaktor unggun tetap untuk reaksi dekomposisi katalitik metana yang mengacu pada kinetika reaksi JW Snoeck, 1997, pada rentang temperatur 550-750C, dimana karbon menghasilkan bentuk CNT. Simulasi dilakukan dengan mengubah nilai dari berbagai parameter operasi untuk mengetahui parameter mana yang paling mempengaruhi proses sehingga kinerja reaktor yang optimal dapat dicapai.
1.2 Rumusan Masalah
Berdasarkan latar belakang seperti yang telah dijelaskan sebelumnya maka rumusan masalah pada penelitian ini adalah "Bagaimana memodelkan reaktor unggun tetap untuk reaksi dekomposisi katalitik metana serta berbagai kondisi operasi yang dapat mempengaruhi jalannya proses?"
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah
Memperoleh model matematis reaktor unggun tetap yang sesuai untuk reaksi dekomposisi katalitik metana.
Menganalisa pengaruh dari berbagai kondisi operasi terhadap kinerja reaktor unggun tetap.
1.4 Batasan Penelitian
Batasan dari penelitian ini adalah
1. Reaktor yang digunakan adalah unggun tetap bentuk tubular dengan metana sebagai sumber karbon dan Ni-Cu-Al sebagai katalis berpori. 2. Suhu umpan divariasikan antara 550C sampai dengan 750C. 3. Tekanan umpan divariasikan antara 1 atm sampai dengan 3 atm.
4. Rasio umpan H2/CH4 divariasikan antara 0 sampai dengan 3.
5. Model ditinjau dari dua sisi yaitu fasa gas pada reaktor dan fasa padat pada katalis.
6. Reaksi terjadi di permukaan pori katalis, yaitu lapisan batas antara fasa gas dengan fasa padat.
7. Model dibuat berdasarkan model heterogen satu dimensi arah aksial pada reaktor dan arah radial pada katalis.
8. Model satu dimensi arah aksial pada reaktor selanjutnya ditransformasi ke bentuk tak berdimensi untuk mempermudah proses scale-up.
9. Sistem pada model bersifat dinamik, yaitu bergantung pada fungsi waktu atau transient, dan bersifat non-isotermal.
10.Model meliputi neraca massa, energi dan momentum yang diselesaikan secara simultan dengan mempertimbangkan pengaruh difusi dan konveksi arah aksial pada reaktor dan difusi arah radial pada partikel serta reaksi kimia yang terjadi pada lapisan batas.
11.Kinetika pada model menggunakan kinetika JW Snoeck (1997). 12.Neraca momentum pada model menggunakan persamaan Ergun. 13.Kinerja reaktor yang di analisa adalah konversi metana (CH4) dan
yield hidrogen (H2).
14.Simulasi model pada komputer menggunakan aplikasi Comsol Multiphysics versi 3.5.
1.5 Sistematika Penulisan
Sistematika penulisan pada penelitian ini adalah:
BAB 1 PENDAHULUAN
Berisi latar belakang, rumusan masalah, tujuan penelitian, batasan penelitian dan sistematika penulisan.
BAB 2 TINJAUAN PUSTAKA
Berisi studi literatur untuk mencari berbagai materi yang berkaitan dengan teori-teori dasar yang digunakan selama penelitian dan dijadikan sebagai rujukan dalam penulisan.
Berisi diagram alir penelitian dan penjelasan mengenai diagram alir serta langkah-langkah yang dilakukan selama penelitian.
BAB 4 PEMODELAN REAKTOR
Berisi penurunan model matematis reaktor unggun tetap dan langkah-langkah pengerjaan dalam aplikasi Comsol yang digunakan selama penelitian.
BAB 5 HASIL SIMULASI
Berisi analisa terhadap hasil simulasi dari berbagai variasi nilai parameter-parameter yang ditinjau selama penelitian.
BAB 6 KESIMPULAN
Berisi kesimpulan dari penelitian yang dilakukan berikut saran-saran yang perlu diperbaiki.
Pada bab ini akan dibahas mengenai teori-teori dasar yang berkaitan dengan penelitian yang dilakukan.
2.1 Carbon Nanotube
Munculnya nanoteknologi pada tahun 1952 membawa perubahan besar bagi pengembangan produk masa kini. Kontribusinya bagi dunia bukan hanya sebatas teori penunjang pada disiplin ilmu semata melainkan sebagai kunci dalam meningkatkan taraf hidup manusia. Nanoteknologi meliputi segala hal yang berkaitan dengan materi berskala nanometer [1], salah satunya yaitu nanokarbon.
Nanokarbon adalah materi padat yang tersusun atas ikatan rantai karbon bentuk bulat atau pipa dalam skala nanometer. Beberapa jenis nanokarbon yang menarik untuk dilihat adalah fullerene dan nanotube atau CNT. Meski berukuran kecil, nanokarbon memberikan pengaruh besar terutama di bidang industri karena keunggulan sifat dan karakteristik yang dimilikinya.
Penggunaan nanokarbon sebagai bahan baku industri dapat menurunkan biaya produksi sekaligus menaikkan laba perusahaan dengan mutu hasil produk yang lebih baik. Dalam pembuatan rangka mobil pada industri otomotif misalnya, nanokarbon sebagai elemen penguat pada bahan komposit mampu menggantikan logam dengan kelebihannya seperti mudah dibentuk, berkekuatan tinggi dan lebih ringan. Dari sifatnya yang mudah dibentuk mempermudah proses pembuatan rangka mobil dalam menghasilkan bentuk sesuai dengan desain yang diinginkan sementara kekuatannya yang tinggi membantu dalam aspek keselamatan penumpang. Selain itu, sifatnya yang ringan dapat menurunkan massa mobil sehingga beban kerja mobil menjadi lebih ringan dan menghemat bahan bakar. Contoh lain dari pemanfaat nanokarbon juga terdapat pada pembuatan memori komputer. Saat ini, kapasitas memori komputer mencapai angka terabit atau seribu kali lebih besar dari kapasitas yang dapat dicapai sebelumnya yang berarti bahwa proses penyimpanan berbagai jenis data dalam perangkat komputer menjadi jauh lebih mudah dan efisien apalagi di era yang serba berbasis komputer ini.
Kemajuan teknologi di bidang nanokarbon tidak lepas dari sejarah awal ditemukannya unsur karbon itu sendiri. Diawali oleh penemuan atom karbon yang merupakan unsur bebas paling sederhana dari karbon; grafit dan intan yang merupakan kumpulan beberapa atom karbon bebas yang membentuk suatu struktur dengan ciri khas tertentu; nanokarbon dalam bentuk bola atau yang disebut sebagai fullerene; hingga ditemukannya nanokarbon bentuk tabung atau yang dikenal dengan CNT. Dari sekian banyaknya produk nanokarbon ini, yang paling menonjol adalah CNT. CNT pertama kali ditemukan oleh seorang peneliti asal Jepang yaitu Sumio Iijima melalui evaporasi Arc Discharge menggunakan wadah berisi argon bertekanan 100 torr. [2]. CNT tersusun atas lembaran grafit berbentuk tubular beralaskan fullerene yang terbelah dua, dengan diameter luar sebesar 4-30 nm dan diameter paling dalam sebesar 2.2 nm serta panjang sebesar 1 µm. Berdasarkan jumlah wall yang dimilikinya, CNT terbagi menjadi 2 yaitu Single-Wall Carbon Nanotube SWCNT dan Multi-Wall Carbon Nanotube MWCNT. SWCNT berukuran lebih kecil sekitar 0.4-3 nm, sementara MWCNT berukuran 1.4-100 nm [3].
Seiring berjalannya waktu, teknologi produksi CNT pun berkembang. Saat ini, salah satu metode sintesis CNT yang cukup sering digunakan adalah reaksi dekomposisi katalitik metana. Dibandingkan dengan metode Arc Discharge, reaksi dekomposisi katalitik metana beroperasi pada temperatur yang lebih rendah yaitu sekitar 550C-750C.
2.2 Reaksi Dekomposisi Katalitik Metana
Dekomposisi katalitik metana atau Catalytic Decomposition of Methane (CDM) merupakan reaksi pemutusan ikatan C-H pada metana menjadi unsur hidrogen (H2) dan karbon (C) melalui persamaan reaksi [4]
CH4 → C + 2H2 ; ∆H298 = +75 kJ/mol
yang bersifat endotermis dengan kebutuhan energi sebesar 75 kJ/mol. Reaksi ini mampu mengkonversi metana menjadi produk hidrogen murni bebas polutan serta menghasilkan produk lain yang bernilai tinggi yaitu CNT. Karena rendahnya kebutuhan energi yang dibutuhkan oleh CDM, CDM pun sering kali dijadikan metode alternatif untuk Steam Methane Reforming (SMR) dalam hal mengkonversi metana. Berikut adalah reaksi SMR [5]
CH4 + H2O → CO + 3H2 ; ∆H298 = +206 kJ/mol
SMR ini biasanya diikuti oleh reaksi Water Gas Shift (WGS) yang mengubah CO menjadi CO2 melalui reaksi
CO + H2O → CO2 + H2 ; ∆H298 = -41 kJ/mol
sehingga untuk mengkonversi metana secara keseluruhan membutuhkan energi sebesar 165 kJ/mol. Kebutuhan energi ini merupakan dua kali lebih besar dibandingkan dengan kebutuhan energi pada CDM. Selain itu, pada SMR dihasilkan polutan CO dan CO2, sedangkan pada CDM murni bebas polutan,
sehingga akan lebih menguntungkan jika menggunakan CDM.
2.2.1 Katalis
Penggunaan logam sebagai katalis sering dipilih pada reaksi-reaksi yang bersifat heterogen dimana reaktan dan katalis memiliki fasa yang berbeda [6], yaitu metana dalam fasa gas (sebagai reaktan) dan katalis logam dalam bentuk padat. Katalis yang banyak digunakan untuk reaksi CDM adalah unsur-unsur logam transisi seperti kobalt (Co), besi (Fe) dan nikel (Ni). Dari ketiga logam tersebut, yang paling sering digunakan untuk memproduksi CNT adalah Ni. Hal ini dikarenakan titik leleh yang dimiliki Ni (1455ºC) lebih rendah dibandingkan Fe (1537ºC) dan Co (1495ºC) sehingga dapat memperkecil suhu pembentukan CNT [7]. Selain itu, Ni juga memiliki solubilitas dan laju difusi karbon yang tinggi sehingga berpengaruh terhadap laju pembentukan karbon yang mengarah pada CNT.
Pada saat katalis logam (Ni) dialiri fluida (CH4) pada suhu tinggi secara
terus menerus, maka akan terjadi suatu proses yang disebut sebagai sintering. Sintering menyebabkan diameter katalis menjadi lebih besar sehingga dapat merusak mutu dari CNT yang dihasilkan. Untuk mengatasi hal tersebut, maka ditambahkan promoter tekstural Alumina (Al) yang mencegah terjadinya sintering, serta penambahan promoter struktural Cuprum (Cu) yang bertujuan untuk menurunkan titik leleh logam Ni agar suhu operasi tidak terlalu tinggi.
2.2.2 Kondisi Operasi
2.2.2.1Tekanan
Reaksi CDM beroperasi pada tekanan rendah atau tekanan atmosferik. Hal ini dapat ditinjau melalui prinsip Le Chatelier dimana jika tekanan operasi diperbesar, maka kesetimbangan akan bergerak ke arah koefisien reaksi yang lebih kecil atau dalam hal ini adalah metana. Reaksi bergerak ke arah metana akan membuat konversi metana menjadi lebih kecil, sehingga tekanan operasi pada CDM diusahakan tidak terlalu tinggi. 2.2.2.2Temperatur
Reaksi CDM umumnya beroperasi pada temperatur yang cukup tinggi, yaitu sekitar 550-1200ºC. Semakin tinggi temperatur operasi CDM, maka semakin cepat pula metana akan terdekomposisi sehingga membuat konversi menjadi besar. Namun penggunaan temperatur yang tinggi ini dapat mengakibatkan katalis lebih mudah mengalami sintering dan deposit karbon yang terbentuk semakin banyak sehingga deaktivasi katalis semakin cepat terjadi. Selain itu, temperatur operasi dari CDM juga mempengaruhi morfologi dari jenis karbon yang dihasilkan. Temperatur rendah akan menghasilkan Carbonnano Filament (CNF), temperatur tinggi akan menghasilkan Bamboo-shaped Nanocarbon, sementara CNT berada pada temperatur sedang.
Berdasarkan penelitian yang dilakukan S.P. Chai, 2004, CNT tumbuh pada temperatur antara 550-700ºC [8]. Sementara itu, pada penelitian yang dilakukan PPDK Wulan, 2011, CNT dapat tumbuh pada temperatur sekitar 550-750ºC [9]. Hal ini menandakan tidak ada temperatur yang mutlak untuk CNT agar dapat tumbuh, namun dapat dipastikan melalui selang temperatur tertentu. Oleh karena itu, pada penelitian ini CNT diasumsikan tumbuh pada temperatur sebesar 550-750ºC, atau sekitar 823-1023 K.
2.3 Kinetika Pertumbuhan Carbon Nanotube [4]
Studi kinetika pertumbuhan CNT berawal dari studi kinetika pertumbuhan CNF yang mencakup mekanisme pertumbuhan karbon filamen pada permukaan
katalis [9]. Secara umum, mekanisme pertumbuhan berbagai jenis nanokarbon memiliki tahapan yang sama, dimulai dari tahap dekomposisi, difusi eksternal ke permukaan katalis sampai difusi internal ke dalam partikel logam katalis. Perbedaan baru terjadi pada tahap nukleasi yang berperan besar dalam menentukan bentuk nanokarbon yang dihasilkan.
Menurut JW Snoeck, model kinetika nanokarbon mencakup dua aspek yaitu: (1) reaksi permukaan dan (2) formasi karbon filamen [10] seperti yang terlihat pada gambar 2.1. Mekanisme produksi CNT berawal dari reaksi pemecahan metana yang berlangsung pada permukaan katalis ketika metana menyentuh permukaan logam dari katalis. Tahap ini dikategorikan sebagai tahap (1) reaksi permukaan dimana metana terpecah menjadi karbon dan hidrogen. Hidrogen dalam bentuk gas terlepas ke udara sementara karbon larut atau teradsorpsi kedalam partikel logam. Adanya perbedaan solubilitas antara karbon dan permukaan logam-gas katalis menyebabkan karbon berdifusi masuk kedalam partikel logam, dimana konsentrasi karbon lebih besar dibandingkan dengan permukaan logam-gas disekitarnya. Karbon terus berdifusi masuk memenuhi partikel logam sampai partikel logam dalam keadaan jenuh. Partikel logam yang jenuh ini selanjutnya akan mengawali tahap nukleasi dimana terjadi presipitasi karbon pada permukaan partikel logam yang kemudian tumbuh menjadi CNT. Tahap ini dikategorikan sebagai tahap (2) formasi karbon filamen.
Gambar 2.1. Mekanisme pertumbuhan CNT. [10]
Pada kondisi yang sebenarnya di permukaan katalis, tempat dimana terjadinya reaksi dekomposisi, metana tidak selalu langsung terpecah menjadi satu atom karbon (C) dan dua molekul gas hidrogen (H2), melainkan dapat melalui
Gambar 2.2. Beberapa kemungkinan reaksi dekomposisi pada methane cracking. [10]
Tahap dekomposisi metana pada gambar tersebut dapat direpresentasikan melalui persamaan-persamaan reaksi berikut ini:
Reaksi adsorpsi di permukaan:
CH4 + I ↔ CH4-I KCH4
CH4-I + I ↔ CH3-I + H-I rds/k+M, kM
CH3-I + I ↔ CH2-I + H-I K3|
CH2-I + I ↔ CH-I + H-I K4|→Kr
CH-I + I ↔ C-I + H-I K5|
2H + I ↔ H2 + I 1/KH
Disolusi/segregasi:
C-I ↔ CNi,T + I 1/KC
Difusi karbon pada Nikel: CNi,T → CNi,r
Presipitasi/disolusi karbon:
CNi,T ↔ Cw Kw
Dalam penelitian tersebut, JW Snoeck menghasilkan laju reaksi untuk pembentukan karbon melalui persamaan:
4 4 2 2 4 4 ' 2 M M CH CH " H r C,M 2 3/ 2 H CH CH " r k k K p p K r 1 1 p K p K dimana 4 CH p dan 2 H
p adalah tekanan parsial metana dan hidrogen yang bergantung pada tekanan dan fraksi mol masing-masing spesi, sementara
4
' "
M CH M r
k , K , k , dan K adalah parameter-parameter kinetika yang bergantung pada suhu reaksi dengan persamaan sebagai berikut:
1. kM 23444 exp
59033
RT 2.
4 CH 143 K 0.21exp RT 3. '
M 60522 k 4389 exp RT 4. K"r 1.109 10 exp 8
137314RT
Model persamaan kinetika tersebut selanjutnya digunakan untuk menghitung laju reaksi yang terjadi di partikel katalis pada penelitian ini.
2.4 Reaksi Katalitik di Permukaan
Reaksi CDM tergolong reaksi heterogen yang melibatkan dua fasa yaitu fasa gas dengan padat. Katalis dalam fasa padat dialiri oleh reaktan dalam fasa gas pada suhu yang tinggi menyebabkan terjadinya reaksi katalitik di daerah yang dekat sekali dengan permukaan antarfasa gas-padat yaitu permukaan luar katalis. Ada dua jenis katalis yang digunakan pada reaksi heterogen yaitu katalis berpori dan katalis tidak berpori. Pada katalis berpori, reaksi terjadi di dalam pori yang merupakan sisi aktif dari katalis, sehingga untuk memperbesar kemungkinan terjadinya reaksi, luas permukaan pori harus diperbesar. Namun demikian, tidak semua katalis membutuhkan luas permukaan pori yang diperbesar untuk mempercepat laju reaksi, karena ada beberapa katalis yang memang sudah cukup aktif sehingga penambahan luas permukaan pori akan menjadi sia-sia [11].
(b)
Berdasarkan ukuran porinya, katalis berpori terbagi menjadi dua, yaitu katalis dengan pori yang besar (poro catalyst) dan katalis dengan pori yang kecil (molecular sieves). Pada reaksi gas dengan padat, katalis dengan pori yang kecil lebih sering digunakan karena memiliki selektivitas yang tinggi. Di dalam pori ini, terjadi serangkaian proses seperti adsorpsi, reaksi permukaan, dan desorpsi yang merupakan bagian dari tahapan reaksi katalitik. Tahapan proses ini direpresentasikan pada gambar 2.3 dengan penjelasan sebagai berikut:
1. Difusi reaktan (spesi A) dari fasa gas (ruah) ke permukaan eksternal partikel katalis.
2. Difusi reaktan dari permukaan eksternal katalis ke permukaan internal katalis melalui pori katalis.
3. Adsorpsi reaktan di permukaan internal katalis.
4. Reaksi permukaan oleh molekul reaktan yang teradsorpsi di permukaan internal katalis menjadi produk (spesi B).
5. Desorpsi produk dari permukaan internal katalis.
6. Difusi produk dari permukaan internal katalis ke permukaan eksternal katalis melalui pori katalis.
7. Difusi produk dari permukaan eksternal katalis ke ruah.
Besarnya laju reaksi sangat bergantung pada difusi yang terjadi di permukaan. Difusi yang lambat di permukaan katalis akan memperlambat laju reaksi secara keseluruhan pada reaksi yang berjalan cepat sehingga dikatakan bahwa difusi melimitasi laju reaksi.
Gambar 2.4. Difusi melalui lapisan batas [11].
Agar difusi tidak melimitasi laju reaksi, maka difusi reaktan ke permukaan katalis harus dibuat besar. Salah satu cara untuk memperbesar difusi adalah dengan mempercepat laju alir fluida. Seperti yang terlihat pada gambar 2.4, pada
laju alir yang rendah (gambar kiri), lapisan batas yang terbentuk di permukaan katalis akan lebih tebal () dibandingkan dengan laju alir yang tinggi (gambar kanan). Lapisan batas yang tebal ini menghasilkan tahanan difusi yang cukup besar sehingga membutuhkan waktu yang lebih lama untuk reaktan berdifusi masuk ke dalam pori katalis yang dapat memperlambat jalannya reaksi dan memperkecil laju reaksi. Sebaliknya pada laju alir yang tinggi, lapisan batas yang terbentuk lebih tipis sehingga tahanan difusi reaktan masuk ke pori katalis lebih kecil dan laju reaksi menjadi besar.
2.5 Reaktor Katalitik Unggun Tetap
Reaktor unggun tetap merupakan salah satu jenis reaktor kontinu katalitik berbentuk tubular yang berisi partikel katalis berukuran seragam, tersusun acak dan rapat serta diam. Reaktor yang biasa digunakan untuk reaksi heterogen fasa gas dengan padat ini banyak diminati di kalangan industri karena desainnya yang sederhana dan ekonomis. Adapun beberapa masalah yang dapat timbul pada reaktor ini adalah terjadinya penurunan tekanan (pressure drop) yang cukup besar di sepanjang reaktor akibat laju alir yang cukup rendah dan terbentuknya hotspot dimana terjadi perbedaan yang cukup besar antara suhu katalis dengan suhu reaktor sehingga dapat mempengaruhi kinerja reaktor. Meski demikian, konversi pada reaktor unggun tetap masih lebih besar dibandingkan reaktor unggun terfluidisasi. Hal ini dapat dilihat pada tabel 1 berikut dimana reaktor unggun tetap memberikan konversi sebesar 47% sementara reaktor unggun terfluidisasi memberikan konversi yang lebih kecil yaitu sekitar 20%.
Tabel 1. Perbandingan berbagai kinerja reaktor untuk produksi CNT.
Jenis Reaktor Konversi Penurunan Usia Katalis Aglomerasi
Tekanan dan Penyumbatan
Spouted Bed 7% Rendah - Tidak
Fluidized Bed 20% Rendah - Tidak
Fixed Bed 47% Tinggi 1 Jam Ya
Pada penelitian lain yang dilakukan oleh Sharif Hussein Sharif Zein, 2004, menggunakan reaktor unggun tetap dengan diameter sebesar 12.7 mm dan
panjang sebesar 600 mm, konversi metana yang didapat di akhir reaksi selama 1 jam adalah sebesar 48.67% pada katalis Ni/SiO2. Sementara ittu, untuk reaksi
selama 1 jam ke atas pada katalis yang berbeda seperti Ni/Al2O3 dapat terjadi
deaktivasi katalis yang lebih cepat.
2.6 Pemodelan dan Simulasi
Di dalam reaktor unggun tetap, serangkaian fenomena-fenomena fisika dan kimia terjadi baik di fasa gas (reaktor) maupun di fasa padat (katalis). Fenomena-fenomena tersebut selanjutnya direpresentasikan ke dalam model matematis berdasarkan hukum konservasi massa, energi dan momentum dalam bentuk sistem persamaan diferensial. Suatu model dapat dikatakan baik jika model tersebut dapat menjelaskan berbagai hal yang terjadi di dalam reaktor secara akurat, meliputi fenomena perpindahan dan kinetika reaksi. Namun pada kenyataannya sangat sulit untuk mendapatkan model tersebut, karena semakin akurat suatu model, semakin banyak parameter-parameter yang terlibat, sehingga pencarian solusi pun akan semakin rumit. Akibatnya, penyederhanaan model melalui berbagai asumsi-asumsi menjadi pilihan yang tak dapat dihindari.
Iordanidis, 2002, mengklasifikasikan model reaktor unggun tetap secara umum menjadi dua, yaitu model pseudo-homogen (satu fasa) dan heterogen (dua fasa), seperti yang terlihat pada gambar 2.5 berikut. Model ini berdasarkan pada model kontinuum yang dapat memperhitungkan keikutsertaan hambatan yang terjadi di lapisan batas antar fasa gas dengan padat.
Berikut adalah klasifikasi dari model kontinuum: 1. Model 1 Dimensi: Pseudo-homogen
Model pseudo-homogen 1D adalah model paling sederhana yang hanya memperhitungkan fenomena perpindahan secara konvektif arah aksial. Pada model ini diasumsikan sifat aliran yang sama di setiap arah radial sehingga disebut sebagai model aliran sumbat atau plug flow. Berikut adalah persamaan modelnya:
Neraca massa: i i dC u R (C, T) dz Neraca energi: w p T w t 4U dT u C R (C, T) (T T ) dz d
2. Model 1 Dimensi: Heterogen
Sama halnya pada model pseudo-homogen 1D, model heterogen 1D hanya memperhitungkan fenomena perpindahan yang terjadi secara konvektif arah aksial. Namun perbedaannya, model ini memperhitungkan hambatan yang terjadi di antar fasa. Berikut adalah persamaan modelnya:
Fasa fluida: i c p s,i i dC u k a (C C ) dz p p p s dT u C h a (T T) dz Fasa padat: c p s,i i i s s k a (C C ) R (C , T ) p p s T s s h a (T T)R (C , T )
3. Model 1 Dimensi: Heterogen dengan Memperhitungkan Difusi Aksial Model ini sama seperti model heteregon 1D yang ditambah dengan memperhitungkan fenomena perpindahan yang terjadi secara difusi arah aksial. Berikut adalah persamaan modelnya:
2 i i ez 2 c p s,i i dC d C u D k a (C C ) dz dz 2 w p ez 2 p p s w t 4U dT d T u C h a (T T) (T T ) dz dz d Fasa padat: c p s,i i i s s k a (C C ) R (C , T ) p p s T s s h a (T T)R (C , T ) 4. Model 2 Dimensi: Pseudo-homogen
Model ini sama seperti pada model pseudo-homogen 1D yang ditambah dengan memperhitungkan fenomena perpindahan yang terjadi secara radial. Berikut adalah persamaan modelnya:
Neraca massa: er i i i D C C u r R (C, T) z r r r Neraca energi: er p T T T u C r R (C, T) z r r r
5. Model dengan Memperhitungkan Hambatan Intrapartikel Katalis
Sesuai dengan namanya, model ini memperhitungkan perpindahan yang terjadi di dalam katalis. Artinya, fenomena saat reaktan berdifusi masuk ke dalam pori katalis ikut diperhitungkan. Tidak seperti di fasa ruah, fenomena yang terjadi di katalis hanya berupa perpindahan secara molekular, bukan secara aliran, sehingga hanya difusi intrapartikel saja yang diperhitungkan. Berikut adalah persamaan modelnya:
i c p s,i i dC u k a (C C ) dz w p w p p s t 4U dT u C (T T ) h a (T T) dz d ep i p i i p D C R (C , T) ep p T p T R (C, T)
6. Model dinamik
Sedikit berbeda dengan model-model sebelumnya, model dinamik memperhitungkan faktor waktu ke dalam model. Pengembangan dari model dinamik dapat digunakan untuk melihat permasalahan seperti: operasi reaktor secara dinamik, reaktor start up dan shut down serta stabilitas proses. Model dinamik ini terbentuk dengan menambahkan suku
i C t
ke model neraca massa dan
T t
ke model neraca energi.
Pada penelitian ini, reaktor unggun tetap akan dimodelkan secara dinamik dengan fasa gas dimodelkan dalam satu dimensi seperti pada model aliran sumbat karena pengaruh dari arah radial dianggap sangat kecil sehingga dapat diabaikan, sementara fasa padat dimodelkan dalam arah radial.
2.7 Aplikasi Comsol
Setelah model reaktor telah dibentuk, tahap berikut yang harus dihadapi adalah metode penyelesaian yang digunakan untuk mencari solusi dari parameter-parameter yang terlibat dalam model. Pada tahap ini biasanya sangat sulit dalam mencari solusi analitik akibat banyaknya parameter yang terlibat dalam model sehingga dibutuhkan solusi numerik yang mendekati solusi analitik tersebut. Keakuratan solusi numerik dalam mendekati solusi analitik diukur dengan menggunakan parameter error yang menghitung selisih atau seberapa dekat solusi numerik dengan solusi analitiknya. Artinya, semakin kecil nilai error maka semakin dekat solusi numerik dengan solusi analitiknya sehingga model pun semakin akurat.
Dalam mendapatkan solusi yang akurat, maka pemilihan metode dalam menyelesaikan persamaan model matematis perlu diperhatikan, karena masing-masing metode dapat memberikan hasil yang berbeda-beda dan terkadang metode yang satu merupakan penyempurna dari metode yang lain. Pada model sangat sederhana yang memiliki orde yang kecil, penghitungan manual dengan metode penyelesaian sederhana seperti Euler dan Runge-Kutta mungkin masih dapat dilakukan. Namun untuk model yang kompleks, penghitungan secara manual saja
tidak cukup, sehingga perlu dibantu dengan perangkat lunak komputer untuk memudahkan pencarian solusi. Ada berbagai hal yang perlu diperhatikan dalam melakukan pencarian solusi menggunakan perangkat lunak komputer, mulai dari pemilihan aplikasi yang digunakan, metode penyelesaian (solver) yang terdapat pada aplikasi tersebut, serta faktor-faktor lain seperti tebakan nilai awal, diskritisasi dan konvergensi.
Comsol Multiphysics merupakan salah satu aplikasi yang digunakan untuk memodelkan dan menyelesaikan berbagai masalah sains dan teknik yang menghasilkan bentuk sistem persamaan diferensial parsial [12]. Pemodelan sistem persamaan diferensial pada Comsol dilakukan dengan tampilan yang user friendly sehingga memudahkan pengguna dalam memasukkan modelnya sendiri, menentukan kondisi awal dan kondisi batas, serta memilih fenomena-fenomena yang akan diikutsertakan dalam model. Selain itu, teknik yang digunakan dalam menyelesaikan model pun sudah dilakukan secara bersambungan (coupling) dan bersamaan (simultan).
Gambar 2.6. Tampilan depan aplikasi Comsol Multiphysics.
Penggunaan Comsol akan lebih efektif dan efisien jika tahapan-tahapan pembuatan model dalam Comsol diketahui dengan baik. Adapun langkah-langkah yang digunakan dalam memodelkan dan mensimulasikan model dalam Comsol adalah sebagai berikut:
1. Membuat geometri pada awal menu Geometry.
2. Menentukan fenomena-fenomena fisik yang terlibat beserta parameter yang akan dicari solusinya pada menu Multiphysics.
3. Memasukkan model matematis ke dalam geometri yang telah dibuat pada menu Subdomain Settings.
4. Memasukkan nilai-nilai koefisien dan variabel yang terlibat pada menu Coefficients dan Global Expression.
6. Melakukan proses diskritisasi dengan menentukan jumlah titik diskrit yang digunakan pada menu Meshing.
7. Menentukan metode apa yang akan digunakan untuk menyelesaikan model pada menu Solver Parameter.
8. Melakukan proses running pada menu Solve dan Post Processing untuk membuat kurva dan lain sebagainya yang diperlukan untuk menganalisa hasil.
Pada bab ini akan dibahas mengenai metodologi penelitian yang digunakan dalam penelitian.
3.1 Diagram Penelitian
Berikut adalah diagram alir penelitian yang digunakan:
Studi literatur
Pengembangan model matematik: Kinetika Reaksi, Pemodelan Reaktor
Pembuatan geometri dalam Comsol
Penyusunan model dalam Comsol
Verifikasi model Running Simulasi Analisa Ya Tidak
Gambar 3.1. Diagram Alir Penelitian. 3.2 Prosedur Penelitian
Adapun prosedur yang dilakukan untuk mencapai tujuan akhir dari penelitian ini adalah sebagai berikut:
3.2.1 Studi Literatur
Studi literatur bertujuan untuk memahami segala bentuk permasalahan yang berkaitan dengan penelitian, mencakup teori-teori dasar mengenai reaksi
dekomposisi katalitik metana, CNT, katalis Ni-Cu-Al, kinetika reaksi, reaktor unggun tetap, penurunan model matematik serta penerapan aplikasi Comsol untuk reaktor unggun tetap.
3.2.2 Pengembangan Model Matematik
Pengembangan model matematik meliputi pembentukan persamaan diferensial matematik reaktor unggun tetap untuk produksi cnt dengan mempertimbangkan fenomena fisika (perpindahan) dan kimia (kinetika reaksi) yang terjadi di sepanjang reaktor, serta menentukan batasan-batasan permasalahan yang akan diteliti agar mempermudah dalam pencarian solusi.
3.2.3 Pembuatan Geometri dalam Comsol
Pembuatan geometri model merupakan salah satu hal yang harus diperhatikan ketika pertama kali membuka Comsol. Pada penelitian ini, ada dua geometri yang harus dibuat, yaitu gambar satu dimensi berupa garis lurus yang mewakili geometri reaktor dan gambar dua dimensi berupa segiempat untuk geometri katalis.
3.2.4 Penyusunan Model dalam Comsol
Penyusunan model dalam Comsol meliputi pemasukan persamaan diferensial matematik ke dalam geometri yang telah dibuat sebelumnya beserta kondisi batas dan nilai awal yang digunakan, diikuti dengan pemasukan konstanta dan variabel seperti parameter perpindahan, koefisien difusi, konduktivitas termal dan lain sebagainya.
3.2.5 Verifikasi Model
Setelah pembuatan geometri dan penyusunan model matematis dilakukan, langkah selanjutnya adalah verifikasi model. Verifikasi model merupakan tahap penentu apakah model yang sudah dimasukkan dapat di run atau tidak. Jika iya, maka lanjut ke langkah selanjutnya yaitu simulasi. Namun jika tidak, perlu dilakukan peninjauan ulang pada langkah sebelumnya yaitu penyusunan model.
Kegagalan yang terjadi pada verifikasi model diakibatkan oleh berbagai faktor seperti kesalahan dalam pemasukan nilai konstanta dan variabel, tanda (+) atau (-) pada persamaan matematis, satuan unit, atau faktor diskritisasi solusi
seperti tebakan nilai awal dan jumlah diskritisasi yang digunakan sehingga solusi tidak mencapai konvergensi.
3.2.6 Simulasi
Simulasi dilakukan dengan mengubah nilai-nilai parameter operasi seperti suhu, tekanan, laju alir dan lain sebagainya. Variasi berbagai nilai parameter ini dimaksudkan untuk mengetahui parameter-parameter apa saja yang berpengaruh terhadapat kinerja reaktor sehingga kondisi yang optimal dapat ditentukan.
3.2.7 Analisa
Setelah uji coba berbagai variasi nilai terhadap parameter-parameter yang ingin diketahui pengaruhnya, dilakukan analisa terhadap hasil yang terbentuk untuk diketahui selanjutnya parameter mana yang memberikan pengaruh yang paling signifikan terhadap kinerja reaktor, didukung dengan adanya teori-teori yang telah dijelaskan pada bab dua.
Pada bab ini akan dibahas mengenai penurunan model unggun tetap reaktor serta langkah-langkah pengerjaannya dalam Comsol Multiphysics 3.5.
4.1 Pemodelan Skala Reaktor
Pada pemodelan skala reaktor terdapat tiga jenis neraca yang ditulis dalam bentuk persamaan matematis, yaitu persaamaan neraca massa, neraca energi dan neraca momentum. Ketiga persamaan ini merepresentasikan fenomena-fenomena perpindahan yang terjadi di skala reaktor. Berikut penjelasannya.
4.1.1 Neraca Massa Skala Reaktor
Dalam pembentukan neraca massa skala reaktor berlaku hukum kekekalan massa sebagai berikut:
Laju Laju Laju Laju Akumulasi Massa Massa Masuk Massa Keluar Generasi Massa
Di skala reaktor, fenomena-fenomena yang terjadi meliputi perpindahan aliran secara konveksidan perpindahan aliran secara molekular atau difusi. Perpindahan aliran secara konveksi terjadi karena adanya fluida yang mengalir di fasa ruah dengan kecepatan sebesar u, sementara difusi terjadi karena adanya gradien konsentrasi fluida yang terbentuk di lapisan film (antar fasa gas - padat). Pada pemodelan ini konveksi dan difusi arah radial diabaikan, sehingga laju massa masuk dan laju massa keluar hanya dikontribusi dari konveksi dan difusi arah aksial saja:
Laju Laju Laju
Akumulasi Massa Massa
Massa Masuk Keluar
Laju Laju Massa Massa Masuk Keluar Konveksi aksial Laju Generasi
Massa Transfer massa di lapisan film
Difusi aksial
Selanjutnya, persamaan neraca tersebut akan diterapkan melalui kontrol volume yang dilakukan pada reaktor unggun tetap pada Gambar 4.1, yang dievaluasi pada arah aksial posisi z dengan interval sebesar z, dimana posisi awal reaktor berada
di titik z. Reaktor memiliki radius sebesar rr dengan luas penampang reaktor
sebesar 2
r
r
dan panjang reaktor sebesar z.
Gambar 4.1. Kontrol Volume Skala Reaktor [13].
Dari kontrol volume tersebut, laju akumulasi massa dari spesi i yang masuk ke reaktor merupakan perubahan konsentrasi spesi i, Ci, per satuan waktu yang
diakumulasikan di sepanjang reaktor, yaitu 2 i r
C r z
t
, sedangkan laju generasi
massa merupakan akumulasi dari laju massa yang terbentuk di sepanjang reaktor. Pada pemodelan ini, laju massa yang terbentuk di sepanjang reaktor diwakili oleh transfer massa di lapisan film, mengingat reaksi hanya terjadi di partikel katalis, bukan di skala reaktor. Untuk laju massa masuk di penampang awal reaktor merupakan laju alir yang masuk pada penampang awal reaktor dikalikan dengan luas penampang awal reaktor, yaitu r u Cr2 i z, demikian juga halnya dengan laju massa keluar di penampang akhir reaktor. Sehingga dari kontrol volume ini diperoleh persamaan-persamaan sebagai berikut:
Laju akumulasi massa: 2 i
r C r z t
Laju massa masuk karena konveksi di z: r u Cr2 i z Laju massa keluar karena konveksi di z+∆z: 2
r i z z
r u C
Laju massa masuk karena difusi di z: r Jr2 i z Laju massa keluar karena difusi di z+∆z: 2
r i z z
r J
Laju generasi massa: 2
,
r c p i s i
r zk A C C
dengan rr adalah radius reaktor (m), z adalah posisi arah aksial di reaktor, Ci
di permukaan partikel (mol·m-3), u adalah kecepatan interstisi (m·s-1), Ji adalah
fluks massa spesi i di reaktor (mol·m-2s-1), kc adalah koefisien transfer massa spesi
i di lapisan film (m·s-1) dan Ap adalah rasio luas per volume partikel (m-1).
Substitusi persamaan-persamaan tersebut ke persamaan neraca massa maka:
2 2 2 2 2 2 , i r r i z r i z z r i z r i z z r c p i s i C r z r u C r u C r J r J t r zk A C C Bagi semua suku dengan 2
r
r z
, kemudian susun ulang menjadi:
,
i i i i i z z z z z z c p i s i u C u C J J C k A C C t z z Untuk ∆z→0, persamaan sekarang menjadi:
,
i i i c p i s i C C J u k A C C t z z Menurut hukum difusi Fick’s, fluks massa yang terjadi di sepanjang reaktor diberikan oleh i i C J D z
dengan D adalah koefisien difusi spesi i di skala reaktor.
Substitusi hukum difusi Fick's tersebut ke persamaan sebelumnya maka diperoleh persamaan neraca massa sebagai berikut:
2
, 2
Suku 4 Suku 1 Suku 2 Suku 3
i i i c p i s i C C C u D k A C C t z z dimana
Suku 1: adalah Akumulasi Massa Suku 2: adalah Aksial Konvektif Suku 3: adalah Aksial Difusif
Suku 4: adalah Transfer Massa Lapisan Film
Selanjutnya untuk kepentingan proses Scale Up, persamaan neraca massa tersebut akan diubah ke dalam bentuk tak berdimensi, dengan memasukkan bilangan tak berdimensi ω ke dalam model, yang merupakan rasio antara panjang reaktor pada model dengan panjang reaktor yang sebenarnya. Pentak-dimensi ω ini bertujuan
untuk memudahkan dalam memvariasikan panjang reaktor, tanpa harus mengubah panjang dari geometri reaktor yang telah dibuat. Sehingga bentuk akhir dari persamaan neraca massa setelah dilakukan pentak-dimensi adalah sebagai berikut:
2 , 2 i i i c p i s i C C C u D k A C C t z z dengan model actual ; L L Lmodel adalah panjang reaktor pada model, dan Lactual adalah
panjang reaktor yang sebenarnya.
4.1.2 Neraca Energi Skala Reaktor
Sama halnya pada pemodelan neraca massa skala reaktor, dalam pembentukan neraca energi skala reaktor berlaku hukum kekekalan energi sebagai berikut:
Laju Laju Laju Laju Akumulasi Energi Energi Masuk Energi Keluar Generasi Energi
Fenomena-fenomena yang terjadi di skala reaktor untuk neraca energi meliputi konveksi dan konduksi pada arah aksial. Sehingga setelah dilakukan kontrol volume terhadap reaktor unggun tetap, diperoleh persamaan neraca energi sebagai berikut:
2 2 2 2 2 2 r p r p z r p z z r z r z z r p p s T r z C r u C T r u C T t r q r q r zh A T T dengan T adalah temperatur di skala reaktor (K), Ts adalah temperatur di
permukaan partikel (K), adalah densitas, Cp adalah kapasitas panas, q adalah
fluks energi dan hp adalah koefisien transfer panas di lapisan film.
Bagi semua suku dengan 2
r
r z
, kemudian susun ulang menjadi:
z z z z z z p p p p s T T q q T C u C h A T T t z z Untuk ∆z→0, maka:
p p p p s T T q C u C h A T T t z z T q k z
dengan k adalah konduktivitas termal spesi i di skala reaktor.
Substitusi hukum tersebut ke persamaan sebelumnya maka persamaan neraca energi menjadi:
2 2 Suku 4 Suku 3 Suku 1 Suku 2 p p p p s T T T C u C k h A T T t z z dimanaSuku 1: adalah Akumulasi Energi Suku 2: adalah Aksial Konvektif Suku 3: adalah Aksial Konduktif
Suku 4: adalah Transfer Energi Lapisan Film
Selanjutnya sama seperti pada neraca massa skala reaktor, setelah dilakukan pentak-dimensi ω, maka bentuk akhir dari persamaan neraca energi menjadi:
2 2 p p p p s T T T C u C k h A T T t z z .Model ini adalah model dimana sistem dalam keadaan non-adiabatik atau tanpa pemanas. Berikut adalah model lengkap dimana sistem dalam keadaan adiabatik
2 2 p p p p s r g w T T T C u C k h A T T A h T T t z z dengan Ar adalah luas selimut reaktor, hg adalah koefisien perpindahan panas
reaktor dan Tw adalah temperatur dinding reaktor. 4.1.3 Neraca Momentum Skala Reaktor
Neraca momentum skala reaktor dimodelkan melalui persamaan Ergun yang menghitung penurunan tekanan yang terjadi di sepanjang reaktor. Model neraca momentum Navier Stokes untuk tiap-tiap katalis tidak dilakukan karena akan menyulitkan dalam pencarian solusi akibat banyaknya persamaan neraca momentum yang terbentuk.
Bentuk persamaan Ergun setelah dilakukan pentak-dimensi adalah sebagai berikut:
3 150 1 1 1 1.75 c p p dP u u dx g d d dengan adalah porositas bed, dp adalah diameter katalis dan adalah viskositas. 4.2 Pemodelan Lapisan Film (Antar Fasa)
Interaksi antara skala reaktor dan skala partikel dihubungkan oleh suatu lapisan yang disebut sebagai lapisan film (atau lapisan batas), yang terbentuk karena adanya perbedaan fasa antara fasa gas di skala reaktor dan fasa padat di skala partikel. Di lapisan film ini, terjadi perpindahan massa ataupun energi yang besarnya dihitung oleh koefisien perpindahan massa atau energi yang bergantung pada tahanan yang terbentuk di lapisan film. Tahanan ini menyebabkan terjadi perbedaan konsentrasi maupun temperatur di skala reaktor dengan konsentrasi maupun temperatur di skala partikel yang berujung pada timbulnya gradien konsentrasi maupun gradien temperatur.
4.2.1 Neraca Massa Lapisan Film
Neraca massa di lapisan film dimodelkan melalui korelasi antara perpindahan massa antar fasa skala reaktor dengan fluks massa di permukaan partikel dalam bentuk persamaan sebagai berikut:
, , Suku 1 Suku 2 i s c p i s i p e dC k A C C A D dr dimanaSuku 1: adalah Perpindahan Massa Antar Fasa (Skala Reaktor) Suku 2: adalah Fluks Difusif (Skala Partikel)
De: Koefisien Difusi Efektif di Partikel.
4.2.2 Neraca Energi Lapisan Film
Sama halnya pada neraca massa di lapisan film, neraca energi di lapisan film dimodelkan melalui korelasi antara perpindahan energi antar fasa skala reaktor dengan fluks energi di permukaan partikel dalam bentuk persamaan sebagai berikut:
Suku 1 Suku 2 s p p s p dT h A T T A k dr dimana
Suku 1: adalah Perpindahan Energi Antar Fasa (Skala Reaktor) Suku 2: adalah Fluks Konduktif (Skala Partikel)
4.3 Pemodelan Skala Partikel
Setelah fluida melewati lapisan film pada permukaan luar partikel, fluida berdifusi ke dalam pori partikel yang berperan sebagai tempat berlangsungnya reaksi. Pada pemodelan skala partikel ini, terdapat dua persamaan neraca yang diperhitungkan, yaitu persamaan neraca massa dan persamaan neraca energi.
4.3.1 Neraca Massa Skala Partikel
Sama halnya pada skala reaktor, pada skala partikel berlaku hukum kekekalan massa sebagai berikut:
Laju Laju Laju Laju Akumulasi Massa Massa Masuk Massa Keluar Generasi Massa
Oleh karena partikel berada dalam fasa padat, maka fenomena perpindahan yang terjadi hanya berupa difusi arah radial melalui pori-pori partikel saja, sehingga:
Laju Laju Laju Laju
Akumulasi Massa Massa Generasi
Massa Masuk Keluar Massa Transfer massa di lapisan film
Difusi radial
Hukum kekekalan massa ini selanjutnya diterapkan ke dalam kontrol volume yang dilakukan pada partikel berbentuk bola dengan jari-jari sebesar r dan dievaluasi sebesar r, seperti pada Gambar 4.2 berikut.
Gambar 4.2. Kontrol Volume Skala Partikel [13].
Dari kontrol volume tersebut, diperoleh persamaan neraca massa sebagai berikut:
, 2 2 2 2 , , , 4 i p 4 i p 4 i p 4 i p r r r C r r r J r J r r R t
dengan r adalah posisi arah radial di partikel, Ci,p adalah konsentrasi spesi i di
partikel (mol·m-3), Ji,p adalah fluks massa spesi i di partikel (mol·m-2s-1), Ri,p
adalah laju reaksi spesi i di partikel (mol·m-3s-1).
Bagi semua suku dengan 4r, kemudian susun ulang menjadi:
2
2
, , , 2 2 , i p i p i p r r r i p r J r J C r r R t r
Untuk ∆z→0, maka:
2
, , 2 2 , i p i p i p r J C r r R t r
Menurut hukum difusi Fick’s, fluks massa di partikel diberikan oleh persamaan: , , i p i p e C J D r
dengan De adalah koefisien difusi efektif di partikel.
Substitusi persamaan tersebut ke persamaan sebelumnya, maka bentuk akhir dari persamaan neraca massa skala partikel adalah:
, 2 , , 2 1 i p i p e i p C C D r R t r r r
dengan rp adalah radius partikel (m). 4.3.2 Neraca Energi Skala Partikel
Sama seperti pada neraca massa skala partikel, pada neraca energi skala partikel berlaku hukum kekekalan energi:
Laju Laju Laju Laju Akumulasi Energi Energi Masuk Energi Keluar Generasi Energi
Fenomena yang terjadi di skala partikel untuk neraca energi hanya meliputi konduksi pada arah radial. Sehingga setelah dilakukan kontrol volume terhadap partikel, diperoleh persamaan neraca energi sebagai berikut:
2 2 2 2 , 4 p p 4 p p 4 j j p r r r T r r C r q r q r r H R t
dengan Tp adalah temperatur di skala partikel (K) ), adalah densitas, Cp adalah
kapasitas panas, qp adalah fluks energi skala partikel.
2
2
2 2 , p p p r r r p j j p r q r q T C r r H R t r
Untuk ∆z→0, maka:
2 2 2 , p p p j j p r q T C r r H R t t
Menurut hukum Fourier, fluks energi di partikel:
p p p T q k z
dengan kp adalah konduktivitas termal partikel.
Substitusi persamaan tersebut ke persamaan sebelumnya, maka bentuk akhir dari persamaan neraca massa skala partikel adalah:
2 , 2 2 1 p p p p j j p T T C k H R t r r
. 4.4 Kondisi BatasPada subbab ini akan dibahas mengenai kondisi-kondisi batas yang perlu diperhatikan dalam menyelesaikan persamaan-persamaan yang telah diuraikan sebelumnya.
4.4.1 Kondisi Batas Skala Reaktor
Terdapat dua kondisi batas untuk skala reaktor, yaitu kondisi batas di awal reaktor (yaitu pada saat z = 0) dan di akhir reaktor (yaitu pada saat z = L).
4.4.1.1Awal Reaktor (z = 0)
Ketika umpan mulai dialirkan ke dalam reaktor selama t waktu, maka pada posisi z = 0, kondisi umpan yang masuk adalah konstan. Artinya, besarnya konsentrasi pada posisi ini sama dengan besarnya konsentrasi umpan yang masuk ke dalam reaktor Ci,0, begitu juga halnya dengan temperatur yang sama dengan
besarnya temperatur umpan masuk T0. Sehingga, berlaku kondisi sebagai berikut:
Pada z = 0; Ci Ci,0 0 T T
4.4.1.2Akhir Reaktor (z = L)
Pada posisi di akhir reaktor, diasumsikan terjadi kondisi dimana sudah tidak ada lagi gradien konsentrasi maupun temperatur, sehingga:
Pada z = L; i 0 z L C z 0 z L T z
4.4.2 Kondisi Batas Skala Partikel
Sama seperti pada skala reaktor, terdapat dua kondisi batas untuk skala partikel, yaitu kondisi batas di pusat partikel (yaitu pada saat r = 0) dan di permukaan luar partikel (yaitu pada saat r = rp).
4.4.2.1Pusat Partikel (r = 0)
Di pusat partikel, diasumsikan terjadi kondisi dimana tidak ada lagi gradien konsentrasi maupun gradien temperatur, sehingga:
Pada r = 0; . 0 0 i p r C r 0 0 p r T r
4.4.2.2Permukaan Luar Partikel (r = rp)
Pada posisi di permukaan luar partikel, besarnya konsentrasi di partikel sama dengan besarnya konsentrasi di permukaan lapisan film Ci,s, demikian juga
halnya temperatur di permukaan luar partikel akan sama dengan besarnya temperatur di permukaan lapisan film Ts, sehingga:
Pada r = rp; Ci p, Ci s,
p s
T T
4.5 Parameter Perpindahan
Pada subbab ini akan diuraikan mengenai parameter-parameter perpindahan yang digunakan dalam pemodelan reaktor unggun tetap. Parameter-parameter ini meliputi koefisien difusi, koefisien perpindahan massa, kecepatan


![Gambar 2.4. Difusi melalui lapisan batas [11].](https://thumb-ap.123doks.com/thumbv2/123dok/1860501.2111152/27.892.171.772.335.1004/gambar-difusi-melalui-lapisan-batas.webp)