PENGARUH PEMBERIAN NAA DAN KINETIN TERHADAP PERUBAHAN GENETIK ORGAN DARI EKSPLAN BUNGA
BETINA KELAPA SAWIT (Elaeis guineensis Jacq.)
SKRIPSI
ILHAM PANGESTU 120805035
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2017
UNIVERSITAS SUMATERA UTARA
PENGARUH PEMBERIAN NAA DAN KINETIN TERHADAP PERUBAHAN GENETIK ORGAN DARI EKSPLAN BUNGA
BETINA KELAPA SAWIT (Elaeis guineensis Jacq.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
ILHAM PANGESTU 120805035
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2017
UNIVERSITAS SUMATERA UTARA
i
PERSETUJUAN
Judul : Pengaruh Pemberian NAA Dan Kinetin Terhadap Perubahan Genetik Organ Dari Eksplan Bunga Betina Kelapa Sawit (Elaeis guineensis Jacq.)
Kategori : Skripsi
Nama : Ilham Pangestu
Nomor Induk Mahasiswa : 120805035
Program Studi : Sarjana (S1) Biologi
Departemen : Biologi
Fakultas : Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Diluluskan di Medan, April 2017
Komisi Pembimbing :
Pembimbing 2, Pembimbing 1,
Dr. Saleha Hannum, M.Si. Dr. Suci Rahayu, M.Si.
NIP. 197108312000122001 NIP. 196506291992032002
Disetujui Oleh
Departemen Biologi FMIPA USU Ketua,
Dr. Saleha Hannum, M.Si.
NIP. 197108312000122001
UNIVERSITAS SUMATERA UTARA
ii
PERNYATAAN
PENGARUH PEMBERIAN NAA DAN KINETIN TERHADAP PERUBAHAN GENETIK ORGAN DARI EKSPLAN BUNGA BETINA
KELAPA SAWIT (Elaeis guineensis Jacq.)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, April 2017
Ilham Pangestu 120805035
UNIVERSITAS SUMATERA UTARA
iii
PENGHARGAAN
Alhamdulillahirabbil’alamin
Penulis ucapkan syukur kepada Allah SWT karena atas karunia dan kasih sayang- Nya, serta shalawat berangkaikan salam kepada Nabi Muhammad SAW sehingga penulis dapat menyelesaikan penelitian yang berjudul “Pengaruh NAA dan Kinetin terhadap Perubahan Genetik Organ dari Eksplan Bunga Betina Kelapa Sawit (Elaeis guineensis Jacq.)
Penelitian dan penulisan skripsi ini dapat diselesaikan dengan baik karena bantuan serta dukungan dari berbagai pihak. Pada kesempatan ini, penulis ingin menyampaikan terima kasih dan penghargaan setinggi-tingginya kepada Ayahanda Suriadi dan Ibunda Masrah, S.H. yang senantiasa dengan setulus hati memberikan cinta, kasih sayang dukungan dan doa kepada penulis. Kakak Hariani Ade Safitri dan Inda Ramadani serta adik Rachmad Ichsan selaku saudara/i penulis yang telah memberikan doa, keceriaan dan semangat.
Ucapan terima kasih tak terhingga penulis ucapkan kepada Ibu Dr. Suci Rahayu, M.Si. selaku dosen pembimbing I dan Ibu Dr. Saleha Hannum, M.Si.
selaku dosen pembimbing II yang telah memberikan bimbingan, arahan, waktu dan perhatiannya kepada penulis dalam menyelesaikan skripsi ini. Penulis juga menyampaikan ucapan terima kasih kepada Ibu Dr. Isnaini Nurwahyuni, M.Sc.
selaku dosen penguji I dan Ibu Dra. Nunuk Priyani, M.Sc. selaku dosen penguji II yang telah banyak memberikan kritik, saran dan masukan untuk kesempurnaan skripsi ini.
Ucapan terima kasih tak terhingga juga penulis ucapkan kepada Ibu Dr.
Hesti Wahyuningsih, M.Si. selaku dosen pembimbing akademik yang telah banyak memberikan arahan dan nasehat kepada penulis dalam menjalani perkuliahan.
Penulis juga menyampaikan ucapan terima kasih kepada Ibu Dr. Nursahara Pasaribu, M.Sc. selaku ketua Departemen Biologi FMIPA USU, staf pengajar Departemen Biologi FMIPA USU, staf pegawai Abangda Endra Raswin, Ibu Roslina Ginting, serta Ibu Nurhasni Muluk dan Siti Khadijah selaku Laboran di Departemen Biologi FMIPA USU atas segala bantuan dan kebaikan yang diberikan kepada penulis.
UNIVERSITAS SUMATERA UTARA
iv
Kepada sahabat seperjuangan Firda Novita, Dwi Febrina dan abangda Imam Aulia yang telah memberikan banyak bantuan, pengalaman dan keceriaan. Staf asisten LIDA USU, staf asisten Struktur Tumbuhan serta staf asisten Fisiologi dan Kultur Jaringan Tumbuhan FMIPA USU, teman seperjuangan Andrew, Desy, Henda, Cica, Fitri, Obi di Lab. Fisiologi dan Kultur Jaringan Tumbuhan dan seluruh sahabat stambuk 2012 (Agent of Change) yang telah mewarnai kehidupan penulis selama masa perkuliahan. Adik-adik stambuk 2013, 2014, 2015 terkhusus kepada Dhaifina Sabila atas dukungan dan doa yang diberikan selama ini kepada penulis.
Penulis juga mengucapkan terima kasih kepada semua pihak yang telah membantu secara langsung maupun tidak langsung atas selesainya penelitian ini.
Semoga skripsi ini bermanfaat bagi semua pihak.
Medan, April 2017
Penulis
UNIVERSITAS SUMATERA UTARA
v
PENGARUH PEMBERIAN NAA DAN KINETIN TERHADAP PERUBAHAN GENETIK ORGAN DARI EKSPLAN BUNGA
BETINA KELAPA SAWIT (Elaeis guineensis Jacq.)
ABSTRAK
Penelitian tentang Pengaruh NAA dan Kinetin terhadap Perubahan Genetik Organ dari Eksplan Bunga Betina Kelapa Sawit (Elaeis guineensis Jacq.) telah dilakukan dari bulan September 2015 sampai bulan Desember 2016 di Laboratorium Fisiologi dan Kultur Jaringan Tumbuhan Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara. Penelitian ini bertujuan untuk mengetahui pengaruh pemberian NAA dan Kinetin terhadap perubahan genetik organ dari eksplan bunga betina kelapa sawit (Elaeis guineensis Jacq.). Rancangan yang digunakan adalah rancangan acak lengkap (RAL) faktorial dua faktor dengan tiga taraf NAA (0 mg/L; 0,05 mg/L; dan 0,1 mg/L) dan tiga taraf Kinetin (0 mg/L;
0,1 mg/L dan 0,2 mg/L). Hasil analisis statistik menunjukkan bahwa NAA dan kinetin berpengaruh terhadap waktu organogenesis (p<0,05). Konsentrasi kinetin 0,1 mg/L memberikan pengaruh paling cepat terhadap waktu tumbuh organ. Inisiasi organ akar dan tunas yang paling baik pada media Y3 yang mengandung NAA dan kinetin (0,05 mg/L dan 0,1 mg/L) dan kinetin 0,1 mg/L. Analisis perubahan genetik dengan teknik SSR menunjukkan bahwa keempat primer SSR mampu mendeteksi terjadinya perubahan genetik sebesar 27% berdasarkan analisis data biner dari pita SSR dengan program NTSYS (Numerical Taxonomy and Multivariate System) versi 1.07.
Kata kunci: bunga betina, kelapa sawit, kinetin, NAA, perubahan genetik, SSR
UNIVERSITAS SUMATERA UTARA
vi
THE EFFECT OF NAA AND KINETIN ON MUTATION OF ORGANS FROM IMMATURE FEMALE INFLORESCENCES OF OIL PALM (Elaeis
guineensis Jacq.)
ABSTRACT
The study of The Effect of NAA and Kinetin on Mutation of Organs from Immature Female Inflorescences of Oil Palm (Elaeis guineensis Jacq.) has been done from September 2015 to November 2016 at Plant Tissue Culture Laboratory of Department Biology, Faculty Mathematics and Science, University of Sumatera Utara. The experiment used two factorial completely randomized design with three levels of NAA concentrations (0; 0,05; 0,1 mg/L) and three levels of Kinetin consentrations (0; 0,1; 0,2 mg/L). The statistical analysis showed that NAA and kinetin significantly affected the organ initiations (p<0,05). The fastest organ initiation was supplemented with 0,1 mg/L kinetin in Y3 medium. The best organs initiation were supplemented with NAA and kinetin (0,05 mg/L and 0,1 mg/L) and kinetin 0,1 mg/L in Y3 medium. SSR marker showed that all of SSR primer were able to detect the mutation of 27% based on NTSYS (Numerical Taxonomy and Multivariate System) program version 1.07.
Keywords: immature inflorescences, kinetin, mutation, NAA, oil palm, SSR
UNIVERSITAS SUMATERA UTARA
vii DAFTAR ISI
Halaman
Persetujuan i
Pernyataan ii
Penghargaan iii
Abstrak v
Abstract vi
Daftar Isi vii
Daftar Tabel ix
Daftar Gambar x
Daftar Lampiran xi
Bab 1. Pendahuluan
1.1. Latar Belakang 1
1.2. Permasalahan 2
1.3. Tujuan Penelitian 3
1.4. Hipotesis 3
1.5. Manfaat Penelitian 3
Bab 2. Tinjauan Pustaka
2.1. Tanaman Kelapa Sawit 4
2.2. Kultur Jaringan 5
2.3. Zat Pengatur Tumbuh 6
2.4. Kultur Jaringan Kelapa Sawit 8
2.5. Perubahan Genetik Kelapa Sawit 8
Bab 3. Metode Penelitian
3.1. Waktu dan Tempat 10
3.2. Prosedur Kerja 10
3.2.1. Sterilisai Eksplan 10
3.2.2. Induksi Kalus 11
3.2.3. Induksi Embrio 11
3.2.4. Induksi Organ 11
3.2.5. Prosedur Preparat Awetan 12
3.2.5.1. Fiksasi 12
3.2.5.2. Dehidrasi 12
3.2.5.3. Dealkoholisasi (Clearing) 12
3.2.5.4. Infiltrasi Parafin 13
3.2.5.5. Penanaman (Embedding) 13
3.2.5.6. Penyayatan (Section) 13
3.2.5.7. Defarafinisasi 14
3.2.5.8. Pewarnaan (Staining) 14
3.2.6. Analisis Histologi 14
3.2.7. Parameter Pengamatan 14
UNIVERSITAS SUMATERA UTARA
viii
3.2.8. Verifikasi Perubahan Genetik 15
3.2.8.1. Isolasi DNA 15
3.2.8.2. Uji Kualitas dan Kuantitas DNA 16 3.2.8.3. Amplifikasi DNA dengan Teknik SSR 16
3.3. Analisis Data 16
Bab 4. Hasil dan Pembahasan
4.1. Induksi Kalus dari Eksplan Bunga Betina Kelapa Sawit 17 4.2. Embriogenesis dari Eksplan Bunga Betina Kelapa
Sawit
18 4.3. Waktu Organogenesis dari Eksplan Bunga Betina
Kelapa Sawit
20
4.4. Inisiasi Tunas 21
4.5. Inisiasi Akar 22
4.6. Analisis Perubahan Genetik dari Eksplan Bunga Betina Kelapa Sawit
23
Bab 5. Kesimpulan dan Saran
5.1. Kesimpulan 27
5.2. Saran 27
Daftar Pustaka 28
Lampiran 33
UNIVERSITAS SUMATERA UTARA
ix
DAFTAR TABEL
Nomor
Tabel Judul Halaman
3.1. Nama Lokus, Motif Ulangan, Urutan Primer dan Suhu Annealing
16 4.1. Rata-rata Waktu Tumbuh Organ pada Beberapa Tingkat
Konsentrasi NAA dan Kinetin
20 4.2. Rata-rata Jumlah Tunas yang Muncul pada beberapa
Tingkat Konsentrasi NAA dan Kinetin
21 4.3. Rata-rata Jumlah Akar yang Muncul Bunga Betina
Kelapa Sawit pada Beberapa Tingkat Konsentrasi NAA dan Kinetin
23
UNIVERSITAS SUMATERA UTARA
x
DAFTAR GAMBAR
Nomor
Gambar Judul Halaman
2.1. Tanaman Kelapa Sawit 4
3.1. Bunga Betina Kelapa Sawit 10
4.1. Morfologi Kalus Embriogenik 17
4.2. Penampang Melintang Kalus Embriogenik 18
4.3. Morfologi Embrio Somatik 18
4.4. Penampang Melintang Embrio Somatik 19
4.5. Respon in vitro dari eksplan bunga betina kelapa sawit (Elaeis guineensis Jacq.)
20 4.6. Pola pita polimorfik DNA organ dari eksplan bunga betina
kelapa sawit hasil amplifikasi dengan primer SSR
24 4.7. Dendrogram kemiripan genetik organ dari eksplan bunga
betina kelapa sawit berdasarkan primer P1T14, P4T8, P4T10 dan P4T20b
26
UNIVERSITAS SUMATERA UTARA
xi
DAFTAR LAMPIRAN
Nomor
Lamp. Judul Halaman
1. Diagram Alir Tahapan Penelitian 33
2. Komposisi Media Y3 (Eeuwens, 1976) 34
3. Protokol Penggunaan GoTaq® Green Master Mix (Promega, USA)
35 4. Data Pengamatan Waktu Inisiasi Organ (Hari) 36
5. Data Pengamatan Jumlah Akar 38
6. Data Pengamatan Jumlah Tunas 40
7. Kualitas dan Kuantitas DNA Organ dari Eksplan Bunga Betina Kelapa Sawit pada Beberapa Tingkat Konsentrasi NAA dan Kinetin
41
8. Data biner dan matriks kemiripan genetik pita DNA hasil amplifikasi dengan primer P1T14, P4T8, P4T10 dan P4T20b
42
UNIVERSITAS SUMATERA UTARA
PENDAHULUAN
1.1. Latar Belakang
Kelapa sawit (Elaeis guineensis Jacq.) merupakan salah satu tanaman penghasil minyak nabati di Indonesia (Sianipar, 2008)dan memegang peranan penting untuk memenuhi kebutuhan minyak nabati dalam negeri, menghasilkan penerimaan negara terbesar dari sektor perkebunan (Toruan-Mathius et al., 2005) serta menggerakkan pembangunan (Sianipar, 2008). Oleh karena itu, Indonesia melakukan peningkatan produksi kelapa sawit dengan cara membuka lahan baru (Badrun, 2010). Pembukaan lahan baru berhubungan langsung dengan peningkatan bibit kelapa sawit yang dibutuhkan.
Ada beberapa upaya yang dapat dilakukan untuk peningkatan dan efisiensi produksi tanaman kelapa sawit, diantaranya yaitu dengan penggunaan bibit unggul, perbaikan teknik budidaya dan penanganan pasca panen yang benar sehingga dapat meningkatkan value added (nilai tambah) pada produk akhir yang dihasilkan (Rahman, 2008).Penyediaan bibit menggunakan teknik kultur jaringan merupakan suatu teknik yang mampu menghasilkan bibit dalam jumlah banyak dan dalam waktu yang relatif singkat (Sianipar, 2008). Hal ini diharapkan mampu memenuhi kebutuhan permintaan bibit.
Teknik kultur jaringan dapat menimbulkan keragaman genetik tanaman (variasi somaklonal) yang menyebabkan abnormalitas dan penurunan produksi minyak kelapa sawit. Phillips et al. (1994) menyatakan bahwa lingkungan kultur jaringan dapat menyebabkan gangguan kontrol seluler yang berperan terhadap sejumlah perubahan genomik yang ada pada tanaman kultur jaringan. Abnormalitas dapat terjadi pada bunga jantan dan bunga betina yang berkembang menjadi buah partenokarpi dan buah mantel (Corley et al., 1986; Bangun, 2002).
Menurut Hetharie (2008), fenomena buah mantel pada klon-klon hasil perbanyakan kultur jaringan menjadi permasalahan di negara-negara produsen kelapa sawit karena mampu menurunkan produktivitas dan menghambat penggunaan teknologi ini untuk pemuliaan tanaman. Identifikasi abnormalitas sejak
UNIVERSITAS SUMATERA UTARA
2
dini pada kultur jaringan sulit dilakukan karena pada umumnya fenotip yang dimunculkan sama dengan tanaman normal.
Teknik molekuler seperti Random Amplified Polymorphic DNA (RAPD), Amplified Fragment Length Polymorphism (AFLP) dan Simple Sequence Repeat (SSR) dalam mendeteksi perubahan genetik tanaman hasil kultur telah banyak digunakan. Rendahnya tingkat reproduksibilitas pita yang dihasilkan dengan teknik RAPD dan mahalnya biaya yang dibutuhkan pada teknik AFLP menyebabkan teknik SSR lebih sering digunakan dalam mempelajari perubahan serta keanekaragaman genetik tanaman yang dihasilkan dari teknik kultur jaringan (Viehmannova et al., 2014)
Ada beberapa pendapat mengenai sebab terjadinya abnormalitas pada tanaman sawit hasil kultur, namun banyak yang berpendapat bahwa penyebab terjadinya abnormalitas umumnya disebabkan gangguan ekspresi gen yang diakibatkan oleh fitohormon (Sanputawong & Te-chato, 2011), level ploidi akibat fitohormon sintetis (Lucia et al., 2011), jenis eksplan yang digunakan, interval subkultur dan umur kalus (Hetharie, 2010; Aulia, 2014; Bayzura, 2014).
Fitohormon α-Naphthalenacetic acid (NAA) dan kinetin sering digunakan dalam induksi planlet tanaman Arecaceae (Fki et al., 2011). Namun, fitohormon tersebut diduga penyebab dominan abnormalitas pada tanaman kelapa sawit.
Eeuwens et al. (2002) melaporkan bahwa penggunaan konsentrasi NAA rendah dan konsentrasi kinetin tinggi menghasilkan persentase abnormalitas bunga pada klon kelapa sawit dari eksplan daun yang cukup tinggi. Akan tetapi, pengaruh fitohormon NAA dan kinetin terhadap abnormalitas kultur dari eksplan bunga betina masih belum diketahui. Keunggulan eksplan dari bunga yaitu tidak merusak pohon induk (ortet), dan memiliki jumlah individu bunga yang banyak (Ginting &
Fatmawati, 2003). Oleh karena itu, dibutuhkan penelitian mengenai pengaruh konsentrasi NAA dan kinetin terhadap perubahan genetik organ dari ekspan bunga betina kelapa sawit yang dihasilkan.
1.2. Permasalahan
Perbanyakan bibit kelapa sawit dengan teknik kultur jaringan semakin banyak diaplikasikan. Namun, klon yang dihasilkan memiliki abnormalitas yang
UNIVERSITAS SUMATERA UTARA
menurunkan produktivitas tanaman kelapa sawit tersebut. Abnormalitas pada tanaman kelapa sawit tersebut diketahui pada fase reproduksi sehingga merugikan petani maupun produsen kelapa sawit. Oleh karena itu, dibutuhkan penelitian untuk deteksi dini serta perbaikan tahap-tahap kultur jaringan kelapa sawit yang mampu menekan abnormalitas klon yang dihasilkan.
1.3. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui pengaruh beberapa konsentrasi NAA dan kinetin terhadap perubahan genetik organ dari eksplan bunga betina kelapa sawit.
1.4. Hipotesis
Penggunaan NAA dan kinetin yang dilakukan dalam perbanyakan tanaman kelapa sawit dapat menimbulkan perubahan genetik pada klon tanaman kelapa sawit yang dihasilkan.
1.5. Manfaat
Manfaat penelitian ini adalah sebagai bahan informasi bagi pihak-pihak yang membutuhkan, serta diharapkan dapat digunakan untuk penelitian lebih lanjut dalam mencari konsentrasi NAA, kinetin dan jenis eksplan yang baik sehingga dihasilkan benih kelapa sawit yang normal dalam skala besar.
UNIVERSITAS SUMATERA UTARA
BAB 2
TINJAUAN PUSTAKA
2.1. Tanaman Kelapa Sawit
Genus Elaeis terdiri atas tiga spesies yaitu Elaeis guineensis Afrika yang dikenal sebagai kelapa sawit dan dua spesies asli dari Amerika Selatan dan Amerika Tengah yaitu Elaeis oleifera dan Elaeis odora (Corley & Tinker, 2003; Hetharie, 2008).
Kelapa sawit (Elaeis guineensis Jacq.) bukanlah tanaman asli Indonesia tetapi berasal dari Afrika. Kelapa sawit diintroduksi ke Asia Tenggara pada tahun 1848 melalui Kebun Raya Bogor, Indonesia. Keturunan generasi kedua dan ketiga dari tanaman asli ini digunakan sebagai bahan tanam dan terbentuklah perkebunan pertama kelapa sawit di Sumatera sejak tahun 1911 dan di Malaysia sejak tahun 1917 kemudian berkembang menjadi varietas Deli Dura (Hetharie, 2008).
Tanaman kelapa sawit tergolong tanaman monokotil (Gambar 2.1.), akarnya terdiri atas akar primer, sekunder, tersier, dan kuarter yang merupakan akar serabut dan sebagian besar berada dekat di permukaan tanah dengan kedalaman 15- 30 cm (Corley & Tinker 2003). Akar primer yang tumbuh dari pangkal batang (bole) ribuan jumlahnya, diameternya berkisar antara 8 dan 10 mm. panjangnya dapat mencapai 18 cm. Akar sekunder tumbuh dari akar primer, diameternya 2-4 mm. Dari akar sekunder tumbuh akar tersier berdiameter 0.7-1.5 mm dan panjangnya dapat mencapai 15 cm (Lubis, 2008).
Gambar 2.1. Tanaman Kelapa Sawit
UNIVERSITAS SUMATERA UTARA
Batangnya tegak tidak bercabang, berdiameter 40-75 cm dan tinggi batang dalam pembudidayaan tidak lebih dari 15-18 m (Corley & Tinker, 2003), memiliki satu titik tumbuh berbentuk kerucut diselimuti oleh daun-daun muda yang masih kecil dan lembut atau pelepah daun (frond base) (Lubis, 2008). Daunnya majemuk dengan pelepah daun tersusun melingkari batang berbentuk spiral (Corley &
Tinker, 2003).
Kelapa sawit merupakan tanaman berumah satu (monoecious), artinya bunga jantan dan bunga betina terdapat dalam satu tanaman dan masing-masing terangkai dalam satu tandan. Rangkaian bunga jantan terpisah dengan bunga betina.
Setiap rangkaian bunga muncul dari pangkal pelepah daun (Saraswati, 2010). Buah yang dihasilkan berbentuk tandan yang besar dan kompak. Tipe buah kelapa sawit adalah drupe dengan mesokarp yang mengandung banyak minyak (Tinche, 2014).
Biji merupakan bagian buah yang telah terpisah dari daging buah dan sering disebut noten atau nut yang memiliki berbagai ukuran tergantung tipe tanaman. Biji kelapa sawit terdiri atas cangkang, embrio dan inti atau endosperm. Embrio panjangnya 3 mm berdiameter 1,2 mm berbentuk silindris seperti peluru dan memiliki dua bagian utama. Bagian yang tumpul permukaannya berwarna kuning dan bagian lain berwarna sedikit kuning. Endosperm merupakan cadangan makanan bagi pertumbuhan embrio. Pada perkecambahan embrio berkembang dan akan keluar melalui lubang cangkang (germpore). Bagian pertama yang muncul adalah radikula (akar) dan menyusul plumula (batang) (Lubis, 2008).
2.2. Kultur Jaringan
Teknik kultur jaringan berkembang tahun 1900-an yang dimulai dengan kultur akar oleh Kotte dan Robbins. Kultur jaringan dapat menyediakan banyak tanaman dalam waktu singkat serta bebas cendawan dan bakteri (Hetharie, 2008). Street (1973) melaporkan bahwa kultur jaringan adalah istilah umum yang ditujukan pada budidaya secara in vitro terhadap berbagai bagian tanaman yang meliputi batang, daun, akar, bunga, kalus, sel, protoplas dan embrio. Bagian-bagian tersebut yang diistilahkan sebagai eksplan, diisolasi dari kondisi in vivo dan dikultur pada medium buatan yang steril sehingga dapat beregenerasi dan berdiferensiasi menjadi tanaman lengkap.
UNIVERSITAS SUMATERA UTARA
6
Perbanyakan kelapa sawit dengan teknik kultur jaringan telah dimulai pada tahun 1960-an sampai tahun 1977, diperoleh klon kelapa sawit pertama yang ditanam di Malaysia. Sejak saat itu perbanyakan kelapa sawit mulai berkembang pesat sampai memasuki tahun 1990-an, teknik kultur jaringan kelapa sawit mulai dimanfaatkan untuk perbanyakan klon komersial (Corley & Tinker, 2003).
Kultur jaringan tanaman kelapa sawit dapat dilakukan dengan kultur embrio (penyelamatan embrio), kultur organ, kultur pollen (tanaman haploid), maupun kultur protoplasma (fusi protoplas). Dengan kultur jaringan juga diperoleh embrio aromatik yang dapat disimpan (konservasi), sehingga stok selalu tersedia dan sewaktu-waktu dapat dimanfaatkan untuk tujuan pemuliaan maupun tujuan perbanyakan tanaman (Bangun, 2002). Proses produksi bibit klonal kelapa sawit melalui embriogenesis somatik terdiri dari lima tahapan, mencakup seleksi ortet dan penyiapan sumber eksplan, induksi kalus dari eksplan daun, embriogenesis somatik dan proliferasi embrio, induksi tunas dan akar, dan aklimatisasi ramet (Marbun, 2013).
2.3. Zat Pengatur Tumbuh
Keberadaan hormon dan zat pengatur tumbuh dalam kegiatan kultur jaringan adalah mutlak. Karena kegiatan kultur jaringan umumnya menggunakan bahan tanam yang tidak lazim (sel, jaringan atau organ) dan budidayanya adalah budidaya yang terkendali. Pengaturan proses tumbuh dan berkembangnya eksplan dapat dilakukan dengan mengatur macam dan konsentrasi hormon atau ZPT tertentu sehingga menghasilkan kombinasi yang tepat sesuai dengan harapan (Santoso & Nursandi, 2001).
Zat pengatur tumbuh merupakan substansi (bahan organik) (selain vitamin dan unsur mikro) yang dalam jumlah sedikit mampu merangsang, menghambat atau sebaliknya mengubah proses fisiologis (Gardner et al., 2008). Senyawa tersebut memiliki karakteristik yang sama dengan hormon, tapi diproduksi secara eksogen (Pierik, 1997). Zat pengatur tumbuh endogen diartikan sebagai hormon tumbuhan atau fitohormon (Gardner et al., 2008) yang berperan merangsang dan meningkatkan pertumbuhan serta perkembangan sel, jaringan dan organ tanaman menuju arah diferensiasi tertentu (Pierik, 1997).
UNIVERSITAS SUMATERA UTARA
Di dalam teknik kultur jaringan, kehadiran kehadiran zat pengatur tumbuh sangat nyata pengaruhnya (Zulkarnain, 2009). Bahkan, Pierik (1997) menyatakan bahwa sangat sulit untuk menerapkan teknik kultur jaringan pada upaya perbanyakan tanaman tanpa melibatkan zat pengatur tumbuh.
Zat pengatur tumbuh seperti auksin dan sitokinin yang ditambahkan dalam media kultur merupakan salah satu faktor penting yang mempengaruhi kalogenesis dan embriogenesis dari eksplan. Eksplan yang berupa potongan daun diinokulasi pada media induksi kalus yang mengandung auksin secara in vitro. Auksin merupakan zat pengatur tumbuh yang memunculkan respon tanaman yang berbeda pada pembelahan dan diferensiasi sel, pemanjangan sel, dan inisiasi akar (Becker
& Hedrich, 2002).
Menurut Artutiningsih (2012), kalogenesis atau proses pembentukan kalus terjadi akibat respon hormonal eksplan terhadap media yang mengandung zat pengatur tumbuh auksin, seperti 2,4-Dichlorophenoxyacetic acid (2,4-D). Corley &
Tinker (2003) menambahkan embriogenesis atau proses pembentukan embrioid terjadi melalui dua cara, yaitu secara langsung maupun tidak langsung.
Embriogenesis langsung adalah pembentukan embrioid secara langsung dari eksplan tanpa melalui pembentukan kalus. Sedangkan embrioid yang umum terbentuk menggunakan metode tidak langsung melalui tahap pembentukan kalus.
Perbanyakan embrioid merupakan tahap yang sangat penting dalam upaya mendapatkan klon-klon kelapa sawit dengan teknik kultur jaringan melalui subkultur berulang.
Pembentukan tunas terjadi pada tahap perbanyakan embrioid. Setiap tunas yang terbentuk dipindahkan ke dalam media kultur yang berbeda, yaitu media perkembangan tunas dan induksi akar dengan pengurangan konsentrasi zat pengatur tumbuh. Subkultur dilakukan berulang sampai tunas membentuk tanaman lengkap (planlet). Planlet pada media kultur belum memiliki kutikula daun normal, sehingga cepat kering pada saat terkena udara luar. Pengaturan kelembaban media aklimatisasi sangat penting dilakukan dengan pengurangan kelembaban secara bertahap, sampai kutikula daun terbentuk dan tanaman mampu hidup pada kondisi lapang (Corley & Tinker, 2003).
UNIVERSITAS SUMATERA UTARA
8
2.4. Kultur Jaringan Kelapa Sawit
Menurut Lestari (2008), kultur jaringan merupakan salah satu teknik dalam perbanyakan tanaman secara klonal untuk perbanyakan massal. Keuntungan pengadaan bibit melalui kultur jaringan antara lain dapat diperoleh bahan tanaman yang unggul dalam jumlah banyak dan seragam, selain itu dapat diperoleh biakan steril (mother stock) sehingga dapat digunakan sebagai bahan untuk perbanyakan selanjutnya. Untuk mendapatkan hasil yang optimum maka penggunaan media dasar dan zat pengatur tumbuh yang tepat merupakan faktor yang penting (Purnamaningsih & Lestari, 1998). Kombinasi media dasar dan zat pengatur tumbuh yang tepat akan meningkatkan aktivitas pembelahan sel dalam proses morfogenesis dan organogenesis (Lestari, 2011).
Perbanyakan tanaman kelapa sawit secara kultur jaringan terdiri dari beberapa tahapan, yaitu pemilihan dan perlakuan eksplan, induksi kalus, pembentukan dan proliferasi embrio, plantula, pupus, induksi dan perkembangan perakaran serta aklimatisasi ramet (Jambak, 2011). Aulia (2014) menyatakan bahwa waktu inisiasi kalus dihitung secara manual dari hari setelah tanam (HST) hingga terbentuknya kalus. Kalus pertama kali dijumpai setelah 3-4 bulan setelah tanam. Jambak (2011) menambahkan bahwa waktu yang digunakan untuk induksi embrio, plantula, pupus dan perakaran biasanya sekitar 2-4 bulan.
2.5. Perubahan Genetik Kelapa Sawit
Tanaman hasil perbanyakan kultur jaringan secara morfologi relatif seragam, namun teknik kultur jaringan juga mampu menimbulkan keragaman genetik tanaman (variasi somaklonal) yang menyebabkan abnormalitas dan penurunan produksi minyak kelapa sawit. Corley et al. (1986) dalam Bangun (2002) mengemukakan ada tiga macam abnormalitas pada tanaman kelapa sawit yaitu berupa rangkaian bunga jantan andromorphic, buah mantled, dan buah partenokarpi. Abnormalitas berupa terbentuknya rangkaian bunga jantan andromorphic dan buah mantled terjadi sebagai akibat adanya kesalahan fungsi organ-organ reproduksi, sedangkan buah partenokarpi dapat terbentuk karena penyerbukan kurang sempurna. Hal tersebut dapat menurunkan produktivitas tanaman kelapa sawit tersebut.
UNIVERSITAS SUMATERA UTARA
Pendekatan yang dapat dilakukan untuk deteksi dini perubahan genetik kelapa sawit adalah dengan menggunakan penanda molekuler. Penanda molekuler merupakan penanda yang polimorfisnya berdasarkan protein dan DNA, dan telah sangat membantu penelitian pada berbagai disiplin ilmu seperti taksonomi, filogeni, ekologi, dan pemuliaan tanaman. Deteksi variasi DNA yang berdampak terhadap perubahan genetik dapat dilakukan dengan beberapa cara seperti Protein Markers dan Allozymes, DNA Sequencing, Restriction Fragment Length Polymorphism (RFLP), Amplified Fragment Length Polymophism (AFLP), Random Amplified Polymorphic DNA (RAPD) dan Microsatellite (Weising et al., 2005).
Deoxyribonucleic Acid (DNA) mikrosatelit merupakan rangkaian pola nukleotida antara dua sampai enam pasang basa yang berulang secara berurutan.
DNA mikrosatelit diamplifikasi menggunakan teknik PCR dengan beberapa pasang primer mikrosatelit. DNA produk PCR dideteksi menggunakan teknik elektroforesis gel poliakrilamid (PAGE) dengan pewarna silver (Putri, 2010).
Amplifikasi berdasarkan PCR menunjukkan bahwa SSR pada kelapa sawit memiliki tingkat polimorfisme yang tinggi sehingga penanda ini memiliki kelebihan yang dapat diandalkan, dapat diulang, dan biaya kompetitif apabila dibandingkan dengan marka yang lain (Singh et al., 2007). Penanda ini juga dapat digunakan untuk studi genetik karena adanya kemudahan SSR dalam mengamplifikasi dan mendeteksi fragmen-fragmen DNA serta tingginya tingkat polimorfisme yang dihasilkan. Selain itu, penanda SSR juga dapat diaplikasikan untuk mempelajari keragaman genetik, identifikasi plasma nutfah, studi evolusi, identifikasi kultivar, pengujian progeni, dan gene tagging (Billotte et al. 2005).
Penanda mikrosatelit telah banyak digunakan pada kelapa sawit selain untuk eksplorasi genotipe-genotipe baru yang unggul juga banyak digunakan untuk memverifikasi kualitas di dalam manajemen produksi secara klonal (Suyekti, 2014). Untuk tujuan tersebut, Artutiningsih (2012) telah melakukan analisis kemiripan genetik antara ortet kelapa sawit dan klon-klon turunannya menunjukkan bahwa lima dari sembilan ortet yang diuji, sebagian besar klon-klonnya memiliki kemiripan genetik lebih besar atau sama dengan 90%.
UNIVERSITAS SUMATERA UTARA
BAB 3
METODE PENELITIAN
3.1. Waktu dan Tempat
Penelitian ini telah dilaksanakan pada bulan September 2015 sampai dengan Desember 2016 di Laboratorium Kultur Jaringan dan Laboratorium Genetika dan Biologi Molekuler, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan.
3.2. Prosedur Kerja 3.2.1. Sterilisasi Eksplan
Spikelet bunga betina kelapa sawit (Gambar 3.1.) diambil dan dibersihkan dengan air mengalir hingga bersih. Spikelet dicuci dengan detergen selama ± 5 menit dan dibilas dengan akuades steril. Bahan tanaman dimasukkan ke dalam larutan NaOCl 1% selama ± 5 menit dan dibilas dengan akuades steril. Tahap selanjutnya spikelet direndam dalam larutan HgCl2 0,1% selama ± 30 menit, bilas dengan akuades steril sebanyak tiga kali selama masing-masing ± 5 menit. Spikelet dikeringkan di atas cawan petri steril yang berisi kertas saring. Spikelet yang sudah steril, diiris ± 0,5 cm2 secara aseptik dan diinokulasikan ke media kultur.
Gambar 3.1. Bunga Betina Kelapa Sawit: (a) Rangkaian Bunga Betina Kelapa Sawit; (b) Spikelet.
a a 10 cm b 1 cm
UNIVERSITAS SUMATERA UTARA
3.2.2. Induksi Kalus
Potongan spikelet diinokulasikan ke media Y3 (Eeuwens, 1976) yang mengandung unsur makro, mikro, zat besi serta penambahan 100mg/L myo-inositol, 0,9 mg/L, 0,9 mg/L asam nikotinat, 5 mg/L Thiamin-HCl, 5 mg/L piridoksin-HCl, 0,25 mg/L asam pentotenat, 2 mg/L glisin, 3.000 mg/L arang aktif, dan sukrosa 30.000 mg/L.
Media kemudian diberi zat pengatur tumbuh 2,4-D 105 mg/L untuk induksi kalus (Texeira, 1994; Aulia, 2014; Nasution, 2014).
Keasaman media diatur sekitar 5,5 ± 0,1 dengan penambahan HCl 0,1 N atau NaOH 0,1 N sebelum ditambahkan 7.000 mg/L agar. Media selanjutnya disterilkan pada suhu 121ºC dengan tekanan 15 psi selama 15 menit. Kultur diletakkan pada suhu 27 ± 1ºC dalam keadaan gelap hingga kalus terbentuk. (Aulia, 2014; Nasution, 2014).
3.2.3. Induksi Embrio
Kalus yang telah terbentuk dipindahkan ke media Y3 dengan penambahan ZPT NAA 0,05 mg/L dan kinetin 0,1 mg/L. Kultur diletakkan di bawah kondisi bercahaya selama 16 jam fotoperiodisme pada suhu 27 ± 1ºC dan disubkultur dua bulan sekali pada media yang sama hingga embrio terbentuk.
3.2.4. Induksi Organ
Embrio somatik diinduksi pada media Y3 dengan kombinasi NAA sebesar 0, 0,05 dan 0,1 mg/L dan kinetin sebesar 0, 0,1 dan 0,2 mg/L. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan 2 faktorial, yaitu:
Faktor 1 (D) : Perlakuan media Y3 dengan penambahan ZPT NAA D0 : Konsentrasi 0 mg/L
D1 : Konsentrasi 0,05 mg/L D2 : Konsentrasi 0,1 mg/L
Faktor 2 (I) : Perlakuan media Y3 dengan penambahan ZPT Kinetin I0 : Konsentrasi 0 mg/L
I1 : Konsentrasi 0,1 mg/L I2 : Konsentrasi 0,2 mg/L
UNIVERSITAS SUMATERA UTARA
12
Sehingga diperoleh kombinasi 9 perlakuan untuk masing-masing kelompok percobaan dengan masing-masing ulangan sebanyak 5 kali. Rincian kombinasi perlakuan sebagai berikut:
D0I0 D1I0 D2I0
D0I1 D1I1 D2I1
D0I2 D1I2 D2I2
Kultur diletakkan di bawah kondisi bercahaya selama 16 jam fotoperiodisme pada suhu 27 ± 1ºC dan disubkultur dua bulan sekali pada media yang sama (Eeuwens et al., 2002).
3.2.5. Prosedur Preparat Awetan
Kalus embriogenik dan embrio somatik yang terbentuk dilakukan pengamatan anatomi dengan melakukan analisis histologi menggunakan metode paraffin Sass (1951) yang dimodifikasi.
3.2.5.1. Fiksasi
Fiksasi dilakukan dengan cara setiap sampel direndam dalam larutan FAA (Formaldehyde Acetic Acid Alcohol) dengan komposisi 50 mL alkohol 95%, 35 mL akuades, 10 mL formalin 37% dan 5 mL asam asetat glacial selama 24-48 jam dan divakum.
3.2.5.2. Dehidrasi
Sampel yang telah difiksasi, dilakukan proses dehidrasi dengan merendam sampel di dalam alkohol bertingkat (30, 50, 70, 90% dan absolut) masing-masing selama 24 jam dan divakum. Proses dehidrasi dimulai dari alkohol persentase rendah menuju ke alkohol persentase tinggi. Hal ini bertujuan untuk menarik air dari dalam sel secara perlahan-lahan dan tetap menjaga agar tidak terjadi perubahan pada sel-sel jaringan secara tiba-tiba.
3.2.5.3. Dealkoholisasi (Clearing)
Setelah dehidrasi, segera dilakukan proses penjernihan. Proses penjernihan dilakukan dengan menggunakan alkohol : xilol dengan perbandingan 3:1, 1:1 dan
UNIVERSITAS SUMATERA UTARA
1:3 selama masing-masing 2 jam. Kemudian organ direndam dalam xilol murni selama 24-48 jam. Hal ini bertujuan untuk menarik alkohol atau dehidran lain dari dalam jaringan, agar dapat digantikan oleh molekul parafin. Untuk optimalisasi tahap penjernihan, dilakukan proses vakum pada tiap perbandingan larutan yang digunakan.
3.2.5.4. Infiltrasi Parafin
Tahap selanjutnya adalah proses infiltrasi parafin dengan menggunakan campuran xilol : parafin dengan perbandingan 3:1, 1:1, dan 1:3 selama masing- masing 2 jam. Jaringan direndam di dalam parafin murni I dan II selama masing- masing 2 jam dan di dalam parafin murni III selama 24 jam. Hal ini bertujuan agar parafin dapat merata pada setiap bagian jaringan. Keseluruhan proses infiltrasi ini, dilakukan di dalam oven pada suhu 50-60oC.
3.2.5.5. Penanaman (Embedding)
Jaringan yang telah melalui proses infiltrasi, dimasukkan ke dalam kotak- kotak karton yang telah berisi parafin cair dengan menggunakan pinset dan dituang kembali dengan parafin murni yang telah berisi jaringan. Simpan jaringan yang telah ditanam pada suhu ruang dan dapat dikeluarkan dari cetakan setelah parafin mengeras.
3.2.5.6. Penyayatan (Section)
Blok-blok parafin yang telah memadat, ditempelkan pada holder sebelum dimulai penyayatan dengan menggunakan mikrotom. Blok parafin dipasang pada mesin mikrotom putar dan proses penyayatan dapat dimulai. Sisi horizontal dari permukaan parafin dibuat sejajar dengan pisau penyayat. Hasil penyayatan akan membentuk pita-pita seri yang berisi sayatan jaringan. Setelah membentuk pita yang cukup panjang, pita dipotong dan diletakkan di tempat yang telah disediakan.
Pita-pita tersebut dimasukkan ke dalam beaker glass yang berisi air dingin agar pita tidak telipat. Kemudian pita dimasukkan ke dalam gelas beaker yang berisi air hangat agar pita tidak terlipat dan kusut.
UNIVERSITAS SUMATERA UTARA
14
3.2.5.7. Deparafinisasi
Gelas benda yang telah berisi irisan jaringan, direndam ke dalam xilol selama 10 menit. Deparafinasi ini bertujuan untuk menghilangkan parafin yang terdapat di dalam jaringan.
3.2.5.8. Pewarnaan (Staining)
Gelas benda yang berisi irisan jaringan, direndam ke dalam alkohol absolut, alkohol 90%, alkohol 70%, alkohol 50%, alkohol 30% dan akuades selama 2-5 menit. Gelas benda yang telah didealkoholisasi, dimasukkan ke dalam larutan pewarna Safranin selama 5 menit. Preparat dicuci dengan akuades, dan direndam ke dalam alkohol 30%, alkohol 50%, alkohol 70% dan alkohol 90% selama 2-5 menit. Gelas benda tersebut dicelupkan ke dalam larutan pewarna Fast Green selama 1-3 menit. Preparat direndam ke dalam alkohol 90% dan alkohol absolut selama 2-5 menit dan direndam kembali ke dalam xilol selama 5 menit. Preparat yang telah direndam dalam xilol, ditetesi dengan Canada balsam dan ditutup dengan gelas penutup.
3.2.6. Analisis Histologi
Preparat yang telah diwarnai, dapat diamati dengan mikroskop cahaya Carl Zeiss Primo Star sehingga diperoleh gambar histologi kalus embriogenik dan embrio somatik.
3.2.7. Parameter Pengamatan
Peubah yang diamati pada penelitian ini adalah:
1. Waktu Inisiasi Organ
Waktu induksi organ dihitung secara manual mulai dari hari setelah tanam (HST) hingga terbentuknya organ.
2. Jumlah Akar
3. Jumlah Tunas
Jumlah botol yang tumbuh akar suatu perlakuan Jumlah total botol percobaan
Jumlah botol yang tumbuh tunas suatu perlakuan Jumlah total botol percobaan
Jumlah Tunas = Jumlah Tunas =
UNIVERSITAS SUMATERA UTARA
3.2.8. Verifikasi Perubahan Genetik 3.2.8.1. Isolasi DNA
Organ-organ yang terbentuk pada setiap perlakuan dilakukan proses isolasi DNA berdasarkan metode Cetyltrimethylamonium bromida (CTAB) (Doyle & Doyle, 1990) yang dimodifikasi. Organ akar dan tunas sebanyak 0,4 g digerus dalam lumpang porselen dengan bantuan nitrogen cair. Sampel yang telah halus seperti tepung berwarna putih dimasukkan ke dalam tabung mikro ukuran 2 mL yang berisi 1 mL buffer ekstraksi (100 mM Tris-HCl pH 8, 1,4 M NaCl, 20 mM EDTA, 2%
CTAB, 3% PVP dan 0,2% β-mercaptoetanol) yang telah dipanaskan pada suhu 65ºC. Larutan dibolak-balik sampai terbentuk suspensi dan dipanaskan di dalam water bath suhu 65ºC selama 30 menit dengan catatan setiap 10 menit sampel dikeluarkan dan dikocok manual.
Sampel dibiarkan dingin pada suhu ruang dan dilanjutkan dengan proses pemurnian. Proses pemurnian diawali dengan penambahan Tris-Phenol : Kloroform : Isoamilalkohol (25:24:1) dengan volume yang sama dan disentrifus dengan kecepatan 10.000 rpm selama 15 menit pada suhu 4ºC. Supernatan dipindahkan ke tabung mikro baru dan dimurnikan lagi dengan larutan kloroform : isoamilalkohol (24:1) dengan volume yang sama dan dibiarkan selama 45 menit serta dibolak-balik secara teratur. Larutan disentrifugasi dengan kecepatan 10.000 rpm selama 15 menit pada suhu 4ºC. Supernatan diambil dengan pipet dan dipindahkan ke tabung mikro yang baru. Sampel DNA diendapkan dengan penambahan 1/10 kali volume sodium asetat (pH 5,2) dan 3 kali volume etanol absolut dingin, dibolak-balik beberapa kali. Sampel DNA tersebut diinkubasi pada suhu -20ºC selama 3 jam dan disentrifugasi dengan kecepatan 10.000 rpm selama 15 menit pada suhu 4ºC. Supernatan dibuang sedangkan pelet diambil dan dibersihkan dengan 500 µL alkohol 70%. Tahap selanjutnya DNA dikeringanginkan pada suhu 37ºC selama 10 menit. Sampel DNA yang telah kering dilarutkan dengan 50 µL akuabides (ddH2O) steril.
Tahap selanjutnya menghilangkan kontaminan RNA dari DNA dengan cara menambahkan 5 µL RNA-se (20 mg/mL) dan diinkubasi selama 90 menit pada suhu 37ºC . Enzim RNA-se dinonaktifkan dengan cara diinkubasi pada suhu 70ºC selama 3 menit. DNA disimpan pada suhu -20ºC untuk digunakan selanjutnya.
UNIVERSITAS SUMATERA UTARA
16
3.2.8.2. Uji Kualitas dan Kuantitas DNA
Sampel DNA hasil ekstraksi kemudian diukur konsentrasinya dengan menggunakan alat Nanophotometer (IMPLEN P-360 NanoPhotometer P-Class).
Larutan blanko yang digunakan adalah ddH2O. Pengukuran konsentrasi DNA pada panjang gelombang 260 nm. Konsentrasi DNA dihitung dengan rumus A260 x 50 x faktor pengenceran. Sedangkan untuk pengukuran kemurnian DNA dilakukan dengan membandingkan absorben pada panjang gelombang 260/280 (A260/280). Uji kualitas dan kuantitas juga dilakukan dengan elektroforesis pada 1% gel Agarosa.
3.2.8.3. Amplifikasi DNA dengan Teknik SSR
Amplifikasi DNA menggunakan GoTaq® Green Master Mix (Promega, USA) (Lampiran 3 halaman 35) serta menggunakan 4 primer SSR yang terdapat pada Tabel 3.1 (Singh et al., 2007). Hasil PCR dielektroforesis pada 2% gel agarosa, tegangan listrik 70 V, kuat arus 500 mA selama 90 menit. Hasil elektroforesis diwarnai dengan ethidium bromida (1 µg/mL) selama 30 menit dan divisualisasikan dengan Gel Documentation (UVItec, Cambridge).
Tabel 3.1. Nama Lokus, Motif Ulangan, Urutan Primer dan Suhu Annealing Nama
Lokus
Motif Ulangan
Urutan Primer F: 5’---3’
R: 5’---3’
Suhu Annealing P1T14 (GA)8
F: TTGAGAGAGAGAGAGAGAGAGA
50°C R: TTACCTGGAGCTTCCGACTC
P4T8 (CT)5
F: GTAGGGGCTCTCTCTCTCTCTAT
52°C R: CATGCCCTGAGGAAATTCAG
P4T10 (CT)9
F: ACACGCACACAGAGAGATAGAGAG
52°C R: CTCGATTCGAATAGGTAGTCACTG
P4T20b (CT)4
F: TGAAAGACTCTCTCTCTCT
50°C R: TCAGCTTTGAATTATCCCATCC
3.3. Analisis Data
Data yang diperoleh selanjutnya dianalisis dengan uji F pada taraf 5%. Jika perlakuan berpengaruh nyata maka dilanjutkan dengan uji DMRT (Duncan New Multiple Range Test) dengan bantuan software SPSS versi 22. Data biner pita DNA diproses dengan bantuan software NTSYS versi 1.07 (Rohlf, 2000) sehingga dihasilkan dendogram kesamaan genetik.
UNIVERSITAS SUMATERA UTARA
HASIL DAN PEMBAHASAN
Penelitian ini dilakukan dengan teknik embriogenesis tidak langsung melalui tahap induksi kalus, induksi embrio dan induksi organ.
4.1. Induksi Kalus dari Eksplan Bunga Betina Kelapa Sawit
Penanaman eksplan bunga betina kelapa sawit pada media Y3 dengan penambahan 2,4-D 105 mg/L (Gambar 4.1.) mampu membentuk kalus embriogenik setelah 90- 120 hari setelah tanam. Hal ini menunjukkan bahwa penambahan 2,4-D dapat membantu pembentukan kalus karena 2,4-D termasuk golongan auksin.
Patcharapisutsin & Kanchanapoom (1996) dan Sianipar et al. (2007) melaporkan bahwa kalus embriogenik umumnya dibentuk pada medium yang mengandung auksin dan penambahan arang aktif. Teixeira et al. (1994) dan Aulia (2014) menambahkan bahwa kalus pertama kali muncul pada konsentrasi 2,4-D sebesar 105 mg/L.
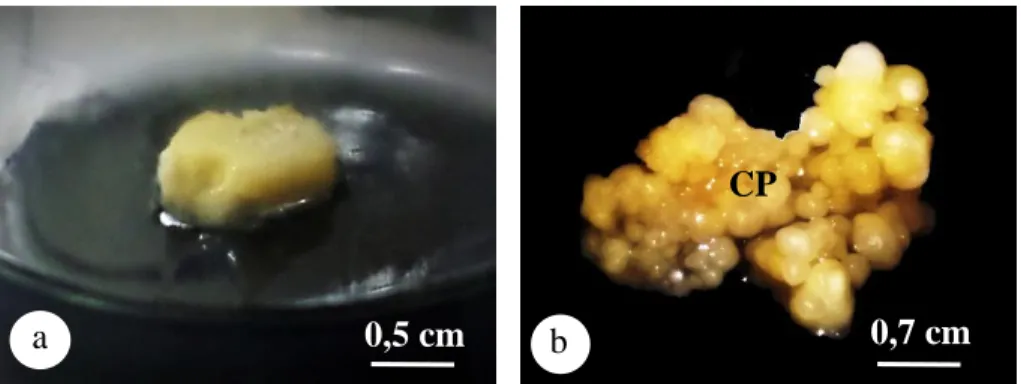
Gambar 4.1. Morfologi kalus embriogenik (a) Eksplan bunga betina kelapa sawit pada media Y3 + 2,4-D 105 mg/L selama 7 hari setelah tanam (b) kalus embriogenik dari eksplan bunga betina kelapa sawit pada media Y3 + 2,4-D 105 mg/L selama 111 hari setelah tanam; CP: kalus embriogenik
Kalus embriogenik yang terbentuk dari eksplan bunga betina kelapa sawit pada media Y3 + 2,4-D 105 mg/L memiliki bentuk bulat (nodular) yang berwarna putih kekuningan dan bertekstur kompak. Hasil yang sama dilaporkan oleh Teixeira et al. (1994); Thawaro & Te-chato (2009); Thuzar et al. (2011) dan Aulia (2014) yang menyatakan bahwa kalus embriogenik yang berasal dari eksplan embrio atau bunga betina kelapa sawit umumnya berwarna kekuningan.
a 0,5 cm 0,7 cm
CP
b
UNIVERSITAS SUMATERA UTARA
18
Kalus embriogenik yang diinduksi pada media Y3 dengan penambahan 2,4- D 105 mg/L, dilakukan analisis histologi untuk melihat anatomi kalus embriogenik tersebut (Gambar 4.2.). Hasil analisis menunjukkan bahwa penampang melintang kalus embriogenik tersusun oleh sel-sel meristem yang mengandung polisakarida berupa pati. Hasil yang sama dilaporkan oleh Atmane et al. (2000) dan Meilvana (2014) bahwa kalus embriogenik mengandung bulir pati. Kasi & Sumaryono (2008) dan Rineksane et al. (2012) menambahkan bahwa kalus embriogenik terdiri atas sel-sel yang bersifat meristematik (ruang antar sel lebih rapat, inti sel lebih jelas, menyerap warna lebih kuat, sitoplasma padat dan aktivitas pembelahan sel yang tinggi).
Gambar 4.2. Penampang melintang kalus embriogenik dari eksplan bunga betina kelapa sawit selama 111 hari setelah tanam; M: meristem; Par:
jaringan parenkim; St: bulir pati
4.2. Embriogenesis dari Eksplan Bunga Betina Kelapa Sawit
Kalus embriogenik yang diperoleh, diinduksi ke dalam media Y3 yang mengandung NAA 0,05 mg/L dan kinetin 0,1 mg/L untuk memperoleh embrio somatik. Embrio somatik muncul setelah 90-120 hari setelah tanam (Gambar 4.3.).
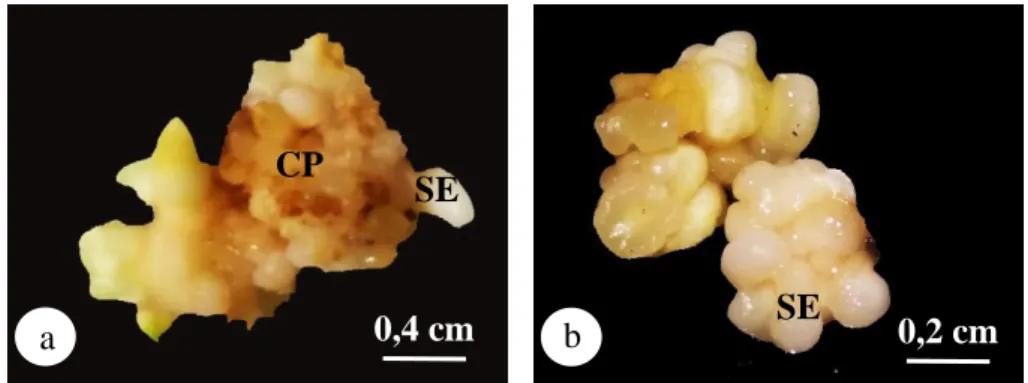
Gambar 4.3. Morfologi embrio somatik (a) kalus dan embrio somatik selama 114 hari setelah tanam (b) embrio somatik fase globular selama 140 hari setelah tanam; CP: kalus embriogenik; SE: embrio somatik
a
CP
0,4 cm SE
b SE 0,2 cm
St
50 µm 150 µm
M Par
UNIVERSITAS SUMATERA UTARA
Hal ini menunjukkan bahwa media Y3 yang mengandung NAA 0,05 mg/L dan kinetin 0,1 mg/L mampu membentuk embrio somatik fase globular. NAA termasuk golongan auksin dan kinetin termasuk golongan sitokinin. Media Y3 mampu menghasilkan embrio somatik karena adanya penambahan zat pengatur tumbuh auksin dan sitokinin dengan perbandingan tertentu. Karunaratne & Periyapperuma (1990) melaporkan bahwa kalus embriogenik yang diinduksi ke media yang mengandung auksin rendah dan sitokinin tinggi mampu menghasilkan embrio somatik.
Embrio somatik fase globular yang terbentuk memiliki ciri-ciri morfologi berbentuk bulat kompak, permukaan rata dan berwarna putih. Hasil yang sama dilaporkan oleh Karunaratne & Periyapperuma (1990) yang menyatakan dalam penelitiannya bahwa embrio somatik yang dikultur dalam media yang mengandung auksin rendah (2,4-D 0,001 mg/L) dan sitokinin yang tinggi (kinetin 0,002 mg/L) mampu menghasilkan embrio somatik fase globular yang bertekstur kompak, bulat, bipolar, permukaan rata dan berwarna putih. Sumaryono et al. (2007) menambahkan bahwa embrio somatik pada fase globular memiliki ukuran yang lebih besar, permukaan tampak halus dan lebih kompak jika dibandingkan dengan ukuran kalus embriogenik.
Embrio somatik yang diinduksi pada media media Y3 yang mengandung NAA 0,05 mg/L dan kinetin 0,1 mg/L, dilakukan analisis histologi untuk melihat anatomi embrio somatik tersebut (Gambar 4.4.).
Gambar 4.4. Penampang melintang embrio somatik dari eksplan bunga betina kelapa sawit selama 140 hari setelah tanam; Pro: protoderm; Par:
jaringan parenkim; Pc: prokambium
Hasil analisis menunjukkan bahwa penampang melintang embrio somatik tersusun atas sel-sel meristematik, protoderm dan jaringan prokambium. Sianipar (2008) melaporkan bahwa embrio somatik pada tahap globular tersusun atas
100 µm Pc
Pro
100 µm Par
Par
UNIVERSITAS SUMATERA UTARA
20
jaringan parenkim, sel-sel meristematik yang akan berkembang menjadi prokambium dan membentuk jaringan pembuluh dan lapisan protoderm yang akan berkembang menjadi epidermis.
4.3. Waktu Organogenesis dari Eksplan Bunga Betina Kelapa Sawit
Waktu organogenesis dari eksplan bunga betina kelapa sawit dihitung secara manual mulai saat penanaman embrio somatik pada media Y3 yang mengandung NAA dan kinetin berbeda (perlakuan) hingga terbentuknya organ (Gambar 4.5.).
Organ pertama kali dijumpai setelah 7-24 hari setelah tanam (Tabel 4.1.).
Gambar 4.5. Respon in vitro dari eksplan bunga betina kelapa sawit (Elaeis guineensis Jacq.) (a) Perkembangan akar dari eksplan bunga betina kelapa sawit (b) Perkembangan tunas dari eksplan bunga betina kelapa sawit; CP: Kalus embriogenik; PS: Bakal tunas; R: Akar; S:
Tunas
Tabel 4.1. Rata-rata waktu tumbuh organ dari eksplan bunga betina kelapa sawit pada beberapa tingkat konsentrasi NAA dan kinetin
Konsentrasi NAA (mg/L)
Waktu Terbentuk Organ (HST)
Rata-Rata Konsentrasi Kinetin (mg/L)
0 0,1 0,2
0 24,00a 12,33cd 7,33e 14,56a
0,05 12,33cd 11,67cd 15,33bc 13,11b
0,1 10,67d 13,00c 12,67c 12,11c
Rata-Rata 15,67a 12,33b 11,78b
F (A: NAA) 13,11*
38,39* 94,43* F (B: Kinetin)
F (A x B)
Keterangan : Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji Duncan. * p < 0,05
S
0,3 cm R
0,4 cm PS
CP
a b
UNIVERSITAS SUMATERA UTARA
Perlakuan penambahan kinetin sebesar 0,2 mg/L mampu menginduksi organ tercepat (7,33 HST). Pada perlakuan dengan penambahan NAA pada beberapa tingkat konsentrasi juga berpengaruh nyata terhadap waktu tumbuh organ, namun masih lebih rendah jika dibandingkan dengan perlakuan yang diperkaya kinetin (10,67 HST).
Hasil yang sama juga diperoleh pada perlakuan interaksi antara NAA dan kinetin, bahwa interaksi antara NAA dan kinetin juga berpengaruh nyata terhadap waktu tumbuh organ, namun masih lebih rendah jika dibandingkan dengan perlakuan yang diperkaya kinetin (11,67 HST). Hal ini menunjukkan bahwa kinetin berperan dalam aktivitas-aktivitas morfogenesis dan formasi organ dari eksplan bunga betina kelapa sawit. Te-Chato et al. (2008) melaporkan bahwa BA (6- benzyladenine) dan kinetin yang tergolong sitokinin berperan dalam proliferasi dan perkembangan kloroplas. Gardner et al. (2008) dan Zulkarnain (2009) melaporkan bahwa sitokinin berperan dalam mengatur dan berhubungan luas dengan aktivitas- aktivitas dan pola morfogenesis. Seyyedyousefi et al. (2013) melaporkan bahwa sitokinin berperan dalam induksi dan perkembangan dari jaringan meristematik yang membantu untuk formasi organ pada tanaman Alstroemeria.
4.4. Inisiasi Tunas
Proses terbentuknya tunas diamati pada media Y3 yang mengandung beberapa tingkat konsentrasi NAA dan kinetin. Waktu inisiasi tunas diamati selama 50 hari setelah tanam (HST). Inisiasi pembentukan tunas dari embrio somatik asal eksplan bunga betina kelapa sawit hanya tumbuh pada beberapa perlakuan saja, sedangkan pada pemberian kinetin tunggal tidak berpengaruh terhadap pembentukan tunas (Tabel 4.2.).
Tabel 4.2. Rata-rata jumlah tunas yang muncul pada beberapa tingkat konsentrasi NAA dan kinetin selama 50 HST
Konsentrasi NAA (mg/L)
Jumlah Tunas
Rata-Rata Konsentrasi Kinetin (mg/L)
0 0,1 0,2
0 - - - -
0,05 - - 1,00 1,00
0,1 3,33 - - 3,33
Rata-Rata 3,33 - 1,00
UNIVERSITAS SUMATERA UTARA
22
Penambahan NAA tunggal dengan konsentrasi 0,1 mg/L mampu menghasilkan jumlah tunas terbanyak. Hal ini menunjukkan bahwa NAA yang tergolong auksin mampu membentuk tunas dengan baik. Hasil yang sama dilaporkan oleh Termizi et al. (2014) menambahkan bahwa embrio somatik kelapa sawit yang dikultur dalam media MS yang mengandung NAA 0,5 mg/L menghasilkan organ tunas sebanyak 10 tunas selama 2 minggu waktu inisisasi.
Seyyedyousefi et al. (2013) menambahkan bahwa tanaman monokotil Alstroemeria yang dikultur dalam media MS yang mengandung NAA 0,2 mg/L mampu menghasilkan jumlah rata-rata tunas terbanyak sebesar 2,6 tunas.
Pada perlakuan interaksi antara NAA dan kinetin juga mampu menghasilkan tunas, namun lebih sedikit jika dibandingkan dengan perlakuan yang diperkaya dengan NAA. Sedangkan pada perlakuan kinetin tunggal tidak mampu untuk menghasilkan tunas. Hal ini menunjukkan bahwa kinetin yang tergolong sitokinin dengan konsentrasi yang semakin meningkat, menghambat terjadinya pembentukan tunas. Khaleghi et al. (2008) melaporkan bahwa konsentrasi sitokinin yang semakin meningkat mengakibatkan penurunan jumlah tunas yang berdampak terhadap dominansi apikal, serta penambahan NAA dalam konsentrasi rendah diperlukan untuk primordia tunas. Zulkarnain (2009) menambahkan bahwa konsentrasi antara sitokinin dan auksin yang berbeda akan mengakibatkan modus pertumbuhan yang berbeda, meskipun memiliki rasio yang sama.
4.5. Inisiasi Akar
Proses terbentuknya akar diamati pada media Y3 yang mengandung beberapa tingkat konsentrasi NAA dan kinetin. Waktu inisiasi akar diamati selama 50 hari setelah tanam (HST). Inisiasi pembentukan akar dari embrio somatik asal eksplan bunga betina kelapa sawit mampu tumbuh pada perlakuan NAA dan kinetin tunggal, sedangkan pada perlakuan interaksi antara NAA dan kinetin tidak mampu membentuk akar (Tabel 4.3.).
Perlakuan dengan penambahan NAA dan kinetin sebesar 0,05 mg/L dan 0,1 mg/L mampu menghasilkan jumlah akar yang paling banyak. Hal ini menunjukkan bahwa kombinasi antara NAA dan kinetin dengan perbandingan tertentu mampu membentuk akar dengan baik.
UNIVERSITAS SUMATERA UTARA
Tabel 4.3. Rata-rata jumlah akar yang muncul pada beberapa tingkat konsentrasi NAA dan kinetin selama 50 HST
Konsentrasi NAA (mg/L)
Jumlah Akar
Rata-Rata Konsentrasi Kinetin (mg/L)
0 0,1 0,2
0 1,00ab 2,67c 1,67bc 1,78a
0,05 2,00bc 3,00c 0,00a 1,67a
0,1 2,00bc 1,67bc 2,67c 2,11a
Rata-Rata 1,67a 2,44b 1,44a
F (A: NAA) 1,00ts
5,15* 7,69* F (B: Kinetin)
F (A x B)
Keterangan : Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji Duncan. * p < 0,05; ts: tidak signifikan
Pada perlakuan NAA tunggal juga mampu membentuk akar, namun masih lebih rendah jika dibandingkan dengan perlakuan NAA dan kinetin sebesar 0,05 mg/L dan 0,1 mg/L. Hasil yang sama juga diperoleh untuk perlakuan NAA tunggal.
Perlakuan NAA tunggal mampu membentuk akar, namun masih lebih rendah dibandingkan dengan perlakuan NAA dan kinetin sebesar 0,05 mg/L dan 0,1 mg/L.
Hal ini menunjukkan bahwa pengaruh perlakuan kinetin tunggal dan perlakuan kombinasi NAA dan kinetin memberikan pengaruh nyata terhadap jumlah akar yang terbentuk. Gomes et al. (2015) melaporkan bahwa penambahan NAA ke dalam medium planlet tidak mampu untuk menghasilkan bentuk dan jumlah akar yang baik serta Seyyedyousefi et al. (2013) melaporkan dalam penelitiannya bahwa sitokinin mampu meningkatkan jumlah rhizome tanaman Alstroemeria.
4.6. Analisis Perubahan Genetik Organ dari Eksplan Bunga Betina Kepala Sawit
Analisis perubahan genetik telah dilakukan pada organ-organ yang telah terbentuk selama 50 hari setelah tanam pada media Y3 yang mengandung beberapa tingkat konsentrasi zat pengatur tumbuh NAA dan kinetin. Analisis perubahan genetik dilakukan pada tingkat DNA (Lampiran 7. halaman 40). Amplifikasi DNA dilakukan dengan teknik SSR dengan empat primer (Gambar 4.6.).
UNIVERSITAS SUMATERA UTARA
24
Gambar 4.6. Pola pita polimorfik DNA organ dari eksplan bunga betina kelapa sawit hasil amplifikasi dengan primer SSR: (a) primer P1T14 (b) primer P4T8 (c) primer P4T10 dan (d) primer P4T20b. M=Marker 100 bp; TI=Tanaman Induk; K=Kalus; E=Embrio; IP1=D0I0 (NAA dan kinetin 0 mg/L);IP2=D0I1 (kinetin 0,1 mg/L);IP3=D0I2 (kinetin 0,2 mg/L) ; IP4= D1I0 (NAA 0,05 mg/L); IP5= D1I1 (NAA 0,05 mg/L dan kinetin 0,1 mg/L); IP6= D1I2 (NAA 0,05 mg/L dan kinetin 0,2 mg/L);
IP7= D2I0 (NAA 0,1 mg/L); IP8= D2I1 (NAA dan kinetin 0,1 mg/L;
IP9= D2I2 (NAA 0,1 mg/L dan kinetin 0,2 mg/L) dan tanda = perubahan pita DNA
Hasil amplifikasi menggunakan primer P1T14, P4T8, P4T10 dan P4T20b menunjukkan bahwa primer tersebut mampu mendeteksi terjadinya perubahan genetik pada tanaman hasil klon kelapa sawit. Singh et al. (2007) melaporkan bahwa primer primer P1T14, primer P4T8, primer P4T10 dan primer P4T20b mampu mendeteksi terjadinya perubahan genetik antara ortet (tanaman dewasa 500 bp
100 bp
500 bp
100 bp 500 bp
100 bp
500 bp
100 bp
M TI K E IP1 IP2 IP3 IP4 IP5 IP6 IP7 IP8 IP9
M TI K E IP1 IP2 IP3 IP4 IP5 IP6 IP7 IP8 IP9
M TI K E IP1 IP2 IP3 IP4 IP5 IP6 IP7 IP8 IP9
b
M TI K E IP1 IP2 IP3 IP4 IP5 IP6 IP7 IP8 IP9
c a
d b
c
d
UNIVERSITAS SUMATERA UTARA
yang digunakan sebagai sumber eksplan untuk perbanyakan tanaman dalam teknik kultur jaringan) dengan organ yang telah terbentuk dari hasil klon tanaman kelapa sawit. Hal ini dibuktikan dengan terjadinya perbedaan jumlah pita yang dihasilkan.
Primer P1T14 mampu mendeteksi terjadinya perubahan genetik organ dari eksplan bunga betina kelapa sawit yang ditunjukkan dengan tidak munculnya beberapa pita pada ukuran 100, 300 dan 400 bp jika dibandingkan dengan tanaman induk.
Sianipar et al. (2008) melaporkan bahwa perubahan sekuens DNA klon embrio somatik normal dan abnormal pada tanaman kelapa sawit berkisar 150 bp. Hanya perlakuan D0I0 (tanpa penambahan NAA dan kinetin)saja yang memiliki pola pita yang sama dengan tanaman induk.
Primer P4T8 mendeteksi terjadinya perubahan genetik organ dari eksplan bunga betina kelapa sawit dengan tidak munculnya pita pada perlakuan D2I1 (NAA dan kinetin 0,1 mg/L) pada ukuran 300 bp. Primer P4T10 mampu mendeteksi terjadinya perubahan genetik dengan bertambahnya pita pada perlakuan perlakuan D0I2 (kinetin 0,2 mg/L), D1I2 (NAA 0,05 mg/L dan kinetin 0,2 mg/L) dan D2I2
(NAA 0,1 mg/L dan kinetin 0,2 mg/L). Sedangkan pada primer P4T20b mendeteksi terjadinya perubahan genetik organ dari eksplan bunga betina kelapa sawit dengan bertambahnya ukuran pita DNA pada semua perlakuan jika dibandingkan dengan tanaman induk.
Pola pita yang berbeda pada tanaman induk dengan tanaman hasil klon menunjukkan terjadinya perubahan genetik. Perbedaan jumlah pita DNA tersebut disebabkan karena terjadinya perubahan sekuens DNA pada tanaman klon dari eksplan bunga betina kelapa sawit. Aulia (2014) melaporkan bahwa penggunaan 2,4-D 105 mg/L dan subkultur 4 dan 5 kali untuk induksi kalus dapat menyebabkan terjadinya perubahan genetik pada klon kelapa sawit. Eeuwens (2002) menambahkan bahwa penggunaan NAA dan kinetin dapat mempengaruhi terbentuknya abnormalitas pada bunga kelapa sawit.
Perubahan genetik yang terjadi pada organ dari eksplan bunga betina kelapa sawit berdasarkan hasil amplifikasi oleh primer P1T14, P4T8, P4T10 dan P4T20b juga dapat dilihat pada dendogram kemiripan (Gambar 4.7.).
UNIVERSITAS SUMATERA UTARA
26
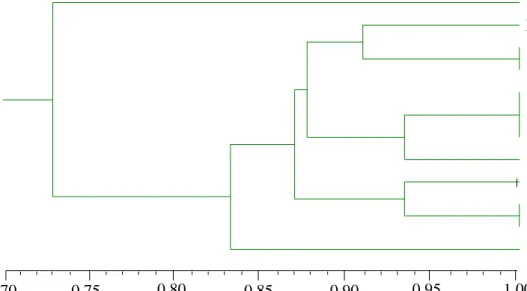
Gambar 4.7. Dendrogram kemiripan genetik organ dari eksplan bunga betina kelapa sawit berdasarkan primer P1T14, P4T8, P4T10 dan P4T20b
Hasil dendogram menunjukkan bahwa seluruh organ dari hasil kultur jaringan mengelompok pada nilai koefisien kemiripan 0,73. Hal ini menunjukkan bahwa seluruh organ hasil kultur jaringan dari eksplan bunga betina kelapa sawit mengalami perubahan genetik sebesar 27% berdasarkan primer P1T14, P4T8, P4T10 dan P4T20b. Perubahan genetik pada organ dari eksplan bunga betina kelapa sawit disebabkan oleh perlakuan zat pengatur tumbuh (ZPT) yang digunakan. Hasil yang sama dilaporkan oleh Sanputawong & Te-Chato (2011) bahwa tanaman hasil klon kelapa mengalami perubahan genetik yang disebabkan oleh penambahan dicamba sebesar 1 mg/L yang diamplifikasi oleh delapan primer SSR.
0,70 0,75 0,80 0,85 0,90 0,95 1,00
Koefisien Kemiripan
TI K IP5 IP7 E IP3 IP4 IP1 IP2 IP6 IP9 IP8
Koefisien
0.70 0.75 0.80 0.85 0.90 0.95 1.00
V10MW
C1
C2
V8
V10
C3
V6
V7
C4
V5
V9
V12
V11
UNIVERSITAS SUMATERA UTARA
KESIMPULAN DAN SARAN
5.1. Kesimpulan
a. Semua primer dapat mendeteksi terjadinya perubahan genetik organ yang terbentuk dari eksplan bunga betina kelapa sawit.
b. Primer P1T14 dan primer P4T20b mendeteksi paling banyak terjadinya perubahan genetik pada organ dari eksplan bunga betina kelapa sawit.
c. Pemberian NAA dan kinetin pada perlakuan D0I2 (kinetin 0,2 mg/L), D1I2
(NAA 0,05 mg/L dan kinetin 0,2 mg/L) dan D2I1 (NAA dan kinetin 0,1 mg/L) menyebabkan terjadinya perubahan genetik organ yang paling banyak.
d. Semua organ hasil klon kultur jaringan dari eksplan bunga betina kelapa sawit mengalami perubahan genetik sebesar 27% dari tanaman induknya.
5.2. Saran
a. Sebaiknya dilakukan penelitian lebih lanjut mengenai frekuensi subkultur dalam mendeteksi perubahan genetik kultur bunga betina kelapa sawit hasil kultur jaringan.
b. Sebaiknya dilakukan analisis lebih lanjut dengan menggunakan marker yang lain sehingga penelitian ini dapat dijadikan acuan dalam mengurangi kerugian abnormalitas tanaman kelapa sawit yang dapat diketahui pada fase reproduksi.
UNIVERSITAS SUMATERA UTARA
DAFTAR PUSTAKA
Artutiningsih, W. 2012. Analisis Kestabilan Genetik Ortet Kelapa Sawit (Elaeis guineensis Jacq.) dan Klon-Klon Turunannya Menggunakan Penanda Mikrosatelit. [Tesis]. Bogor: Institut Pertanian Bogor, Program Pascasarjana.
Atmane, N., Blervacq, A. S., Michaux-Ferriere, N. and Vasseur, J. 2000.
Histological Analysis of Indirect Somatic Embryogenesis in The Marsh Clubmoss Lycopodiella inundata (L.) Holub (Pteridophytes). Plant Science.
156: 159-167.
Aulia, I. 2014. Pengaruh Pemberian 2,4-D dan Frekuensi Subkultur terhadap Perubahan Genetik Kalus dari Kalus Bunga Betina Kelapa Sawit (Elaeis guineensis Jacq.). [Skripsi]. Medan: Universitas Sumatera Utara, Program Sarjana.
Badrun, M. 2010. Lintasan 30 Tahun Pengembangan Kelapa Sawit. Kementerian Pertanian Republik Indonesia. Jakarta.
Bangun, S. I. I. 2002. Analisis Genotipe Normal dan Abnormal pada Klon Kelapa Sawit (Elaeis guineensis Jacq.) dengan RAPD. [Tesis]. Bogor: Institut Pertanian Bogor, Program Pascasarjana.
Bayzura, E. N. 2014. Pengaruh 2,4-D dan Frekuensi Subkultur terhadap Perubahan Genetik Kultur Apikal Bud Kelapa Sawit (Elaeis guineensis Jacq.) pada media MS. [Skripsi]. Medan: Universitas Sumatera Utara, Program Sarjana.
Becker, D. and Hedrich, R. Channelling Auxin Action: Modulation of Ion Transport by Indole-3-Acetic Acid. Plant Mol Biol. 49:349-356.
Billotte, N., Marseillac, N., Risterucci, A. M., Adon, B., Brottier, P., Baurens, F.
C., Singh, R., Herràn, A., Asmady, H., Billot, C., Amblard, P., Durand- Gasselin, T., Courtois, B., Asmono, D., Cheah, S. C., Rohde, W., Ritter, E.
and Charrier, A. 2005. Microsatellite-based High Density Linkage Map in Oil Palm (Elaeis guineensis Jacq.). Theor Appl Genet. 110: 754-765.
Corley, R. H. V. and Tinker, P. B. 2003. The Oil Palm. Ed ke-4. Blackwell Science Ltd. USA.
Corley, R. H. V., Lee, C. H., Law, L. H., and Wong, C. Y. 1986. Abnormal Flower Development in Oil Palm Clones. Planter. 62: 233-240.
Doyle, J. J. and J. L. Doyle. 1990. A Rapid DNA Isolation Procedure for Fresh Plant Tissue. Focus. 12: 13-15.
Eeuwens, C. J. 1976. Mineral Requirements for Growth and Callus Initiation of Tissue Explants Excised from Mature Coconut Palms (Cocos nucifera) and Cultured in vitro. Physiol. Plant. 36: 23-28.
Eeuwens, C. J., Lord, S., Donough, C.R., Rao, V., Vallejo, G. and Nelson, S. 2002.
Effects of Tissue Culture Condition During Embryoid Multiplication on The
UNIVERSITAS SUMATERA UTARA