Kinetika Adsorpsi Ion Cr(III) pada Biomassa-Kitosan
Imprinted Ionik
Titin Anita Zaharah
1, Anis Shofiyani
1*, Endah Sayekti
1 1Jurusan Kimia, Fakultas MIPA, Universitas Tanjungpura, Pontianak *Corresponding author: (e-mail) [email protected]
Abstrak. Pada penelitian ini telah dipreparasi Biomassa-Kitosan Imprinted Ionik (BKII) dan
Biomassa-Kitosan Non-Imprinted Ionik (BKNII) yang dilakukan dengan cara imprinting logam Cr(III) pada kitosan hidrogel, coating hidrogel kitosan pada biomassa mikroalga Chlorella dilanjutkan dengan crosslinking menggunakan reagen epiklorohidrin. Kompleks logam Cr(III) imprinted dielusi menggunakan larutan EDTA dan regenerasi adsorben menggunakan larutan NaOH. Kajian kinetika adsorpsi ion Cr(III) pada BKII dan BKNII dipelajari dengan cara menentukan jumlah ion logam teradsorpsi pada waktu kontak yang divariasi pada kisaran 5-120 menit. Penentuan konstanta laju adsorpsi dihitung berdasarkan model kinetika adsorpsi pseudo-order satu dan pseudo order-dua. Hasil penelitian menunjukkan bahwa ion Cr(III) teradsorpsi secara optimum masing-masing pada BKII dan BKNII pada waktu 60 menit. Hasil perhitungan menunjukkan bahwa adsorpsi ion Cr(III) masing-masing pada BKII dan BKNII mengikuti dengan baik model kinetika adsorpsi pseudo-order dua, mengindikasikan bahwa proses adsorpsi didominasi oleh mekanise secara kimia. Laju adsorpsi Cr(III) pada BKII berlangsung lebih cepat dibandingkan pada BKNII dengan nilai konstanta laju adsorpsi (k2) sebesar 14,774 dan 7,097 (g/mg.menit)
masing-masing pada BKII dan BKNII.
Kata kunci : Biomassa-Kitosan Imprinted-Ionik (BKII),kinetika, adsorpsi, Cr(III)
PENDAHULUAN
Salah satu jenis logam berat yang berbahaya di lingkungan adalah kromium. Akumulasi kromium dalam tubuh manusia dapat mengakibatkan kanker paru-paru, luka bernanah kronis serta kerusakan selaput tipis hidung. Keberadaan kromium dalam lingkungan perairan terutama sebagai sebagai limbah dari proses industri baja, elektroplating, cat, tinta, penyamakan kulit, pewarnaan tekstil dan industri kimia.
Berbagai penelitian dan teknik
pemisahan yang ditujukan untuk rekoveri logam kromium dari lingkungan perairan telah dilakukan antara lain melalui proses
pengendapan, ekstraksi fasa padat,
pertukaran ion, adsorpsi, elektrokimia ataupun proses membran [2].
Metode-metode ini umumnya rumit atau
memerlukan pelarut organik dalam jumlah besar, beberapa diantaranya berbahaya
untuk kesehatan dan menyebabkan masalah lingkungan. Dari berbagai teknik tersebut, penjerapan (adsorpsi) sering digunakan karena prosesnya yang relatif sederhana dan biaya relatif murah.
Kitosan dan turunannya merupakan jenis
polimer yang banyak dikembangkan
sebagai adsorben. Keutamaan kitosan
terletak pada gugus –NH2 dan –OH yang
dapat bertindak sebagai situs pengkhelat ion
logam. Pemanfaatan kitosan dan
crosslinked-kitosan sebagai adsorben logam
berat telah banyak dilakukan. Proses ikat silang mampu meningkatkan kekuatan mekanis kitosan namun kapasitas adsorpsi berkurang karena sebagian besar gugus
-NH2 telah digunakan untuk bereaksi dengan
agen pengikat silang. [8] Membuat
imprinted-kitosan untuk mengatasi
kelemahan tersebut. Imprinted-kitosan
mampu meningkatkan kapasitas adsorpsi ion logam namun tidak menguntungkan
secara kinetika karena hambatan difusi massa ion logam ke dalam struktur pori adsorben. Untuk itu, dikenalkan teknik
cetak-muka ionik (Surface Ionik
Imprinting) pada kitosan. [9], [10], [11],
yang mempreparasi Ni(II)-SMIB (Surface
Molecular Imprinted Biosorbent) dari
kitosan memanfaatkan miselia jamur
Penicillium sebagai material pendukung
untuk pengikatan ion logam Ni(II) dari limbah cair industri. Dilaporkan bahwa terjadi peningkatan kapasitas, selektivitas adsorpsi dan stabilitas dari adsorben yang yang signifikan. Adsorben yang dihasilkan
dapat dipergunakan nggan 15 kali dalam
proses adsorpsi-desorpsi atau regenerasi. Pada penelitian ini dibuat
biomassa-kitosan imprinted-ionik (BKII)
menggunakan ion Cr(III) sebagai ion logam templat. Selanjutnya dipelajari kinetika adsorpsi ion Cr(III) target pada BKII yang
akan dibandingkan dengan BKNII.
Biomassa yang digunakan sebagai material pendukung adalah dari jenis mikroalga
Chlorella yang telah dipublikasikan secara
luas mempunyai kinerja adsorpsi yang baik terhadap jenis-jenis tertentu logam berat (Aksu dan Donmez, 2006). Pemanfaatan
biomassa Chlorella sebagai material
pendukung kitosan bersifat sinergis karena
kemiripan struktur kimia dan
bio-kompatibilitasnya yang tinggi.
TUJUAN PENELITIAN
Mempelajari kinetika adsorpsi ion
Cr(III) pada biomassa-kitosan imprinted ionik (BKII) dan BKNII.
METODE PENELITIAN
Alat Penelitian
Peralatan analisis meliputi: Timbangan analitik (Mettler AE 160), spatula, labu ukur, gelas piala 100 mL, gelas ukur, pipet volum, pipet tetes, bol pipet, statip, siring, pengaduk magnet, labu semprot, pH meter,
porselin, alat penggerus (lumpang), ayakan
ukuran 80 mesh (Resth), dan
spektrofotometer serapan atom (Perkin Elmer 3101 Jepang).
Bahan Penelitian
Bahan analisis meliputi: Kitosan DD
85% (Sigma), CH3COOH glasial (Merck),
CrCl3.5H2O (Merck), akuades, akuabides,
epiklorohidrin 99% (Aldrich), NaOH
(Merck), etanol pa, Na2EDTA (Merck),
kertas saring biasa, kertas saring Whatman no. 42 (Whatman).
PROSEDUR PENELITIAN
Pembuatan Biomassa-Kitosan Imprinted Ionik (BKII)
BKII disintesis melalui 3 tahap kerja
menurut metode [10]
(i) Pertama, dibuat larutan logam Cr(III) konsentrasi 500 mg/L di dalam pelarut asam asetat dan pH larutan diatur pada 5,0 menggunakan larutan buffer asetat. Sejumlah 2,5 gram kitosan dilarutkan ke dalam 50 mL larutan logam tersebut dan diaduk selama 60 menit pada temperatur ruang. Gel homogen yang
terbentuk selanjutnya didiamkan
semalam untuk menghilangkan
gelembung-gelembung yang terbentuk. (ii) Tahap kedua : ditambahkan biomassa
alga Chloreela 1:1 (b/b) dan sejumlah akua DI. Campuran didiamkan selama 1 jam pada temperatur ruang setelah diaduk selama 15 menit. Campuran yang terbentuk selanjutnya diteteskan kedalam larutan NaOH-metanol. Gel beads yang terbentuk diaduk selama 1 jam, kemudian disaring dan dicuci hingga netral. Reaksi pengikatan-silang
dilakukan dengan cara merendam
butiran beads komplek chitosan-logam kedalam epiklorohidrin sambil diaduk
selama 24 jam. Butiran beads
selanjutnya disaring, dicuci
Tahap ketiga : Ion logam yang terikat
pada kompleks (ii) dilepaskan dengan
cara desorpsi menggunakan larutan EDTA 0,1M (3 kali desorbsi dengan metode batch) Setelah dilakukan penyaringan, adsorben diregenerasi kedalam larutan NaOH 0,1 M selama 1 jam, kemudian dipisahkan dengan cara disaring, dicuci bersih menggunakan akuades dan dikeringkan pada oven
dengan temperatur 600C, digerus dan
diayak ukuran 80 mesh.
Sebagai pembanding, dibuat biomassa-kitosan non-imprinted ionik (BKNII). Prosedur pembuatan BKNII sama dengan pembuatan BKII namun tidak dilakukan tahapan imprinted ion.
Penentuan parameter kinetika adsorpsi ion Cr(III) pada BKII dan BKNII
Kajian laju adsorpsi dilakukan dengan cara menginteraksikan sebanyak masing-masing 0,05 gram adsorben BKII dan BKNII dengan 10 mL larutan ion Cr(III) logam pada waktu kontak yang divariasi pada kisaran waktu 5-120 menit pada pH 5,0-5,5. Konsentrasi ion logam yang digunakan adalah 200 mg/L. Selanjutnya
adsorben dipisahkan dengan cara
penyaringan dan kandungan logam sisa
teradsorpsi ditentukan secara
spektrofotometri serapan atom.
Penentuan parameter kinetika adsorpsi ion Cr(III) pada BKII dan BKNII dilakukan menggunakan persamaan kinetika adsorpsi pseudo-order satu dari [12] sebagai berikut :
qe qt
qe k t 303 , 2 log log 1dimana qe dan qt adalah konsentrasi ion
logam teradsorpsi dalam kesetimbangan dan dalam waktu (t) (mg/L), t adalah waktu
kontak dalam satuan menit; dan k1 adalah
konstanta laju adsorpsi (menit-1).
Sedangkan konstanta laju adsorpsi pseudo-order dua dihitung berdasarkan persamaan
berikut: t q q k q t e e t 1 1 2 2 ) (
Selanjuntya nilai ion logam teradsorpsi
(qe) dan konstanta laju adsorpsi order-dua
(k2) ditentukan melalui slope dan intersep
dari kurva persamaan diatas.
HASIL DAN PEMBAHASAN
Kinetika adsorpsi menggambarkan laju pengikatan solut pada perubahan waktu kontak suatu reaksi. Kinetika adsorpsi merupakan salah satu karakteristik penting yang mendefinisikan efisiensi dari proses adsorpsi. Pada proses adsorpsi, kinetika dipengaruhi oleh reaksi penjerapan yang terjadi dan tahapan transfer massa yang mengiringi perpindahan ion logam dalam larutan menuju situs aktif adsorpsi yang terdapat pada adsorben. Model kinetika
pseudo-order 1 digunakan untuk
mendeskripsikan kesetimbangan reversibel antara fasa cair (adsorbat) dan padat (adsorben). Pada banyak kasus, model kinetika pseudo-order-satu tidak sesuai diterapkan pada hasil penelitian adsorpsi
ion logam pada kiitosan, sehingga
digunakan model kinetika pseudo-order-dua.
Pada model kinetika pseudo-order dua,
tahap pembatas laju adsorpsi yang
dipertimbangkan adalah adsorpsi secara kimia melalui berbagai mekanisme seperti
interaksi elektrostatik, pembentukan
kompleks atau pembentukan khelat.
Dari hasil penelitian, perubahan jumlah ion logam Cr(III) yang teradsorpsi pada masing-masing adsorben BKII dan BKNII pada perubahan waktu kontak adsorpsi ditunjukkan melalui Gambar 1.
Kurva pada Gambar 1 memperlihatkan pola laju adsorpsi ion Cr(III) yang hampir sama baik pada BKII maupun pada BKNII. Dari gambar juga terlihat bahwa terjadi kenaikan jumlah ion teradsorpsi pada pertambahan waktu kontak. Pada 30 menit
pertama, kenaikan jumlah ion teradsorpsi terjadi sangat cepat menandakan jumlah situs aktif pada masing-masing adsorben masih relatif cukup besar untuk dapat diakses oleh ion logam Cr(III). Pada
kenaikan waktu-waktu berikutnya,
peningkatan jumlah ion yang teradsorpsi menjadi lebih lambat dan akhirnya relatif tetap atau tidak menunjukkan perubahan ion teradsorpsi secara signifikan diatas
waktu kontak 60 menit. Hal ini
mengindikasikan bahwa ion logam Cr(III) mencapai waktu kesetimbangan adsorpsi-desorpsi pada masing-masing adsorben BKII dan BKNII setelah waktu kontak tersebut.
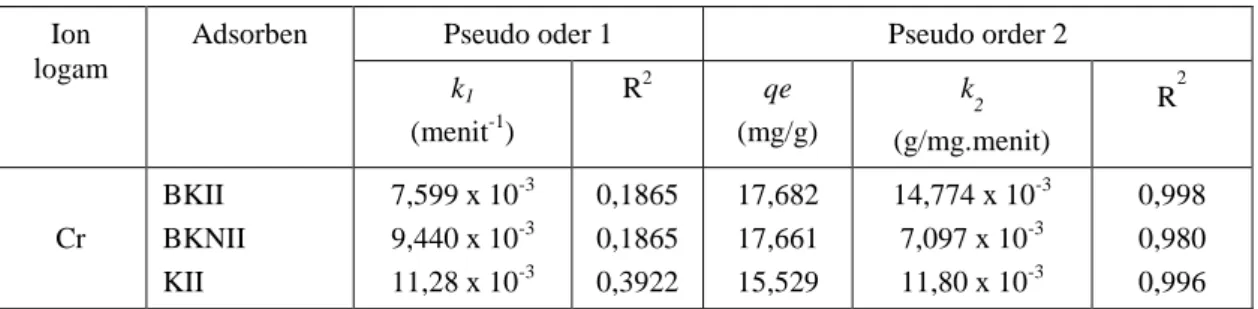
Perhitungan parameter kinetika adsorpsi menggunakan model persamaan kinetika adsoprsi order satu dan pseudo-order dua untuk untuk adsorpsi Cr(III) pada BKII dan BKNII disajikan melalui Tabel 1.
Dari Tabel 1 terlihat bahwa kinetika adsorpsi ion Cr(III) pada ketiga jenis adsorben lebih mengikuti kinetika pseudo order-2 dibandingkan pseudo order-1. Hal ini mengindikasikan bahwa dari berbagai jenis kemungkinan pola pengikatan ion logam pada adsorben hasil penelitian,
mekanisme adsorpsi secara kimia
dipertimbangankan memegang peran lebih dominan. Hasil ini juga sejalan dengan
data-data isoterm adsorpsi (tidak
ditampilkan) dimana adsorpsi monolayer lebih mendominasi mekanisme adsorpsi Cr(III) pada BKII, BKNII maupun KII. Proses isoterm adsorpsi yang terjadi pada monolayer permukaan adsorben menurut
Langmuir mengindikasikan terjadinya
mekanisme adsorpsi secara kimia yang terjadi secara spesifik dan kuat pada situs aktif yang juga spesifik.
Model kinetika pseudo-order-dua juga sukses diterapkan pada hasil penelitian adsorpsi Cu(II) pada kitosan [13], Au(III), Pt(IV) dan Pa(II) pada resin chitosan termodifikasi glisin, Ni(II) pada chitosan termodifikasi alginat.
Dari penelitian diperlihatkan bahwa
konstanta laju adsorpsi pseudo-order dua
(k2) pada BKII lebih besar dibandingkan
pada BKNII. Ini dapat diartikan bahwa adsorpsi Cr(III) pada BKII berlangsung lebih cepat dibandingkan pada BKNII. Hasil penelitian ini menjelaskan bahwa
proses imprinting berhasil menata
konfigurasi situs aktif pada adsorben dan menyiapkan templat yang sesuai untuk ion logam Cr(III) target. Peran biomassa
Chlorella sebagai material pendukung
kitosan dalam pembuatan BKII juga mampu meningkatkan kinerja adsorben yang dihasilkan dengan cara menata dan membuka situs aktif adsorben sehingga adsorpsi dapat berlangsung lebih cepat karena langsung terarah pada permukaan biosorben.
Pada proses adsorpsi, sewaktu adsorben BKII dikontakkan dengan ion logam Cr(III) yang sama dengan templat, situs aktif BKII langsung ‘mengenali‘ ion logam tersebut yang memungkinkan adsorpsi berlangsung lebih efektif dan relatif lebih cepat dibandingkan dengan adsorben yang
non-imprinted (BKNII). Sedangkan bila
dibandingkan dengan KII, adsorpsi Cr(III) pada BKII juga lebih cepat dibuktikan dengan nilai tetapan kinetika yang 25% lebih tinggi. Hal ini disebabkan peran
biomassa pada BKII menjadikan
konfigurasi situs aktif kitosan lebih tertata dan terarah pada permukaan adsorben sehingga membuka lebih banyak situs aktif
Gambar 1. Kurva perubahan ion Cr(III) teradsorpsi
Laju adsorpsi ion Cr(III) pada BKII dan BKNII
0 4 8 12 16 20 0 30 60 90 120 150 waktu (menit) q t (m g /g C r( II I) t e ra d s o rp s i) Cr-BKII Cr-BKNII
Tabel 1. Parameter kinetika adsorpsi Cr(III) pada BKII dan BKNII
Ion logam
Adsorben Pseudo oder 1 Pseudo order 2
k1 (menit-1) R2 qe (mg/g) k 2 (g/mg.menit) R2 Cr BKII BKNII KII 7,599 x 10-3 9,440 x 10-3 11,28 x 10-3 0,1865 0,1865 0,3922 17,682 17,661 15,529 14,774 x 10-3 7,097 x 10-3 11,80 x 10-3 0,998 0,980 0,996
adsorpsi yang bisa diakses oleh adsorbat ion Cr(III). Karena adsorpsi lebih terarah di permukaan biosorben, maka porsi difusi ion logam (adsorpsi fisika) yang memerlukan waktu lebih lama menuju struktur kitosan menjadi berkurang, dan adsorpsi pada permukaan BKII menjadi lebih cepat dan efisien. Data-data yang dihasilkan pada kinetika ini saling mendukung dengan data-data sebelumnya yakni data-data isoterm dan karakteristik adsorben hasil penelitian.
KESIMPULAN
Kajian kinetika adsorpsi ion Cr(III) pada Biomassa-Kitosan Imprinted Ionik Ionik (BKII) menunjukkan bahwa ion Cr(III) teradsorpsi secara optimum pada BKII dan BKNII pada waktu 60 menit. Adsorpsi ion Cr(III) pada BKII dan BKNII mengikuti dengan baik model kinetika adsorpsi pseudo-order dua, mengindikasikan bahwa mekanisme adsorpsi secara kimia lebih dominan terjadi pada proses pengikatan ion Cr(III). Proses imprinting ionik berhasil menata konfigurasi situsaktif pada adsorben BKII dan menyiapkan templat yang sesuai untuk ion logam Cr(III) target, sehingga adsorpsi pada BKII berlangsung lebih cepat dan efektif, ditandai dengan nilai konstanta
laju adsorpsi Cr(III) pseudo-order dua (k2)
yang lebih besar (14,774 g/mg.menit) dibandingkan 7,097 (g/mg.menit) pada BKNII.
UCAPAN TERIMA KASIH
Penelitian ini merupakan bagian dari
penelitian yang didanai oleh Ditjen Dikti melalui skim Penelitian Hibah Bersaing Tahun 2012.
DAFTAR PUSTAKA
Sperling M, Zu S dan Weiz B, 1992, Determination of Chromium(III) and (VI) in water Using Flow Injection On-Line preconcentration With Selective Adsorption On Activated Alumina, Anal.
Chem. 64: 3101-3108
Modrzejewska, Z. dan Kaminsky, W., 1999, Separation of Cr(VI) on Chitosan Membranes, Ind. Eng. Chem. Res. 38: 4946-4950
Ngah WS dan Liang KH, 1999, Adsorption of Gold(III) Ions onto Chitosan and N-Carboxymethyl Chitosan: Equilibrium Studies, Ind. Eng. Chem. Res, 10: 3164-3167
Gao Y, Lee K.H, Oshima M, dan Motomizu S, 2000, Adsorption Behaviour of Metal Ions on Cross-linked Chitosan and the
Determination of Oxoanions after
Pretreatment with a Chitosan Column,
Anal.Sci, 16:13031308.
Guibal E, 2004, Interactions of Metal Ions with Chitosan-based Sorbents : A Review, Sep. Purif. Technol, 38: 43-74 Li N dan Bai R, 2006, Development of
Chitosan-Based Granular Adsorbents for Enhanced And Selective Performance in
Heavy Metal Removal,