PEMBUATAN DAN KARAKTERISASI KITOSAN-UREA DENGAN PENAMBAHAN ASAM KLOROASETAT DAN
GLUTARALDEHID SEBAGAI ADSORBEN ION LOGAM Cu2+
MELALUI TEKNIK ADSORPSI FLUIDISASI
SKRIPSI
NOURMALASARI AISYAH
PROGRAM STUDI S-1 KIMIA DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
PEMBUATAN DAN KARAKTERISASI KITOSAN-UREA DENGAN PENAMBAHAN ASAM KLOROASETAT DAN
GLUTARALDEHID SEBAGAI ADSORBEN ION LOGAM Cu2+
MELALUI TEKNIK ADSORPSI FLUIDISASI
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar SarjanaSains Bidang Kimia Pada Fakultas Sains dan Teknologi
Universitas Airlangga
NOURMALASARI AISYAH 080810054
Tanggal Lulus: 17 Juli 2012
Disetujui Oleh :
Pembimbing I
Dr. Ir. Suyanto, M.Si NIP. 19520217 198203 1 001
Pembimbing II
LEMBAR PENGESAHAN NASKAH SKRIPSI
Judul : Pembuatan dan Karakterisasi Kitosan-Urea dengan Penambahan Asam Kloroasetat dan Glutaraldehid Sebagai Adsorben Ion Logam Cu2+ Melalui Teknik Adsorpsi Fluidisasi
Penyusun : Nourmalasari Aisyah
NIM : 080810054
Tanggal Ujian : 17 Juli 2012
Pembimbing I
Dr. Ir. Suyanto, M.Si NIP. 19520217 198203 1 001
Pembimbing II
Siti Wafiroh, S.Si, M.Si NIP. 19681209 199411 2 001
Mengetahui,
Ketua Program Studi S-1 Kimia Departemen Kimia
Fakultas Sains dan Teknologi Universitas Airlangga
PEDOMAN PENGGUNAAN SKRIPSI
Skripsi ini tidak dipublikasikan, namun tersedia di perpustakaan dalam
lingkungan Universitas Airlangga, diperkenankan untuk dipakai sebagai referensi
kepustakaan, tetapi pengutipan harus seizin penyusun dan harus menyebutkan
sumbernya sesuai kebiasaan ilmiah. Dokumen skripsi ini merupakan hak milik
KATA PENGANTAR
Assalamualaikum wr.wb
Puji syukur kehadirat Allah SWT atas segala rahmat dan hidayah-Nya, sehingga penyusun dapat menyelesaikan skripsi dengan judul Pembuatan dan
Karakterisasi Kitosan-Urea dengan Penambahan Asam Kloroasetat dan
Glutaraldehid Sebagai Adsorben Ion Logam Cu2+ Melalui Teknik Adsorpsi
Fluidisasi. Shalawat serta salam tetap tercurahkan kepada Nabi Muhammad SAW
karena berkat perjuangan beliau dan para sahabatnya, penyusun bisa menikmati indahnya iman.
Penyusun menyadari bahwa penulisan naskah skripsi ini tidak lepas dari bantuan berbagai pihak, untuk itu penyusun menyampaikan terima kasih kepada:
1. Bapak Dr. Ir. Suyanto, M.Si selaku pembingbing I dan Ibu Siti Wafiroh, S.Si, M.Si selaku pembingbing II yang telah memberikan ide, saran, koreksi, doa dan bimbingan sampai terselesaikan skripsi ini.
2. Bapak Dr. Mulyadi Tandjung, M.S selaku penguji I dan Ibu Dr. Muji Harsini, M.Si selaku penguji II yang telah memberikan saran, doa, dan bimbingan hingga terselesaikan skripsi ini.
3. Ibu Dr. Afaf Baktir selaku Dosen Wali yang senantiasa membimbing serta
memberikan banyak masukan selama kegiatan kuliah.
4. Ibu Dr. Alfinda Novi Kristanti, DEA selaku Ketua Departemen Kimia yang senantiasa memberikan dukungan.
5. Seluruh staf pengajar Fakultas Sains dan Teknologi Universitas Airlangga, atas ilmu yang telah diberikan.
6. Bapak Nono Mariyono dan Ibu Lusy Sawitri, serta kakak dan adik yang telah memberikan kasih sayang, dukungan moral dan spiritual serta doa yang senantiasa mengalir demi kesuksesan anak-anaknya.
7. Ardana Yudistira Aulia yang telah banyak memberikan doa dan bantuan selama kegiatan menyelesaikan skripsi.
8. Teman-teman kimia angkatan 2008 khususnya Puji Lestari, Asri Zulchana,
Vridayani Anggi, Ryan Rachmawan, Ayu Eprilita, Yan Polan, Nadya Aisya, Jemmy Mahesa, Reylah Mustika, Della Ratna, Laras Risqoniah, Riza Damayanti, Siti Mariam, Wike Arnovia, Ariesta Faulina, Faiz Tamami, M.Avi, Farradhina Choria, Ratih Kusuma.
9. Teman-teman KKN Somber khususnya Gerry Maulana, Neni Oktavia, Rara Gendis, Darari Rahmantya, Nanda Firmanda, Isnaini Septi, Titis Rieski, dan Wisudawan, yang banyak memberikan dukungan pada penulis selama mengerjakan skripsi.
10.Teman-teman angkatan 2008, 2009, 2010 yang senantiasa menemani dalam menuntut ilmu dalam perkuliahan.
11.Teman-teman yang telah membantu pada proses pembuatan kolom fluidisasi,
terimakasih untuk semangat serta saran yang telah diberikan.
Penyusun menyadari bahwa dalam penulisan naskah skripsi ini masih banyak kekurangan, sehingga penyusun mengharapkan kritik dan saran yang membangun demi perbaikan skripsi ini. Penyusun berharap naskah skripsi ini dapat bermanfaat dan
sedikit memberikan kontribusi dalam pengembangan ilmu pengetahuan dan teknologi di negeri ini.
Wassalamu’alaikum wr.wb
Surabaya, Juli 2012 Penyusun,
Aisyah, N., 2012, Pembuatan dan Karakterisasi Kitosan-Urea dengan Penambahan Asam Kloroasetat dan Glutaraldehid Sebagai Adsorben Ion Logam Cu2+ Melalui Teknik Adsorpsi Fluidisasi. Skripsi ini di bawah bimbingan Dr. Ir. Suyanto, M.Si., dan Siti Wafiroh, S.Si, M.Si., Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya
ABSTRAK
Kitosan merupakan biopolimer dengan kemampuan adsorpsi terhadap ion logam yang sangat baik. Modifikasi kitosan banyak dilakukan sebagai upaya meningkatkan kemampuan adsorpsi terhadap ion logam. Penelitian ini bertujuan mengetahui pengaruh pembuatan kitosan-urea dengan penambahan asam kloroasetat, glutaraldehid dan urea, serta kemampuan kitosan-urea dalam mengadsorpsi ion logam Cu2+ melalui metode adsorpsi fluidisasi. Pada penelitian ini, senyawa turunan kitosan yaitu kitosan urea disintesis melalui dua tahap, tahap pertama o-carboksimetilasi dan modifikasi dengan penambahan glutaraldehid- urea. Karakterisasi senyawa kitosan dan kitosan-urea dilakukan menggunakan spektroskopi FT-IR dan pengukuran kadar ion logam Cu2+ hasil adsorpsi dianalisis menggunakan AAS pada panjang gelombang maksimal 324.75 nm. Proses transformasi kitosan setelah penambahan asam kloroasetat terlihat pada perubahan struktur pada gugus hidroksil menghasilkan karboksi metil kitosan. Penambahan glutaraldehid-urea pada karboksi metil kitosan mensubstitusi pada gugus amina. Modifikasi kitosan menjadi kitosan-urea digunakan sebagai adsorben ion logam Cu2+. Proses adsorpsi dilakukan menggunakan metode adsorpsi fluidisasi dengan mengontakkan 0.5 gram adsorben kitosan-urea dengan 200 ml larutan yang mengandung ion logam Cu2+ dengan waktu kontak selama 20 hingga 100 menit. Metode adsorpsi fluidisasi lebih efektif, hal ini terlihat dari hasil kapasitas adsorpsi kitosan pada ion logam Cu2+ sebesar 34.51 mg/g dalam waktu adsorpsi 180 menit, dan kapasitas adsorpsi kitosan-urea sebesar 35.76 mg/g dalam waktu adsorpsi 80 menit.
Kata kunci : kitosan, modifikasi kitosan, asam kloroasetat, glutaraldehid,
Aisyah, N., 2012, Synthesize and Characterisation Chitosan-Urea With Addition of Chloroacetic acid and Glutaraldehyde as Adsorbent Cu 2+ Ion by Fluidization Adsorption Technique. This study is under guidance of Dr. Ir. Suyanto, M.Si., and Siti Wafiroh, S.Si, M.Si., Department of Chemistry, Science and Technology Faculty, Universitas Airlangga.
ABSTRACT chitosan-urea modified chitosan derivatives were synthesizes through two steps, o-carboxymethylated first and then modified by the addition of glutraldehyde-urea Characterization of chitosan and chitosan-urea performed by FT-IR spectroscopy and determination of Cu2+ metal ions adsorption results were analyzed using AAS at wavelength of 324.75 nm. The chitosan transformation process after addition of chloroasetic acid changes in the structure of the hydroxyl group then produce carboxy methyl chitosan. The addition of glutaraldehyde-urea in the carboxy methyl chitosan substituting on the amine group. Modifications chitosan into chitosan-urea is used as adsorbent of metal ions Cu2+. The process adsorption by fluidization adsorption method using 0.5 grams of adsorbent chitosan-urea in 200 ml solution containing metal ions Cu2+ with the contact time for 20 to 100 minutes. Fluidization adsorption method is considered as an effective method. This is evident from the result of the adsorption capacity of chitosan on the metal ions Cu2+ at 34.51 mg/g in the adsortption time of 180 minutes, and the adsorption capacity of chitosan-urea of 35.76 mg/g in the adsorption time of 80 minutes.
Keywords : chitosan, modified chitosan, chloroacetic acid, glutaraldehyde,
DAFTAR ISI
Halaman
LEMBAR JUDUL ... i
LEMBAR PERNYATAAN... ii
LEMBAR PENGESAHAN ... iii
LEMBAR PEDOMAN PENGGUNAAN SKRIPSI ... iv
KATA PENGANTAR ... v
2.3Karakterisasi Kitin dan Kitosan ... 14
2.4Kitosan Termodifikasi ... 18
2.5Urea ... 20
2.6Logam Berat ... 21
2.7Logam Tembaga ... 22
2.8Adsorpsi... 23
2.9Teknik Adsorpsi Fluidisasi ... 24
2.10Spektroskopi FTIR ... 27
2.11AAS ... 28
BAB III METODE PENELTIAN ... 30
3.1Tempat dan Waktu Penelitian ... 30
3.2.1Bahan-bahan penelitian ... 30
3.2.2Alat-alat penelitian ... 30
3.3Diagram Kerja ... 31
3.4Pembuatan Reagen ... 32
3.5Prosedur Penelitian ... 34
3.5.1Preparasi serbuk cangkang rajungan ... 34
3.5.2Pembuatan kitosan dari kitin ... 34
3.5.3Karakterisasi kitin dan kitosan ... 36
3.5.4Pembuatan kitosan-urea ... 37
3.5.5Proses adsorpsi ... 38
3.5.6Penentuan kapasitas adsorpsi logam Cu2+ dalam kitosan-urea ... 39
3.5.5 Penentuan ukuran pori adsorben kitosan-urea ... 40
BAB IV HASIL DAN PEMBAHASAN ... 41
4.1Hasil Preparasi Serbuk Cangkang Rajungan ... 41
4.2Hasil Pembuatan Kitosan dari Kitin ... 41
4.2.1Tahap isolasi kitin dari cangkang rajungan ... 41
4.2.2Hasil transformasi kitin menjadi kitosan ... 44
4.3Hasil Karakterisasi Kitin dan Kitosan ... 46
4.3.1Hasil uji kelarutan kitosan ... 46
4.3.2Hasil penentuan berat molekul rata-rata kitsoan ... 47
4.3.3Hasil penentuan derajat deasetilasi dengan FTIR ... 47
4.4Hasil Pembuatan Kitosan-urea ... 50
4.4.1Hasil pembuatan karboksi metil kitosan ... 50
4.4.2Hasil pembuatan karboksi metil kitosan dan glutaraldehid-urea ... 53
4.5Hasil Proses Adsorpsi ... 60
4.5.1Pembuatan kurva standar Cu ... 62
4.5.2Pengukuran kadar ion logam Cu2+ hasil adsorpsi ... 63
4.5.3Hasil penentuan kapasitas adsorpsi ion logam Cu2+ dalam kitosan-urea ... 66
4.5.4Hasil analisa BET pengukuran pori kitosan-urea ... 68
DAFTAR TABEL
Nomor Judul Tabel Halaman
2.1 Komposisi cangkang rajungan ... 9
4.1 Gugus fungsi dan bilangan gelombang kitin dan
kitosan ... 48
4.2 Gugus fungsi dan bilangan gelombang senyawa
organik dan karboksi metil kitosan ... 53
4.3 Gugus fungsi dan bilangan gelombang senyawa
organik dan kitosan-urea ... 60
4.4 Adsorpsi ion logam Cu2+ dari kitosan pada beberapa penelitian menggunakan senyawa turunan kitosan... 67
DAFTAR GAMBAR
Nomor Judul Gambar Halaman
2.1 Struktur kitin ... 8
2.2 Struktur kitosan ... 10
2.3 Mekanisme transformasi kitin menjadi kitosan ... 11
2.4 Spektrum FTIR senyawa kitosan ... 15
2.5 Mekanisme reaksi karboksi metil kitosan ... 19
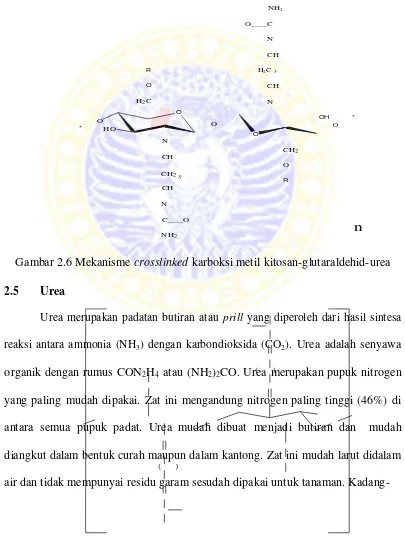
2.6 Mekanisme crosslinked karboksi metil kitosan glutaraldehid-urea ... 20
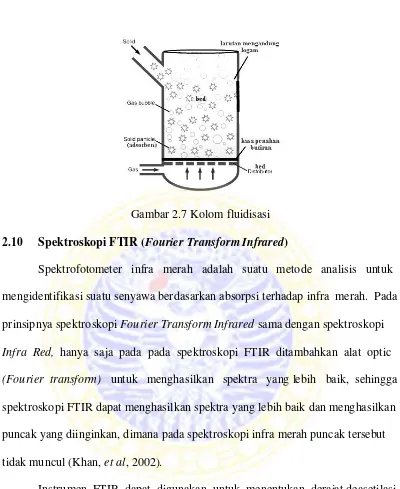
2.7 Kolom fluidisasi ... 27
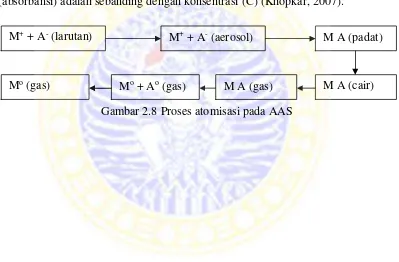
2.8 Proses atomisasi pada AAS ... 29
3.1 Kolom fluidisasi pada penelitian ... 39
4.1 Serbuk cangkang rajungan ... 41
4.2 Reaksi deproteinasi ... 42
4.3 Reaksi demineralisasi ... 43
4.4 Reaksi deasetilasi ... 45
4.5 Serbuk kitosan ... 46
4.6 Kelarutan kitin (a) dan kitosan (b) ... 47
4.7 Spektrum FT-IR kitin ... 48
4.8 Spektrum FT-IR kitosan... 49
4.9 Karboksi metil kitosan ... 51
4.10 Struktur senyawa karboksi metil kitosan ... 52
4.11 Spektrum FT-IR karboksi metil kitosan... 52
4.12 Struktur glutaraldehid... 54
4.13 Struktur urea ... 54
4.14 Mekanisme reaksi glutaraldehid dan urea ... 55
4.15 Kitosan-urea ... 56
4.16 Mekanisme reaksi pembentukan kitosan-urea ... 57
4.17 Hipotesis struktur kitosan-urea ... 59
4.18 Spektrum FT-IR kitosan-urea ... 59
4.19 Kolom adsorpsi fluidisasi ... 61
4.20 Kurva standar Cu ... 62
4.21 Grafik adsorpsi ion logam Cu2+ oleh kitosan... 63
4.22 Grafik adsorpsi ion logam Cu2+ oleh kitosan-urea ... 64
DAFTAR LAMPIRAN
Nomor Judul Lampiran
1 Data hasil perubahan massa cangkang rajungan pada proses isolasi
kitin menjadi kitosan
2 Data penentuan berat molekul kitosan rata-rata kitosan
3 Data hasil karakterisasi FTIR kitin dan kitosan organik dan
karboksi metil kitosan
4 Data hasil adsorpsi ion logam Cu2+ oleh kitosan dan kitosan-urea
5 Data hasil penentuan kapasitas adsorpsi ion
BAB I
PENDAHULUAN
1.1 Latar Belakang Permasalahan
Logam berat di lingkungan perairan sebagian besar menyebabkan
kerusakan parah, yang berakibat pada kehidupan manusia dan lingkungan
perairan. Pencemaran logam berat dianggap sebagai bahan yang tidak dapat
didegradasi. Senyawa organik beracun dan logam berat sebagian besar berasal
dari kegiatan industri, seperti industri elektroplating, dan metalurgi (Vega et al,
2006). Toksisitas dari pencemaran yang terus menerus mencemari lingkungan
akan sangat berbahaya bagi kehidupan manusia dan lingkungan sekitarnya (Jang
et al, 2005). Oleh karena itu, logam berat harus diolah sehingga memenuhi standar
ambang batas sebelum dibuang kewilayah perairan. Tembaga (Cu2+) merupakan
ion logam yang mendapat perhatian utama sebagai bahan pencemar lingkungan,
karena secara luas digunakan dalam pembuatan pupuk, penyulingan minyak bumi,
cat dan pigmen, kertas dan pulp, pengecoran, industri elektroplating. Penyerapan
Cu2+ yang berlebihan didalam tubuh (lebih dari 1.0 mg / L pada air minum) dapat
menyebabkan anemia, hemolitik, kelainan neurologis dan kerusakan kornea
(Massaro, 2003).
Berbagai metode physico-chemical termasuk filtrasi, pertukaran osmosis
(Ning, 2002), electrochemical treatment (Chen et al, 2002), pertukaran ion,
karbon aktif (Hu et al, 2003), adsorpsi, dan teknologi membran (Reddad et al,
2003), koagulasi dan flokulasi yang digunakan untuk mengurangi dan
sebagai pretreatment, posttreatment atau metode utama dalam penanganan
limbah. Namun, metode ini memiliki banyak kelemahan. Sebagai contoh,
pertukaran ion adalah metode yang efisien, tetapi tidak hanya menghilangkan ion
logam berat tetapi terjadi pertukaran Ca2+ dan Mg2+ (Li et al, 2008). Beberapa
teknologi ini termasuk dalam teknologi dengan biaya yang relatif mahal. Beberapa
metode tersebut tidak efektif terutama pada ion logam berat dengan konsentrasi
yang lebih rendah dai 100 mg/L logam. Upaya pengurangan Cu2+ dari air limbah
telah banyak diselidiki. Pada berbagai penelitian telah banyak diselidiki manfaat
dari polimer sebagai bahan alternatif yang efisien dan ekonomis, serta proses
adsorpsi yang secara khusus digunakan dalam pengolahan air (Copello et al,
2008).
Adsorpsi adalah metode yang sangat efektif untuk menghilangkan limbah
beracun dari limbah yang mengandung logam berat, terutama karena kemudahan
proses dan biaya yang murah sebagai adsorben alami seperti limbah pertanian,
bahan pembuatan tanah liat, biomassa dan pengolahan limbah hasil laut.
Penggunaan biopolimer sebagai adsorben ion logam telah banyak dilakukan.
Menurut Ravi dan Muzarelli tahun 2004, kitosan adalah biopolimer yang berasal
dari kitin dan dapat diaplikasikan secara luas dalam pengolahan air limbah,
industri kimia, biomedis dan farmasi. Kitosan diperoleh dari proses deasetilasi
kitin yang memiliki manfaat lebih luas. Kitosan tidak beracun, bersifat
bioadsorben dan memiliki berbagai macam fungsi biologis termasuk
antitrombogenik, meningkatkan imunitas, homeostatik, dan penyembuhan luka
Kitosan telah digunakan secara luas sebagai adsorben untuk mengurangi
pencemaran air yang terkontaminasi logam berat. Kitosan memiliki kemampuan
mengikat logam beracun lebih dari 1 mmol / gram. Kemampuan pengikatan
kitosan terhadap logam tertentu lebih besar dibandingkan dengan karbon aktif
(Varma et al, 2004). Besarnya adsorpsi kitosan tergantung pada sumber kitosan,
derajat deasetilasi, sifat dari ion logam dan pH larutan (Cestari et al, 2005).
Biopolimer kitosan mudah diperoleh dari deasetilasi kitin, sebuah
mukopolisakarida alami yang banyak ditemukan dalam eksoskeleton serangga,
cangkang crustaceae dan dinding sel jamur (Arica et al, 2004). Rajungan sebagai
salah satu komoditas ekspor sektor perikanan Indonesia yang dijual dalam bentuk
kemasan dalam kaleng. Proses pengemasan ini menghasilkan limbah kulit
(cangkang) dalam jumlah besar, sekitar 40-60% dari total berat rajungan (Rahayu
dan Purnavita, 2004). Semakin banyak limbah rajungan yang belum dimanfaatkan
secara maksimal, perlu adanya solusi. Sehingga dapat mengurangi permasalahan
lingkungan, seperti bau dan estetika yang kurang baik, yang nantinya memberikan
nilai tambah bagi usaha pengolahan rajungan (Rahayu dan Purnavita, 2004).
Limbah cangkang rajungan masih mengandung senyawa kimia cukup
banyak yaitu protein, mineral dan kitin. Kitin adalah polimer alam yang tidak larut
dalam air, sehingga penggunaannya terbatas. Namun dengan modifikasi kimia
dapat diperoleh senyawa turunan kitin yang mempunyai sifat kimia dan efek yang
lebih baik, yaitu kitosan (Ramesh et al, 2008).
Kitosan terdiri dari β-(1,4)-2-acetamido-2-deoxy-β-D-glucose dan unit β-
reaktif serta dapat menyerap ion logam pada larutan netral. Hal ini secara
signifikan mampu meningkatkan kapasitas adsorpsi secara fisik maupun kimia.
Yang termasuk dalam modifikasi kimia adalah cross-lingking (meningkatkan
stabilisasi polimer dalam larutan asam) (Piron et al, 1997), dan penambahan
gugus fungsi (memperbanyak bidang adsorpsi) (Martins et al, 2004). Modifikasi
yang banyak dilakukan para peneliti adalah dengan cara crosslinked antar rantai
atau mengubahnya dalam bentuk garam (Purwatiningsih, 2009). Beberapa macam
bahan yang digunakan untuk crosslinking adalah glutaraldehid (Wan Ngah et al,
2006), epiklorohidrin dan etilenglikol diglisidil eter (Ngah et al, 2002). Diantara
senyawa turunan kitosan, percabangan gugus fungsi karboksil mampu
meningkatkan daya adsorpsi dari kitosan. Crosslinked pada kitosan dengan
penambahan glutaraldehid mampu meningkatkan kapasitas adsorpsi dari adsorben
(Sun dan Wang, 2005). Screenivasan tahun 2009, pada penelitiannya
menggunakan kitosan tercrosslinked glutaraldehid dan epiclorohydrin yang
mampu meningkatkan penyerapan ion logam Cu2+ sebanyak 82%. Kitosan juga
memiliki kemampuan untuk menyerap ion logam Cu2+ dan Cr4+ yang terdapat
pada limbah (Schmuhl et al, 2001).
Proses adsorpsi logam berat secara umum menggunakan metode batch
atau sistem aliran silang. Metode batch memiliki beberapa kelemahan, yaitu
jumlah adsorben yang banyak akibat penampungan larutan dan adsorben dari
batch ke batch berikutnya, pemurnian yang kurang merata terhadap adsorben,
serta efisiensi terhadap waktu penyerapan logam terhadap adsorben (Crittenden,
proses adsorpsi, diantaranya adalah teknik adsorpsi fluidisasi (fluidized bed
adsorption) yaitu teknik adsorpsi dalam media kolom dengan aliran gas secara
kontinyu melalui bed penahan adsorben. Fluidisasi digambarkan sebagai proses
kontak antara solid dengan fluid. Fluidisasi merupakan proses pengontakan bahan
padat dengan fluida sehingga sifatnya berubah menyerupai sifat fluida. Kelebihan
dari teknik adsorpsi fluidisasi adalah pergerakan adsorben dalam bagian kolom
sebagai akibat adanya proses aliran gas dalam kolom, mampu mengadsorpsi ion
logam dalam larutan secara maksimal, serta efisiensi waktu yang lebih baik
(Crittenden, 1998).
Pada penelitian sebelumnya, kitosan murni digunakan sebagai adsorben
pada ion logam Cu2+ yang menghasilkan kapasitas adsorpsi maksimal sebesar
37,88 mg/gr dan penyerapan pada ion logam Pb2+ menghasilkan kapasitas
adsorpsi maksimal sebesar 13,05 mg/g (Chen et al, 2008). Wang tahun 2010,
dalam penelitiannya menggunakan kitosan termodifikasi glutaraldehid dan tiourea
mampu mengadsorpsi ion logam Hg2+ dengan kapasitas adsorpsi sebesar 6,29
mmol/g. Chen tahun 2009, menggunakan kitosan termodifikasi glutaraldehid dan
crosslinked logam mampu mengadsorpsi ion Cu2+ dengan kapasitas adsorpsi
sebesar 33,00 mg/gr.
Pada penelitian ini akan disintesis kitin dari cangkang rajungan, melalui
tahap deproteinasi, demineralisasi dan depigmentasi. Kemudian melalui proses
deasetilasi kitin ditransformasi menjadi kitosan. Kitosan yang diperoleh
dimodifikasi menjadi kitosan-urea dengan penambahan asam kloroasetat,
diharapkan mampu meningkatkan kemampuan adsorpsi dari adsorben kitosan-
urea. Kitosan-urea yang telah disintesis digunakan sebagai adsorben ion logam
Cu2+ dengan teknik adsorpsi fluidisasi. Kitin, kitosan, dan kitosan-urea
dikarakterisasi dengan menggunakan FT-IR, larutan logam Cu2+ dianalisis
menggunakan AAS, dan adsorben kitosan-urea dianalisis menggunakan uji BET.
1.2 Rumusan Masalah
Berdasarkan latar belakang masalah tersebut di atas, maka dapat
dirumuskan masalah sebagai berikut.
1. Bagaimana mensintesis kitosan-urea dengan penambahan asam
kloroasetat dan glutaraldehid sebagai agen crosslinked ?
2. Bagaimana pengaruh variasi konsentrasi urea pada sintesis kitosan-
urea sebagai adsorben ion logam Cu2+ dari hasil kapasitas adsorpsi dan
variasi waktu kontak dalam menyerap ion logam Cu2+ melalui proses
adsorpsi fluidisasi ?
1.3 Tujuan
Tujuan penelitian ini adalah sebagai berikut.
1. Mensistesis kitosan-urea dengan penambahan asam kloroasetat dan
glutaraldehid sebagai agen crosslinked
2. Mengetahui pengaruh variasi konsentrasi urea pada sintesis kitosan-
urea sebagai adsorben ion logam Cu2+ dan variasi waktu kontak
1.4 Manfaat Penelitian
Dari hasil penelitian ini diharapkan dapat dihasilkan suatu metode yang
efektif untuk mengurangi ion logam Cu2+ di perairan sehingga bermanfaat untuk
BAB II
TINJAUAN PUSTAKA
2.1 Kitin
Kitin disebut sebagai polisakarida linear (1,4)-2-acetamida-2-deoksi- β
-D-glukosa atau poli-(β-1,4-N-asetilglukosamin) yang merupakan polisakarida alami
dengan kelimpahan terbesar kedua setelah selulosa (Khor, 2010). Kitin dengan
rumus molekul (C8H13NO5)n tersusun atas 47% C, 6% H, 7% N dan 40%
O. Struktur kitin menyerupai selulosa dan hanya berbeda pada gugus yang terikat
di posisi atom C2. Gugus C2 pada selulosa adalah gugus hidroksil, sedangkan
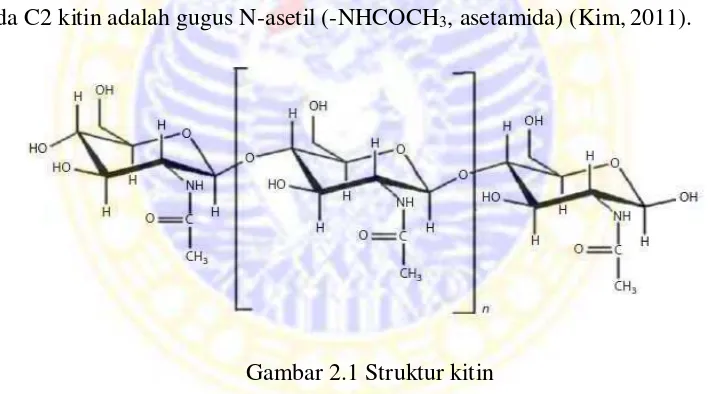
pada C2 kitin adalah gugus N-asetil (-NHCOCH3, asetamida) (Kim, 2011).
Gambar 2.1 Struktur kitin
Kitin adalah senyawa yang berwarna putih, elastis, polisakarida nitrogen
dengan biodegradasi, biokompatibilitas, bersifat nontoksik, dan dapat
diaplikasikan sebagai adsorben pada adsorpsi logam (No dan Meyers, 2000).
Sumber kitin yang sangat potensial adalah kerangka luar Crustacea (seperti
udang, rajungan, dan lobster), serangga, dinding yeast dan jamur, serta mollusca
Rajungan merupakan salah satu komoditas ekspor sektor perikanan
Indonesia yang dijual dalam bentuk rajungan beku atau kemasan daging dalam
kaleng. Pada proses pengambilan dagingnya, dihasilkan limbah kulit (cangkang)
cukup banyak, jumlahnya mencapai sekitar 40-60% dari total berat rajungan
(Rahayu dan Purnavita, 2004). Limbah cangkang rajungan mengandung senyawa
kimia yaitu protein, mineral dan kitin. Komposisi dari cangkang rajungan
ditunjukkan pada tabel 2.1.
Tabel 2.1 Komposisi cangkang rajungan
Komposisi Jumlah kandungan (%)
Kadar air 5,50
Kadar abu 48,43
Kadar protein 40,53
Kitin 15,04
Kadar Asetil 88,12
Sumber : Hartati (2002)
Berdasarkan sifatnya yang tidak larut dalam air, penggunaan kitin sangat
terbatas. Namun dengan modifikasi struktur kimianya kitin memiliki sifat yang
lebih baik sehingga dapat dimanfaatkan secara luas.
Menurut Khor (2010) proses isolasi kitin dan pembuatan kitosan adalah
sebagai berikut :
1. Deproteinasi
Kitin didalam cangkang luar dari crustaceae berikatan dengan kalsium
karbonat (CaCO3) dan protein. Pada cangkang mengandung 30-40% protein dari
komponen organik total. Protein terikat secara fisik dan sebagian lainnya terikat
secara kovalen. Kadar protein dari crustaceae beragam tergantung dari jenisnya.
umum dilakukan pada suasana basa, dengan reagen seperti NaOH, Na2CO3, KOH,
NaHSO3.
2. Demineralisasi
Kandungan mineral cangkang crustaceae umumnya sebanyak 30-50%
mineral, dengan mineral terbanyak yaitu CaCO3. Mineral lain yaitu Ca3(PO4)2
dengan kadar 8-10% dari total bahan organik. Karena garam-garam anorganik
terikat secara fisik, senyawa CaCO3 lebih mudah dipisahkan dibanding protein.
Demineralisasi secara umum dilakukan dengan larutan HCl atau asam lain seperti
H2SO4.
3. Depigmentasi
Depigmentasi adalah proses pemutihan (bleaching) pada kitin hasil
demineralisasi dan deproteinasi. Penghilangan warna dari kitin adalah dengan
menggunakan aseton.
2.2 Kitosan
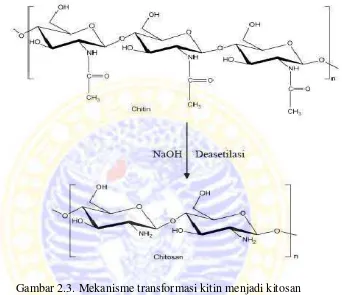
Kitosan disebut juga poli(1,4)-2-amina-2-deoksi-β-D-glukosa atau poli-(β-
1,4-N-asetilglukosamine) (Khor, 2010). Kitosan merupakan senyawa kitin yang
dihilangkan gugus asetilnya dan terdeasetilasi sebanyak mungkin, secara teoritis
kandungan gugus asetil pada kitin adalah 21,2% (Sugita, 2006).
Deasetilasi secara kimia dapat dilakukan dengan menggunakan basa kuat
NaOH dan KOH. Namun penggunaan KOH dapat memutuskan ikatan hidrogen
yang kuat antar rantai kitin (Khor, 2010).
Gambar 2.3. Mekanisme transformasi kitin menjadi kitosan
Metode penyediaan kitosan pertama kali dibuat oleh Hope Seyler pada
tahun 1894 yaitu dengan merefluks kitin dalam larutan kalium hidroksida pada
temperatur 180oC.
Senyawa kitin dan kitosan dapat dibedakan berdasarkan gugus asetamida
pada karbon kedua (C2) dalam struktur molekulnya. Pada kitosan, sebagian besar
gugus asetil digantikan dengan atom hidrogen melalui reaksi hidrolisis dengan
alkali pekat. Adanya gugus amina menjadikan kitosan bermuatan parsial positif.
Hal ini menyebabkan kitosan dapat larut dalam larutan asam hingga netral. Selain
bermuatan parsial negatif seperti minyak, lemak, dan protein (Puspawati dan
Simpen, 2010).
2.2.1 Sifat kitosan
Sifat fisiko-kimia kitosan yaitu berwarna putih dan berbentuk serpihan
seperti bubuk. Kitosan larut dengan baik dalam larutan asam asetat 1-2%, selain
itu kitosan larut dalam HCl encer, HNO3 encer, H3PO4 0,5% dan tidak larut dalam
asam pekat dan basa kuat. Pada suasana asam, gugus amino (-NH2) kitosan akan
menangkap H+ dari lingkungannya, sehingga gugus amino terprotonasi menjadi –
NH3+. Gugus -NH3+ inilah yang menyebabkan kitosan bertindak sebagai garam,
sehingga dapat larut dalam air. Sebagai informasi bahwa kelarutan kitosan
bergantung pada berat molekul, derajat deasetilasi, karakteristik rantai samping.
Derajat deasetilasi dan berat molekul berperan penting dalam kelarutan kitosan,
sedangkan derajat deasetilasi menunjukkan kemampuan kitosan untuk dapat
berinteraksi isoelektrik dengan molekul lain (Wibowo, 2006).
Adanya gugus amina pada kitosan menunjukkan kapasitas dan kemampuan
adsorpsi kitosan terhadap ion logam (tembaga) dibandingkan dengan kitin. Hal ini
dikarenakan jumlah gugus amina bebas (sebanding dengan derajat deasetilasi)
kitosan yang ada untuk pengkhelatan lebih banyak dibanding pada kitin, sehingga
kemampuan kitosan dalam menyerap ion logam lebih besar dari pada kitin
(Agusnar, 2006).
2.2.2 Manfaat kitosan
Kitosan memiliki potensi besar untuk dapat diaplikasikan pada berbidang
pangan, kosmetik, industri tekstil, industri kertas, dan industri elektronika.
Aplikasi khusus dari kitosan antara lain pada pengolahan limbah cair adalah
sebagai bahan bersifat resin penukar ion untuk meminimalisasi logam-logam
berat, mengkoagulasi minyak/lemak, serta pada industri pangan sebagai penstabil
minyak, rasa dan lemak (Ramesh, 2008). Kitosan tidak beracun, dengan
bifungsionalitas yang tinggi pada bidang kesehatan termasuk anti thrombogenic
dan agen penyembuh luka (Tang, et al 2003). Pada bidang kesehatan lainnya,
aplikasi kitosan adalah sebagai agen penurun kolesterol (Ormrod et al, 1998), dan
sebagai pereduksi berat badan (Ernst dan Pitler, 1998).
Kitosan telah banyak digambarkan sebagai polimer alami yang digunakan
sebagai adsorben ion logam (Volda et al, 2003). Banyaknya atom nitrogen dalam
kitosan memungkinkan penyerapan ion logam melalui berbagai mekanisme
seperti khelasi dan pertukaran ion, yang bergantung pada ion logam dan pH
larutan (Guibal, 2004). Kemampuan kitosan untuk mengikat logam dengan cara
pengkhelat adalah dihubungkan dengan kadar nitrogen yang tinggi pada rantai
polimernya. Kitosan mempunyai satu amino linier dalam setiap unit glukosa.
Kumpulan amino ini mempunyai sepasang elektron bebas yang dapat membentuk
ikatan aktif dengan kation-kation logam. Unsur nitrogen dalam pada setiap
monomer kitosan adalah sisi yang aktif dengan kation logam (Hutahahean, 2001).
Salah satu aplikasi kitosan sebagai adsorben adalah pada proses penjernihan air.
Pada proses ini diperlukan mutu kitin dan kitosan yang tinggi, sedangkan
pada bidang kesehatan diperlukan kemurnian yang tinggi. Kitosan sebagai
hidrogel, dan membran (film). Kitosan sebagai adsorben sering dimanfaatkan
untuk proses adsorpsi ion logam berat dan beracun seperti merkuri, timah,
tembaga, dan sebagai pengikat zat warna tekstil dalam air limbah. Besarnya
afinitas kitosan dalam mengikat ion logam sangat bergantung pada karakteristik
makrostruktur kitosan yang dipengaruhi oleh sumber dan kondisi pada proses
isolasi. Perbedaan bentuk kitosan akan berpengaruh pada luas permukaannya.
Semakin kecil ukuran kitosan, maka luas permukaan kitosan akan semakin besar,
dan proses adsorpsi pun dapat berlangsung lebih baik (Purwatiningsih, 2009).
2.3 Karakterisasi Kitin dan Kitosan
1. Uji Kelarutan
Kelarutan kitin dan kitosan dapat dianalisis dengan cara melarutkan kitin
dan kitosan dalam asam asetat 0,75%. Apabila serbuk tersebut tidak larut maka
serbuk tersebut adalah kitin. Sedangkan kitosan larut dalam asam asetat encer
(Kuntoro, 2004).
2. Derajat Deasetilasi
Melalui tahap deproteinasi dan demineralisasi, kitin yang diperoleh tidak
larut dalam sebagian pereaksi kimia. Untuk memudahkan kelarutannya kitin
dideasetilasi menjadi kitosan. Bertambahnya gugus amino (NH2) pada kitosan
meningkatkan kemampuan absorpsi didalamnya. Peningkatan kelarutan
berbanding lurus dengan peningkatan derajat deasetilasi, karena pada proses
deasetilasi gugus asetil pada kitin dipotong. Ion H pada gugus amina menjadikan
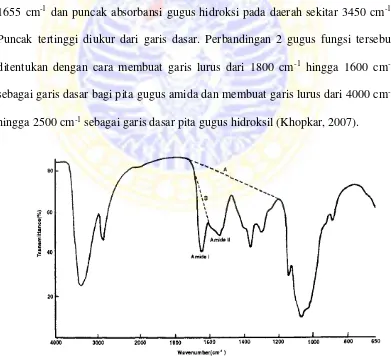
Pada penentuan derajat deasetilasi digunakan spektroskopi FTIR. Derajat
deasetilasi ditentukan dengan metode baseline, dihitung dari nilai perbandingan
pita serapan antara puncak absorbansi absorbansi gugus amida pada daerah sekitar
1655 cm-1 dan puncak absorbansi gugus hidroksi pada daerah sekitar 3450 cm-1.
Puncak tertinggi diukur dari garis dasar. Perbandingan 2 gugus fungsi tersebut
ditentukan dengan cara membuat garis lurus dari 1800 cm-1 hingga 1600 cm-1
sebagai garis dasar bagi pita gugus amida dan membuat garis lurus dari 4000 cm-1
hingga 2500 cm-1 sebagai garis dasar pita gugus hidroksil (Khopkar, 2007).
Derajat deasetilasi kitosan dapat diukur melalui beberapa metode. Metode
yang banyak digunakan adalah metode garis dasar Fourier Transform Infra Red
Spectrometry (FTIR) yang pertama kali diajukan oleh Moore dan Robert pada
tahun 1977. Keuntungan dari teknik ini adalah waktu yang relatif cepat, efisien
karena tidak perlu murni, dan dengan tingkat ketelitian yang tinggi dibandingkan
dengan teknik titrimetri atau metode spektroskopi lainnya (Khopkar, 2007).
Puncak tertinggi diukur dari garis dasar yang dipilih. Nilai absorbansi
dapat ditentukan dengan persamaan :
Po
dimana :
A = log (
P ) (1)
A = absorbansi cuplikan
Po = % absorbansi pada garis dasar
P = % absorbansi pada puncak minimum
Derajat deasetilasi ditentukan untuk mengetahui seberapa besar kitin yang
sudah berubah menjadi kitosan. Derajat deasetilasi kitosan ditentukan melalui
persamaan berikut :
DD = 100 – [(A1655 / A 3450 ) x 115] (2)
Nilai 115 menunjukkan rumus empiris berdasarkan data-data yang sudah
dicoba yang menyatakan hubungan yang sama untuk deasetilasi menentukan
derajat deasetilasi secara sempurna (Khan, 2002).
Semakin banyak gugus asetil yang dihilangkan, maka semakin tinggi nilai
derajat deasetilasinya. Kitosan dengan derajat deasetilasi 70-90% dinamakan
kitosan pasaran (Puspawati dan Simpen, 2010).
3. Berat Molekul Rata-rata (BM)
Metode viskosimetri adalah metode yang umum digunakan untuk
menentukan berat molekul rata-rata suatu polimer. Pengukuran berat molekul
rata-rata kitosan dilakukan dengan cara pengukuran viskositas larutan dengan
pembanding viskositas dari pelarut murni (Billmeyer, 1994). Alat yang
waktu yang diperlukan cairan tertentu untuk melalui pipa kapiler dengan gaya
yang disebabkan oleh berat cairan itu sendiri, hal tersebut terjadi akibat adanya
perbedaaan tekanan antara kedua ujung pipa U yang besarnya diasumsikan
sebanding dengan berat jenis cairan (Bird, 1993). Penentuan berat molekul dapat
diketahui melalui persamaan :
η1 − η2 t − to
ηsp =
η2 = to (3)
viskositas spesifik yang diperoleh dapat digunakan untuk menentukan viskositas
intrinsik melalui persamaan Huggins (Billmeyer, 1994) sebagai berikut :
5sp
= [5] + k[5′]2 (4)
C
Keterangan :
ηsp : viskositas spesifik
η1 : viskositas pelarut
η2 : viskositas larutan
t : waktu alir larutan (detik)
to : waktu alir pelarut (detik)
η’ : viskositas intrinsik
C : konsentrasi
k : konstanta
untuk menghitung berat molekul rata-rata maka viskositas intrinsic disubstitusikan
kedalam persamaan Mark-Houwink Sakurada, sebagai berikut :
Nilai K dan a untuk kitosan adalah 1,40 x 10-4 dan 0,83. Dari persamaan
Mark-Houwink Sakurada dapat diperoleh nilai massa molekul rata-rata kitosan
(Mv) (Hwang et al, 2002).
2.4 Kitosan Termodifikasi
Kitosan larut dalam larutan asam, sehingga aplikasinya terbatas, oleh
karena itu perlu adanya modifikasi dari kitosan agar tidak larut dalam media asam.
Modifikasi kitosan dapat dilakukan secara kimiawi maupun fisik. Modifikasi
dapat dilakukan melalui gabungan antara kitosan dengan beberapa polimer lain.
Polimer yang digunakan baik polimer alam maupun polimer sintetik.
Pada perkembangannya modifikasi kitosan yang telah banyak dilakukan
oleh para peneliti adalah dengan cara crosslinked antar rantai atau mengubah
dalam bentuk garamnya. Crosslinked dilakukan menggunakan senyawa dengan
minimal memiliki 2 gugus fungsi aktif. Berbagai bahan kimia yang telah banyak
digunakan sebagai agen crosslink yaitu glutaraldehid (Ruiz et al, 2000),
epiklorohidrin (Vieira dan Beppu, 2006) dan ethyleneglycol diglisidil eter (Li dan
Bai, 2006). Beberapa turunan kitosan telah diperoleh dengan cara menambahkan
gugus fungsional baru untuk membantu meningkatkan selektivitas penyerapan ion
logam. Gugus fungsional yang baru diperoleh dari poli(ethylenimine) (Chassary
et al, 2005), tiourea (Chassary et al, 2004.), melalui crosslinked kitosan.
Menurut Guibal (2004), penambahan gugus fungsional baru yaitu
meningkatkan densitas dari penyerapan logam, mengatur rentang pH, dan
meningkatkan selektivitas terhadap penyerapan logam. Beberapa tahun terakhir,
ethylenediaminetetraacetic (Juang dan Ju, 1998), thicarbamonyl (Baba et al,
2002), dan L-lysine (Fujiwara et al, 2007) digunakan pada pembuatan modifikasi
kitosan crosslinked untuk menghilangkan atau mengurangi ion logam pada
larutan. Selain modifikasi kitosan dengan agen crosslinked, juga telah
berkembang modifikasi dari senyawa polimer lainnya. Salah satunya yaitu MIP
(Molecularly Imprinted Polymer). Kitosan sebagai polimer alam digunakan
dengan mensintesis kitosan dengan katalis TiO2 sebagai adsorben yang tidak
hanya mampu mendegradasi senyawa organik, tetapi juga mampu mengadsorpsi
ion logam berat (Li et al, 2008).
Senyawa turunan kitosan dapat dibuat dengan teknik modifikasi kimia,
seperti grafting (mencangkok/menambahkan gugus fungsi baru), sulfonasi,
carboxymethylation. Diantar teknik tersebut, penambahan gugus fungsi
karboksilat, glutaraldehid, dan urea dianggap menarik dan mampu meningkatkan
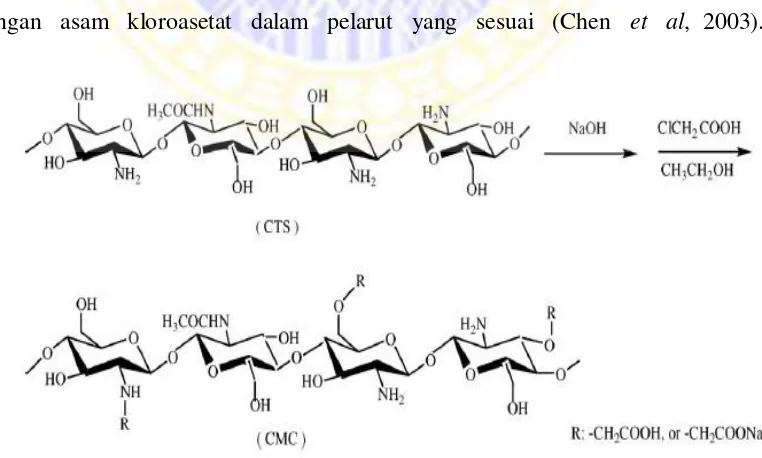
sifat adsorpsi dari kitosan. Karboksi metil kitosan dibuat dari reaksi antara kitosan
dengan asam kloroasetat dalam pelarut yang sesuai (Chen et al, 2003).
Glutaraldehid adalah agen crosslinked yang paling banyak digunakan
karena dapat bereaksi dengan kitosan melalui reaksi pembentukan basa Schiff
(imina tersubstitusi, -CH=NR) antara gugus aldehid glutaraldehida dengan gugus
–NH2 kitosan. Kitosan termodifikasi glutaraldehid telah banyak digunakan
sebagai bahan penyerap berbagai logam berat (Cestari et al, 2007).
NH2
Gambar 2.6 Mekanisme crosslinked karboksi metil kitosan-glutaraldehid-urea
2.5 Urea
Urea merupakan padatan butiran atau prill yang diperoleh dari hasil sintesa
reaksi antara ammonia (NH3) dengan karbondioksida (CO2). Urea adalah senyawa
organik dengan rumus CON2H4 atau (NH2)2CO. Urea merupakan pupuk nitrogen
yang paling mudah dipakai. Zat ini mengandung nitrogen paling tinggi (46%) di
antara semua pupuk padat. Urea mudah dibuat menjadi butiran dan mudah
diangkut dalam bentuk curah maupun dalam kantong. Zat ini mudah larut didalam
kadang zat ini juga digunakan untuk pemberian makanan daun. Disamping
penggunaannya sebagai pupuk, urea juga digunakan sebagai tambahan makanan
protein untuk hewan pemamah biak, juga dalam produksi melamin, dalam
pembuatan resin, plastik, adhesif, bahan pelapis, bahan anti kerut, tekstil, dan
resin perpindahan ion. Bahan ini merupakan bahan antara dalam pembuatan
amonium sulfat, asam sulfanat, dan ftalosianina (Austin, 1997).
Urea ditemukan pertama kali oleh Roelle pada tahun 1773 dalam urine.
Pembuatan urea dari amonia dan asam sianida untuk pertama kalinya ditemukan
oleh F.Wohler pada tahun 1828 . Namun pada saat ini pembuatan urea pada
umumnya menggunakan proses dehidrasi yang ditemukan oleh Bassarow pada
tahun 1870. Sifat fisik yang terdapat dalam urea diantaranya adalah berat molekul
sebesar 60,06, dengan berat jenis 1,355 (200C/40C), tidak bermuatan listrik, titik
leleh sebesar 132,7 oC, berbentuk butiran berwarna putih. Urea dapat dibuat dari
amoniak dan karbon dioksida menjadi amonium karbamat, dan dilanjutkan
dengan reaksi lebih lanjut amonium karbamat menjadi urea dan air (Rachman,
2006). Reaksi pembentukan urea sebagai berikut :
2 NH3 + CO2 NH4OCONH2 NH2CONH2 + H2O
(Amonium karbamat) (Urea)
2.6 Logam Berat
Logam adalah unsur alam yang dapat diperoleh dari laut, erosi batuan
tambang, vulkanisme, dan ditemukan dalam bentuk persenyawaan dengan unsur
lain. Pada kondisi suhu ruangan, unsur logam berat tidak selalu berbentuk padat
perairan, logam pada umumnya berada dalam bentuk ion-ion, baik sebagai
pasangan ion maupun dalam bentuk tunggal, sedangkan pada lapisan atmosfer
logam ditemukan dalam bentuk partikulat (Palar, 2004). Menurut Palar (2004)
logam memiliki kerapatan yang tinggi, memiliki kemampuan sebagai penghantar
listrik dan panas, dapat membentuk alloy dengan logam yang lain serta dapat
ditempa dan dibentuk.
Dalam perairan, logam berat dapat ditemukan dalam bentuk terlarut dan
tidak terlarut. Logam berat terlarut adalah logam berat yang membentuk komplek
dengan senyawa organik dan anorganik, sedangkan logam berat tidak terlarut
merupakan partikel-partikel koloid yang tersuspensi. Menurut Darmono (2001),
permasalahan yang timbul akibat pencemaran logam berat diantaranya adalah
ancaman kehidupan bagi makhluk hidup, kerusakan ekosistem dan keterkaitan
terhadap estetika (perubahan bau, warna dan rasa air). Akan tetapi bila jumlah dari
logam berat masuk ke dalam tubuh dengan jumlah berlebih, maka akan berubah
fungsi menjadi racun bagi tubuh (Palar, 2004).
2.7 Logam Tembaga (Cu)
Tembaga dengan nomor atom 29 dalam sistem periodik unsur adalah
elemen pertama yang mengandung perak dan emas, sehingga dianggap sebagai
logam semimulia. Unsur Cu berasal dari hasil pelapukan/pelarutan mineral yang
terkandung dalam bebatuan. Kandungan Cu dalam tanahh dan perairan diperoleh
dari industry-industri tembaga, pembakaran batu bara, pembakaran kayu, minyak
Tembaga (Cu2+) termasuk kedalam logam berat yang sulit untuk
didegradasi. Limbah tembaga (Cu2+) di lingkungan perairan berasal dari industri
elektroplating, industri cat dan kertas, dan industri baja. Meningkatnya kandungan
logam tembaga (Cu2+) (diatas 1.0 mg/L dalam air minum) dapat menimbulkan
gangguan kesehatan, diantaranya anemia, penyumbatan pembuluh darah, dan
kerusakan kornea (Screenivasan dan Rijith, 2009).
2.8 Adsorpsi
Adsorpsi merupakan peristiwa fisik dari permukaan suatu bahan yang
tergantung dari daya gabung antara adsorben dengan zat yang diadsorbsi.
Adsorpsi adalah peristiwa penyerapan pada permukaan suatu adsorben, zat yang
teradsorpsi disebut sebagai adsorbat dan zat pengadsorpsi disebut sebagai
adsorben (House, 2007).
Menurut Adamson (1990), Peristiwa adsorpsi pada umumnya
menggunakan adsorben berupa zat padat. Adsorpsi oleh zat padat dibedakan atas
adsorpsi fisik dan adsorpsi kimia. Adsorpsi fisik terjadi akibat oleh adanya gaya
van der Waals. Pada adsorpsi kimia, molekul-molekul yang teradsorpsi pada
permukaan bereaksi secara kimia, sehingga terjadi pemutusan dan pembentukan
ikatan. Ikatan yang terjadi antara adsorben dan adsorbat cukup kuat, karena
prosesnya bersifat irreversible dan diperlukan energi yang besar untuk melepas
ikatan tersebut. Pada peristiwa adsorpsi secara kimia, umumnya kapasitas adsorpsi
akan meningkat dengan meningkatnya temperatur. Kenaikan temperatur yang
Macam-macam isoterem adsorpsi antara lain adalah isoterem Langmuir,
isoterm BET, dan isoterem Freundlich. Isoterem Langmuir lebih tepat dijelaskan
sebagai adsorpsi kimiawi, dimana sebuah ikatan kimia ionik atau kovalen
terbentuk antara adsorben dan adsorbat. Isotherm Langmuir merupakan isoterem
paling sederhana yang didasarkan pada asumsi bahwa setiap bagian tempat
adsorpsi adalah ekivalen. Pada isotherm BET, volume total yang teradsorpsi
sebanding dengan jumlah partikel yang teradsorpsi. Sedangkan pada isoterem
Freunlich menghubungkan antara jumlah bahan yang teradsorpsi dengan
konsentrasi bahan dalam larutan (House, 2007).
Faktor yang dapat mempengaruhi proses adsorpsi adalah jenis adsorben,
macam zat yang diadsorpsi, konsentrasi zat, luas permukaan adsorben, dan
temperatur saat proses berlangsung. Zat yang bersifat asam akan mudah di
adsorbs dengan adsorben basa, demikian pula sebaliknya, karena asam dan basa
akan saling tarik-menarik. Begitu juga pada konsentrasi zat, semakin tinggi
konsentrasi, makin besar adsorbat yang dapat teradsorbsi. Pada luas permukaan
adsorben yang besar maka semakin banyak adsorbat yang dapat diserap. Jenis
adsorben yang akan digunakan harus memenuhi beberapa persyaratan seperti,
berupa zat padat dengan daya serap dan luas permukaan yang besar, dan paling
utama adalah tidak larut dalam zat yang akan diadsorpsi (Crittenden, 1998).
2.9 Teknik Adsorpsi Fluidisasi
Pada perkembangan proses adsorpsi telah dikenal berbagai cara pada
proses adsorpsi. Menurut John dan Crittenden (1998) dalam bukunya menjelaskan
bed. Proses batch adalah proses yang banyak digunakan sebagai teknik adsorpsi.
Pada proses batch, cairan dan adsorben diletakkan dalam sebuah wadah (batch)
dengan memberikan pengadukan selama waktu tertentu pada saat proses
berlangsung. Adsorben dipisahkan dari cairan dengan cara sedimentasi atau
filtrasi. Proses batch dapat digambarkan sebagai proses sedimentasi bertingkat,
dimana pada filtrat yang telah dikontakkan dengan adsorben, dipindahkan ke
wadah (batch) lain dengan adsorben baru, sehingga adsorben dapat
menghilangkan pengotor / zat yang sengaja ingin dihilangkan dari filtrat. Proses
ini diulang beberapa kali. Teknik adsorpsi dengan metode batch memiliki
keunggulan yaitu proses pemisahannya yang sangat baik, namun proses batch
yang dilakukan memerlukan jumlah adsorben yang sangat banyak dan tidak dapat
digunakan untuk mengadsorpsi larutan dengan konsentrasi yang besar. Efisiensi
waktu dari proses sedimentasi bertingkat ini juga menjadi salah satu kekurangan
dari proses batch. Sehingga efisiensi waktu dan biaya menjadi bagian yang sangat
dipertimbangkan untuk teknik adsorpsi dengan proses batch. Teknik yang lain
yaitu fixed bed dan moving bed. Kedua teknik ini adalah dengan memberikan
bagian (bed) tetap dan berpindah dari kolom yang digunakan sebagai tempat
kontak antara adsorben dan filtrat. Secara sederhana teknik ini digambarkan
dengan adanya bagian tetap atau bergerak dari kolom yang mampu memberikan
gerakan dari adsorben dalam larutan sehingga proses adsorpsi dapat berjalan.
Kelebihan dari teknik ini sederhana dan relatif murah untuk proses pembuatannya,
karena bagian (bed) yang akan digunakan dapat diatur. Selain itu jumlah adsorben
dari proses fixed bed (bagian yang tetap) adalah adsorpsi yang kurang merata dari
filtrat pada seluruh bagian kolom (adsorpsi hanya terjadi pada bagian tertentu
yang dikenal sebagai zona transfer massa), sedangkan pada moving bed (bagian
yang bergerak) memerlukan desain alat yang rumit oleh karena itu diperlukan
biaya yang mahal. Teknik adsorpsi yang belum banyak dikembangkan namun
memiliki kelebihan pada prosesnya yaitu teknik adsorpsi fluidisasi (fluidized bed).
Pada proses ini adsorben dapat bergerak didalam larutan dengan adanya aliran gas
dalam kolom. Laju aliran gas yang diberikan dalam kolom untuk membantu
pergerakan adsorben dapat diatur, sehingga adsorben bergerak keseluruh bagian
kolom (Crittenden, 1998).
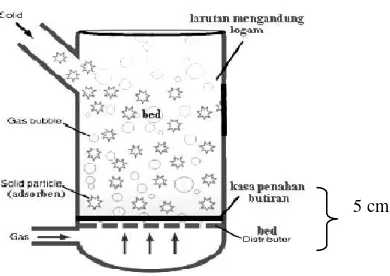
Fluidisasi digunakan untuk menggambarkan proses kontak antara solid
dengan fluid. Fluidisasi merupakan operasi pengontakan unggun padatan dengan
fluida sehingga sifatnya berubah menyerupai sifat fluida. Mekanisme adsorpsi
fluidisasi dilakukan dengan mengontakkan larutan limbah dengan adsorben dalam
sebuah kolom, aliran gas diberikan melalui bed distributor udara. Gas yang
dialirkan bertujuan agar butiran adsorben dapat bergerak ke atas dalam kolom
fluidisasi, sehingga logam yang terdapat dalam larutan dapat terserap. Keuntungan
dari proses fluidisasi yaitu aliran dan pertikel dapat terkontrol secara otomatis,
tercampur secara isothermal, sirkulasi padatannya besar, cocok untuk skala besar,
serta panas dan kecepatan transfer masa antar gas dan partikel sangat tinggi
Gambar 2.7 Kolom fluidisasi
2.10 Spektroskopi FTIR (Fourier Transform Infrared)
Spektrofotometer infra merah adalah suatu metode analisis untuk
mengidentifikasi suatu senyawa berdasarkan absorpsi terhadap infra merah. Pada
prinsipnya spektroskopi Fourier Transform Infrared sama dengan spektroskopi
Infra Red, hanya saja pada pada spektroskopi FTIR ditambahkan alat optic
(Fourier transform) untuk menghasilkan spektra yang lebih baik, sehingga
spektroskopi FTIR dapat menghasilkan spektra yang lebih baik dan menghasilkan
puncak yang diinginkan, dimana pada spektroskopi infra merah puncak tersebut
tidak muncul (Khan, et al, 2002).
Instrumen FTIR dapat digunakan untuk menentukan derajat deasetilasi
(DD) kitosan yang teramati pada spectrum infra merah. Derajat deasetilasi
merupakan salah satu parameter untuk mengetahui kualitas dari kitosan yang
menyatakan besarnya jumlah gugus asetil yang lepas dari kitin pada proses
deasetilasi. Spektrofotometer FTIR memiliki kelebihan dibandingkan
meningkatkan sensitifitas pengukuran menjadi lebih tinggi dan waktu analisis
sampel menjadi lebih singkat.
2.11 AAS (Atomic Adsorption Spectrofotometer)
Metode AAS digunakan pada penentuan unsur-unsur logam yang
didasarkan pada penyerapan energi sinar oleh atom-atom netral dalam keadaan
gas. Pada tahun 1955, seorang ilmuwan Australia, Walsh melaporkan hasil
penelitiannya tentang penggunaan lampu katoda sebagai sumber radiasi yang
menghasilkan radiasi dengan panjang gelombang karakteristik yang sesuai dengan
SSA (Ismail, 2003).
Metode spektrometri atom yang paling banyak digunakan adalah
spektrometri serapan atom, merupakan suatu metode pengukuran unsur-unsur
logam dengan identifikasi secara kuantitatif dan kualitatif logam dalam berbagai
sampel, yang didasarkan pada jumlah radiasi yang diserap oleh atom-atom bebas
dalam keadaan gas (Mendham et al, 2000). Spektrometri serapan atom,
spektometri emisi atom dan spektrometri fluorosensi atom merupakan jenis dari
SSA. Spektrometri serapan atom terdiri dari spektrometri serapan atom nyala dan
non nyala. Karena sensitivitas yang tinggi, alat ini sering digunakan sebagai
pilihan utama dalam menganalisis unsur logam yang konsentrasinya sangat kecil.
Penggukuran AAS didasarkan pada besarnya energi radiasi yang diserap
pada panjang gelombang yang sesuai sehingga elektron terluar mengalami eksitasi
dari keadaan dasar ke keadaan tereksitasi. Pembentukan atom-atom pada keadaan
dasar atau proses atomisasi pada umumnya dilakukan dalam nyala, dimana
hokum Lambert-Beer yang menyatakan bahwa jumlah energi yang diserap
(absorbansi) adalah sebanding dengan konsentrasi (C) (Khopkar, 2007).
M+ + A- (larutan) M A (padat)
Mo (gas) M A (cair)
Gambar 2.8 Proses atomisasi pada AAS M+ + A- (aerosol)
Mo + Ao (gas) M A (gas)
larutan garam M+ dan A- akan melalui serangkaian proses dalam nyala, sebelum
akhirnya menjadi atom logam dalam keadaan dasar (Mo). Atom-atom dalam
keadaaan dasar akan menyerap energi, sumber energi berasal dari lampu katoda
berongga dimana jumlah energi yang diserap adalah sebanding dengan
konsentrasi atom-atom dalam sampel. Penentuan konsentrasi unsur logam dalam
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Kimia Fisik, Departemen
Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga pada bulan Januari
2012 sampai dengan Juli 2012.
3.2 Bahan dan Alat Penelitian
3.2.1 Bahan-bahan penelitian
Sampel yang digunakan pada penelitian ini adalah cangkang rajungan.
Bahan lain yang digunakan berupa natrium hidroksida (NaOH) teknis (98%),
asam klorida (HCl) teknis, asam kloroasetat p.a, asam asetat teknis, aseton teknis,
glutaraldehid p.a, urea p.a, tembaga(II)sulfat (CuSO4.5H2O), etanol teknis, asam
nitrat p.a, 2-propanol p.a.
3.2.2 Alat-alat penelitian
Alat-alat yang digunakan pada penelitian ini adalah gelas beaker, labu
ukur, gelas ukur, corong Buchner, pengayak mesh, krus porselen, neraca analitik,
hotplate stirrer, kolom fluidisasi (fluidized bed), spektofotometer FT-IR, Atomic
Uji kelarutan
1. Deproteinasi dengan larutan NaOH 3,5% pada
65oC selama 2 jam
2. Demineralisasi dengan larutan HCl 2N selama 30 menit
3. Depigmentasi dengan aseton
Deasetilasi dengan larutan NaOH 50% pada suhu > 95oC selama 2 jam
1. 10,0 gr Kitosan dilarutkan dalam 100 ml asam asetat 2% dan 13,5 gr NaOH direaksikan pada suhu 50oC selama 1 jam
2. Kitosan ditambahkan 15,0 gr asam kloroasetat dalam 20 ml isopropanol,dan direaksikan pada suhu 50oC selama 4 jam, kemudian bilas
3,0 gr urea dalam 60 ml akuades dan dilarutkan
dalam 17,1 ml glutaraldehid. Larutan
direaksikan pada 50oC selama 3 jam
2. 1,36 gr CMC dalam 30 ml akuades direaksikan
dengan larutan glutaraldehid-urea pada suhu 80oC selama 8 jam
0,5 gram kitosan-urea dalam kolom fluidisasi dengan ditambahkan 200 ml Larutan CuSO4.5H2O 100 ppm
Hasil adsorpsi Filtrat dianalisis dengan
3.4 Pembuatan Reagen
1. Pembuatan larutan NaOH 3.5 % (w/v) untuk proses deproteinasi
Sebanyak 43,75 gram NaOH 80% ditimbang, dan dilarutkan dengan
akuades dalam gelas beker 1000 ml. Kemudian diaduk dan ditambahkan
akuades hingga volume larutan 1000 ml.
2. Pembuatan larutan HCl 2N (v/v) untuk proses demineralisasi
Pada pembuatan larutan HCl 2N dipipet sebanyak 191,75 ml larutan HCl
32% menggunakan pipet ukur. Kemudian dilarutkan dalam gelas beker
1000 ml menggunakan akuades hingga volume larutan menjadi 1000 ml.
3. Pembuatan larutan NaOH 50 % untuk proses deasetilasi
Sebanyak 625 gram NaOH 80% ditimbang, dan dilarutkan dengan akuades
dalam gelas beker 1000 ml. Kemudian larutan dipindahkan kedalam labu
ukur 1000 ml dan diencerkan dengan menambahkan akuades sampai tanda
batas. Kocok larutan dalam labu ukur hingga larutan menjadi larutan yang
homogen.
4. Pembuatan larutan asam asetat 2 %
Sebanyak 2,02 ml larutan asam asetat 98% diambil dengan menggunakan
pipet ukur, kemudian dipindahkan kedalam labu ukur 100 ml dan
diencerkan dengan menambahkan akuades hingga tanda batas.
5. Pembuatan larutan induk Cu2+ 1000 ppm
Larutan induk 1000 ppm dibuat dengan cara menimbang sebanyak 3,9291
10,0 ml dalam gelas beker 100 ml. Kemudian dipindahkan dalam labu
ukur 1000 ml dan diencerkan dengan akuadem hingga tanda batas.
6. Pembuatan larutan induk Cu2+ 100 ppm
Diambil 10,0 ml larutan induk Cu2+ 1000 ppm menggunakan pipet
volume. Kemudian dipindahkan secara kuantitatif kedalam labu ukur 100
ml dan diencerkan dengan akuadem hingga tanda batas.
7. Pembuatan larutan kerja Cu2+ 10 ppm
Diambil 2,5 ml larutan induk Cu2+ 100 ppm menggunakan pipet volume.
Kemudian dipindahkan secara kuantitatif kedalam labu ukur 25 ml dan
diencerkan dengan akuadem hingga tanda batas.
8. Pembuatan larutan standar Cu2+ 2 ppm
Diambil 0,5 ml larutan kerja Cu2+ 100 ppm menggunakan pipet volume.
Kemudian dipindahkan secara kuantitatif kedalam labu ukur 25 ml dan
diencerkan dengan akuadem hingga tanda batas.
9. Pembuatan larutan standar Cu2+ 4 ppm
Diambil 1,0 ml larutan kerja Cu2+ 100 ppm menggunakan pipet volume.
Kemudian dipindahkan secara kuantitatif kedalam labu ukur 25 ml dan
diencerkan dengan akuadem hingga tanda batas.
10.Pembuatan larutan standar Cu2+ 6 ppm
Diambil 1,5 ml larutan kerja Cu2+ 100 ppm menggunakan pipet volume.
Kemudian dipindahkan secara kuantitatif kedalam labu ukur 25 ml dan
diencerkan dengan akuadem hingga tanda batas.
Diambil 2,0 ml larutan kerja Cu2+ 100 ppm menggunakan pipet volume.
Kemudian dipindahkan secara kuantitatif kedalam labu ukur 25 ml dan
diencerkan dengan akuadem hingga tanda batas.
12.Pembuatan larutan standar Cu2+ 10 ppm
Diambil 2,5 ml larutan kerja Cu2+ 100 ppm menggunakan pipet volume.
Kemudian dipindahkan secara kuantitatif kedalam labu ukur 25 ml.
3.5 Prosedur Penelitian
3.5.1 Preparasi serbuk cangkang rajungan
Cangkang rajungan dicuci hingga bersih dari kotoran yang menempel,
kemudian dijemur dengan tidak terkena sinar matahari langsung, yaitu dengan
cara dianginkan. Setelah kering, cangkang kepiting digiling dengan menggunakan
blender, kemudian diayak menggunakan pengayak mesh hingga diperoleh serbuk
halus.
3.5.2 Pembuatan kitosan dari kitin
Tahapan yang dilakukan pada proses isolasi kitin yaitu melalui tahap
deproteinasi, demineralisasi, depigmentasi, dan tahap transformasi kitin menjadi
kitosan melalui tahap deasetilasi.
Deproteinasi adalah tahap pemisahan protein yang terdapat pada cangkang
rajungan. Serbuk cangkang rajungan yang telah kering, diayak dengan pengayak
100 mesh, dan dimasukkan dalam gelas beaker. Kemudian ditambahkan NaOH
3,5% (b/v) dengan perbandingan 1:10 antara serbuk cangkang rajungan dengan
larutan NaOH. Kemudian diaduk mengguankan stirrer magnetic, dengan
Buchner dan kertas saring sehingga diperoleh residunya. Kemudian cuci residu
dengan akuades hingga pH netral, kemudian dikeringkan dalam oven pada suhu
50oC selama 24 jam. Tahapan kedua yaitu demineralisasi, tujuan demineralisasi
adalah untuk menghilangkan mineral dari sampel. Sampel hasil deproteinasi
dimasukkan dalam gelas beaker dan ditambahkan larutan HCl 2N dengan
perbandingan 1:15 antara sampel dengan HCl. Pada proses ini dilakukan pada
suhu ruangan selama 30 menit sambil diaduk menggunakan magnetic stirrer.
Kemudian larutan disaring dan residunya dicuci dengan akuades hingga pH netral.
Residu yang diperoleh dkeringkan dalam oven pada suhu 50oC selama 24 jam.
Tahap selanjutnya pada proses pembuatan kitin adalah depigmentasi,
depigmentasi aadalah tahap penghilangan warna. Hasil sampel yang diperoleh
dari tahap demineralisasi, di rendam dalam larutan aseton dengan perbandingan
1:10 antara sampel dengan larutan aseton. Kemudian disaring dan endapan yang
diperoleh dicuci dengan akuades hingga pH netral. Sampel disaring dan
dikeringkan dalam oven pada suhu 65oC selama 24 jam. Hasil yang diperoleh
setelah melalui tiga tahapan ini adalah kitin.
Pada tahap deasetilasi, kitin yang diperoleh dimasukkan dalam gelas
beaker dan ditambahkan larutan NaOH 50% dengan perbandingan 1:10 antara
kitin dan larutan NaOH. Larutan dipanaskan pada suhu diatas 95oC selama 2 jam.
Larutan disaring dan residu yang diperoleh dicuci dengan akuades hingga pH
netral. Hasil yang diperoleh setelah tahap ini adalah kitosan.
Penentuan derajat deasetilasi (DD) kitosan dianalisis dengan menggunakan
3.5.3 Karakterisasi kitin dan kitosan
Penentuan derajat deasetilasi kitin dengan menggunakan FT-IR dan uji
kelarutan dengan cara menambahkan kitin dengan asam asetat 2%.
1. Uji kelarutan kitosan
Kelarutan kitosan dapat dianalisis dengan cara melarutkan kitosan dalam
asam asetat 2%. Apabila serbuk tersebut tidak larut maka serbuk tersebut
adalah kitin. Sedangkan kitosan larut dalam asam asetat encer (Kuntoro,
2004).
2. Penentuan berat molekul rata-rata
Metode viskosimetri adalah metode yang umum digunakan untuk
menentukan berat molekul rata-rata suatu polimer. Alat yang digunakan
adalah viskometer Ostwald yaitu dengan cara menghitung lamanya waktu
yang diperlukan cairan tertentu untuk melalui pipa kapiler. Penentuan
berat molekul rata-rata kitosan dilakukan berdasarkan metode viskosimetri
dengan menentukan waktu alir pelarut asam asetat (to) dan waktu alir
larutan kitosan (t) sehingga nilai viskositas spesifik (ηsp). Larutan kitosan
dibuat dengan cara melarutkan 0,15 gram kitosan kedalam 100 ml asam
asetat 0,75% (w/v) dan dimasukkan dalam labu ukur 100 ml, kamudian
diencerkan dengan variasi konsentrasi 0,1 ; 0,2 ; 0,3 ; 0,4 A . Kemudian
masing-masing larutan dimasukkan kedalam viskometer Ostwald
sebanyak 5,0 ml dan diukur waktu alirnya (t1). Begitu pula pada larutan
asam asetat (to). Untuk menentukan berat molekul rata-rata kitosan ( Mv )
dengan nilai K dan a untuk kitosan adalah 1,40 x 10-4 dan 0,83 (Hwang et
al, 2002). Dari persamaan Mark-Houwink Sakurada dapat diperoleh nilai
massa molekul rata-rata kitosan (Mv).
3. Penentuan derajat deasetilasi kitosan
Pada penentuan derajat deasetilasi digunakan spektroskopi FT-IR. Derajat
deasetilasi ditentukan dengan metode baseline, dihitung dari nilai
perbandingan pita serapan antara puncak absorbansi gugus hidroksil
disekitar 3450 cm-1 dan puncak absorbansi gugus amida pada 1655 cm-1.
Kemudian buat garis lurus dari 4000 cm-1 hingga 2500 cm-1 sebagai garis
dasar bagi gugus hidroksil dan 1800 cm-1 sampai 1600 cm-1 sebagai garis
dasar bagi gugus amida. Derajat deasetilasi ditentukan untuk mengetahui
seberapa besar kitin yang sudah berubah menjadi kitosan. Derajat
deasetilasi kitosan ditentukan melalui persamaan 2. Pada penelitian ini
derajat deasetilasi kitin dan kitosan dihitung menggunakan software DDK
project (Iflakhah, 2011).
3.5.4 Pembuatan kitosan-urea
1. Pembuatan karboksi metil kitosan
Sebanyak 10,00 gr kitosan dilarutkan dengan 100 ml asam asetat 2%, dan
ditambahkan 13,5 gram NaOH dalam gelas beaker 500 ml, kemudian
direaksikan diatas penangas air dengan suhu 50oC selama 1 jam. Setelah 1
jam, ditambahkan 15,0 gr asam kloroasetat yang telah dilarutkan dalam 20
ml isopropanol. Kemudian dicampurkan tetes demi tetes kedalam gelas