BAB II
TINJAUAN PUSTAKA
2.1 POLUTAN LOGAM BERAT
Pencemaran lingkungan dengan zat beracun telah meningkat dalam beberapa
tahun terakhir sebagai akibat dari pesatnya pertumbuhan industri [8]. Aktivitas
berbagai industri pada umumnya menghasilkan limbah cair yang sering menjadi
permasalahan bagi lingkungan karena mengandung berbagai macam kontaminan
yang berbahaya. Pencemaran ini berdampak pada penurunan kualitas air dan
meningkatnya padatan tersuspensi pada air.
Salah satu jenis pencemar pada air disebabkan oleh logam berat. Logam berat
tidak seperti polutan organik yang pada beberapa kasus pencemaran dapat
didegradasi [9]. Akibatnya, logam-logam tersebut terakumulasi di lingkungan
terutama membentuk senyawa kompleks dengan bahan organik dan anorganik
dalam ekosistem perairan. Logam berat tersebut memiliki potensi merusak sistem
fisiologi dan biologis manusia, jika melewati batas toleransi yang menimbulkan
berbagai penyakit dan gangguan [8,10]. Logam berat masuk ke dalam jaringan
tubuh makhluk hidup melalui beberapa jalan, yaitu saluran pernapasan,
pencernaan, dan penetrasi melalui kulit [9].
Menurut Darmayanti dkk., 2012, berdasarkan toksisitas dan dampak
pencemaran bagi lingkungan, maka logam berat dapat klasifikasikan dalam
beberapa bagian, yaitu:
1. Sangat beracun, yaitu dapat mengakibatkan kematian atau gangguan
kesehatan dalam waktu singkat. Logam-logam tersebut antara lain: Hg, Cd,
Pb, As, Sb, Ti, Co, Be, dan Cu.
2. Moderat, yaitu mengakibatkan gangguan kesehatan baik yang dapat pulih
maupun yang tidak dapat pulih dalam waktu yang relatif lama. Logam-logam
3. Kurang beracun, dalam jumlah besar dapat menimbulkan gangguan
kesehatan. Logam-logam tersebut antara lain: Bi, Fe, Ca, Mg, Ni, K, Zn, dan
Ag.
2.2 TEKNOLOGI PENYERAPAN LOGAM BERAT
Logam berat menimbulkan ancaman lingkungan yang besar karena dapat
menimbulkan kandungan racun yang tinggi terhadap ekosistem dan manusia
[10,11]. Pada umumnya pencemaran tersebut berada pada sistem perairan dan
tanah. Pemurnian air adalah salah satu cara terbaik untuk membantu mengatasi
masalah tersebut [7]. Dari beberapa proses pemurnian air dari logam berat, proses
adsorpsi lebih efisien dan lebih murah dibandingkan teknologi penjerapan logam
berat lainnya [5] seperti, koagulasi dan presipitasi kimia, elektroflotasi [4],
pertukaran ion, dan pemisahan membran [11]. Berikut adalah teknologi
pemisahan logam berat yang sering digunakan :
2.2.1 Elektroflotasi
Beberapa teknik tradisional yang dilakukan untuk pengolahan air limbah
tidak menunjukkan kinerja yang memuaskan untuk larutan yang sangat encer (≤ 50 mg dm-3
), terutama karena efisiensi operasionalnya rendah dan biaya
ekstraksi yang tinggi. Metode elekroflotasi merupakan alternatif yang dapat
diterapkan dalam berbagai skala, baik skala kecil, menengah maupun besar.
Elektroflotasi adalah proses sederhana yang mengapungkan ion atau partikel
padatan, yang terlarut dalam fasa cair. Pengapungan terjadi akibat adhesi
pada gelembung kecil hidrogen dan oksigen pada katoda dan anoda pada sel
flotasi [4].
2.2.2 Pemisahan Membran
Membran dapat didefinisikan sebagai hambatan selektif antara dua fasa
dengan perpindahan massa berlangsung dari fasa donor ke fasa akseptor.
Salah satu jenis membran yang digunakan adalah Liquid Membranes (LMs).
Dalam kasus LMs, membran ini terdiri dari fasa cair memisahkan dua larutan
yang tidak saling bercampur. Penghilangan logam berat dapat juga dilakukan
yang dilakukan MBR, dinilai mampu memisahkan Fe, Cu, dan Cd yang
cukup tinggi dari limbah perkotaan.
2.2.3 Adsorpsi
Adsorpsi merupakan suatu proses yang terjadi ketika suatu
fluida/substansi-terlarut yang ada dalam larutan, terikat pada suatu padatan
(adsorben) yang ditimbulkan oleh gaya kimia-fisika antara sustansi dan
penyerapnya. Adsorpsi logam berat mengunakan adsorben umumnya
dipelajari dengan menggunakan sistem batch [12,13,14,15]. Beberapa faktor
yang mempengaruhi proses adsorpsi adalah pH, suhu, konsentrasi dan waktu
kontak [10,13,15,16,17,18]. Pada umumnya, pecobaan dilakukan dengan
menyediakan larutan logam dengan konsentrasi yang sama untuk sejumlah
adsorben dalam wadah yang ditempatkan pada alat pengaduk (shaker)
[3,12,17,18]. Jenis larutan disediakan dalam bentuk larutan satu sistem atau
larutan biner. Perbedaan ini didasarkan pada karakteristik adsorpsi yang ingin
dilihat.
2.3 ADSORBEN
Adsorben adalah zat padat yang dapat menyerap partikel fluida dalam suatu
proses adsorpsi. Perilaku adsorben pada berbagai jenis larutan (mono, biner,
tertier), telah dikonfirmasi oleh peneliti sebelumnya, khususnya mengenai
adsorpsi logam berat tertentu seperti adsorben pasir [12], nanotube dan nanofiber
[3,5], zeolit [19], turmalin [10], dan bio-adsorben seperti arang hayati [9,14],
batang jagung [20,21], abu jerami [17], dan berbagai jenis adsorben lainnya.
Sehingga adsorben dapat dibagi dua yaitu material anorganik (silika, alumina,
zeolit) dan organik (karbon, polimer, biomassa).
Menurut Darmayanti dkk. [9], ada beberapa syarat yang harus dipenuhi
sebagai acuan dalam memilih dan memperoleh adsorben yang baik, yaitu :
1. Mempunyai daya serap yang tinggi.
2. Berupa zat padat yang mempunyai luas permukaan yang besar.
3. Tidak boleh larut pada larutan zat yang akan diadsorpsi.
4. Tidak ada reaksi kimia dengan campuran yang akan dimurnikan.
6. Tidak beracun.
7. Tidak meninggalkan residu berupa gas berbau.
8. Mudah didapat dan harganya murah.
Proses adsorpsi pada umumnya memiliki biaya operasional yang rendah dan
sangat efisien terutama untuk adsorpsi logam berat konsentrasi rendah [22].
Namun, penggunaan bio-adsorben lebih menguntungkan dibandingkan dengan
jenis adsorben lain yang digunakan. Karena selain biaya yang murah dan mudah
didapatkan, bio-adsorben juga tidak kalah efektif dalam menyerap logam
dibandingkan jenis adsorben lainnya sehingga sangat cocok digunakan untuk
pengolahan limbah industri [7].
2.4 ADSORBEN BATANG JAGUNG
Jagung adalah salah satu produk komoditas tertinggi di Indonesia bahkan di
dunia. Tongkol, kulit, daun serta batang jagung adalah residu/limbah pertanian
jagung yang sering dibakar tanpa dimanfaatkan [30]. Namun, baru-baru ini limbah
jagung telah diteliti untuk proses adsorpsi [25].
Struktur morfologi batang jagung telah diselidiki pada penelitian terdahulu
dengan menggunakan Scanning Electron Microscope (SEM) yang ditampilkan
pada Gambar 2.1. Perbesaran yang dilakukan sekitar 500 kali menunjukkan sifat
dasar permukaan batang jagung sebagai sebuah struktur poros yang berguna
dalam mengadsorpsi logam [15]. Sedangkan struktur kimia batang jagung
ditunjukkan pada Gambar 2.2.
Gambar 2.2 Struktur Kimia Batang Jagung [23]
Berdasarkan analisis yang dilakukan, permukaan tongkol jagung memiliki
porositas lebih tinggi jika dibandingkan batang jagung. Porositas rata-rata batang
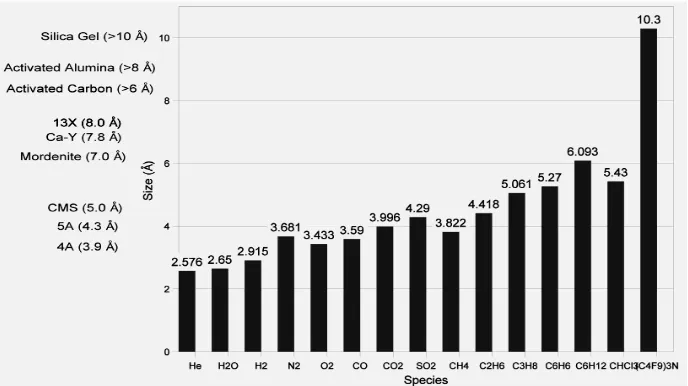
jagung adalah 58,51% sedangkan tongkol jagung mencapai 67,93% [31]. Jika dilihat berdasarkan diameter pori, batang jagung memiliki diameter pori ± 50 μm, 10 kali lebih besar dibandingkan karbon aktif dan zeolit yaitu hanya sekitar 3 – 6 μm [19]. Berikut data diameter pori dari berbagai jenis adsorben dan adsorbat (molekul yang sering diserap) sebagai bentuk perbandingan. Dari Gambar
tersebut, dapat dilihat bahwa ukuran pori batang jagung, lebih besar dibandingkan
beberapa jenis adsorben lainnya.
Gambar 2.3 Ukuran Pori dan Ukuran Berbagai Molekul pada Umumnya
[32]
2.5 KARAKTERISTIK PROSES ADSORPSI
Bagian ini menjelaskan karakteristik ilmiah dan kuantitatif tentang proses
di sini sebagai dasar untuk pemilihan adsorben dan analisis proses adsorpsi yang
terjadi. Pada kenyataannya, materi yang disajikan di sini hanyalah berupa
gambaran, karena untuk memahami dampaknya memerlukan pemahaman yang
cukup mendalam tentang bidang adsorpsi.
2.5.1 Pengukuran Kapasitas Adsorpsi
Adsorpsi multi logam (biner) sangat penting dilakukan, karena
karakteristik suatu logam dalam single solution berbeda dengan binary
solution. Dalam beberapa kasus, kandungan logam berat dalam suatu limbah
lebih kompleks dan ditemukan lebih dari satu jenis logam berat [5]. Model
larutan biner sangat mirip dengan sistem pada limbah sehingga penelitian ini
sangat berpotensi untuk dikembangkan bahkan diaplikasikan dalam teknologi
pengolahan limbah.
Untuk sistem biner, larutan disediakan dalam pH dan perbandingan
konsentrasi tertentu dengan suhu yang dijaga konstan. Jumlah logam
teradsorpsi per satuan massa adsorben pada kesetimbangan (Persaman 2.1),
Jumlah logam teradsorpsi per satuan massa adsorben pada waktu t
(Persamaan 2.2), dan persentasi penghapusan pada waktu t (Persamaan 2.3),
dapat dihitung dengan menggunakan persamaan berikut ini :
= − � (2.1)
[5,10,15,17, 23,24]
� = − � (2.2)
[5,10]
�% = − . % (2.3)
[5,10,23]
Keterangan:
qe = massa logam teradsorpsi pada kesetimbangan (mg/g)
qe = massa logam teradsorpsi pada waktu t (mg/g)
R% = Persentasi penghapusan logam (%)
C0 = konsentrasi logam awal (mg/L)
Ce = konsentrasi kesetimbangan (mg/L)
V = volume larutan (L)
mads = massa adsorben (g)
Persamaan-persamaan ini mengasumsikan bahwa perubahan volume fase
cair massal diabaikan karena konsentrasi zat terlarut kecil dan volume yang
ditempati oleh adsorben juga kecil. Jumlah logam berat teradsorpsi pada
sampel dihitung dengan menggunakan kurva kalibrasi yang ditentukan
sebelumnya berdasarkan hasil eksperimen.
2.5.2 Kesetimbangan Isotermal Adsorpsi
Kesetimbangan isotermal adsorpsi adalah salah satu data penting untuk
memahami mekanisme adsorpsi dan menggambarkan bagaimana adsorbat
dapat berinteraksi dengan adsorben sehingga sangat penting pengoptimalan
penggunaan adsorben [17]. Untuk mengoptimalkan desain sistem adsorpsi,
sangat penting untuk menetapkan hubungan yang paling sesuai dalam kurva
keseimbangan [25]. Untuk mendapatkan isotermal adsorpsi, pengaruh
konsentrasi pada kapasitas adsorpsi ion logam dari suatu adsorben, dilakukan
dengan memvariasikan konsentrasi awal larutan ion logam [10]. Beberapa
persamaan isotermal yang tersedia untuk menganalisis data eksperimen
adalah Langmuir, Freundlich, Langmuir-Freundlich.
Data adsorpsi logam berat dalam kesetimbangan yang diperoleh secara
eksperimental yang diterapkan dalam persamaan isotermal (Langmuir,
Freundlich, Langmuir-Freundlich ) merupakan model isotermal adsorpsi
untuk adsorpsi fasa cair [17]. Model adsorpsi ini memberikan representasi
dari kesetimbangan adsorpsi antara adsorbat dalam larutan dan permukaan
aktif adsorben.
Isotermal Langmuir yang berlaku untuk lapisan adsorpsi monomolekular
dapat diterapkan untuk mendapatkan kapasitas adsorpsi maksimum. Isotermal
Langmuir mengasumsikan bahwa pertukaran ion maksimum tergantung pada
tingkat kejenuhan satu lapisan molekul adsorbat pada permukaan adsorben,
bahwa energi pertukaran ion adalah konstan, dan bahwa tidak ada
dari isotermal Langmuir dapat dilihat pada Persamaan 2.4. Sedangkan model
Freundlich awalnya diusulkan sebagai persamaan empiris untuk
menggambarkan data pada adsorben heterogen yaitu melalui mekanisme
adsorpsi multi lapisan, seperti karbon aktif (Persamaan 2.5) [10,25].
Persamaan Langmuir, Freundlich dan Langmuir-Freundlich isotermal
adsorpsi secara berurutan dapat dinyatakan sebagai berikut:
=� ��
konstanta empiris yang menunjukkan tingkat adsorpsi dan efektivitas adsorpsi
masing-masing. Konstanta n memberikan gambaran tentang kelas
heterogenitas dalam distribusi pusat energi dan berhubungan dengan besarnya
kekuatan pendorong adsorpsi. Oleh karena itu, nilai n tinggi menunjukkan
permukaan adsorben relatif seragam, sedangkan nilai n yang rendah
menunjukkan adsorpsi tinggi pada larutan berkonsentrasi rendah. Selain itu,
nilai n rendah menunjukkan adanya bagian yang besar dari situs aktif
permukaan berenergi tinggi [17].
Namun berbeda untuk larutan biner. Bentuk persamaannya akan berubah
karena pada biner terdapat beberapa logam yang akan mempengaruhi
kesetimbangan adsorpsinya. Sehingga Persamaan 2.4 di atas dapat diturunkan
sebagai berikut:
,� = +���, , �,�,+��,, , (2.7)
Dimana a dan b adalah jenis logam yang digunakan dalam larutan.
Persamaan 2.7 di atas dapat juga dianalogikan dengan Persamaan 2.6, karena
Persamaan 2.6 digunakan untuk mono-sistem sehingga harus disesuaikan
dengan sistem biner.
2.5.3 Kinetika Adsorpsi
Kinetika adsorpsi merupakan laju penyerapan suatu fluida oleh adsorben
dalam jangka waktu tertentu. Untuk menyelidiki proses adsorpsi logam berat,
model kinetik yang berbeda digunakan untuk menggambarkan tingkat
penyerapan adsorbat pada adsorben [25]. Pada berbagai penelitian, data
kinetika adsorsi diperoleh secara empiris dengan menggunakan model
persamaan orde satu, persamaan orde dua dan model Elovich [17,25].
Tujuannya untuk mempelajari kinetika adsorpsi dan menemukan model
terbaik yang cocok untuk data eksperimen. Ketiga model ini telah banyak
digunakan untuk menggambarkan kinetika penyerapan logam maupun
senyawa organik pada berbagai jenis adsorben yang berbeda [10,17,25].
a. Persamaan Orde Satu
Dalam banyak kasus, model kinetika persamaan orde satu kurang cocok
dengan seluruh rentang waktu kontak, dan umumnya berlaku pada tahap awal
proses adsorpsi [25]. Persamaan persamaan orde satu dinyatakan sebagai
berikut:
log − � = log − ,� � (2.8)
[10,25]
Dimana qe dan qt adalah jumlah adsorbat (logam berat) yang diserap
(mg/g) pada keadaan setimbang dan selang waktu tertentu, t (min) dan k1
merupakan tetapan laju adsorpsi persamaan orde satu (min-1). Plot antara log
(qe – qt) vs t akan menghasilkan sebuah garis lurus untuk mendapatkan
tingkat parameter. Parameter tersebut adalah nilai k1, kapasitas adsorpsi
b. Persamaan Orde Dua
Seperti yang dapat diamati, persamaan persamaan orde dua tampaknya
memiliki model yang lebih baik dibandingkan dua persamaan lainnya. Hal ini
dapat dibuktikan dengan nilai koefisien korelasi (R2) yang didapatkannya
cukup besar [17] dan nilai qe teoritis yang dihasilkan sangat dekat dengan
nilai qe eksperimental, hal ini menunjukkan bahwa data adsorpsi sangat cocok
dibuat dengan menggunakan persamaan persamaan orde dua [10]. Persamaan
tersebut dapat dilihat di bawah ini :
�
� =� � +� � (2.9)
[17,25]
Dimana k2 merupakan tetapan laju adsorpsi persamaan orde dua
(g/mg.min).
c. Persamaan Elovich
Persamaan Elovich yang digunakan untuk mendeskripsikan aktivasi
adsorpsi dapat dinyatakan sebagai berikut:
� =�ln +�ln � (2.10)
[25]
Dimana α adalah tetapan laju adsorpsi awal (mg/g.min) dan β adalah konstanta desorpsi yang berkaitan dengan tingkat cakupan permukaan dan
energi aktivasi untuk proses adsorpsi secara kimia [25].
2.5.4 Proses Difusi
Difusi merupakan suatu proses berpindahnya suatu zat dalam pelarut dari
bagian berkonsentrasi tinggi ke bagian berkonsentrasi rendah. Dalam proses
adsorpsi dapat dipahami sebagai proses berpindahnya suatu substansi dari
pelarut menembus permukaan adsorben. Menurut Fonseca dkk., [12] proses
adsorpsi terjadi pada permukaan luar dan permukaan pori-pori bagian dalam
adsorben, sehingga untuk dapat teradsorpsi, proses-proses yang terjadi pada
1. Perpindahan massa zat terlarut/padatan dari cairan ke permukaan
adsorben.
2. Difusi dari permukaan adsorben ke dalam adsorben melalui pori.
3. Perpindahan massa zat padat dari cairan dalam pori ke dinding pori
adsorben.
4. adsorpsi padatan pada dinding pori adsorben.
Difusi ion pada suatu adsorben dapat dibagi dua, yaitu difusi eksternal dan
difusi internal. Jika difusi dari suatu ion hanya meliputi bagian luar permukaan
adsorben atau memiliki keterbatasan, maka disebut sebagai difusi eksternal yang
dapat dideskripsikan menggunakan persamaan berikut:
= −�. � + � (2.11)
[10]
Dengan z :
� = �� (2.12)
C0, Ct, dan A/V berturut-turut adalah konsentrasi awal larutan,
konsentrasi pada waktu t, dan perbandingan antara total luas permukaan
partikel terhadap volume larutan. A/V dapat dihitung dengan :
� = � (2.13)
[10]
Dimana m adalah massa adsorben (g), d adalah diameter partikel (µm), dan ρ adalah densitas adsorben (g/cm3
). Koefisien difusi eksternal, kf (cm/s),
dapat dideterminasikan dari slop/kemiringan pada garis dari plot antara
ln(Ct/Co) versus t.
Jika difusi ion terjadi pada permukaan dalam dan pori-pori, maka proses
ini disebut difusi internal. Difusi internal dapat dideskripsikan menggunakan
data percobaan mengikuti persamaan berikut :
� = � √� + � (2.14)
Dimana qt adalah kapasitas adsorpsi pada waktu t (mg/g), kid adalah
koefisien difusi (mg/g.min0,5) dan t adalah waktu adsorpsi.
2.5.5 Preferensi Adsorpsi (Prefential Adsorption)
Sering pada suatu larutan terdapat dua atau lebih substansi terlarut (ion)
yang akan diadsorpsi [3,10,12]. Jika ditinjau berdasarkan sifat kimia-fisika,
masing-masing ion terlarut memiliki propertis yang berbeda (ukuran partikel,
konfigurasi elektron, keelektronegatifan) [33]. Perbedaan sifat ini dapat
mempengaruhi mekanisme adsorpsi yang terjadi. Sehingga ada substansi
yang lebih disukai (dominan) diadsorpsi dan ada substansi yang kurang
disukai. Peristiwa ini disebut sebagai kecenderungan adsorpsi (prefential
adsorption). Kecenderungan Adsorpsi suatu adsorben terhadap satu dari dua
ion pada larutan biner, dapat didefinisikan menggunakan faktor separasi ∝ ,
yaitu :
∝ = �� (2.15)
[10]
Jika ion A memiliki interaksi yang lebih baik terhadap adsorben, maka
faktor separasi akan lebih besar dari satu. Jika sebaliknya, ion B interaksi
yang lebih baik, maka faktor separasi akan lebih kecil dari satu. Faktor
separasi dihitung dari data kesetimbangan adsorpsi. Jika faktor separasi
mendekati nilai satu, maka selektivitas adsorben cukup buruk. Namun, jika
faktor separasi lebih besar atau lebih kecil dari satu, maka selektivitas
![Gambar 2.1 Permukaan Batang Jagung pada Perbesaran 500 Kali. [15]](https://thumb-ap.123doks.com/thumbv2/123dok/1789722.1134323/4.595.185.442.550.710/gambar-permukaan-batang-jagung-pada-perbesaran-kali.webp)