PEMBUATAN KITOSAN PERAK SEBAGAI ADSORBEN UNTUK MENURUNKAN KADAR LOGAM BESI (Fe)
DAN ZINK (Zn) PADA AIR SUNGAI DESA TORONG KECAMATAN SIMPANG
EMPAT KABUPATEN KARO
SKRIPSI
NABILAH HANNANI 140802011
PROGRAM STUDI S1 KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
2018
PEMBUATAN KITOSAN PERAK SEBAGAI ADSORBEN UNTUK MENURUNKAN KADAR LOGAM BESI (Fe)
DAN ZINK (Zn) PADA AIR SUNGAI DESA TORONG KECAMATAN SIMPANG
EMPAT KABUPATEN KARO
SKRIPSI
Diajukan Untuk Melengkapi Tugas Dan Memenuhi Syarat Mencapai Gelar Sarjana Sains
NABILAH HANNANI 140802011
PROGRAM STUDI S1 KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
2018
UNIVERSITAS SUMATERA UTARA
PENGESAHAN SKRIPSI
Judul : Pembuatan Kitosan Perak Sebagai Adsorben Untuk Menurunkan Kadar Logam Besi (Fe) dan Zink (Zn) Pada Air Sungai Desa Torong Kecamatan Simpang Empat Kabupaten Karo
Kategori : Skripsi
Nama : Nabilah Hannani
Nomor Induk Mahasiswa : 140802011
Program Studi : Sarjana (S1) Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam (FMIPA) Universitas Sumatera Utara
Disetujui di Medan, Agustus 2018
Ketua Program Studi, Pembimbing,
Dr. Cut Fatimah Zuhra, S.Si, M.Si Prof. Dr. Harry Agusnar, M.Sc NIP. 197405051999032001 NIP. 195308171983031002
ii
PERNYATAAN ORISINALITAS
PEMBUATAN KITOSAN PERAK SEBAGAI ADSORBEN UNTUK MENURUNKAN KADAR LOGAM BESI (Fe)
DAN ZINK (Zn) PADA AIR SUNGAI DESA TORONG KECAMATAN SIMPANG
EMPAT KABUPATEN KARO
SKRIPSI
Saya menyatakan bahwa skripsi ini adalah hasil karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Agustus 2018
Nabilah Hannani 140802011
PENGHARGAAN Bismillahirrahmannirrahim,
Assalamu’alaikum Warohmatullahi Wabarokatuh,
Puji dan syukur senantiasa penulis ucapkan kepada Allah SWT karena berkat rahmat dan hidayah-Nya penulis dapat menyelesaikan skripsi ini dengan baik. Shalawat dan salam penulis hadiahkan kepada junjungan Nabi Besar Muhammad SAW, semoga kelak kita mendapatkan syafaatnya di hari akhir. Aamiin.
Dalam kesempatan ini penulis ingin menyampaikan ucapan terima kasih yang tak terhingga kepada kedua orang tua tercinta, untuk Ayahanda H. Burhanuddin Noor, LC dan Ibunda Hj.Nur’aini, terima kasih atas kelimpahan cinta dan kasih sayang, doa, pengorbanan dan dukungan baik moril maupun materil kepada penulis.
Kepada abang dan kakak tersayang Fathi Hawari, Mhd. Miqdad, Yunita Pratiwi, Ratna Hening Pitaloka dan Luknah Uyuni terima kasih atas doa dan dukungan terbaik yang telah diberikan kepada penulis.
Terima kasih penulis sampaikan kepada Bapak Prof. Dr. Harry Agusnar, M.Sc selaku dosen pembimbing yang telah membantu dan memotivasi penulis untuk menyelesaikan skripsi ini. Terima kasih juga kepada Ibu Dr. Cut Fatimah Zuhra, M.Si selaku Ketua Departemen Kimia FMIPA USU dan Ibu Dr. Sofia Lenny, S.Si, M.Si selaku Sekretaris Departemen Kimia FMIPA USU. Terima kasih juga kepada Bapak dan Ibu dosen atas ilmu yang sangat bermanfaat untuk penulis selama masa perkuliahan.
Ucapan terima kasih juga penulis ucapkan kepada Ibu Dr. Sabarmin Perangin-Angin, M.Si dan kakak Sri Rahayu, S.Si selaku kepala dan laboran di Laboratorium Kimia Dasar LIDA USU. Untuk keluarga besar Laboratorium Kimia Dasar, rekan-rekan dari stambuk 2013-2016 terima kasih atas kekeluargaannya selama ini. Untuk sahabat terbaik penulis Afif Khairi, Uti, Iyol, Mandek dan Opop, kepada sahabat LIDA 2014 Abduh, Hari, Taufik, Ade, Uan serta kepada teman- teman seperjuangan stambuk 2014 terima kasih atas dukungan, doa dan bantuan untuk penulis serta kenangan yang telah terukir semasa perkuliahan.
Semoga Allah SWT melindungi dan mengabulkan segala Doa-doa kita dan membalas semua kebaikan kalian kepada penulis. Aamiin Allahumma Aamiin.
Medan, Agustus 2018
Nabilah Hannani
iv
PEMBUATAN KITOSAN PERAK SEBAGAI ADSORBEN UNTUK MENURUNKAN KADAR LOGAM BESI (Fe)
DAN ZINK (Zn) PADA AIR SUNGAI DESA TORONG KECAMATAN SIMPANG
EMPAT KABUPATEN KARO
ABSTRAK
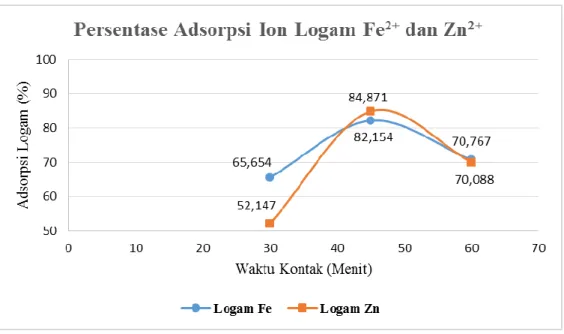
Penelitian pembuatan kitosan yang dimodifikasi dengan larutan AgNO3 menjadi kitosan perak sebagai adsorben untuk menurunkan kadar logam besi (Fe) dan zink (Zn) pada air sungai desa torong kecamatan simpang empat kabupaten karo telah dilakukan. Pada penelitian ini, didahului dengan pembuatan kitosan perak dengan melarutkan kitosan komersial dan asam asetat 1% serta dicampurkan dengan larutan AgNO3 0,5 M dengan rasio 2:1 lalu diteteskan kedalam larutan NaOH 2 M yang kemudian membentuk gel (bead) berwarna hitam. Kitosan perak yang telah dikeringkan dimasukkan ke dalam kolom, lalu ditambahkan dengan 50 mL sampel yang telah didestruksi dan sudah diketahui kadar logam Fe dan Zn sebesar 1,5175 mg/L dan 0,7218 mg/L. Didiamkan berdasarkan variasi waktu kontak selama 30, 45, dan 60 menit. Penentuan penurunan kadar logam yang telah di adsorbsi oleh kitosan perak dilakukan dengan menggunakan Spektrofotometri Serapan Atom (SSA). Hasil penelitian menunjukkan bahwa pada proses adsorpsi diperoleh persentase penyerapan logam Fe 82,154% dan logam Zn 84,871 % pada waktu kontak optimum penyerapan yaitu 45 menit.
Kata kunci : Adsorben, Kitosan Perak, Logam Besi (Fe), Logam Zink (Zn), SSA.
PRODUCT OF SILVER CHITOSAN AS ADSORBENT TO REDUCING CONCENTRATION OF IRON (Fe) AND ZINC (Zn) METAL IN THE WATER OF THE RIVER AT TORONG VILLAGE SUB-DISTRICT SIMPANG
EMPAT, THE REGENCY OF KARO
ABSTRACT
Research to modification and product chitosan with AgNO3 solution into silver chitosan as adsorbent to reducing the concentration of iron (Fe
)
and zinc (Zn) metal in the water of the river at Torong Village Sub-district Simpang Empat, the regency of Karo has been done. In this research, preceded by making silver chitosan by dissolving commercial chitosan and 1% acetic acid and mixed with 0,5 M AgNO3 solution with ratio 2:1 and dropped into a solution of 2 M NaOH which then forms black gel (bead). Silver chitosan was dried included in the column, then was added with 50 ml of sample that have been destruction and known the concentration of Fe and Zn metal are 1,5175 mg/L and 0,7218 mg/L.Which allowed by variations of contact time that are 30, 45, and 60 minutes. The determination of metal content reduction was obtained by Atomic Absorption Spectrophotometre (AAS). The results showed that the adsorption process was obtained in the percentage of absorption, for Fe metal 82,154% and Zn metal 84,871 %, by the optimum contact time of absorption is 45 minutes.
Keywords: Adsorbent, Silver Chitosan, Iron (Fe) Metal, Zinc (Zn) Metal, AAS .
vi DAFTAR ISI
Halaman
PENGESAHAN SKRIPSI i
PERNYATAAN ORISINALITAS ii
PENGHARGAAN iii
ABSTRAK iv
ABSTRACT v
DAFTAR ISI vi
DAFTAR TABEL ix
DAFTAR GAMBAR x
DAFTAR LAMPIRAN xi
DAFTAR SINGKATAN xii
BAB 1 PENDAHULUAN 1.1. Latar Belakang 1 1.2. Perumusan Masalah 3 1.3. Pembatasan Masalah 3 1.4. Tujuan Penelitian 3
1.5. Manfaat Penelitian 4
1.6. Metodologi Penelitian 4
BAB 2 TINJAUAN PUSTAKA 2.1. Kitosan 6
2.1.1. Sifat Fisika-Kimia Kitosan 7
2.1.2. Kegunaan Kitosan 9
2.2. Modifikasi Kitosan 10
2.3. Destruksi 11
2.4. Adsorpsi 11
2.5. Logam Berat 12
2.5.1. Logam Besi (Fe) 12
2.5.2. Logam Zink (Zn) 13
2.6. Kemampuan Kitosan Untuk Menyerap Logam 13
2.7. FTIR (Fourier Transform Infra Red) 14
2.8. Spektrofotometri Serapan Atom (SSA) 15
2.8.1. Prinsip dan Teori 15
2.8.2. Instrumentasi 16
2.8.3. Rangkaian Spektrofotometer Serapan Atom 16
2.8.4. Gangguan Pada SSA dan Cara Mengatasinya 18
BAB 3 METODE PENELITIAN 3.1. Waktu dan Tempat 19
3.2. Alat dan Bahan 19
3.2.1. Alat 19
3.2.2. Bahan 20
3.3. Pembuatan Larutan Pereaksi 20
3.3.1. Larutan Asam Asetat 1% 20 3.3.2. Larutan NaOH 2 M 20 3.3.3. Larutan AgNO3 0,5 M 20
3.4. Pembuatan Larutan Kitosan 21
3.5. Pembuatan Kitosan Perak 21
3.6. Preparasi Larutan Sampel 21 3.7. Penentuan Kandungan Besi (Fe) Secara
Spektrofotometri Serapan Atom (SSA) 21 3.8. Pembuatan Larutan Standar Fe 21 3.8.1. Pembuatan Larutan Standar Fe 100 mg/L 21 3.8.2. Pembuatan Larutan Standar Fe 10 mg/L 22 3.8.3. Pembuatan Larutan Seri Standar Fe 0,2 ;
0,4 ; 0,6 ; 0,8 ; dan 1,0 mg/L 22 3.8.4. Pembuatan Kurva Kalibrasi Larutan Standar Fe 22 3.9. Penentuan Kandungan Zink (Zn) Secara
Spektrofotometri Serapan Atom (SSA) 22 3.10. Pembuatan Larutan Standar Zn 22 3.10.1. Pembuatan Larutan Standar Zn 100 mg/L 22 3.10.2. Pembuatan Larutan Standar Zn 10 mg/L 22 3.10.3. Pembuatan Larutan Seri Standar Fe 0,2 ;
0,4 ; 0,6 ; 0,8 ; dan 1,0 mg/L 23 3.10.4. Pembuatan Kurva Kalibrasi Larutan Standar Zn 23 3.11. Penentuan Waktu Kontak Optimum pada Kitosan Perak 23
3.12. Bagan Penelitian 24
3.12.1. Pembuatan Larutan Pereaksi 24 3.12.1.1. Larutan Asam Asetat 1% 24 3.12.1.2. Larutan NaOH 2 M 24 3.12.1.3. Larutan AgNO3 0,5 M 25 3.12.2. Pembuatan Larutan Kitosan 25 3.12.3. Pembuatan Kitosan Perak 26 3.12.4. Penentuan Kurva Kalibrasi Besi (Fe) 27 3.12.5. Preparasi dan Penentuan Kadar Logam Besi (Fe)
pada Sampel 27
3.12.6. Penentuan Kurva Kalibrasi Zink (Zn) 28 3.12.7. Preparasi dan Penentuan Kadar Logam Zink (Zn)
pada Sampel 28
3.12.8. Penentuan Waktu Kontak Optimum Pada
Kitosan Perak 29
BAB 4 HASIL DAN PEMBAHASAN
4.1. Data Absorbansi Larutan Standar Besi (Fe) 30 4.1.1. Penurunan Persamaan Garis Regresi dengan
Metode Kurva Kalibrasi untuk Larutan Standar Fe 31 4.1.2. Penentuan Koefisien Korelasi 32 4.2. Data Absorbansi Larutan Standar Zink (Zn) 33
4.2.1. Penurunan Persamaan Garis Regresi dengan
Metode Kurva Kalibrasi untuk Larutan Standar Zn 34 4.2.2. Penentuan Koefisien Korelasi 35
viii
4.3. Data Persentase Penurunan Kadar Logam dalam larutan
(Penentuan Persen (%) Adsorpsi) 36 4.3.1. Penentuan Persen Adsorpsi Logam Fe 36 4.3.2. Penentuan Persen Adsorpsi Logam Zn 36
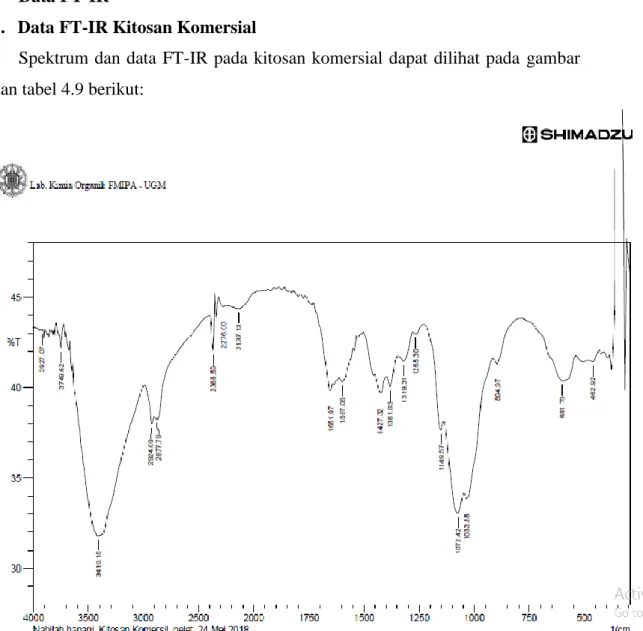
4.4. Data FT-IR 37
4.4.1. Data FT-IR Kitosan Komersial 37 4.4.2. Data FT-IR Kitosan Perak 38
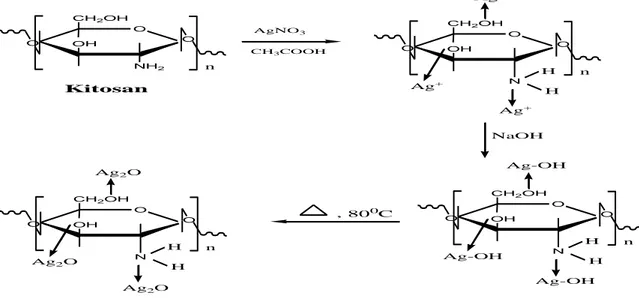
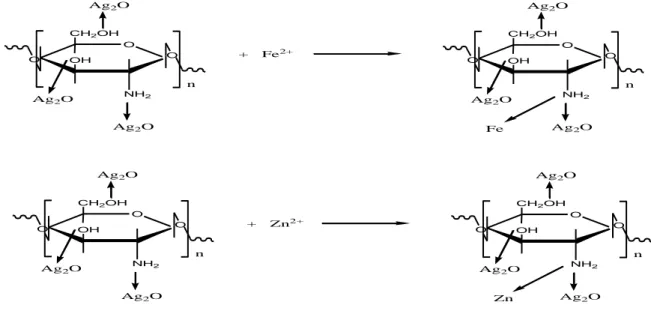
4.5. Reaksi-reaksi 39
4.5.1. Reaksi Kitosan Komersial menjadi Kitosan Perak 39 4.5.2. Reaksi Kitosan Perak dengan Ion Logam Fe2+
dan Zn2+ 40
4.6. Pembahasan 40
4.6.1. Analisa Spektrum FT-IR 40
4.6.2. Adsorpsi Ion Logam Besi (Fe2+) dan Zink (Zn2+) dengan Kitosan Perak Berdasarkan Waktu Kontak
Optimum 41
BAB 5 KESIMPULAN DAN SARAN
5.1. Kesimpulan 44
5.2. Saran 44
DAFTAR PUSTAKA 45
LAMPIRAN 48
DAFTAR TABEL
Nomor Judul Halaman
Tabel
2.1. Spesifikasi Kitosan 7
2.2. Kelarutan Kitosan pada Berbagai Pelarut Asam Organik 8
4.1. Data Absorbansi Larutan Standar Besi (Fe) 30
4.2. Kondisi Alat Spektrofotometer AA-7000 pada Absorbansi Fe 30 4.3. Penurunan Persamaan Garis Regresi Untuk Penentuan
Konsentrasi Logam Fe Berdasarkan Pengukuran
Absorbansi Larutan Standar Fe 31
4.4. Data Absorbansi Larutan Standar Zink (Zn) 33
4.5. Kondisi Alat Spektrofotometer AA-7000 pada Absorbansi Zn 33 4.6. Penurunan Persamaan Garis Regresi Untuk Penentuan
Konsentrasi Logam Zn Berdasarkan Pengukuran
Absorbansi Larutan Standar Zn 34
4.7. Data Penurunan Kadar Logam Fe dan Persentase Adsorpsi
Berdasarkan Variasi Waktu 36
4.8. Data Penurunan Kadar Logam Zn dan Persentase Adsorpsi
Berdasarkan Variasi Waktu 37
4.9. Data Spektrum FT-IR Kitosan Komersial 38
4.10. Data Spektrum FT-IR Kitosan Perak 39
x
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar
2.1. Struktur Polimer Kitosan 6
2.2. Rangkaian Ringkas Spektrofotometer Serapan Atom 16
4.1. Kurva Kalibrasi Larutan Seri Standar Fe 31
4.2. Kurva Kalibrasi Larutan Seri Standar Zn 34
4.3. Spektrum FT-IR Kitosan Komersial 37
4.4. Spektrum FT-IR Kitosan Perak 38
4.5. Reaksi Kitosan Komersial Menjadi Kitosan Perak 39 4.6. Reaksi Kitosan Perak dengan Ion Logam Fe2+ dan Zn2+ 40 4.7. Grafik Waktu Optimum dengan Persentase Adsorpsi Ion
Logam Fe2+ dan Zn2+ 42
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lampiran
1. Hasil Penelitian 48
2. Peralatan Penelitian 48
3. Spektrum FT-IR Kitosan Komersial 50
4. Spektrum FT-IR Kitosan Perak 50
5. Peraturan Menteri Kesehatan Republik Indonesia Nomor : 416/MENKES/PER/IX/1990
Tanggal : 3 September 1990
Daftar Persyaratan Kualitas Air Miinum 51
6. Peraturan Menteri Kesehatan Republik Indonesia Nomor : 416/MENKES/PER/IX/1990
Tanggal : 3 September 1990
Daftar Persyaratan Kualitas Air Miinum 53
xii
DAFTAR SINGKATAN
FTIR = Fourier Transform Infra-Red SSA = Spektrofotometri Serapan Atom
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Air merupakan bahan yang sangat vital yang tidak dapat dipisahkan dari seluruh aktivitas kehidupan mahkluk hidup di bumi ini. Keseluruhan jumlah dari 40 juta mil kubik air yang berada di planet bumi ini, baik yang didalam maupun permukaan ternyata hanya 0,5% atau 0,2 juta mil kubik yang secara langsung dapat digunakan.
Sisanya, yaitu 97% berbentuk air laut dan 2,5% berbentuk salju dan es abadi yang dalam keadaan cair baru dapat digunakan (Suriawiria, 2005).
Berdasarkan peraturan Menkes Nomor 416/MEN.KES/PER/IX/1990 tentang Syarat-syarat dan Pengawasan Kualitas Air yang disebut sebagai air minum adalah air yang melalui proses pengolahan yang memenuhi syarat kesehatan dan dapat langsung di minum. Sedangkan air bersih adalah air yang digunakan untuk keperluan sehari-hari yang kualitasnya memenuhi syarat kesehatan dan dapat diminum apabila telah dimasak.
Sungai memiliki peran strategis secara ekonomi bagi masyarakat dan pembangunan daerah, diantaranya sebagai sumber air minum, bahan baku industri, sarana budidaya perikanan, irigasi pertanian, dan pembangkit listrik daerah. Sungai juga memiliki peran penting secara ekologi sebagai sebuah ekosistem dengan seluruh kesatuan didalamnya. Sebagai sebuah ekosistem perairan terbuka yang mengalir, sungai mendapat input dari luar sejak di hulu hingga ke hilir. Input tersebut dapat berupa limbah sisa industri dan limbah domestik maupun input dari gangguan bencana alam. Hal tersebut dapat menurunkan kualitas air sungai, mempengaruhi biota perairan, dan secara luas merugikan kehidupan manusia (Imroatushshoolikhah, 2014).
Erupsi gunung yang berupa aliran lava, hujan abu vulkanik, banjir lahar dingin merupakan batuan dan mineral yang berasal dari gunung berapi yang mengandung logam-logam mineral, logam berat maupun unsur radionuklida alam
2
dengan isotop K, U, dan Th yang umumnya terdapat di dalam magma atau material yang dikeluarkan gunung berapi (Ardianto, 2009).
Logam berat didefinisikan sebagai logam yang memiliki densitas yang tinggi dan merupakan pencemar yang banyak dijumpai baik di lingkungan darat maupun perairan. Logam berat memiliki pengaruh pada kehidupan organisme lingkungan, karena bersifat racun dan dapat menyebabkan kematian apabila jumlahnya melewati ambang batas yang telah ditetapkan. Maka dari itu, kandungan logam berat di lingkungan dapat dikurangi dengan cara menjerapnya yaitu dengan menggunakan kitosan (Karthikeyan et al., 2004).
Kitosan adalah senyawa polimer alam turunan kitin yang diisolasi dari limbah perikanan, seperti kulit udang, cangkang kepiting, cumi-cumi, serta belangkas dengan kandungan kitin hingga 90 persen. Senyawa kitin dan kitosan ini dapat diolah dan dimanfaatkan sebagai bahan penyerap logam-logam berat yang dihasilkan oleh limbah industri. Hal ini dimungkinkan karena senyawa kitin dan kitosan mempunyai sifat sebagai bahan pengemulsi koagulasi, reaktifitas kimia yang tinggi dan menyebabkan sifat polielektrolit kation sehingga dapat berperan sebagai penukar ion (ion exchanger) dan dapat berfungsi sebagai adsorben terhadap logam berat (Agusnar, 2006).
Agusnar (2006) telah melakukan penelitian mengenai Penggunaan Kitosan dari Tulang Rawan Cumi-Cumi (Loligo pealli) untuk Menurunkan Kadar Ion Logam, dimana hasilnya kitosan mampu menyerap logam kadmium secara optimum pada waktu kontak 75 menit dengan % penyerapan sebesar 35,75%.
Khairuni, M (2017) telah melakukan penelitian menggunakan modifikasi kitosan menjadi komposit kitosan CuO sebagai adsorben untuk menyerap kadar logam besi (Fe), Mangan (Mn) dan Zink (Zn) pada air sungai Belawan Medan.
Daulay, A.M. (2011) telah melakukan penelitian penggunaan kitosan magnetic nanopartikel untuk menyerap logam kadmium (Cd) dan tembaga (Cu) dengan menggunakan Spektrofotometer serapan atom (SSA) dimana daya serap optimum pada logam Cd sebesar 90,04% dan pada logam Cu sebesar 99,12%
dengan waktu kontak 30 menit.
Maslan (2011) telah melakukan penelitian efektivitas penyerapan logam besi (Fe) dan Logam Natrium (Na) oleh kitosan nanopartikel pada limbah cair detergen dimana daya serap optimum logam Fe sebesar 90,03% dan logam Na sebesar 96,43%.
Berdasarkan latar belakang dan penelitian yang telah dilakukan sebelumnya, peneliti tertarik untuk melakukan penelitian dengan judul “Pembuatan Kitosan Perak Sebagai Adsorben Untuk Menurunkan Kadar Logam Besi (Fe) dan Zink (Zn) Pada Air Sungai Desa Torong Kecamatan Simpang Empat Kabupaten Karo”.
1.2 Perumusan Masalah
Permasalahan dalam penelitian ini adalah:
1. Bagaimana pengaruh daya serap kitosan perak sebagai adsorben terhadap logam Fe dan Zn ?
2. Berapakah waktu kontak yang optimum pada penggunaan kitosan perak sebagai adsorben terhadap logam Fe dan Zn ?
1.3 Pembatasan Masalah
Dalam penelitian ini masalah dibatasi pada :
1. Kitosan yang digunakan adalah kitosan dari Cangkang Belangkas
2. Sampel yang digunakan adalah Air Sungai Desa Torong Kecamatan Simpang Empat Kabupaten Karo
3. Modifikasi kitosan dibuat menjadi kitosan perak dengan melakukan perendaman campuran larutan kitosan dan larutan AgNO3 pada larutan NaOH sehingga terbentuk kitosan bead
4. Penyerapan logam Fe dan Zn dilakukan berdasarkan perbandingan variasi waktu kontak
1.4 Tujuan Penelitian
1. Untuk menentukan pengaruh daya serap kitosan perak sebagai adsorben terhadap logam Fe dan Zn
2. Untuk mengetahui waktu kontak optimum penyerapan logam Fe dan Zn menggunakan kitosan perak
4
1.5 Manfaat Penelitian
Hasil yang diperoleh dari penelitian ini diharapkan dapat menjadi salah satu informasi ilmiah bahwa kitosan perak mampu menanggulangi pencemaran logam Fe dan Zn pada Air Sungai Desa Torong Kecamatan Simpang Empat Kabupaten Karo berdasarkan waktu kontak optimum perendaman kitosan perak di dalam sampel.
1.6 Metodologi Penelitian
1. Penelitian dilakukan secara eksperimen laboratorium.
2. Pembuatan kitosan perak dilakukan dengan cara menimbang kitosan dan dilarutkan dalam asam asetat 1 % lalu dicampurkan dengan larutan AgNO3 0,5 M dengan rasio 2:1 dan selanjutnya diteteskan dalam larutan NaOH 2 M hingga terbentuk bead. Kemudian didiamkan satu malam lalu dicuci dengan aquadest dan dikeringkan. Produk di analisis dengan Spektrofotometer FTIR.
3. Sampel terlebih dahulu dipreparasi dan didestruksi basah dengan menggunakan HNO3(p)
4. Uji Kuantitatif untuk penentuan kandungan logam Fe dan Zn sebelum dan sesudah diserap kitosan perak dilakukan dengan metode SSA dengan λspesifik = 248,3 nm dan λspesifik = 213,9 nm berdasarkan variasi waktu kontak (30, 45, dan 60 menit)
Variabel yang digunakan dalam penelitian ini adalah 1. Variabel terikat meliputi :
Volume sampel Air Sungai Desa Torong yang digunakan pada penyerapan adalah 50 mL
2. Variabel tetap meliputi :
a. Volume sampel Air Sungai Desa Torong yang digunakan pada penyerapan adalah 50 mL
b. Volume Asam asetat 1% yang digunakan untuk melarutkan kitosan adalah 100 mL
3. Variabel bebas meliputi :
Waktu kontak yang digunakan pada proses penyerapan adalah 30, 45, dan 60 menit.
BAB 2
TINJAUAN PUSTAKA
2.1 Kitosan
Kitosan adalah senyawa polimer alam turunan kitin yang diisolasi dari limbah perikanan, seperti kulit udang dan cangkang kepiting dengan kandungan kitin antara 65-70 %. Sumber bahan baku kitosan yang lain diantaranya adalah kalajengking, jamur, cumi, gurita, serangga, laba-laba dan ulat sutera dengan kandungan kitin antara 5-45 %. Kitosan merupakan bahan kimia multiguna berbentuk serat dan merupakan kopolimer berbentuk lembaran tipis, berwarna putih atau kuning, tidak berbau. Kitosan merupakan produk deasetilasi kitin melalui proses kimia menggunakan basa natrium hidroksida atau melalui proses enzimatis menggunakan enzim chitin deacetylase. Serat ini bersifat tidak dicerna dan tidak diserap oleh tubuh. Sifat menonjol kitosan adalah kemampuan mengabsorpsi lemak hingga 4-5 kali beratnya (Rismana, 2006).
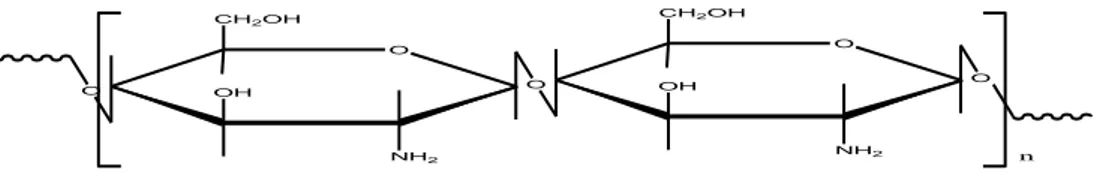
Kitosan adalah poli - (2-amino-deoksi-β(1-4)-D-glukopiranosa) dengan rumus molekul (C6H11NO4)n yang diperoleh dari deasetilasi kitin. Kitosan juga dijumpai secara alamiah di beberapa organisme. Kitosan bukan merupakan senyawa tunggal, tetapi merupakan kelompok yang dideasetilasi sebagian dengan derajat polimerisasi yang berbeda. Struktur polimer kitosan dapat dilihat pada gambar (Gambar 2.1.) dibawah ini :
O
NH2 OH
CH2OH
O O
O
NH2 OH
CH2OH
O
n
Gambar 2.1. Struktur polimer kitosan (Sugita, 2009)
Proses deasetilasi kitosan dapat dilakukan dengan cara kimiawi maupun enzimatik. Proses kimiawi menggunakan basa misalnya NaOH dan dapat menghasilkan kitosan dengan derajat deasetilasi yang tinggi, yaitu mencapai 85-93%
(Tsigos et al., 2000). Namun proses kimiawi menghasilkan kitosan dengan bobot
molekul yang beragam dan deasetilasi juga sangat acak, sehingga sifat fisik dan kimia kitosan tidak seragam (Martinou et al., 1995). Selain itu proses kimiawi juga dapat menimbulkan pencemaran lingkungan, sulit dikendalikan, dan melibatkan banyak reaksi samping yang dapat menurunkan rendemen (Chang et al., 1997).
Proses enzimatik dapat menutupi kekurangan proses kimiawi. Pada dasarnya deasetilasi secara enzimatik bersifat selektif dan tidak merusak struktur rantai kitosan, sehingga menghasilkan kitosan dengan karakteristik yang lebih seragam agar dapat memperluas bidang aplikasinya. (Tokuyasu et al., 1997).
2.1.1 Sifat Fisika-Kimia Kitosan
Kitosan memiliki sifat unik yang dapat digunakan dalam berbagai cara serta memiliki kegunaan yang beragam, antara lain sebagai perekat, aditif untuk kertas dan tekstil, penjernih air minum, serta untuk mempercepat penyembuhan luka, dan memperbaiki sifat pengikatan warna. Kitosan merupakan pengkelat yang kuat untuk ion logam transisi. Kitosan mempunyai kemampuan untuk mengabsorbsi logam dan membentuk kompleks kitosan dengan logam (Robert, 1992)
Sifat dan penampilan produk kitosan dipengaruhi oleh perbedaan kondisi seperti jenis pelarut, konsentrasi, waktu, dan suhu proses ekstraksi. Kitosan dapat diperoleh dengan berbagai macam bentuk morfologi diantaranya struktur yang tidak teratur, bentuknya kristalin atau semikristalin (Harianingsih, 2010).
Tabel 2.1. Spesifikasi kitosan
Parameter Ciri – ciri
Ukuran partikel Serpihan sampai bubuk
Kadar air (%) ≤ 10,0
Kadar abu (%) ≤ 2,0
Warna larutan Tidak berwarna
N-deasetilasi (%) ≥ 70,0 Kelas viskositas (cps) :
- - Rendah < 200
- Medium 200799
- - Tinggi pelarut organik 800200
(Sugita, 2009)
8
Kitosan merupakan padatan amorf yang berwarna putih kekuningan dengan rotasi spesifik [α]D11 -3 hingga -10˚ (pada konsentrasi asam asetat 2%). Kitosan larut pada kebanyakan larutan asam organik pada pH sekitar 4,0 tetapi tidak larut pada pH lebih besar dari 6,5 juga tidak larut dalam pelarut air, alkohol, dan aseton. Dalam asam mineral pekat seperti HCl dan HNO3, kitosan larut pada konsentrasi 0,15-1,1%, tetapi tidak larut pada konsentrasi 10%.
Kitosan bersifat hidrofilik, menahan air dalam strukturnya dan membentuk gel secara spontan. Pembentukan gel berlangsung pada pH asam dan sedikit asam, disebabkan sifat kationik kitosan. Viskositas juga meningkat dengan meningkatnya derajat deasetilasi. Gel kitosan terdegradasi secara berangsur-angsur, seperti halnya kitosan melarut (Muzzarelli, 1977).
Kitosan tidak larut dalam H2SO4 pada berbagai konsentrasi, sedangkan didalam H3PO4 tidak larut pada konsentrasi 1% sementara pada konsentrasi 0,1%
sedikit larut. Perlu kita ketahui, bahwa kelarutan kitosan dipengaruhi oleh bobot molekul, derajat deasetilasi, dan rotasi spesifiknya yang beragam bergantung pada sumber dan metode isolasi serta transformasinya (Sugita, 2009).
Tabel 2.2. Kelarutan kitosan pada berbagai pelarut asam organik Konsentrasi asam organik Konsentrasi asam organik (%)
10 50 >50
Asam asetat + ± -
Asam adipat - - -
Asam sitrat + - -
Asam format + + +
Asam laktat + - -
Asam maleat + - -
Asam malonat + - -
Asam oksalat + - -
Keterangan : + larut; - tidak larut; ± larut sebagian (Sugita, 2009)
Kitosan mempunyai sifat spesifik yaitu adanya sifat bioaktif, biokompatibel, pengkelat, anti bakteri dan dapat terbiodegradasi. Kualitas kitosan dapat dilihat dari sifat intrinsiknya, yaitu kemurniaannya, massa molekul, dan derajat deasetilasi.
Umumnya kitosan mempunyai derajat deasetilasi 75-100%. Massa molekul kitosan dan distribusinya berpengaruh terhadap sifat-sifat fisika-kimia polisakarida, seperti sifat reologi kitosan, fleksibilitas rantai. Derajat deasetilasi dan massa molekul kitosan hasil deasetilasi kitin pada dasarnya dipengaruhi oleh konsentrasi alkali/basa, rasio larutan terhadap padatan, suhu, dan waktu reaksi, lingkungan/kondisi reaksi selama deasetilasi. Konsentrasi alkali, rasio padatan dan larutan yang tinggi dapat memfasilitasi proses deasetilasi menghasilkan kitosan yang memiliki sifat fisika- kimia yang mempengaruhi syarat untuk berbagai aplikasi (Ramadhan, dkk.2010).
2.1.2 Kegunaan Kitosan
Di bidang industri, kitosan berperan antara lain sebagai koagulan polielektrolit pengolahan limbah cair, pengikat dan penjerap ion logam, mikroorganisme, mikroalga, pewarna, residu pestisida, lemak, tanin, PCB (poliklorinasi bifenil), mineral dan asam organik, media kromatografi afinitas, gel dan pertukaran ion, penyalut berbagai serat alami dan sintetik, pembentuk film dan membran mudah terurai, meningkatkan kualitas kertas, pulp, dan produk tekstil (Sugita, 2009).
Selain itu, kitosan telah dimanfaatkan dalam berbagai bidang biokimia, obat- obatan, farmakologi, pertanian, pangan dan gizi, mikrobiologi, penanganan air limbah serta keperluan industri seperti industri kertas dan tekstil sebagai zat aditif, industri pembungkus makanan berupa film khusus, industri metalurgi sebagai adsorban untuk ion-ion metal, industri kulit untuk perekat, photografi, industri cat sebagai koagulan, pensuspensi, dan flokulasi, serta industri makanan sebagai aditif dan penghasil protein tunggal (Suptijah, dkk.2012).
Salah satu aplikasi kitosan yang paling berpotensi di bidang lingkungan adalah sebagai adsorben yang digunakan untuk mengurangi zat pencemar pada lingkungan. Kitosan lazimnya disintesis dari deasetilasi kitin yang berasal dari limbah kulit udang dan kepiting. Oleh karena itu, penggunaan kitosan sejak awal telah berperan dalam mengurangi pencemaran lingkungan. Manfaat kitosan di bidang
10
lingkungan adalah untuk menjerap logam berat maupun zat warna yang banyak dihasilkan oleh industri tekstil atau kertas. Logam berat merupakan limbah yang sangat berbahaya. Hal tersebut dikarenakan logam berat menyebabkan toksisitas akut pada manusia maupun habitat yang ada di lingkungan perairan (Sugita, 2009).
Karena adanya gugus amino, kitosan merupakan polielektrolit kationik (pKa = 6,5), hal yang sangat jarang terjadi secara alami. Karena sifatnya yang basa ini, maka kitosan :
a. Dapat larut dalam media asam encer membentuk larutan kental, sehingga dapat digunakan untuk pembuatan gel dalam beberapa variasi konfigurasi seperti butiran, membran, pelapis kapsul, serat dan spons.
b. Membentuk kompleks yang tidak larut dalam air dengan polielektrolit anion yang dapat juga digunakan untuk pembuatan butiran gel, kapsul dan membran.
c. Dapat digunakan sebagai pengekelat ion logam berat dimana gelnya menyediakan sistem proteksi terhadap efek destruksi dari ion (Kaban, 2009).
2.2 Modifikasi Kitosan
Dewasa ini, modifikasi kitosan sebagai adsorben dapat berada dalam berbagai bentuk, antara lain bentuk butir, serpih, hidrogel, dan membran (film). Kitosan sebagai adsorben sering dimanfaatkan untuk proses adsorpsi ion logam berat.
Besarnya afinitas kitosan dalam mengikat ion logam sangat bergantung pada karakteristik makrostruktur kitosan yang dipengaruhi oleh sumber dan kondisi pada saat proses isolasi.
Perbedaan bentuk kitosan sangat berpengaruh pada luas permukaannya.
Semakin kecil ukuran kitosan, maka luas permukaan kitosan akan semakin besar, dan proses adsorpsi pun dapat berlangsung lebih baik. Modifikasi kimia kitosan menjadi gel kitosan dapat meningkatkan kapasitas jerapnya. Keunggulan ini disebabkan oleh bentuk butiran gel mempunyai volume pori yang lebih besar dibandingkan dengan bentuk serpihan, tetapi daya absorpsi butiran gel kitosan dipengaruhi oleh kestabilan sifat gel yang dibentuk. Kestabilan gel sangat dipengaruhi oleh beberapa faktor seperti konsentrasi, pH, suhu, polielektrolit, dan keberadaan hidrokoloid lainnya.
Disamping faktor-faktor tersebut, butiran gel kitosan juga dipengaruhi oleh bobot molekulnya. Kitosan dengan bobot molekul yang tinggi akan menghasilkan larutan dengan viskositas (kekentalan) yang tinggi pula (Rao et al., 1993).
2.3 Destruksi
Destruksi merupakan suatu cara perlakuan (perombakan) senyawa menjadi unsur-unsur sehingga dapat dianalisa. Metode destruksi yang selama ini dikenal dapat dilakukan dengan dua cara, yaitu :
1. Destruksi Basah 2. Destruksi Kering
Destruksi basah memiliki prinsip yaitu penggunaan asam nitrat untuk mendestruksi zat organik pada suhu rendah dengan maksud menghindari kehilangan mineral akibat penguapan. Pada umumnya digunakan untuk menganalisa logam arsen, timah hitam, timah putih, seng, dan tembaga.
Destruksi kering merupakan penguraian (perombakan) senyawa organik dalam sampel menjadi senyawa anorganik dengan cara jalan pengabuan sampel dan memerlukan suhu pemanasan tertentu (Raimon, 1992).
2.4 Adsorpsi
Secara umum, adsorpsi merupakan suatu proses pemisahan komponen- komponen tertentu dalam fasa cair atau gas melewati suatu permukaan padat yang disebut adsorben, sedangkan komponen yang diserap disebut adsorbat.
Proses adsorpsi disebabkan oleh gaya tarik molekul permukaan adsorben.
Adsorpsi berbeda dengan absorpsi, karena pada absorpsi zat yang diserap masuk kedalam absorben. Berkat selektivitasnya yang tinggi, proses adsorpsi sangat sesuai untuk memisahkan bahan dengan konsenrasi yang kecil dan campuran yang mengandung bahan lain yang berkonsentrasi tinggi. Adsorpsi digunakan dalam pengolahan air buangan industri, terutama untuk mengurangi komponen-komponen organik misalnya warna, fenol, detergen, zat-zat toksik dan zat-zat organik yang sukar diurai (Mc. Cabe, 1999).
Proses adsorpsi meliputi tiga tahap mekanisme, yaitu : 1. Pergerakan molekul adsorbat menuju permukaan adsorben
12
2. Penyebaran molehul-molekul adsorbat ke dalam rongga-rongga adsorben 3. Penarikan molekul-molekul adsorbat oleh permukaan aktif membentuk
ikatan, yang berlangsung sangat cepat (Metcalf, 1979).
2.5 Logam Berat
Logam berat (heavy metal) atau logam (toxic metals) adalah bentuk umum yang digunakan untuk menjelaskan sekelompok elemen-elemen logam yang kebanyakan tergolong berbahaya bila masuk ke dalam tubuh makhluk hidup. Logam berat yang terdapat baik di lingkungan maupun di dalam tubuh manusia dalam konsentrasi yang sangat rendah disebut sebagai Trace Metals, seperti Cadmium (Cd), Timbal (Pb), dan Merkuri (Hg) (Nugroho, 2006).
Logam berat adalah komponen alamiah lingkungan yang mendapatkan perhatian berlebih akibat ditambahkan ke dalam tanah dalam jumlah yang semakin meningkat dan bahaya yang mungkin ditimbulkan. Logam berat merujuk pada logam yang mempunyai berat jenis lebih tinggi dari 5 atau 6 g/mL. Namun pada kenyataannya dalam pengertian logam berat ini, dimasukkan pula unsur-unsur metaloid yang mempunyai sifat berbahaya seperti logam berat sehingga jumlah seluruhnya mencapai lebih kurang 40 jenis. Beberapa logam berat yang beracun tersebut adalah As, Cd, Cr, Cu, Pb, Hg, Ni, dan Zn (Palar, 2004).
Kandungan logam berat di lingkungan dapat dikurangi dengan cara menjerapnya yaitu dengan menggunakan kitosan. Beberapa contoh logam berat adalah Hg, Zn, Cd, Cu, Co, Pb, dan Cr. Proses penjerapan logam berat pada kitosan dan modifikasinya berlangsung secara spontan (Karthikeyan et al., 2004).
2.5.1 Logam Besi (Fe)
Logam Fe ditemukan dalam inti bumi berupa hematit. Fe hampir tidak dapat ditemukan sebagai unsur bebas. Fe diperoleh dalam bentuk tidak murni sehingga harus melalui reaksi reduksi guna untuk mendapatkan Fe murni. Fe berperan penting dalam system imunitas (Widowati, 2008). Kandungan besi di dalam air dipengaruhi oleh beberapa faktor, antara lain kedalaman air didalam tanah. Semakin dalam air yang meresap, akan semakin tinggi kelarutan besi, rendahnya pH air dan suhu yang
tinggi menyebabkan kadar berkurangnya O2 dalam air menguraikan kadar besi (Atmaningsih, 2007).
Untuk mengurangi pencemaran dari limbah serta meningkatkan nilai ekonomi, limbah yang mengandung unsure Al, Fe dan Cu dapat dijadikan bahan baku yang lebih bermanfaat seperti tawas, ferosulfat, dan logam Cu. Untuk mengurangi pencemaran Fe, dapat digunakan teknologi fitoremidasi, mikroorganisme bioremoval, menaikkan pH larutan, saringan pasir aktif dan Advanced Oxidation Processes (AOPs), yaitu oksidasi menggunakan H2O2 sebagai oksidator (Widowati, 2008).
Kelebihan zat besi (Fe) menyebabkan keracunan, dimana terjadi muntah, diare dan kerusakan usus. Kelebihan zat besi juga dapat menyebabkan hemokromatis. Hemokromatis merupakan penyakit kelebihan zat besi (Fe) yang bisa berakibat fatal tetapi mudah diobati, dimana penyakit ini banyak menyerang lebih dari 1 juta orang di Amerika Serikat (Ahmad, 2004).
2.5.2 Logam Zink (Zn)
Zink (Zn) adalah logam dengan warna keabu-abuan, yang dalam kedaan murni setelah dilap tampak putih kebiru-biruan, berkilat. Logam ini cukup mudah ditempa pada suhu 100-150°C, mudah melentur, meleleh pada suhu 4200C , dan mendidih pada suhu 9070C. Selain itu seng adalah logam yang memiliki karakteristik cukup reaktif. Zn diperlukan tubuh untuk proses metabolisme, tetapi dalam kadar tinggi dapat bersifat racun.(Gabriel, 2001).
Zink (Zn) bukan merupakan senyawa toksik dan merupakan unsur essensial bagi pertumbuhan semua jenis hewan dan tumbuhan. Zn akan bersifat toksik ketika berada dalam bentuk ionnya. Meskipun logam ini merupakan logam yang essensial namun jika dikonsumsi dalam dosis yang tinggi akan berbahaya dan bersifat toksik.
Gejala defisiensi Zn antara lain pertumbuhan terhambat, rambut rontok, diare, berkurangnya fungsi indera penglihatan, dan sebagainya. (Widowati, 2008).
2.6 Kemampuan Kitosan Untuk Menyerap Logam
Dalam kondisi asam berair, gugus amino (-NH2) kitosan akan menangkap H+ dari lingkungannya, sehingga gugus aminonya terprotonasi menjadi –NH3+. Gugus
14
NH3+ inilah yang menyebabkan kitosan bertindak sebagai garam, sehingga dapat larut dalam air. Sementara adsorpsi zat warna kationik dan kation logam memanfaatkan keberadaan pasangan elektron bebas pada gugus –OH dan NH2. Oleh karena itu, sebaiknya proses penyerapan dilakukan dalam lingkungan yang tidak asam agar gugus –NH2 akan berperan sebagai ligan yang dapat berinteraksi dengan zat warna kationik atau kation logam melalui mekanisme pembentukan ikatan kovalen koordinasi (Sugita, 2009).
Kitosan bersifat polielektrolit kation yang dapat mengikat logam berat, sehingga dapat berfungsi sebagai adsorben terhadap logam berat dalam limbah.
Prinsip dasar dalam mekanisme pengikatan antara kitosan dan logam berat yang terkandung dalam limbah cair adalah prinsip pertukaran ion. Kitosan sebagai polimer kationik yang dapat mengikat logam dimana gugus amina yang terdapat pada kitosan berikatan dengan logam dapat membentuk ikatan kovalen. Gaya yang bekerja yaitu gaya Van Der Walls dan gaya elektrostatik (Widodo dkk, 2005).
2.7 FTIR (Fourier Transform Infra Red)
Pancaran infra merah pada umumnya mengacu pada bagian spektrum elektromagnetik yang terletak di antara daerah tampak dan daerah gelombang mikro.
Sebagian besar kegunaannya terbatas di daerah antara 4000 cm-1 dan 666 cm-1 (2,5- 15,0 µm). Akhir-akhir ini muncul perhatian pada daerah infra merah dekat, 14290- 4000 cm-1 (0,7-2,5 µm) dan daerah infra merah jauh, 700-200 cm-1 (14,3-50 µm) (Silverstein, 1967).
Salah satu hasil kemajuan instrumentasi IR adalah pemrosesan data seperti Fourier Transform Infra Red (FTIR). Teknik ini memberikan informasi dalam hal kimia, seperti struktur dan konformasional pada polimer dan polipaduan, perubahan induksi tekanan dan reaksi kimia. Dalam teknik ini padatan diuji dengan cara merefleksikan sinar infra merah yang melalui tempat kristal sehingga terjadi kontak dengan permukaan cuplikan. Degradasi atau induksi oleh oksidasi, panas, maupun cahaya, dapat diikuti dengan cepat melalui infra merah. Sensitivitas FTIR adalah 80- 200 kali lebih tinggi dari instrumentasi dispersi standar karena resolusinya lebih tinggi (Kroschwitz, 1990).
Spektrofotometer FTIR digunakan untuk : 1. Mendeteksi sinyal lemah.
2. Menganalisis sampel dengan konsentrasi rendah.
3. Analisis getaran (Silverstein, 1967).
2.8 Spektrofotometri Serapan Atom (SSA)
Spektrofotometri serapan atom adalah metoda pengukuran kuantitatif suatu unsur yang terdapat dalam suatu cuplikan berdasarkan penyerapan cahaya pada panjang gelombang tertentu oleh atom – atom bentuk gas dalam keadaan dasar.
Telah lama ahli kimia menggunakan pancaran radiasi oleh atom yang dieksitasikan dalam suatu nyala sebagai alat analisis. Fraksi atom – atom yang tereksitasi berubah secara eksponensial dengan temperatur. Teknik ini digunakan untuk penetapan sejumlah unsur, kebanyakan logam dalam sampel yang sangat beraneka ragam (Walsh, 2005).
2.8.1 Prinsip dan Teori
Spektrofotometri serapan atom mengikuti Hukum Beer. Dimana absorbansi secara langsung sebanding pada panjang jalur dalam nyala dan konsentrasi pada uap atom dalam nyala. Kedua variabel tersebut sulit untuk diukur, tetapi panjang jalur dapat ditahan hingga konstan dan konsentrasi pada uap atom secara langsung sebanding dengan konsentrasi pada analit dalam larutan yang diaspirasikan. Prosedur yang digunakan adalah untuk preparasi sebuah kurva kalibrasi pada konsentrasi melawan absorbansi (Christian, 2004).
Spektrofotometri serapan atom didasarkan pada bahwa atom – atom pada suatu unsur dapat mengabsropsi energi sinar pada panjang gelombang tertentu.
Banyak energi sinar yang di absropsi berbanding lurus dengan jumlah atom – atom unsur yang mengabsropsi. Atom terdiri atas inti atom yang mengandung proton bermuatan positif dan neutron berupa pertikel netral, dimana inti atom dikelilingi oleh elektron –elektron bermuatan negatif pada tingkat energi yang berbeda – beda.
Jika energi diabsropsi oleh atom, maka elektron yang berada di kulit terluar (elektron valensi) akan tereksitasi dan bergerak dari keadaan dasar atau tingkat energi yang
16
terendah ke keadaan tereksitasi dengan tingkat energi yang terendah. Jumlah energi yang dibutuhkan untuk memindahkan elektron ke tingkat energi tertentu dikenal sebagai potensial eksitasi untuk tingkat energi tersebut (Clark, 1979).
2.8.2 Instrumentasi
Untuk keperluan analisis kuantitatif dengan spektrofotometer serapan atom, maka sampel harus dalam bentuk larutan. Untuk menyiapkan larutan, sampel harus diperlukan sedemikian rupa yang pelaksanaannya tergantung dari macam dan jenis sampel. Yang penting untuk diingat adalah bahwa larutan yang akan dianalisis haruslah sangat encer.
Ada beberapa cara untuk melarutkan sampel, yaitu:
Langsung dilarutkan dengan pelarut yang sesuai
Sampel dilarutkan dalam suatu asam
Sampel dilarutkan dalam suatu basa atau dilebur dahulu dengan basa kemudian hasil leburan dilarutkan dengan pelarut yang sesuai
Metode pelarutan apapun yang akan dipilih untuk dilakukan analisis dengan spektrofotometer serapan atom, yang terpenting adalah bahwa larutan yang dihasilkan harus jernih, stabil dan tidak mengganggu zat-zat yang akan dianalisis.
Pelarutan juga dimaksudkan untuk destruksi sampel dimana biasanya digunakan asam-asam seperti asam nitrat pekat (Rohman, 2007)
Komponen penting yang membentuk spektrofotomter serapan atom diperlihatkan pada gambar 2.2 dibawah ini.
2.8.3 Rangkaian Spektrofotometer Serapan Atom
A B C D E F Gambar 2.2. Rangkaian Ringkas Spektrofotometer Serapan Atom
Keterangan Gambar :
A = Lampu Katoda Berongga B = Nyala
C = Monokromator D = Detektor E = Amplifier
F = Recorder (Khopkar, 2007) a. Sumber sinar
Sumber sinar yang lazim dipakai adalah lampu katoda berongga. Lampu ini terdiri atas tabung kaca tertutup yang mengandung suatu katoda dan anoda (Mulja, 1995)
b. Tempat sampel
Dalam analisis dengan spektofotometri serapan atom, sampel yang akan dianalisis harus diuraikan menjadi atom-atom netral yang masih dalam keadaan asas. Ada berbagai macam yang dapat digunakan untuk mengubah suatu sampel menjadi uap atom-atom yaitu dengan nyala dan tanpa nyala.
1. Nyala (flameless)
Nyala digunakan untuk mengubah sampel yang berupa padatan atau cairan menjadi bentuk uap atomnya, dan juga berfungsi untuk atomisasi.
2. Tanpa nyala (flameless)
Pengatoman dapat dilakukan dalam tungku dari grafit. Sampel diletakkan dalam tabung grafit, kemudian tabung tersebut dipanaskan dengan sistem elektris dengan cara melewatkan arus listrik grafit.
Akibat pemanasan ini, maka gas yang akan dianalisis berubah menjadi atom-atom netral (Rohman, 2007).
c. Monokromator
Monokromator memisahkan, mengisolasi dan mengontrol intensitas dari radiasi energi yang mencapai detektor (Haswell, 1991).
18
d. Detektor
Detektor dapat diatur sedemikian rupa pada nilai frekuensi tertentu, sehingga tidak memberikan respon terhadap nilai emisi yang berasal dari eksitasi termal (Khopkar, 2007).
e. Read Out
Merupakan suatu alat petunjuk atau dapat juga diartikan sebagai sistem beberapa pencatat hasil (Khopkar, 2007).
2.8.4 Gangguan Pada SSA dan Cara Mengatasinya
Gangguan nyata pada SSA adalah seringkali didapatkan suatu harga yang tidak sesuai dengan konsentrasi sampel yang ditentukan. Penyebab dari gangguan ini adalah faktor matriks sampel dan faktor kimia karena adanya gangguan molekuler yang bersifat radiasi.
Sampel dalam bentuk molekul karena disosiasi yang tidak sempurna akan cenderung mengabsorpsi radiasi dari sumber radiasi. Demikian juga terjadinya ionisasi atom akan menjadi kesalahan pada SSA oleh karena spektrum radiasi oleh ion jauh berbeda dengan spektrum absorpsi atom netral yang memang akan ditentukan. Ada beberapa usaha untuk mengurangi gangguan kimia pada SSA yaitu dengan cara:
1. Menaikkan temperatur nyala agar mempermudah penguraian untuk itu dipakai gas pembakar campuran C2H2 + N2O yang memberikan nyala dengan temperatur yang tinggi.
2. Menambahkan elemen pengikat gugus atom penyangga, sehingga terikat kuat akan tetapi atom yang ditentukan bebas sebagai atom netral. Misalnya penentuan logam yang terikat sebagai garam, dengan penambahan logam yang lainnya akan terjadi ikatan lebih kuat dengan anion pengganggu.
3. Pengeluaran unsur pengganggu dari matriks sampel dengan cara eksitasi (Mulja,1995).
BAB 3
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian dilakukan pada November 2017 sampai Mei 2018 di Laboratorium Ilmu Dasar dan Umum, FMIPA Universitas Sumatera Utara. Analisis gugus fungsi menggunakan Spektrofotometer Fourier Transform Infra Red (FTIR) dilakukan di Laboratorium Kimia Organik, FMIPA Universitas Gadjah Mada. Analisis logam Besi (Fe) dan Zink (Zn) menggunakan Spektrofotometri Serapan Atom (SSA) dilakukan di Badan Riset dan Standardisasi Industri ( BARISTAND ) Medan.
3.2 Alat dan Bahan 3.2.1 Alat
Adapun alat-alat yang digunakan dalam penelitian ini adalah:
Nama Alat Merek
Spektrofotometer Serapan Atom (SSA) Shimadzu AA-7000
Spektrofotometer FTIR Shimadzu
Batang Pengaduk
Beaker Glass Pyrex
Corong Kaca Pyrex
Gelas Ukur Pyrex
Spatula
Neraca Analitik (presisi ± 0,0001 g) Mettler Cawan Petri
Hot plate Fisher
Pipet Volume Pyrex
Labu Takar Pyrex
Pipet Tetes
Bola Karet DnG
Kertas Saring Whatmann No. 42
Botol Aquadest Magnetic bar
20
Indikator pH Universal
Pompa Injeksi One Med
Alat Kolom Botol Vial
3.2.2 Bahan
Adapun bahan-bahan yang digunakan dalam penelitian ini adalah:
Bahan Merek
Kitosan
NaOH pellet p.a (E.Merck)
AgNO3 (s) p.a (E.Merck)
CH3COOH glacial p.a (E.Merck)
Akuades
Larutan Standar Fe
Larutan Standar Zn
HNO3(p) p.a (E.Merck)
Air Sungai Desa Torong
3.3. Pembuatan Larutan Pereaksi 3.3.1 Larutan Asam Asetat 1% (v/v)
Sebanyak 10 mL asam asetat glacial dimasukkan ke dalam labu takar 1000 mL. Kemudian diencerkan dengan akuades sampai garis tanda, lalu dihomogenkan.
3.3.2 Larutan NaOH 2 M (b/v)
Sebanyak 40 g NaOH pellet dimasukkan ke dalam Beaker glass.
Ditambahkan 500 mL akuades. Lalu diaduk sampai homogen sehingga diperoleh larutan NaOH 2 M.
3.3.3 Larutan AgNO3 0,5 M (b/v)
Sebanyak 21,22 g Kristal AgNO3 dimasukkan ke dalam Beaker glass.
Dilarutkan dengan akuades, dimasukkan kedalam labu takar 250 mL kemudian ditambahkan akuades sampai garis tanda sehingga diperoleh larutan AgNO3 0,5 M.
3.4 Pembuatan Larutan Kitosan
Sebanyak 1 g kitosan dilarutkan ke dalam larutan asetat 1 % (b/v) sebanyak 100 mL. Lalu diaduk sampai homogen sehingga diperoleh larutan kitosan yang kental.
3.5 Pembuatan Kitosan Perak
Larutan kitosan dimasukkan kedalam Beaker glass. Kemudian ditambahkan dengan larutan AgNO3 0,5 M dengan rasio 2:1 hingga diperoleh larutan kental.
Larutan kental kemudian dimasukkan ke dalam pompa injeksi dan diteteskan kedalam larutan NaOH 2 M sebanyak 1L hingga terbentuk butiran hitam.
Selanjutnya didiamkan selama 1 malam. Lalu disaring dan dicuci dengan akuades dan dipanaskan sampai kering hingga temperatur 80oC. Disimpan pada suhu ruang.
3.6 Preparasi Larutan Sampel
Diukur sebanyak 250 mL sampel Air Sungai Desa Torong kemudian dimasukkan ke dalam Beaker glass 500 mL, ditambahkan HNO3(p) hingga pH=3.
Diambil sebanyak 100 mL kemudian dimasukkan kedalam Beaker glass dan ditambahkan 5 mL HNO3(p). Dipanaskan perlahan diatas hotplate hingga volume 15- 20 mL, kemudian ditambahkan 50 mL akuades dan dimasukkan kedalam labu takar 100 mL melalui kertas saring. Diencerkan dengan akuades hingga garis tanda dan diaduk hingga homogen.
3.7 Penentuan Kandungan Besi (Fe) Secara Spektrofotometri Serapan Atom (SSA)
Larutan sampel yang telah didestruksi, dianalisa secara kuantitatif dengan mengukur absorbansinya pada λspesifik = 248,3 nm dengan menggunakan alat Spektrofotometer Serapan Atom (SSA).
3.8 Pembuatan Larutan Standar Fe
3.8.1 Pembuatan Larutan Standar Fe 100 mg/L
Sebanyak 10 mL larutan induk Fe 1000 mg/L dimasukkan kedalam labu ukur 100 mL, ditambahkan akuades hingga garis tanda dan dihomogenkan.
22
3.8.2 Pembuatan Larutan Standar Fe10 mg/L
Sebanyak 10 mL larutan standar Fe 100 mg/L dimasukkan kedalam labu ukur 100 mL, ditambahkan akuades hingga garis tanda dan dihomogenkan.
3.8.3 Pembuatan Larutan Seri Standar Fe0,2 ; 0,4 ; 0,6 ; 0,8 ; dan 1,0 mg/L Dipipet masing-masing sebanyak 1,0 ; 2,0 ; 3,0 ; 4,0 dan 5,0 mL larutan standar Fe 10 mg/L masing-masing dimasukkan kedalam labu ukur 50 mL, ditambahkan akuades hingga garis tanda dan dihomogenkan.
3.8.4 Pembuatan Kurva Kalibrasi Larutan Standar Fe
Larutan seri standar 0,2 mg/L dibuat dengan pH tidak lebih dari 3 kemudian diukur absorbansinya dengan menggunakan Spektrofotometer Serapan Atom (SSA) pada λspesifik = 248,3 nm. Perlakuan dilakukan sebanyak 3 kali dan dilakukan hal yang sama dengan larutan seri standar yang lain (0,4 ; 0,6 ; 0,8 ; dan 1,0 mg/L).
3.9 Penentuan Kandungan Zink (Zn) Secara Spektrofotometri Serapan Atom (SSA)
Larutan sampel yang telah didestruksi, dianalisa secara kuantitatif dengan mengukur absorbansinya pada λspesifik = 213,9 nm dengan menggunakan alat Spektrofotometer Serapan Atom (SSA).
3.10 Pembuatan Larutan Standar Zn
3.10.1 Pembuatan Larutan Standar Zn 100 mg/L
Sebanyak 10 mL larutan induk Zn 1000 mg/L dimasukkan kedalam labu ukur 100 mL, ditambahkan akuades hingga garis tanda dan dihomogenkan.
3.10.2 Pembuatan Larutan Standar Zn 10 mg/L
Sebanyak 10 mL larutan standar Zn100 mg/L dimasukkan kedalam labu ukur 100 mL, ditambahkan akuades hingga garis tanda dan dihomogenkan.
3.10.3 Pembuatan Larutan Seri Standar Zn0,2 ; 0,4 ; 0,6 ; 0,8 ; dan 1,0 mg/L Dipipet masing-masing sebanyak 1,0 ; 2,0 ; 3,0 ; 4,0 dan 5,0 mL larutan standar Zn 10 mg/L masing-masing dimasukkan kedalam labu ukur 50 mL, ditambahkan akuades hingga garis tanda dan dihomogenkan.
3.10.4 Pembuatan Kurva Kalibrasi Larutan Standar Zn
Larutan seri standar 0,2 mg/L dibuat dengan pH tidak lebih dari 3 kemudian diukur absorbansinya dengan menggunakan Spektrofotometer Serapan Atom (SSA) pada λspesifik = 213,9 nm. Perlakuan dilakukan sebanyak 3 kali dan dilakukan hal yang sama dengan larutan seri standar yang lain (0,4 ; 0,6 ; 0,8 ; dan 1,0 mg/L).
3.11 Penentuan Waktu Kontak Optimum pada Kitosan Perak
Larutan sampel Air Sungai Desa Torong yang telah didestruksi dimasukkan ke dalam kolom yang telah berisi 10 g kitosan perak, didiamkan berdasarkan variasi waktu yaitu 30, 45, dan 60 menit. Kemudian dibuka tutup kolom dan ditampung dengan botol vial. Selanjutnya diuji absorbansinya dengan menggunakan Spektrofotometri Serapan Atom.
24
3.12 Bagan Penelitian
3.12.1 Pembuatan Larutan Pereaksi 3.12.1.1. Larutan Asam Asetat 1%
10 mL Asam Asetat Glasial
dimasukkan ke dalam labu takar 1000 mL diencerkan dengan akuades sampai garis tanda dihomogenkan
Hasil
3.12.1.2. Larutan NaOH 2 M
40 g NaOH pellet
dimasukkan ke dalam beaker glass dilarutkan dengan 400 mL akuades
dihomogenkan
Hasil
dimasukkan ke dalam labu ukur 500 mL ditambahkan akuades hingga garis tanda
3.12.1.3. Larutan AgNO3 0,5 M
21,22 g AgNO3
dimasukkan ke dalam beaker glass dilarutkan dengan akuades
Hasil
dimasukkan ke dalam labu ukur 250 mL diencerkan dengan akuades hingga garis tanda dihomogenkan
3.12.2 Pembuatan Larutan Kitosan
100 mL Larutan Asam Asetat 1 %
ditambahkan 1 g kitosan diaduk hingga homogen
Hasil
26
3.12.3 Pembuatan Kitosan Perak
1 g Kitosan
dimasukkan ke dalam beaker glass ditambahkan 100 mL Asam Asetat 1 %
Hasil
Larutan Kitosan
dimasukkan larutan kitosan dan larutan AgNO3 secara bersamaan kedalam beaker glass dengan rasio 2:1
Gel
dimasukkan ke dalam pompa injeksi
diteteskan ke dalam larutan NaOH 2 M hingga terbentuk butiran hitam didiamkan selama 1 malam
dicuci dengan akuades hingga netral disaring
dipanaskan sampai kering pada temperatur 80oC
3.12.4 Penentuan Kurva Kalibrasi Besi (Fe)
Larutan Blanko Besi (Fe) 0,00 mg/L
Diatur pH ±3
Ditentukan absorbansinya pada panjang gelombang 248,3 nm dengan menggunakan Spektrofotometer Serapan Atom
Hasil
Catatan : Dilakukan perlakuan yang sama untuk larutan seri standar besi (Fe) 0,2;
0,4; 0,6; 0,8; dan 1,0 mg/L
3.12.5 Preparasi dan Penentuan Kadar Logam Besi (Fe) pada Sampel
250 mL Sampel Air Sungai Torong
dimasukkan ke dalam beaker glass 500 mL ditambahkan HNO3 (p) hingga pH = 3
Hasil
100 mL Sampel Air Sungai Torong
dimasukkan kedalam beaker glass 250 mL ditambahkan 5 mL HNO3 (p)
dipanaskan perlahan diatas hotplate hingga sisa volume 15 mL
ditambahkan 50 mL akuades
dimasukkan ke dalam labu takar 100 mL melalui kertas saring
diencerkan dengan akuades sampai garis tanda diaduk sampai homogen
diukur absorbansinya dengan SSA pada panjang gelombang 248,3 nm
28
3.12.6 Penentuan Kurva Kalibrasi Zink (Zn)
Larutan Blanko Zink (Zn) 0,00 mg/L
Diatur pH ±3
Ditentukan absorbansinya pada panjang gelombang 213,9 nm dengan menggunakan Spektrofotometer Serapan Atom
Hasil
Catatan : Dilakukan perlakuan yang sama untuk larutan seri standar zink (Zn) 0,2;
0,4; 0,6; 0,8; dan 1,0 mg/L
3.12.7 Preparasi dan Penentuan Kadar Logam Zink (Zn) pada Sampel
250 mL Sampel Air Sungai Torong
dimasukkan ke dalam beaker glass 500 mL ditambahkan HNO3 (p) hingga pH = 3
Hasil
100 mL Sampel Air Sungai Torong
dimasukkan kedalam beaker glass 250 mL ditambahkan 5 mL HNO3 (p)
dipanaskan perlahan diatas hotplate hingga sisa volume 15 mL
ditambahkan 50 mL akuades
dimasukkan ke dalam labu takar 100 mL melalui kertas saring
diencerkan dengan akuades sampai garis tanda diaduk sampai homogen
diukur absorbansinya dengan SSA pada panjang gelombang 213,9 nm
3.12.8 Penentuan Waktu Kontak Optimum Pada Kitosan Perak
Sampel Air Sungai Torong
dirangkai alat kolom dengan statif dan klem dimasukkan 10 g kitosan perak ke dalam kolom
Hasil
Hasil Rendaman Kitosan
dibuka bagian tutup bawah kolom
dimasukkan 50 mL larutan sampel air Sungai Torong didiamkan selama variasi waktu 30, 45 dan 60 menit
ditampung berdasarkan variasi waktu 30, 45, dan 60 menit dengan menggunakan botol vial
diukur absorbansinya pada panjang gelombang 248,3 nm dengan menggunakan SSA
Catatan : Dilakukan perlakuan yang sama untuk logam zink (Zn) pada panjang gelombang 213,9 nm
BAB 4
HASIL DAN PEMBAHASAN
4.1. Data Absorbansi Larutan Standar Besi (Fe)
Data absorbansi untuk larutan standar Besi (Fe) dapat dilihat pada tabel 4.1 dibawah ini :
Tabel 4.1. Data Absorbansi Larutan Standar Besi (Fe)
No Konsentrasi (mg/L) Absorbansi Rata-rata
1 0,0 0,0000
2 0,2 0,0264
3 0,4 0,0438
4 0,6 0,0620
5 0,8 0,0874
6 1,0 0,1092
Kondisi alat spektrofotometer AA-7000 untuk absorbansi ion logam Fe dapat dilihat pada tabel 4.2 dibawah ini:
Tabel 4.2. Kondisi Alat Spektrofotometer AA-7000 pada Absorbansi Fe
No Parameter Logam Fe
1 2 3 4 5 6 7
Comment
Panjang Gelombang (nm) Lebar Celah (nm) Ketinggian Burner (mm)
Tipe nyala
Kecepatan Aliran Gas Pembakar (L/min) Kecepatan Aliran Udara (L/min)
Flame 248,30 0,7 7,0 Udara-C2H2
1,8 15,0
4.1.1. Penurunan Persamaan Garis Regresi dengan Metode Kurva Kalibrasi untuk Larutan Standar Fe
Data absorbansi yang diperoleh untuk suatu seri larutan standar Fe diplotkan terhadap konsenterasi larutan standar sehingga diperoleh kurva kalibrasi berupa garis linear seperti pada gambar 4.1 berikut ini:
Gambar 4.1. Kurva Kalibrasi Larutan Seri Standar Fe
Persamaan garis regresi ini diturunkan dengan metode Least Square, dimana konsenterasi dari larutan standar dinyatakan sebagai Xi dan absorbansi dinyatakan sebagai Yi seperti pada tabel 4.3 berikut:
Tabel 4.3. Penurunan Persamaan Garis Regresi Untuk Penentuan Konsentrasi Logam Fe Berdasarkan Pengukuran Absorbansi Larutan Standar Fe
No Xi Yi
1 0,0 0,0000 -0,5 -0,0548 0,25 0,003003 0,027400 2 0,2 0,0264 -0,3 -0,0284 0,09 0,000806 0,008520 3 0,4 0,0438 -0,1 -0,0110 0,01 0,000121 0,001100 4 0,6 0,0620 0,1 0,0072 0,01 0,000051 0,000720 5 0,8 0,0874 0,3 0,0326 0,09 0,001062 0,009780 6 1,0 0,1092 0,5 0,0544 0,25 0,002959 0,027200 Ʃ 3,0 0,3288 0,0 0,0000 0,70 0,008002 0,074720
32
Dari persamaan garis regresi dengan metode Least Square tersebut dapat diperoleh nilai konsentrasi rata-rata ( dan nilai absorbansi rata-rata ( dengan persamaan berikut :
Penurunan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis :
Dimana a = slope b = intercept
Harga Slope dan intercept dapat ditentukan dengan menggunakan metode least square sebagai berikut :
Maka Persamaan Garis Regresi adalah :
4.1.2. Penentuan Koefisien Korelasi
Koefisien korelasi dapat ditentukan dengan menggunakan persamaan sebagai berikut:
4.2. Data Absorbansi Larutan Standar Zink (Zn)
Data absorbansi untuk larutan standar Zink (Zn) dapat dilihat pada tabel 4.4 dibawah ini :
Tabel 4.4 Data Absorbansi Larutan Standar Zink (Zn)
No Konsentrasi (mg/L) Absorbansi Rata-rata
1 0,0 0,0000
2 0,2 0,1508
3 0,4 0,2779
4 0,6 0,4109
5 0,8 0,5118
6 1,0 0,5932
Kondisi alat spektrofotometer AA-7000 untuk absorbansi logam Zn dapat dilihat pada tabel 4.5 dibawah ini:
Tabel 4.5 Kondisi Alat Spektrofotometer AA-7000 pada Absorbansi Zn
No Parameter Logam Zn
1 2 3 4 5 6 7
Comment
Panjang Gelombang (nm) Lebar Celah (nm) Ketinggian Burner (mm)
Tipe nyala
Kecepatan Aliran Gas Pembakar (L/min) Kecepatan Aliran Udara (L/min)
Flame 213,9
0,7 7,0 Udara-C2H2
1,8 15,0
34
4.2.1. Penurunan Persamaan Garis Regresi dengan Metode Kurva Kalibrasi untuk Larutan Standar Zn
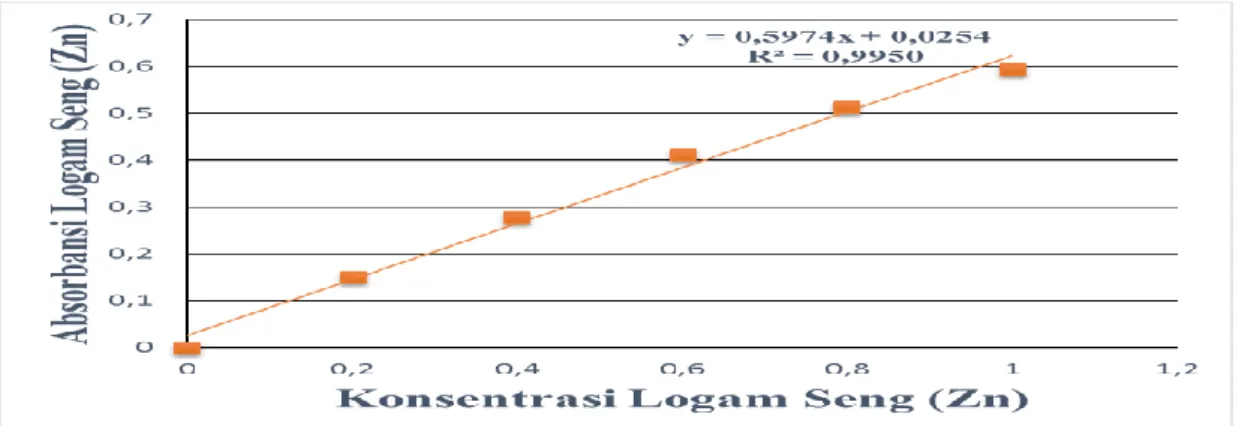
Data absorbansi yang diperoleh untuk suatu seri larutan standar Zndiplotkan terhadap konsenterasi larutan standar sehingga diperoleh kurva kalibrasi berupa garis linear seperti pada gambar 4.2. berikut ini:
Gambar 4.2. Kurva Kalibrasi Larutan Seri Standar Zn
Persamaan garis regresi ini diturunkan dengan metode Least Square, dimana konsenterasi dari larutan standar dinyatakan sebagai Xi dan absorbansi dinyatakan sebagai Yi seperti pada tabel 4.6 berikut :
Tabel 4.6 Penurunan Persamaan Garis Regresi Untuk Penentuan Konsentrasi Logam Zn Berdasarkan Pengukuran Absorbansi Larutan Standar Zn
No Xi Yi
1 0,0 0,0000 -0,5 -0,3241 0,25 0,105040 0,162050 2 0,2 0,1508 -0,3 -0,1733 0,09 0,030032 0,051990 3 0,4 0,2779 -0,1 -0,0462 0,01 0,002134 0,004620 4 0,6 0,4109 0,1 0,0868 0,01 0,007534 0,008680 5 0,8 0,5118 0,3 0,1877 0,09 0,035231 0,056310 6 1,0 0,5932 0,5 0,2691 0,25 0,072414 0,134550 Ʃ 3,0 1,9446 0,0 0,0000 0,70 0,252385 0,418200
Dari persamaan garis regresi dengan metode Least Square tersebut dapat diperoleh nilai konsentrasi rata-rata ( dan nilai absorbansi rata-rata ( dengan persamaan berikut :
Penurunan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis :
Dimana a = slope b = intercept
Harga Slope dan intercept dapat ditentukan dengan menggunakan metode least square sebagai berikut :
Maka Persamaan Garis Regresi adalah :
4.2.2. Penentuan Koefisien Korelasi
Koefisien korelasi dapat ditentukan dengan menggunakan persamaan sebagai berikut:
36
4.3. Data Persentase Penurunan Kadar Logam dalam larutan (Penentuan Persen (%) Adsorpsi)
Persentase penurunan kadar logam dalam larutan sebelum dan setelah di adsorpsi dapat ditentukan dengan menggunakan persamaan berikut:
% Adsorpsi = x 100%
4.3.1. Penentuan Persen Adsorpsi Logam Fe
Dari data hasil pengukuran yang terdapat pada tabel 4.7 maka penentuan % adsorpsi untuk waktu kontak optimum dengan kitosan perak adalah:
% Adsorpsi = x 100%= 82,154 %
Tabel 4.7. Data Penurunan Kadar Logam Fe dan Persentase Adsorpsi Berdasarkan Variasi Waktu
Waktu Kontak (Menit)
Konsentrasi (mg/L)
Konsentrasi yang terserap
(mg/L)
Persentase (%) Penurunan Konsentrasi Sebelum
Penambahan
Setelah Penambahan
30 1,5175 0,5212 0,9963 65,654
45 1,5175 0,2708 1,2467 82,154
60 1,5175 0,4436 1,0739 70,767
4.3.2. Penentuan Persen Adsorpsi Logam Zn
Dari data hasil pengukuran yang terdapat pada tabel 4.8 maka penentuan % adsorpsi untuk waktu kontak optimum dengan kitosan perak adalah:
% Adsorpsi = x 100%= 84,871 %