PENGGUNAAN KITOSAN NANOPARTIKEL SEBAGAI
ADSORBEN PADA LIMBAH CAIR INDUSTRI BENANG KARET
UNTUK MENURUNKAN KADAR ION LOGAM Zn DAN Na,
NILAI COD, BOD5, TSS, DAN TDS
TESIS
Oleh
CUT WIRA EMILIA 097006004/KIM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PENGGUNAAN KITOSAN NANOPARTIKEL SEBAGAI
ADSORBEN PADA LIMBAH CAIR INDUSTRI BENANG KARET
UNTUK MENURUNKAN KADAR ION LOGAM Zn DAN Na,
NILAI COD, BOD5, TSS, DAN TDS
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh gelar Magister Sains dalam Program Studi Ilmu Kimia pada Fakultas Matematika dan
Ilmu Pengetahuan Alam Universitas Sumatera Utara
Oleh
CUT WIRA EMILIA 097006004/KIM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
Judul : PENGGUNAAN KITOSAN NANOPARTIKEL
SEBAGAI ADSORBEN PADA LIMBAH CAIR
INDUSTRI BENANG KARET UNTUK MENURUNKAN KADAR ION LOGAM Zn DAN Na, NILAI COD, BOD5,
TSS, DAN TDS
Nama Mahasiswa : CUT WIRA EMILIA Nomor Pokok : 097006004
Program Studi : Magister Ilmu Kimia
Menyetujui Komisi Pembimbing
Prof. Dr. Harry Agusnar, M.Sc, M.Phil Prof. Dr, Zul Alfian, M.Sc
Ketua Anggota
Ketua Program Studi, Dekan,
Telah diuji pada Tanggal : 29 Juli 2011
PANITIA PENGUJI TESIS
Ketua : Prof. Dr. Harry Agusnar, M.Sc, M.Phil Anggota : 1. Prof. Dr, Zul Alfian, M.Sc
2. Prof. Basuki Wirjosentono, MS, Ph.D 3. Prof. Dr, Harlem Marpaung
PERNYATAAN
PENGGUNAAN KITOSAN NANOPARTIKEL SEBAGAI ADSORBEN PADA LIMBAH CAIR INDUSTRI BENANG KARET UNTUK MENURUNKAN
KADAR ION LOGAM Zn DAN Na, NILAI COD, BOD5, TSS, DAN TDS
TESIS
Dengan ini saya menyatakan bahwa saya mengakui semua karya tesis ini adalah hasil karya saya sendiri kecuali kutipan dan ringkasan yang tiap satunya telah dijelaskan sumbernya dengan benar
Medan, 29 Juli 2011
PENGGUNAAN KITOSAN NANOPARTIKEL SEBAGAI ADSORBEN PADA LIMBAH CAIR INDUSTRI BENANG KARET UNTUK MENURUNKAN
KADAR ION LOGAM Zn DAN Na, NILAI COD, BOD5, TSS, DAN TDS
ABSTRAK
Penelitian ini adalah tentang penggunaan kitosan nanopartikel sebagai adsorben pada limbah cair industri benang karet untuk menurunkan kadar ion logam Zn dan Na, nilai COD, BOD5, TSS, dan TDS dengan variasi berat kitosan nanopartikel. Kitosan nanopartikel dibuat dengan dilarutkan dalam 100 ml asam asetat 1% dengan menggunakan pengaduk jartes yang dilakukan selama 30 menit, yang kemudian dicampurkan dengan 200 ml sampel limbah cair industri benang karet. Sampel hasil preparasi dianalisis dengan SAA untuk ion Zn2+ dan Na+, juga dianalisis kadar COD, BOD5, TSS, dan TDS. Hasil penelitian menunjukkan bahwa komposisi paling optimum dihasilkan pada berat kitosan nanopartikel 0,8 g dengan persentase penyerapan ion Zn2+ sebesar 95,37%, ion Na+ 95,27%, dan persentase penurunan kadar COD sebesar 43,68%; BOD5 73,77%; TSS 78,98%; dan TDS 81,82%.
THE USE OF CHITOSAN NANOPARTICLES AS ADSORBEN IN LIQUID WASTE OF INDUSTRIAL RUBBER THREAD TO REDUCE CONTENT ION
Zn AND Na, VALUE OF COD, BOD5, TSS, AND TDS
ABSTRACT
This study is about the use of chitosan nanoparticles as adsorben in liquid waste of industrial rubber thread to reduce content ion Zn and Na, value of COD, BOD5, TSS, and TDS, with the variation of weight chitosan nanopartikel. Chitosan nanoparticles were prepared by dissolved in 100 ml of 1% acetic acid by using a jartes stirrer for 30 minutes, which is then mixed with 200 ml samples in liquid waste of industrial rubber thread. Sample resulted in preparation were analyzed AAS for Zn2+ and Na+ ions, were also analyzed contents of COD, BOD5, TSS, and TDS. The results showed that the optimum composition of weight chitosan nanoparticles produced at 0.8 g with adsorption percentage of 95,37% Zn2+ ions, 95.27% Na+ ions, and the percentage reduction in 43,68% COD; 73,77% BOD5; 78,98% TSS; and 81,82% TDS.
KATA PENGANTAR
Pertama-tama penulis panjatkan puji dan syukur kehadirat Allah SWT atas
segala limpahan rahmad dan karunia-Nya sehingga tesis yang berjudul “ Penggunaan
Kitosan Nanopartikel Sebagai Adsorben Pada Limbah Cair Industri Benang Karet
Untuk Menurunkan Kadar Logam Zn dan Na, Nilai COD, BOD5, TSS, dan TDS” ini
dapat diselesaikan.
Dengan diselesaikannya tesis ini, penulis mengucapkan terima kasih yang
sebesar-besarnya kepada Rektor Universitas Sumatera Utara Prof. Dr. dr. Syahril
Pasaribu, DTM&H, M.Sc (CTM), Sp. A(K) atas kesempatan yang diberikan kepada
penulis untuk mengikuti dan menyelesaikan pendidikan Program Magister. Dekan
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara Dr.
Sutarman, M.Sc, Ketua Program Studi Magister Ilmu Kimia Prof. Basuki
Wirjosentono, MS, Ph.D, dan Sekretaris Program Studi Magister Ilmu Kimia Dr.
Hamonangan, M.Sc atas kesempatan menjadi mahasiswa Program Magister pada
Program Pascasarjana Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas
Sumatera Utara.
Terima kasih yang tak terhingga dan penghargaan setinggi-tingginya
ditujukan kepada :
1. Bapak Prof. Dr. Harry Agusnar, M.Sc, M.Phil selaku Pembimbing Utama dan
Bapak Prof. Dr. Zul Alfian, M.Sc selaku Anggota Komisi Pembimbing yang
telah memberikan perhatian, dorongan, bimbingan dan arahan dengan penuh
kesabaran menuntun dan membimbing penulis hingga selesainya penelitian ini.
2. Bapak Prof. Basuki Wirjosentono, MS, Ph.D, Prof. Dr. Harlem Marpaung, Dr.
Hamongan, M.Sc selaku penguji yang telah banyak memberikan masukan dan
saran untuk menyelesaikan tesis ini.
3. Kepala Laboratoium Analitik FMIPA USU dan Kepala Laboratorium Penelitian
FMIPA USU beserta staf atas fasilitas dan sarana yang diberikan selama
4. Ayahanda Drs. Abdurrahman Yusuf dan Ibunda Dra. Dewi Farida Hanum yang telah memberikan do’a restu serta dorongan moril maupun materil sehingga penulis dapat menyelesaikan pendidikan.
5. Suami Ir. Darmansyah Kayana dan anak-anak Abdurrahman Arfansya, Farah
Fatimah Wirda, Tari Uswatun Nisa, Rahmat Irfansyah yang tercinta yang telah
memberikan dorongan moril kepada penulis untuk menyelesaikan tesis ini.
6. Rekan-rekan seangkatan 2009 atas kekompakan dan kerjasamanya yang baik
selama perkuliahan maupun selama penelitian.
Penulis menyadari bahwa tesis ini masih kurang sempurna, oleh karena itu
penulis mengharapkan kritik dan saran dari pihak pembaca demi kesempurnaan tesis
ini. Akhirnya semoga tesis ini bermanfaat bagi penelitian dan kemajuan ilmu
pengetahuan untuk masa yang akan datang.
Hormat Penulis,
RIWAYAT HIDUP DATA PRIBADI
Nama Lengkap berikut gelar : Cut Wira Emilia, S.Si
Tempat dan Tanggal Lahir : Langsa, 31 Maret 1971
Alamat Rumah : Jl. Villa 5C Tanjung Permai
Telepon/HP : 081271792614
Email : cut_wira@yahoo.com
DATA PENDIDIKAN
SD : SD Negeri 11 Langsa Tamat : 1983
SMP : SMP Negeri 1 Langsa Tamat : 1986
SMU : SMA Negeri 1 Langsa Tamat : 1989
Strata-1 : Universitas Syah Kuala Tamat : 1995
DAFTAR ISI
ABSTRAK i
ABSTRACT ii
KATA PENGANTAR iii
RIWAYAT HIDUP v
DAFTAR ISI vi
DAFTAR TABEL x
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xii
BAB 1 PENDAHULUAN 1
1.1 Latar Belakang 1
1.2 Perumusan Masalah 2
1.3 Pembatasan Masalah 3
1.4 Tujuan Penelitian 3
1.5 Manfaat Penelitian 3
1.6 Metodologi Penelitian 4
1.7 Lokasi Penelitian 4
BAB 2 TINJAUAN PUSTAKA 5
2.1 Kitosan 5
2.1.1 Sifat - Sifat Kitosan 5
2.1.2 Penggunaan Kitosan 6
2.1.3 Interaksi Kitosan Dengan Ion Logam 7
2.1.4 Proses Pengikatan Ion Logam Oleh Kitosan 8
2.2 Nanopartikel 10
2.2.1 Kitosan Nanopartikel 11
2.4 Limbah Industri 12
2.4.1 Limbah Cair Industri 13
2.4.2 Kandungan Logam Berat (Zinkum dan Natrium)
Dalam Limbah Cair Industri 14
2.5 Parameter Untuk Menentukan Kualitas Air 16
2.5.1 Paramater Fisika 16
2.5.2 Parameter Kimia 19
2.6 Spektrofotometri Serapan Atom 21
BAB 3 METODE PENELITIAN 23
3.1 Bahan-Bahan 23
3.2 Alat-Alat 23
3.3 Prosedur Penelitian 24
3.3.1 Pembuatan Pereaksi 24
3.3.1.1 Pembuatan Larutan CH3COOH 1% 24
3.3.1.2 Pembuatan Larutan Baku K2Cr2O7 0,025 N 24
3.3.1.3 Pembuatan Larutan Baku Na2S2O3 0,025 N 24
3.3.1.4 Pembuatan Larutan Baku MnSO4 24
3.3.1.5 Pembuatan Larutan Amilum 25
3.3.1.6 Pembuatan Larutan KOH-KI 25
3.3.1.7 Pembuatan Larutan Baku Zn 10 ppm 25
3.3.1.8 Pembuatan Larutan Standar Na 10 ppm 25
3.3.2 Penentuan Kurva Kalibrasi 26
3.3.2.1 Penentuan Kurva Kalibrasi Larutan Seri
Standar Zn 26
3.3.2.2 Penentuan Kurva Kalibrasi Larutan Seri
Standar Na 26
3.3.3 Pembuatan Kitosan Nanopartikel 26
3.3.4 Preparasi Sampel Limbah Cair Industri Benang
3.3.5 Penyerapan Ion Zn2+ dan Na+ Dalam Limbah Cair Industri Benang Karet Dengan Adanya Penambahan
Larutan Kitosan Nanopartikel 27
3.3.6 Penentuan Nilai COD Dalam Sampel Hasil Preparasi 28
3.3.7 Penentuan Nilai BOD5 Dalam Sampel Hasil Preparasi 28
3.3.8 Penentuan Nilai TSS Dalam Sampel Hasil Preparasi 29
3.3.9 Penentuan Nilai TDS Dalam Sampel Hasil Preparasi 29
3.4. Bagan Penelitian 30
3.4.1 Pembuatan Kitosan Nanopartikel 30
3.4.2 Preparasi Sampel Limbah Cair Industri Benang
Karet Dengan Kitosan Nanopartikel 30
3.4.3 Penyerapan Ion Zn2+ dan Na+ Dalam Limbah Cair Industri Karet Dengan Adanya Penambahan Larutan
Kitosan Nanopartikel 31
3.4.4 Penentuan Nilai COD Dalam Sampel Hasil Preparasi 31
3.4.5 Penentuan Nilai BOD5 Dalam Sampel Hasil Preparasi 32
3.4.6 Penentuan Nilai TSS Dalam Sampel Hasil Preparasi 32
3.4.7 Penentuan Nilai TDS Dalam Sampel Hasil Preparasi 33
BAB 4 HASIL DAN PEMBAHASAN 34
4.1 Hasil 34
4.1.1 Perhitungan Persamaan Garis Regresi Dengan
Metode Kurva Kalibrasi Untuk Standar Zn 34
4.1.2 Perhitungan Persamaan Garis Regresi Dengan
Metode Kurva Kalibrasi Untuk Standar Na 35
4.1.3 Perhitungan Penyerapan Ion Zn2+ Dalam Limbah Cair Industri Benang Karet Dengan Adanya
Penambahan Larutan Kitosan Nanopartikel 36
4.1.4 Perhitungan Penyerapan Ion Na+ Dalam Limbah Cair Industri Benang Karet Dengan Adanya
Penambahan Larutan Kitosan Nanopartikel 37
4.1.5 Perhitungan Penurunan Nilai COD dan BOD5 Dalam Limbah Cair Industri Benang Karet Dengan
4.1.6 Perhitungan Penurunan Nilai TSS dan TDS Dalam Limbah Cair Industri Benang Karet Dengan Adanya
Penambahan Larutan Kitosan Nanopartikel 40
4.2 Pembahasan 41
4.2.1 Penyerapan Ion Zn2+ dan Na+ Dalam Limbah Cair Industri Benang Karet Dengan Adanya Penambahan
Larutan Kitosan Nanopartikel 41
4.2.2 Penurunan Nilai COD, BOD5, Dalam Limbah Cair Industri Benang Karet Dengan Adanya Penambahan
Larutan Kitosan Nanopartikel 43
4.2.3 Penurunan Nilai TSS dan TDS Dalam Limbah Cair Industri Benang Karet Dengan Adanya Penambahan
Larutan Kitosan Nanopartikel 44
BAB 5 KESIMPULAN DAN SARAN 46
5.1. Kesimpulan 46
5.2. Saran 46
DAFTAR PUSTAKA 47
DAFTAR TABEL
Nomor Judul Halaman
2.1 Pemanfaatan Kitosan Pada Beberapa Industri 7
4.1 Perhitungan Persamaan Garis Regresi Dengan Metode Kurva
Kalibrasi Untuk Standar Zn 34
4.2 Perhitungan Persamaan Garis Regresi Dengan Metode Kurva
Kalibrasi Untuk Standar Na 35
4.3 Data Perhitungan Daya Serap Ion Zn2+ Dengan Kitosan
Nanopartikel 37
4.4 Data Perhitungan Daya Serap Ion Na2+ Dengan Kitosan
Nanopartikel 38
4.5 Data Perhitungan Penurunan Nilai COD Dan BOD5 Dengan
Kitosan Nanopartikel 39
4.6 Data Perhitungan Penurunan Nilai TSS dan TDS Dengan
DAFTAR GAMBAR
Nomor Judul Halaman
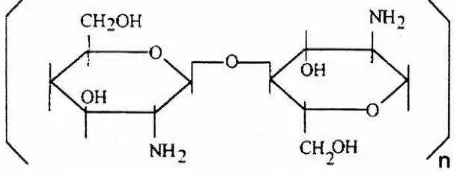
2.1 Struktur Kitosan 5
2.2 Mekanisme pengikatan Logam Berat Oleh Kitosan 8
2.3 Tahap-Tahap Koagulasi Polielektrolit Kitosan 9
2.4 Mekanisme Koagulasi Perbedaan Muatan 9
2.5 Skematis Instrumentasi SSA 21
3.1 Bagan Penelitian Pembuatan Kitosan Nanopartikel 30
3.2 Bagan Penelitian Preparasi Sampel Limbah Cair Industri
Benang Karet dengan Kitosan Nanopartikel 30
3.3 Bagan Penelitian Penyerapan Ion Zn2+ dan Na+ Dalam Limbah Cair Industri Karet Dengan Adanya Penambahan Larutan
Kitosan Nanopartikel 31
3.4 Bagan Penelitian Penentuan Nilai COD Dalam Sampel Hasil
Preparasi 31
3.5 Bagan Penelitian Penentuan Nilai BOD5 Dalam Sampel Hasil
Preparasi 32
3.6 Penentuan Nilai TSS Dalam Sampel Hasil Preparasi 32
DAFTAR LAMPIRAN
Nomor Halaman
1 Gambar 1. Kurva Kalibrasi Larutan Standar Zn 50 Tabel 1. Hasil Pengukuran Konsentrasi dan Absorbansi Dari
Larutan Standar Zn Dengan Menggunakan
Spektrofotometer Serapan Atom 50
2 Gambar 2. Kurva Kalibrasi Larutan Standar Na 51 Tabel 2. Hasil Pengukuran Konsentrasi dan Absorbansi Dari
Larutan Standar Na Dengan Menggunakan
Spektrofotometer Serapan Atom 51
3 Gambar 3. Grafik Hubungan Persentase Penyerapan Ion Zn2+
Dengan Berat Kitosan Nanopartikel 52
4 Gambar 4. Grafik Hubungan Persentase Penyerapan Ion Na+
Dengan Berat Kitosan Nanopartikel 53
5 Gambar 5. Grafik Hubungan Persentase Penurunan Nilai COD dan BOD5Dengan Berat Kitosan Nanopartikel 54
6 Gambar 6. Grafik Hubungan Persentase Penurunan Nilai TSS dan TDSDengan Berat Kitosan Nanopartikel 55
PENGGUNAAN KITOSAN NANOPARTIKEL SEBAGAI ADSORBEN PADA LIMBAH CAIR INDUSTRI BENANG KARET UNTUK MENURUNKAN
KADAR ION LOGAM Zn DAN Na, NILAI COD, BOD5, TSS, DAN TDS
ABSTRAK
Penelitian ini adalah tentang penggunaan kitosan nanopartikel sebagai adsorben pada limbah cair industri benang karet untuk menurunkan kadar ion logam Zn dan Na, nilai COD, BOD5, TSS, dan TDS dengan variasi berat kitosan nanopartikel. Kitosan nanopartikel dibuat dengan dilarutkan dalam 100 ml asam asetat 1% dengan menggunakan pengaduk jartes yang dilakukan selama 30 menit, yang kemudian dicampurkan dengan 200 ml sampel limbah cair industri benang karet. Sampel hasil preparasi dianalisis dengan SAA untuk ion Zn2+ dan Na+, juga dianalisis kadar COD, BOD5, TSS, dan TDS. Hasil penelitian menunjukkan bahwa komposisi paling optimum dihasilkan pada berat kitosan nanopartikel 0,8 g dengan persentase penyerapan ion Zn2+ sebesar 95,37%, ion Na+ 95,27%, dan persentase penurunan kadar COD sebesar 43,68%; BOD5 73,77%; TSS 78,98%; dan TDS 81,82%.
THE USE OF CHITOSAN NANOPARTICLES AS ADSORBEN IN LIQUID WASTE OF INDUSTRIAL RUBBER THREAD TO REDUCE CONTENT ION
Zn AND Na, VALUE OF COD, BOD5, TSS, AND TDS
ABSTRACT
This study is about the use of chitosan nanoparticles as adsorben in liquid waste of industrial rubber thread to reduce content ion Zn and Na, value of COD, BOD5, TSS, and TDS, with the variation of weight chitosan nanopartikel. Chitosan nanoparticles were prepared by dissolved in 100 ml of 1% acetic acid by using a jartes stirrer for 30 minutes, which is then mixed with 200 ml samples in liquid waste of industrial rubber thread. Sample resulted in preparation were analyzed AAS for Zn2+ and Na+ ions, were also analyzed contents of COD, BOD5, TSS, and TDS. The results showed that the optimum composition of weight chitosan nanoparticles produced at 0.8 g with adsorption percentage of 95,37% Zn2+ ions, 95.27% Na+ ions, and the percentage reduction in 43,68% COD; 73,77% BOD5; 78,98% TSS; and 81,82% TDS.
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Meningkatnya sektor industri merupakan sarana untuk memperbaiki taraf
hidup masyarakat namun di pihak lain muncul masalah yang diakibatkan dari limbah
cair industri yang dibuang kesaluran air yang dapat merusak kelestarian lingkungan,
keseimbangan sumber alam dan berkembangbiaknya bibit penyakit sehingga air
tersebut tidak dapat dikonsumsi.
Pencemaran yang diakibatkan oleh limbah cair yang mengandung logam
terhadap lingkungan merupakan suatu proses yang erat hubungannya dengan
penggunaan logam tersebut oleh manusia. Pada awalnya logam digunakan sebagai
alat namun belum diketahui pengaruh pencemarannya pada lingkungan. Tetapi
ternyata limbah cair yang mengandung logam dapat menyebabkan timbulnya bahaya
pada makhluk hidup, dimana logam tersebut memiliki sifat yang merusak jarigan
tubuh makhluk hidup. Pencemaran dapat terjadi jika manusia atau pabrik yang
menggunakan logam tersebut untuk proses produksi tidak memperhatikan
keselamatan lingkungan. Limbah cair dari pengolahan karet memiliki logam berat
yang cukup tinggi, antara lain seperti Zn, TiO2, Na dan lain-lain yang menimbulkan
pencemaran lingkungan (Juli, 2003).
Beberapa metode dalam mengolah limbah cair yang mengandung cemaran
logam adalah perlakuan dengan pengendapan, adsorpsi, koagulasi atau flokulasi,
filtrasi, proses membrane, pertukaran ion, proses biologi dan reaksi-reaksi kimia.
Dalam penerapannya setiap metode memiliki keunggulan dan keterbatasan
masing-masing dari aspek teknis, ekonomis dan dampak ikutannya.
Metoda adsorpsi logam berat dilingkungan telah banyak dilakukan oleh para
ahli karena cukup aman, ekonomis, dan mudah diilakukan dengan menggunakan
adsorben organik yang mempunyai gugus spesifik seperti asam humat yang sedang
banyak dikembangkan, alga, kitin serta kitosan. (Muzzarelli, 1985)
Kitosan merupakan biopolimer alam bersifat polielektrolit kationik, ramah
lingkungan, mudah terbiodegradasi serta tidak beracun yang berpotensi tinggi sebagai
bahan pengikat logam berat. Hal ini dibuktikan dari penelitian yang telah dilakukan
sebelumnya oleh Muzzarelli (1985) membuktikan serbuk atau larutan kitosan dapat
menghilangkan atau mengurangi logam atau ion logam yang terdapat dalam air
sungai, air laut, dan air limbah.
Seiring dengan perkembangan nano teknologi para ahli mengubah partikel
kitosan dengan ukuran nano. Dimana ukuran partikel nya semakin kecil (nano) berarti
akan memperluas permukaan kitosan sehingga daya serap terhadap logam tinggi.
Penelitian di cina yang dilakukan oleh Szeto Yau-shan, (2007) menggunakan kitosan
nanopartikel dalam pengolahan industri tekstil. Mengatasi polusi pada ekosistem
sungai dan laut solusinya dengan adsorpsi kitosan nanopartikel yang diyakini dapat
mengurangi terkontaminasinya biota sungai dan laut. Kitosan nanopartikel diyakini
mempunyai daya absoprsi yang lebih besar dibandingkan dengan kitosan dalam
ukuran biasa yang sering dipakai untuk mengadsorpsi, hal ini logis jika dikaji
faktor-faktor yang mempengaruhi kinetika reaksi yaitu semakin luas permukaan maka akan
semakin cepat reaksi berlangsung. Dengan kata lain semakin kecil ukuran partikel
kitosannya akan semakin cepat reaksi berlangsung.
Berdasarkan uraian diatas peniliti ingin melakukan penelitian menggunakan
kitosan nanopartikel sebagai adsorben untuk menurunkan kadar logam Zn, logam Na,
COD, BOD, TSS, dan TDS pada limbah cair industri benang karet.
1.2 Perumusan Masalah
Berdasarkan uraian diatas, maka perumusan masalah sebagai berikut :
1. Bagaimana kemampuan kitosan nopartikel sebagai adsorben menurunkan
kadar logam Zn, logam Na, COD, BOD5, TSS, dan TDS pada limbah cair
2. Apakah variasi berat kitosan nanopartikel berpengaruh terhadap
penurunan kadar logam Zn, logam Na, COD, BOD5, TSS, dan TDS pada
limbah cair pabrik benang karet.
1.3 Pembatasan Masalah
1. Sampel yang digunakan dalam penelitian ini yaitu limbah cair dari
penampungan yang berasal dari industri “PT. Benang Karet Nusantara”.
2. Adsorben yang digunakan yaitu kitosan yang dipreparasi dalam bentuk
ukuran nanopartikel.
3. Metode analisis yang dilakukan yaitu untuk penentuan kadar logam Zn
dan Na menggunakan SSA, penentuan kadar COD dan BOD5
menggunakan metode titrimetri, dan penentuan kadar TSS dan TDS
menggunakan metode gravimetri.
1.4 Tujuan Penelitian
Berdasarkan permasalahan diatas, maka penelitian ini bertujuan untuk
mengetahui kemampuan kitosan nanopartikel sebagai adsorben menurunkan kadar
logam Zn, logam Na, COD, BOD5, TSS, dan TDS nya pada limbah industri benang
karet.
1.5 Manfaat Penelitian
Hasil yang diperoleh dari penelitian ini diharapkan dapat bermanfaat yaitu :
1. Memberi informasi tentang kemampuan kitosan nanopartikel sebagai
adsorben untuk menurunkan kadar logam Zn dan Na, serta kadar COD,
BOD5, TSS, dan TDS dalam limbah cair industri benang karet.
2. Sebagai informasi tambahan bagi pengembangan penelitian kitosan
1.6 Metodologi Penelitian
Penelitian ini eksperimen laboratorium, dengan tahapan sebagai berikut :
1. Tahapan pembuatan kitosan nanopartikel.
Kitosan dilarutkan dalam asam asetat 1% sebanyak 1 L dimasukkan ke
dalam jartest diaduk dengan kecepatan 200 rpm selama 30 menit,
ditambahkan NH3(p), dan dimasukkan ke dalam ultrabatch selama + 1 jam.
Hasilnya dikarakterisasi dengan FESEM.
2. Tahapan preparasi limbah cair dengan kitosan nanopartikel.
100 mL kitosan naopartikel yang sudah dilarutkan dengan air,
ditambahkan dengan 200 mL sampel limbah cair, diaduk, dan didiamkan
selama 30 menit, kemudian disaring.
3. Tahapan analisis sampel limbah cair dengan kitosan nanopartikel.
Sampel yang telah dipreparasi dianalisis untuk kandungan logam Zn dan
Na nya dengan menggunakan SSA, untuk kandungan COD dan BOD5
dengan titrimetri, dan untuk kandungan TSS dan TDS dengan gravimetri.
Variabel yang dilakukan dalam penelitian ini adalah :
1. Variabel Tetap : Sampel limbah cair (200 mL), Asam asetat 1% (1L).
2. Variabel Bebas : Kitosan Nanopartikel (0,2 g; 0,4 g; 0,6 g; 0,8 g; 1 g).
3. Varibel Terikat : Kadar Zn, Na, COD, BOD5, TSS dan TDS.
1.7 Lokasi Penelitian
Penelitian dilakukan di Laboratorium Kimia Analitik Fakultas Matematika
Ilmu Pengetahuan Alam Universitas Sumatera Utara dan analisis dilakukan di
Laboratorium Penelitian Fakultas Matematika Ilmu Pengetahuan Alam Universitas
BAB 2
TINJAUAN PUSTAKA
2.1 Kitosan
Kitosan adalah jenis polimer alam yang mempunyai rantai tidak linear dan mempunyai rumus umum (C6H11NO4)n atau disebut sebagai (β(1-4)-2-amino-2- Deoksi-D-glukopiranosa. Kitosan merupakan suatu turunan utama dari kitin, dimana
untuk mendapatkan kitosan yang baik tergantung dari kitin yang diperoleh dan
kekuatan suatu alkali serta waktu yang digunakan dalam reaksi deasetilasi (Zakaria,
1995).
Gambar 2.1 Struktur Kitosan
Kitosan mengandung unsur nitrogen yang tinggi (sekitar 70 %) dapat
mengambil ion logam yang tinggi. Elektron terpencil pada atom nitrogen dan oksigen
pada gugus amina dapat membentuk ikatan kovalen dengan ion logam berat dan ion
logam peralihan. Gugusan amina pada kitosan juga merupakan tempat pengkhelat ion
logam perlaihan dan gugus ini bersifat stabil dalam NaOH 50 % walaupun mencapai
temperatur 160oC (Muzzarelli, 1977).
2.1.1 Sifat - Sifat Kitosan
Kitosan mudah mengalami degrdasai secara biologis dan tidak beracun,
kationik kuat, flokulan dan koagulan yang baik, mudah membentuk membran atau
film serta membentuk gel dengan anion bervalensi ganda. Kitosan tidak larut dalam
Kitosan larut dengan cepat dalam asam organik seperti asam formiat, asam sitrat dan
asam asetat (Zakaria, 1995).
Kitosan adalah biopolimer dengan berat molekul yang tinggi. Ini dipengaruhi
oleh sumber polisakarida dan metode pembuatannya. Viskometri adalah cara yang
paling sederhana dan cepat untuk menentukan berat molekul kitosan. Yang umum
digunakan untuk melarutkan kitosan adalah asam asetat 1 % dengan pH sekitar 4,0.
Pada pH diatas 7,0 stabilitas kelarutan kitosan sangat terbatas. Pada pH tinggi,
cendrung terjadi pengendapan dan larutan kitosan membentuk kompleks polielektrolit
dengan hidrokoloid anionik menghasilkan gel (Asteria, 2003).
Kitosan bersifat polielektrolit kation yang dapat mengikat logam berat,
sehingga dapat berfungsi sebagai adsorben terhadap logam berat dalam air limbah.
Prinsip dasar dalam mekanisme pengikatan antara kitosan dan logam berat yang
terkandung dalam limbah cair adalah prinsip penukar ion. Gugus amina khususnya N
dalam kitosan akan beraksi dan mengikat logam dari persenyawaan limbah cair.
Kitosan yang tidak dapat larut dalam air akan menggumpalkan logam menjadi
flok-flok yang akan bersatu dan dapat dipisahkan dari air limbah. Kitosan dapat bekerja
sempurna jika dilarutkan dalam larutan asam (Marganof, 2003; Widodo, 2005).
Kitosan juga bersifat hidrofilik, menahan air dalam strukturnya dan
membentuk gel secara spontan. Pembentukan gel berlangsung pada harga pH asam
dan sedikit asam, disebabkan sifat kationik kitosan. Viskositas juga meningkat dengan
meningkatnya derajat deasetilasi. Gel kitosan terdegradasi secara berangsur – angsur,
sebagaimana halnya kitosan melarut (Muzzarelli, 1985).
2.1.2 Penggunaan Kitosan
Kitosan juga telah digunakan secara luas dalam bidang pengobatan,
bioteknologi, menjadi bahan yang penting dalam aplikasi farmasi, karena mempunyai
kemampuan biodegrada si dan biocompatibility dan rendah toksisitasnya (Berger,
2004). Kitosan juga memperlihatkan aktivitas biologi seperti hypocholesterolemic,
Tabel 2.1 Pemanfaatan Kitosan Pada Beberapa Industri
Industri Manfaat
Industri pengolahan Penyerapan ion logam, koagulan, protein, asam amino, dan Limbah bahan pencelup.
Industri makanan Pengawet, penstabil makanan, penstabil warna, bahan pengental, dan lain – lain.
Industri kesehatan Penyembuh luka dan tulang, pengontrol kolesterol
darah, kontak lensa, penghambat plat gigi, dan lain – lain .
Industri pertanian Pupuk, pelindung biji dan lain – lain.
Kosmetik Pelembab ( moisturizer ), krem wajah, tangan dan badan, dan lain – lain.
Bioteknologi Dapat immobolisasi enzim, chromatography, penyembuh sel dan lain – lain.
Sumber : Fernandez-Kim, 2004
2.1.3 Interaksi Kitosan Dengan Ion Logam
Interaksi kitosan dengan ion logam terjadi karena proses pengkompleksan
dimana pertukaran ion, penyerapan, dan pengkhelatan terjadi selama proses
berlangsung. Ketiga proses tersebut tergantung dari ion logam masing-masing.
Kitosan menunjukkan afinitas yang tinggi pada logam transisi golongan 3, begitu
pula pada logam yang bukan golongan alkali dengan konsentrasi rendah (Muzzarelli,
1973,1977).
Kitosan mempunyai kemampuan untuk mengikat logam dan membentuk
kompleks logam-kitosan. Sifat penyerapan ion logam yang sangat baik oleh kitosan
dengan selektif dan kapasitas penyerapan yang tinggi yang disebabkan 3 (tiga) sifat
yaitu :
1. Sifat hidrofilik kitosan dengan jumlah yang besar pada gugusan hidroksil.
2. Gugus amina primer dengan aktivitas yang tinggi.
3. Struktur rantai polimer kitosan yang fleksibel yang dapat membentuk konfigurasi
2.1.4 Proses Pengikatan Logam Oleh Kitosan
Kitosan bersifat polielektrolit kation yang dapat mengikat logam berat,
sehingga dapat berfungsi sebagai adsorben terhadap logam dalam air limbah. Prinsip
dasar dalam mekanisme pengikatan antara kitosan dan logam berat yang terkandung
dalam limbah cair adalah prinsip penukar ion.Gugus amina khususnya nitrogen dalam
kitosan akan bereaksi dan mengikat logam dari persenyawaan limbah cair. Kitosan
yang tidak larut dalam air akan menggumpalkan logam menjadi flok – flok yang akan
bersatu dan dapat dipisahkan dari air limbah. Kitosan dapat bekerja sempurna jika
dilarutkan dalam larutan asam.(Marganof, 2003; Widodo, 2005). Proses koagulasi
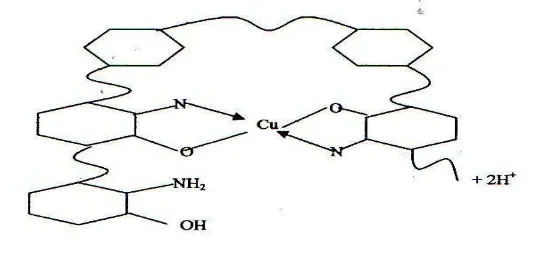
logam berat oleh kitosan seperti gambar berikut
Gambar 2.2 Mekanisme Pengikatan Logam Berat Oleh Kitosan
Contoh di atas menggunakan logam Cu atau tembaga. Terjadi pengikatan Cu
oleh gugus N (nitrogen ) dan O (oksigen). Logam Cu tersebut akan terikat atau
terserap, terkumpul dan terjadi flok – flok logam. Kitosan dengan kemampuan daya
ikat atau daya serapnya mampu menjadikannya jadi tidak berbahaya.
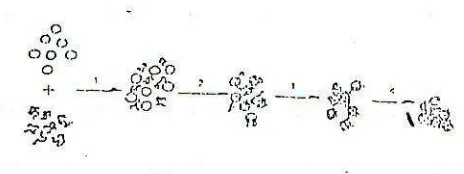
Polielektrolit merupakan bagian dari polimer khusus yang dapat terionisasi
dan mempunyai kemampuan untuk membuat terjadinya suatu flokulasi dalam
medium cair. Kitosan merupakan salah satu contoh dari polielektrolit. Koagulasi yang
disebabkan oleh polielektrolit meliputi empat tahap, yaitu:
1. Dispersi dari polielektrolit dalam suspensi.
2. Adsorpsi antara permukaan solid- liquid.
4. Penyatuan dari masing –masing polielektrik yang telah terlingkupi oleh partikel
untuk membentuk flok-flok kecil dan berkembang menjadi flok yang lebih besar.
Keempat proses tersebut digambarkan sebagai berikut :
Gambar 2.3 Tahap-Tahap Koagulasi Polielektrolit Kitosan
Logam berat dan logam lain secara keseluruhan dalam larutan elektrolit
merupakan partikel bermuatan positif, sedangkan kitosan adalah polielektrolit
bermuatan negatif, reaksi antara kedua partikel akan menuju ke arah penghilangan
gradien muatan dan terbentuk senyawa produk yang tidak bermuatan ditunjukkan
oleh Gambar 2.4 berikut.
Gambar 2.4 Mekanisme Koagulasi Perbedaan Muatan
Kitosan juga bersifat hidrofilik, menahan air dalam strukturnya dan
membentuk gel secara spontan. Pembentukan gel berlangsung pada pH asam dan
sedikit asam, disebabkan sifat kationik kitosan.viskositas gel kitosan akan meningkat
dengan meningkatnya berat molekul atau jumlah polimer. Viskositas juga meningkat
dengan meningkatnya derajat deasetilasi. Gel kitosan terdegradasi secara
2.2 Nanopartikel
Dalam nanoteknologi, suatu partikel digambarkan sebagai satu obyek kecil
yang bertindak secara unit keseluruhan dalam hal transport dan sifat-sifatnya. Dengan
nanoteknologi, material dapat didesain sedemikian rupa dalam orde nano, sehingga
dapat memperoleh sifat dan material yang kita inginkan tanpa melakukan
pemborosan atom-atom yang tidak diperlukan. Aplikasi nanoteknologi akan membuat
revolusi baru dalam dunia industri dan diyakini pemenang persaingan global di masa
yang akan datang adalah negara-negara yang dapat menguasai nanoteknologi.
Ruang lingkup nanoteknologi meliputi usaha dan konsep untuk menghasilkan
material/bahan berskala nanometer, mengeksplorasi dan merekayasa karakteristik
material/bahan tersebut, serta mendisain ulang material/bahan tersebut ke dalam
bentuk, ukuran dan fungsi yang diinginkan.
Nanopartikel sebagai partikulat material dengan paling sedikit satu dimensi
lebih kecil dari 100 nanometer. Satu nanometer adalah 10-9 m. Nanopartikel
merupakan hal ilmiah besar sebagaimana adanya secara efektif satu jembatan antara
bahan-bahan curah dan struktur-struktur molekul atau atom. Satu material curah
mempunyai sifat fisika tetap dengan mengabaikan ukuran nya, tetapi pada skala nano
bergantung ukuran sifat-sifat diamati seperti pembatasan kuantum di dalam
partikel-partikel semi penghantar, permukaan resonansi plasmon dalam beberapa partikel-partikel
logam dan superparamagnetik di dalam bahan magnet.
Nanopartikel mempunyai luas permukaan yang besar terhadap perbandingan
volume. Karakteristik nanopartikel umumnya dilakukan dengan teknik mikroskop
elektron [TEM,SEM], mikroskop atomik [AFM], penghamburan cahaya dinamik
[DLS], x-ray mikroskop fotoelektron [XPS], bubuk x-ray difraktometri [XRD], FTIR,
2.2.1 Kitosan Nanopartikel
Untuk meningkatkan daya adsorpsinya, kitosan dimodifikasi dalam bentuk
magnetik nanokitosan. Penggunaan kitosan dan magnetik nanokitosan telah
digunakan untuk mengadsorpsi ion Fe(II) dan Fe(III), Cu(II), Co(II), zat warna dan
furosemida (Wan-Ngah, 1998). Hasil penelitian mengenai adsoprsi ion Ni(II) oleh
kitosan dan magnetik nanokitosan telah membahas kondisi optimal untuk
mengadsorpsi ion Ni(II) oleh kitosan dan magnetik nanokitosan.
Kitosan nanopartikel adalah kitosan yang mana partikelnya berukuran
100-400 nm. Sekarang ini, banyak ahli-ahli menggunakan kitosan dengan nano teknologi,
Yau Shan Szeto dan Zhigang Hu untuk menyiapkan kitosan nano-partikel dimana
kitosan dilarutkan dalam larutan asam lemah kemudian ditambahkan larutan yang
bersifat basa seperti larutan amoniak, natrium hidroksida atau kalium hidroksida
distirer dengan kecepatan 300 rpm sehingga diperoleh gel kitosan putih dan dibilas
dengan aquadest sampai netral kemudian ditempatkan dalam ultrasonik bath untuk
memecah partikel-partikel gel kitosan menjadi lebih kecil (Szeto, 2007). Sebagian
ahli juga mencoba metode lain untuk menyiapkan kitosan nano menambahkan larutan
tripoliposfat kedalam larutan kitosan sehingga diperoleh emulsi kitosan sambil
distirer dengan kecepatan 1200 rpm kemudian emulsi dibuat pH 3,5 dengan
menambahkan asam asetat hasilnya akan berupa suspensi kitosan (Cheung, 2008).
2.3 Adsorpsi
Adsorpsi adalah suatu proses penyerapan komponen-komponen dalam bentuk
fasa cair atau gas (adsorbat) oleh zat padat yang disebut adsorben. Berkat
selektivitasnya yang tinggi, proses adsorpsi sangat sesuai untuk memisahkan bahan
dengan konsentrasi yang kecil dari campuran yang mengandung bahan lain yang
berkonsentrasi tinggi. Adsorpsi digunakan dalam pengolahan air buangan industri,
terutama untuk mengurangi komponen-komponen organik misalnya warna, fenol,
detergen, zat-zat toksik dan zat-zat organik yang sukar diuraikan (nonbiodegradable).
adsorbennya, maka dibedakan antara adsorpsi fisika dan adsorpsi kimia. Adsorpsi
fisika merupakan interaksi Van der Waals antara adsorben dengan adsorbat.
Sedangkan adsorpsi kimia adalah merupakan interaksi antara elektron-elektron pada
permukaan adsorben dengan molekul-molekul adsorbat membentuk ikatan yang lebih
kuat dibandingkan dengan adsorpsi fisika.
Proses adsorpsi meliputi tiga tahap mekanisme yaitu :
1. Pergerakan molekul-molekul adsorbat menuju permukaan adsorben.
2. Penyebaran molekul-molekul adsorbat kedalam rongga-rongga adsorben.
3. Penarikan molekul-molekul adsorbat oleh permukaan aktif membentuk ikatan,
yang berlangsung sangat cepat (Metcalf, 1979).
Adsorben (untuk adsorpsi fisik) adalah bahan padat dengan luas permukaan
yang besar. Permukaan yang luas ini termasuk karena banyaknya pori yang halus
pada padatan tersebut. Tergantung pada tujuan penggunaannya adsorben dapat berupa
granulat (dengan ukuran butir sebesar beberapa mm) atau serbuk (khusus untuk
adsorpsi campuran cair). Beberapa bahan yang dapat digunakan sebagai adsorben
diantaranya yaitu : karbon aktif, silika gel, tapis molekular (molekular sieves), dan
zeolit.
2.4 Limbah Industri
Pengertian limbah menurut peraturan pemerintah republik Indonesia Nomor
82 tahun 2001 adalah sisa suatu usaha atau kegiatan yang mengandung bahan
berbahaya atau beracun yang karena sifat atau konsentrasinya dan jumlahnya baik
secara langsung atau tidak langsung akan dapat membahayakan lingkungan hidup,
kesehatan, kelangsungan hidup manusia serta makhluk air.
Bila ditinjau secara kimiawi, limbah ini terdiri atas bahan kimia organik dan
anorganik. Buangan industri yang mengandung unsur atau senyawa logam berat
merupakan toksikan yang mempunyai daya racun tinggi. Buangan industri yang
mengandung persenyawaan logam berat tersebut bukan hanya bersifat racun bagi
Tingkat bahaya keracunan yang disebabkan oleh limbah tergantung pada jenis
dan karakteristik limbah, baik dalam jangka pendek maupun jangka panjang.
Mungkin dalam jangka waktu singkat tidak akan memberi pengaruh yang berarti,
namun dalam jangka panjang mungkin berakibat fatal terhadap lingkungan.
Beberapa kemungkinan yang akan terjadi akibat masuknya limbah ke dalam
lingkungan adalah:
1. Lingkungan tidak mendapat pengaruh yang berarti. Hal ini disebabkan karena
volume limbah kecil, parameter pencemar yang terdapat dalam limbah sedikit
dengan konsentrasi yang kecil.
2. Ada pengaruh perubahan, tetapi tidak mengakibatkan pencemaran.
3. Memberikan perubahan dan menimbulkan pencemaran.
Berdasarkan nilai ekonomisnya, limbah dibedakan menjadi limbah yang
mempunyai nilai ekonomis dan limbah yang tidak memiliki nilai ekonomis.
Sedangkan berdasarkan karakteristiknya, limbah industri dapat digolongkan menjadi
tiga bagian (Chandra, 2007) :
1. Limbah cair;
2. Limbah gas dan partikel;
3. Limbah padat.
2.4.1 Limbah Cair Industri
Limbah cair adalah sisa dari suatu hasil usaha dan atau kegiatan yang
berwujud cair yang dibuang ke lingkungan dan diduga dapat menurunkan kualitas
lingkungan. Limbah cair secara umum dapat dibagi menjadi human excreate (fases
dan urine), sewage (air limbah), industrial waste (bahan buangan dan sisa proses
industri).
Limbah cair industri yang bersumber dari pabrik, biasanya banyak
menggunakan air dalam proses produksinya. Di industri, fungsi dari air antaranya
1. Untuk mentransportasikan produk atau bahan baku.
2. Sebagai air pendingin. Berfungsi untuk memindahkan panas yang terjadi dari
proses produksi.
3. Sebagai air proses, misalnya sebagai umpan boiler pada pabrik minuman.
4. Untuk mencuci dan membilas produk, gedung atau instalasi.
Limbah cair industri mengandung bahan pencemar yang bersifat racun dan
berbahaya yang dikenal dengan sebutan B3 (bahan beracun dan berbahaya). Air dari
pabrik membawa sejumlah padatan dan partikel, baik yang larut maupun yang
mengendap. Bahan ini ada yang kasar dan ada yang halus. Kerapkali air buangan
pabrik berwarna keruh dan bersuhu tinggi. Berdasarkan persenyawaan yang
ditemukan dalam air buangan industri, sifat limbah cair tersebut dapat dikatagorikan
berdasarkan karakteristik fisik, kimia, dan biologi. Pengamatan mengenai
karakteristik ini penting untuk menetapkan jenis parameter pencemar yang terdapat
didalamnya. Sifat kimia dan fisika masing-masing parameter dapat menunjukkan
akibat yang ditimbulkannya terhadap lingkungan. (Chandra, 2007)
2.4.2 Kandungan Logam Berat (Zinkum dan Natrium) Dalam Limbah Cair Industri
Logam menurut pengertian awam adalah barang yang padat dan berat yang
biasanya selalu digunakan oleh orang untuk alat-alat dapur atau untuk perhiasan,
yaitu besi, baja, emas, dan perak. Padahal masih banyak logam lain yang sangat kecil
dan penting serta berperan dalam proses biologis makhluk hidup, misalnya selenium,
kobalt, mangan, dan lain-lainnya.
Menurut Soemirat (2003), definisi logam adalah elemen yang dalam larutan
air dapat melepaskan satu atau lebih elektron dan menjadi kation. Sedangkan logam
berat adalah unsur logam yang mempunyai densitas > 5 g/cm3. Logam berat masih
termasuk golongan logam dengan kriteria-kriteria yang sama dengan logam-logam
lain. Perbedaannya terletak dari pengaruh yang dihasilkan bila logam berat ini
menimbulkan efek-efek khusus pada makhluk hidup. Semua logam berat dapat
menjadi bahan racun yang akan meracuni tubuh makhluk hidup. Hal ini terjadi jika
sejumlah logam mencemari lingkungan. Namun demikian, meski semua logam berat
dapat mengakibatkan keacunan atas makhluk hidup, sebagian dari logam-logam berat
tersebut tetap dibutuhkan oleh makhluk hidup. atau beracun, di mana keberadaannya
dalam tubuh masih belum diketahui manfaatnya atau bahkan dapat bersifat racun,
seperti Hg, Cd, Pb, Cr dan lain-lain. Logam berat ini dapat menimbulkan efek
kesehatan bagi manusia tergantung pada bagian mana logam berat tersebut terikat
dalam tubuh. Daya racun yang dimiliki akan bekerja sebagai penghalang kerja enzim,
sehingga proses metabolisme tubuh terputus. Lebih jauh lagi, logam berat ini akan
bertindak sebagai penyebab alergi, mutagen, teratogen atau karsinogen bagi manusia.
Jalur masuknya adalah melalui kulit, pernapasan dan pencernaan.
Logam berat berdasarkan sifat racunnya yang berdampak terhadap kesehatan
manusia dapat dikelompokkan menjadi empat golongan, yaitu:
1. Sangat beracun, yaitu dapat mengakibatkan kematian atau gangguan kesehatan
dalam waktu singkat. Logam-logam tersebut antara lain: Pb, Hg, Cd, As, Sb, Ti,
Be, dan Cu.
2. Moderat, yaitu mengakibatkan gangguan kesehatan baik yang dapat pulih
maupun yang tidak dapat pulih dalam waktu yang relatife lama. Logam-logam
tersebut antara lain: Ba, Be, Cu, Au, Li, Mn, Se, Te, Va, Co, dan Rb.
3. Kurang beracun, dalam jumlah besar dapat menimbulkan gangguan kesehatan.
Logam-logam tersebut antara lain: Bi, Co, Fe, Ca, Mg, Ni, K, Zn (Seng), dan Ag.
4. Tidak beracun, yaitu tidak menimbulkan gangguan kesehatan seperti: Al dan Na
(Natrium).
Dalam penelitian ini yang ingin di analisis yaitu kandungan logam Zn (Seng)
dan Na (Natrium), dimana Zn merupakan logam yang tingkat toksisitasnya rendah
(kurang beracun), sedangkan logam Na merupakan logam yang tingkat toksisitasnya
sangat kecil (tidak beracun). Tetapi kelebihan logam Zn dapat mempengaruhi
timbulnya aterosklerosi, juga dapat menyebabkan muntah, diare, demam, kelelahan,
anemia dan gangguan reproduksi. Sedangkan natrium sendiri bagi tubuh tidak
merupakan benda asing, tetapi toksisitasnya tergantung pada gugus senyawanya,
karena Natrium dalam air bisa sangat reaktif (Almatsier, 1987). Tentunya kandungan
logam Zn dan Na menjadi suatu hal yang penting dan perlu dilakukan proses
pemisahannya dalam limbah cair menggunakan adsorben seperti kitosan.
2.5 Parameter Untuk Menentukan Kualitas Air 2.5.1 Parameter Fisika
Ada beberapa parameter fisik yang menentukan kualitas air, antara lain:
1. Warna
Untuk air alami yang sama sekali belum mengalami pencemaran, berwarna
bening, atau sering dikatakan tak berwarna. Timbulnya warna disebabkan oleh
kehadiran bahan-bahan tersuspensi yang berwarna, ekstrak senyawa-senyawa organik
ataupun tumbuh-tumbuhan dan karena terdapatnya mikro organisme seperti plankton,
disamping itu juga akibat adanya ion-ion metal alami seperti besi dan mangan.
Komponen penyebab warna, khususnya yang berasal dari limbah industri
kemungkinan dapat membahayakan bagi manusia mau bagi biota air. Disamping itu
warna air juga memberi indikasi terdapatnya senyawa-senyawa organik, yang melalui
proses klorinasi dapat meningkatkan pertumbuhan mikro organisme air.
2. Bau dan Rasa
Air alami yang sama sekali belum tercemar dikatakan tidak berbau dan tidak
berasa. Air yang berbau sudah pasti menimbulkan rasa yang tidak menyenangkan.
Adanya bau dan rasa pada air, menunjukkan terdapatnya organisme penghasil bau
dan juga adanya bahan-bahan pencemar yang dapat mengganggu kesehatan.
3. Suhu
Dalam setiap penentuan kualitas air, pengukuran suhu merupakan hal yang
Suhu air yang normal berkisar ± 30 oC dari suhu udara. Peningkatan suhu air bisa
disebabkan oleh berbagai hal, antara lain, air (sungai) yang dekat dengan gunung
berapi, ataupun akibat adanya pembuangan limbah cair yang panas ke badan air.
Disamping itu adanya limbah bahan organik, yang lebih lanjut mengalami proses
degradasi baik secara biologis maupun kima, seringkali meningkatkan suhu air.
Kenaikan suhu air dapat mengakibatkan kelarutan oksigen dalam air menjadi
berkurang, sehingga konsumsi oksigen oleh biota air juga menjadi terganggu.
4. Total Padatan Tersuspensi (Total Suspended Solid,TSS)
Total padatan tersuspensi adalah total bahan-bahan yang tersuspensi (diameter >1μm) yang tertahan pada saringan millipore dengan diameter pori 0,45 μm. TSS terdiri atas lumpur dan pasir halus serta jasad-jasad renik terutama yang disebabkan
oleh kikisan tanah atau erosi yang terbawa ke dalam badan air. Materi yang
tersuspensi mempunyai dampak buruk terhadap kualitas air karena mengurangi
penetrasi matahari ke dalam badan air, kekeruhan air meningkat yang menyebabkan
gangguan pertumbuhan bagi organisme produser.
Total padatan tersuspensi merupakan padatan yang menyebabkan kekeruhan
air, tidak terlarut dan tidak dapat mengendap langsung. Padatan tersuspensi terdiri
dari partikel-partikel yang ukuran maupun beratnya lebih kecil dari sedimen seperti
bahan-bahan organik tertentu, tanah liat dan lainlain. Misalnya air permukaan
mengandung tanah liat dalam bentuk tersuspensi.
Air buangan selain mengandung padatan tersuspensi dalam jumlah yang
bervariasi, juga sering mengandung bahan-bahan yang bersifat koloid, seperti protein.
Air buangan industri makanan mengandung padatan tarsuspensi yang relatif tinggi.
Padatan terendap dan padatan tersuspensi akan mengurangi penetrasi sinar matahari
ke dalam air, sehingga dapat mempengaruhi regenerasi oksigen secara fotosintesa.
Pengukuran langsung padatan tersuspensi (TSS) sering memakan waktu cukup lama.
TSS adalah jumlah bobot bahan yang tersuspensi dalam volume air tertentu, yang
cahaya yang datang, sehingga menurunkan intensitas cahaya yang disebarkan.
Padatan tersuspensi dalam air umumnya terdiri dari fitoplankton, zooplankton, sisa
tanaman dan limbah industri (Sunu, 2001).
5. Total Padatan Terlarut (Total Dissolved Solid,TDS)
Total padatan terlarut (sering disingkat TDS) adalah ukuran dari isi gabungan
semua bahan anorganik dan organik yang terkandung dalam cairan di molekul,
terionisasi atau mikro-butiran (sol koloid) bentuk tersuspensi. Total padatan terlarut
biasanya dibahas hanya untuk sistem air tawar, seperti salinitas terdiri beberapa ion
merupakan definisi TDS.
Aplikasi utama dari TDS adalah dalam studi kualitas air untuk sungai, sungai
dan danau, meskipun TDS umumnya tidak dianggap sebagai polutan primer
(misalnya tidak dianggap terkait dengan efek kesehatan) digunakan sebagai indikasi
karakteristik estetika air minum dan sebagai indikator agregat kehadiran array yang
luas dari kontaminan kimia.
Sumber utama untuk TDS dalam menerima perairan limpasan pertanian dan
perumahan, pencucian kontaminasi tanah dan titik sumber air pembuangan polusi dari
industri atau limbah tanaman pengobatan. Konstituen kimia yang paling umum
adalah kalsium, fosfat, nitrat, natrium, kalium dan klorida, yang ditemukan di
limpasan gizi, limpasan stormwater umum dan limpasan dari iklim bersalju di mana
jalan de-icing garam diterapkan. Bahan kimia dapat kation, anion, molekul, atau
aglomerasi pada urutan seribu atau lebih sedikit molekul, asalkan granula mikro-larut
terbentuk. Elemen lebih eksotik dan berbahaya dari TDS adalah pestisida yang timbul
dari limpasan permukaan. Tertentu yang terjadi secara alami total padatan terlarut
timbul dari pelapukan dan pembubaran batu dan tanah. Amerika Serikat telah
menetapkan standar kualitas air sekunder dari 500 mg/l untuk menyediakan
2.5.2 Parameter Kimia
Ada banyak parameter kimia yang menentukan kualitas air, namun yang
umum ada beberapa parameter, diantaranya:
1. BOD
Biological oxygen demand atau kebutuhan oksigen biologis adalah jumlah
oksigen yang dibutuhkan oleh mikroorganisme di dalam air untuk memecah atau
mendegradasi atau mengoksidasi limbah organik yang terdapat didalam air. Jika
konsumsi oksigen tinggi yang ditunjukkan dengan semakin kecilnya sisa oksigen
terlarut, maka berarti kandungan bahan-bahan buangan yang membutuhkan oksigen
tinggi. Organisme hidup yang bersifat aerob membutuhkan oksigen untuk bereaksi
secara biokimia, yaitu untuk mengoksidasi bahan organik, sintesis sel, dan oksidasi
sel. Komponen organik yang mengandung senyawa nitrogen dapat pula dioksidasi
menjadi nitrat, sedangkan komponen organik yang mengandung komponen sulfur
dapat dioksidasi menjadi sulfat (Sunu, 2001).
Pengukuran BOD diperlukan untuk menentukan beban pencemaran akibat air
buangan penduduk ataupun industri dan untuk mendesain sistim pengolahan biologis
bagi air yang tercemar tersebut. Penguraian zat organik adalah proses alamiah, yang
kalau suatu badan air dicemari oleh zat organik maka selama proses penguraiannya
mikroorganisme dapat menghabiskan oksigen terlarut dalam air tersebut. Hal ini
dapat mengakibatkan kematian ikan-ikan dalam air. Disamping itu kehabisan oksigen
dapat mengubah keadaan menjadi anaerobik sehingga dapat menimbulkan bau busuk.
Pengukuran BOD didasarkan atas reaksi oksidasi zat organik oleh oksigen
dalam air, dan proses tersebut berlangsung disebabkan adanya bakter aerobik.
Menurut penelitian, untuk supaya 100% bahan organik terurai, diperlukan waktu
kira-kira 20 hari. Namun dalam waktu 5 hari, pada temperatur inkubasi 20 0C, bahan
organik yang dapat diuraikan mencapai 75%, sehingga waktu ini sudah dianggap
cukup. Maka timbullah istilah BOD520 dapat ditentukan dengan mencari selisih
Pemeriksaan BOD diperlukan untuk menentukan beban pencemaran akibat air
buangan penduduk atau industri, dan untuk mendesain sistem-sistem pengolahan
biologis bagi air yang tercemar tersebut. Pemeriksaan BOD didasarkan atas reaksi zat
organik dengan oksigen di dalam air dan proses tersebut berlangsung karena adanya
bakteri aerobik, sebagai hasil oksidasi akan terbentuk karbon dioksida, amoniak dan
air. Reaksi biologis pada uji BOD dilakukan pada temperatur inkubasi 20oC dan
dilakukan selama 5 hari (Alaerts, 1987).
Prinsip analisa BOD yaitu oksigen dalam sampel akan menoksidasi MnSO4
yang ditambahkan kedalam larutan pada keadaan alkalis, sehingga terjadi endapan
MnO2 . dengan penambahan asam sulfat dan kalium iodida maka akan dibebaskan
iodin yang ekuivalen dengan oksigen terlarut. Iodin yang dibebaskan tersebut
kemudian dianalisa dengan metode titrasi iodometris yaitu dengan larutan standar
tiosulfat dengan indikator kanji (Alaerts, 1987) :
2. COD
COD (Chemical Oxygen Demand) atau Kebutuhan Oksigen Kimiawi adalah
jumlah O2 (mg) yang dibutuhkan untuk mengoksidasi total zat-zat organik yang
terdapat dalam 1 liter sampel air. Angka COD merupakan ukuran bagi pencemaran
air oleh total zat-zat organik baik yang dapat diuraikan secara biologis, maupun yang
hanya dapat diuraikan dengan proses kimia. Analisa COD berbeda dengan analisa
BOD, namun perbandingan antara angka COD dengan angka BOD dapat ditetapkan.
Secara umum perbandingan BOD5/COD = 0,40 – 0,60. Pengukuran COD dilakukan
2.6 Spektrofotometri Serapan Atom
Spektrofotometri Serapan Atom didasarkan adanya adsorbsi gelombang
elektromagnetik oleh atom-atom. Atom mempunyai dua keadaaan tingkat energi,
yaitu energi keadaaan dasar (ground state) dan energi keadaan tereksitasi (excited
state). Atom-atom menyerap cahaya tersebut pada panjang gelombang tertentu,
tergantung pada sifat unsurnya. Cahaya dengan panjang gelombang ini mempunyai
cukup energi untuk mengubah tingkat elektronik suatu atom. Transisi elektronik suatu
unsur bersifat spesifik. Dengan adsorpsi energi berarti memperoleh lebih banyak
energi, suatu atom pada keadaan dasar dinaikkan tingkat energinya ke tingkat
eksitasi. Tingkat eksitasinya pun bermacam-macam (Khopkhar, 2001).
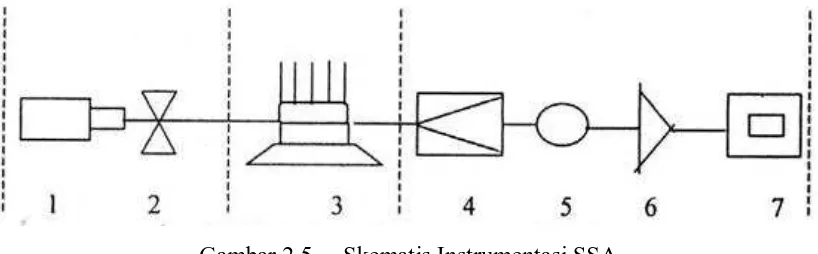
Ada dua tipe instrument SSA, yaitu nyala berkas tunggal (singel beam) dan
nyala berkas ganda (double beam). Umumnya instrumen SSA terdiri dari :
Gambar 2.5 Skematis Instrumentasi SSA
Keterangan :
1. Lampu katoda berongga, dimana lampu katoda ini berfungsi sebagai sumber
radiasi yang memancarkan spektrum atom dari unsur yang ditentukan. Lampu
katoda berongga terdiri dari dua elektroda dalam sebuah tabung silinder gelas
yang mempunyai jendela yang transparan pada letak yang berlawanan dengan
katoda.
2. Chopper (pembagi cahaya), dimana cahaya dari lampu katoda dibagi oleh alat
pembagi untuk diteruskan ke ruangan contoh disebut sinar contoh dan bagian lain
3. Unit Pengatoman Analit (atomizer) berfungsi untuk mengubah larutan yang akan
diuji menjadi atom-atom dalam bentuk gas. Oleh karena itu sistem ini sering
disebut sebagai atomizer. Berdasarkan kerjanya atomizer mempunyai dua
komponen utama : pengembun (nebulizer) dan pembakar (burner).
4. Monokromator berfungsi untuk mengontrol pancaran cahaya yang datang dari
lampu katoda berongga dan memisahkan garis spektrum yang lain yang
menganggu pengamatan. Kemampuan untuk menyeleksi suatu panjang
gelombang yang berbeda merupakan suatu karakteristik monokromator yang
sangat penting.
5. Detektor berfungsi untuk menangkap dan mengatur sinar yang ditransmisikan
serta memberikan sinyal sebagai respon terhadap sinar diterima.
6. Rekorder berfungsi untuk menerima dan merekam sinyal yang disampaikan oleh
detektor dan menyampaikannya ke sistem read-out.
7. Sistem read-out berfungsi untuk mengubah sinyal yang diterima menjadi bentuk
digital yaitu dalam satuan absorbansi. Ini berarti mencegah dan mengurangi
kesalahan pembacaan skala secara paralaks, kesalahan interpolasi di antara
pembagian skala dan sebagainya serta menyeragamkan tampilan data. (Novianty,
BAB 3
METODE PENELITIAN
3.1 Bahan – Bahan
Bahan – bahan yang digunakan dalam penelitian ini yaitu :
1. Kitosan fluka
2. Limbah cair industri benang karet
3. CH3COOH glasial p.a. E.Merck
4. NH3(p) p.a. E.Merck
5. H2SO4(p) p.a. E.Merck
6. K2Cr2O7 p.a. E.Merck
7. MnSO4.4H2O p.a. E.Merck
8. Na2S2O3.5H2O p.a. E.Merck
9. KOH p.a. E.Merck
10. KI p.a. E.Merck
11. Amilum p.a. E.Merck
12. Aquadest
3.2 Alat-Alat
Alat – alat yang digunakan dalam penelitian ini yaitu :
1. Labu takar 5 mL; 10m L; 100 mL; 1L pyrex
2. Gelas Ukur 10 mL; 100 mL pyrex
3. Pipet volumetri 10 mL pyrex
4. Gelas Erlenmeyer pyrex
5. Gelas Beaker pyrex
6. Corong pisah pyrex
7. Tabung Reaksi pyrex
8. Jartest fisher
10. Botol Sampel
11. Ultrasonic Batch
12. Stop watch
13. Neraca Analitis Mettler A.E 200
14. SSA Shimadzu
3.3 Prosedur Penelitian 3.3.1 Pembuatan Pereaksi
3.3.1.1 Pembuatan Larutan CH3COOH 1%
Dipipet sebanyak 10 mL larutan CH3COOH glasial 99%, dimasukkan ke
dalam labu takar 1 L, ditambahkan dengan aquadest sampai garis batas dan
dihomogenkan.
3.3.1.2 Pembuatan Larutan Baku K2Cr2O7 0,025 N
Ditimbang 1,205 g K2Cr207 (yang telah dikeringkan pada suhu 150°C selama
2 jam) dengan air suling, dan dimasukkan ke dalam labu takar 1 L, kemudian
ditambahkan aquadest sampai garis batas, dan dihomogenkan.
3.3.1.3 Pembuatan Larutan Baku Na2S2O3 0,025 N
Ditimbang 6,205 g Na2S2O3.5H2O dan dilarutkan dengan aquadest yang telah
dididihkan (bebas oksigen), ditambahkan dengan 1,5 mL NaOH 6 N dan
diencerkan hingga 1000 mL.
3.3.1.4 Pembuatan Larutan Baku MnSO4
Ditimbang 480g MnSO4.4H2O, kemudian dimasukkan ke dalam labu takar 1
3.3.1.5 Pembuatan Larutan Amilum
Dilarutkan 2 g amilum dalam labu takar 100 mL, kemudian diencerkan
dengan aquadest yang telah dipanaskan sampai garis batas, dan
dihomogenkan.
3.3.1.6 Pembuatan Larutan KOH-KI
700 g KOH dan 150 g KI dimasukkan ke dalam labu takar 1 L, diencerkan
dengan aquadest sampai garis batas, dan dihomogenkan.
3.3.1.7 Pembuatan Larutan Baku Zn 10 ppm
1. Ditimbang kristal ZnSO4.7H20 sebanyak 4415,38 mg, dimasukkan ke
dalam gelas Beaker kemudian ditambahkan dengan sedikit aquadest,
diaduk hingga larut, dimasukkan ke dalam labu takar 1 L sampai garis
batas dan dihomogenkan yang selanjutnya disebut dengan larutan induk
Zn 1000 ppm.
2. Sebanyak 10 mL larutan induk Zn 1000 ppm dimasukkan ke dalam labu
takar 100 mL, diencerkan dengan aquadest hingga garis batas dan
dihomogenkan yang selanjutnya disebut dengan larutan standar Zn 100
ppm.
3. Sebanyak 1 mL larutan standar Zn 100 ppm dimasukkan ke dalam labu
takar 10 mL, diencerkan dengan aquadest hingga garis batas dan
dihomogenkan yang selanjutnya disebut dengan larutan standar Zn10
ppm.
3.3.1.8 Pembuatan Larutan Standar Na 10 ppm
1. Sebanyak 10 mL larutan induk Na 1000 ppm dimasukkan ke dalam labu
takar 100 mL, diencerkan dengan aquadest hingga garis batas dan
dihomogenkan yang selanjutnya dsebut dengan larutan standar Na 100
2. Sebanyak 1 mL larutan standar Na 100 ppm dimasukkan ke dalam labu
takar 10 mL, diencerkan dengan aquadest hingga garis batas dan
dihomogenkan yang selanjutnya disebut dengan larutan standar Na 10
ppm.
3.3.2 Penentuan Kurva Kalibrasi
3.3.2.1 Penentuan Kurva Kalibrasi Larutan Seri Standar Zn
1. Sebanyak 0,5 mL; 1 mL; 1,5 mL, dan 2 mL larutan standar Zn 10 ppm
dimasukkan ke dalam labu takar 10 mL, diencerkan dengan aquadest
hingga garis batas dan dihomogenkan sehingga diperoleh larutan seri
standar Zn 0,5 ppm; 1 ppm; 1,5 ppm; dan 2 ppm.
2. Diukur absorbansinya untuk masing-masing konsentasi larutan Zn dengan
Spektroskopi Serapan Atom.
3.3.2.2 Penentuan Kurva Kalibrasi Larutan Seri Standar Na
1. Sebanyak 0,1 mL; 0,25 mL; 0,5 mL, dan 1 mL larutan standar Na 10 ppm
dimasukkan ke dalam labu takar 10 mL, diencerkan dengan aquadest
hingga garis batas dan dihomogenkan sehingga diperoleh larutan seri
standar Na 0,1 ppm; 0,25 ppm; 0,5 ppm; dan 1 ppm.
2. Diukur absorbansinya untuk masing-masing konsentasi larutan Na dengan
Spektroskopi Serapan Atom.
3.3.3 Pembuatan Kitosan Nanopartikel
Pembuatan kitosan nanopartikel dengan Metode Z.G. Hu, 2006, dengan
prosedur sebagai berikut :
1. 0,2 g Kitosan dilarutkan dalam 1 L asam asetat 1%, kemudian diaduk
hingga homogen dengan pengaduk Jartest dengan kecepatan 200 rpm
sebanyak 10 tetes, sehingga terbentuk larutan berwarna putih yang
disebut larutan emulsi kitosan.
2. Larutan tersebut dimasukkan dalam erlemeyer lalu ditempatkan pada
ultrasonic batch untuk menghilangkan NH3 yang masih tersisa selama + 1
jam, sehingga terbentuk kitosan nanopartikel, hasil dikarakterisasi dengan
FESEM.
3. Perlakuan sama juga dilakukan untuk kitosan 0,4 g; 0,6 g; 0,8 g; dan 1 g.
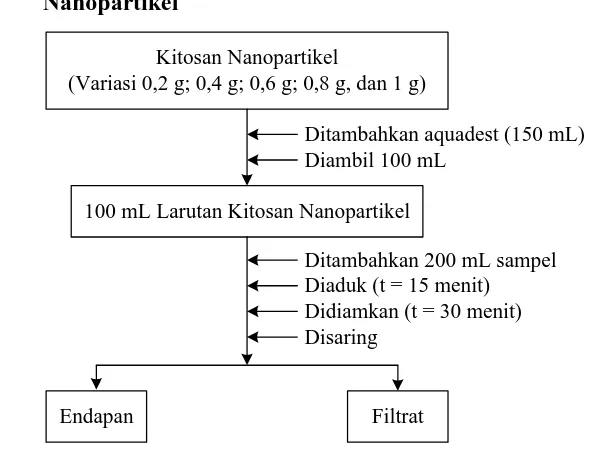
3.3.4 Preparasi Sampel Limbah Cair Industri Benang Karet dengan Kitosan Nanopartikel
1. Kitosan nanopartikel dengan variasi berat kitosan 0,2 g ditambahkan 150
mL aquadest, kemudian diambil 100 mL ditambahkan dengan 200 mL
limbah cair industri benang karet, diaduk selama 15 menit, kemudian
didiamkan selama 30 menit.
2. Campuran tersebut disaring dengan kertas saring Whatman No. 42,
sehingga terpisah antara endapan dan filtratnya.
3. Perlakuan yang sama juga dilakukan untuk larutan kitosan nanopartikel
dengan variasi berat kitosan 0,4 g; 0,6 g; 0,8 g; dan 1 g.
3.3.5 Penyerapan Ion Zn2+ dan Na+ Dalam Limbah Cair Industri Benang Karet Dengan Adanya Penambahan Larutan Kitosan Nanopartikel 1. Filtrat dianalisis dengan spektroskopi serapan atom untuk menentukan
konsentrasi Zn2+ dan Na+ dari masing-masing sampel baik sampel tanpa
penambahan larutan kitosan nanopartikel, maupun dengan sampel dengan
penambahan kitosan nanopartikel variasi berat 0,2 g; 0,4 g; 0,6 g; 0,8 g,
dan 1 g.
2. Ditentukan besarnya persentase ion Zn2+ dan Na+ yang terserap dalam
3.3.6 Penentuan Nilai COD Dalam Sampel Hasil Preparasi
1. Dipipet 120 mL sampel tanpa penambahan larutan kitosan nanopartikel
dan dimasukkan ke dalam erlenmeyer.
2. Dimasukkan batu didih yang telah dibersihkan.
3. Ditambahkan 5 mL H2SO4(p) dan 10 mL K2Cr2O7 0,025 N.
4. Dirangkai alat refluks dan dihidupkan alat pemanas listrik, selanjutnya
ditambahkan 25 mL H2SO4(p) dari bagian atas pendingin bola sampai
H2SO4(p) jatuh kebawah.
5. Direfluks selama + 2 jam, kemudian ditambahkan 50 mL aquadest.
6. Kemudian rangkaian alat refluks dibuka dan didinginkan, selanjutnya
ditambahkan 100 mL aquadest.
7. Ditambahkan 7 tetes indikator feroin
8. Dititrasi dengan larutan standar Ferro Amonium Sulfat 0,1 N sampai
terjadi perubahan warna dari hijau biru sampai coklat kemerahan.
9. Dicatat volume Ferro Amonium Sulfat 0,1 N yang terpakai.
10. Perlakuan yang sama juga dilakukan terhadap sampel hasil preparasi
dengan penambahan larutan kitosan nanopartikel dengan variasi berat
kitosan 0,2 g; 0,4 g; 0,6 g; 0,8 g; dan 1 g.
3.3.7 Penentuan Nilai BOD5 Dalam Sampel Hasil Preparasi
1. Sampel tanpa penambahan larutan kitosan nanopartikel dimasukkan ke
dalam gelas winkler, ditutup sampai tidak ada gelombang udara dan
dimasukkan ke dalam termos selama 5 hari.
2. Ditambahkan 1 mL MnSO4 dan 1 mL KOH-KI.
3. Diendapkan + 10 menit.
4. Ditambahkan 1 mL H2SO4(p).
5. Dititrasi dengan Na2S2O3 0,025 N sampai kuning pucat.
6. Ditambahkan 3 tetes amilum.
8. Dicatat volume Na2S2O3 0,025 N yang terpakai.
9. Perlakuan yang sama juga dilakukan terhadap sampel hasil preparasi
dengan penambahan larutan kitosan nanopartikel dengan variasi berat
kitosan 0,2 g; 0,4 g; 0,6 g; 0,8 g; dan 1 g.
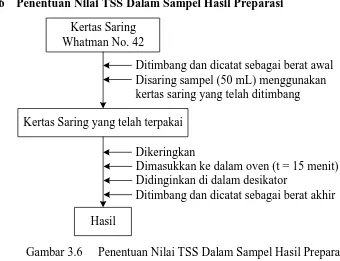
3.3.8 Penentuan Nilai TSS Dalam Sampel Hasil Preparasi
1. Kertas saring Whatman No. 42 ditimbang selanjutnya disebut sebagai
berat awal.
2. Sebanyak 50 mL sampel tanpa penambahan larutan kitosan nanopartikel
disaring dengan kertas saring yang sudah ditimbang.
3. Kertas saring dikeringkan, dimasukkan ke dalam oven + 15 menit,
didinginkan di dalam desikator, dan kemudian ditimbang selanjutnya
disebut sebagai berat akhir.
4. Perlakuan yang sama juga dilakukan terhadap sampel hasil preparasi
dengan penambahan larutan kitosan nanopartikel dengan variasi berat
kitosan 0,2 g; 0,4 g; 0,6 g; 0,8 g; dan 1 g.
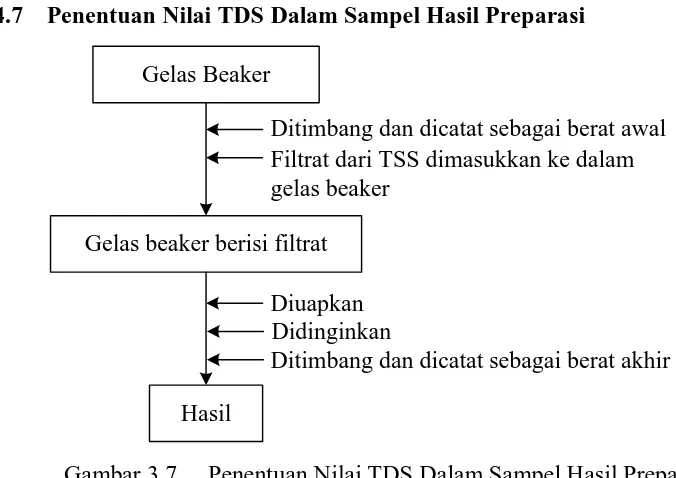
3.3.9 Penentuan Nilai TDS Dalam Sampel Hasil Preparasi
1. Gelas beaker yang kosong ditimbang selanjutnya disebut sebagai berat
awal.
2. Hasil saringan (filtrat) dari TSS untuk sampel tanpa penambahan larutan
kitosan nanopartikel dimasukkan ke dalam gelas beaker yang telah
ditimbang.
3. Filtrat diuapkan.
4. Gelas beaker didinginkan dan ditimbang.
5. Perlakuan yang sama juga dilakukan terhadap sampel hasil preparasi
dengan penambahan larutan kitosan nanopartikel dengan variasi berat
3.4. Bagan Penelitian
3.4.1 Pembuatan Kitosan Nanopartikel
Kitosan (0,2 g; 0,4 g; 0,6 g, 0,8 g; dan 1,0 g)
Ditambahkan CH3COOH 1% (1 L)
Diaduk hingga homogen (v = 200 rpm, t = 30 menit) Ditambahkan NH3 (p) (10 tetes)
Dimasukkan ke dalam erlenmeyer
Ditempatkan ke dalam ultrasonic batch (t = 1 jam)
Kitosan nanopartikel Larutan Emulsi Kitosan
Dikarakterisasi dengan FESEM
Hasil
Gambar 3.1 Bagan Penelitian Pembuatan Kitosan Nanopartikel
3.4.2 Preparasi Sampel Limbah Cair Industri Benang Karet Dengan Kitosan Nanopartikel
Kitosan Nanopartikel
(Variasi 0,2 g; 0,4 g; 0,6 g; 0,8 g, dan 1 g)
100 mL Larutan Kitosan Nanopartikel
Ditambahkan aquadest (150 mL) Diambil 100 mL
Ditambahkan 200 mL sampel Diaduk (t = 15 menit)
Didiamkan (t = 30 menit) Disaring
Endapan Filtrat
3.4.3 Penyerapan Ion Zn2+ dan Na+ Dalam Limbah Cair Industri Karet Dengan Adanya Penambahan Larutan Kitosan Nanopartikel
Filtrat
Dianalisis dengan SSA
Dihitung penyerapan ion Zn2+ dan Na+
Hasil
Gambar 3.3 Bagan Penelitian Penyerapan Ion Zn2+ dan Na+ Dalam Limbah Cair Industri Karet Dengan Adanya Penambahan Larutan Kitosan Nanopartikel
3.4.4 Penentuan Nilai COD Dalam Sampel Hasil Preparasi
Filtrat (120 mL)
Dimasukkan ke dalam erlenmeyer Dimasukkan ke dalam batu didih
Hasil
Ditambahkan H2SO4(p) (5 mL)
Ditambahkan K2Cr2O7 0,025 N (10 mL) Dirangkai alat refluks
Ditambahkan H2SO4(p) (5 mL) dari bagian atas pendingin bola
Direfluks (t = 2 jam)
Ditambahkan aquadest (50 mL) Rangkaian alat refluks dibuka Ditambahkan aquadest (100 mL) Ditambahkan indikator feroin (7 tetes) Dititrasi dengan Amonim ferro sulfat 0,1 N Dicatat volume yang terpakai