EFEKTIVITAS PENYERAPAN LOGAM BESI ( Fe ) DAN LOGAM NATRIUM (Na) OLEH KITOSAN NANO PARTIKEL PADA
LIMBAH CAIR DETERGEN
TESIS
OLEH
MASLAN 097006027
SEKOLAH PASCA SARJANA PROGRAM MAGISTER ILMU KIMIA
UNIVERSITAS SUMATERA UTARA MEDAN
EFEKTIVITAS PENYERAPAN LOGAM BESI (Fe) DAN LOGAM NATRIUM (Na) OLEH KITOSAN NANO PARTIKEL PADA
LIMBAH CAIR DETERGEN
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh gelar Magister Sains Dalam program Magister Ilmu Kimia pada Fakultas Matematika
Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Oleh MASLAN 097006027
PROGRAM STUDI ILMU KIMIA SEKOLAH PASCA SARJANA UNIVERSITAS SUMATERA UTARA
Judul Tesis : Efektivitas Penyerapan Logam Besi (Fe) dan Logam Natrium (Na) oleh Kitosan Nanopartikel Pada Limbah Cair Detergen
Nama Mahasiswa : Maslan Nomor Induk Mahasiswa : 097006027
Program Studi : Magister Ilmu Kimia
Menyetujui Komisi Pembimbing :
Prof.Dr.Harry Agusnar,MSc,M.Phil. Prof.Dr.Zul Alfian,MSc
Ketua Anggota
Ketua Program Studi Dekan
Prof.Basuki Wirjosentono,MS,Ph.D Dr.Sutarman,M.Sc
PERNYATAAN ORISINALITAS
EFEKTIVITAS PENYERAPAN LOGAM BESI (Fe) DAN LOGAM NATRIUM (Na) OLEH KITOSAN NANO PARTIKEL PADA
LIMBAH CAIR DETERGEN
Tesis
Dengan ini saya nyatakan bahwa yang tertulis dalam tesis ini benar-benar hasil karya sendiri dan sepanjang pengetahuan saya tidak terdapat pendapat atau karya yang pernah ditulis atau diterbitkan oleh orang lain kecuali secara tertulis diacu dalam naskah dan disebutkan sumbernya dalam daftar pustaka.Pendapat atau temuan dalam tesis ini dikutip berdasarkan kode ilmiah.
Medan,…………..2011 Penulis
Maslan
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademika Universitas Sumatera Utara Saya yang bertanda tangan di bawah ini :
Nama : Maslan
NIM : 097006027
Program Studi : Magister Ilmu Kimia Jenis karya ilmiah : Tesis
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-Eksklusif (Non-Exclusive Royalty Free Righ) atas tesis saya yang berjudul :
EFEKTIVITAS PENYERAPAN LOGAM BESI (Fe) DAN LOGAM NATRIUM (Na) OLEH KITOSAN NANO PARTIKEL PADA LIMBAH CAIR DETERGEN
Beserta perangkat yang ada (jika diperlukan). Dengan hak bebas royalty non-eksklusif ini, Universitas Sumatera Utara berhak menyimpan, mengalih media, memformat, mengelola dalam bentuk data base, merawat dan mempublikasikan tesis saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan pemegang dan atau sebagai pemilik hak cipta.
Medan,………...
Telah diuji pada :
Hari/tanggal :
Panitia penguji Tesis :
Ketua :
ABSTRAK
Kitosan telah digunakan sebagai penyerap (absorbsi) limbah logam besi (Fe2+ ) dan natrium (Na+) pada limbah cair detergen. Kitosan Nanopartikel digunakan untuk mengefektifkan daya serap (adsorbsi) kitosan terhadap limbah cair detergen dengan cara memperluas permukaan kitosan tersebut. Analisa FESEM didapatkan permukaan kitosan nanopartikel yang lebih besar dan merata dengan nilai 80 nm.
Analisa spektroskopi FTIR (Fourier Transform Infra-Red) menunjukkan bahwa panjang gelombang N – H = 3425.6 cm ¯¹ ; C – H = 2877.8 cm¯¹ ; C=O = 1651.1 cm¯¹ ; C – N = 1381.0 cm¯¹.
Variasi konsentrasi larutan kitosan nanopartikel tersebut efektif untuk menyerap (mengadsorbsi) logam besi (Fe2+ ) dan natrium (Na+ ).
Daya serap kitosan nanopartikel pada logam Fe optimum pada konsentrasi 0.8 gram/liter sebesar 97.03% dan logam Na pada konsentrasi 0.8 gram/liter sebesar 96.43%.
ABSTRACT
Chitosan had used as absorber of iron waste (Fe2+ ) and Natrium (Na+ ) on detergent liquid waste. Nanoparticle chitosan is used to increase the effectiveness of chitosan absorption on detergent liquid waste by enlarger the surface of chitosan. FESEM analysis found that Nanoparticle chitosan is larger and smooth in the value of 80 nm.
The spectroscopic analysis of FTIR (Fourier Transform Infra-Red) indicates that the wave length N – H = 3425.6 cm¯¹ ; C – H = 2877.8 cm¯¹ ; C = O = 1651.1 cm¯¹ ; C – N = 1381.0cm¯¹.
Variation of Nanoparticle chitosan concentration is effective for absorption of iron (Fe2+ ) and Natrium (Na+ ).
The absorption of Nanoparticle chitosan on Fe is optimum on concentration of 0.8 gram/liter for 97.03% and Na on concentration of 0.8 gram/liter for 96.43%.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan tesis ini.
Dengan selesainya tugas ini perkenankanlah kami mengucapkan terima kasih yang sebesar besarnya kepada Rektor Universitas Sumatera Utara Prof. Chairuddin P.Lubis, DMT
&
H, Sp. A (K) atas kesempatan dan fasilitas yang diberikan kepada saya untuk menyelesaikan pendidikan Program Magister.Direktur Sekolah Pascasarjana Universitas Sumatera Utara yang dijabat oleh Prof. Dr. Ir. Chairun Nisa B, M.Sc atas kesempatan menjadi mahasiswa Program Magister di Universitas Sumatera Utara.
Terima kasih yang tak terhingga dan penghargaan yang setinggi-tingginya kami ucapkan kepada :
1. Bapak Prof. Dr. Harry Agusnar, M.Sc, M.Phil selaku Pembimbing Utama dan Bapak Prof. Dr. Zul Alfian, M.Sc selaku Anggota Komisi Pembimbing yang setiap saat dengan penuh perhatian memberikan bimbingan, motivasi dan saran sehingga tesis ini dapat diselesaikan.
2. Bapak Prof. Dr. Harlem Marpaung, Bapak Prof. Basuki Wirjosentono, MS, Ph.D, Bapak Dr. Hamonangan Nainggolan , M.Sc selaku Penguji yang banyak memberikan masukan dan saran untuk menyelesaikan tesis ini, untuk itu penulis ucapkan terima kasih.
3. Bapak Prof. Dr. Harry Agusnar, M.Sc, M.Phil selaku kepala Lembaga Penelitian yang telah banyak memberikan kemudahan kepada penulis Melakukan penelitian sehingga selesainya tesis ini.Kepada Bapak saya ucapkan terima kasih.
atas bantuan dan motivasi serta do’anya.
6. Untuk anak-anakku tersayang Jefri Affandi, Azwar Fadli, Rifki Dimas semoga ini menjadi motivasi bagi kalian untuk menempuh pendidikan yang lebih tinggi.
7. Untuk abang-abangku Drs. Rahmat Nauli, M.Sc dan Joni Harmi terima kasih banyak atas bantuan yang diberikan kepada penulis.
8. Bapak Drs. Ramli Siregar selaku kepala sekolah SMA Negeri 1 Sunggal Kab. Deli Serdang dan Bapak Drs. Jaswar, M.Pd selaku kepala sekolah SMK Negeri 1 P. Sei Tuan yang telah banyak membantu, memberikan motivasi saya
ucapkan terima kasih.
9. Teman-teman angkatan 2009, khusus Sri Wahyuni, Raima, Dek Leli di Sekolah Pascasarjana Ilmu Kimia, Bang Man di Lab Penelitian yang telah banyak membantu, memberikan motivasi saya ucapkan terima kasih.
Penulis menyadari bahwa tesis ini masih kurang sempurna oleh karena itu penulis sangat mengharapkan kritik dan saran yang membangun dari pihak pembaca demi kesempurnaan tesis ini. Akhirnya semoga tesis ini bermanfaat bagi penelitian dan kemajuan ilmu pengetahuan untuk masa yang akan datang.
Hormat Penulis,
RIWAYAT HIDUP
1. Nama : Maslan
2. Tempat/ Tanggal lahir : Padang Sidimpuan, 10 Oktober 1967 3. Agama : Islam
4. Status : Menikah
5. Alamat : Jl. Perhubungan Gg. Teratai III No. 2 Lau Dendang Kec. P. Sei Tuan. 6. HP : 085261317351
7. Nama Ayah : Ahmad Pane (Alm) 8. Nama Ibu : Masro Ritonga 9. Pendidikan :
SD Negeri 142438 Padang Sidimpuan : 1975 – 1981 SMP Negeri 2 Padang Sidimpuan : 1981 – 1984 SMA Negeri 3 Padang Sidimpuan : 1984 – 1987 D III FPMIPA IKIP Medan : 1987 – 1990 Sarjana (S1) FPMIPA IKIP Medan :1996 – 1997 Sekolah Pascasarjana Program Kimia, USU : 2009 – 2011 10. Riwayat Pekerjaan :
DAFTAR ISI Halaman
ABSTRAK... i
ABSTRACT ... ii
KATA PENGANTAR ... iii
RIWAYAT HIDUP ... v
DAFTAR ISI ... vi
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
BAB I PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Perumusan Masalah ... 4
1.3. Tujuan Penelitian ... 4
1.4. Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Kitosan ... 6
2.1.1 Nanopartikel... 7
2.1.2 Kitosan nanopartikel ... 8
2.1.3 Sifat – sifat dan penggunaan Kitosan... 9
2.1.4 Derajat Deasetilasi ... 10
2.1.5 Interaksi Kitosan Dengan Ion Logam ... 11
2.2 Jenis – Jenis Daya Serap Kitosan... 12
2.2.1 Adsorbsi ... 12
2.2.2 Koagulasi ... 14
2.2.3 Flokulasi... 14
2.3 Logam ... 15
2.3.1 Limbah Cair Logam Besi (Fe) ... 17
2.3.2 Limbah Cair Logam Natrium (Na) ... 18
2.4 Spektrofotometer Serapan Atom... 20
2.5 Spektrum Inframerah ... 23
2.6 Proses Pengikatan Logam Oleh Kitosan Nanopartikel ... 24
BAB III METODOLOGI PENELITIAN ... 27
3.1 Lokasi Penelitian... 27
3.2 Bahan ... 27
3.3 Alat... 27
3.4 Prosedur Penelitian... 28
3.4.1 Pembuatan Kitosan Nanopartikel... 28
3.4.2 Bagan Penelitian Pembuatan Kitosan Nanopartikel ... 30
3.4.3 Bagan Preparasi Sampel... 31
3.4.4 Daya Serap (absorbsi) Kitosan Nanopartikel Terhadap Limbah Cair Logam Besi (Fe) dan Natrium (Na) pada Detergen... 32
3.4.5 Spektroskopi Inframerah (FTIR = Fourier Transform Infra Red) ... 32
3.4.6 Analisa Field Emition Scanning Electron Microscopy (FESEM) ... 32
BAB IV HASIL DAN PEMBAHASAN ... 33
4.1 Hasil Penelitian ... 33
4.2 Penetapan Kadar Logam Besi (Fe) ... 33
4.2.1 Penentuan Persamaan Garis Regresi dengan Metode Kurva Kalibrasi... 33
4.2.2 Data Hasil Pengukuran Daya Serap Ion Fe... 36
4.2.3 Perhitungan % Penurunan Kadar Konsentrasi Ion Fe dalam Sampel ... 38
4.3 Penetapan Kadar Logam Natrium (Na) ... 39
4.3.1 Penentuan Persamaan Garis Regresi dengan Metode Kurva Kalibrasi... 40
4.3.3 Perhitungan % Penurunan Kadar Konsentrasi Ion
Na dalam Sampel ... 43
4.4 Pembahasan... 44
4.4.1 Daya Serap Kitosan Nanopartikel Untuk Menurunkan Kadar Besi (Fe) dan Natrium (Na) Dalam Limbah Cair Detergen ... 44
4.4.2 Analisa Field Emition Scanning Electron Microscopy (FESEM) ... 45
4.4.3 Spektrum FT-IR Derajat Deasetilasi dari Kitosan Nanopartikel ... 45
4.4.4 Penyerapan Kitosan Nanopartikel Dengan Variasi Berat Kitosan Nanopartikel... 47
BAB V KESIMPULAN DAN SARAN ... 49
5.1 Kesimpulan ... 49
5.2 Saran... 49
DAFTAR PUSTAKA ... 50
DAFTAR TABEL
Halaman
2.1 Pemanfaatan Kitosan Pada Beberapa Industri……… 10 4.1 Kurva Absorbansi Vs Konsentrasi Larutan Fe ……….. 33 4.2 Data Hasil Penurunan Persamaan Garis Regresi
Untuk Logam Besi (Fe) ………. 34 4.3 Data Daya Serap Kitosan Nanopartikel Pada
Limbah Cair Detergen ……….. 37 4.4 Kurva Absorbansi Vs Konsentrasi Larutan Na ………. 39 4.5 Data Hasil Penurunan Persamaan Garis Regresi
Untuk Logam Na ……… 40 4.6 Data Daya Serap Kitosan Nanopartikel Pada
DAFTAR GAMBAR
Nomor Judul Halaman
2.1 Struktur Kitin, Sumber Muzzarelli 1977 ……… 7
2.2 Struktur Kitosan, Sumber Muzzarelli 1977 ………..……… 7
2.3 Skema Peralatan Spektrofotometer Serapan Atom ……… 21
2.4 Mekanisme Pengikatan Logam Berat oleh Kitosan ……….. 24
2.5 Tahap-Tahap Koagulasi Polielektrolit Kitosan ………. 25
2.6 Mekanisme Koagulasi Perbedaan Muatan ………. 25
3.1 Bagan Penelitian Pembuatan Kitosan Nanopartikel (Metode Z.G. Hu, et al, 2006 ………. 30
3.2 Bagan Preparasi Sampel ………. 31
4.1 Kurva Absorbansi Vs Konsentrasi Larutan Fe ……… 34
4.2 Kurva Daya Serap Vs Konsentrasi Larutan Fe ……… 38
4.3 Kurva Absorbansi Vs Konsentrasi Laruran Na ……….. 39
DAFTAR LAMPIRAN
ABSTRAK
Kitosan telah digunakan sebagai penyerap (absorbsi) limbah logam besi (Fe2+ ) dan natrium (Na+) pada limbah cair detergen. Kitosan Nanopartikel digunakan untuk mengefektifkan daya serap (adsorbsi) kitosan terhadap limbah cair detergen dengan cara memperluas permukaan kitosan tersebut. Analisa FESEM didapatkan permukaan kitosan nanopartikel yang lebih besar dan merata dengan nilai 80 nm.
Analisa spektroskopi FTIR (Fourier Transform Infra-Red) menunjukkan bahwa panjang gelombang N – H = 3425.6 cm ¯¹ ; C – H = 2877.8 cm¯¹ ; C=O = 1651.1 cm¯¹ ; C – N = 1381.0 cm¯¹.
Variasi konsentrasi larutan kitosan nanopartikel tersebut efektif untuk menyerap (mengadsorbsi) logam besi (Fe2+ ) dan natrium (Na+ ).
Daya serap kitosan nanopartikel pada logam Fe optimum pada konsentrasi 0.8 gram/liter sebesar 97.03% dan logam Na pada konsentrasi 0.8 gram/liter sebesar 96.43%.
ABSTRACT
Chitosan had used as absorber of iron waste (Fe2+ ) and Natrium (Na+ ) on detergent liquid waste. Nanoparticle chitosan is used to increase the effectiveness of chitosan absorption on detergent liquid waste by enlarger the surface of chitosan. FESEM analysis found that Nanoparticle chitosan is larger and smooth in the value of 80 nm.
The spectroscopic analysis of FTIR (Fourier Transform Infra-Red) indicates that the wave length N – H = 3425.6 cm¯¹ ; C – H = 2877.8 cm¯¹ ; C = O = 1651.1 cm¯¹ ; C – N = 1381.0cm¯¹.
Variation of Nanoparticle chitosan concentration is effective for absorption of iron (Fe2+ ) and Natrium (Na+ ).
The absorption of Nanoparticle chitosan on Fe is optimum on concentration of 0.8 gram/liter for 97.03% and Na on concentration of 0.8 gram/liter for 96.43%.
BAB I PENDAHULUAN
1.1. Latar Belakang
Air yang tersebar di alam tidak pernah terdapat dalam bentuk murni, tetapi bukan berarti semua air sudah terpolusi. Sebagai contoh, meskipun di daerah pegunungan atau hutan yang terpencil dengan udara yang bersih dan bebas dari polusi, air hujan selalu mengandung bahan – bahan terlarut seperti CO2, O2 dan N2, serta bahan-bahan tersuspensi seperti debu dan partikel-partikel lainnya yang terbawa dari atmosfer. Air permukaan dan air sumur biasanya mengandung bahan-bahan metal terlarut seperti Na, Mg, Ca dan Fe. Air yang mengandung komponen-komponen tersebut dalam jumlah tinggi disebut air sadah (Agusnar, 2007). Air minum pun bukan merupakan air murni. Meskipun bahan-bahan tersuspensi dan bakteri mungkin telah dihilangkan dari air tersebut, tetapi air minum mungkin masih mengandung komponen-komponen terlarut. Bahkan air murni sebenarnya tidak enak untuk diminum karena beberapa bahan yang terlarut mungkin memberikan rasa yang spesifik terhadap air minum (Agusnar, 2007).
Perubahan pada air buangan, baik ke arah alkali ( pH menaik ) maupun ke arah asam ( pH menurun ), akan sangat mengganggu kehidupan ikan dan hewan air di sekitarnya. Selain itu air buangan yang mempunyai pH rendah bersifat sangat korosif terhadap baja dan sering menyebabkan pengkaratan pada pipa – pipa besi.
garam-garamnya. Sebagai contoh, air buangan pabrik gula biasanya mengandung berbagai jenis gula yang larut, sedangkan air buangan industri kimia sering mengandung mineral – mineral seperti merkuri ( Hg ), timbal ( Pb ), arsenik ( As ), cadmium ( Cd ), khromium ( Cr ), nikel ( Ni ), Cl2, serta garam – garam kalsium
dan magnesium yang mempengaruhi kesadahan air. Selain itu air buangan juga sering mengandung sabun, detergen dan surfaktan yang larut dalam air misalnya pada air buangan rumah tangga dan industri pencucian ( Agusnar., 2007 ). Selain kegiatan industri, di perkotaan limbah juga dihasilkan oleh hotel, rumah sakit dan rumah tangga. Bentuk limbah yang dihasilkan oleh komponen kegiatan yang disebut di atas adalah limbah padat dan limbah cair.
Menurut Sugiharto (1987) air limbah adalah kotoran yang berasal dari masyarakat dan rumah tangga dan juga berasal dari industri, air tanah, air permukaan, serta buangan lainnya.
Penggunaan kitosan dan turunannya dalam mengatasi pencemaran lingkungan pernah dilakukan oleh (Zikakis, 1984), dimana limbah cair dari industri dapat diturunkan kandungan logamnya.
Kitosan merupakan polimer pengkhelat yang berasal dari bahan alami karena kitosan memiliki kemampuan untuk mengikat logam dan membentuk kompleks logam kitosan.Kitosan merupakan bahan pengkelat ion yang sangat baik (Wan Ngah et al., 1998).
Kitosan polimer polikationik alami yang dapat berperan sebagai adsorben terhadap logam berat dalam air limbah (Onsoyen & Shaugrud., 1990).Kitosan zat non-toksik yang merupakan polisakarida alami yang terdiri dari kopolimer glukosamin dan N-asetil glukosamin dan dapat diperoleh dari deasetilasi kitin (Khan et al, 2002). Kitin adalah biopolimer alami terbesar kedua yang dapat ditemukan di alam setelah selulosa. Kitin dapat diperoleh dari inverteberate laut, serangga, jamur, dan ragi (Guibal, 2004) jenis crustacean mengandung 20-30% kitin pada bagian eksoskletonnya.
efektivitas penyerapan logam besi (Fe) dan logam natrium (Na) oleh kitosan nano partikel pada limbah cair detergen dimana detergen adalah surfaktan anionik dengan gugus alkil (umumnya C9 – C15) atau garam dari sulfonat atau sulfat berntai panjang dari Natrium (RSO3-Na+ dan ROSO3-Na+) yang berasal dari
derivate minyak nabanti atau minyak bumi (fraksi paraffin dan olefin). Tanpa mengurangi makna manfaat detergen dalam memenuhi kebutuhan sehari-hari, harus diakui bahwa bahan kimia yang digunakan pada detergen dapat menimbulkan dampak negatif terhadap kesehatan maupun lingkungan.
1.2. Perumusan Masalah
a. Apakah kitosan nanopartikel efektif untuk menurunkan kadar logam besi ( Fe ) dan natrium ( Na ) pada limbah cair detergen.
b. Apakah variasi berat kitosan nanopartikel mempengaruhi penurunan kadar logam besi ( Fe ) dan natrium ( Na ) pada limbah cair detergen.
1.3. Tujuan Penelitian
1.4. Manfaat Penelitian
a. Memberikan informasi kepada masyarakat tentang efektivitas penyerapan logam Besi ( Fe ) dan logam Natrim ( Na ) oleh kitosan nano partikel pada limbah cair detergen.
BAB II
TINJAUAN PUSTAKA 2.1. Kitosan
Kitosan merupakan polisakarida alami yang terdiri dari kopolimer glukosamin dan N – asetilglukosamin, dan dapat diperoleh dari deasetilasi kitin ( Khan et al, 2002 ). Kitin biopolimer alami terbesar ke dua yang dapat ditemukan di alam setelah selulosa. Kitin dapat diperoleh dari arthropoda, jamur, dan ragi (Fernandez-Kim., 2004), tetapi sumber komersial yang penting adalah eksoskleton dari kepiting (Kim & Park., 2001).
Kitin dapat diisolasi dari kulit udang yang mengandung protein (25% - 40%), kitin (15% - 20%), dan kalsium karbonat (45% - 50%) (Margahof, 2003).
Struktur kitin sangat mirip dengan selulosa yaitu ikatan yang terjadi antara monomernya terangkai dengan ikatan glikosida pada posisi β-( 1 – 4 ).Perbedaannya dengan selulosa adalah gugus hidroksil yang terikat pada atom karbon yang kedua, pada kitin diganti oleh gugus asetamida ( NHCOCH3 )
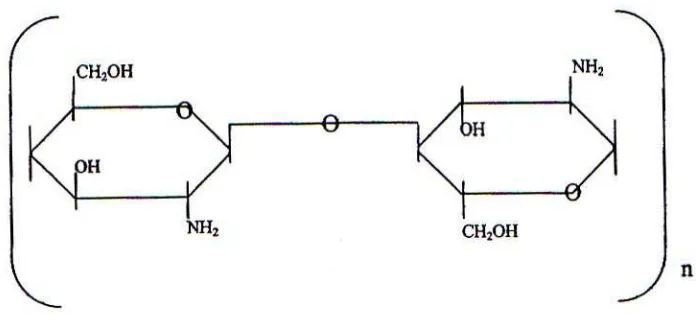
sehingga kitin menjadi sebuah polimer berunit N – asetilglukosamin kitosan mempunyai rantai tidak linier dan mempunyai rumus umum ( C6H11NO4 ) n atau
Gambar 2.1. Struktur Kitin Sumber, (Muzzarelli, 1977)
Gambar 2.2. Struktur Kitosan Sumber, (Muzzarelli, 1977)
2.1.1 Nanopartikel
Dalam nano teknologi, suatu partikel digambarkan sebagai satu objek kecil yang bertindak secara unit keseluruhan dalam hal transfor dan sifat – sifatnya. Dengan nano teknologi material dapat didesain sedemikian rupa dalam orde nano sehingga dapat diperoleh sifat dan material yang diinginkan tanpa melakukan pemborosan atom – atom yang tidak diperlukan.
karakteristik material serta mendesain ulang material ke dalam bentuk atau ukuran yang diinginkan.
Nanopartikel merupakan partikulat material dengan ukuran paling sedikit satu dimensi lebih kecil dari 100 nanometer. Satu nanometer adalah 10-9 m. Sehingga nanopartikel mempunyai luas permukaan yang lebih besar terhadap perbandingan volume.Karakteristik nanopartikel umumnya dilakukan dengan teknik mikroskop elektron [TEM, SEM], mikroskop atomic [AFM], penghamburan cahaya dinamik [ DLS], x-ray mikroskop foto elektron [XPS], bubuk x-ray difraktometri [XRD], FT-IR, spektroskopi UV-Vis.(Anisa Muyusiwalla, 2003).
2.1.2 Kitosan nano partikel
kecepatan 1200 rpm kemudian emulsi dibuat pH 3,5 dengan menambahkan asam asetat hasilnya akan berupa suspensi kitosan (Cheung, 2008 ).
2.1.3 Sifat – sifat dan Penggunaan Kitosan
Kitosan bersifat polielektrolit kation yang dapat mengikat logam berat, sehingga dapat berfungsi sebagai absorben terhadap logam berat dalam air limbah. Prinsip dasar dalam mekanisme pengikatan antara kitosan dan logam berat yang terkandung dalam limbah cair adalah prinsip penukar ion. Gugus amina khususnya nitrogen dalam kitosan akan beraksi dan mengikat logam dari persenyawaan limbah cair. Kitosan yang tidak dapat larut dalam air akan menggumpalkan logam menjadi flok – flok yang akan bersatu dan dapat dipisahkan dari air limbah. Kitosan dapat bekerja sempurna jika dilarutkan dalam larutan asam ( Marganof., 2003 ; Widodo et al, 2005 ).
Kitosan juga bersifat hidrofilik, menahan air dalam strukturnya dan membentuk gel secara spontan. Pembentukan gel berlangsung pada harga pH asam dan sedikit asam, disebabkan sifat kationik kitosan. Viskositas juga meningkat dengan meningkatnya derajat deasetilasi. Gel kitosan terdegradasi secara berangsur – angsur, sebagaimana halnya kitosan melarut ( Muzzarelli et al, 1988 ).
toksisitasnya ( Berger et al, 2004 ). Kitosan juga memperlihatkan aktivitas biologi seperti hypocholesterolemic, antimikroba, anti jamur ( Rhoades & Roller., 2000 ).
Tabel 2.1. Pemanfaatan Kitosan pada Beberapa Industri
Industri Manfaat
Industri pengolahan Penyerap ion logam, koagulan, protein, asam amino, dan Limbah bahan pencelup.
Industri makanan Pengawet, penstabil makanan, penstabil warna, bahan pengental, dan lain – lain.
Industri kesehatan Penyembuh luka dan tulang, pengontrol kolesterol
darah, kontak lensa, penghambat plat gigi, dan lain – lain . Industri pertanian Pupuk, pelindung biji dan lain – lain.
Kosmetik Pelembab ( moisturizer ), krem wajah, tangan dan badan, dan lain – lain.
Bioteknologi Dapat immobilisasi enzim, chromatography, penyembuh sel dan lain – lain.
__________________________________________________________________ Sumber : Fernandez-Kim., 2004
2.1.4 Derajat Deasetilasi
Derajat deasetilasi adalah persentasi gugus asetilasi yang berhasil dihilangkan selama proses deasetilasi kitin. Derajat deasetilasi berperan penting dalam proses penyerapan. Pertambahan nilai derajat deasetilasi menyebabkan bertambahnya jumlah gugus amina bebas ( Milot et al, 1998 ). Berat molekul kitosan dan derajat deasetilasi juga dapat mempengaruhi kelarutan kitosan dalam suasana asam dan membawa pengaruh pada proses penyerapan.
meningkatnya gugus amina bebas didalam praktiknya berat molekul dan derajat deasetilasi bertambah nilainya juga membawa pengaruh pada sifat fisik dan fisikokimia pada porositas, viskositas, dan titik leburnya ( Agusnar., 1990 ).
Perbedaan antara kitin dengan kitosan terdapat dalam derajat deasetilasinya. Kitosan mempunyai derajat deasetilasi 80 – 90 % akan tetapi kebanyakan publikasi menggunakan istilah kitosan apabila derajat deasetilasi lebih besar dari 70 %.
2.1.5 Interaksi Kitosan Dengan Ion Logam
Interaksi kitosan dengan ion logam terjadi karena proses pengkompleksan dimana pertukaran ion, penyerapan dan pengkhelatan terjadi selama proses berlangsung. Ketiga proses tersebut tergantung dari ion logam masing – masing. Kitosan menunjukkan afinitas yang tinggi pada logam transisi golongan 3, begitu pula pada logam yang bukan golongan alkali dengan konsentrasi rendah. ( Muzzarelli., 1973, 1977 ).
Sifat penyerapan ion logam yang sangat baik oleh kitosan dengan selektif dan kapasitas penyerapan yang tinggi yang disebabkan tiga sifat yaitu :
1. Sifat hidrofilik kitosan dengan jumlah yang besar pada gugusan hidroksil. 2. Gugus amina primer dengan aktivitas yang tinggi.
Menurut Mc Kay ( 1987 ), kitosan mempunyai kemampuan untuk mengikat logam dan membentuk kompleks logam - kitosan. Contoh mekanisme yang terjadi seperti dibawah ini.
2R-NH3 + Fe+² +2Cl¯ 2 ( RNH3 )FeCl2
( Amelia A., 1991 )
Kitosan mempunyai satu kumpulan amino linier bagi setiap unit glukosa. Kumpulan amino ini mempunyai sepasang elektron yang dapat berkoordinat untuk membentuk ikatan – ikatan aktif dengan kation – kation logam. Unsur nitrogen pada setiap monomer kitosan dikatakan sebagai gugus yang aktif berkordinat dengan kation logam. ( Hutahahean., 2001 ).
2.2 Jenis – Jenis Daya Serap Kitosan 2.2.1 Adsorbsi
Molekul – molekul pada permukaan zat padat atau zat cair, mempunyai gaya tarik kearah dalam, karena tidak ada gaya – gaya lain yang mengimbanginya. Adanya gaya – gaya ini menyebabkan zat padat dan zat cair, mempunyai gaya adsorbsi. ( Sukardjo., 1997 ). Apabila pada permukaan antara dua fasa yang bersih ( seperti antara gas – cairan dan cairan – cairan ) ditambahkan komponen ketiga, maka komponen ini akan sangat mempengaruhi sifat permukaan. Dimana komponen ketiga yang ditambahkan adalah molekul yang teradsorbsi pada permukaan. ( Bird, Tony., 1993 ).
itu,adsorsi dapat terjadi antara zat padat dan zat cair, zat padat dan gas, zat cair dan zat cair, atau gas dan zat cair.
Peristiwa adsorbsi ini disebabkan oleh gaya tarik molekul – molekul di permukaan adsorben. Adsorbsi berbeda dengan absorbsi, Karena pada absorbsi zat yang diserap masuk ke dalam adsorben, misalnya absorbsi air dengan sponge atau uap air oleh CaCl2 anhidrous. ( Sukardjo., 1990 )
Zat – zat teradsorbsi terikat dengan kuat dalam lapisan – lapisan yang biasanya tebalnya tak lebih dari satu atau dua molekul ( atau ion ). Banyaknya zat asing yang dapat diadsorbsi bergantung pada luasnya permukaan yang tersingkap. Meskipun adsorbsi merupakan suatu gejala umum dari zat padat, adsorbsi ini teristimewa efisiensinya dengan materi koloid yang disebabkan oleh besarnya luas permukaan itu (Keenan., 1999).
Adsorbsi ada dua jenis yaitu adsorbsi fisika dan adsorbsi kimia. Pada adsorbsi fisika, adsorbsi disebabkan gaya van der Waals yang ada pada permukaan adsorben, panas adsorbsi fisika biasanya rendah ( ~ 10000 Kal/ Mol), lapisan yang terjadi pada permukaan adsorben biasanya lebih dari satu molekul dan kesetimbangan adsorbsi reversible dan cepat misalnya adsorbsi gas pada charcoal.
2.2.2 Koagulasi
Koagulasi adalah proses pengolahan air atau limbah cair dengan menstabilkan partikel – partikel koloid untuk memfasilitasi pertumbuhan partikel selama flokulasi, sedangkan flokulasi adalah proses pengolahan air dengan cara mengadakan kontak diantara partikel – partikel koloid yang telah mengalami destabilisasi sehingga ukuran partikel – partikelnya tumbuh menjadi partikel yang lebih besar ( Kiely, 1998 ). Koagulasi dan flokulasi diperlukan untuk menghilangkan material limbah berbentuk suspensi atau koloid. Koloid mempunyai ukuran partikel diameter sekitar 1 nm. Partikel – partikel ini tidak dapat mengendap dalam periode waktu yang wajar dan tidak dapat dihilangkan dengan proses perlakuan fisika biasa.
2.2.3 Flokulasi
mereka bertubrukan, tetap bersatu, dan tumbuh menjadi satu ukuran yang siap mengendap. Pengadukan yang cukup harus diberikan untuk membawa flok kedalam kotak. Terlalu banyak pengadukan dapat membubarkan flok sehingga ukurannya menjadi kecil dan terdispersi halus ( Davis dan Cornwell ). Dalam proses flokulasi, kecepatan penggumpalan dari agregat ditentukan oleh banyaknya tubrukan antar partikel yang terjadi serta efektifitas dari benturan yang terjadi.
2.3 Logam
Meningkatnya perkembangan sektor industri di Indonesia merupakan sarana untuk memperbaiki taraf hidup rakyat, tetapi dilain pihak muncul masalah pencemaran air akibat limbah cair industri yang dibuang ke dalam badan air. Adanya pencemaran air dapat merusak kelestarian lingkungan, keseimbangan sumber daya alam dan berkembang biaknya bibit penyakit sehingga air tersebut tidak dapat dikonsumsi.
Pencemaran logam berat terhadap lingkungan merupakan suatu proses yang erat hubungannya dengan penggunaan logam berat tersebut oleh manusia. Pada awalnya digunakannya logam sebagai alat, belum diketahui pengaruh pencemaran pada lingkungan. Proses oksidasi dari logam yang menyebabkan perkaratan sebetulnya merupakan tanda – tanda adanya pencemaran tersebut di atas.
pertanian ( pemakaian pupuk dan pestisida ) juga memberikan kontribusi terhadap pencemaran logam.
Beberapa metode dalam mengolah limbah cair yang mengandung cemaran logam adalah perlakuan dengan pengendapan, koagulasi atau flokulasi, filtrasi, proses membran, pertukaran ion, proses biologi dan reaksi – reaksi kimia. Dalam penerapannya setiap metode memiliki keunggulan dan keterbatasan masing – masing dari aspek teknis, ekonomis dan dampak ikutannya.
Logam dapat juga menyebabkan timbulnya suatu bahaya pada makhluk hidup.Hal ini terjadi jika sejumlah logam mencemari lingkungan.Logam – logam tersebut berbahaya jika ditemukan dalam konsentrasi tinggi dalam lingkungan (dalam air, tanah dan udara ) karena logam tersebut memiliki sifat yang merusak jaringan tubuh makhluk hidup. Pencemaran lingkungan oleh logam – logam berbahaya dapat terjadi jika orang atau pabrik yang menggunakan logam tersebut untuk proses produksinya tidak memperhatikan keselamatan lingkungan.
2.3.1 Limbah Cair Logam Besi ( Fe )
dalam bentuk terlarut sebagai senyawa garam ferri ( Fe+³ ) atau garam ferro ( Fe²+ ); tersuspensi sebagai butir koloidal ( diameter < 1 mm ) atau lebih besar seperti Fe(OH)3 ;dan tergabung dengan zat organik atau zat padat yang anorganik
( seperti tanah liat dan partikel halus terdispersi ). ( Eaton et,al, 2005 ).
Besi berperan dalam aktivitas beberapa enzim seperti sitokrom dan flavo protein apabila tubuh tidak mampu mengekskresikan besi (Fe) akan menjadi akumulasi besi ( Fe ) karenanya kulit menjadi hitam. ( Juli Soemirat., 1996 )
Sekalipun Fe diperlukan oleh tubuh, tetapi dalam dosis besar dapat merusak dinding usus. Kematian seringkali disebabkan oleh rusaknya dinding usus, debu Fe juga dapat diakumulasi dalam alveori menyebabkan berkurangnya fungsi paru – paru ( Juli Soemirat.,1996 ).
2.3.2 Limbah Cair Logam Natrium ( Na )
Natrium elemental ( Na ) sangat reaktif, karenanya bila berada di dalam air akan terdapat sebagai suatu senyawa. Natrium sendiri bagi tubuh tidak merupakan benda asing, tetapi toksisitasnya tergantung pada gugus senyawanya. NaOH atau hidroksida Na ini sangat korosif.
2.3.3 Detergen
Detergen adalah Surfaktant anionik dengan gugus alkil ( umumnya C9 –
C15 ) atau garam dari sulfonat atau sulfat berantai panjang dari Natrium ( RSO¯3
Na+ dan ROSO¯3 Na+ )yang berasal dari derivate minyak nabati atau minyak
bumi ( fraksi parafin dan olefin ).
Proses pembuatan detergen dimulai dengan membuat bahan penurun tegangan permukaan, misalnya : p-alkilbenzena sulfonat dengan gugus alkil yang sangat bercabang, disintesis dengan polimerisasi propilena dan dilekatkan pada cincin benzena dengan reaksi alkilasi Friedel – Craft Sulfonasi, yang disusul pengolahan dengan basa.
Pada umumnya, detergen mengandung bahan – bahan berikut :
1. Surfaktan (surface active agent) merupakan zat aktif permukaan yang mempunyai ujung berbeda yaitu hydrophile ( suka air ) dan hydrophobe ( suka lemak ). Bahan aktif ini berfungsi menurunkan tegangan permukaan air sehingga dapat melepaskan kotoran yang menempel pada permukaan bahan. Surfaktan ini dapat berupa anionik ( Alkyl Benzene Sulfonate/ABS, Linier Alkyl Benzene Sulfonate/LABS, Alpha Olein Sulfonate/AOS ), Kationik ( Garam Ammonium ), Non ionic ( Nonyl phenol polyethoxyle ), Amphoterik ( Acyl Ethylenediamines ).
3. Filler (pengisi) adalah bahan tambahan detergen yang tidak mempunyai kemampuan meningkatkan daya cuci, tetapi menambah kuantitas atau dapat memadatkan dan memantapkan sehingga dapat menurunkan harga. Contoh sodium sulfate.
4. Additives adalah bahan suplemen/tambahan untuk membuat produk lebih menarik, misalnya pewangi, pelarut, pewarna dan sebagainya yang tidak berhubungan langsung dengan detergen. Additives ditambahkan untuk maksud komersialisasi produk. Contoh: Carboxy Methyl Cellulosa (CMC), di pakai agar kotoran yang telah dibawa oleh detergen ke dalam larutan tidak kembali ke bahan cucian pada waktu mencuci (anti dereposisi). Parfum dipakai agar cucian berbau harum, sedangkan air sebagai bahan pengikat.
Kemampuan detergen untuk menghilangkan kotoran yang menempel pada kain dan objek lain, mengurangi keberadaan kuman dan bakteri yang menyebabkan infeksi dan meningkatkan umur pemakaian kain dan lainnya sudah tidak diragukan lagi. Oleh karena banyaknya manfaat penggunaan detergen, sehingga menjadi bagian penting dalam kehidupan masyarakat modern.
2.4 Spektrofotometer Serapan Atom
Prinsip Dasar Spektrofotometer Serapan Atom
Prinsip penentuan metode ini berdasarkan pada penyerapan energi radiasi oleh atom-atom netral pada keadaan dasar dengan panjang gelombang tertentu yang menyebabkan tereksistansinya dalam berbagai tingkatan energi. Keadaan eksitasi ini tidak stabil dan kembali ke tingkat dasar dengan melepaskan sebahagian atau seluruh energi eksistansinya dalam bentuk radiasi. Sumber radiasi tersebut dikenal sebagai lampu katoda berongga (hallow chode lamp). Proses- proses yang terjadi dari saat pemasukan larutan dari unsur yang dianalisis sampai pencatatan adalah atomisasi, interaksi atom dengan berbagai bentuk energi dan penguluran intensitas frekuensi radiasi oleh alat pencatat. Unsur yang diperiksa harus dalam keadaan atom yang tidak tereksitasi, proses untuk menghasilkan atom tersebut disebut atomisasi.
Jika larutan yang mengandung suatu garam logam (atau sesuatu senyawa logam ) dihembuskan ke dalam suatu nyala (misalnya asetilena yang terbakar di udara ) dapatlah terbentuk uap yang mengandung atom–atom logam dalam gas ini dapat dieksitasi ke tingkatan energi yang cukup tinggi untuk memungkinkan pemancaran radiasi yang karakteristik dari logam tersebut. Atom – atom keadaan dasar ini mampu menyerap energi cahaya yang panjang gelombang resonansinya khas untuknya, yang pada umumnya adalah panjang gelombang radiasi yang dipancarkan atom – atom itu bila tereksitasi dari keadaan dasar.
akan diserap, dan jauhnya penyerapan akan berbanding lurus dengan banyaknya atom keadaan dasar yang berada dalam nyala. Inilah yang mendasari spektroskopi serapan atom ( AAS ).
Secara garis besar instrumentasi dari Spektrofotometer Serapan Atom dapat digambarkan sebagai berikut :
7. Penguat Arus 6. Detektor
5. Monokromator 4. Nyala
1. Sumber Cahaya
3. Udara Gas pembakar
8. Pencatat
2. Sampel
Gambar 2.3. Skematis Peralatan Spektrofotometer Serapan Atom Keterangan :
1. Sumber cahaya 2. Sampel
3. Udara – bahan bakar 4. Nyala
5. Monokromator 6. Detektor 7. Penguat Arus 8. Pencatat
[image:40.595.107.548.259.691.2]spectrum dengan ketelitian yang tinggi dan tajam, serta menghasilkan pancaran
cahaya yang diskrit dengan garis serapan yang kelebaran jalurnya 0.0001 . Nyala yang digunakan harus memberi suhu > 2000 K untuk mencapai suhu biasanya digunakan gas pembakar dalam gas pengoksida (oksigen) seperti udara dan nitrogen oksida (N2O). Gas pembakar yang umum dipakai adalah etena (C2H2), Hidrogen (H2) dan propane (C3H8). Monokromator pada SSA adalah memisahkan, mengisolasi serta mengontrol intensitas radiasi yang mencapai detector. Sampai saat ini detector tabung penggandaan foton (PMP = Photo Multipler Tube). Frekuensi resonansi yang telah dipisahkan oleh monokromator selanjutnya ditransmisikan ke amplifier.
0
A
2.5 Spektrum Inframerah
Seperti hal nya tipe penyerapan energi yang lain maka molekul akan tereksitasi ke tingkatan energi yang lebih tinggi bila menyerap radiasi inframerah. Penyerapan radiasi inframerah sesuai dengan perubahan energi.
spektrum inframerah kedua senyawa tepat sama maka dalam banyak hal dua senyawa tersebut adalah identik.
Alat yang menentukan spectrum serapan suatu senyawa disebut spektrofotometer inframerah.Spektrofotometer menentukan kekuatan dan kedudukan relatif dari semua serapan dalam daerah inframerah dan melukiskannya pada kertas grafik yang telah dikalibrasi. Gambar yang menyatakan intensitas serapan lawan bilangan gelombang disebut spektrum inframerah.
Bentuk dari puncak sering mengungkapkan identitasnya. Sebagai contoh,daerah N-H, sedangkan O-H biasanya memberikan puncak serapan yang lebar.
Dalam mempelajari spectra inframerah maka kita perlu memperhatikan bentuk intensitas.Sehingga kita sering mendapat serapan-serapan dengan tanda kuat (s), medium (m), tanda lemah (w), lebar atau tajam.
Untuk memperoleh informasi struktur dari spectra inframerah lebih lanjut, kita harus terbiasa dengan frekuensi atau panjang gelombang dimana sebagai gugus fungsional menyerap sebagai pelengkap informasi tersebut, dipakai tabel yang disebut tabel korelasi inframerah yang memuat informasi dimana berbagai gugus fungsional menyerap.
2.6 Proses Pengikatan Logam Oleh Kitosan Nanopartikel
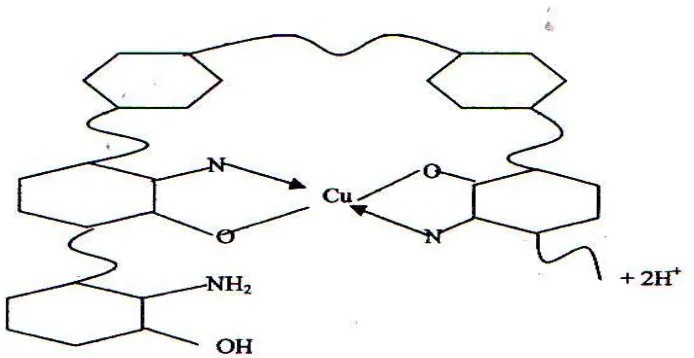
terkandung dalam limbah cair adalah prinsip penukar ion.Gugus amina khususnya nitrogen dalam kitosan akan bereaksi dan mengikat logam dari persenyawaan limbah cair. Kitosan yang tidak larut dalam air akan menggumpalkan logam menjadi flok – flok yang akan bersatu dan dapat dipisahkan dari air limbah. Kitosan dapat bekerja sempurna jika dilarutkan dalam larutan asam.(Marganof., 2003:Widodo et al., 2005). Proses koagulasi logam berat oleh kitosan seperti gambar berikut
Gambar 2.4. Mekanisme Pengikatan Logam Berat oleh Kitosan
Contoh di atas menggunakan logam Cu atau tembaga.Terjadi pengikatan Cu oleh gugus N (nitrogen ) dan O (oksigen). Logam Cu tersebut akan terikat atau terserap, terkumpul dan terjadi flok – flok logam. Kitosan dengan kemampuan daya ikat atau daya serapnya mampu menjadikannya jadi tidak berbahaya.
1. Dispersi dari polielektrolit dalam suspensi. 2. Adsorbsi antara permukaan solid- liquid.
3. Kompresi atau pemeraman dari polielektrik yang teradsorbsi.
trik yang telah terlingkupi oleh enjadi flok 4. Penyatuan dari masing –masing polielek
partikel untuk membentuk flok-flok kecil dan berkembang m yang lebih besar.
[image:44.595.205.432.314.417.2]Keempat proses tersebut digambarkan sebagai berikut :
Gambar 2.5 Tahap-tahap koagulasi polielektrolit kitosan (Kennedy, dkk.2001)
rutan elektrolit erupakan partikel bermuatan positif, sedangkan kitosan adalah polielektrolit Logam berat dan logam lain secara keseluruhan dalam la
m
bermuatan negatif, reaksi antara kedua partikel akan menuju ke arah penghilangan gradien muatan dan terbentuk senyawa produk yang tidak bermuatan ditunjukkan oleh gambar 2.5
[image:44.595.231.410.621.709.2]BAB III
BAHAN DAN METODOLOGI PENELITIAN
3.1 Lokasi Penelitian
Penelitian ini dilaksanakan di Laboratorium penelitian FMIPA USU Medan dan dilakukan dengan tahapan sebagai berikut :
1. Penyediaan Kitosan
2. Penyediaan Kitosan Nano Partikel
3.2 Bahan
Bahan – bahan yang digunakan dalam penelitian ini adalah sebagai berikut :
Kitin fluka
Asam Asetat Glasial p.a ( E.Merck )
Aquadest
HNO3Pekat p.a ( E.Merck )
NH3Pekat p.a ( E.Merck )
3.3 Alat
Alat yang digunakan dalam penelitian ini adalah : Labu Takar 1L, 100mL, 50mL
Gelas Ukur pyrex
Pipet volumetri pyrex
Neraca Analitis mettler A.E 200
SSA shimadzu
FTIR FESEM
Jartest fisher
Erlemeyer pyrex
Corong pisah pyrex
Flat kaca pyrex
Mortar Stop watch
Tabung Reaksi pyrex
3.4 Posedur Penelitian
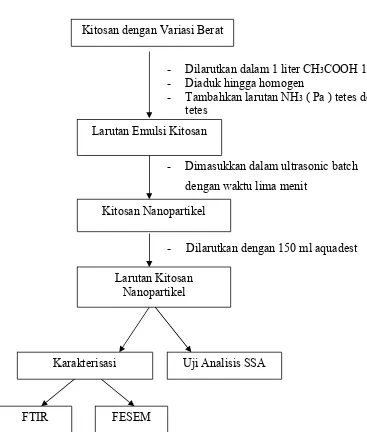
3.4.1 Pembuatan kitosan Nanopartikel
3.4.2 Bagan Penelitian Pembuatan Kitosan Nanopartikel (Metode Z.G. Hu, et al, 2006)
Kitosan dengan Variasi Berat
- Dilarutkan dalam 1 liter CH3COOH 1%
- Diaduk hingga homogen
- Tambahkan larutan NH3 ( Pa ) tetes demi
tetes
- Dimasukkan dalam ultrasonic batch dengan waktu lima menit
Larutan Emulsi Kitosan
Kitosan Nanopartikel
- Dilarutkan dengan 150 ml aquadest
Uji Analisis SSA
FTIR
Karakterisasi
Larutan Kitosan Nanopartikel
[image:49.595.126.493.148.580.2]FESEM
3.4.3 Bagan Preparasi Sampel
- Dimasukkan dalam 100 ml limbah cair detergen
- Diaduk selama 10 menit - Didiamkan
- Diambil larutan 50 ml Larutan Kitosan Nanopartikel
dengan variasi konsentrasi
_________________________________________________
Endapan Supernatan
[image:50.595.98.508.138.529.2]Analisa logam Fe dan Na dengan SSA
3.4.4 Daya Serap ( adsorbsi ) Kitosan Nanopartikel Terhadap Limbah Cair Logam Besi (Fe) dan Natrium (Na) Pada Detergen
Filtrat dari sample kitosan nanopartikel dengan variasi berat ( 200; 400; 600; 800; 1000) mg/L dilarutkan dalam asam asetat 1 % dicampur terhadap limbah cair sebanyak 100 ml kemudian di jartest selama 10 menit. Kemudian didiamkan selama 20 menit dan filtratnya diambil untuk pengukuran kadar logam besi ( Fe ) dan natrium ( Na ) yang ada pada sampel limbah cair detergen seterusnya diadakan pengukuran spektroskopi serapan atom (SSA) di laboratorium USU Medan.
3.4.5 Spektroskopi Inframerah ( FTIR =Fourier Transform Infra Red )
Lapis tipis atom partikel yang diperoleh dari hasil kitosan nanopartikel diletakkan pada alat ke arah sinar inframerah, hasil akan direkam ke dalam kertas berskala aliran kurva bilangan gelombang terhadap intensitas cahaya.
3.4.6 Analisa Field Emition Scanning Electron Microscopy ( FESEM )
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
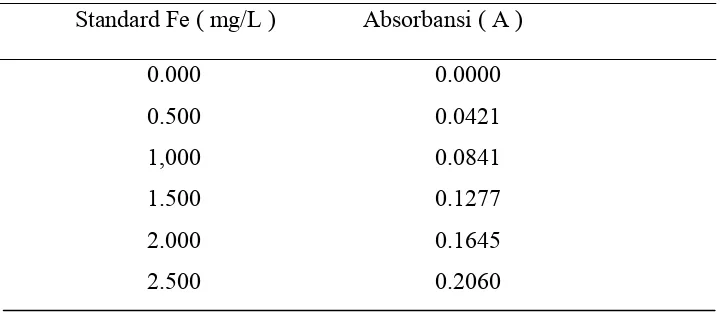
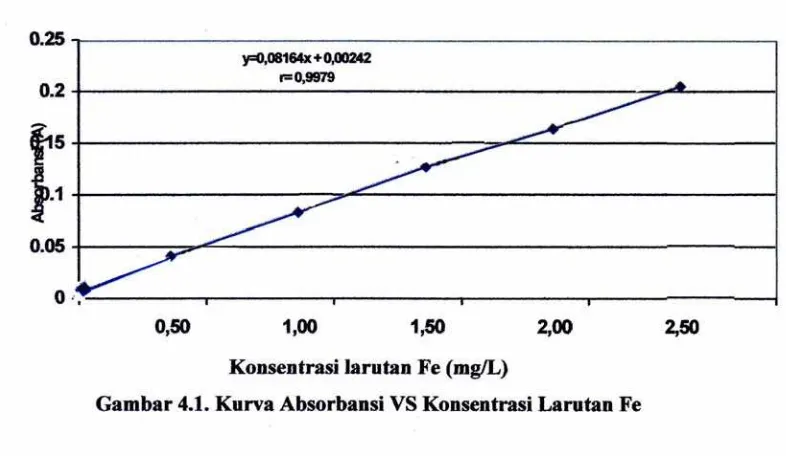
[image:52.595.148.512.373.530.2]Penyediaan Kitosan Nanopartikel telah diukur dengan FESEM (Field Emission Scanning Electron microscope) dengan ukuran 80 nm dan ditunjukkan pada lampiran dan data hasil pengukuran absorbansi dari larutan standard besi diplotkan terhadap konsentrasi larutan standard besi tertera pada Tabel 4.1 dibawah ini :
Tabel 4.1 Kurva Absorbansi Vs Konsentrasi Larutan Fe
____________________________________________________________ Standard Fe ( mg/L ) Absorbansi ( A )
____________________________________________________________
0.000 0.0000
0.500 0.0421
1,000 0.0841
1.500 0.1277
2.000 0.1645
2.500 0.2060
4.2 Penetapan Kadar Logam Besi (Fe)
4.2.1 Penentuan Persamaan Garis Regresi Dengan Metode Kurva Kalibrasi
Tabel 4.2 Data Hasil Penurunan Garis Regresi untuk Logam Besi(Fe)
No Xi Yi Xi – X Yi – Y (Xi – X)² (Yi –Y)² (Xi–X)(Yi–Y) __________________________________________________________________ 1 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000
2 0.5000 0.0421 - 1.0000 -0.0948 1.0000 0.0089 0.0947
3 1.0000 0.0941 - 0.5000 -0.0428 0.2500 0.0018 0.0214
4 1.5000 0.1377 0.0000 0.0082 0.0000 0.0000 0.0000
5 2.0000 0.1845 0.5000 0.0476 0.2500 0.0023 0.0238
6 2.5000 0.2260 1.0000 0.0891 1.0000 0.0079 0.0891
Σ 7.5000 0.6244 0.0000 0.0000 2.5000 0.0211 0.2291
Persamaan garis regresi untuk kurva dapat diturunkan dari persamaan garis :
y = ax + b dimana a = slope
b = intersept
09164 . 0 5000000 . 2 2041000 . 0 2
X Xi Y Yi X Xi aSehingga diperoleh harga slope (a) = 0.09164
Harga intersept (b) diperoleh melalui subtitusi harga (a) ke persamaan berikut :
y = a x + b b = y – ax
= 0,13688 – (0,09164 × 1,5000) = 0,13688 – 0,13630
= 0,00058
Sehingga diperoleh harga intersept (b) = 0,00058 Maka persamaan regresi yang diperoleh adalah : y = ax + b
= 0,09164 x + 0,00058
Maka persamaan garis regresi yang diperoleh adalah : Y = 0,09164 X + 0,00058
Perhitungan koefisien korelasi (r) dapat ditentukan sebagai berikut :
9978 , 0 2296228 . 0 2291 . 0 021090654 . 0 50000000 . 2 2291 . 0 021090654 . 0 50000000 . 2 2291 . 0 2 2
Xi X Yi YY Yi X Xi r
Jadi koefisien korelasi pada penetapan kadar Fe dengan spektrofotometri serapan atom adalah ( r ) = 0,9978
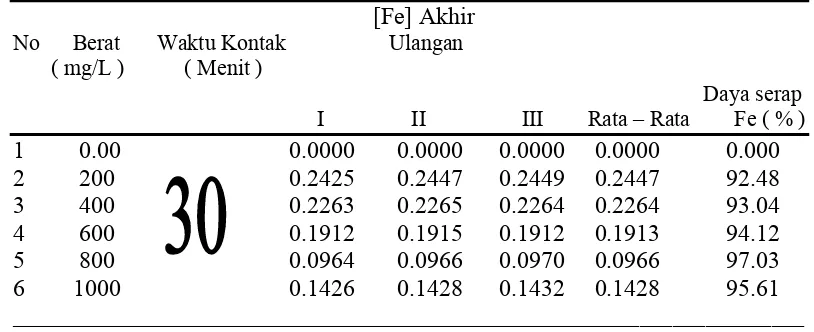
4.2.2 Data Hasil Pengukuran Daya Serap Ion Fe
Kitosan nanopartikel adalah suatu zat yang dapat menyerap ion Fe yang terdapat dalam limbah cair detergen. Untuk menentukan persentase daya serap kitosan nanopartikel terhadap limbah cair detergen dapat dibuat suatu perbandingan konsentrasi ion Fe yang ada dalam limbah dengan kadar ion Fe setelah dilakukan reparasi sampel. Dari data yang diperoleh bahwa konsentrasi awal ion Fe dalam limbah detergen adalah sebesar 3,2550 mg/L.
tabel dan didapat nomor penyerapannya. Data pengukuran daya serap Kitosan Nanopartikel untuk menurunkan kadar Fe dalam limbah detergen.
Tabel 4.3 Data Daya Serap Fe oleh Kitosan Nanopartikel Pada Limbah Cair Detergen
[Fe] Akhir
No Berat Waktu Kontak Ulangan
( mg/L ) ( Menit )
Daya serap
I II III Rata – Rata Fe ( % )
1 0.00 0.0000 0.0000 0.0000 0.0000 0.000 2 200 0.2425 0.2447 0.2449 0.2447 92.48 3 400 0.2263 0.2265 0.2264 0.2264 93.04 4 600 0.1912 0.1915 0.1912 0.1913 94.12 5 800 0.0964 0.0966 0.0970 0.0966 97.03 6 1000 0.1426 0.1428 0.1432 0.1428 95.61 ________________________________________________________________________
[image:56.595.107.514.232.398.2]92.48
93.04
94
97.03
95.61
90
91
92
93
94
95
96
97
98
0.2
0.4
0.6
0.8
1
D a y a S e ra p (% )
[image:57.595.118.516.136.424.2]Konsentrasi Larutan Fe (mg/L)
Gambar 4.2. Kurva Daya Serap Vs Konsentrasi Larutan Fe
4.2.3 Perhitungan % Penurunan Kadar Konsentrasi Ion Fe dalam Sampel Penurunan kadar ion Fe dalam sampel dinyatakan dalam (%) dengan membandingkan konsentrasi besi yang terserap terhadap konsentrasi awal seperti pada persamaan berikut ini :
% penyerapan kitosan =
100%awal Fe akhir [Fe] -awal Fe x
% penyerapan kitosan = 100% 2250 , 3 0966 , 0 2250 , 3 x
4.3 Penetapan Kadar Logam Natrium (Na)
[image:58.595.111.512.227.328.2]Data hasil pengukuran absorbansi dari larutan standard Natrium diplotkan terhadap konsentrasi larutan standard natrium tertera pada Tabel 4.4 di bawah ini :
Tabel 4.4 Kurva Absorbansi Vs Konsentrasi Larutan Na Standard Na ( mg/L ) Absorbansi ( A ) 0.0000 0.0000 0.0200 0.0416
0.0400 0.0607
0.0600 0.0851
0.0800 0.1031
0.1000 0.1249
[image:58.595.118.510.237.572.2]4.3.1 Penentuan Persamaan Garis Regresi Dengan Metode Kurva Kalibrasi
Hasil pengukuran absorbansi dari suatu larutan standard dengan diplotkan terhadap konsentrasi larutan standard sehingga diperoleh kalibrasi berupa garis linier seperti pada gambar. Persamaan garis regresi untuk kurva dapat diturunkan dengan metode Least Square pada tabel di bawah ini.
Tabel 4.5.Data Hasil Penurunan Persamaan Garis Regresi untuk Logam Na
No Xi Yi Xi – X Yi – Y (Xi – X)² (Yi –Y)² (Xi–X)(Yi–Y) 1 0.0200 0.0416 -0.0400 -0.0415 0.0016 0.0017 0.0016
2 0.0400 0.0607 -0.0200 -0.0224 0.0004 0.0005 0.0004
3 0.0600 0.0851 0.0000 0.0200 0.0000 0.0000 0.0000
4 0.0800 0.1031 0.0200 0.0418 0.0004 0.0004 0.0004
5 0.1000 0.1249 0.0400 0.0000 0.0016 0.0017 0.0017 Σ 0.3000 0.4154 0.0000 0.0000 0.0040 0.0044 0.0042
Dimana X rata-rata : X = Σ X / n = 0,3000/5 = 0,06 Harga Y rata-rata : Y = Σ Y / n = 0,4154/5 = 0,08308
Persamaan garis regresi untuk kurva dapat diturunkan dari persamaan garis : y = ax + b
dimana : a = slope b = intersept
045 , 1 0040000 . 0 0041800 . 0 2
X Xi Y Yi X Xi aHarga intersept ( b ) diperoleh melalui substitusi harga ( a ) ke persamaan
berikut :
y = ax + b b = y – ax
= 0,08308 – ( 1,045 x 0,06 ) = 0,08308 – 0,0627
= 0,02038
Sehingga diperoleh harga intersept ( b ) = 0,02038 Maka persamaan regresi yang diperoleh adalah :
Y = 1,045 x + 0,02038
Perhitungan koefisien korelasi ( r ) dapat ditentukan sebagai berikut :
9992 , 0 999183 , 0 004183417 . 0 041800000 . 0 0000175 . 0 0418 . 0 2 2
Xi X Yi YY Yi X Xi r
4.3.2 Data Hasil Pengukuran Daya Serap Ion Na
Kitosan nano adalah suatu zat yang dapat menyerap ion Na yang terdapat dalam limbah cair detergen. Untuk menentukan persentase daya serap kitosan nanopartikel terhadap limbah cair detergen dapat dibuat suatu perbandingan konsentrasi ion Na yang ada dalam limbah dengan ion Na setelah dilakukan reparasi sampel. Dari data diperoleh bahwa konsentrasi awal ion Na dalam limbah detergen adalah sebesar 15,445 mg/L.
[image:61.595.114.511.540.695.2]Setelah dilakukan pengukuran dengan menggunakan metode kurva kalibrasi dengan cara mensubstitusikan nilai y (absorbansi) yang diperoleh dari hasil pengukuran terhadap persamaan garis regresi dari kurva kalibrasi y = ax + b. Kurva regresi yang didapatkan dari data adalah y = 1,045x + 0,02038. Sehingga diperoleh konsentrasi ion Na yang ada dalam limbah cair detergen pada tabel dan didapat nomor penyerapannya. Data pengukuran daya serap Kitosan Nanopartikel untuk menurunkan kadar Na dalam limbah detergen.
Tabel 4.6 Data Daya Serap Na oleh Kitosan Nanopartikel Pada Limbah Detergen
__________________________________________________________________ [Na] Akhir
No Berat Waktu Kontak Ulangan
( mg/L ) ( Menit )
Daya serap
I II III Rata – Rata Na ( % )
Dari tabel penyerapan ion Na oleh kitosan nanopartikel diperoleh penyerapan yang paling optimal sebesar 96,43 % dengan konsentrasi ion Na akhir = 0,5512 mg/L. 93.83 94.79 95.12 96.43 95.78 92 92.5 93 93.5 94 94.5 95 95.5 96 96.5 97
0.02 0.04 0.06 0.08 1
[image:62.595.111.513.217.489.2]Ab so rb a n si (A ) Konsentrasi Larutan Na (mg/L)
Gambar 4.4. Kurva Daya Serap Vs Konsentrasi Larutan Na 4.3.3 Perhitungan % Penurunan Kadar Konsentrasi Ion Na dalam Sampel
Penurunan kadar ion Na dalam sampel dinyatakan dalam % dengan membandingkan konsentrasi natrium yang terserap terhadap konsentrasi awal seperti pada persamaan berikut :
% penyerapan kitosan =
100%awal Na akhir [Na] -awal Na x
% penyerapan = 100% 445 , 15 5512 , 0 445 . 15 x
4.4 Pembahasan
4.4.1 Daya Serap Kitosan Nanopartikel Untuk Menurunkan Kadar Besi (Fe) dan Natrium(Na) Dalam Limbah Cair Detergen
Kitosan Nanopartikel bereaksi dengan ion logam besi (Fe) dan logam natrium (Na) yang ada pada limbah cair detergen membentuk senyawa kompleks, dimana reaksi pertukaran ion, penyerapan dan pengkhelatan terjadi pada proses pembentukan senyawa kompleks tersebut.
Banyak logam–logam berat yang mampu diserap oleh Kitosan Nanopartikel, antara lain : Cu²+ , Zn²-, Fe²+, Co²+, dan lain–lain. Biasanya logam– logam berat tersebut ada pada limbah cair industri yang dibuang ke sungai atau ke laut yang akhirnya mempunyai dampak cukup besar terhadap ekosistem lingkungan mengakibatkan terjadinya ketidakseimbangan alam.
Berdasarkan kekuatan medan ligan dalam spektrokimia sebagai berikut : CN > NO2 > NH3 > H2O > F > OH > Cl > Br > I
Dalam penelitian ini terbukti bahwa terjadi penurunan konsentrasi ion Fe dan ion Na dengan membandingkan konsentrasi ion Fe dan Na dalam limbah cair detergen sebelum reparasi sampel yaitu 3,2550 mg/L dan 15,445 mg/L.
Penyerapan ion Fe dan Na paling besar terjadi pada konsentrasi ion Fe akhir 0,0966 mg/L dan ion Na 0,5512mg/L mempunyai daya serap optimal ion Fe 97,03 % dan ion Na 96,43 %.
Kemudian pada konsentrasi akhir Fe dan Na 0,1426 dan 0,6503 daya serapnya turun menjadi 95,61 % dan 95,78 %. Hal ini terjadi karena kejenuhan larutan terjadi pada konsentrasi akhir ion Fe 0,1426 dan konsentrasi akhir ion Na 0,6503 tersebut.
4.4.2 Analisa Field Emition Scanning Electron Microscopy (FESEM)
Hasil karakterisasi Kitosan Nanopartikel dilakukan dengan analisis Field Scanning Electron Mikroscope (FESEM). Alat ini berfungsi untuk menunjukkan bentuk (morfologi) dan perubahan dari suatu permukaan bahan. Partikel Kitosan Nano terbentuk dengan sempurna dan homogen. Hal ini ditunjukkan dengan foto FESEM yang diperbesar 1000 kali.Dapat dilihat pada Lampiran .
Tabel 4.7. Bilangan Gelombang Derajat Deasetilasi
Ikatan Bilangan Gelombang Bilangan gelombang Literatur (cm ) Yang Didapat (cm ) __________________________________________________________________ Ikatan N-H (amina) 3500-3100 3425,6
Ikatan C-H 3000-2800 2877,8 Ikatan C=O (amida) 1670-1600 1651,1 Ikatan C-N 1400-1000 1381,0
__________________________________________________________________ Sumber : Fessenden, J.R 1999
4.4.4 Penyerapan Kitosan Nanopartikel Dengan Variasi Berat Kitosan Nanopartikel
Mekanisme penyerapan adalah akumulasi atau penggumpalan partikel pencemar dari larutan ke permukaan suatu penyerap. Menurut Kurita (1992) ada beberapa faktor yang mempengaruhi proses adsorbsi antara lain konsentrasi, sifat adsorben dan adsorbat serta waktu kontak antara adsorben dan adsorbat.
Kitosan sebagai polimer kationik yang dapat mengikat logam dimana gugus amino yang terdapat pada kitosan berikatan dengan logam dapat membentuk ikatan kovalen. Dalam hal ini terjadi gaya-gaya yang bekerja antara molekul-molekul adsorbat pada permukaan adsorben yakni gaya van der Walls, gaya elektrostatik, ikatan hidrogen serta ikatan kovalen.
Dari Tabel 4.3. Penyerapan optimum ion Fe dengan waktu kontak 30 menit terjadi pada berat 800 mg sebesar 97,03 % dengan konsentrasi akhir ion Fe 0,0966 mg/L. Sedangkan pada berat 1000 mg kembali terjadi kenaikan konsentrasi akhir ion Fe sebesar 0,1428 mg/L.
Dari Tabel 4.6. Penyerapan optimum ion Na dengan waktu kontak 30 menit terjadi pada berat 800 mg sebesar 96,43 % dengan konsentrasi akhir ion Na 0,5512 mg/L. Sedangkan pada berat 1000 mg kembali terjadi kenaikan konsentrasi akhir ion Na sebesar 0,6507 mg/L.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Kitosan Nanopartikel mempunyai daya serap logam besi (Fe) sebesar 97,03% dengan waktu kontak 30 menit pada konsentrasi akhir Fe 0,0966 mg/L, dan daya serap logam natrium (Na) sebesar 96,43% dengan waktu kontak 30 menit pada konsentrasi akhir Na 0,5512 mg/L.
5.2 Saran
DAFTAR PUSTAKA
Agusnar, H. 1990. Kitin dan Kitosan sebagai Fasa dalam Kromatografi Gas Untuk Pemisahan Hidrokarbon. Tesis M.Sc. UKM.
Agusnar, H. 2007. Kimia Lingkungan. USU Press.
Alimuniar, A., Zainuddin, R. 1998.An Economical Technque for Produsing, Advantage integration chitin and chitosan, London, Elvieser. P. 627. Berger, J., Reist, M., Mayera, J.M.,O.Feltb. N.A Peppas, R.Gurny.2004. Strukture
and Interaction In Covalently and Ionocally Crosslinked Chitosan Hydragels For Biomedical Application. Europen Journal of Pharm And Biopharm 57: 19-34.
Cheung, W. H., S. Szeto, and G. McKay.2008. Enhancing the adsorption capacities of acid dyes by chitosan nano particles. Departmen of Chemical Engineering, University of Science and Technology, Clear Water Bay, Kowloon, Hong Kong.
Eaton, Andrew, et al. 2005. Standard Methods for Examination of Water and
Wastewater. 21 st Edition. American Public Heath association.
Marryland USA.
Fernandez-Kim, S.O. 2004. Phsycochemical and Functional Properties of Crawfish Chitosan as Effected by Different Processing Protocols. Thesis The Departement of Foo Science.Seoul National University. Pp 6-8; 28- 29.
Fessenden, Ralp J:Fessenden, Joan, S. 1994. Kimia organic. Edisi III. Jilid 2;Erlangga; Jakarta.
Guibal, E. 2004. Metal Ion Interaction with Chitosan A Review. Separation and Purification Tecnology. 38:43.
Kim, S. D., and Park-Yoon, B. 2001.Effect on The Removal of Pb2+ from Aqueous Solution by Crab Shell. J. of Chem. and Biotech. 76-179.
Marganof.2003.Potensi Limbah Udang sebagai Penyerap Logam Berat (Timbal,Kadmium, dan Tembaga) di Perairan. Available from:
tumoutu.net/70207134/marganof.pdf.
Millot, C., Mcbrien,J.,Allen, S. and Guibel, E.1998. Influence of Pschochemical and Structural Characteristic of Chitosan Falkes on Molybdate Sorption. J.Applied. Polymer Science. 68:571-580
Muzzarelli, R., Baldassare, V ., Conti, F., Ferrara, P., and Biagini, G. 1988. Biological Activity of Chitosan: Ultrastructural Study. Biomaterial. 9:247-252.
Onsoyen, E., and Skaugrud, O. 1990. Metal Recovery Using Chitosan. J Chem Tecnol Biotecnol. 49:395-404.
Rhoades, J., and Roller, S. 2000. Antimicrobial Actions of Degraded and Native Chitosan Against Spoilage Organism in Laboratory Media and Foods. American Society for Microbiology. Pp 80-86.
Szeto Yau-shan and Zhingang Hu. 2007. Article Exploring nanochitosan. ATA Journal for Asia on Textile & Apparel. Cina.
Sugiharto. 1987. Dasar-dasar Pengelolaan Air Limbah.Rineka Cipta; Jakarta. Sukardjo, 1990. Kimia Anorganik. Rineka Cipta; Jakarta
Wan-Ngah, W. S., and Isa, I.M. 1998. Comparison Study Of Copper Ion Adsorption. On Chitosan, Dowek A-I and Zeolit 225. J. Applied Polymer Science. 67:1067-1070
Widodo, A., Mardiah., Prasetyo. 2005. Potensi Kitosan dari Sisa Udang sebagai Koagulan Logam Berat Limbah Cair Industri Tekstil. Availabel from : http://www.kemahasiswaan.its.ac.id/files/PKMI%20ITS%20Agus%20&Mardiah.
Gambar: Alat Jartest
[image:74.595.122.512.460.710.2]