PENYEDIAAN DAN KARAKTERISASI
KITOSAN GLUTARALDEHIDA SEBAGAI ADSORBEN UNTUK
MENENTUKAN KADAR ION LOGAM CU DENGAN SSA
(SPEKTROFOTOMETRI SERAPAN ATOM)
SKRIPSI
INDAH LESTARI RAHMAN
100822046
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PENYEDIAAN DAN KARAKTERISASI
KITOSAN GLUTARALDEHIDA SEBAGAI ADSORBEN UNTUK
MENENTUKAN KADAR ION LOGAM CU DENGAN SSA
(SPEKTROFOTOMETRI SERAPAN ATOM)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
INDAH LESTARI RAHMAN
100822046
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PENYEDIAAN DAN KARAKTERISASI KITOSAN GLUTARALDEHIDE SEBAGAI ADSORBEN UNTUK MENENTUKAN KADAR ION LOGAM CU DENGAN SSA (SPEKTROFOTOMETRI SERAPAN ATOM) Kategori : SKRIPSI
Nama : INDAH LESTARI RAHMAN Nomor Induk Mahasiswa : 100822046
Program Studi : SARJANA (S1) KIMIA Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Diluluskan di
Medan, Juli 2012
Komisi pembimbing :
Pembimbing 2 Pembimbing 1
Prof. Dr. Zul Alfian, M.Sc. Prof. Dr. Harry Agusnar, M.Sc., M.Phill NIP. 195504051983031002 NIP. 195308171983031002
Diketahui/Disetujui oleh :
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PENYEDIAAN DAN KARAKTERISASI KITOSAN GLUTARALDEHIDE SEBAGAI ADSORBEN UNTUK MENENTUKAN KADAR ION LOGAM
CU DENGAN SSA (SPEKTROFOTOMETRI SERAPAN ATOM)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juli 2012
PENGHARGAAN
Bismillahirrahmanirrahim,
Alhamdulillah, segala puji bagi ALLAH Tuhan Semesta Alam yang dengan curahan
cinta-Nya saya dapat menyelesaikan skripsi ini sebagai salah satu persyaratan untuk
meraih gelar Sarjana Kimia pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara. Serta shalawat dan salam saya sampaikan pada Rasulullah,
Muhammad SAW, sosok yang sangat saya idolakan, semoga kelak mendapat syafaat
Beliau. Amin.
Selanjutnya saya menyampaikan penghargaan dan cinta kasih tulus kepada
Ayahanda tersayang Abdurrahman Ayun,SH,S.Pd, yang dengan doa dan tetes peluhnya,
mengorbankan banyak hal untuk membesarkan dan mendidik saya dengan penuh cinta,
juga kepada Ibunda tersayang Dra. Anizar yang dengan doa tiada henti dan cintanya telah
mengajarkan banyak hal untuk kehidupan saya sampai detik ini, juga kepada Abangda
tersayang Aulia Hazairin Rahman, S.Pd serta kedua adinda tercinta Habib Muhazirin
Mahfudz Umri Rahman dan Nusa Intan Tata Rahmani, dan untuk seluruh keluarga yang
telah memberikan banyak dukungannya kepada saya, saya ucapkan terima kasih banyak.
Selesainya Skripsi ini juga tidak lepas dari bimbingan dan bantuan dari berbagai
pihak. Dengan segala kerendahan hati, saya mengucapkan terima kasih yang
sebesar-besarnya kepada:
1. Prof. Dr. Harry Agusnar, M.Sc, M.Phill selaku pembimbing I dan Prof. Dr. Zul
Alfian M.Sc selaku dosen pembimbing II yang telah banyak memberikan
pengarahan dan bimbingan hingga terselesaikannya skripsi ini.
2. Prof. Dr. Harlem Marpaung dan Ibu Juliati Tarigan, M.Si selaku Dosen Penguji
yang telah memberikan masukan dan saran yang sangat membantu dalam
menyempurnakan skripsi ini.
3. Dr. Rumondang Bulan. MS dan Dr. Darwin Yunus, MS selaku Ketua dan
4. Bapak dan Ibu Dosen yang telah memberikan ilmunya dan pengetahuan selama
masa studi saya di FMIPA USU.
5. Kepala, staf dan seluruh asisten Laboratorium Kimia Analitik dan Laboratorium
Penelitian FMIPA USU Medan yang telah memberikan segala fasilitas terbaik
selama saya melakukan penelitian terutama untuk Bang Man, terima kasih atas
masukan, bantuan dan kerjasamanya.
6. Teman seperjuangan saya : Ratri Karmilaningtyas dan teman-teman yang selalu
ada memberi dukungan dalam segala aktivitas : Julia Wansiska, Sari Wulan,
Ardiansyahputra Hasibuan, Jefri Aldi, Widayan Sucinta, Lisma Sari, kak Wati
serta teman-teman yang tergabung dalam Ekstensi Kimia 2010 yang telah
memberikan semangat dan motivasi kepada saya.
7. Keluarga Besar Yaspend Abdi negara Binjai : Ibu Heppiani Dahlia, SE, M.Si
selaku Ketua Yayasan dan Keluarga Besar SMA Abdi Negara Binjai : Ibu Nila
Hevy Zulianty, Ibu Susi Rahayu, dan rekan-rekan guru lainnya yang selalu
memberikan semangat kepada saya.
8. Keluarga Besar SMP Negeri 6 Binjai : Ibu Eka Mutia Khairuma, M.Psi selaku
Kepala Sekolah dan semua rekan-rekan guru SMP Negeri 6 Binjai, terima kasih
untuk semangat dan dukungan yang telah diberikan.
Saya menyadari bahwa skripsi ini masih banyak kekurangan, karena keterbatasan
saya baik dalam literatur maupun pengetahuan. Oleh karena itu, saya mengharapkan
kritik dan saran yang membangun demi kesempurnaan skripsi ini, dan semoga skripsi ini
bermanfaat bagi kita semua. Amin.
Medan, Juli 2012
ABSTRAK
Telah dilakukan penelitian untuk menganalisis kadar ion tembaga menggunakan ikat silang Kitosan glutaraldehida sebagai adsorben. Kitosan bead dibuat dari kitosan yang telah ditambahkan dengan asam asetat encer dan menjadi gel dengan penambahan NaOH. Kitosan bead ditambahkan dengan larutan Glutaraldehida 2,5% dan direndam dengan aseton kemudian dikeringkan sehingga diperoleh ikat silang kitosan glutaraldehida. Sebanyak 2 gram ikat silang kitosan glutaraldehida dimasukkan kedalam beaker glass lalu ditambahkan dengan 20 mL larutan standar tembaga (Cu2+) 0,2 gr/mL, diaduk selama 10 menit dan dibiarkan. Kemudian lapisan bagian atas diambil dan diuji dengan Spektrofotometer Serapan atom. Hasil penyerapan ion logam Cu2+ yang diperoleh adalah sebesar 73%.
THE PREPARATION AND CHARACTERISTIC OF CHITOSAN GLUTARALDEHYDE AS ADSORBENT TO MEASURED THE LEVELS OF
CUPRUM METAL IONS WITH ATOMIC ABSORPTION SPECTROPHOTOMETRY (AAS) METHODE
ABSTRACT
There was an experiment to analyzed the levels of Cuprum metal ions (Cu2+) with cross-linked of chitosan glutaraldehyde as adsorbent. Chitosan bead has prepared from chitosan that was dissolved with watery acetic acid and coagulated with sodium hydroxide. Chitosan bead was added with 2,5% glutaraldehyde solution and aseton, then dry it to get Cross-linked of chitosan glutaraldehyde. Put 2 gram of chitosan glutaraldehyde into beakerglass and put on 20 mL of metal solution (Cu2+) 0,2 mg/L, then stirred by 10 minutes and leat it. Then take the top of layer and measured by Atomic Absorption Spectrophotometry. The result of cuprum metal ions (Cu2+) absorption was 73%.
DAFTAR ISI
Halaman
Persetujuan ii
Pernyataan iii
Penghargaan iv
Abstrak vi
Abstract vii
Daftar Isi viii
Daftar Tabel x
Daftar Gambar xi
Daftar Lampiran xii
Bab 1 Pendahuluan 1
1.1. Latar Belakang 1
1.2. Identifikasi Masalah 3
1.3. Pembatasan Masalah 3
1.4. Tujuan Penelitian 4
1.5. Manfaat Penelitan 4
1.6. Metodologi Penelitian 4
1.7. Lokasi Penelitian 4
Bab 2 Tinjauan Pustaka 5
2.1. Kitosan 5
2.1.1. Struktur Kitosan 6
2.1.2. Sifat-sifat Kimia dan Biologi kitosan 7 2.1.3. Kelarutan Kitosan 8
2.2. Glutaraldehide 8
2.2.1. Struktur Glutaraldehide 9
2.3. Logam Tembaga (Cu) 9
2.3.1. Logam 9
2.3.2. Tembaga (Cu) 10
2.3.3. Efek toksik Tembaga 11
2.4. Adsorbsi 11
2.4.1. Pengertian Adsorbsi 11
2.4.2. Adsorben 13
Bab 3 Metodologi Penelitian 18
3.1. Bahan 18
3.2. Alat 18
3.3. Prosedur Penelitian 19
3.3.1. Pembuatan Larutan Asetat 5% 19 3.3.2. Pembuatan Larutan NaOH 2M 19 3.3.3. Pembuatan larutan Glutaraldehide 2,5% 19 3.3.4. Pembuatan Larutan standar Ion Cu 19 3.3.5. Pembuatan Kitosan Bead 20 3.3.6. Pembuatan Ikat Silang Kitosan dengan Glutaraldehide 20 3.3.7. Kitosan Glutaraldehide sebagai Adsorben ion logam Cu 21 Dengan variasi berat 2 g
3.4. Bagan Penelitian 21
3.4.1. Pembuatan Kitosan Bead/manik 21 3.4.2. Pembuatan Ikat silang Kitosan dengan Glutaraldehide 22 3.4.3. Pembuatan Larutan Seri Standar logam tembaga 23
0,2; 0,4; 0,6; 0,8; dan 1,0 mg/L
3.4.4. Kitosan Glutaraldehide sebagai adsorben ion logam Cu 24
Bab 4 Hasil dan Pembahasan 25
4.1. Hasil Penelitian 25
4.1.1. Ion Tembaga (Cu2+) 25 4.1.1.1. Penurunan Persamaan Garis Regresi Dengan Metode 26
Least Square
4.1.1.2. Koefisien Korelasi 28 4.1.2. Ikat silang Kitosan Glutaraldehide dengan 28
Ion tembag (Cu2+)
4.1.2.1. Penurunan Persamaan Garis Regresi Dengan Metode 29 Least Square
4.1.2.2. Koefisien Korelasi 30 4.1.2.3. Persentase (% penurunan konsentrasi logam tembaga 31 4.1.3. Mekanisme reaksi ikatan silang antara Kitosan dengan 33
Glutaraldehide
4.2. Pembahasan 34
Bab 5 Kesimpulan Dan Saran 35
5.1. Kesimpulan 35
5.2. Saran 35
Daftar Pustaka 36
DAFTAR TABEL
Halaman
Tabel 4.1. Kondisi Alat SSA Merek Shimadzu Tipe AA-6300 Pada Pengukuran 25 Konsentrasi ion Tembaga (Cu2+)
Tabel 4.2. Data Absorbansi Larutan Standar Ion Tembaga (Cu2+) 25 Tabel 4.3. Penurunan Persamaan Garis Regresi Untuk Penentuan Konsentrasi 26
Ion Tembaga (Cu2+) berdasarkan Pengukuran Absorbansi Larutan Standar Ion Tembaga (Cu2+)
Tabel 4.4. Data Absorbansi Larutan Standar Ion Tembaga (Cu2+) 28 Dengan ikat silang Kitosan Glutaraldehide
Tabel 4.5. Penurunan Persamaan Garis Regresi Untuk Penentuan Konsentrasi 29 Ion Tembaga (Cu2+) berdasarkan Pengukuran Absorbansi Larutan Standar Ion Tembaga (Cu2+) dan ikat silang Kitosan Glutaraldehide Tabel 4.6. Data persentase (%) penurunan konsentrasi logam tembaga dalam 31
DAFTAR GAMBAR
Halaman
Gambar 1.1. Reaksi pembentukan kitosan dari kitin 1 Gambar 1.2. Struktur Glutaraldehida 3 Gambar 2.1. Struktur kitosan 6 Gambar 2.2. Struktur Glutaraldehide 9 Gambar 2.3. Komponen-Komponen Spektrofotometer Serapan Atom 14 Gambar 4.1. Kurva Kalibrasi Larutan Standar Ion Tembaga (Cu2+) 26 Gambar 4.2. Persentase (%) Penurunan Konsentrasi Logam tembaga dalam 32
DAFTAR LAMPIRAN
Halaman
ABSTRAK
Telah dilakukan penelitian untuk menganalisis kadar ion tembaga menggunakan ikat silang Kitosan glutaraldehida sebagai adsorben. Kitosan bead dibuat dari kitosan yang telah ditambahkan dengan asam asetat encer dan menjadi gel dengan penambahan NaOH. Kitosan bead ditambahkan dengan larutan Glutaraldehida 2,5% dan direndam dengan aseton kemudian dikeringkan sehingga diperoleh ikat silang kitosan glutaraldehida. Sebanyak 2 gram ikat silang kitosan glutaraldehida dimasukkan kedalam beaker glass lalu ditambahkan dengan 20 mL larutan standar tembaga (Cu2+) 0,2 gr/mL, diaduk selama 10 menit dan dibiarkan. Kemudian lapisan bagian atas diambil dan diuji dengan Spektrofotometer Serapan atom. Hasil penyerapan ion logam Cu2+ yang diperoleh adalah sebesar 73%.
THE PREPARATION AND CHARACTERISTIC OF CHITOSAN GLUTARALDEHYDE AS ADSORBENT TO MEASURED THE LEVELS OF
CUPRUM METAL IONS WITH ATOMIC ABSORPTION SPECTROPHOTOMETRY (AAS) METHODE
ABSTRACT
There was an experiment to analyzed the levels of Cuprum metal ions (Cu2+) with cross-linked of chitosan glutaraldehyde as adsorbent. Chitosan bead has prepared from chitosan that was dissolved with watery acetic acid and coagulated with sodium hydroxide. Chitosan bead was added with 2,5% glutaraldehyde solution and aseton, then dry it to get Cross-linked of chitosan glutaraldehyde. Put 2 gram of chitosan glutaraldehyde into beakerglass and put on 20 mL of metal solution (Cu2+) 0,2 mg/L, then stirred by 10 minutes and leat it. Then take the top of layer and measured by Atomic Absorption Spectrophotometry. The result of cuprum metal ions (Cu2+) absorption was 73%.
BAB 1
PENDAHULUAN
1.1.Latar Belakang
Udang merupakan salah satu komoditas perikanan Indonesia yang mulai di lirik oleh
pasar dunia. Selama ini sebagaimana yang diketahui, limbah udang di Indonesia hanya
digunakan untuk pakan ternak, hidrolisat protein, silase, bahan baku terasi, petis dan
kerupuk udang. Sementara itu, limbah udang di negara-negara maju seperti jepang dan
Amerika Serikat telah diisolasi kitinnya. Kitin dalam kulit udang sebesar 15-20% dan
dapat diisolasi melalui proses deproteinase yang diikuti dengan demineralisasi. Kitin juga
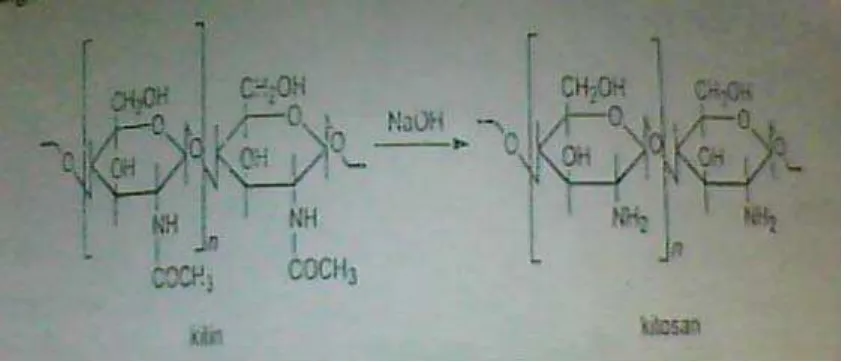
dapat diubah menjadi kitosan setelah lebih dari gugus asetil (CH3CO-)-nya dihilangkan.
Ternyata penghilangan gugus asetil kitin meningkatkan kelarutannya, sehingga
kitosan lebih banyak digunakan dari pada kitin, antara lain di industri kertas, pangan,
farmasi, fotografi, kosmetika, fungisida,dan tekstil sebagai pengemulsi, koagulan,
pengkelat serta pengental emulsi (Batchelor, 2004). Selain itu kitosan juga bersifat
nontoksik, biokompatibel, dan biodegradabel sehingga aman digunakan.
Kitosan larut dalam pelarut organik, HCl encer, HNO3 encer tetapi tidak larut
dalm basa kuat dan H2SO4. Dalam kondisi asam berair, gugus amino kitosan akan
menangkap H dari lingkungannya, sehingga gugus amino-nya terprotonisasi menjadi –
NH3. Gugus –NH3 inilah yang menyebabkan kitosan bertindak sebagai garam, sehingga
dapat larut dalam air. Selain itu muatan positif –NH3 dapat digunakan dimanfaatkan
untuk adsorpsi (penyerapan) zat warna anionik (bermuatan negatif). Sementara adsorpsi
zat warna kationik dan kation logam memanfaatkan keberadaan pasangan elektron bebas
pada gugus –OH dan NH2. Oleh karena itu sebaiknya proses penyerapan dilakukan dalam
lingkungan yang tidak asam agar gugus –NH2 tidak terprotonasi. Pasangan elektron pada
gugus –OH dan NH2 akan berperan sebagai ligan (basa lewis, donor pasangan elektron)
yang dapat berinteraksi dengan zat warna kationik atau kation logam melalui mekanisme
pembentukan ikatan kovalen koordinasi (komplek). Karena jumlah gugus –NH2 kitosan
lebih banyak dibandingkan dengan kitin, kemampuan adsorpsi kitosan lebih tinggi
daripada kitin.
Sebagai adsorben, kitosan dapat digunakan secara langsung dalam bentuk
serpihan. Namun telah banyak penelitian yang menggunakan kitosan dalam bentuk
butiran, hidrogel, dan membran/film. Banyak peneliti juga telah memodifikasi struktur
kitosan untuk meningkatkan kemampuan adsorpsi, kekuatan mekanik dan kestabilannya.
Sebagai contohnya, taut silang antar rantai kitosan dengan menggunakan glutaraldehida
atau tripolifosfat. (Pope, 2004)
Kitosan dapat disintesis menjadi kitosan bead yang tidak larut dalam asam
sehingga dapat dimanfaatkan lebih luas. Adanya asam lemah encer dalam matriks kitosan
kitosan. Afinitas yang dimiliki kitosan bead menyebabkan meningkatnya kemampuan
kitosan bead dalam mengadsorpsi logam berat. Kemampuan adsorpsi kitosan bead dapat
ditingkatkan dengan mengikat silangkan kitosan bead dengan glutaraldehide. (Thate,
2004)
Glutaraldehide adalah suatu senyawa organik dengan Rumus Molekul C5H8O2 /
CH2(CH2CHO)2, dengan Massa molar 100.12 g mol−1 dan densitasnya adalah 1.06 g/mL.
Glutaraldehid merupakan salah satu desinfektan yang populer pada kedokteran gigi, baik
tunggal maupun dalam bentuk kombinasi.
Gambar 1.2. Struktur Glutarakdehide
Dilihat dari strukturnya, glutaraldehida mempunyai 2 gugus aldehida yang reaktif.
Gugus aldehide tersebut sangat reaktif terhadap gugus amina pada kitosan sehingga
apabila direaksikan, gugus aldehida akan berikatan kovalen dengan gugus amina dan
membentuk jembatan yang menghubungkan polimer kitosan yang satu dengan yang
lainnnya. Dengan penambahan agen crosslinking ini dipercaya dapat meningkatkan
kekuatan mekanik membran.
Oleh karena itu, peneliti tertarik untuk mengetahui bagaimana karakteristik
Kitosan Glutaraldehida, dan bagaimanakah kemampuan Kitosan Glutaraldehida sebagai
1.2.Identifikasi Masalah
Bagaimanakah karakteristik Kitosan Glutaraldehida sebagai adsorben untuk menentukan
kadar ion logam Cu.
1.3.Pembatasan Masalah
Penelitian ini hanya dibatasi oleh :
- Sampel yang digunakan adalah kitosan yang berasal dari limbah kulit udang yang
diperoleh dari pabrik pengolahan udang daerah pantai Belawan
- Perbandingan antara kitosan dengan Glutaraldehide adalah 1 : 1,5
- Analisis Kitosan Glutaraldehide sebagai adsorben dalam logam Cu dilakukan
dengan metode Spektrofotometri Serapan Atom (SSA)
1.4.Tujuan Penelitian
Untuk mengetahui karakteristik Kitosan Glutaraldehida sebagai adsorben terhadap ion
logam Cu.
1.5. Manfaat Penelitian
Diharapkan hasil yang diperoleh dari penelitian ini memberikan suatu informasi ilmiah
bahwa Kitosan Glutaraldehide dapat bertindak sebagai adsorben dalam menentukan kadar
1.6. Metodologi Penelitian
Penelitian ini bersifat percobaan laboratorium yaitu melihat karakterisasi kitosan
glutaraldehide sebagai adsorben terhadap penentuan kadar ion logam Cu yang dilakukan
dengan metode Spektrofotometri Serapan Atom (SSA)
1.7. Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Penelitian FMIPA Universitas Sumatera Utara.
Analisis spektrofotometer Fourier Transform Infra Red (FTIR) dilakukan di
Laboratorium Kimia Organik Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA)
Universitas Gajah Mada, dan Analisis Spektrofotometer Serapan Atom dilakukan di Pusat
BAB 2
TINJAUAN PUSTAKA
2.1. Kitosan
Kitosan adalah senyawa polimer alam turunan kitin yang diisolasi dari limbah perikanan,
seperti kulit. udang dan cangkang kepiting dengan kandungan kitin antara 65-70 persen.
Sumber bahan baku kitosan yang lain di antaranya kalajengking, jamur, cumi, gurita,
serangga, laba - laba dan ulat sutera dengan kandungan kitin antara 5-45 persen. Kitosan
merupakan bahan kimia multiguna berbentuk serat dan merupakan kopolimer berbentuk
lembaran tipis, berwarna putih atau kuning, tidak berbau. Kitosan merupakan produk
deasetilasi kitin melalui proses kimia menggunakan basa natrium bidroksida atau proses
enzimatis menggunakan enzim chitin deacetylase. Serat ini bersifat tidak dicerna dan
tidak diserap tubuh. Sifat menonjol kitosan adalah kemampuan mengabsorpsi lemak
hingga 4-5 kali beratnya (Rismana, 2006).
Kitosan adalah senyawa kimia yang berasal dari bahan hayati kitin, suatu senyawa
organik yang melimpah di alam ini setelah selulosa. Kitin ini umumnya diperoleh dari
kerangka hewan invertebrata dari kelompok Arthopoda sp, Molusca sp, Coelenterata sp,
Annelida sp, Nematoda sp, dan beberapa dari kelompok jamur Selain dari kerangka
hewan invertebrata, juga banyak ditemukan pada bagian insang ikan, trakea, dinding usus
dan pada kulit cumi-cumi. Sebagai sumber utamanya ialah cangkang Crustaceae sp, yaitu
udang, lobster, kepiting, dan hewan yang bercangkang lainnya, terutama asal laut.
Sumber ini diutamakan karena bertujuan untuk memberdayakan limbah udang (Hawab,
Kitosan adalah produk terdeasetilasi dari kitin yang merupakan biopolimer alami
kedua terbanyak di alam setelah selulosa, yang banyak terdapat pada serangga, krustasea,
dan fungi (Sanford and Hutchings, 1987). Diperkirakan lebih dari 109-1.010 ton kitosan
diproduksi di alam tiap tahun. Sebagai negara maritim, Indonesia sangat berpotensi
menghasilkan kitin dan produk turunannya. Limbah cangkang rajungan di Cirebon saja
berkisar 10 ton perhari yang berasal dari sekurangnya 20 industri kecil. Kitosan tersebut
masih menjadi limbah yang dibuang dan menimbulkan masalah lingkungan. Data statistik
menunjukkan negara yang memiliki industri pengolahan kerang menghasilkan sekitar
56.200 ton limbah. Pasar dunia untuk produk turunan kitin menunjukkan bahwa oligomer
kitosan adalah produk yang termahal, yaitu senilai $ 60.000/ton.
Kitosan merupakan senyawa turunan kitin, senyawa penyusun rangka luar hewan
berkaki banyak seperti kepiting, ketam, udang dan serangga. Kitosan dan kitin termasuk
senyawa kelompok polisakarida. Senyawa – senyawa lain yang termasuk kelompok
polisakarida yang sudah tidak asing bagi kita adalah pati dan sellulosa. Polisakarida –
polisakarida ini berbeda dalam jenis monosakarida penyusunnya dan cara monosakarida –
monosakarida berikatan membentuk polisakarida (Rismana, 2006).
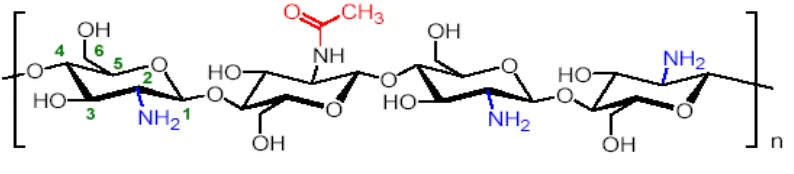
2.1.1. Struktur Kitosan
Kitosan adalah jenis polimer rantai yang tidak linier yang mempunyai rumus umum (C
-6H11O4)n atau disebut sebagai (1,4)-2-Amino-2-Deoksi-β-D-Glukosa, dimana strukturnya
dapat dilihat sebagai berikut :
2.1.2. Sifat – Sifat Kimia dan biologi Kitosan
Sebagian besar polisakarida yang terdapat secara alami seperti sellulosa, dekstran, pektin,
asam alginat, agar, karangenan bersifat netral atau asam di alam, sedangkan kitosan
merupakan polisakarida yang bersifat basa (Kumar, 2000).
Menurut Rismana (2006) sifat alami kitosan dapat dibagi menjadi dua sifat besar
yaitu, sifat kimia dan biologi. Sifat kimia kitosan antara lain :
• Merupakan polimer poliamin berbentuk linear.
• Mempunyai gugus amino aktif.
• Mempunyai kemampuan mengikat beberapa logam.
Sifat biologi kitosan antara lain:
• Bersifat biokompatibel artinya sebagai polimer alami sifatnya tidak mempunyai akibat samping, tidak beracun, tidak dapat dicerna, mudah diuraikan oleh mikroba
(biodegradable).
• Dapat berikatan dengan sel mamalia dan mikroba secara agresif.
• Bersifat hemostatik, fungistatik, spermisidal, antitumor, antikolesterol.
• Bersifat sebagai depresan pada sistem saraf pusat. Berdasarkan kedua sifat
tersebut maka kitosan mempunyai sifat fisik khas yaitu mudah dibentuk menjadi
spons, larutan, pasta, membran, dan serat. yang sangat bermanfaat.
(Rismana, 2006)
Kitosan dengan bentuk amino bebas tidak selalu larut dalam air pada pH lebih dari
6,5 sehingga memerlukan asam untuk melarutkannya. Kitosan larut dalam asam asetat
dam asam formiat encer. Adanya dua gugus hidroksil pada kitin sedangkan kitosan
dengan 1 gugus amino dan 2 gugus hidroksil merupakan target dalam modifikasi kimiawi
Sifat kation kitosan adalah linier polielektrolit, bermuatan positif, flokulan yang
sangat baik, pengkelat ion – ion logam. Sifat biologi kitosan adalah non toksik, polimer
alami, sedangkan sifat kimia seperti linier poliamin, gugus amino dan gugus hidroksil
yang reaktif. Aplikasi kitosan dalam berbagai bidang tergantung sifat – sifat kationik,
biologi dan kimianya (Sandford dan Hutchings, 1987).
2.1.3. Kelarutan Kitosan
Kitosan yang disebut juga dengan β-1,4-2 amino-2-dioksi-D-glukosa merupakan senyawa
yang sedikit larut dalam HCl, HNO3, dan H3PO4 dan tidak larut dalam H2SO4. Kitosan
tidak beracun, mudah mengalami biodegradasi dan bersifat polielektrolitik. Disamping itu
kitosan dapat dengan mudah berinteraksi dengan zat-zat organik lainnya seperti protein.
Oleh karena itu, kitosan relatif lebih banyak digunakan pada berbagai bidang industri
terapan dan industri kesehatan. Kitosan tidak larut dalam air, pelarut-pelarut organik, juga
tidak larut dalam alkali dan asam-asam mineral pada pH di atas 6,5. Dengan adanya
sejumlah asam, maka dapat larut dalam air-metanol, air-etanol, air-aseton, dan campuran
lainnya. Kitosan larut dalam asam formiat dan asam asetat dan menurut Peniston dalam
20% asam sitrat juga dapat larut. Asam organik lainnya juga tidak dapat melarutkan
kitosan, asam-asam anorganik lainnya pada pH tertentu setelah distirer dan dipanaskan
dan asam sitrat juga dapat melarutkan kitosan pada sebagian kecil setelah beberapa waktu
akan terbentuk endapan putih yang menyerupai jelly. ( Widodo. A, 2005 )
2.2. Glutaraldehide
Glutaraldehide adalah suatu senyawa organik dengan Rumus Molekul C5H8O2 /
CH2(CH2CHO)2, dengan Massa molar 100.12 g mol−1 dan densitasnya adalah 1.06 g/mL.
Glutaraldehid merupakan salah satu desinfektan yang populer pada kedokteran gigi, baik
Aldehid merupakan desinfektan yang kuat. Glutaraldehid 2% dapat dipakai untuk
mendesinfeksi alat-alat yang tidak dapat disterilkan, diulas dengan kasa steril kemudian
diulas kembali dengan kasa steril yang dibasahi dengan akuades, karena glutaraldehid
yang tersisa pada instrumen dapat mengiritasi kulit/mukosa, operator harus memakai
masker, kacamata pelindung dan sarung tangan heavy duty. Larutan glutaraldehid 2%
efektif terhadap bakteri vegetatif seperti M. tuberculosis, fungi, dan virus akan mati
dalam waktu 10-20 menit, sedang spora baru akan mati setelah 10 jam.
2.2.1. Struktur Glutaraldehide
Gambar 2.2. Struktur Glutarakdehide
Dilihat dari strukturnya, glutaraldehida mempunyai 2 gugus aldehida yang reaktif.
Gugus aldehide tersebut sangat reaktif terhadap gugus amina pada kitosan sehingga
apabila direaksikan, gugus aldehida akan berikatan kovalen dengan gugus amina dan
membentuk jembatan yang menghubungkan polimer kitosan yang satu dengan yang
lainnnya. Dengan penambahan agen crosslinking ini dipercaya dapat meningkatkan
kekuatan mekanik membran.
2.3. Logam Tembaga (Cu)
2.3.1. Logam
Logam juga dapat menyebabkan timbulnya suatu bahaya pada makhluk hidup. Hal ini
berbahaya jika ditemukan dalam konsentrasi tinggi dalam lingkungan, karena logam
tersebut mempuyai sifat merusak tubuh makhluk hidup. Disamping hal tersebut, beberapa
logam sangat diperlukan dalam proses kehidupan makhluk hidup (Darmono,1995).
Logam berat dapat menimbulkan efek gangguan terhadap kesehatan manusia,
tergantung pada bagian mana dari logam berat tersebut yang terikat dalam tubuh serta
besarnya dosis paparan. Efek toksik dari logam berat mampu menghalangi kerja enzim
sehingga mengganggu metabolisme tubuh, menyebabkan alergi, bersifat mutagen,
tetratogen, atau karsinogen bagi manusia maupun hewan (Widowati, W. 2008).
2.3.2. Tembaga (Cu)
Tembaga adalah logam merah muda, yang lunak, dapat ditempa dan liat. Ia melebur pada
suhu 10380C. Karena potensial elektroda standarnya positif, (+0,34 V untuk pasangan
Cu/Cu2+), ia tak larut dalam asam klorida dan asam sulfat encer, meskipun dengan adanya
oksigen ia dapat larut sedikit. Asam Nitrat yang sedang pekatnya (8M) dengan mudah
melarutkan tembaga. (Widowati, 2008)
Tembaga yang tidak berikatan dengan protein merupakan zat racun.
Mengkonsumsi sejumlah kecil tembaga yang tidak berikatan dengan protein dapat
menyebabkan mual dan muntah.
Makanan atau minuman yang diasamkan, yang bersentuhan dengan pembuluh,
selang atau katup tembaga dalam waktu yang lama, dapat tercemar oleh sejumlah kecil
tembaga. Jika sejumlah besar garam tembaga, yang tidak terikat dalam protein, secara
tidak sengaja tertelan atau jika pembebatan larutan garam tembaga digunakan untuk
mengobati daerah kulit yang terbakar luas, sejumlah tembaga bisa terserap dan merusak
ginjal, menghambat pembentuklan air kemih dan menyebabkan anemia karena pecahnya
sel-sel darah merah (hemolisis). Keracunan tembaga dapat diobati dengan penisilamin
Kekurangan tembaga jarang terjadi pada orang sehat. Ini sering terjadi pada
bayi-bayi prematur atau bayi-bayi-bayi-bayi yang sedang dalam masa penyembuhan dari malnutrisi yang
berat.Orang-orang yang menerima makanan secara intravena (parenteral) dalam waktu
lama juga memiliki resiko menderita kekurangan tembaga.
2.3.3. Efek Toksik Tembaga
Unsur Tembaga (Cu) bisa ditemukan pada berbagai jenis makanan, air dan udara
sehingga manusia bisa terpapar Tembaga(Cu) melalui jalur makanan, minuman dan saat
bernafas. Tembaga (Cu) merupakan unsur yang dibutuhkan dalam jumlah kecil. Apabila
jumlah Tembaga (Cu) telah melampaui batas aman, akan muncul toksisitas. Manusia
biasanya terpapar Tembaga (Cu) dari tanah, debu, makanan, serta minuman yang
tercemar Tembaga(Cu) yang berasal dari pipa bocor pada penambangan Tembaga (Cu)
atau industri yang menghasilkan limbah tembaga (Cu). Kira-kira 75%-99% total intake
Tembaga (Cu) berasal dari makanan dan minuman. Setiap hari manusia bisa terpapar
Tembaga (Cu) yang antara lain berasal dari peralatan dapur ataupun koin.
Keracunan logam berat bersifat kronis dan dampaknya baru terlihat setelah
beberapa tahun. Logam berat bersifat akumulatif didalam tubuh organisme dan
konsentrasi mengalami peningkatan (biomagnifikasi) dalam rantai makanan.
Biomagnifikasi berhubungan langsung dengan manusi yang menempati posisi top level
dalam rantai makanan karena konsentrasi logam berat yang dikandung dalam makanan
manusia telah mengalami peningkatan mulai dari komponen tingkat dasar (produsen).
Keracunan kronis Tembaga (Cu) dapat mengurangi umur, menimbulkan berbagai
2.4. Adsorbsi
2.4.1. Pengertian Adsorbsi
Peristiwa penyerapan suatu zat pada permukaan zat lain disebut adsorbsi. Zat yang
terserap disebut fase terserap sedangkan zat yang diserap disebut adsorben. Kecuali zat
padat, adsorben dapat pula berupa zat cair. Karena itu adsorbsi dapat terjadi antara: zat
padat dan zat cair, zat padat dan gas, zat cair dan zat cair, atau gas dan zat cair.
Proses adsorbsi ini disebabkan oleh gaya tarik molekul permukaan adsorben.
Adsorbsi berbeda dengan absorbsi, karena pada absorbsi zat yang diserap masuk kedalam
absorbens.
Berkat selektivitasnya yang tinggi, proses adsorbsi sangat sesuai untuk
memisahkan bahan dengan konsentrasi yang kecil dari campuran yang mengandung
bahan lain yang berkonsentrasi tinggi. Adsorbsi digunakan dalam pengolahan air buangan
industri, terutama untuk mengurangi komponen-komponen organik misalnya warna,
fenol, detergen, zat-zat toksik dan zat-zat organik yang sukar diuraikan (
non-biodeyadable). (Mc. Cabe dkk., 1999)
Kecepatan adsorbsi tidak hanya tergantung pada perbedaan konsentrasi dan pada
luas permukaan adsorben, melainkan juga pada suhu, tekanan (untuk gas), ukuran partikel
dan porositas adsorben. Juga tergantung pada ukuran molekul bahan yang akan diadsorbsi
dan pada viskositas campur yang akan dipisahkan (cairan, gas). Pemilihan proses adsorbsi
yang akan digunakan untuk pemisahan disesuaikan dengan kondisi agregasi campuran
yang akan dipisahkan (padat, cair, gas), konsentrasi bahan yang akan dipisahkan,
adsorben yang paling cocok, metode regenerasi yang diperlukan maupun pertimbangan
ekonominya.
Proses adsorbsi meliputi tiga tahap mekanisme yaitu :
- Pergerakan molekul adsorbat menuju permukaan adsorben
- Penarikan molekul-molekul adsorbat oleh permukaan aktif membentuk
ikatan, yang berlangsung sangat cepat (Metcalf and Eddy, 1979).
2.4.2. Adsorben
Adsorben (untuk adsorbsi fisik) adalah bahan padat dengan luas permukaan dalam yang
sangat besar. Permukaan yang luas ini terbentuk karena banyaknya pori yang halus pada
padatan tersebut. Biasanya luasnya berada dalam orde 200 - 1000 m2/g adsorben.
Diameter pori sebesar 0,0003 – 0,002 µm.
Disamping luas spesifik dan diameter pori, maka kerapatan unggun, distribusi
ukuran partikel maupun kekerasannya merupakan data karakterisitik yang penting dari
suatu adsorben. Tergantung pada tujuan penggunaannya, adsorben dapat berupa granulat
(dengan ukuran butir sebesar beberapa mm) atau serbuk (khusus untuk adsorbsi campuran
cair) (Mc.Cabe dkk.,1999)
2.5. Spektrofotometri Serapan Atom
2.5.1. Definisi Spektrofotometri Serapan Atom
Spektrofotometri Serapan Atom adalah suatu metode pengukuran kuantitatif suatu unsur
yang terdapat dalam suatu cuplikan berdasarkan penyerapan cahaya pada panjang
gelombang tertentu oleh atom-atom bentuk gas dalam keadaan dasar.
2.5.2. Prinsip dan Dasar Teori
Jika cahaya dengan panjang gelombang tertentu dilewatkan pada nyala yang mengandung
penyerapan akan berbanding lurus dengan banyaknya atom dalam keadaan dasar yang
berada dalam nyala. Hal ini merupakan dasar penentuan kuantitatif logam-logam dengan
menggunakan SSA (Walsh,A., 1955).
2.5.3. Peralatan Spektrofotometri Serapan Atom (SSA)
Komponen penting yang membentuk spektrofotometer serapan atom dapat diperlihatkan
secara skematis pada gambar berikut:
Gambar 2.3. Komponen-komponen spektrofotometer serapan atom
(Day, R.A.Jr.,Underwood A.L. 1988).
1. Sumber Tenaga
Suatu sumber radiasi yang digunakan harus memancarkan spektrum atom dari unsur yang
ditentukan. Spektrum atom yang dipancarkan harus terdiri dari garis tajam yang
mempunyai setengah lebar yang sama dengan garis serapan yang dibutuhkan oleh
atom-atom dalam contoh. Sumber sinar yang lazim dipakai adalah lampu katoda berongga
(hallow chatode lamp) (Bassett dkk, 1994).
2. Nyala dan Sistem Pembakar- Pengabut
Nyala digunakan untuk mengubah sampel yang berupa padatan atau cairan menjadi
bentuk uap atomnya, dan juga berfungsi untuk atomisasi. Untuk spektroskopi nyala suatu
Tabung katoda cekung
Pemotong
berputar Nyala M onokrom ator D etektor
Penguat arus
searah Pencatat
Sum ber tenaga
B ahan
persyaratan yang penting adalah bahwa nyala yang dipakai hendaknya menghasilkan
temperature lebih dari 2000oK. Untuk memenuhi persyaratan ini digunakan suatu gas
pembakar bersama-sama dengan suatu gas pengoksidasi / oksidator, seperti udara ataupun
gas dinitrogen oksida (N2O) (Haswell,S.J, 1991). Tujuan sistem pembakar – pengabut
adalah untuk mengubah larutan uji menjadi atom-atom dalam bentuk gas. Fungsi
pengabut adalah menghasilkan kabut atau aerosol larutan uji. Larutan yang akan
dikabutkan ditarik kedalam pipa kapiler oleh aksi semprotan udara yang ditiupkan
melalui ujung kapiler, diperlukan aliran gas bertekanan tinggi untuk menghasilkan
aerosol yang halus (Basset dkk, 1994).
3. Monokromator
Dalam spektroskopi serapan atom fungsi monokromator adalah untuk memisahkan garis
resonansi dari semua garis yang tak diserap yang dipancarkan oleh sumber radiasi. (
Braun, R.D, 1982).
4. Detektor
Detektor pada spektrofotometer serapan atom berfungsi mengunggah intensitas radiasi
yang datang menjadi arus listrik. Pada spektrofotometer serapan atom yang umum dipakai
sebagai detektor adalah tabung penggandaan foton (PMT = Photo Multiplier Tube
Detector). (Mulja, 1997).
5. Pencatat
Pencatat merupakan sistem pencatatan hasil. Hasil pembacaan dapat berupa angka atau
berupa kurva dari suatu recorder yang menggambarkan absorbansi atau intensitas emisi
2.5.4. Optimasi peralatan Spektrofotometri Serapan Atom
Pada peralatan optimasi Spektrofotometri Serapan Atom agar memberikan wacana dan
sejauh mana sensitivitas dan batas deteksi alat terhadap sampel yang akan dianalisis,
optimasi pada peralatan SSA meliputi:
• Pemilihan persen (%) pada transmisi
• Lebar celah (slith width)
• Kedudukan lampu terhadap focus slit
• Kemampuan arus lampu Hallow Cathode
• Kedudukan panjang gelombang (λ)
• Set monokromator untuk memberikan sinyal maksimum
• Pemilihan nyala udara tekanan asetilen
• Kedudukan burner agar memberikan absorbansi maksimum
• Kedudukan atas kecepatan udara tekan
• Kedudukan atas kecepatan asetilen
2.5.5. Gangguan-gangguan pada Spektrofotometri Serapan Atom
Yang dimaksud dengan gangguan pada Spektrofotometri Serapan Atom adalah
peristiwa-peristiwa yang menyebabkan pembacaan absorbansi unsur yang dianalisis menjadi lebih
kecil atau lebih besar dari nilai yang sesuai dengan konsentrasinya dalam sampel.
1. Gangguan yang berasal dari sampel yang mana dapat mempengaruhi banyaknya
sampel yang mencapai nyala. Hal tersebut dapat berpengaruh terhadap laju aliran
bahan bakar / gas pengoksidasi. Sifat-sifat tersebut meliputi viskositas, tegangan
permukaan, berat jenis, dan tekanan uap. Gangguan yang lain adalah pengendapan
unsur yang dianalisis sehingga jumlah atom yang mencapai nyala menjadi lebih
sedikit dari konsentrasi yang seharusnya terdapat dalam sampel.
2. Gangguan kimia yang dapat mempengaruhi jumlah / banyaknya atom yag terjadi
didalam nyala. Meliputi disosiasi senyawa yang tidak sempurna dan ionisasi
atom-atom dalam nyala. Disosiasi tidak sempurna disebabkan oleh terbentuknya
senyawa yang bersifat refraktorik ( sukar diuraikan didalam nyala api ), misal
oksida garam-garam fosfat, silikat, aluminat dari logam alkali tanah. Ionisasi ion
dalam nyala dapat terjadi jika suhu yang digunakan untuk atomisasi tinggi. Jika
suhu yang digunakan terlalu tinggi maka akan mengganggu pengukuran
absorbansi karena spektrum atom tersebut mengalami ionisasi yang tidak sama
dengan spektrum atom dalam keadaan netral.
3. Gangguan oleh absorbansi yang disebabkan bukan oleh absorbansi atom yang
dianalisis, yakni absorbansi oleh molekul-molekul yang tidak terdisosiasi dalam
nyala. Hal ini juga dapat terjadi karena suhu atomisasi terlalu tinggi, penambahan
senyawa penyangga, dan pengektraksian unsur yang akan dianalisis
4. Gangguan oleh penyerapan non-atomik ( non atomic absorption )
Gangguan jenis ini berarti terjadinya penyerapan cahaya dari sumber sinar yang
bukan berasal dari atom-atom yang akan dianalisis. Penyerapan tersebut terjadi
karena penyerapan cahaya oleh partikel-partikel padat yang berada didalam nyala
BAB 3
METODE PENELITIAN
3.1. Bahan
- Kitosan dari Kulit Udang
- NaOH p.a. (E. Merck)
- Asam Asetat p.a. (E. Merck)
- Glutaraldehide p.a. (E. Merck)
- Aseton p.a. (E. Merck)
- Aquadest
3.2. Alat
- Beaker Glass Pyrex
- Erlenmeyer Pyrex
- Gelas Ukur Pyrex
- Neraca analitik (presisi ± 0,0001 g) Mettler
- pH meter Walklab
- Labu takar Pyrex
- Pipet volumetri Pyrex
- Spektrofotometer Serapan Atom (SSA) Shimadzu AA-6300
- Fourier Transform Infra Red (FTIR) Shimadzu
- Inkubator
- Spatula
- Corong
- Alu dan Lumpang
3.3. Prosedur Penelitian
3.3.1. Pembuatan Larutan Asetat 5 % (v/v)
Sebanyak 5 mL larutan Asetat glasial dimasukkan kedalam beaker glass. Ditambahkan
dengan 100 mL akuades. Lalu diaduk sampai homogen, sehingga diperoleh larutan asetat
5%.
3.3.2. Pembuatan larutan NaOH 2 M
Sebanyak 40 g NaOH pelet dimasukkan kedalam beaker glass. Ditambahkan 500 mL
akuades. Lalu diaduk sampai homogen sehingga diperoleh larutan NaOH 2 M.
3.3.3. Pembuatan larutan Glutaraldehide 2,5%
Sebanyak 10 mL Glutaraldehide dipipet kedalam labu takar 100 mL. Ditambahkan
dengan akuades hingga garis tanda. Lalu dihomogenkan sehingga diperoleh larutan
3.3.4. Pembuatan larutan standar Cu
a. Pembuatan larutan standar Cu 100 mg/L
Dipipet 5 mL larutan induk Cu 1000 mg/L dan dimasukkan kedalam labu takar
50 mL, diencerkan dengan aquadest hingga garis tanda, dikocok hingga
homogen.
b. Pembuatan larutan standar Cu 10 mg/L
Dipipet 5 mL larutan standar Cu 100 mg/L dan dimasukkan kedalam labu takar
50 mL, diencerkan dengan aquadest hingga garis tanda, dikocok hingga
homogen.
c. Pembuatan larutan seri standar Cu 0,2; 0,4; 0,6; 0,8; 1,0 mg/L
Dipipet masing-masing 1 mL, 2 mL, 3 mL, 4 mL, dan 5 mL larutan standar Cu
10 mg/L dan masing-masing dimasukkan kedalam labu takar 50 mL, diencerkan
dengan aquadest hingga garis tanda, dikocok hingga homogen.
3.3.5. Pembuatan Kitosan Bead (Basuki, 2009)
- Kitosan kulit udang ditimbang sebanyak 15 g
- dimasukkan kedalam beaker glass
- dimasukkan Asam asetat 5% dengan perbandingan 1:40 kemudian diaduk
- disemprotkan dengan NaOH 2 M hingga berbentuk gel
- dikeringkan
3.3.6. Pembuatan Ikat silang kitosan dengan Glutaraldehide (Basuki, 2009)
- Kitosan bead yang telah kering dimasukkan dalam beaker glass
- dimasukkan glutaraldehide 2,5% dengan rasio 1,5 mL tiap gram kitosan bead
- hasil pengeringan dicuci dengan aquadest
- residu yang diperoleh direndam dengan aseton
- dikeringkan
- Hasil yang diperoleh kemudian dilakukan Uji SSA dan Uji FTIR
3.3.7. Kitosan Glutaraldehide sebagai Adsorben ion logam Cu dengan variasi
berat 2 g (Basuki,2009)
- 2 g kitosan glutaraldehide dimasukkan kedalam beaker glass
- ditambahkan larutan seri standar Cu 0,2 mg/L dengan volume 20 mL
- distirer selama 10 menit kemudian disaring
- Filtrat yang dihasilkan akan dianalisa dengan Spektrofotometri Serapan
Atom pada λ = 324,7 nm
-Diulangi perlakuan yang sama untuk larutan seri standar Cu 0,4; 0,6; 0,8; dan
1,0 mg/L.
3.4 Bagan penelitian
3.4.1. Pembuatan Kitosan Bead / Manik (Basuki, 2009)
Dilarutkan dalam asam asetat 5% (b/v) dengan rasio 1:40
Disemprotkan dalam NaOH 2 M
dikeringkan
Hasil Gel Kitosan
3.4.2. Pembuatan Ikat Silang Kitosan dengan Glutaraldehide (Basuki, 2009)
Dimasukkan dalam Larutan Glutaraldehide 2,5% dengan
Rasio 1,5 mL tiap gram Kitosan Bead
dikeringkan
Dicuci dengan aquadest
Dimasukkan dalam aseton
dikeringkan
Hasil
Hasil Kitosan Bead
3.4.3. Pembuatan larutan Standar Logam Tembaga 0,2; 0,4; 0,6; 0,8; 1,0 mg/L
Dipipet sebanyak 5 mL larutan induk Cu
Dimasukkan kedalam labu takar 50 mL
Diencerkan dengan aquadest hingga garis tanda
Dikocok hingga homogen
Dipipet sebanyak 5 mL larutan standar Cu
Dimasukkan kedalam labu takar 50 mL
Diencerkan dengan aquadest hingga garis tanda
Dikocok hingga homogen
Dipipet masing-masing 1 mL, 2 mL, 3 mL, 4 mL dan 5 mL
larutan standar Cu
Dimasukkan masing-masing kedalam labu takar 50 mL
Diencerkan dengan aquadest hingga garis tanda
Dikocok hingga homogen
Diukur absorbansinya dengan spektrofotometer Serapan
Atom pada λspesifik 324,7 nm
Larutan Induk Tembaga 1000 mg/L
Larutan Standar Tembaga 100 mg/L
Larutan Standar Tembaga 10 mg/L
Larutan Seri Standar Logam Tembaga 0,2; 0,4; 0,6; 0,8; 1,0 mg/L
3.4.4. Kitosan Glutaraldehide sebagai Adsorben Ion logam Cu (Basuki,2009)
Dimasukkan dalam beaker glass
Ditambahkan larutan sampel Cu dengan
volume 20 mL
dilakukan perendaman dan distirer dalam
waktu 10 menit
disaring
dibuat pH 2
Kitosan Glutaraldehide variasi 2 g
Residu Filtrat
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1. Ion Tembaga (Cu 2+)
Kondisi alat Spektrofotometer Serapan Atom (SSA) pada pengukuran konsentrasi ion
Tembaga (Cu2+) dapat dilihat pada tabel 4.1.
Tabel 4.1. Kondisi alat SSA Merek Shimadzu tipe AA-6300 pada pengukuran
konsentrasi ion Tembaga (Cu 2+)
No Parameter Ion Tembaga (Cu2+)
Panjang gelombang
Tipe nyala
Kecepatan aliran gas pembakar
Kecepatan aliran Udara
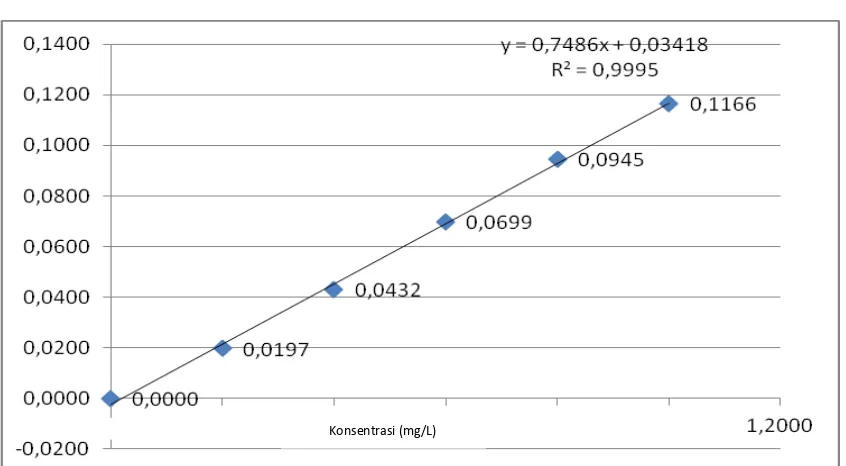
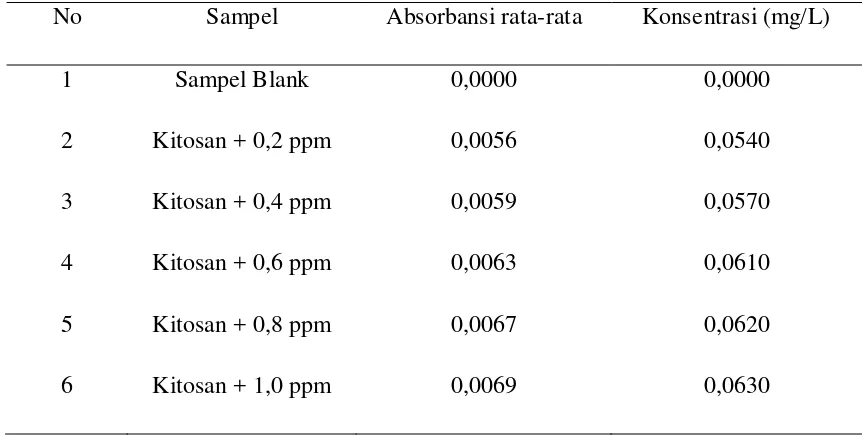
Tabel 4.2. Data absorbansi larutan standar ion Tembaga (Cu2+)
Gambar 4.1. Kurva kalibrasi larutan standar ion Tembaga (Cu2+)
No Absorbansi rata-rata
4.1.1.1. Penurunan Persamaan Garis Regresi dengan Metode Least Square
Hasil pengukuran absorbansi larutan seri standar ion Tembaga (Cu2+) pada tabel 4.2.
diplotkan terhadap konsentrasi sehingga diperoleh kurva kalibrasi berupa garis linier.
Persamaan garis regresi untuk kurva kalibrasi ini dapat diturunkan dengan metode least
square dengan data pada tabel 4.3.
Tabel 4.3. Penurunan persamaan garis regresi untuk penentuan konsentrasi ion
Tembaga (Cu2+) berdasarkan pengukuran absorbansi larutan standar
ion Tembaga (Cu2+)
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis :
dimana :
a = slope
b = intercept
Selanjutnya harga slope dapat ditentukan dengan menggunakan metode Least Square
sebagai berikut :
2
Dengan mensubstitusikan harga-harga yang tercantum pada tabel 4.3. pada persamaan ini
maka diperoleh :
7486
Maka pesamaan garis yang diperoleh adalah :
y = 0,7486 x + 0,03418
4.1.1.2. Koefisien Korelasi
Koefisien korelasi dapat ditentukan dengan menggunakan persamaan sebagai berikut :
[
2 2]
12[
]
0,29951 0,999764.1.2. Ikat silang Kitosan glutaraldehide dengan Ion Tembaga (Cu 2+)
Hasil pengukuran absorbansi larutan seri standar ion Tembaga (Cu2+) dengan ikat silang
kitosan Glutaraldehida terdapat pada tabel 4.4 sebagai berikut :
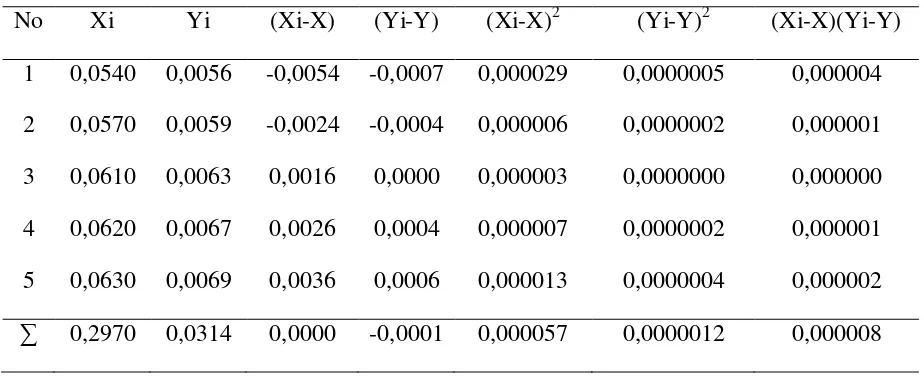
Tabel 4.4. Data absorbansi larutan seri standar ion Tembaga (Cu2+) dengan ikat
silang kitosan glutaraldehide
4.1.2.1. Penurunan Persamaan Garis Regresi dengan Metode Least Square
Hasil pengukuran absorbansi larutan seri standar ion Tembaga (Cu2+) dengan ikat silang
kitosan glutaraldehide pada tabel 4.4. diplotkan terhadap konsentrasi. Persamaan garis
regresi untuk kurva kalibrasi ini dapat diturunkan dengan metode least square dengan data
pada tabel 4.5.
No Sampel Absorbansi rata-rata Konsentrasi (mg/L)
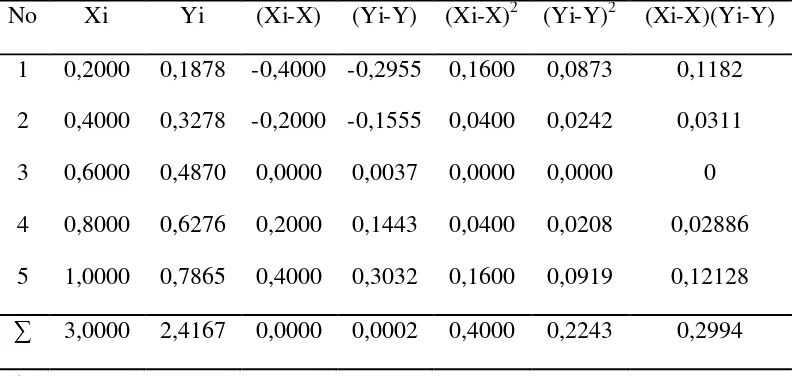
Tabel 4.5. Penurunan persamaan garis regresi untuk penentuan konsentrasi ion
Tembaga (Cu2+) berdasarkan pengukuran absorbansi larutan standar
ion Tembaga (Cu2+) dan ikat silang kitosan glutaraldehide
No Xi Yi (Xi-X) (Yi-Y) (Xi-X)2 (Yi-Y)2 (Xi-X)(Yi-Y)
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis :
y = ax + b
dimana :
a = slope
b = intercept
Selanjutnya harga slope dapat ditentukan dengan menggunakan metode Least Square
2
Dengan mensubstitusikan harga-harga yang tercantum pada tabel 4.5. pada persamaan ini
maka diperoleh :
1388
Maka pesamaan garis yang diperoleh adalah :
y = 0,1388 x - 0,0020
4.1.2.2. Koefisien Korelasi
Koefisien korelasi dapat ditentukan dengan menggunakan persamaan sebagai berikut :
[
( )2 ( )2]
12Koefisien korelasi untuk ion Tembaga (Cu2+) dan ikat silang kitosan glutaraldehide
4.1.2.3. Persentasi (%) Penurunan Konsentrasi Logam Tembaga (Cu)
Persentasi (%) penurunan konsentrasi logam tembaga (Cu) dapat ditentukan dengan
menggunakan rumus :
%
Maka persentasi (%) penurunan konsentrasi logam tembaga (Cu) dalam larutan standar
setelah penambahan Ikat silang Kitosan Glutaraldehide adalah :
%
Dengan cara yang sama dapat dihitung persentasi (%) penurunan logam tembaga (Cu)
dalam larutan standar setelah penambahan kitosan.
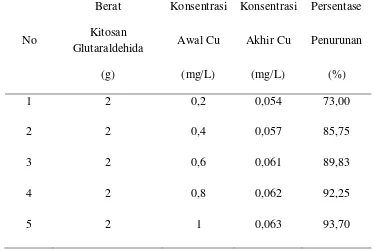
Tabel 4.6. Data persentase (%) penurunan konsentrasi Logam Tembaga dalam
larutan standar setelah penambahan Kitosan Glutaraldehide
No
Berat Konsentrasi Konsentrasi Persentase
Kitosan
Glutaraldehida Awal Cu Akhir Cu Penurunan
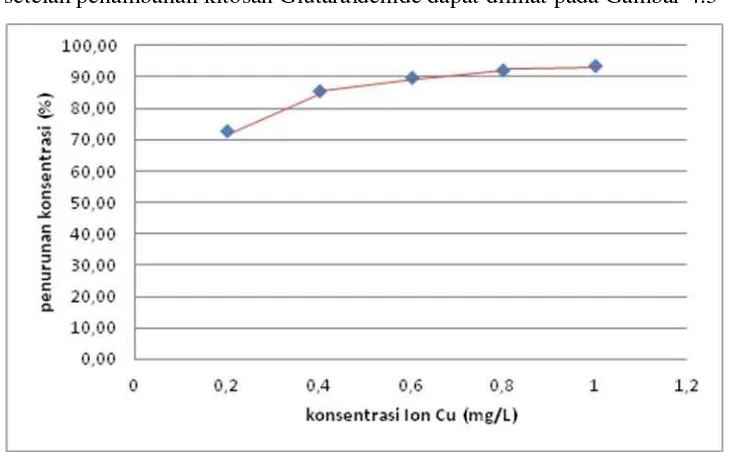
Grafik persentase (%) penurunan konsentrasi logam tembaga (Cu) dalam larutan standar
setelah penambahan kitosan Glutaraldehide dapat dilihat pada Gambar 4.3
Gambar 4.3. Persentase (%) Penurunan Konsentrasi Logam Tembaga (Cu)
4.1.3. Mekanisme Reaksi Ikat silang antara Kitosan dengan Glutaraldehide
+
Kitosan + Glutaraldehide
Ikat silang
+ 2 H2O
4.2. Pembahasan
Penelitian ini dilakukan untuk mengetahui karakteristik Kitosan Glutaraldehide dan
kemampuan Kitosan Glutaraldehide sebagai adsorben untuk menentukan kadar ion logam
Cu.
Hasil FTIR dari Kitosan menunjukkan bahwa adanya serapan pada bilangan
gelombang 3386,8 cm-1 yang merupakan daerah –OH dan air. Pita serapan pada bilangan
gelombang 2877,6 cm-1 menunjukkan daerah puncak untuk gugus C-H. Adanya serapan
pada bilangan gelombang 1654,8 cm-1 dan 1377,1 cm-1 mungkin merupakan daerah
puncak untuk gugus N-H dari gugus amina dan gugus C-H pada CH3. (Gambar terlampir)
Hasil FTIR dari ikat silang Kitosan dengan Glutaraldehide menunjukkan bahwa
adanya serapan pada bilangan gelombang 3448,72 cm-1 yang merupakan daerah –OH dan
air. Pita serapan pada bilangan gelombang 2924,09 cm-1 menunjukkan daerah puncak
untuk gugus C-H. Adanya serapan pada bilangan gelombang 1651,07 cm-1 dan 1381,03
cm-1 mungkin merupakan daerah puncak untuk gugus N-H dari gugus amina dan gugus
C-H pada CH3. (Gambar terlampir)
Dari hasil Uji dengan SSA, diperoleh data bahwa konsentrasi larutan standar Cu
setelah ditambahkan dengan Kitosan Glutaraldehide mengalami penurunan. Hal ini
membuktikan bahwa Kitosan Glutaraldehida dapat berfungsi menjadi adsorben yang baik
untuk logam-logam berat, sebagai contoh adalah Cu. Hal ini disebabkan oleh karena
adanya asam lemah encer dalam matriks kitosan bead yang menyebabkan gugus –NH2
kitosan bead memiliki afinitas lebih tinggi dibanding kitosan. Afinitas yang dimiliki
kitosan bead menyebabkan meningkatnya kemampuan kitosan bead dalam mengadsorpsi
logam berat. Kemampuan adsorpsi kitosan bead ini semakin meningkat dengan mengikat
silangkan kitosan bead dengan glutaraldehide yang dibuktikan oleh penyerapan logam Cu
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil analisis yang dilakukan terhadap ion Cu2+ menggunakan Spektroskopi Serapan
Atom (SSA) diperoleh data bahwa Kitosan Glutaraldehide 2 g + 0,2 mg/L larutan seri
standar Cu, maka konsentrasi larutan seri standar Cu akan mengalami penurunan
konsentrasi sebesar 73%, sedangkan Kitosan glutaraldehide 2 g + 1,0 mg/L larutan seri
standar Cu, maka larutan standar Cu akan mengalami penurunan konsentrasi logam Cu
yaitu sebesar 93,70 %.
5.2 Saran
Disarankan untuk peneliti selanjutnya, agar dapat melakukan sintesis ikat silang kitosan
dengan senyawa lainnya serta dapat mengidentifikasi kemampuan adsorbsinya terhadap
DAFTAR PUSTAKA
Basuki, Bagus R., 2009. Sintesis Ikat Silang Kitosan dengan Glutaraldehid serta
identifikasi Gugus fungsi dan derajat deasetilasinya. Jurnal Ilmu Dasar 10(1):
Hal. 94-95
Darmono. 1995. Logam Dalam Sistem Biologi Makhluk Hidup. Jakarta: UI Press
Day, R.A. Jr., Underwood, A.L. 1988. Analisa Kimia Kuantitatif. Edisi keempat. Jakarta:
Erlangga.
3 Juni 2012
Hawab, H.M., 2004. Perlu Berhati-hati Mengkonsumsi Kitosan. http://www.kompas.com.
(16 April 2012).
Hirano, S., 1986. Chitin and Chitosan. In Ullmann’s Encyclopedia of Industrial
Chemistry. Completely revised edition. Weinheim, New York.
Kumar, M.N.V.R., 2000. Chitin and Chitosan for Versatile Applications.
http://members.tripod.com (16 April 2012).
Rismana, 2006. Serat Kitosan Pengikat Lemak.
Rohman, A. 2007. Kimia Farmasi Analisis. Jakarta: Pustaka Pelajar
Sanford, P.T. & Hutchings. 1987. World Market of Chitin and Its Derivatives. Di dalam
Varum KM, Domard A and Smidsrod O, editors. Advances in Chitin Science.
Vol VI. Trondheim, Norway.
Thate MR. 2004. Synthesis and Antibacterial Assessment of Water-Soluble Hydrophobic
Chitosan Derivatives Bearing QuaternaryAmmonium Functionality. Louisiana:
Walsh. A. 1955. Aplication of Atomic Absorption Spectrato Chemical Analysis
Spectrochemica. Acta. Vol 7
Widodo, A. 2005. Potensi Kitosan dari Sisa Udang Sebagai Koagulan Logam Berat
Limbah Cair Industri Tekstil. Jurnal. Surabaya : ITS.
Widowati, W. 2008. Efek Toksik Logam Pencegahan Dan Penanggulangan Pencemaran.
Lampiran 1 . FT-IR Kitosan
Lampiran 4. Larutan Kitosan dengan Asam Asetat Encer
Lampiran 6. Larutan Kitosan dengan Glutaraldehida