Pendahuluan
Serangan penyakit merupakan salah satu faktor pembatas dalam budidaya perikanan. Oleh karena itu pengendalian penyakit merupakan salah satu faktor utama penentu keberhasilan budidaya
perikanan. Selama ini pendekatan pengendalian penyakit dilakukan melalui penerapan bahan-bahan kimia sebagai racun hama dan penyakit, serta penerapan obat-obatan terutama antibiotik. Aktivitas ini mempunyai dampak kontra produktif yang berupa penurunan daya dukung lingkungan yang disebabkan
Pengaruh Suplementasi Ekstrak Herbal (Jahe, Temulawak dan Kencur) Terhadap
Jumlah Total Hemosit dan Aktivitas Fagositosis Udang Putih
(Litopenaeus vannamei)
Wilis Ari Setyati
1, Subagiyo
1dan Slamet Subyakto
2 1) Lab. Eksplorasi dan Bioteknologi Kelautan, UNDIP2) Balai Budidaya Air Payau, Situbondo
Abstract
Wilis Ari setyati, Subagiyo and Slamet Subyakto. 2007. Effects of herbal extract suplement (Zingiber officinale, Kaempferia galangal and Curcuma xanthorrhiza) on total haemocyt and phagocytosis activity of white shrimp (Litopenaeus vannamei). Aquacultura Indonesiana, 8 (3): 155–161. Research on herbal extract
food fortification has been conducted to improve non-specific immune system of white shrimp with total haemocyt and phagocytosis activity as indicators. Rhizome of Zingiber officinale, Kaempferia galangal and Curcuma
xanthorrhiza were extracted using a hot water extraction method and fortified as much as 1% to shrimp food. Total
haemocyt of shrimp was directly counted under microscope using haemocytometer while phagocytosis activity counted as total active phagocytes. The results show that the herbal extract fortification has an effect of total haemocyt and phagocytosis activity of shrimp. Total number of haemocytes increased up to 19.12% (2 weeks application) in Z. officinale, 104.27% (1 week) in C. xanthorrhiza and 46.44% (1 week) in K. galangal while with
Z. officinale decreased after 1 week (-28.77%) and after 3 weeks application (-46.31) with K. galangal except for
curcuma application (no decrease). Phagocytosis activity increased up to 34.19%, 47.29% and 71.23% (1 after 3 weeks) and decreased 31.28% and -26.91 after 2 weeks with Z. officinale and K. galangal but for curcuma extract application.
Keywords: Phagocytosis activity; Herbal extract; Haemocyt white shrimp
Abstrak
Penelitian suplementasi ekstrak herbal (jahe, temulawak dan kencur) dalam pakan udang ini bertujuan untuk mengetahui pengaruh aplikasi ekstrak herbal melalui pakan terhadap jumlah total hemosit dan aktivitas fagositosis. Jumlah total hemosit dan aktivitas fagositosis merupakan salah satu parameter system pertahanan non spesifik. Jahe, kencur dan temulawak diekstraksi menggunakan metode hot water extraction. Ekstrak diberikan secara oral melalui pakan sebesar 1%. Jumlah total hemosit dihitung secara langsung dibawah mikroskop menggunakan hemocytometer. Aktivitas fagositosis dihitung berdasarkan penghitungan jumlah fagosit yang aktif. Hasil percobaan menunjukan bahwa suplementasi ekstrak jahe, kencur dan temulawak berpengaruh pada jumlah total hemosit dan aktivitas fagositosis. Penelitian ini aplikasi ekstrak jahe, kencur dan temulawak berpengaruh meningkatkan jumlah total hemosit berurut-turut 19% (2 minggu aplikasi), 104,27% (1 minggu aplikasi) dan 46,43% (1 minggu aplikasi) secara berturut-turut. Akan tetapi aplikasi ekstrak jahe dan kencur menyebabkan penurunan jumlah total hemosit berturut-turut sebesar -28,77% (1 minggu aplikasi) dan -46,31% (3 minggu aplikasi), namun perlakuan ekstrak jahe tidak menunjukkan penurunan hemosit hingga 3 minggu aplikasi. Pengaruh aplikasi ekstrak jahe, kencur dan temulawak terhadap peningkatan aktivitas fagositosis berturut-turut sebesar 34,19%, 47,29% dan 71,23% (pada 3 minggu setelah aplikasi). Namun penurunan aktivitas fagositosis berturut-turut terjadi pada 2 minggu setelah diaplikasi ekstrak jahe (-31,29%), ekstrak kencur tidak menunjukkan penurunan hingga minggu ketiga aplikasi dan 2 minggu aplikasi ekstrak temulawak (-26,91%)
oleh adanya residu bahan kimia dan antibiotik pada ekosistem tambak, terbentuknya dan meningkatkan resistensi hama dan penyebab penyakit terhadap obat-obatan. Selain itu kondisi lingkungan ini juga berdampak pada peningkatan stress lingkungan terhadap hewan budidaya, yang berakibat menjadi rentan terhadap infeksi patogen. Beberapa penelitian telah dilakukan terhadap kejadian resistensi bakteri terhadap antibiotik (Jones, 1986; Kerry et al., 1994) dan residu antibiotik dalam sistem budidya (Bjorklund et al.,1990; Bjorklund et al., 1991; Coyne et al., 1994).
Sesuai dengan paradigma baru dibidang pembangunan perikanan yang berwawasan lingkungan maka untuk mendukung perkembangan perikanan perlu dilakukan penelitian yang intensif diantaranya adalah pengendalian hama dan penyakit secara terpadu berbasis biosecurity. Biosecurity adalah suatu tindakan pengamanan dalam upaya pencegahan, pengendalian dan eradikasi patogen dari inang dan lingkungan. Bentuk antisipasi kontribusi terhadap paradigma pengendalian penyakit berbasis biosecurity adalah untuk menggantikan aplikasi pestisida, obat-obatan pembarantas hama dan penyakit dan antibiotik dengan bahan yang lebih ramah lingkungan diantaranya adalah melalui aplikasi immunostimulan. Pendekatan ini merupakan tindakan preventif. Secara umum tindakan preventif merupakan strategi yang paling penting dan memberikan keberhasilan yang tinggi dan tidak menyebabkan gangguan pada ekosistem budidaya itu. Sehingga immunostimulasi sistem kekebalan tubuh merupakan pendekatan yang paling tepat karena bersifat luas tidak terbatas pada jenis patogen tertentu. Selain itu sistem kekebalan tubuh dalam krustase kurang berkembang dengan baik daripada vertebrata. Udang bergantung pada proses kekebalan non spsesifik untuk mengatasi infeksi. Udang mempunyai 3 jenis hemosit yaitu vertebrates hyaline cells, semi-granular cells dan large granular cells (Le Moullac, 1998). Hemosit ini bertanggungjawab dalam pertahanan seluler (Hose et al., 1990). Kemampuan immunostimulan dalam melakukan proteksi terhadap infeksi secara luas telah direview oleh Smith et al. (2003).
Banyak agensia immunostimulan yang telah dikenal di bidang budidaya perikanan seperti glukan (Barracco et al., 1991; Engstad et al., 1992; Sung
levamisol, khitin, chitosan, hormon pertumbuhan (Sakai, 1999). Akan tetapi beberapa immunostimulan tidak dapat diaplikasikan secara komersial diantaranya adalah karena harga yang tinggi dan efektifitasnya terbatas (Dugenci et al., 2003). Oleh karena itu diperlukan eksplorasi dan pengujian berbagai sumber immunostimulan yang efektif dan murah
Dibidang kesehatan masyarakat sejumlah besar tanaman telah digunakan dalam pengobatan tradisional baik untuk tujuan kuratif maupun preventif terhadap berbagai penyakit, diantaranya adalah jahe, kencur dan temulawak.
Jahe (Zingiber officinale) mempunyai manfaat yang paling penting untuk meningkatkan daya tahan tubuh serta berperan sebagai antioksidan. Temulawak (Curcuma xanthorrhiza) bermanfaat sebagai antiradang, tonikum, meningkatkan nafsu makan (Syukur, 2005). Kunyit putih (Kaempfieria rotunda) sangat bermanfaat sebagai antiimflamasi, immunostimulan dan antioksidan (Syukur, 2005).
Berdasarkan berbagai hasil penelitian menunjukan bahwa tumbuhan yang secara tradisional digunakan untuk meningkatkan daya tahan tubuh juga mengandung senyawa–senyawa yang mempunyai aktivitas antibakterial, antifungal, anti viral dan antioksidan yang tinggi. Oleh karena itu herbal merupakan sumber immunostimulan dengan fungsi ganda yang mempunyai potensi untuk diteliti aplikasi dan pengembangan di bidang budidaya perikanan.
Secara umum penelitian ini bertujuan mengetahui pengaruh suplementasi ekstrak herbal (jahe, kencur dan temulawak) terhadap sistem kekebalan nonspesik udang vanname berdasarkan gambaran hematologinya yaitu jumlah total hematosit dan aktivitas fagositositnya. Jumlah total hemosit merupakan indikator potensial status immun udang (Henning et al., 1998; Le Moullac et al.,1998; Lorenzon et al., 1999; Lee dan Shiau, 2001; Lo´peza et al., 2003; Selvin et al., 2004).
Materi dan Metode
Penelitian dilakukan dengan metode eksperimental dengan 3 perlakuan dan 2 kali ulangan yaitu ekstrak jahe, ekstrak kencur dan ekstrak temulawak. Untuk mengetahui efek perlakuan
akuarium plastik (ukuran 60x30x30
cm
3) denganflow through water system menggunakan konstruksi pipa goyang.
Ekstraksi Herbal
Ekstraksi dilakukan dengan teknik hot water extraction. Sampel (jahe, kencur dan temulawak) yang digunakan adalah sampel yang telah dikering anginkan, kemudian sebelum diekstraksi dengan air panas dilakukan penghilangan senyawa–senyawa yang bersifat mengganggu seperti lapisan lilin. Untuk menghilangkan senyawa–senyawa tersebut dilakukan maserasi menggunakan pelarut organik. Ampas hasil maserasi ini selanjutnya dimasukan ke dalam akuadest dan didihkan. Kemudian dilakukan penyaringan untuk memisahkan ampas dengan filtrat. Ekstrak diperoleh dengan cara menguapan pelarut (akuades) menggunakan rotavapor dengan pemanas minyak.
Suplementasi Ekstrak ke dalam Pakan
Prosedur sumplementasi ekstrak herbal ke dalam pakan dilakukan dengan prosedur yang biasa digunakan di laboratorium pakan BBAP, Situbondo. Pakan udang komersial (bintang shrimp feed) kode 583 dengan komposi protein kasar minimal 40%, kelembaban maksimal 11%, lemak minimal 6% dan serat maksimum 3%. Pellet dihancurkan dengan cara digiling kemudian disaring. Selanjutnya ditambahkan ekstrak sebanyak 10 g/kg pakan dan dicampur secara homogen. Selanjutnya dilakukan proses pembuatan pelet.
Penyiapan Udang Uji
Udang yang akan digunakan dalam percobaan ini adalah udang vanamei dengan berat +10 g. Sebelum digunakan untuk percobaan dilakukan proses aklimasi. Prosedur aklimatisasi mengikuti prosedur menurut Rodryguez et al. (2003a) yang dimodifikasi. Udang dipelihara dalam bak-bak semen besar yang dilengkapi sistem aerasi dan sirkulasi air dengan fotoperioda alami. Aklimasi dilakukan selama 15 hari. Selama proses aklimasi dilakukan pemberian pakan menggunakan pelet komersial. Udang hasil aklimatisasi selanjutnya dibagi secara random ke dalam akuarium percobaan, tiap akuarium berisi 15 ekor udang.
Pemberian Pakan
Prosedur pemberian pakan mengikuti prosedur menurut Couso et al. (2003). Pakan diberikan sebanyak 5% biomass/hari
Pengambilan Sampel Darah
Darah udang diambil dengan interval 1 minggu sekali selama 3 minggu. Pengambilan sampel darah udang dilakukan dengan prosedur menurut Cordova et al. (2002) menggunakan syringe 1 mL yang telah dibasahi dengan larutan anticoagulant (EDTA 10%). Hemolymph diperoleh dari bagian pangkal pleopod pada segment abdominal dekat lubang genital. Hemolimfe selanjutnya ditempatkan dalam microtube steril dan disimpan dalam cool box.
Penghitungan Jumlah Total Hemosit
Penghitungan jumlah total hemosit dilakukan dengan prosedur menurut Cordova et al. (2002). Jumlah total hemosit dihitung menggunakan haemocytometer. Perbandingan jumlah total hemosit antara perlakuan dengan kontrol digunakan sebagai nilai efek treatment. Perhitungan jumlah hemosit/ liter menggunakan rumus :
Penentuan Aktivitas Fagositosis
Aktivitas fagositosis ditentukan menggunakan prosedur menurut Isnansetyo et al. (2007). Sel- sel bakteri hasil pemanenan yang akan digunakan untuk uji fagositosis dimatikan dengan cara dicampur dengan larutan formalin selama 24 jam, kemudian diendapkan dengan sentrifugasi dan dicuci 2 kali menggunakan larutan PBS. 250 uL hemosit dicampur dengan 500 uL suspensi sel-sel bakteri yang telah dimatikan Inkubasi pada suhu kamar selama 60 menit. Aktivitas fagositosis diamati secara mikroskopis menggunakan mikroskop cahaya pada perbesaran 1000 kali. Penghitungan aktivitas fagositosis ini dapat menggunakan rumus :
THC =
Jumlah sel yang dihitung
x pengenceran x 106
Volume yang dihitung
Jumlah fagosit yang aktif Jumlah fagosit yang diamati
Analisis Data
Pengaruh suplementasi ekstrak terhadap jumlah total hemosit dihitung dengan rumus :
Hasil dan Pembahasan
Hemosit merupakan salah satu bentuk system pertahanan tubuh yang bersifat seluler. Hemosit krustasea memainkan peranan penting pada respon immun. Menurut Smith et al. (2003) Hemosit juga memegang peranan yang sangat penting dalam mematikan agent penyebab infeksi melalui sintesis dan eksositosis suatu molekul bioaktif yang berupa protein mikrobisidal. Selanjutnya disebutkan bahwa faktor-faktor immuno-reactive (seperti peroxinectin, antibacterial peptida, clotting components) disimpan di dalam hemosit. Maka salah satu parameter kemampuan suatu zat atau senyawa untuk menstimulasi sistim pertahanan nonspesifik udang adalah melalui peningkatan jumlah hematosit. Penggunaan jumlah total hemosit sebagai indikator respon peningkatan pertahanan tubuh udang telah dilaporkan oleh Lee dan Shiau (2000); Lo´peza et al. (2003); Selvin et al. (2004). Hasil penelitian pengaruh suplementasi ekstrak jahe, kencur dan temulawak terhadap jumlah total hemosit vaname ditunjukan pada Tabel 1. Sedangkan pengaruh terhadap aktivitas fagositosis tertera pada Tabel 2. Berdasarkan hasil analisis pengaruh suplementasi ekstrak jahe, kencur dan temulawak
ekstrak jahe, kencur dan temulawak memberikan pengaruh terhadap jumlah total hemosit. Dari Tabel 1 tampak bahwa pengaruh suplementasi ekstrak jahe, kencur dan temulawak terhadap peningkatan jumlah hemosit udang vaname selama 3 minggu pengamatan menunjukkan pola pengaruh yang berbeda. Aplikasi ekstrak jahe menyebabkan penurunan jumlah hemosit pada minggu pertama aplikasi (-28,77%), tetapi meningkat pada dua minggu aplikasi (19,12%) dan tiga minggu aplikasi (3,69%). Sedangkan perlakuan ekstrak kencur menunjukkan pengaruh yang besar pada peningkatan jumlah total hemosit pada minggu pertama aplikasi (104,27%) selanjutnya mengalami penurunan yang tajam pada tiga minggu aplikasi (-46%). Aplikasi ekstrak temulawak menunjukkan stimulasi peningkatan jumlah hemosit terjadi mulai satu minggu aplikasi (46,43%) hingga 3 minggu aplikasi (3,5%). Pengaruh penurunan jumlah total hemosit terjadi pada beberapa penelitian aplikasi immunostimulan. Hasil review Smith et al. (2003) menunjukkan adanya efek aplikasi immunostimulant diantaranya adalah efek akut yang berupa penurunan yang cepat jumlah total hemosit. Penurunan jumlah hemosit ini disebabkan diantaranya adalah melalui proses degranulasi, lisis dan pembentukan cell clumps atau nodul. Mekanisme penurunan jumlah total hemosit oleh aplikasi immunostimulant secara ( THCP – THCK )
x 100% THCK
THCP = Jumlah total hemosit udang dengan perlakuan suplementasi ekstrak THCK = Jumlah total hemosit udang dengan
tanpa perlakuan suplementasi ekstrak (kontrol)
Pengaruh suplementasi ekstrak terhadap jumlah aktivitas fagositosis dihitung dengan rumus :
( AFP – AFK )
x 100% AFK
AFP = Aktivitas fagositosis udang dengan perlakuan suplementasi ekstrak
AFK = Aktivitas fagositosis udang dengan tanpa perlakuan suplementasi ekstrak (kontrol)
Tabel 1. Pengaruh suplementasi ekstrak jahe, kencur dan temulawak terhadap peningkatan jumlah total hemosit udang vanamei (%)
Waktu Peningkatan jumlah total hemosit (%)
(minggu ke) Jahe Kencur Temulawak
1 -28,77 + 21,76 104,27 + 43,11 46,44 + 3,42 2 19,12 + 40,11 4,83 + 8,02 7,35 + 56,15 3 3,69 + 2,61 -46,31 + 12,26 3,51 + 8,61
Tabel 2. Pengaruh suplementasi ekstrak jahe, kencur dan temulawak terhadap peningkatan aktivitas fagositosis hemosit udang vanamei (%)
Waktu Peningkatan aktivitas fagositosis (%)
(minggu ke)
Jahe Kencur Temulawak
1 2,65 + 26,34 12,51 + 24,59 -26,26 + 30,64 2 -31,29 + 49,96 33,94 + 63,49 -26,91 + 24,66 3 34,19 + 47,73 47,29 + 26,08 71,23 + 83,90
memperbaiki jumlah hemosit ini. Beberapa penelitian yang menunjukan immnostimulant dapat meningkatkan jumlah total hemosit telah dilakukan oleh Courdova et al. (2002) dan Selvin et al. (2004).
Berdasarkan pengamatan terhadap aktivitas fagositosis menunjukan bahwa perlakuan ekstrak jahe, kencur dan temulawak secara keseluruhan dapat memodulasi aktivitas fagositosis. Pengaruh tertinggi peningkatan aktivitas fagositosis
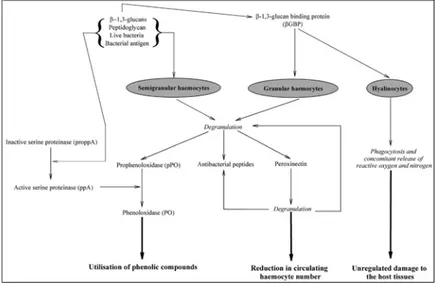
Gambar 1. Potensial merusak dari aplikasi immunstimulant untuk menstimulasi system immune krustase (Smith et al., 2003)
pada aplikasi ekstrak jahe, kencur dan temulawak berturut-turut adalah 34% (3 minggu aplikasi), 47,29% (3 minggu apliaksi) dan 71,23% (pada 3 minggu aplikasi). Menurut Lee dan Shiau (2004) fagositosis pada udang merupakan salah satu mekanisme pertahanan tubuh. Hemosit yang berperan utama dalam aktivitas ini adalah semigranular haemocytes (Bachere et al., 1995; Soderhall dan Cerenius, 1992). Hemosit krustacea memainkan peranan penting pada respon immun meliputi recognition, phagocytosis, melanization, cytotoxicity dan cell to cell communication (Johansson et al., 2000). Semigranular hemosit dilaporkan merupakan sel-sel utama yang berperan dalam fagositosis partikel asing (Bachere et al., 1995; Soderhall dan Cerenius, 1992). Sedangkan sel-sel hemosit granular dapat melakukan hemositosis tetapi dengan kemampuan yang lebih rendah (Hose dan Martin, 1989). Hemosit granular berperan dalam sistem pertahanan tubuh udang melalui aktivitas antibacterial. Penelitian lain membuktikan bahwa aplikasi immunostimulan dapat menyebabkan peningkatan fagositosis (Sung et al., 2000; Selvin et al., 2004; Lee dan Shiau, 2004).
Kesimpulan dan Saran
Kesimpulan
Berdasarkan hasil penelitian dapat disimpulkan bahwa suplementasi jahe, kencur dan temulawak pada dosis 10 g/kg pakan berpengaruh meningkatkan jumlah total hemosit dan aktivitas fagositosis hemosit udang vanamei.
Saran
Berdasarkan hasil penelitian dapat disarankan untuk dilakukan penelitian lebih lanjut mengenai potensi ekstrak jahe, kencur dan temulawak untuk menstimulasi sistem pertahanan tubuh nonspesifik udang vaname, terutama terkait dengan dosis optimum aplikasi dan lama waktu dan frekwensi aplikasi
Daftar Pustaka
Bachere, E., E. Mialhe and D. Noel. 1995. Knowledge
and research prospects in marine mollusca and crustacean, immunology. Aquaculture, 132:17–32.
Barracco, M.A., B. Duvic and So¨derha¨ll. 1991. The
beta-1,3-glucan-binding protein from the crayfish
Pacifastacus leniusculus, when reacted with a
beta-1,3-glucan, induces spreading and degranulation of crayfish granular cells. Cell
Tissue Research, 266: 491–97
Bjorklund, H., J. Bonderstam and G. Bylund. 1990.
Residue of oxytetracycline in wild fish and sediment from fish farm. Aquaculture, 86: 359– 367.
Bjorklund, H.V., C.M. Rabergh and G. Bylund. 1991.
Residue of oxonic acid and oxytetracycline in fish and sediment from fish farm. Aquaculture, 97: 85– 96.
Courdova, C.A.I., N.Y.H. Saavedra, R. De Phillips and F. Ascencio. 2002. Generation of superoxide anion
and SOD activity in haemocytes and muscle of American white shrimp (Litopenaeus vannamei) as a response to b-glucan and sulphated polysaccharide. Fish & Shellfish Immunology, 12: 353–366.
Couso, N, R. Castro, B. Magarin˜o, A. Obach and J. Lamas. 2003. Effect of oral administration of
glucans on the resistance of gilthead sea bream to pasteurellosis. Aquaculture, 219: 99–109.
Coyne R., M. Hiney, B. O’Connor, J. Kerry, D. Cazabon and P.Smith. 1994. Concentration and persistence
of oxytetracycline in sediments under a marine salmon farm. Aquaculture, 123: 31–42.
Dugenci, S.K., N. Arda and A. Candan. 2003. Some
medicinal plants as immunostimulan for fish.
J. Ethno pharmacology, 88: 99–106
Engstad, R.E., B. Robertsen and E. Frivold. 1992. Yeast
glucan induces increase in lysozyme and complement-mediated hemolytic activity in Atlantic salmon blood. Fish & Shellfish Immunology, 2: 287–97.
Esteban, M.A., A. Cuesta, J. Ortun˜o and J. Meseguer.
2001. Immunomodulatory e.ects of dietary intake of chitin in gilthead seabream (Sparus aurata L.) innate immune response. Fish & Shellfish
Immunology, 11: 303–15.
Henning, O., T. Itami, M. Maeda, M. Kondo, T. Natsukari and T. Takahashi. 1998. Analyses of hemolymph
immunoparameters in Kuruma shrimp infected with penaeid rod-draped DNA virus. Fish Pathol. 33: 389–393.
Hose, J.E. and G.G. Martin. 1989. Defense function of
granulocytes in the Ridgeback prawn Sicyonia
igentis. J. Invertebr. Pathol., 53: 335–346. Hose, J.E., G.G. Martin and A.S. Gerard. 1990. A decapods
hemocyte classification scheme integrating morphology, cytochemistry and function. Biology
Hematologi Ikan, Laboratorium Hama dan Penyakit Ikan, Universitas Gadjah Mada, Yogyakarta, 12 hlm.
Itami, T., M. Asano, K. Tokushige, K. Jubono, A. Nakagawa, N. Takeno, H. Nishimura, M. Maeda, M. Kondo and Y. Takahashi. 1998. Enhancement
of disease resistance of karuma shrimp, Penaeus
japonicus, after oral administration of
peptidoglycan derived from Bifidobacterium
thermophilum. Aquaculture, 164: 277–288. Johansson, M.W., P. Keyser, K. Sritunyalucksana and
K. Soderhall. 2000. Crustacean haemocytes and
haematopoiesis. Aquaculture, 191: 45–52.
Jones, J.G. 1986, Antibiotic resistance in aquatic bacteria, J. Antimicrobial Chemotherapy, 18: 149–154. Kerry, J., M. Hiney, R. Coyne, D. Cazabon, S.
Nicgabhainn and P. Smith. 1994. Frequency and
distribution of resistance to oxytetracycline in microorganisms isolated from marine fish farm sediment following therapeutic use of oxytetracycline. Aquaculture, 123: 43–54.
Le Moullac, G., C. Soyez, D. Saulnier, D. Ansquer, J.C. Avarre and P. Levy. 1998. Effect of hypoxic stress
on the immune response and the resistance to vibriosis of the shrimp Penaeus stylirostris. Fish
Shellfish Immunol., 8: 621–629.
Lee, M.H. and S.Y. Shiau. 2001. Dietary vitamin C and
its derivatives affect immune responses in grass shrimp, Penaeus monodon. Fish & Shellfish
Immunology, 12: 119–129.
Lee, M.H. and S.Y. Shiau. 2004. Vitamin E requirements of juvenile grass shrimp, Penaeus monodon, and
effects on non-specific immune responses. Fish
& Shellfish Immunology, 16: 475–485.
Lo´peza, N., C. Gerard, G. Gabriela, G. Taboadac, M. Valenzuelac, C. Pascualc, A. Sa´nchezc and C. Rosasc. 2003. Physiological, nutritional, and
immunological role of dietary h 1-3 glucan and ascorbic acid 2-monophosphate in
Litopenaeus vannamei juveniles. Aquaculture,
224: 223–243.
Lorenzon, S., S. Guarrini, V.J. Smith and E.A. Ferrero.
1999. Effects of LPS injection on circulating haemocytes in crustaceans in vivo. Fish &
Shellfish Immunol., 9: 31–50.
Rodriguez, A., A. Cuesta, J. Ortun˜o, M.A. Esteban and J. Meseguer. 2003a. Immunostimulant properties of a cell wall-modified whole Saccharomyces
cerevisiae strain administered by diet to sea bream
(Sparus auratai L.). Veterinary Immunology and
Immunopathology, 10: 183–192
Rodriguez, A., M.A. Esteban and J. Meseguer. 2003b. A
Sakai, M. 1999. Current research status of fish
immunostimulans. Aquaculture, 172: 63–92.
Selvin J, A.J. Huxley and A.P. Lipton. 2004.
Immunomodulatory potential of marine secondary metabolites against bacterial diseases of shrimp. Aquaculture, 230: 241–248
Smith, V.J., J.H. Brown and C. Hauton. 2003.
Immunostimulation in crustaceans: does it really protect against infection. Fish & Shellfish
Immunology, 15: 71–90.
Soderhall, K. and L. Cerenius. 1992. Crustacean
immunity. Annu. Rev. Fish Dis., 2: 3–23.
Sung H.H., G.H. Kou and Y.L. Song. 1994. Vibrosis
resistance induced by glucan treatment in tiger
shrimp (Penaeus monodon). Fish Pathology, 29: 11–7.
Sung H.H., P.A. Kuo and W.Y. Kao. 2000. Effect of
lipopolysaccharide on in vitro phagocytosis by hemocytes from giant freshwater prawn (Macrobrachium rosenbergii). Fish Pathology, 35: 109–16.
Sung H.H, Y.L. Yang and Y.L. Song. 1996. Enhancement
of microbicidal activity in the tiger shrimp,
Penaeus monodon, via immunostimulation. Journal of Crustacean Biology, 16: 278–84. Syukur, C. 2005. Pembibitan Tanaman Obat : Mengulas
40 jenis tanaman Obat Komersial. Penebar Swadaya, Jakarta, 113 hlm.