I
KAJIAN POTENSI INKOMPATIBILITAS DAN INSTABILITAS SEDIAAN RACIKAN KAPSUL BERISI HALOPERIDOL DAN
TRIHEKSIFENIDIL HIDROKLORIDA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Kresensia Novilinda Taek NIM : 168114118
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
viii ABSTRAK
Peracikan obat menjadi perhatian karena banyak memunculkan kejadian yang tidak dikehendaki seperti masalah farmasetis (inkompatibilitas) dan interaksi obat. Untuk mengatasi permasalahan tersebut maka perlu dilakukan pengkajian mengenai inkompatibilitas obat yang menyebabkan perubahan pada stabilitas obat. Tujuan dari penulisan ini yaitu mengetahui adanya potensi inkompatibilitas dan instabilitas sediaan racikan kapsul berisi obat haloperidol dan triheksifenidil hidroklorida.
Penulisan ini menggunakan metode kepustakaan (Library Research) kemudian dilakukan pengkajian mengenai inkompatibilitas dan instabilitas menggunakan beberapa literatur dengan kriteria yang sudah ditentukan. Penelusuran kepustakaan dilakukan dengan melihat informasi umum sediaan obat, sifat fisika dan kimia aktif dan potensi inkompatibilitas dan instabilitas yang mungkin dapat terjadi.
Hasil penelusuran menunjukkan bahwa resep racikan mengandung haloperidol dan triheksifenidil hidroklorida memiliki potensi inkompatibilitas dan instabilitas terhadap lembab, paparan cahaya matahari atau sinar UV, asam dan basa dan juga suhu namun boleh kedua obat diracik dengan beberapa perhatian seperti proses pembuatan dan penyimpanan sediaan racikan harus dijauhkan dari jangkauan sinar matahari langsung, menggunaka silika gel untuk mencegah cangkang kapsul terpapar oleh lembab, menggunakan kapsul HPMC yang lebih stabil serta penyimpanan kapsul dalam ruang atau tempat yang tidak terlalu lembab atau dingin dan kering, terbuat dari wadah plastik dan tertutup rapat.
Kata kunci: Peracikan; Kapsul; Inkompatibilitas; Instabilitas; Haloperidol; Triheksifenidil Hidroklorida.
ix ABSTRACK
Drug compounding is a great concern because it may cause undesired effect such as pharmaceutical problems (incompatibility) and drug interactions. To overcome this problem, it is necessary to do a study about the incompatibility of drugs that cause changes in drug stabilities. The purpose of this study is to find out the potential incompatibility and instability of the compounding of capsules containing haloperidol and ttrihexyphenidyl hydrochloride.
This writing uses the method of literature (Library Research) and then assesses the incompatibility and instability using some literature with predetermined criteria. A literature search is carried out by looking at general information on drug preparations, active physical and chemical properties, and potential incompatibilities and instability that may occur.
The search results show that prescription compounding containing of haloperidol and trihexyphenidyl hydrochloride which have the potential for incompatibility and instability against moisture, sunlight, UV light, acids and bases and are also free to be used for medicines that are formulated with the help of making and storing compounding greetings need to be kept away from possible Direct sunlight, using silica gel to prevent capsule shells from being exposed to moisture, uses a more stable HPMC capsule and also stores capsules in a room or place that is not too moist or cold and dry, made of plastic containers and tightly closed.
Keywords: Compounding; Capsule; Incompatibility; Instability; Haloperidol; Trihexiphenidyl Hydrochloride.
x
DAFTAR PUSTAKA
Halaman
JUDUL SKRIPSI ... i
PERSETUJUAN PEMBIMBING...ii
PENGESAHAN SKRIPSI BERJUDUL ... iii
PERNYATAAN KEASLIAN KARYA ... iiiv
PERNYATAAN PERSETUJUAN PUBLIKASI ... v
PRAKATA...vi
ABSTRAK ...iv
ABSTRACK ...ixi
DAFTAR ISI ... x
DAFTAR TABEL ...xi
DAFTAR GAMBAR ...xii
PENDAHULUAN ... 1
METODE PENULISAN ... 2
HASIL DAN PEMBAHASAN ... 5
KESIMPULAN ... 16
DAFTAR PUSTAKA ... 17
xi
DAFTAR TABEL
Tabel 1. Matriks Risiko Teknis berdasarkan Handbook of Extemporaneous
Preparation (Jackson and Lowey 2010)...3 Tabel 2. Matriks Risiko Klinis berdasarkan Handbook of Extemporaneous
Preparation (Jackson and Lowey 2010)...4 Table 3. Gugus fungsi dan potensi reaksi pada haloperidol ... 8 Table 4. Gugus fungsi dan potensi reaksi pada triheksifenidil hidroklorida ... 11
xii
DAFTAR GAMBAR
Gambar 1. Struktur obat haloperidol ... 6
Gambar 2. Gugus fungsi haloperidol ... 7
Gambar 3. Struktur obat triheksifenidilhidroklorida ... 9
1 PENDAHULUAN
Obat racikan (compounding medicine) adalah obat yang dibentuk dengan mencampur bahan-bahan aktif serta mengubah suatu bentuk sediaan menjadi bentuk sediaan lain. Di Indonesia masih banyak dokter yang memberikan obat dalam bentuk racikan (serbuk, serbuk terbagi, dan kapsul racikan). Hal ini dikarenakan beberapa obat dengan kekuatan utuh untuk dosis dewasa dengan komposisi dan dosis tertentu tidak tersedia dalam bentuk sediaan jadi (Andriani et al, 2013). Namun, peracikan obat menjadi perhatian karena terdapat berbagai resiko yang bisa terjadi, memunculkan kejadian yang tidak dikehendaki seperti masalah farmasetis (inkompatibilitas) dan interaksi obat kesalahan pengobatan (Turwewi, 2018).
Inkompatibilitas merupakan suatu kejadian dimana obat tidak tercampurkan secara fisika maupun kimia dan berakibat pada hilangnya potensi, meningkatnya toksisitas atau efek samping yang lain (Rochjana dkk, 2019). Inkompatibilitas obat dapat terjadi sebelum obat mencapai pasien yang dihasilkan dari reaksi fisikokimia antara beberapa obat, antara obat dengan pelarut atau dengan peralatan yang digunakan (Mirzaqon et al., 2018). Contoh inkompatibilitas suatu obat seperti serbuk menjadi lembab, terjadi perubahan warna pada sediaan dan terjadi endapan pada suatu larutan. Ketika obat berubah warna, bau, dan bentuk serta terdapat cemaran mikroba maka dapat disimpulkan bahwa obat tersebut tidak stabil. Suatu obat dapat dikatakan stabil jika kadarnya tidak berkurang dalam penyimpanan (Zaini and Gozali, 2016).
Resep racikan sediaan kapsul mengandung haloperidol dan triheksilfenidil hidroklorida merupakan contoh peracikan yang dilakukan di rumah sakit dengan permintaan resep kombinasi obat-obat ini sebesar 35,3% kasus (Permatasari, 2016) dan potensi interaksi obat haloperidol dan triheksifenidil hidroklorida sebesar 16% (Rahmi, 2017). Namun informasi tentang resiko, stabilitas, dan kompatibilitas yang komprehensif mengenai sediaan racikan tersebut masih belum tersedia. Studi ini bertujuan untuk memberikan informasi mengenai resiko peracikan, potensi
2
instabilitas, dan potensi inkompatibilitas pada resep racikan sediaan kapsul yang mengandung haloperidol dan triheksifenidil hidroklorida. Hasil studi ini diharapkan mampu memberikan gambaran bagi praktisi dalam melakukan peracikan sediaan tersebut, supaya dapat menghasilkan sediaan yang aman dan efektif bagi pasien. METODE PENULISAN
Desain dan Objek Studi
Studi ini menggunakan metode kepustakaan (Library Research). Pada studi ini dilakukan analisis risiko serta analisis potensi instabilitas dan inkompatibilitas pada kombinasi obat. Informasi dan data yang dikumpulkan pada studi ini mengenai inkompatibilitas dan instabilitas obat haloperidol dan triheksifenidil hidroklorida. Informasi diperoleh dengan bantuan berbagai macam material seperti dokumen, buku, artikel, maupun catatan mengenai ketidakcampuran antar kedua obat yang akan menghasilkan produk yang tidak diinginkan, yang dapat mempengaruhi keamanan, kemanjuran, penampilan dan stabilitas produk farmasi. Kejadian ketika terjadi perubahan warna, bau, bentuk, degradasi formulasi obat, kehilangan potensi (bahan aktif), kehilangan bahan-bahan tambahan (pengawet, antioksidan, dan lainnya) serta terdapat cemaran mikroba ketika obat haloperidol dan triheksifenidil hidroklorida dicampurkan akan menyebabkan ketidakstabilan pada produk obat. Salah satu contoh kasus mengenai resep yang mengandung haloperidol dan triheksifenidil hidroklorida memiliki frekuensi peresepan sebanyak 62 resep dalam satu bulan di sebuah Rumah Sakit. Salah satu contoh resep yang mengandung formula tersebut adalah:
R/ Haloperidol 5 mg 10 tab
Triheksifenidil 2 mg 10 tab m.f pulv. No. X da in caps S 3 dd caps I
3 Sumber data
Pada analisis potensi instabilitas dan inkompatibilitas pada kombinasi obat haloperidol dan triheksifenidil hidroklorida menggunakan berbagai literatur secara sistematis yaitu kompendia (Farmakope edisi V), database daring (Pubchem, Drugbank), dokumen atau artikel dari situs resmi (BPOM, KeMenKes, FDA, WHO, dll), buku referensi, dan berbagai artikel ilmiah. Pencarian artikel ilmiah dilakukan secara sistematis menggunakan bantuan mesin pencari google scholar dan PubMed dengan tanpa pengaturan batas minimal tahun penerbitan artikel. Kata kunci yang digunakan untuk pencarian adalah nama masing-masing obat, stabilitas/stability of (nama obat), inkompatibilitas/incompatibility of (nama obat atau gugus fungsi obat), interaksi obat/pharmaceutical drug interaction of (nama obat), degradasi/degradation of (nama obat atau gugus fungsi obat). Sedangkan analisis resiko dilakukan menggunakan matriks analisis resiko (Tabel 1 dan Tabel 2) berdasarkan Handbook of Extemporaneous Preparation (Jackson dan Lowey, 2010).
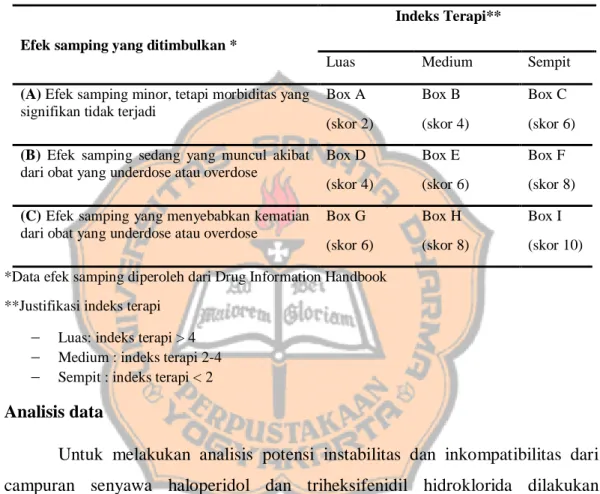
Tabel 1. Matriks Risiko Teknis berdasarkan Handbook of Extemporaneous Preparation (Jackson and Lowey 2010).
Kerumitan perhitungan*
Kerumitan proses peracikan**
Rendah Sedang Tinggi
Sederhana Box A (skor 2) Box B (skor 4) Box C (skor 6) Sedang Box D (skor 4) Box E ( skor 6) Box F (skor 8)
Sangat rumit Box G
(skor 6)
Box H (skor 8)
Box I (skor 10) *Justifikasi kerumitan perhitungan
Sederhana: tanpa perhitungan, perhitungan dengan penjumlahan, pengurangan, pembagian,
dan perkalian sederhana
Sedang: perhitungan dengan melibatkan perubahan satuan namun masih dalam unit sama
(contoh mg ke g)
Rumit : perhitungan dengan melibatkan perubahan satuan beda unit (satuan volume ke
4
**Justifikasi kerumitan proses peracikan
Rendah: melibatkan < 3 tahap peracikan
Sedang: melibatkan 4-5 tahap peracikan
Tinggi: melibatkan > 6 tahap peracikan, atau peracikan menggunakan alat khusus (blender,
homogenator)
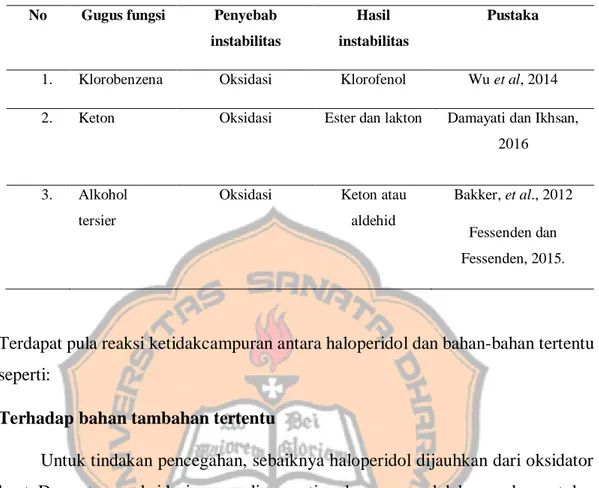
Tabel 2. Matriks Risiko Klinis berdasarkan Handbook of Extemporaneous Preparation (Jackson and Lowey, 2010).
Efek samping yang ditimbulkan *
Indeks Terapi**
Luas Medium Sempit
(A) Efek samping minor, tetapi morbiditas yang
signifikan tidak terjadi
Box A (skor 2) Box B (skor 4) Box C (skor 6)
(B) Efek samping sedang yang muncul akibat
dari obat yang underdose atau overdose
Box D (skor 4) Box E (skor 6) Box F (skor 8)
(C) Efek samping yang menyebabkan kematian
dari obat yang underdose atau overdose
Box G (skor 6) Box H (skor 8) Box I (skor 10) *Data efek samping diperoleh dari Drug Information Handbook
**Justifikasi indeks terapi
Luas: indeks terapi > 4
Medium : indeks terapi 2-4
Sempit : indeks terapi < 2
Analisis data
Untuk melakukan analisis potensi instabilitas dan inkompatibilitas dari campuran senyawa haloperidol dan triheksifenidil hidroklorida dilakukan pengkajian data informasi umum dari kedua obat seperti kandungan zat aktif, indikasi atau informasi kedua obat untuk suatu penyakit serta bentuk sediaan obat yang beredar dipasaran. Informasi mengenai sifat fisika dan kimia zat aktif masing-masing komponen obat untuk melihat potensi instabilitas atau inkompatibilitas pada publikasi ilmiah/literatur/studi. Kejadian instabilitas atau inkompatibilitas obat pada kondisi lembab, suhu tertentu, asam dan basa, serta pada pH tertentu dikaji dan jika obat peka pada beberapa kondisi yang ada maka faktor pemicu tersebut
tetap dipertimbangkan dapat berisiko menyebabkan instabilitas dan
5
dalam reaksi tertentu, dilakukan pengkajian terhadap penyebab instabilitas pada gugus fungsi tersebut yang kemungkinan dapat menghasilkan suatu produk toksik. Data dari analisis gugus fungsional yang menjadi kandungan utama dalam senyawa organik (obat) disajikan dalam uraian dan juga tabel, secara terperinci mengenai inkompatibilitas dan instabilitas yang diperoleh. Mengacu pada data yang diperoleh, dilakukan analisis untuk mencari potensi inkompatibilitas dan instabilitas dari campuran senyawa.
Analisis resiko dilakukan menggunakan matriks analisis resiko (Tabel 1 dan Tabel 2) berdasarkan Handbook of Extemporaneous Preparation (Jackson and Lowey, 2010). Analisis resiko yang dilakukan terbagi menjadi 2 aspek yaitu resiko teknis dan resiko klinis. Total skor analisis risiko adalah jumlah skor analisis risiko teknis dan risiko klinis. Hasil skor total risiko diklasifikasikan menjadi rendah (nilai 15).
HASIL DAN PEMBAHASAN Informasi umum
Tablet haloperidol dengan kandungan zat aktif haloperidol yang digunakan dalam studi ini merupakan tablet konfensional yang mengandung zat aktif haloperidol. Haloperidol yang merupakan antipsikotik generasi pertama dan merupakan obat yang paling utama pada penatalaksanaan semua tipe skizofrenia (Tan & Rahardja 2015). Haloperidol juga merupakan pilihan utama pada terapi tunggal pasien skizofrenia karena haloperidol merupakan salah satu obat turunan butiroferon yang tersedia dalam bentuk generik dan parenteral (Paramitha S, dkk, 2018). Haloperidol juga merupakan terapi tambahan jangka pendek untuk agitasi psikomotor, eksitasi, perilaku kekerasan atau impulsif yang berbahaya (PIONAS, 2020). Bentuk sendiaan yang tersedia dipasaran adalah haloperidol dengan bentuk tablet konfensional dan injeksi (ISO, 2019).
Sedangkan, triheksifenidil hidroklorida yang digunakan juga merupakan tablet konfensional berisi triheksifenidil hidroklorida yang merupakan obat golongan antikolinergik yang digunakan untuk mengatasi gejala penyakit parkinson
6
dan tremor (Dipiro, 2008). Triheksifenidil hidroklorida juga dipakai untuk mengontrol gangguan ekstrapiramidal akibat efek samping obat sistem saraf pusat seperti reserpin dan fenotiazin. Indikasi lain triheksifenidil hidroklorida adalah untuk menangani pasien gangguan kejiwaan pada pasien skizofrenia (Kusuma dkk, 2017). Mekanisme kerja dari triheksifenidil hidroklorida yakni menekan dan
menghambat reseptor muskarinik sehingga menghambat sistem saraf
parasimpatetik, dan juga memblok reseptor muskarinik pada sambungan saraf otot sehingga terjadi relaksasi (Vivi Swayami, 2014). Bentuk sediaan yang tersedia di pasaran berupa triheksifenisil hidroklorida dalam bentuk tablet konfensional (ISO, 2019).
Analisis sifat fisika kimia obat haloperidol
(Sumber: PubChem) Gambar 1. Struktur obat haloperidol
Tablet haloperidol mengandung haloperidol (C12H23CIFNO2) tidak kurang
dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket. Haloperidol merupakan serbuk amorf atau serbuk hablur halus; putih hingga agak kekuningan. Larutan jenuh bereaksi netral terhadap lakmus. Haloperidol stabil pada pH 3.0-3.6, serta memiliki titik lebur antara 147ºC dan 152ºC. Haloperidol bersifat tidak higroskopis dan dapat disimpan dalam wadah tertutup rapat, tidak tembus cahaya. Haloperidol praktis tidak larut dalam air; larut dalam kloroform; agak sukar larut dalam etanol; sukar dalam eter (Kementrian Kesehatan RI, 2014).
7 Stabilitas terhadap lembab
Pada penelitian Shameen (2014), dinyatakan bahwa tablet haloperidol yang diuji menghasilkan hasil yang memuaskan. Pada suhu tinggi dan kelembaban tinggi tablet haloperidol tidak memiliki efek buruk pada sifat fisik atau kimia tablet (Shameen, 2014).
Stabilitas terhadap cahaya
Haloperidol stabil dalam berbagai bentuk sediaan. Namun pada penelitian Gadhavi (2014), bubuk haloperidol disimpan pada ruang radiasi sinar UV selama 2 hari diketahui mengalami degradasi fotolitik sebanyak 10,95% (Gadhavi, 2014). Stabilitas terhadap asam basa
Pada penelitian Gadhavi (2014), pengujian degradasi haloperidol dalam medium asam dan basa diperoleh hasil berupa pada kondisi asam dengan yaitu dengan penambahan larutan HCl 0,1N dan disimpan pada suhu 80˚C selama 2 jam diperoleh hasil degradasi sebanyak 12,96%. Sedangkan haloperidol yang diberi tambahan larutan NaOH 0,1N pada penyimpanan selama 2 jam dengan suhu 80˚C diperoleh hasil degradasi sebanyak 16,14% (Gadhavi, 2014).
Stabilitas terhadap suhu
Untuk studi degradasi oleh panas, bubuk haloperidol yang disimpan pada cawan petri dan beri suhu panas kering (80˚C) selama 12 jam dalam oven kemudian. Hasil degradasi yang di peroleh yaitu sebanyak 10,95% (Gadhavi, 2014).
Gambar 2. Gugus fungsi haloperidol 1
3
2 Klorobenzena
Keton
8
Table 3. Gugus fungsi dan potensi reaksi pada haloperidol
No Gugus fungsi Penyebab
instabilitas
Hasil instabilitas
Pustaka
1. Klorobenzena Oksidasi Klorofenol Wu et al, 2014
2. Keton Oksidasi Ester dan lakton Damayati dan Ikhsan,
2016
3. Alkohol
tersier
Oksidasi Keton atau
aldehid
Bakker, et al., 2012
Fessenden dan Fessenden, 2015.
Terdapat pula reaksi ketidakcampuran antara haloperidol dan bahan-bahan tertentu seperti:
Terhadap bahan tambahan tertentu
Untuk tindakan pencegahan, sebaiknya haloperidol dijauhkan dari oksidator kuat. Dua zat pengoksidasi yang paling penting dan umum adalah asam kromat dan kalium permanganate (Pasaribu, 2018). Beberapa contoh bahan kimia lain yang merupakan oksidator yaitu permanganat, perklorat, dikromat, hidrogen peroksida, periodat, persulfat, benzil peroksida, asetil peroksida eter oksida peroksida, dan eter oksida (Wismono, 2007). Salah satu bahan yang pengandung zat oksidator yaitu bahan pengikat tablet seperti polivinil pirolidon (PVP). Polivinil pirolidon (PVP) atau pirolidon umumnya digunakan sebagai bahan pengikat tablet (Soedirman dkk, 2009). PVP juga digunakan sebagai bahan pembentuk film, dan juga untuk membentuk dispersi amorf pada obat. PVP diproduksi oleh radikal bebas polimerisasi N-vinylpyrrolidone menggunakan hidrogen peroksida sebagai inisiator; PVP komersial selalu mengandung jejak peroksida yang tidak bereaksi yang dapat mengoksidasi bahan aktif farmasi. Pada penelitian Bharate et al, menyatakan ada interaksi yang kuat antara PVP dan haloperidol yang teramati (Bharate, Bharate and Bajaj, 2010). Gugus yang dapat mengalami oksidasi yaitu
9
gugus alkohol dan keton. Oksidasi alkohol biasanya dilakukan dengan asam kromat (H2CrO4) yang akan menghasilkan Na2Cr2O7 atau CrO3 (kromat anhidrat). Keton
dapat teroksidasi menggunakan asam peroksi yang menghasilkan ester dan asam karboksilat (Pasaribu, 2018).
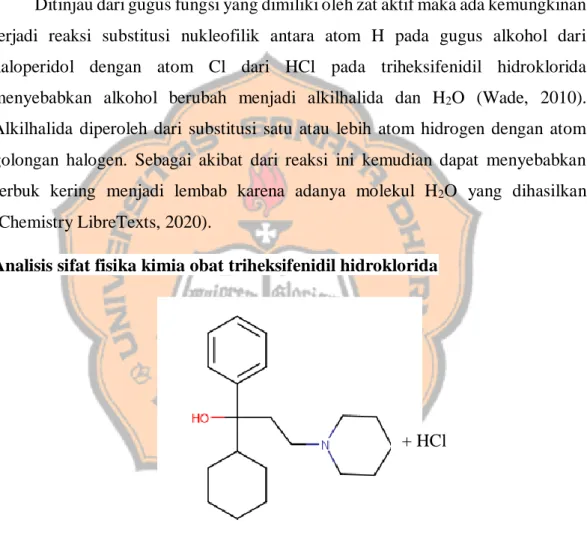
Terhadap zat lain
Ditinjau dari gugus fungsi yang dimiliki oleh zat aktif maka ada kemungkinan terjadi reaksi substitusi nukleofilik antara atom H pada gugus alkohol dari haloperidol dengan atom Cl dari HCl pada triheksifenidil hidroklorida menyebabkan alkohol berubah menjadi alkilhalida dan H2O (Wade, 2010).
Alkilhalida diperoleh dari substitusi satu atau lebih atom hidrogen dengan atom golongan halogen. Sebagai akibat dari reaksi ini kemudian dapat menyebabkan serbuk kering menjadi lembab karena adanya molekul H2O yang dihasilkan
(Chemistry LibreTexts, 2020).
Analisis sifat fisika kimia obat triheksifenidil hidroklorida
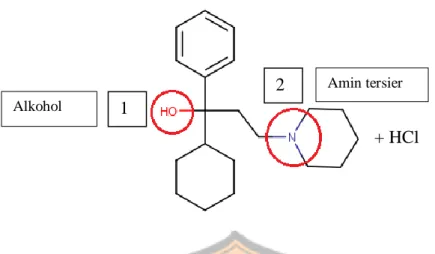
Gambar 3. Struktur obat triheksifenidil hidroklorida
Triheksifenidil hidroklorida mengandung tidak kurang dari 98,0% dan tidak lebih dari 102,0% C20H31NO.HCl, dihitung terhadap zat yang telah dikeringkan.
Triheksifenidil hidroklorida merupakan serbuk hablur putih atau hampir putih; bau lemah; melebur pada suhu lebih kurang 250ºC. Triheksifenidil hidroklorida stabil pada pH 5.0-6.0, serta titik lebur 115ºC (The International Pharmacopoeia, 2016). Triheksifenidil hidroklorida sukar larut dalama air, larut dalam etanol dan dalam
10
kloroform (Kementerian Kesehatan RI, 2014). Triheksifenidil hidroklorida juga stabil dalam beberapa keadaan seperti:
Stabilitas terhadap cahaya
Pada penelitian Shetti dan Venkatachalam 2010, menyatakan studi degradasi yang dilakukan untuk menunjukkan selektivitas dan stabilitas obat dengan sampel tablet diberi degradasi fotolitik (yaitu dalam UV dan cahaya putih selama 2,5 hari) menunjukkan triheksifenidil hidroklorida ditemukan peka terhadap degradasi oksidatif, di mana uji turun menjadi 90,5% pada UV light dan 91,3% pada white light (Shetti and Venkatachalam, 2010).
Stabilitas terhadap suhu
Pada penelitian Shetti dan Venkatachalam 2010 juga dilakukan pengujian degradasi termal pada 105°C selama 4 jam dan hasilnya menunjukkan tablet triheksifenidil hidroklorida ditemukan peka terhadap degradasi termal, di mana pengujian turun menjadi 91,9% (Gadhavi, 2014).
Stabilitas terhadap asam dan basa
Pada penelitian Shetti dan Venkatachalam 2010, dilakukan pengujian stabilitas terhadap asam dan basa dengan cara larutan sampel diberi larutan asam 0,1N HCl pada suhu 80°C selama 30 menit, larutan basa 0,1N NaOH pada suhu 80°C selama 60 menit, pengoksidasi (0,1% H2O2 pada suhu 30°C selama 30 menit dan pereduksi 0,1% natrium metabisulfit pada suhu 30°C selama 30 menit. Hasil pengujiannya menunjukkan penurunan persentase assay yang menandakan adanya degradasi (Shetti and Venkatachalam, 2010).
Triheksifenidil hidroklorida juga memiliki beberapa gugus fungsi yang masing-masing berperan dalam reaksi tertentu seperti berikut:
11
Gambar 4. Gugus fungsi triheksifenidil hidroklorida
Triheksifenidil hidroklorida memiliki beberapa gugus fungsi yang masing-masing berperan dalam reaksi tertentu seperti berikut:
Table 4. Gugus fungsi dan potensi reaksi pada triheksifenidil hidroklorida
No Gugus fungsi Penyebab
instabilitas Hasil instabilitas Pustaka 1. Alkohol tersier Oksidasi Keton/asam karboksilat dan alkil halida Stoker, 2013
2. Amin tersier Dealkilasi Gugus NH2 Stoker, 2013
Terdapat juga reaksi ketidakcampuran antara triheksifenidil hidroklorida dan bahan-bahan tertentu seperti:
Terhadap bahan tambahan
Berdasarkan (British Pharmacopoeia Commission, 2013), triheksifenidil hidroklorida mengalami inkompatibilitas dengan zat pengoksidasi kuat. Seperti pada haloperidol, gugus yang dapat mengalami oksidasi yaitu gugus alkohol. Oksidasi alkohol biasanya dilakukan dengan asam kromat (H2CrO4) yang akan
menghasilkan Na2Cr2O7 atau CrO3 (kromat anhidrat). Zat pengoksidasi yang paling
penting dan umum adalah asam kromat dan kalium permanganate (Pasaribu, 2018). + HCl
1
2 Alkohol
12
Beberapa contoh bahan kimia lain yang merupakan oksidator yaitu permanganat, perklorat, dikromat, hidrogen peroksida, periodat, persulfat, benzil peroksida, asetil peroksida eter oksida peroksida, dan eter oksida (Wismono, 2007).
Terhadap zat lain
Seperti pada haloperidol, ditinjau dari gugus fungsi yang dimiliki oleh zat aktif maka ada kemungkinan terjadi reaksi substitusi nukleofilik antara atom H pada gugus alkohol dari haloperidol dengan atom Cl dari HCl pada triheksifenidil hidroklorida menyebabkan alkohol berubah menjadi alkilhalida dan H2O (Wade,
2010). Alkilhalida diperoleh dari substitusi satu atau lebih atom hidrogen dengan atom golongan halogen. Sebagai akibat dari reaksi ini kemudian dapat menyebabkan serbuk kering menjadi lembab karena adanya molekul H2O yang
dihasilkan (Chemistry LibreTexts, 2020). Potensi inkompatibilitas dan instabilitas
Potensi instabilitas dan inkompatibilitas dilakukan dengan melihat sifat fisika dan kimia zat aktif masing-masing komponen, serta berdasarkan studi stabilitas atau studi kompatibilitas obat berdasarkan publikasi ilmiah. Pada studi ini dilakukan penelusuran potensi inkompatibilitas dan instabilitas dari sediaan racikan kapsul berisi haloperidol dan triheksifenidil hidroklorida. Studi ini menggunakan metode kepustakaan untuk mendapatkan informasi mengenai data inkompatibilitas dan instabilitas dengan melihat sifat fisika kimia dari masing-masing obat. Informasi sifat fisika kimia yang telah diperoleh digunakan untuk melihat adanya kemungkinan inkompatibilitas dan instabilitas dari kedua obat.
Pada resep racikan kombinasi obat haloperidol dan triheksifenidil hidroklorida terdapat beberapa permasalahan yang berpotensi menyebabkan kejadian inkompatibilitas dan instabilitas pada sediaan racikan yang akan dibuat diantaranya adanya potensi instabilitas fisik yaitu terjadinya lembab pada serbuk yang dapat menyebabkan serbuk obat menggumpal sehingga obat tidak tercampur dengan baik. Hal ini diakibatkan oleh beberapa faktor seperti kelembaban udara yang tinggi dari disuatu ruangan, sirkulasi udara yang tidak seimbang sehingga
13
dapat merangsang pertumbuhan mikroba seperti virus, jamur, bakteri, protozoa dll (Sri Arjani, 2011). Cangkang kapsul gelatin yang digunakan juga dapat mengalami instabilitas fisik karena apabila disimpan pada tempat dengan kelembaban udara yang tingi maka uap air akan terabsorpsi oleh kapsul gelatin dan kapsul akan terdistorsi dan kehilangan bentuk yang kaku. Sebaliknya, dalam kondisi lingkungan yang sangat kering, kelembaban yang ada dalam kapsul akan hilang dan kapsul menjadi rapuh sehingga apabila kapsul tersebut dipegang akan mudah hancur. Oleh karena itu, kapsul gelatin yang keras harus selalu dijaga pada lingkungan yang bebas dari kelembaban atau kekeringan yang berlebihan (Murtini dan Elisa, 2018).
Tablet haloperidol dan triheksifenidil hidroklorida juga diketahui mengalami degradasi yang akan mempengaruhi stabilitas fisik dari produk sediaan racikan obat oleh suhu tertentu, sehingga produk yang dihasilkan dari campuran kedua obat kemungkinan dapat terdegradasi melalui jalur suhu/panas. Degradasi obat dapat juga membuat obat berubah bentuk secara estetika sehingga tidak dapat digunakan seperti perubahan warna dan bau (Sabdowati, 2015). Sensivitas masing-masing obat terhadap suhu penyimpanan menyebabkan kedua obat harus dikemas dalam kondisi wadah kedap udara (Suryani, Supandi and Sabdowati, 2019). Namun kemungkinan pada proses peracikan ini tidak terjadi degradasi kedua obat dikarenakan peracikan di rumah sakit dilakukan pada suhu <25°C dengan kelembab relatif pada ruangan antara 40-50% serta dilengkapi dengan sistem pendingin yang dapat menjaga suhu ruangan sesuai dengan Kemenkes RI tahun 2019 tentang Petunjuk Teknis Standar. Pada Permenkes No. 72 tahun 2016 tentang Standar Pelayanan Kefarmasian di Rumah Sakit, suhu udara diruang bersih dan ruang steril dipelihara pada suhu 16-25°C, terdapat juga lemari pendingin dan pendingin ruangan untuk obat yang termolabil serta kelembaban relatif pada ruang antara 45-55%.
Terdapat juga potensi instabilitas dari tablet haloperidol dan triheksifenidil hidroklorida yang diketahui peka terhadap paparan cahaya matahari atau sinar UV (UV light dan white light) (Shetti and Venkatachalam, 2010) pada penyimpanan selama 2 sampai 2,5 hari. Oleh sebab itu, pada saat proses pembuatan harus dijauhkan
14
dari jangkauan sinar matahari, tidak boleh dikemas di plastik klip biasa karena dapat merusak obat. Pada pengujian stabilitas pada pH dari masing-masing obat diketahui adanya degradasi pada suasana asam maupun basa melalui reaksi hidrolisis. Hidrolisis biasanya merupakan reaksi utama dari degradasi obat dalam bentuk larutan sehingga pada sediaan ini kemungkinan tidak mengalami reaksi dikarenakan sediaan racikan yang dibuat dalam bentuk sediaan solid (padat) yang tidak memerlukan penambahan pelarut, obat dapat diformulasikan pada pH dengan stabilitas optimum dan dengan mengontrol kadar obat sediaan (Sabdowati, 2015).
Permasalahan yang terjadi pada saat peracikan dapat diatasi dengan beberapa alternatif penyelesaian diantaranya pencampuran kedua obat harus dihindarkan dari sinar matahari langsung untuk mencegah terjadinya degradasi fotolisis. Peracikan dapat dilakukan di ruangan yang mendapatkan cahaya dan sirkulasi udara yang cukup. Jika memungkinkan disediakan pendingin ruangan (air conditioner) sesuai kebutuhan (Permenkes RI, 2016). Upaya mencegah cangkang kapsul gelatin keras terpapar oleh lembab, maka seringkali cangkang kapsul-kapsul tersebut dikemas bersama dengan kantong kecil yang berisi bahan penyerap lembab, seperti: silika gel kering (Murtini dan Elisa, 2018). Cangkang kapsul gelatin yang mudah lembab juga dapat diganti menggunakan kapsul HPMC-keragenan dikarenakan cangkang kapsul HPMC-karagenan memiliki proteksi terhadap perubahan kelembaban yang lebih baik dibanding gelatin (Richardson, 2011). Penyimpanan kapsul juga sebaiknya disimpan dalam ruang atau tempat yang tidak terlalu lembab atau dingin dan kering, terbuat dari wadah plastik, tertutup rapat dan diberi bahan pengering dan pada alumunium foil dalam blister atau strip (Syamsuni, 2005).
Berdasarkan hasil penelusuran data potensi inkompatibilitas dan instabilitas sediaan racikan kapsul berisi obat haloperidol dan triheksifenidil hidroklorida yang diperoleh, ditemukan adanya potensi ketidakstabilan dan inkompatibilitas yang mungkin terjadi yaitu potensi terjadinya kelembaban pada serbuk, reaksi fotolisis dan reaksi hidrolisis. Namun beberapa upaya dapat dilakukan untuk meningkatkan kualitas obat dan menjamin keamanannya yaitu menggunakan cangkang kapsul
15
HPMC-karagen, menyimpan sediaan dalam wadah tertutup rapat, terhindar dari cahaya matahari dan menambahkan silika gel sehingga kedua obat boleh diracik dalam bentuk sediaan kapsul.
Analisis Risiko pada Resep
Resep racikan kapsul mengandung haloperidol dan triheksifenidil
hidroklorida termasuk dalam kategori risiko sedang berdasarkan Handbook of Extemporaneous Preparation (Jackson dan Lowey, 2010) dengan total nilai yakni 6. Pada Matriks Risiko Teknis, resep racikan ini memiliki kerumitan perhitungan termasuk dalam kategori sederhana dan kerumitan proses peracikannya termasuk dalam kategori sedang dengan total skor yakni 2. Resep ini merupakan resep tanpa perhitungan, perhitungan dengan penjumlahan, pengurangan, pembagian, dan perkalian sederhana serta melibatkan 4-5 tahap peracikan. Untuk Matrik Risiko Klinis, resep racikan ini memiliki skor 2 dikarenakam obat haloperidol dan triheksifenidil hidroklorida memiliki ) efek samping minor, tetapi morbiditas yang signifikan tidak terjadi serta indeks terapi luas. Berdasarkan diatas, maka secara garis besar risiko yang mungkin dihadapi dalam peracikan sediaan kapsul ini tidak berakibat buruk/berbahaya bagi pasien sehingga boleh diracik secara bersamaan.
16 KESIMPULAN
Resep racikan kapsul yang mengandung haloperidol dan triheksifenisil hidroklorida berpotensi mengalami ketidakstabilan seperti potensi terjadinya kelembaban pada serbuk, reaksi fotolisis dan reaksi hidrolisis . Upaya pencegahan yang dapat dilakukan oleh tenaga kefarmasian untuk meminimalisasikan kejadian inkompatibilitas dan instabilitas dalam racikan kapsul yaitu penggunaan silika gel, penggunaan kapsul HPMC-karagen dan penyimpanan sediaan dalam wadah tertutup rapat, terhindar dari cahaya langsung pada suhu ruang. Namun, sediaan racikan ini tidak berpotensi mengalami inkompatibilitas.
SARAN
Peracikan sediaan kapsul berisi haloperidol dan triheksifenidil hidroklorida dapat dilakukan dengan memperhatikan upaya-upaya yang harus dilakukan untuk meminimalisasikan potensi instabilitas pada sediaan racikan kapsul sepertiini. Meskipun demikian, potensi instabilitas yang ditemukan dalam studi ini masih berdasar pada kajian pustaka, sehingga perlu dilakukan penelitian eksperimental untuk mengetahui profil stabilitas dan kompatibilitas sediaan racikan tersebut.
17
DAFTAR PUSTAKA
Andriani, D. et al., 2013. Profil Peresepan Sediaan Kapsul Racikan Di Apotek “ X ” Di Surabaya. 1(2). Departemen Farmasi Komunitas, Fakultas Farmasi, Universitas Airlangga. Surabaya. pp. 42.
Bakker, P., Herman W., Vincet G.m Ben N., Rachel van der Kaaij, Nicolien W., 2012. Dermatological Preparation for The Tropics A Formulary of Dermatological Preparation and Background Information on Therapeutic Choices, Production and Dispensing. Second revised edition, Beta Science Shop. Netherland. 124-128.
Bharate, S. S., Bharate, S. B. and Bajaj, A. N., 2010. Interactions and incompatibilities of pharmaceutical excipients with active pharmaceutical ingredients: A comprehensive review. Journal of Excipients and Food Chemicals. 1(3). pp. 3–26.
Bhermana, B. G., Safni and Syukri,. 2015). Degradasi Zat Warna Metanil Yellow Secara Fotolisis Dan Penyinaran Matahari Dengan Penambahan Katalis Tio2 -Anatase Dan Sno2. Journal of Islamic Science and Technology, 1(1), pp. 49–62.
BPOM, 2019. Haloperidol http://pionas.pom.go.id/monografi/haloperidol diakses pada tanggal 16 Oktober 2019 pukul 19.21.
BPOM, 2019. Triheksifenidil http://pionas.pom.go.id/monografi/triheksifenidil diakses pada tanggal 16 Oktober 2019 pukul 19.42.
British Pharmacopoeia Commission., 2013. Safety data sheet: gliclazide assay standard. (1), pp. 2–7.
Damayati dan Ikhsan, 2016. Aldehida & Keton: Aplikasi Augmented Reality pada Pembelajaran Kimia. Augmented Reality Media. Yogyakarta. Hal. 71-72. Desai, K., and Gokani, R., 2012. Stability Study: Regulatory Requirement.
International Journal of Advances in Pharmaceutical Analysis. 2(3). pp. 62–67.
18
Dipiro J.T., Talbert R.L., Yee G.C., Matzke G.R., Wells B.G., Posey L.M.,2008. Pharmacotherapy a pathophysiologic approach. Edisi ke-7. McGraw-Hill Companies. New York.
Fessenden dan Fessenden., 2015. Kimia Organik. Edisi 3. Penerbit Erlangga. Jakarta. Hal. 27-30.
Gadhavi, R., 2014. Development and Validation of Stability Indicating Assay Method of Haloperidol in Oral Solution. 4(5). pp. 2014319–329.
ISO., 2019. Haloperidodl. Volume 52. Isfi Penerbitan. Jakarta. Hal. 304. ISO., 2019. Triheksifenidil. Volume 52. Isfi Penerbitan. Jakarta. Hal. 177-178. Jackson, M., dan Lowey, A., 2010. Handbook of Extemporaneous Preparation.
Pharmaceuticals Press.
Kemendikbud, 2019. Reaksi Unsur Alkali dengan Asam Encer.
https://medukasi.kemendikbud.go.id/medukasi/produkfiles/kontenkm/km 2016/KM201610/ReaksiAlkaliDenganAsam.html diakses pada tanggal 17 Mei 2020 pukul 21.43.
Kementerian Pendidikan dan Kebudayaan., 2013. Dasar-Dasar Kefarmasian. Jakarta.
Kementrian Kesehatan Republik Indonesia., 2014. Farmakope Indonesia edisi V. Kementrian Kesehatan RI. Jakarta.
Kementrian Kesehatan Republik Indonesia., 2014. Peraturan Menteri Kesehatan Republik Indonesia Nomor 58 Tahun 2014 tentang Standar Pelayanan Kefarmasian di Rumah Sakit.
Kementrian Kesehatan Republik Indonesia. 2016. “Peraturan Menteri Kesehatan No 72 Tahun 2016 Tentang Standar Pelayanan Kefarmasian Di Rumah Sakit.”
Kirk Othmer, 1998, Encyclopedia of Chemical Technolog, 4nd edition. Vol.7. Interscience Willey.
19
Krisantii, J.D., Sentosa, S., 2008. Metodologi Penelitian Biomedis Edisi 2. Danamartha Sejahtera Utama. Bandung. hal. 47.
Kusuma D., Dewi A.K., dan Hermanto B., 2017. Pengaruh Pemberian
Triheksifenidil Dosis Bertingkat Per Oral terhadap Diameter Lumen Tubulus Ginjal Mus Musculu. eJKI Vol. 5. Surabaya. Hal. 152.
Li, J., and Wu, Y., 2014. Lubricants in Pharmaceutical Solid Dossagr Form. Lubricants. 2(1), pp. 21-43.
Luxminarayan, L. et al., 2017. Asian Journal of Pharmaceutical Research and Development. Asian Journal of Pharmaceutical Research and Development. 5(2). pp. 1–8.
Mirzaqon, A. et al., 2018. Studi Kepustakaan Mengenai Landasan Teori Dan Praktik Konseling Jurnal Farmaka. Hal. 1-8.
Niazi and Sarfaraz, 2006. Handbook of Preformulation: Chemical, Biological, and Botanical Drugs. Informa Healthcare USA Inc. New York.
Paramitha S. R., Endang S. E., dan Kartika U. M., 2018. Analisis Rasionalitas Penggunaan Antipsikotik Pada Pasien Skizofrenia Di Instalasi Rawat Inap RSJD Atma Husada Mahakam Samarinda Tahun 2016. Pharmacon: Jurnal Farmasi Indonesia. Surakarta. Hal. 23.
Pasaribu, 2018. Sintesis Basa Schiff Antara Dialdehid Alginat Dengan Kitosan Dan Pengujian Sifat Antibakteri. Universitas Sumatera Utara. Hal. 6 & 8. Permatasari, V. D., 2016. Pola Penggunaan Antipsikotik pada Pasien Skizofrenia
di Instalasi Rawat Inap Rumah Sakit Jiwa Grhasia, Yogyakarta Tahun
2014. Universitas Gadjah Mada, 2016. Diunduh dari
http://etd.repository.ugm.ac.id/ pada tanggal 18 November 2019 pukul 11.14. pp. 3–4.
20
Permekes, 2016. Peraturan Menteri Kesehatan Republik Indonesia Nomor 74 Tahun 2016 Tentang Standar Pelayanan Kefarmasian di Puskesmas. Kemenkes RI. Jakarta. Hal. 28.
PIONAS, 2019. Haloperidol, diakses pada tanggal 19 November 2019 pukul 11.34
http://pionas.pom.go.id/monografi/haloperidol
PIONAS, 2019. Triheksifenidil, diakses pada tanggal 19 November 2019 pukul 11.42 http://pionas.pom.go.id/monografi/triheksifenidil
Pubchem, 2020. Terfenadin, diakses pada tanggal 05 Mei 2020 pukul 15.32
https://pubchem.ncbi.nlm.nih.gov/compound/haloperidol diakses pada
tanggal 05 Mei 2020.
Rahmi, A., 2017. Pasien Skizofrenia Paranoid Rawat Jalan. Universitas Andalas. Padang.
Rochjana A.U.H., Jufri M., Andrajati R., Sartika R.A.D., 2019. Masalah Farmasetika dan Interaksi Obat pada Resep Racikan Pasien Pediatri: Studi Retrospektif pada Salah Satu Rumah Sakit di Kabupaten Bogor. Jurnal Farmasi Klinik Indonesia. Depok. Hal. 43.
Sabdowati, R. A., 2015. Uji Stabilitas Obat Spironolakton Terhadap Perubahan pH dengan Menggunakan Kromatografi Cair Kerja Tinggi (KCKT). UIN Syarif Hifayatullah. Jakarta. Hal. 6-8.
Shamen, S., 2014. Development Of Analytical Methods For The Determination Of Haloperidol In Commercial Dosages Forms. Department Of Chemistry Aligarh Muslim University Aligarh. India. Pp. 2-7.
Shetti, P. and Venkatachalam, A. 2010. Stability indicating HPLC method for simultaneous quantification of trihexyphenidyl hydrochloride, trifluoperazine hydrochloride and chlorpromazine hydrochloride from tablet formulation. E-Journal of Chemistry, 7(SUPPL. 1). doi: 10.1155/2010/529386.
21
Soedirman, I., Siswanto, A., dan Ernawati, Y., 2009. Pengaruh Metode Penambahan Pvp Sebagai Bahan Pengikat Terhadap Sifat Fisis Tablet Asam Mefenama. Pharmacy, Volume 06. Purwokerto. Hal. 36.
Sri Arjadi I.A.M.., 2011. Kualitas Udara Dalam Ruang Kerja. Jurnal Skala Husada, Vol. 8 (2): Denpasar. Hal. 181.
Stoker, H. S., 2013. General, Organic, and Biological Chemistry. 6th edition.
Belmont, USA: Brooks/Cole.
Tan H.T., dan Rahardja K., 2015. Obat–Obat Penting Edisi 7. Elex Media Komputindo. Jakarta.
The International Pharmacopoeia, 2016. Trihexyphenidyl hydrochloride
(Trihexyphenidyli hydrochloridum). Sixth Edition. WHO.
Tuerwewi, S.W., 2018. Evaluation Of Compounding Medicine Absorption And Availibility Of Drug Formula For Pediatrics Patients In Pharmacies In Kota Kupang. CHM-K Pharmaceutical Scientific Journal. Kupang. Hal. 54. Vadas, E.B. (2010). Stability of Pharmaceutical Products. dalam Remington: The Science and Practice of Pharmacy. Volume 1. Editor: Alfonso Gennaro. London: Lippincott Williams & Wilkins.
Vivi Swayami, I., 2014. Aspek Biologi Triheksifenidil Di Bidang Psikiatri. Medicina. Fakultas Kedokteran Universitas Udayana. Bali. 45(2). pp. 88-89.
Wade, Jr., L. G., 2010. Organic Chemistry. 7th edition. New York: Pearson Inc. Pp. 432-433, 478-488, 503, and 881.
Widyaswari, R. and Wiedyaningsih, C., 2012. Evaluasi Profil Peresepan Obat Racikan Dan Ketersediaan Formula Obat Untuk Anak Di Puskesmas Propinsi Diy Evaluation of Compounding Prescription Profile and Availability of Medicine Pediatric Formulation in Primary Health Care Diy Province. Chairun Wiedyaningsih Majalah Farmasuetik. 8(3). p. 227.
22
Wismono, J., 2007. Kimia dan Kecakapan Hidup. Graneca Exact. Jakarta. Hal. 115.
Wu, R., Wang, S., and Wang, L., 2014. Atmospheric oxidation mechanism of chlorobenzene. Chemosphere. China. Pp. 542.
Yulianty, M. D., Cahaya, N., and Srikartika, V. M., 2017. Studi Penggunaan Antipsikotik dan Efek Samping pada Pasien Skizofrenia di Rumah Sakit Jiwa Sambang Lihum Kalimantan Selatan. 3(May). pp. 153–164.
Zain, E. R. and Rafaid, Y., 2019. Analisis Pengaruh Faktor Udara Ruang Produksi terhadap Mutu Cangkang Kapsul Kosong secara Mikrobiologi Impactness of Air Conditions at Production Room to Empty Hard Capsules Quality based on Microbiologically.
Zaini, A. N., and Gozali, D., 2016. Pengaruh Suhu Terhadap Stabilitas Obat Sediaan Suspensi. Jurnal Farmaka. 14(2). pp. 1–13.
23
BIOGRAFI PENULIS
Penulis skripsi dengan judul “Kajian Potensi Inkompatibilitas Dan Instabilitas Sediaan Racikan Kapsul Berisi Haloperidol dan Triheksifenidil Hidroklorida” adalah Kresensia Novilinda Taek, lahir di Kefamenanu, Nusa Tenggara Timur pada 30 November 1998. Penulis merupakan anak pertama dari
pasangan suami-istri Patrisius Neonnufa dan
Gemirensiana Oni. Penulis memulai pendidikan SD Katolik Yaperna Loel (2004-2010), SMP Negeri 1 Insana Utara (2010-2013), SMK St. Agustinus Kefamenanu (2013-2016). Penulis melanjutkan pendidikan sarjana di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta pada tahun 2016. Selama masa perkuliahan penulis terlibat aktif dalam beberapa kegiatan kemahasiswaan seperti menjadi peserta Seminar Nasional FACTION#3 dengan tema "Healthy Skin Makes a Dazzling New You", Seminar Pendidikan FKIP USD 2019 dengan tema "Guru Merengkuh Teknologi dalam Meningkatkan Kualitas Pendidikan", menjadi volunteer AKSI World No Tobacco Day 2017 dan juga sebagai anggota divisi konsumsi Kegiatan Perayaan Pekan Suci 2018 di Gereja Kampus Paingan.