KOMBINASI CACING SUTRA Tubifex DAN PAKAN BUATAN
PADA PEMELIHARAAN LARVA IKAN PATIN Pangasius sp.
RIA SEPTY ANGGRAINI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi Kombinasi Cacing Sutra Tubifex dan Pakan Buatan pada Pemeliharaan Larva Ikan Patin Pangasis sp. adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014
Ria Septy Anggraini
ABSTRAK
RIA SEPTY ANGGRAINI. Kombinasi Cacing Sutra Tubifex dan Pakan Buatan pada Pemeliharaan Larva Ikan Patin Pangasius sp.. Dibimbing oleh DEDI JUSADI dan MUHAMMAD AGUS SUPRAYUDI.
Penelitian ini mengevaluasi pengaruh perbedaan frekuensi pemberian pakan harian cacing sutra (C) dan pakan buatan (PB) terhadap sintasan dan pertumbuhan larva ikan patin Pangasius sp.. Larva ikan patin yang baru menetas (d0) berukuran 0,44±0,04 cm dipelihara dalam akuarium kaca berukuran 30x20x20 cm3 yang diisi air setinggi 15 cm selama 14 hari. Mulai d5, larva diberi lima perlakuan pemberian pakan, yaitu 6C+0PB, 5C+2PB, 3C+3PB, 2C+5PB, dan 0C+6PB. Pemberian pakan dilakukan secara ad libitum. Hasil penelitian menunjukkan bahwa larva yang diberi 6C+0PB dan kombinasi C+PB memiliki tingkat kelangsungan hidup dan panjang akhir yang tidak berbeda nyata. Namun larva yang diberi 0C+6PB, kelangsungan hidup dan panjang akhirnya rendah. Semakin banyak porsi PB yang diberikan menunjukkan tren aktivitas lipase yang cenderung meningkat. Tetapi pada aktivitas protease pada pemberian 6C+0PB dan 0C+6PB lebih rendah dari ketiga perlakuan kombinasi C+PB. Dengan demikian, larva ikan patin dapat dibudidaya dengan menggunakan kombinasi cacing sutra dan pakan buatan.
Kata kunci: Cacing sutra, pakan buatan, larva, ikan patin, Pangasius sp., aktivitas lipase, aktivitas protease.
ABSTRACT
RIA SEPTY ANGGRAINI. Combination of Tubifex and Artificial Diet for Larval Yellowtail Catfish Pangasius sp. Supervised by DEDI JUSADI and MUHAMMAD AGUS SUPRAYUDI.
This research was conducted to evaluate the effect of different combination of feeding frequency of Tubifex (C) and artificial diet (P) on survival rate and growth rate of larval yellowtail catfish Pangasius sp.. Newly hatched larvae (d0) with total length of 0.44±0.04 cm were cultured for 14 days in 30x20x20 cm3 aquarium. Water volume in each aquarium was 9 L. At d5, larvae were fed on five different feeding frequencies either 6C+0PB, 5C+2PB, 3C+3PB, 2C+5PB, dan 0C+6PB. Feeding method used in this research was ad libitum. Results showed that survival rate and total length of d14 old larvae fed on 0C+6PB was lower than the groups fed on either 6C+0PB or three combinations of C+PB. Lipase activity tend to be increase in line with the increasing amount of artificial feed. On the other hand, larvae fed on 6C+0PB and 0C+6PB had the lowest protease activity. Therefore, larval catfish can be fed by combination of
Tubifex and artificial feed.
Keywords: Artificial diet, lipase activity, protease activity, silkworm, yellowtail catfish larva Pangasius sp.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Budidaya Perairan
KOMBINASI CACING SUTRA Tubifex DAN PAKAN BUATAN
PADA PEMELIHARAAN LARVA IKAN PATIN Pangasius sp.
RIA SEPTY ANGGRAINI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Kombinasi Cacing Sutra Tubifex dan Pakan Buatan pada Pemeliharaan Larva Ikan Patin Pangasius sp.
Nama : Ria Septy Anggraini NIM : C14100025
Disetujui oleh
Dr Dedi Jusadi Pembimbing I
Dr Muhammad Agus Suprayudi Pembimbing II
Diketahui oleh
Dr Sukenda Ketua Departemen
PRAKATA
Puji dan syukur penulis ucapkan atas rahmat Allah SWT. yang telah melimpahkan karunia-Nya sehingga karya tulis ini berhasil diselesaikan. Tema yang dipilih dalam karya tulis yang dilaksanakan sejak Februari-April 2014 ini berjudul “Kombinasi Cacing Sutra Tubifex dan Pakan Buatan pada Pemeliharaan Larva Ikan Patin Pangasius sp.” Terima kasih dan penghargaan penulis ucapkan kepada:
1. Ayahanda Syarbani, Ibunda Nur Afiah, Kakak-kakakku Ayi, Ani, Uwan, serta Adik-adikku Cici dan Bayu atas doa, cinta, kasih sayang, dan dukungan yang tak pernah berhenti mengalir.
2. Terima kasih kepada bapak Dr. Dedi Jusadi selaku dosen pembimbing I dan bapak Dr. Muhammad Agus Suprayudi selaku dosen pembimbing II atas bantuan, masukan, dan motivasi yang diberikan.
3. Terima kasih pula kepada Pak Wasjan, Mba Retno, Pak Manarwan, Pak Hendak, dan Kang Abe yang sangat banyak membantu dalam penelitian ini. 4. Teruntuk sahabat-sahabat, Sandri, Dina, Della, Mirvat, Anna, Nyimas, Renny,
Bani, dan seluruh XII IPA A yang selalu menjadi penyemangat setia.
5. Terima kasih untuk Bang Astrid, Evi, Alit, Rere, Ina, Lira, Saki, Ella, Amal Dita, Adri, Dede, Fira, Intan, Ijah NutriKids 47 dan BDP 47 yang telah bersusah payah menemani bermalam di Lab. kalian luar biasa.
6. Terima kasih kepada Tarmizi, Hermin, Yurika, Dila, Farha, Taufiq, Ega, Nindya, Kak wening, seluruh keluarga IKAMUSI, dan Wisma Arundina yang telah memberikan warna selama 4 tahun kuliah di IPB.
7. Terima kasih keluarga kamar 348, Anand, Mona, dan Lidya, Lorong 6, A3 serta Ridha, Suci, Ulfa dan teman-teman TPB B24 atas canda tawanya selama ini.
8. Terima kasih untuk keluarga BEM TPB kabinet Harmoni, MAD47, BEM C kabinet Biru Bersatu, BEM C kabinet Pengarung Samudra, dan Aerobik Poseidon dengan semua warna warni dunia kampusnya.
9. Dan terakhir terima kasih kepada beasiswa PPA/BBM 2013-2014 yang telah banyak membantu.
Semoga karya tulis ini dapat bermanfaat bagi penulis khusunya dan juga pagi pembaca.
Bogor, Juli 2014
DAFTAR ISI
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
METODE ... 2
Pemeliharaan Larva ... 2
Pakan dan Pemberian Pakan ... 3
Panen ... 4
Parameter Uji ... 4
Analisis Kimia ... 5
Analisis Data ... 5
HASIL DAN PEMBAHASAN ... 6
Hasil ... 6 Pembahasan ... 8 KESIMPULAN ... 11 DAFTAR PUSTAKA ... 11 LAMPIRAN ... 12 RIWAYAT HIDUP ... 18
DAFTAR TABEL
1 Kualitas air media budidaya ikan selama penelitian ... 2
2 Hasil analisa proksimat (% bobot basah) pakan yang digunakan di dalam penelitian ... 3
3 Jenis pakan yang diberikan selama masa pemeliharaan ... 3
4 Jadwal pemberian cacing dan pakan buatan ... 4
5 Jumlah pemberian pakan nauplii artemia, cacing sutra dan pakan buatan selama pemeliharaan ... 4
DAFTAR GAMBAR
1 Kelangsungan hidup larva ikan patin di akhir penelitian (d14) ... 62 Panjang larvaikan patin di akhir penelitian (d14) ... 7
3 Aktivitas enzim lipase pada larva ikan patin d14 ... 7
4 Aktivitas enzim protease pada larva ikan patin d14 ... 8
DAFTAR LAMPIRAN
1 Prosedur Analisa Serat Kasar ... 122 Prosedur Analisa Enzim ... 15
3 Anova dan hasil uji Tukey tingkat kelangsungan hidup ... 16
4 Anova dan uji Tukey panjang Akhir ... 16
5 Anova dan uji Tukey Aktivitas Lipase ... 17
PENDAHULUAN
Latar Belakang
Pembenihan merupakan suatu kegiatan usaha memproduksi benih ikan sampai ukuran siap tebar. Segmen pertama dalam usaha pembenihan ikan patin adalah pemeliharaan telur sampai benih ukuran sekitar 1 inci, dan di tahun 2014 berubah menjadi 1,7 cm. Proses produksi benih patin sampai ukuran tersebut sangat bergantung pada ketersediaan cacing sutra Tubifex, karena pakan yang digunakan hanya cacing sutra. Menurut informasi, hatchery patin Stasiun Lapangan, Departemen Budidaya Perairan, Kampus IPB Dramaga, pada tahun 2013 setiap siklusnya memproduksi 170.000 ekor benih ukuran sekitar 1 inci. Untuk menghasilkan benih tersebut dibutuhkan cacing sutra sebanyak 59.145,6 g dengan rata-rata waktu produksi 19 hari. Dengan demikian, kebutuhan cacing sutra dalam setahun (7 siklus) di hatchery tersebut untuk produksi benih patin ukuran 1 inci adalah sebanyak 414.019,2 g. Seperti dikemukakan di atas, dalam satu tahun, produksi benih patin hanya bisa dilakukan tujuh siklus. Kekosongan produksi terjadi biasanya pada musim penghujan dan musim kemarau. Pada musim hujan kekosongan produksi terjadi karena pasokan cacing akibat hasil tangkapan di alam yang menurun drastis. Sedangkan pada musim kemarau kekosongan terjadi karena induk ikan patin sulit untuk matang gonad. Di sisi lain, cacing sutra juga digunakan sebagai pakan larva ikan dan berbagai jenis ikan hias. Untuk meningkatkan produktivitas hatchery, khususnya ikan patin, ketergantungan pada cacing sutra harus dikurangi. Salah satu alternatif yang dapat dilakukan adalah dengan pemberian pakan buatan dan mempersingkat/mengurangi porsi pemberian cacing. Namun, penggunaan pakan buatan diduga masih belum bisa maksimal, karena pencernaan larva ikan patin yang masih belum sempurna. Tingkat kecernaan bisa dilihat dengan aktivitas enzim endogenus dalam tubuh larva. Peningkatan aktivitas enzim berbanding lurus dengan umur larva (FAO 1996). Berdasarkan Aliye et al. (2014), larva ikan mas koi yang diberi pakan nauplii artemia dari umur 4 hari sampai umur 7 hari setelah menetas menunjukkan aktivitas enzim lipase dan protease yang terus meningkat seiring bertambahnya umur larva. Effendi et al. (2003) menyatakan bahwa pada larva ikan patin umur satu hari sudah memiliki aktivitas enzim lipase dan protease didalam saluran pencernaannya, namun belum terdapat aktivitas enzim amilase. Ketika aktivitas enzim sudah tinggi dapat diindikasikan secara fisiologi larva siap untuk memperoleh pakan dari luar (Gawlicka et al. 2000). Dengan demikian, efisiensi penggunaan cacing sutra dapat dilakukan dengan mengkombinasikan cacing sutra dengan pakan buatan atau dapat juga dengan menggantikan cacing sutra dengan pakan buatan lebih awal.
2
Tujuan
Penelitian ini dilakukan dengan tujuan untuk mengevaluasi pengaruh perbedaan frekuensi pemberian pakan harian cacing dan pakan buatan terhadap sintasan dan pertumbuhan larva ikan patin Pangasius sp..
METODE
Pemeliharaan Larva
Larva ikan patin yang baru menetas (d0) diperoleh dari pembenih ikan di Cibanteng, Bogor. Larva baru menetas berukuran 0,44±0,04 cm ditebar ke dalam 15 akuarium kaca ukuran 30x20x20 cm3 yang diisi air setinggi 15 cm di Stasiun Lapangan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Penebaran larva dilakukan pada pukul 16.00 WIB dengan kepadatan 100 ekor per akuarium. Sebelum larva ditebar, air akuarium diberi elbaju sebanyak 5 mg/l, serta diberi garam secara bertahap hingga salinitasnya menjadi 2 g/l. Larva dipelihara sampai berumur d14. Selama masa budidaya, larva diberi pakan sesuai dengan perlakuannya. Selama pemeliharaan salinitas air dalam akuarium dipertahankan 2 g/l.
Selama masa budidaya, dilakukan pergantian air secara periodik. Pergantian air mulai dilakukan saat larva berumur d2, yakni bersamaan dengan pemberian pakan pertama. Pergantian air dilakukan setiap hari sebanyak satu kali. Saat larva berumur 2-8 hari pergantian air dilakukan sebanyak 30%. Sedangkan saat larva berumur 8-14 hari pergantian air dilakukan sebanyak 50%. Pada d1 sampai d4 pagi, suhu media pemeliharaan berkisar antara 24-26 oC. Sehubungan dengan kisaran suhu yang rendah, mulai d5 dipasang dua buah lampu pijar dengan masing-masing dayanya 60 Watt. Lampu tersebut diletakkan diantara akuarium agar terjadi efek peningkatan suhu dan seluruh akuarium ditutup plastik transparan. Suhu air mulai d6 meningkat menjadi 26-28oC. Kondisi suhu dan pH air harian diukur dua kali sehari disajikan di Tabel 1. Di Tabel tersebut juga bisa dilihat kandungan oksigen terlarut dan amoniak, yang diukur pada awal dan akhir penelitian.
Tabel 1. Kualitas air media budidaya ikan selama penelitian
Parameter Perlakuan Tandon
6C+0PB 5C+2PB 3C+ 3PB 2C+5PB 0C+6PB Suhu (oC) 23,5-29 23,5-28 23,5-29 23,5-28 24-30 23,5-27,9 DO (mg/L) 5,2-8,1 5,2-7,8 5,3-7,3 5,0-7,7 5,6-7,6 6,5-6,7 pH 6,0-7,6 6,0-8,0 6,0-7,65 6,0-7,7 6,0-8,0 6,0-7,5 Amoniak (mg/L) 0-0,02 0-0,02 0-0,02 0-0,02 0-0,02 0,0
3 Pakan dan pemberian pakan
Pakan yang diberikan untuk larva ikan patin berupa artemia, cacing sutra, dan pakan buatan merek Orange. Kandungan proksimat dari masing-masing pakan yang digunakan dapat dilihat di Tabel 2.
Tabel 2. Hasil analisa proksimat (% bobot basah) pakan yang digunakan dalam penelitian
Komposisi Jenis Pakan
Artemia Cacing sutra Pakan Buatan
Serat kasar 0,82 0,44 0,44 Kadar abu 1,81 2,17 10,22 Lemak 3,31 2,65 11,87 Protein 11,96 10,90 42,39 BETN 0,68 1,53 29,60 Kadar Air 81,42 82,31 5,48
Pada saat berumur d2, larva mulai diberi makan artemia dengan frekuensi pemberian setiap 2 jam. Mulai umur d5, larva diberi pakan berupa cacing sutra dan pakan buatan dengan jumlah yang berbeda sesuai perlakuan (Tabel 3). Pemberian cacing sutra dan pakan buatan dilakukan setiap periode 4 jam. Larva dipelihara sampai umur d14, sesuai standar pemeliharaan dipembenihan ikan patin, karena larva sudah dapat dijual pada umur tersebut.
Tabel 3. Jenis pakan yang diberikan selama masa pemeliharaan
Perlakuan Umur larva (d)
2 3 4 5 6 7 8 9 10 11 12 13 14
6C+0PB Artemia 6 Cacing
5C+2PB Artemia 5 Cacing, 2 Pakan Buatan
3C+3PB Artemia 3 Cacing, 3 Pakan Buatan
2C+5PB Artemia 2 Cacing, 5 Pakan Buatan
0C+6PB Artemia 6 Pakan Buatan
Sesuai perlakuan, jadwal dan frekuensi pemberian pakan dapat dilihat pada Tabel 4. Untuk perlakuan yang menggunakan cacing, cacing tersebut diberikan mulai pagi hari, selanjutnya mulai siang hari diberi pakan buatan. Penentuan besarnya pakan buatan yang diberikan didasarkan pada metode ad
4
Tabel 4. Jadwal pemberian cacing dan pakan buatan
Perlakuan Pakan Jam (WIB)
09.00 13.00 17.00 21.00 01.00 05.00 6C+0PB Cacing ░░░░ ░░░░ ░░░░ ░░░░ ░░░░ ░░░░ Pakan buatan 5C+2PB Cacing ░░░░ ░░░░ ░░░░ ░░░░ ░░░░ Pakan buatan ░░░░ ░░░░ 3C+3PB Cacing ░░░░ ░░░░ ░░░░ Pakan buatan ░░░░ ░░░░ ░░░░ 2C+5PB Cacing ░░░░ ░░░░ Pakan buatan ░░░░ ░░░░ ░░░░ ░░░░ ░░░░ 0C+6PB Cacing Pakan buatan ░░░░ ░░░░ ░░░░ ░░░░ ░░░░ ░░░░
Berdasarkan jadwal pemberian pakan pada Tabel 4 didapatkan jumlah pakan dari ketiga jenis pakan yang diberikan selama pemeliharaan 14 hari. Banyaknya jumlah pakan pada masing-masing jenis pakan tersebut dapat dilihat pada Tabel 5.
Tabel 5. Jumlah pemberian pakan nauplii artemia, cacing sutra dan pakan buatan selama pemeliharaan
Perlakuan Artemia (individu) Cacing (g) Pakan Buatan (g)
6C+0PB 6371 224,4 0 5C+2PB 6371 174,4 4,4 3C+3PB 6371 97,8 12,3 2C+5PB 6371 63,3 13,9 0C+6PB 6371 0 19,0 Panen
Panen larva dilakukan pada d14, mulai pukul 16.00 WIB.Larva di setiap akuarium dihitung jumlahnya untuk menentukan tingkat kelangsungan hidupnya. Selanjutnya, larva dipisahkan berdasarkan ukurannya (grading). Ukuran larva dibuat dalam dua kategori ukuran, yakni besar dan kecil. Larva ikan yang dikategorikan besar bila ukurannya telah mancapai ≥1,6cm dan kecil bila ukurannya <1,6 cm. Setelah dipisahkan, jumlah populasi larva yang besar dan yang kecil dihitung, kemudian dilakukan pengukuran panjang total larva dengan mengambil 30% larva dari tiap jumlah populasi larva yang besar dan yang kecil. Seluruh ikan selanjutnya dimasukkan ke dalam freezer untuk keperluan analisa aktivitas enzim.
Parameter Uji
Kelangsungan hidup larva dihitung pada d14 atau pada akhir masa pemeliharaan. Kelangsungan hidup dihitung dari jumlah larva yang masih tersisa di dalam akuarium.
5 Panjang akhir larva diukur dengan menggunakan penggaris dengan ketelitian 0,1 cm.Untuk menghitung panjang akhir rata-rata ikan di setiap akuarium digunakan rumus sebagai berikut:
Panjang akhir rata-rata = ⋯
∑
Keterangan:
n = panjang hasil pengukuran ke-t (cm) ∑n = jumlah larva yang dihitung
Selain itu juga dilakukan pengukuran terhadap aktivitas enzim lipase dan protease pada ikan d14. Satu unit aktivitas lipase didefinisikan sebagai volume 0.01N NaOH yang dibutuhkan untuk menetralisir asam lemak yang dihasilkan 6 jam inkubasi dengan substrat dan setelah dikoreksi dengan blanko (Borlongan 1990). Aktivitas lipase dapat dihitung dengan rumus sebagai berikut:
Aktivitas lipase (unit/mg protein) =
Aktivitas protease didefinisikan sebagai nilai absorban sampel dan standar yang dibaca pada gelombang λ 578 nm dengan menggunakan substrat casein 20 mg/mL pH 7 dan inkubasi pada suhu 37 oC selama 40 menit (Bergmeyer dan Grassi 1983). Aktivitas protease dapat diukur dengan menggunakan formula berikut ini:
Aktivitas protease (unit/mg protein) =
( . )
Analisis Kimia
Analisis kimia yang dilakukan terdiri dari analisis proksimat pakan uji dan analisa enzim ikan umur d14. Analisa pakan uji meliputi analisa kadar air, kadar abu, serat kasar, lemak, serta protein mengikuti Takeuchi (1988) seperti tercantum di Lampiran 1. Sedangkan analisa enzim meliputi analisa enzim lipase dan enzim protease. Analisa enzim protease dilakukan dengan penambahan substrat kasein 20 mg/mL pH 7 dan inkubasi pada suhu 37 oC selama 40 menit dan dispektropada λ 578 nm (Bergmeyer dan Grassi 1983). Analisa enzim lipase 37ºC selama 6 jam dan dititrasi segera dengan NaOH 0.01 N (Borlongan 1990). Selain itu juga dianalisis konsentrasi protein terlarut dalam sampel ditentukan dengan metode Bradford (1976) dengan menggunakan albumin bovine serum sebagai standar. Aktivitas enzim pencernaan dinyatakan sebagai U/mg protein (Bradford 1976) Lampiran 2.
Analisis Data
Penelitian ini menggunakan RAL (Rancangan Acak Lengkap) dengan lima perlakuan dan tiga ulangan. Untuk menganalisis data digunakan SPSS VERSI
6
17.0, serta dilakukan uji lanjut untuk beda nyata menggunakan uji Tukey. Parameter yang dianalisis statistik secara kuantitatif adalah tingkat kelangsungan hidup, panjang akhir, serta aktivitas enzim protease dan lipase.
HASIL DAN PEMBAHASAN
Hasil
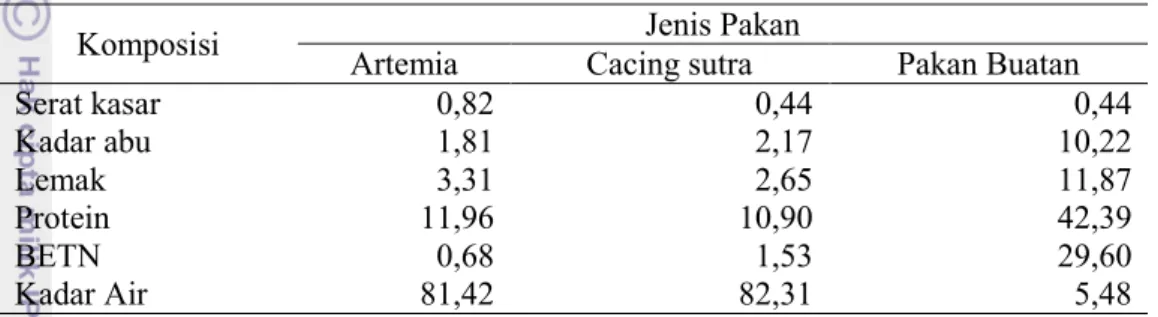
Saat panen, larva ikan patin yang diberi pakan cacing sutra atau kombinasi cacing sutra dan pakan buatan memiliki kelangsungan hidup yang sama tingginya dan tidak berbeda nyata (Lampiran 3). Kelangsungan hidup larva pada empat perlakuan tersebut, perlakuan cacing dan kombinasi cacing dengan pakan buatan berkisar antara 84% sampai 87%. Kelangsungan hidup larva menurun drastis ketika larva hanya diberi pakan buatan. Nilai kelangsungan hidup larva patin pada perlakuan pakan buatan tersebut hanya sebesar 23% (Gambar 1).
Gambar 1. Kelangsungan hidup larva ikan patin di akhir penelitian (d14).
Keterangan: Huruf superskrip yang sama menunjukkan hasil yang tidak berbeda nyata (P>0,05)
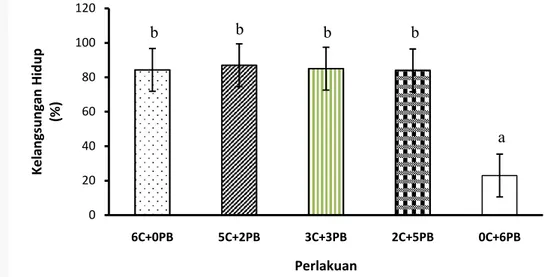
Pada akhir pemeliharaan juga dilakukan pengukuran panjang akhir. Pada keempat perlakuan pemberian pakan cacing dan kombinasi cacing dengan pakan buatan memiliki panjang akhir yang tidak berbeda nyata (Lampiran 4), yaitu berkisar 1,4 cm sampai 1,7 cm. Sedangkan pada perlakuan dengan pemberian pakan hanya dengan pakan buatan memberikan panjang akhir terpendek yaitu 0,9 cm (Gambar 2). 0 20 40 60 80 100 120 6C+0PB 5C+2PB 3C+3PB 2C+5PB 0C+6PB K e lan gs u n gan H id u p (% ) Perlakuan b b b b a
7
Gambar 2. Panjang larva ikan patin di akhir penelitian (d14).
Keterangan: Huruf superskrip yang sama menunjukkan hasil yang tidak berbeda nyata (P>0,05)
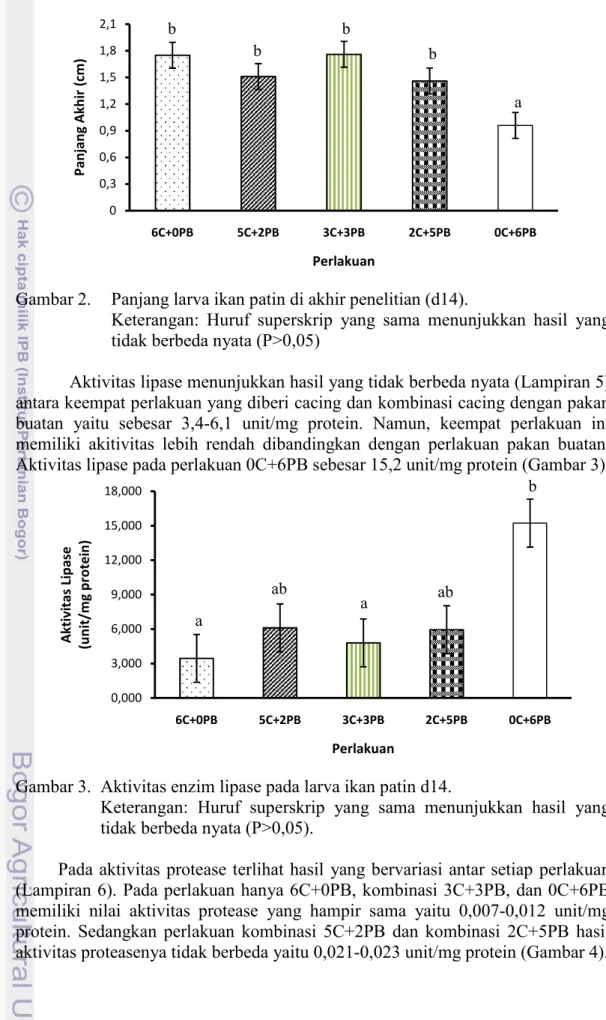
Aktivitas lipase menunjukkan hasil yang tidak berbeda nyata (Lampiran 5) antara keempat perlakuan yang diberi cacing dan kombinasi cacing dengan pakan buatan yaitu sebesar 3,4-6,1 unit/mg protein. Namun, keempat perlakuan ini memiliki akitivitas lebih rendah dibandingkan dengan perlakuan pakan buatan. Aktivitas lipase pada perlakuan 0C+6PB sebesar 15,2 unit/mg protein (Gambar 3).
Gambar 3. Aktivitas enzim lipase pada larva ikan patin d14.
Keterangan: Huruf superskrip yang sama menunjukkan hasil yang tidak berbeda nyata (P>0,05).
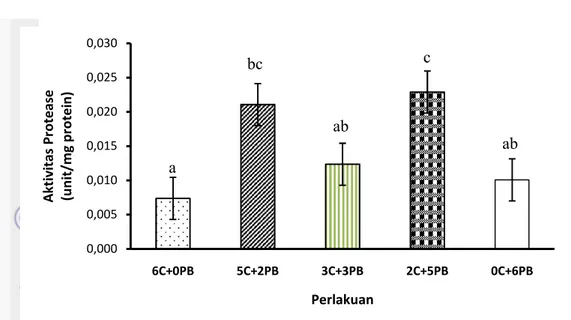
Pada aktivitas protease terlihat hasil yang bervariasi antar setiap perlakuan (Lampiran 6). Pada perlakuan hanya 6C+0PB, kombinasi 3C+3PB, dan 0C+6PB memiliki nilai aktivitas protease yang hampir sama yaitu 0,007-0,012 unit/mg protein. Sedangkan perlakuan kombinasi 5C+2PB dan kombinasi 2C+5PB hasil aktivitas proteasenya tidak berbeda yaitu 0,021-0,023 unit/mg protein (Gambar 4).
0 0,3 0,6 0,9 1,2 1,5 1,8 2,1 6C+0PB 5C+2PB 3C+3PB 2C+5PB 0C+6PB P an jan g A kh ir ( cm ) Perlakuan b b b b a 0,000 3,000 6,000 9,000 12,000 15,000 18,000 6C+0PB 5C+2PB 3C+3PB 2C+5PB 0C+6PB A kt iv it as L ip as e (u n it /m g p ro te in ) Perlakuan a ab a ab b
8
Gambar 4. Aktivitas enzim protease pada larva ikan patin d14.
Keterangan: Huruf superskrip yang sama menunjukkan hasil yang tidak berbeda nyata (P>0,05).
Pembahasan
Larva ikan patin yang diberi cacing dan kombinasi cacing dengan pakan buatan pakan alami memiliki tingkat kelangsungan hidup dan panjang akhir yang sama tinggi. Sedangkan larva yang diberikan hanya pakan buatan menunjukkan kelangsungan hidup dan panjang akhir yang sangat rendah. Rendahnya pertumbuhan dan kelangsungan hidup di perlakuan pakan buatan, diduga oleh aktivitas enzim yang masih rendah. Pendekatan ini dapat dilakukan karena enzim di dalam saluran pencernaan berperan dalam perombakan molekul besar pakan menjadi yang lebih kecil, sehingga molekul tersebut dapat diserap dan diedarkan ke sel-sel yang membutuhkan. Berdasarkan Haryati (2002), larva ikan betutu yang diberi pakan buatan umur 10, 15, dan 20 hari menunjukkan aktivitas enzim lebih rendah dibandingkan dengan yang diberi pakan campuran dan pakan alami berupa
Brachionus. Aktivitas enzim yang rendah inilah yang membuat asupan nutrient ke
tubuh larva minim, sehingga larva kekurangan energi yang menyebabkan pembentukan organ terhambat. Pertumbuhan organ tubuh yang lambat menyebabkan pertumbuhan larva kurang dan menyebabkan tingkat kematiannya tinggi.
Kombinasi cacing dan pakan buatan yang diberikan ke larva menunjukkan hasil yang tidak berbeda nyata dengan larva yang hanya diberi pakan cacing, yaitu mempunyai panjang akhir yang baik dan kelangsungan hidup yang tinggi. Hal ini diduga karena adanya enzim eksogen yang disumbangkan oleh cacing yang diberikan pada larva pada pagi hari. Sehingga saat diberikan pakan buatan di malam harinya enzim tersebut membantu mencerna pakan buatan yang diberikan pada larva. Menurut Muchlisin et al. (2003), umunya aktivitas enzim akan tinggi jika larva diberikan pakan alami terutama Artemia salina. Tingginya aktivitas enzim ini disebabkan oleh adanya exogenus enzyme dari pakan alami yang akan merangsang secara langsung produksi dan aktivitas endogenus enzyme dalam saluran pencernaan larva. Adanya aktivitas enzim eksogen inilah yang mampu
0,000 0,005 0,010 0,015 0,020 0,025 0,030 6C+0PB 5C+2PB 3C+3PB 2C+5PB 0C+6PB A kt iv it as P ro te as e (u n it /m g p ro te in ) Perlakuan a bc ab c ab
9 membantu larva untuk menceran pakan buatan, sehingga asupan nutrien yang masuk ke tubuh larva sama banyak dengan larva yang hanya diberi cacing. Asupan nutrien yang banyak membuat larva dengan perlakuan kombinasi cacing dan pakan buatan memiliki energi yang cukup untuk menghasilkan pertumbuhan panjang dan mempertahankan kelangsungan hidup tetap tinggi.
Sejalan dengan hasil penelitian ini, tingkat kelangsungan hidup larva ikan gurame yang diberi pakan buatan pada umur 10 hari juga rendah, yaitu hanya 34%. Sedangkan pemberian pakan buatan pada umur 25 hari memberikan tingkat kelangsungan hidup yang lebih baik, yaitu 65,25% (Arlia 1994). Hal ini juga terjadi pada larva ikan baung yang diberi pakan buatan pada umur 7 hari menunjukkan kelangsungan hidup yang rendah, yaitu 10,92%. Sedangkan larva baung yang diberi pakan buatan pada umur 16 hari menunjukkan tingkat kelangsungan hidup yang lebih baik, yaitu 72,58% (Haryati 2002). Hasil yang rendah terhadap pemberian pakan buatan ini dimungkinkan terjadi karena kandungan nutrien dari pakan yang diberikan. Berdasarkan hasil analisa proksimat (% bobot basah) pakan yang digunakan di dalam penelitian (Tabel 2), kabohidrat pada pakan buatan cukup tinggi sehingga membuat larva semakin sulit untuk mencerna pakan buatan. Saat pemberian pakan buatan, enzim amilase yang terdapat pada pencernaan larva belum memenuhi sehingga karbohidrat tersebut belum bisa tercerna dengan baik. Menurut Effendi et al. (2003), larva ikan patin umur 1 hari setelah menetas ternyata belum mempunyai enzim amilase. Hal ini yang memungkinkan pertumbuhan larva ikan patin pada perlakuan 0C+6PB memiliki tingkat pertumbuhan paling rendah. Selain itu, berdasarkan Stckney & Novell (1997) dalam Arief (2009), pakan dengan kandungan karbohidrat sebanyak 2,5-10% dari berat pakan menghasilkan pertambahan berat, namun bila karbohidrat ditingkatkan menjadi 15-20% dari berat pakan maka pertambahan berat pakan akan menurun.
Varikul dan Boonson (1968) dalam Suwarsih (2010), menjelaskan bahwa perkembangan larva patin setelah menetas dari hari ke-0 sampai hari ke-10 yaitu pada hari ke-0: bentuk larva mulai melebar, susunan mulut dan mata belum terbentuk, terletak di atas kumpulan kuning terlur dan memanjang ke belakang ujung anus larva. Hari ke-1: mata tidak berpigmen, sirip dada, mulut, dubur belum tampak dan kantong kuning telur mulai mengecil. Hari ke-2: mulut mulai terbuka dan terlihat struktur gelembung dari kantong kuning telur dengan jelas. Hari ke-3: mata tumbuh dengan baik dan kuning telur semakin mengecil. Hari ke-4: susunan pencernaan lengkap dengan mata dan mulut terlihat dari selaput gelembung. Hari ke-5: perkembangan mulut baik dan mata memanjang. Hari ke-6: mata terbuka, gigi tumbuh dengan baik, dan perkembangan pigmentasi terbentuk. Hari ke-7: sirip tumbuh dnegan baik, kuning telur perlahan berkambang, gigi tumbuh dengan cepat, dan mata memanjang. Hari ke-8: pigmentasi tumbuh dengan baik dan selaput memanjang sedikit mencekung. Hari ke-10: tumbuh kuat dan berkembang dengan struktur tubuh yang baik, sehingga serupa dengan ikan dewasa. Penjelasan di atas menunjukkan bahwa pada stadia larva tidak bisa langsung diberikan pakan dari luar, sehingga diperlukan perhitungan waktu pemberian pakan yang sesuai untuk pemeliharaan larva.
Aktivitas lipase tertinggi pada pemberian 0C+6PB, namun tidak diikuti dengan kelangsungan hidup dan pertumbuhan yang tinggi pula. Hal ini dimungkinkan karena larva yang mempunyai sistem pencernaan yang masih
10
sederhana harus memproduksi enzim pencernaan secara cepat agar mampu mencerna pakan dari luar. Selain itu, kebiasan larva yang dari awal menetas memperoleh pakan dari kantong telurnya yang mengandung minyak atau lemak membuat aktivitas lipase yang dihasilkan oleh larva ikan patin tinggi. Berdasarkan Kuzmina (1996), aktivitas enzim dipengaruhi oleh kebiasaan makan dan komposisi biokimia pakan. Sedangkan aktivitas protease pada perlakuan 0C+6PB cenderung rendah dikarenakan sulitnya larva mencerna protein pakan. Berdasarkan Bundit (2007), larva yang diberi pakan buatan aktivitas proteasenya rendah karena rendahnya daya cerna terhadap protein pakan. Hasil peneitian Darwis et al. (2009) juga menunjukkan hal yang sama terhadap benih ikan betutu yang diberi pakan buatan. Aktivitas protease pada benih ikan betutu yang diberi pakan buatan menunjukkan hasil terendah dari pada diberi pakan artemia dan ikan rucah.
Pada perlakuan 6C+0PB juga menunjukkan aktivitas protease yang juga rendah pada d14. Pemberian pakan alami di awal pemeliharaan larva sangat baik untuk mempertahankan kelangsungan hidup dan meningkatkan aktivitas enzim pada sistem pencernaan larva sehingga perkembangan sistem pencernaan lebih cepat (Kamarudin et al. 2011). Aktivitas enzim yang meningkat diiringi dengan sistem pencernaan larva yang meningkat pula, sehingga pemberian pakan alami terus menerus tidak memberikan peningkatan aktivitas enzim. Hal ini dikarenakan, sistem pencernaan telah baik untuk mencerna pakan dari luar sehingga tidak memacu larva untuk menghasilkan lebih banyak enzim pencernaan. Pernyataan ini diperkuat dengan hasil penelitian Kamarudin et al. (2011), larva ikan baung yang diberi pakan alami memiliki kecenderungan penurunan aktivitas enzimnya mulai dari umur 6-14 hari setelah menetas.
Perlakuan kombinasi cacing sutra dan pakan buatan menunjukkan aktivitas lipase dan protease yang tinggi, sehingga menghasilkan kelangsungan hidup dan pertumbuhan larva yang tinggi pula. Hal ini dikarenakan pemberian pakan alami di awal yang membawa enzim eksogenus membantu enzim eksogenus di dalam sistem pencernaan larva untuk mencerna pakan buatan yang diberikan pada malam harinya. Pemberian pakan buatan malam harinya memacu larva untuk meingkatkan aktivitas enzimnya agar pakan buatan yang diberikan bisa dicerna dengan baik. Keadaan inilah yang membuat larva ikan patin yang diberi kombinasi pakan alami dan pakan buatan memiliki aktivitas enzim lipase maupun protease yang cenderung tinggi.
Pada dasarnya, aktivitas lipase dan protease pada umumnya meningkat seiring dengan bertambahnya umur ikan. Berdasarkan Aliye et al. (2014), larva ikan mas koi yang diberi pakan nauplii artemia yang didekapsulasi dan tidak didekapsulasi dari d4-d7 setelah menetas menunjukkan aktivitas enzim lipase dan protease yang terus meningkat seiring bertambahnya umur larva. Larva koi yang diukur aktivitas enzimnya dari umur 10-34 hari setiap 3 hari. Hal ini juga terjadi pada larva ikan bandeng yang diberi pakan alami brachionus, pakan campuran, dan pakan buatan mulai umur 10 hari, 15 hari, dan 20 hari menunjukkan aktivitas lipase, tripsin, dan pepsin yang terus meningkat sampai umur 30 hari (Haryati 2002).
11 KESIMPULAN
Pakan yang diberikan pada larva ikan patin selama pemeliharaan dapat dikombinasikan antara pakan cacing dan pakan buatan. Namun, larva ikan patin tidak bisa diberi pakan buatan sepenuhnya.
DAFTAR PUSTAKA
Aliye MK, Suzer C, Saka S, dan Firat K. 2014. Enzymatic characteristics and growth parameters of ornamental koi carp (Cyprinus carpio var. Koi) larvae fed by Artemia nauplii and cysts. J Fisheries and Aquatic Sciences. 14(1):125-133. doi: 10.4194/1303-2712-v14_1_14.
Arief M, Irmaya T, dan Widya PL. 2009. Pengaruh pemberian pakan alami dan pakan buatan terhadap pertumbuhan benih ikan betutu (Oxyeleotris
marmorata Bleeker). J Ilmiah Perikanan dan Kelautan. 1(1): 51-57.
Arlia L. 1994. Pengaruh kadar protein pakan buatan terhadap pertumbuhan benih ikan gurame (Osphronemus goramy Lacepede) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Bergmeyer and Grass. 1983. Method of Enzymatic Analysis. Ed ke-3. Germany (DE): VCH (Verlagsgsellschaft), Meinheim. hlm 1-159.
Borlongan IG. 1990. Studies on the digestive study of milkfish, Chanos chanos. J
Aquaculture. 89(1): 315-325.
Bradford MM. 1976. A Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. J Analytical Biochemistry. 72(1): 248-254.
Bundit J. 2007. The nutrition and feeding of a native Thai species, the marble goby (Oxeyeleotris marmoratus), involving on-farm and experimental studies [tesis]. Scotland (SCT): University of Stirling.
Darwis M, Sitti R, Muhammad S, Masaru T, dan Shigeharu S. 2009. Effects of different types of feed on growth, survival and digestive enzyme activity of marble goby, Oxyeleotris marmoratus juveniles. J Oseanologi dan
Limnologi Indonesia. 35(1): 1-18. ISSN: 0125-9830
Effendi I, Widanarni, danAugustine D. 2003. Perkembangan enzim pencernaan larva ikan patin, Pangasius hypophthalmus sp. J Akuakultur Indonesia. 2(1): 13-20.
[FAO] Food and Agriculture Organization. 1996. Manual on The Production and
Use of Live Food for Aquaculture. Belgium (BE): University of Ghent
Ghent. hlm 4.
Gawlicka A, Parent B, Horn MH, Ross N, Opstad I, and Torrissen OJ. 2000. Activity of digestive anzyme in yolk-sac larvae of Atlantic halibut (Hippoglossus hippoglossus): indication of readiness for first feeding. J
12
Haryati. 2002. Respon larva ikan bandeng (Chanos chanos Forskal) terhadap pakan buatan dalam sistem pembenihan [tesis]. Bogor (ID): Institut Pertanian Bogor.
Kamarudin MS, Otoi S, dan Saad CR. 2011. Changes in growth, survival, and digestive anzyme activities of Asian red tail catfish, Mystus nemurus, larvae fed on different diets. J Biotechnology. 10(21): 4484-4493. doi: 10.5897/AJB09.1895.
Kuzmina VV. 1996. Influence of age on digestive enzyme activity in some freshwater teleostei. J Aquaculture. 110: 287-297.
Muchlisin ZA, Ahmad D, Rina F, Muhammadar, dan Musri M. 2003. Pengaruh beberapa jenis pakan alami terhadap pertumbuhan dan kelangsungan hidup larva ikan lele dumbo (Clarias gariepinus). J Biologi. 3(2): 105-113. ISSN: 0853-7240
Suwarsih. 2010. Pengaruh pengaturan pencahayaan dengan perbedaan persentase penutupan media terhadap kelulusan hidup dan pertumbuhan larva ikan patin (Pangasius sutchi) [Penelitian dosen]. Tuban (ID): Universitas PGRI Ronggolawe.
Takeuchi T. 1988. Laboratory Work Chemical Evaluation of Dietary Nutrition. In Watanabe T, ed. Fish Nutrition and Mariculture, JICA Textbook the General Aquaculture Course. Tokyo (JP): Kanagawa internat. hlm 179-229
LAMPIRAN
Lampiran1 Prosedur analisa proksimat A. Kadar Protein
Tahap Oksidasi
1. Sampel ditimbang sebanyak 0.5 gram dan dimasukkan ke dalam labu Kjedahl.
2. Katalis (K2SO4+CuSO4.5H2O) dengan rasio 9:1 ditimbang sebanyak 1.5 gram dan dimasukkan ke dalam labu Kjedahl.
3. 10 ml H2SO4 pekat ditimbahkan ke dalam labu Kjedahl dan kemudian labu tersebut dipanaskan dalam rak oksidasi/ digestion pada suhu 400ºC selama 3-4 jam sampai terjadi perubahan warna cairan dalam labu menjadi hijau bening.
4. Larutan didinginkan lalu ditambahkan air destilasi 100 ml. Kemudian larutan dimasukkan ke dalam labu takar dan diencerkan dengan akuades sampai volume larutan mencapai 100 ml. Larutan sampel siap didestilasi. Tahap Destilasi
1. Beberapa tetes H2SO4 dimasukkan kedalan labu, sebelumnya labu diisi setengahnya dengan akuades untuk menghindari kontaminasi oleh amonia lingkungan. Kemudian didihkan selama 10 menit.
2. Erlenmeyer diisi 10 ml H2SO4 0,05 N dan ditambahkan 2 tetes indicator
methyl red diletakkan di bawah pipa pembuangan kondensor dengan cara
13 3. 5 ml larutan sampel dimasukkan ke dalam tabung destilasi melalui corong
yang kemudian dibilas dengan akuades dan ditambahkan 10 ml NaOH 30% lalu dimasukkan melalui corong tersebut dan ditutup.
4. Campuran alkalin dalam labu destilasi disuling menjadi uap air selama 10 menit sejak terjadi pengembunan pada kondensor.
Tahap Titrasi
1. Larutan hasil destilasi dititrasi dengan larutan NaOH 0.05 N 2. Volume hasil titrasi dicatat
3. Prosedur yang sama juga dilakukan pada blanko
Kadar Protein (%) = . ∗ ( ) . ∗∗ x 100% Keterangan : Vb = Volume hasil titrasi blanko (ml)
Vs = Volume hasil titrasi sampel (ml) S = Bobot Sampel (gram)
* = Setiap ml 0.05 NaOH ekivalen dengan 0.0007 gram Nitrogen ** = Faktor Nitrogen
B. Kadar Lemak Metode ekstraksi Soxhlet
1. Labu ekstraksi dipanaskan dalam oven pada suhu 110 ºC dalam waktu 1 jam. Kemudian didinginkan dalam desikator selama 30 menit dan ditimbang bobot labu tersebut (X1).
2. Sampel ditimbang sebanyak 3-5 gram (A), dan dimasukkan ke dalam selongsong tabung filter dan dimasukkan ke dalam soxhlet dan pemberat diletakkan di atasnya.
3. N-hexan 100-150 ml dimasukkan ke dalam soxhlet sampai selongsong terendam dan sisa N-hexan dimasukkan ke dalam labu.
4. Labu yang telah dihubungkan dengan soxhlet dipanaskan di atas water bath sampai cairan yang merendam sampel dalam soxhlet berwarna bening. 5. Labu dilepaskan dan tetap dipanaskan hingga N-hexan menguap
6. Labu dan lemak yang tersisa dipanaskan dalam oven selama 60 menit, kemudian didinginkan dalam desikatot selama 30 menit dan ditimbang (X2).
Kadar Lemak (%) = x 100% Metode Floch
1. Sampel ditimbang sebanyak 2-3 gram (A) dan dimasukkan ke dalam gelas homogenize dan ditambahkan larutan kloroform/methanol(20xA), sebagian disisakan untuk membilas pada saat penyaringan.
2. Sampel dihomogenizer selama 5 menit setelah itu disaring dengan vacuum pump.
3. Sampel yang telah disaring tersebut dimasukkan dalam labu pemisah yang telah diberi larutan MgCl2 0,03 N (0.2xC), kemudian dikocok dengan kkuat minimal selama 1 menit kemudian ditutup dengan alumunium foil dan didiamkan selama 1 malam.
4. Labu silinder dioven terlebih dahulu pada suhu 110 ºC selama 1 jam, didinginkan dalam desikator selama 30 menit kemudian ditimbang (X1).
14
5. Lapisan bawah yang terdapat dalam labu pemisah disaring kedalam labu silinder kemudian dievaporator sampai kering. Sisa kloroform / methanol yang terdapat dalam labu ditiup dengan menggunakan vacuum.
6. Stelah sisa kloroform/methanol dalam labu habis, labu dimasukkan kedalam oven selama 1 jam, didinginkan dalam desikator selama 30 menit kemudian di timbang (X2).
Kadar Lemak (%) = x 100% C Kadar Air
1. Cawan dipanaskan dalam oven pada suhu 100 ºC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1) 2. Bahan ditimbang 2-3 gram.
3. Cawan dan bahan dipanaskan dalam oven pada suhu 110 ºC selama 4-6 jam kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X2)
Kadar Air (%) = ( ) x 100% D. Kadar Abu
1. Cawan dan bahan dipanaskan dlama oven pada suhu 100 ºC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1)
2. Bahan ditimbang 2-3 gram(A)
3. Cawan dan bahan dipanaskan dalam tanur pada suhu 600 ºC sampai menjadi abu kemudian dimasukkan kedalam oven selama 15 menit, didinginkan dalam desikator selama 30 menit dan ditimbang. (X2)
Kadar Abu (%) = x 100% E. Kadar Serat Kasar
1. Kertas filter dipanaskan dalam oven selama 1 jam pada suhu 110 ºC setelah itu didinginkan dalam desikator selama 15 menit dan ditimbang (X1)
2. Sampel ditimbang sebanyak 0,5 gram (A) dimasukkan kedalam Erlemeter 250 ml
3. H2SO4 0,3 N sebanyak 50 ml ditambahakan ke dalam erlemeyer kemudian di panaskan diatas pembakar bunsen selama 30 menit. Setelah itu NaOH 1,5 N sebanyak 25 ml ditambahkan ke dalam Erlemeyer dan dipanaskan kembali 30 menit.
4. Larutan dan bahan yang telah dipanaskan kemudian disaring dalam corong Buchner dan hubungkan pada vacuum pump untuk memepercepat filtrasi. 5. Larutan dan bahan yang ada pada corong Buchner kemudian dibilas secra
berturut-turut dengan 50 ml air panas, 50 ml H2SO4 0,3 N, 50 ml air panas, dan 25 ml aseton.
6. Kertas saring dan residu bahan dimasukkan dalam cawan porselin, lalu dipanaskan dalam oven 105 – 110 ºC selama 1 jam kemudian didinginkan dalam desikator selama 30 menit dan ditimbang (x2)
7. Setelah itu di panaskan dalam tanur 600 ºC hingga berwarna putih atau menjadi abu (±4 jam). Kemudian dimasukkan dalam oven 105-110 ºC selama 15 menit, didinginkan dalam desikator selama 30 menit dan ditimbang (X3)
15
Kadar Serat Kasar = x 100%
Lampiran 2 Prosedur Analisa Enzim A. Preparasi sampel
Usus, isi lambung,ikan kecil segar ditimbang,kemudian ditambahkan larutan buffer Tris (20 mM Tris HCl, 1 mM EDTA, 10 mM CaCl2, pH 7,5) dengan perbandingan 10%.Lalu dimasukkan kedalam tabung effendorf dan disentrifuge selama 10 menit 12.000 rpm suhu 4˚C.Diambil supernatantnya,dan dilakukan berbagai analisis enzim terhadap supernatant tersebut.
B. Enzim protease
1. Siapkan tabung reaksi untuk blanko, standar dan contoh (banyaknya tabung tergantung pada jumlah contoh).
2. Masukkan buffer phosphat 0,05 M pH 7 sebanyak 1 mL kedalam semua tabung reaksi.
3. Lalu masukkan larutan substrat casein 20 mg/mL pH 7 sebanyak 1 mL juga kedalam semua tabung reaksi.
4. Kemudian masukkan contoh sebanyak 0,2 mL, kedalam tabung reaksi contoh saja.
5. Masukkan 0,2 mL larutan standar Tirosin 5 mmol/L kedalam tabung reaksi untuk standar.
6. Dan masukkan 0,2 mL aquadest kedalam tabung reaksi untuk blanko. 7. Inkubasi pada suhu 37ºC selama 10 menit.
8. Tambahkan larutan TCA 0,1 M sebanyak 2 ml kedalam semua tabung. 9. Tambahkan larutan CaCl2 2 mmol/L sebanyak 0,2 mL kedalam tabung
blanko dan standar, sedangkan kedalam tabung sampel/contoh ditambahkan 0,2 mL aquadest.
10. Diamkan pada suhu 37ºC selama 10 menit.
11. Sentrifuge selama 10 menit dengan kecepatan 3500 rpm.
12. Filtrat dari masing-masing tabung diambil 1,5 mL, ditambahkan 5 mL Na2CO3 0,4 M kedalam setiap tabung, lalu larutan Folin Ciaocalteau (1:1) sebanyak 1 ml.
13. Didiamkan selama 20 menit pada suhu 37ºC.
14. Diukur absorbansinya dengan spektrofotometer pada λ 578 nm. C. Enzim lipase
1. Dipipet 1,5 mL substrat lipase murni (minyak zaitun murni), dan dimasukkan kedalam erlenmeyer ukuran 100-125 mL.
2. Kemudian ditambahkan 1 mL Tris-HCl 0,1 M pH 8.0 kedalam erlenmeyer tersebut, dan 1 mL contoh.
3. Dihomogenkan lalu diinkubasi pada suhu 37ºC selama 6 jam.
4. Ditambahkan 3 mL etil alkohol 95% (untuk memberhentikan proses hidrolisis), dan dititrasi segera dengan NaOH 0,01 N (dengan menggunakan indikator Thymolphtalein 0.9%).
D. Protein Bradford
1. Digunakan sampel 0,5 g kemudian ditambahkan 5 mL Tris-HCl pH 6,5 0,05M
16
2. Lalu disentrifuse 10.000 rpm selama 20 menit
3. Ambil supernatannya saja, kemudian dimasukkan ke dalam evendorf
4. Dimasukkan 0,5 mL supernatan tadi ke dalam tabung reaksi dan 2,5 mL larutan bradford ke semua tabung tersebut.
5. Diinkubasi pada suhu 30 oC
6. Dispektro dengan panjang gelombang 595 nm
Lampiran 3 Anova dan hasil uji Tukey tingkat kelangsungan hidup Jumlah kuadrat df Rataan kuadrat F Sig. SR Antar Kelompok 9129.048 4 2282.262 52.578 .000 Dalam kelompok 390.667 9 43.407 Total 9519.714 13
Perlakuan N Untuk alpha = 0.05
1 2 0C+6PB 3 23.0000 2C+5PB 2 84.0000 6C+0PB 3 84.3333 3C+3PB 3 85.0000 5C+2PB 3 87.0000 Sig. 1.000 .982
Rata-rata untuk tiap kelompok pada homogenus yang diperlihatkan. Lampiran 4 Anova dan uji Tukey panjang Akhir
Jumlah kuadrat df Rataan kuadrat F Sig. P.Akhir Antar kelompok .734 4 .184 17.883 .000 Dalam kelompok .092 9 .010 Total .827 13
Perlakuan N Untuk alpha = 0.05
1 2 0C+6PB 3 -.0467 2C+5PB 2 .3800 5C+2PB 3 .4067 6C+0PB 3 .5500 3C+3PB 3 .5633 Sig. 1.000 .293
17 Lampiran 5 Anova dan uji Tukey Aktivitas Lipase
Jumlah kuadrat df Rataan kuadrat F Sig. E.Lipase Antar kelompok 3.778 4 .944 7.278 .005 Dalam kelompok 1.298 10 .130 Total 5.075 14
Perlakuan N Untuk alpha = 0.05
1 2 6C+0PB 3 1.1441 3C+3PB 3 1.5469 2C+5PB 3 1.7669 1.7669 5C+2PB 3 1.7932 1.7932 0C+6PB 3 2.6746 Sig. .252 .069
Rata-rata untuk tiap kelompok pada homogenus yang diperlihatkan. Lampiran 6 Anova dan uji TukeyEnzim protease
Jumlah kuadrat df Rataan kuadrat F Sig. E.Protease Antar kelompok .001 4 .000 14.800 .000 Dalam kelompok .000 10 .000 Total .001 14
Perlakuan N Untuk alpha = 0.05
1 2 3 0C+6PB 3 .00502 6C+0PB 3 .00738 3C+3PB 3 .01236 .01236 5C+2PB 3 .02106 .02106 2C+5PB 3 .02289 Sig. .167 .083 .968
18
RIWAYAT HIDUP
Penulis dilahirkan di Palembang, pada tanggal 30 Agustus 1992 dari bapak Syarbani dan ibu Nur Afiah merupakan anak keempat dari enam bersaudara. Penulis mempunyai tiga orang kakak perempuan yaitu Retno Kumalasari, Dwi Permata Afyani, dan Uliyah Wulandari. Penulis juga mempunyai satu adik perempuan dan satu laki-laki yang bernama Rizky Puspa Lestari dan Muhammad Bayu Nugroho.
Pendidikan formal yang dilalui penulis mulai dari TK Al-Amanah Kenten Laut (1997-1998), SD Negeri 2 Kenten Laut (1998-2004), SMP Negeri 14 Palembang (2004-2007), dan SMA Negeri 3 Palembang (2007-2010). Penluis diterima menjadi mahasiswa Program Studi Teknologi dan Manajemen Perikanan Budidaya, Departemen Budaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk Institut Pertanian Bogor (USMI) pada tahun 2010.
Selama mengikuti perkuliahan, penulis aktif menjadi anggota Organisasi Mahasiswa Daerah (OMDA) Ikatan Keluarga Mahasiswa Sumatera Selatan (2010-sekarang), anggota Departemen Kominfo Badan Eksekutif Mahasiswa Tingkat Persiapan Bersama IPB (2010-2011), anggota Departemen Pengembangan Budaya dan Olahraga Badan Eksekutif Mahasiswa Fakultas Perikanan dan Ilmu Kelautan Kabinet Biru Bersatu (2011-2012), Sekretaris Departemen Pengembangan Budaya dan Olahraga Badan Eksekutif Mahasiswa Fakultas Perikanan dan Ilmu Kelautan Kabinet Pengarung Samudra (2012-2013). Penulis juga menjadi asisten mata kuliah Nutrisi Ikan (2013/2014) dan mata kuliah Teknologi Produksi Plankton, Bentos dan Alga (2013/2014). Lomba yang pernah dimenangkan penulis antara lain mendapat pendanaan Program Kreativitas Mahasiswa DIKTI bidang Penelitian (PKMP) tahun 2013. Penulis juga pernah mengikuti kegiatan magang di Balai Besar Pengembangan Budidaya Air Tawar Sukabumi, Jawa Barat (2012) dan kegiatan Praktik Lapangan di Balai Pengembangan Budidaya Air Tawar Subang, Jawa Barat pada Juni-Agustus 2013 dengan judul “Pembenihan Ikan Patin (Pangasionodon hypopthalmus) Di Balai Pengembangan Budidaya Air Tawar (BPBAT) Subang”.
Tugas Akhir dalam pendidikan tinggi sarjana diselesaikan oleh penulis dengan menyusun skripsi yang berjudul “Kombinasi Pakan Alami Tubifex dan Pakan Buatan pada Pemeliharaan Larva Ikan Patin Pangasius sp.”