INTISARI
Antioksidan adalah senyawa yang menghambat reaksi radikal bebas dalam tubuh, akibatnya kerusakan sel dan jaringan dapat dicegah. Ketapang merupakan salah satu tanaman, dimana buahnya memiliki kadar senyawa fenolik dan flavonoid yang digunakan untuk obat sakit kepala, pencahar, rematik, dan lepra.
Penelitian ini bertujuan untuk mengetahui aktivitas antioksidan fraksi etil asetat buah ketapang serta menentukan kadar flavonoid total. Nilai aktivitas penangkapan radikal hidroksil dinyatakan dalam persen penangkapan (% scavenging) dan nilai penangkapan efektif (effective scavenging) radikal hidroksil sebesar 50% (ES50).
Metode penangkapan radikal hidroksil yang digunakan adalah metode spektrofotometri visibel menggunakan deoksiribosa. Prinsip metode ini adalah degradasi deoksiribosa oleh radikal hidroksil, membentuk malondialdehid (MDA) dalam suasana asam dan adanya asam tiobarbiturat (TBA) menghasilkan kromogen MDA-TBA berwarna merah muda yang diukur absorbansinya pada panjang gelombang maksimum 532 nm.
Data kromatografi berupa hRf dan warna bercak sebelum dan sesudah ditambah pereaksi (uap amonia dan besi (III) klorida), diamati dengan sinar tampak maupun dengan sinar UV 254 nm dan 366 nm. Kadar flavonoid total dihitung menggunakan persamaan regresi linear kurva baku kuersetin.
Hasil penelitian menunjukkan bahwa fraksi etil asetat buah ketapang memiliki aktivitas penangkapan radikal hidroksil dengan ES50 sebesar
69,39µg/mL. Kadar flavonoid total fraksi etil asetat buah ketapang adalah 3,302 %b/b ekivalen kuersetin.
ABSTRACT
Antioxidant is a compound which habbits free radical reaction inside the body, so it prevents body cells and tissues damage. Ketapang is one of plants, which its fruit contents phenolic and flavonoid compounds, used for treating headache, laksantia, gout, and leprosy.
This research aimed to find out the antioxidant activity of the ethyl acetate fraction of ketapang fruit, and also to determine the total consentrations of flavonoid. The activity value of hydroxyl radical scavenging activity is state in percent (%) scavenging and hydroxyl radical effective scavenging value is in 50% (ES50).
The hydroxyl radical scavenging method that is spectrophotometry visible method used deoxyribose. The principle of this method is the deoxyribose degradation by the hydroxyl radical, forms the malondialdehyde (MDA) in acid condition, and also by the existence of thiobarbituric acid (TBA) produces the pink chromogent which has 532 nm for the length of the maximum wave, after the absorbance is measured.
The chromatography data is the form of hRf and spots colour on before and after being added with reagent (ammonia vapor and iron (III) chloride), is being observed by the normal beam or even UV lights on 254 nm and 366 nm. The total contents of flavonoid is analyzed using the regretion linear equation quercetin.
The result of the research indicates that the ethyl acetate fraction of ketapang fruit has 93.39 % μg/ml for ES50 the activity of hydroxyl radical
scavenging. The total flavonoid consentrations of ethyl acetate fraction from ketapang fruit is 3.302 % b/b equivalent quercetin.
UJI AKTIVITAS ANTIOKSIDAN DENGAN METODE
SPEKTROFOTOMETRI VISIBEL MENGGUNAKAN DEOKSIRIBOSA DAN PENENTUAN KADAR FLAVONOID TOTAL
FRAKSI ETIL ASETAT BUAH KETAPANG (Terminalia catappa L.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Diajukan oleh : Yovita Dwi Arini NIM : 038114128
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
PRAKATA
Puji dan Syukur Penulis panjatkan kepada Allah Bapa yang senantiasa
mendampingi, membimbing, memberikan berkat, anugerah, kasih dan
pertolonganNya sehingga penulis dapat menyelesaikan skripsi ini dengan baik.
Skripsi dengan judul Uji Aktivitas Antioksidan Dengan Metode Spektrofotometri Visibel Menggunakan Deoksiribosa Dan Penentuan Kadar Flavonoid Total Fraksi Etil Asetat Buah Ketapang (Terminalia catappa L.) disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi di
Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Dalam penelitian dan penyusunan skripsi ini tentunya tidak terlepas dari
bantuan berbagai pihak. Oleh karena itu, dalam kesempatan ini penulis ingin
mengucapkan terima kasih kepada :
1. Ibu Rita Suhadi, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma.
2. Bapak Dr. C.J. Soegihardjo, Apt selaku Dosen Pembimbing yang dengan
sabar telah bersedia membimbing, mengoreksi, memberi masukan,
bantuan dan saran mulai dari awal persiapan hingga akhir penyusunan
skripsi ini. Bahan-bahan yang bapak berikan sungguh berguna.
3. Bapak Drs. Sulasmono, Apt., selaku Dosen Penguji yang bersedia
berdiskusi, menguji, memberikan saran, kritik selama penyusunan skripsi.
4. Ibu Erna Tri Wulandari, M.Si., Apt., selaku Dosen Penguji yang bersedia
berdiskusi, menguji, memberikan saran, masukan, kritik selama
5. Ign. Y. Kristio Budiasmoro, M.Si., selaku Dosen Pembimbing Akademik
yang telah mendukung, memotivasi, membantu dan memberikan
pengarahan selama kuliah.
6. Seluruh staf pengajar dan karyawan Fakultas Farmasi Universitas Sanata
Dharma Yogyakarta. Terima kasih atas pengalaman, ilmu, dan
pengetahuannya.
7. Mas Wagiran, Mas Sigit, Mas Sarwanto, Mas Kunto, Mas Parlan, terima
kasih atas kerja sama, bantuan, dan pendampingan selama penulis
“ngelab” di lantai tiga dan empat. Untuk Mas Andri, Mas Heru, Mas
Parjiman, Mas Kayat, Mas Yuwono, Pak Musrifin, Pak Iswandi dan Mas
Ottok, terima kasih atas peminjaman alat, kerja sama dan sapa ramahnya.
8. My sisters and brothers yang selalu menanyakan ’kapan selesai, kapan
wisuda?’, yang merupakan motivator untuk maju dan terus berusaha.
9. Teman-teman seperjalan hidup empat tahun ini, yanti ’nduke’, rachel
’ndut’, nopha ’nyet2’, tatik ’item’, mbak dias, mbak pepi, mbak sisca,
mbak estri, rita, tutu, vira. Cerita, tawa, kebersamaan dan kekompakan
yang akan selalu kurindukan.
10.Kelas C angkatan 2003 (kami menyebutnya Che_mistry), rasanya tak
habis-habis aku bercerita tentang semua yang kita lakukan empat tahun ini.
Canda, cerita, tugas, praktikum, ”dolan”, dan lainnya, pasti akan buat aku
kangen. Terima kasih buat persahabatan, kebersamaan, perhatian, doa,
11.Anggara Eka Nugraha, yang selalu memberi motivasi, bantuan, kritik,
saran, semangat ketika penulis sedang putus asa. Terima kasih buat
sayang, perhatian, doa, waktu, dukungan, dan pendampingannya serta
karya-karyanya yang sungguh ’cantik’.
12.Adik-adik angkatan baik yang menemani penulis saat ”ngelab”, sehingga
suasana di laboratorium lebih hidup dan ramai maupun yang selalu
menyapa penulis sehingga penulis termotivasi dan bersemangat kembali.
13.Mas Prasojo, yang mau memberikan ilmu tentang mekanisme reaksi dan
mas Ardian yang membantu memastikan metode yang digunakan.
14.Pak Yahya di UGM yang memberi ijin dan bersedia memetik ketapang
untuk penulis.
Serta untuk semua pribadi yang membantu penulis dalam banyak hal untuk
menyelesaikan skripsi ini, dan terima kasih untuk semuanya.
Penulis menyadari bahwa masih banyak kekurangan dalam penyusunan
skripsi ini. Oleh karena itu, penulis mengharapkan kritik dan saran dari berbagai
pihak. Akhirnya besar harapan penulis semoga hasil penelitian ini bermanfaat bagi
perkembangan ilmu farmasi
Yogyakarta, Januari 2008
DAFTAR ISI
Halaman
HALAMAN JUDUL... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PRAKATA... v
PERNYATAAN KEASLIAN KARYA ... viii
DAFTAR ISI... ix
DAFTAR TABEL... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xvi
INTISARI... xvii
ABSTRACT... xviii
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
B. Permasalahan... 4
C. Manfaat Penelitian... 4
D. Keaslian Penelitian... 5
E. Tujuan Penelitian ... 5
BAB II. PENELAHAAN PUSTAKA... 6
1. Nama tanaman ... 6
2. Sistematika tanaman ... 7
3. Kandungan kimia ... 7
4. Kegunaan dan khasiat ... 7
B. Flavonoid... 8
1. Kerangka dasar dan pengertian flavonoid ... 8
2. Penyebaran flavonoid ... 9
3. Penggolongan dan sifat flavonoid ... 10
4. Penyarian flavonoid ... 12
5. Deteksi dan identifikasi flavonoid ... 16
6. Kegunaan flavonoid ... 16
C. Antioksidan ... 16
1. Radikal bebas ... 16
2. Definisi dan aktivitas antioksidan ... 18
3. Penggolongan antioksidan ... 18
4. Metode pengujian daya antioksidan ... 22
D. Deoksiribosa ... 24
E. Metode Penyarian ... 26
F. Kromatografi Lapis Tipis (KLT) ... 29
G. Spektrofotometri UV-Vis ... 32
H. Keterangan Empirik ... 38
BAB III. METODOLOGI PENELITIAN ... ... 40
A. Jenis dan Rancangan Penelitian ……….. ... 40
B. Variabel - Variabel Penelitian ………40
1. Variabel bebas... 40
2. Variabel tergantung ... 40
3. Variabel pengacau ... 40
C. Definisi Operasional ………... 41
1. Uji aktivitas antioksidan ... 41
2. Fraksi etil asetat ... 41
3. Kadar senyawa flavonoid total ... 41
4. buah ketapang ... 41
D. Bahan Penelitian ... 42
E. Alat Penelitian ... 42
F. Tata Cara Penelitian ... 43
1. Determinasi tanaman... 43
2. Pengumpulan bahan ... 43
3. Pembuatan ekstrak etanol buah ketapang ... 43
4. Pembuatan fraksi etil asetat buah ketapang ... 44
5. Uji kualitatif kandungan flavonoid dengan metode KLT ... 44
6. Pembuatan buffer fosfat ... 44
7. Pembuatan pereaksi ... 45
9. Uji aktivitas penangkapan radikal hidroksil oleh fraksi etil
asetat buah ketapang ... 48
10. Penentuan kadar flavonoid total ... 49
G. Analisis Hasil ... 50
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN ... 51
A. Hasil Determinasi Tanaman ... 51
B. Hasil Pengumpulan Bahan ... 51
C. Pembuatan Ekstrak Etanol Buah Ketapang... 52
D. Hasil Pembuatan Fraksi Etil Asetat Buah Ketapang... 57
E. Hasil Uji Kualitaif Flavonoid dengan metode KLT ... 58
F. Optimasi Metode ... 61
1. Penentuan waktu operasi ... 61
2. Penentuan panjang gelombang serapan maksimum ... 66
G. Hasil Uji Aktivitas Penangkapan Radikal Hidroksil dengan Metode Deoksiribosa ... 68
H. Penentuan Kadar Senyawa Flavonoid Total ... 74
BAB V. KESIMPULAN DAN SARAN ... 79
A. Kesimpulan ... 79
B. Saran ... 79
DAFTAR PUSTAKA ... 80
LAMPIRAN... 85
DAFTAR TABEL
Halaman
Tabel I. Warna bercak beberapa flavonoid setelah disemprot dengan
pereaksi besi (III) klorida ... 13
Tabel II. Penafsiran warna bercak dari segi struktur flavonoid ... 15
Tabel III. Beberapa macam ROS dan antioksidan yang menetralkan... 17
Tabel IV. Absorbansi kromogen MDA-TBA pada penambahan fraksi etil
asetat buah ketapang dengan berbagai konsentrasi... 69
Tabel V. Persen scavenging fraksi etil asetat buah ketapang ... 71
Tabel VI. Kadar kuersetin dan absorbansinya setelah direaksikan dengan
aluminium klorida dalam suasana basa ... 76
Tabel VII. Kadar flavonoid total fraksi etil asetat dihitung sebagai %b/b
DAFTAR GAMBAR
Halaman
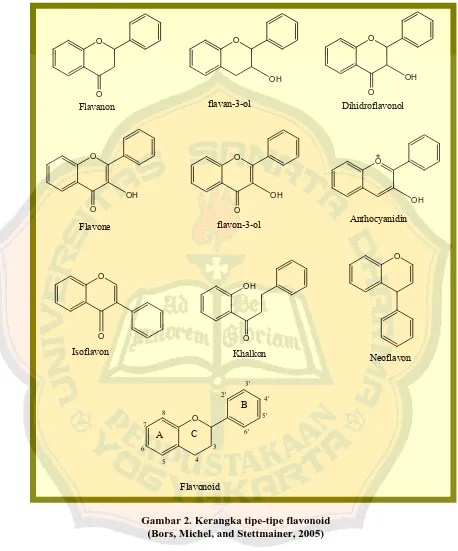
Gambar 1. Kerangka dasar flavonoid ... 9
Gambar 2. Kerangka tipe-tipe flavonoid ... 11
Gambar 3. Pembentukan struktur kuinoid flavonoid karena uap ammonia . 13 Gambar 4. Reaksi pembentukan kompleks flavonoid (flavon, 5-OH flavon, flavonol) dengan pereaksi aluminium klorida ... 14
Gambar 5. Senyawa-senyawa yang memiliki aktivitas antioksidan ... 21
Gambar 6. Struktur kimia beberapa antioksidan sintetik ... 21
Gambar 7. Struktur deoksiribosa ... 24
Gambar 8. Tingkat energi elektronik ... 34
Gambar 9. Struktur rutin ... 58
Ganbar 10. Kromatogram uji kualitatif flavonoid pada fraksi etil asetat dengan fase diam: selulosa, fase gerak: butanol-asam asetat-air (4:1:5) v/v, deteksi: uap amonia ... 59
Gambar 11. Kromatogram uji kualitatif flavonoid pada fraksi etil asetat dengan fase diam: selulosa, fase gerak: n-butanol-asam asetat-air (4:1:5) v/v, deteksi: pereaksi semprot besi (III) klorida ... 60
Gambar 12. Kurva hubungan waktu (menit) dengan absorbansi kromogen MDA-TBA... 62
Gambar 13. Reaksi pembentukan gugus enol pada TBA ... 63
Gambar 14. Reaksi pembentukan MDA ... 64
Gambar 16. Struktur kromogen MDA-TBA ... 66
Gambar 17. Kurva hubungan panjang gelombang (nm) dengan absorbansi kromogen MDA-TBA... 67
Gambar 18. Kurva hubungan antara penambahan konsentrasi fraksi etil asetat buah ketapang dengan absorbansi kromogen MDA-TBA 70 Gambar 19. Kurva hubungan kenaikan konsentrasi fraksi etil asetat dengan % Scavenging ... 71
Gambar 20. Mekanisme penangkapan radikal hidroksil oleh flavonoid dan efek resonansi yang terjadi pada flavonoid... 73
Gambar 21. Reaksi kopling radikal fenoksil... 74
Gambar 22. Reaksi yang terjadi dalam penetapan kadar flavonoid ... 75
Gambar 23. Kurva kadar kuersetin dan absorbansinya setelah direaksikan dengan aluminium klorida dalam suasana basa ... 76
Gambar 23. Pohon ketapang ... 94
Gambar 24. Buah ketapang ... 94
Gambar 25. Daun ketapang ... 94
Gambar 26. Bunga ketapang ... 94
Gambar 27. Ekstrak kental buah ketapang ... 95
Gambar 29. Fraksi etil asetat buah ketapang ... 95
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Tabel nilai koefisien korelasi (r) ... 85
Lampiran 2. Perhitungan rendemen ... 85
Lampiran 3. Gambar kromatogram uji kualitatif flavonoid... 86
Lampiran 4. Contoh perhitungan % scavenging fraksi etil asetat buah ketapang ... 86
Lampiran 5. Perhitungan nilai ES50 fraksi etil asetat ... 87
Lampiran 6. Contoh perhitungan kadar flavonoid fraksi etil asetat ... 87
Lampiran 7.Perhitungan A (1%, 1 cm) ... 88
Lampiran 8. Foto-foto ... 94
Lampiran 9. Surat determinasi ... 96
Lampiran 10. Sertifikat analisis deoksiribosa ... 97
Lampiran 11. Sertifikat analisis rutin... 98
Lampiran 12. Sertifikat analisis kuersetin... 99
INTISARI
Antioksidan adalah senyawa yang menghambat reaksi radikal bebas dalam tubuh, akibatnya kerusakan sel dan jaringan dapat dicegah. Ketapang merupakan salah satu tanaman, dimana buahnya memiliki kadar senyawa fenolik dan flavonoid yang digunakan untuk obat sakit kepala, pencahar, rematik, dan lepra.
Penelitian ini bertujuan untuk mengetahui aktivitas antioksidan fraksi etil asetat buah ketapang serta menentukan kadar flavonoid total. Nilai aktivitas penangkapan radikal hidroksil dinyatakan dalam persen penangkapan (% scavenging) dan nilai penangkapan efektif (effective scavenging) radikal hidroksil sebesar 50% (ES50).
Metode penangkapan radikal hidroksil yang digunakan adalah metode spektrofotometri visibel menggunakan deoksiribosa. Prinsip metode ini adalah degradasi deoksiribosa oleh radikal hidroksil, membentuk malondialdehid (MDA) dalam suasana asam dan adanya asam tiobarbiturat (TBA) menghasilkan kromogen MDA-TBA berwarna merah muda yang diukur absorbansinya pada panjang gelombang maksimum 532 nm.
Data kromatografi berupa hRf dan warna bercak sebelum dan sesudah ditambah pereaksi (uap amonia dan besi (III) klorida), diamati dengan sinar tampak maupun dengan sinar UV 254 nm dan 366 nm. Kadar flavonoid total dihitung menggunakan persamaan regresi linear kurva baku kuersetin.
Hasil penelitian menunjukkan bahwa fraksi etil asetat buah ketapang memiliki aktivitas penangkapan radikal hidroksil dengan ES50 sebesar 69,39µg/mL. Kadar flavonoid total fraksi etil asetat buah ketapang adalah 3,302 %b/b ekivalen kuersetin.
ABSTRACT
Antioxidant is a compound which habbits free radical reaction inside the body, so it prevents body cells and tissues damage. Ketapang is one of plants, which its fruit contents phenolic and flavonoid compounds, used for treating headache, laksantia, gout, and leprosy.
This research aimed to find out the antioxidant activity of the ethyl acetate fraction of ketapang fruit, and also to determine the total consentrations of flavonoid. The activity value of hydroxyl radical scavenging activity is state in percent (%) scavenging and hydroxyl radical effective scavenging value is in 50% (ES50).
The hydroxyl radical scavenging method that is spectrophotometry visible method used deoxyribose. The principle of this method is the deoxyribose degradation by the hydroxyl radical, forms the malondialdehyde (MDA) in acid condition, and also by the existence of thiobarbituric acid (TBA) produces the pink chromogent which has 532 nm for the length of the maximum wave, after the absorbance is measured.
The chromatography data is the form of hRf and spots colour on before and after being added with reagent (ammonia vapor and iron (III) chloride), is being observed by the normal beam or even UV lights on 254 nm and 366 nm. The total contents of flavonoid is analyzed using the regretion linear equation quercetin.
The result of the research indicates that the ethyl acetate fraction of ketapang fruit has 93.39 % μg/ml for ES50 the activity of hydroxyl radical scavenging. The total flavonoid consentrations of ethyl acetate fraction from ketapang fruit is 3.302 % b/b equivalent quercetin.
BAB I PENGANTAR
A. Latar Belakang
Oksigen merupakan atom yang sangat reaktif dan dapat berubah menjadi
suatu molekul perusak yang sering disebut ‘radikal bebas’. Radikal bebas dapat
menyerang sel-sel tubuh yang sehat dan menyebabkan sel-sel tersebut kehilangan
fungsi dan strukturnya. Radikal bebas yang sangat reaktif ini akan mencuri
(menangkap atau mengambil) elektron dari senyawa lain seperti protein, lipid dan
DNA untuk menetralkan diri. Radikal bebas yang masuk dalam tubuh akan
menyerang selaput lipid yang melindungi sel, kemudian merusak protein, enzim
dan inti sel dimana DNA dibentuk (Kumalaningsih, 2007). Kerusakan sel yang
disebabkan radikal bebas menjadi kontributor utama dalam penuaan dan penyakit
degeneratif seperti kanker, penyakit kardiovaskular, katarak, penurunan sistem
imun dan kerusakan otak (Percival, 1998).
Reactive Oxygen Species (ROS) merupakan bentuk yang terdiri dari
radikal yang sangat reaktif, molekulnya mengandung oksigen dan merupakan
radikal bebas yang umum dihasilkan dalam sistem biologi. ROS juga dapat
dihasilkan oleh sumber eksogen seperti komponen makanan dan radiasi
ultraviolet. Beberapa macam ROS: radikal superoksid (O2•-), anion peroksid
(HOO-), radikal hidroksil (•OH), radikal peroksil (ROO•), radikal peroksinitrit
(O=NOO•-), radikal oksida nitrit (NO•), oksigen singlet (O•), radikal hipoklorid
Antioksidan merupakan senyawa yang mampu menghambat reaksi
berantai radikal bebas dalam tubuh manusia dan dapat memberikan elektronnya
kepada molekul radikal bebas tanpa terganggu fungsinya (Kumalaningsih, 2007).
Antioksidan merupakan first line dalam pertahanan terhadap kerusakan yang
disebabkan oleh radikal bebas karena berfungsi menstabilkan atau mendeaktivasi
radikal bebas sebelum menyerang sel (Percival, 1998).
Ketapang merupakan tanaman pelindung yang biasa ditanam di daerah
pantai sebagai peneduh, memperindah pantai dan produsen edible nuts
(kacang-kacangan), karena bijinya dapat dimakan. Banyak tumbuh didaerah tropis dan
subtropis. Mudah beradaptasi dengan tanah tempat tumbuh dan kadar garam,
cepat tumbuh dan perawatannya minimal sehingga mudah dibudidayakan
(Thomson, 2006). Ketapang merupakan tanaman yang memiliki kandungan
fenolik, yaitu tanin dan flavonoid. Buahnya digunakan untuk obat sakit kepala,
leprosy (lepra), rematik, mual saat perjalanan, laksantia (pencahar) (Anonim,
2006a). Daun tanaman ketapang memiliki kegunaan sebagai antikanker dan
antioksidan sebaik sifat anticlastogenic (pencegah pemutusan ikatan) (Anonim,
2006b). Dalam beberapa penelitian buah ketapang mempunyai efek sebagai anti
HIV, anti asmathik, anti katarak, antidiabetik, xanthin oxidase inhibitor, aldose
reductase inhibitor. Kombinasi dari daun dan batang tanaman ketapang memiliki
aktivitas antikanker-antioksidan (Nagappa, Thakurdesai, Venkat Rao, Singh,
2006). Kemungkinan dalam buah ketapang memiliki aktivitas yang sama atau
Flavonoid merupakan senyawa polar karena mempunyai sejumlah gugus
hidroksi yang tidak tersubstitusi atau suatu gula. Oleh karena itu, umumnya
flavonoid cukup larut dalam pelarut polar seperti etanol, metanol, butanol, aseton,
etil asetat, dimetilsulfoksida, dimetilformamid, dan air (Markham, 1988).
Aktivitas antioksidan dimiliki oleh sebagian besar flavonoid disebabkan adanya
gugus hidroksi fenolik dalam struktur molekulnya. Beberapa tahun belakangan ini
diteliti kemampuan flavonoid sebagai antioksidan untuk merubah atau mereduksi
radikal bebas dan juga sebagai antiradikal bebas (Giorgio, 2000).
Etil asetat merupakan pelarut yang paling baik untuk aglikon flavonoid
dan dianjurkan untuk digunakan dalam proses pemurnian (Robinson, 1995).
Glikosida dan beberapa aglikon flavonoid larut dalam etil asetat (Mabry,
Markham, and Thomas, 1970). Aktivitas antioksidan daun ketapang dalam fraksi
etil asetat lebih tinggi dibandingkan pentana atau diklorometana (Chyau, Tsai, Ko,
and Mau, 2002). Dalam penelitian tentang antioksidan herba ketul (Bidens pilosa
L.), didapatkan fraksi etil asetat memiliki aktivitas sebagai antioksidan yang
paling tinggi dibandingkan rutin, fraksi klorofom dan ekstrak metanoliknya
(Nusarini, 2007; Wiyatsih, 2007).
Metode pengujian yang dipilih adalah metode deoksiribosa. Metode ini
menggunakan deoksiribosa sebagai model biomolekul dari gula DNA yang
terdapat dalam tubuh sehingga secara tidak langsung memberikan gambaran
reaksi radikal hidroksil dalam tubuh. Selain itu, metode ini relatif sederhana dan
mudah. Adanya aktivitas penangkapan radikal hidroksil oleh fraksi etil asetat buah
absorbansi larutan kontrol (tanpa sampel) dan larutan dengan sampel dibagi
absorbansi kontrol dikalikan 100%. Nilai aktivitas penangkapan radikal hidroksil
dapat dinyatakan dalam aktivitas penangkapan efektif 50% radikal hidroksil atau
effective scavenging 50% (ES50). Semakin kecil nilai ES50 maka sampel tersebut mempunyai nilai keefektifan sebagai penangkap radikal hidroksil (sebagai
antioksidan) yang lebih baik
B. Permasalahan
1. Apakah fraksi etil asetat buah ketapang mempunyai aktivitas antioksidan
melalui uji penangkapan radikal hidroksil dengan metode deoksiribosa?
2. Berapa besar kadar flavonoid total fraksi etil asetat buah ketapang?
C. Manfaat Penelitian 1. Manfaat praktis
Penelitian ini diharapkan dapat memberi informasi bagi penelitian
lebih lanjut maupun masyarakat luas mengenai potensi buah ketapang
sebagai antioksidan alami.
2. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan sumbangan pada
perkembangan ilmu pengetahuan dalam bidang farmasi, khususnya tentang
D. Keaslian Penelitian
Penelitian terhadap buah ketapang sejauh ini belum banyak dilakukan
terutama penelitian terhadap kadar flavonoid total serta uji aktivitas antioksidan
dengan metode deoksiribosa. Adapun penelitian yang telah dilakukan adalah
aktivitas antidiabetes buah ketapang (Nagappa, et.al, 2006)
E. Tujuan Penelitian Penelitian ini bertujuan :
1. Mengetahui aktivitas antioksidan fraksi etil asetat buah ketapang melalui uji
penangkapan radikal hidroksil dengan metode deoksiribosa.
BAB II
PENELAAHAN PUSTAKA
A. Tanaman Ketapang 1. Nama tanaman
Nama latin : Terminalia catappa L. Sinonim : Phytolacca javanica Osbeck.
Terminalia mauritiana Blanco.
Terminalia moluccana Lamk.
Terminalia procera Roxb. (Thomson and Evans, 2006)
Nama daerah: Sumatera: beowa, kilaulu, geutapang, ketapang, hatapang, katapang, lahapang, katafa, ketapas, ketapieng. Jawa: katapang, ketapang.
Nusatenggara: katapang, klihi. Sulawesi: tarisei, salrise, talisei, kanaunggang,
katapang, atapang, lisa. Maluku: wewa, wew, sadina, sarina, saliha, sertalo,
kayane, sirisa, sarisa, sarisalo, lisa, tasi, klis, klais, kris, ngusu, id. Irian: ruge
(Anonim, 1989).
Common Name: Tropical Almond, India Almond, Umbrella Tree, Badam
Amandier De Cayenne, Wild Almond, Hulu Kwang, Sea Almond, Bengal Almond,
Singapore Almond, Malabar Almond, Tropical Almond, Alite, ‘Autara’a, ‘Aua,
‘Auari’iroa, Kamani Haole, Kamani‘ula, False Kamani, Kauariki, Kaukauariki,
Taraire, Ma’i’i, Koa’i’i, Ta’ie, Natapoa, Talie, Talise, Tavola, Tivi, Telie.
2. Sistematika tanaman
Klasifikasi tanaman ketapang dalam sistematika tumbuhan.
Regnum : Plantae
Divisio : Magnoliophyta
Classis : Magnoliopsida
Ordo : Myrtales
Familia : Combretaceae
Genus : Terminalia
Species : Terminalia catappa L.
(http://www.naturia.per.sg/buloh/plants/sea_almond.htm)
3. Kandungan kimia
Daun mengandung beberapa flavonoid (seperti kaemferol dan kuersetin),
beberapa tanin (seperti punicalin, punicalagin, atau tercatin), saponin, dan
fitosterol (Anonim, 2006b).
Buah mengandung cyanidin-3-glucoside, corilagin, ellagic-acid, asam
galat, pentosa, brevifolin-carboxyclic-acid eugenic acid, flavonoid, tanin, dan β
-karoten (Nagappa et al., 2006).
4. Kegunaan dan khasiat a. Daun
Daun mengandung senyawa untuk mencegah kanker dan antioksidan
sebaik sifat anticlastogenic (Anonim, 2006b). Sebagai obat rematik,
anti-inflamasi, mengatasi masalah mata, luka baru, mencegah pendarahan setelah
mengobati penyakit hati (hepatitis), daun muda sebagai pencahar, obat penyakit
kulit (dermatitis), scabies (Anonim, 2006a; Lin, Hsu, Lin, and Hsu, 2001).
b. Buah
Buahnya digunakan untuk obat sakit kepala, leprosy (lepra), mual saat
perjalanan, laksantia (pencahar), rematik dan dapat juga dikonsumsi langsung
(Anonim, 2006a). Dalam beberapa penelitian buah ketapang mempunyai efek
sebagai anti HIV, anti asmathik, anti katarak, antidiabetik, Xanthin oxidase
inhibitor, aldose reductase inhibitor, berpotensi untuk treatment DB (Nagappa
et al., 2006).
c. Batang
Batangnya digunakan untuk obat mulut dan tenggorokan, sakit perut dan
diare, demam, disentri (Anonim, 2006a).
d. Kombinasi
Daun dan batang telah dilaporkan mempunyai aktivitas sebagai
antikanker-antioksidan, anti-HIV reverse transcriptase, hepatoprotektif,
antiinflamasi, hepatitis dan aphrodisiac (Nagappa et al., 2006). Buah, batang
dan daun untuk mengobati disentri (Asia Tenggara), rematik (Indonesia, India).
Buah dan batang untuk mengobati batuk (Samoa) dan asma (Mexico).
(http://www.naturia.per.sg/buloh/plants/sea_almond.htm
B. Flavonoid 1. Kerangka dasar dan pengertian flavonoid
Flavonoid merupakan senyawa polifenol yang strukturnya merupakan
dapat digambarkan sebagai deretan senyawa C6-C3-C6. Artinya, kerangka karbon terdiri atas dua gugus C6 (cincin benzen tersubstitusi) disambungkan dengan
rantai alifatik tiga karbon (Robinson, 1995).
C
C C
Gambar 1. Kerangka dasar flavonoid (Robinson, 1995)
Aktivitas antioksidan dimiliki oleh sebagian besar flavonoid disebabkan
adanya gugus hidroksi fenolik dalam struktur molekulnya. Ketika
senyawa-senyawa ini bereaksi dengan radikal bebas, mereka membentuk radikal baru yang
distabilisasi oleh efek resonansi inti aromatik. Dengan demikian fase propagasi
yang meliputi reaksi radikal berantai dapat dihambat (Cuvelier, Richards, and
Besset, 1991).
2. Penyebaran flavonoid
Flavonoid merupakan kandungan khas tumbuhan hijau, kecuali untuk
golongan algae. Flavonoid sebenarnya terdapat pada semua bagian tumbuhan
termasuk daun, akar, kulit, kayu, tepung sari, bunga, buah dan biji. Hanya sedikit
saja catatan yang melaporkan adanya flavonoid pada hewan (Harborne, 1987).
Penyebaran flavonoid pada golongan tumbuhan yang tersebar yaitu
Angiospermae (Markham, 1988). Penyebaran flavonoid sebagai salah satu
senyawa aktif tumbuhan sering diakibatkan oleh lingkungan tempat tumbuh yang
tempat tumbuh yang berbeda, karena pertumbuhan suatu tanaman dipengaruhi
oleh tinggi tempat, keadaan tanah dan cuaca. Senyawa ini dalam jaringan
tumbuhan lazimnya ditemukan sebagai campuran dari berbagai turunannya dan
jarang ditemukan sebagai senyawa tunggal (Harborne, 1987).
Flavonoid dalam tumbuhan terikat pada gula sebagai glikosida dan aglikon
flavonoid, mungkin saja terdapat dalam satu tumbuhan dalam beberapa bentuk
kombinasi glikosida. Karena alasan itu maka dalam menganalisis flavonoid
biasanya lebih baik ekstrak tumbuhan dihidrolisis terlebih dahulu untuk
mendapatkan bentuk flavonoid sebagai aglikon sebelum memperhatikan
kerumitan glikosida yang mungkin terdapat dalam ekstrak asal (Harborne, 1987).
3. Penggolongan dan sifat flavonoid
Penggolongan flavonoid berdasarkan pada substituen cincin heterosiklik
yang mengandung oksigen dan perbedaan distribusi gugus hidroksil pada atom
C3. Perbedaan di bagian atom C3 menentukan sifat, khasiat dan golongan flavonoid, yaitu flavon, flavanon, flavonol, flavanolnol, isoflavon, auron, dan
khalkon (Markham, 1988).
Flavonoid merupakan fitokimia tumbuhan yang tidak dapat disintesis oleh
manusia. Senyawa ini mempunyai efek positif terhadap kesehatan manusia.
Flavonoid sering merupakan senyawa pereduksi yang baik, karena menghambat
banyak reaksi oksidasi, baik secara enzimatis maupun non enzimatis. Flavonoid
bertindak sebagai penampung yang baik radikal hidroksil dan superoksida, dan
dengan demikian melindungi lipid membran terhadap reaksi yang merusak
OH
Gambar 2. Kerangka tipe-tipe flavonoid (Bors, Michel, and Stettmainer, 2005)
4. Penyarian flavonoid
Penyarian flavonoid dari dalam simplisia tumbuhan dapat dilakukan
kelarutan flavonoid yang diekstraksi. Kelarutan flavonoid berbeda-beda sesuai
golongan dan substitusinya (Robinson, 1995). Pelarut yang kurang polar
digunakan untuk mengekstraksi aglikon flavonoid, sedangkan pelarut yang lebih
polar digunakan untuk glikosida flavonoid atau antosianin. Flavonoid merupakan
senyawa polar karena mempunyai sejumlah gugus hidroksi yang tidak
tersubstitusi atau suatu gula. Oleh karena itu, umumnya flavonoid cukup larut
dalam pelarut polar seperti etanol, metanol, butanol, aseton, etil asetat,
dimetilsulfoksida, dimetilformamid, dan air (Markham, 1988).
Penyarian flavonoid dari tumbuhan didasarkan polaritas kandungan yang
akan disari dan asal bahan (dari mana substansi tersebut berasal). Flavonoid yang
berasal dari vakuola sel umumnya bersifat hidrofilik sehingga penyarian dapat
dilakukan dengan air atau pelarut-pelarut alkoholik. Jika flavonoid terdapat pada
kloroplas, pelarut yang dipergunakan untuk penyarian adalah pelarut-pelarut non
polar sebelum dilakukan penyarian dengan alkohol. Bahan segar dapat diekstraksi
dengan alkohol 96%. Bahan kering dan berkayu dapat menggunakan campuran
alkohol dengan air, hal ini disesuaikan glikosida flavonoidnya (Harborne, 1987).
5. Deteksi dan identifikasi flavonoid
Senyawa flavonoid merupakan senyawa fenolik, oleh karena itu dapat
memberikan reaksi dengan pereaksi untuk fenol antara lain membentuk warna
khas dengan besi (III) klorida (FeCl3), aluminium klorida (AlCl3), larutan asam
sulfanilat terdiasotasi, sitroborat, vanilin HCl dan senyawa asam sulfat pekat
(Harborne, 1987). Flavonoid dapat dideteksi dengan ammonia, jika tidak
pembentukan garam dan struktur kuinoid pada cincin B. Reaksi ini memberi
warna spesifik untuk masing-masing golongan. Flavon dan flavonol akan
memberikan warna kuning, antosian berwarna lembayung biru. Flavanon tidak
berwarna namun akan menjadi merah bila dipanaskan. Flavanolol akan berwarna
coklat hingga jingga, dan adanya khalkon atau auron akan menimbulkan warna
merah mendadak dalam suasana asam (Robinson, 1995).
Tabel I. Warna bercak beberapa flavonoid setelah disemprot dengan pereaksi besi (III) klorida (Mabry, Markham, and Thomas, 1970)
Tipe Flavonoid Warna Bercak
Naringenin
Abu-abu dan biru tua
Deodarin (Dihidroflavonol) Ungu intensif
Dihidrokhalkon Merah
Flavanon Hijau-coklat
Flavonoid akan membentuk kompleks jika direaksikan dengan pereaksi
sitroborat atau dengan pereaksi aluminium klorida. Kompleks yang terbentuk
berwarna kuning (Mabry, et.al., 1970).
O
O
Gambar 4. Reaksi pembentukan kompleks flavonoid (flavon, 5-OH flavon, flavonol) dengan pereaksi AlCl3
Warna Bercak Dengan Sinar UV
Jenis Flavonoid yang mungkin Sinar UV tanpa
NH3 Sinar UV dengan NH3
Lembayung Gelap
Kuning, hijau-kuning atau hijau
a. Biasanya 5-OH flavon atau dihidroflavon (tersulih pada 3-H dan mempunyai 4’-OH) b. Kadang-kadang 5-OH flavonon dan
4’-OH khalkon tanpa 4’-OH pada cincin B
Perubahan warna sedikit atau tanpa perubahan warna
a. Biasanya flavon atau flavonol tersulih pada 3-O mempunyai 5-OH tetapi tanpa 4’-OH bebas
b.beberapa 6- tatau 8-OH flavon dan flavonol tersulih pada 3-O serta mengandung 5-OH
c. Isoflavon, dihidroflavonol, biflavonil dan beberapa flavanon yang mengandung 5-OH
d. Khalkon yang mengandung 2’- dan atau 6’-OH tetapi tidak mengandung 2- atau 4-OH bebas
Biru muda Beberapa 5-OH flavanon
Merah atau jingga Khalkon yang mengandung 2- dan atau 4-OH bebas
Fluorosensi biru muda
Fluorosensi hijau-kuning atau kuning-biru
a. Flavon dan flavanon yang tak mengandung 5-OH, misal 5-OH glikosid b. Flavonol tanpa 5-OH bebnas tetapi
tersulih pada 3-OH Perubahan warna sedikit
atau tanpa perubahan warna
Isoflavon yang mengandung 5-OH bebas
Fluorosensi biru muda Isoflavon yang mengandung 5-OH bebas Tak Nampak Fluorosensi biru muda Isoflavon tanpa 5-OH bebas
Kuning redup dan
kuning, atau fluorosensi jinga
Perubahan warna sedikit atau tanpa perubahan warna
Flavonol yang mengandung 3-OH bebas dan mempunyai atau tak mempunyai 5-OH bebas (kadang-kadang berasal dari dihidroflavon)
Fluorosensi kuning Merah atau jingga Auron yang mengandung 4’-OH bebas dan beberapa 2- atau 4-OH khalkon
Hijau-Kuning,
Hijau-biru, atau hijau
Perubahan warna sedikit atau tanpa perubahan warna
a. Auron yang tak mengandung 4’-OH bebas dan flavanon tanpa 5-OH bebas b.Flavonol yang mengandung 2-OH bebas
dan disertai atau tanpa 5-OH bebas Merah jingga redup
atau merah senduduk Biru
Antosianidin 3,5-diglikosid
Merah jambu atau fluorosensi kuning Biru
6. Kegunaan flavonoid
Flavonoid dalam tanaman bertindak sebagai tabir surya alami, melindungi
terhadap kerusakan sinar ultraviolet, karena berada pada permukaan atau sel
epidermis daun hijau (Bors et al., 2007). Cuvelier et al. (2005) menyatakan bahwa
ketika flavonoid bereaksi dengan radikal bebas, akan terbentuk radikal baru yang
distabilisasi oleh efek resonansi inti aromatik. Dengan demikian fase propagasi
yang meliputi reaksi berantai radikal dihambat. Aktivitas antioksidan yang
dimiliki oleh sebagian besar flavonoid disebabkan adanya gugus hidroksi fenolik
dalam struktur molekulnya. Selanjutnya, Hudson (dalam Achmad, 1990)
menyatakan bahwa aktivitas tersebut ditentukan oleh gugus –OH ganda (gugus
fenolik), terutama dengan gugus C=O pada posisi C-3 dengan gugus –OH pada
posisi C-2 atau pada posisi C-5. Sistem gugus fungsi demikian memungkinkan
terbentuknya kompleks dengan logam.
Flavonoid merupakan senyawa penangkap radikal superoksida yang kuat
dan dapat bereaksi dengan radikal peroksi menyebabkan terminasi reaksi berantai
pada autooksidasi lemak tak jenuh ganda. Selain itu dapat berfungsi sebagai
penangkap radikal –OH yang merupakan radikal bebas yang reaktif (Buhler and
Miranda, 2007).
C. Antioksidan 1. Radikal bebas
Radikal bebas merupakan atom atau molekul yang sifatnya sangat tidak
stabil (mempunyai satu elektron atau lebih yang tidak berpasangan), sehingga
jaringan. Radikal bebas yang terbentuk cenderung untuk mengadakan reaksi
berantai yang bila terjadi dalam tubuh dapat menimbulkan kerusakan-kerusakan
yang serius. Senyawa radikal tersebut timbul akibat berbagai proses kimia
kompleks dalam tubuh, berupa hasil sampingan dari proses oksidasi atau
pembakaran sel yang berlangsung pada waktu bernafas; metabolisme sel, 90%
ROS digunakan sel untuk transpor elektron oleh mitokondria; peradangan, terjadi
fagositosis oleh sel darah putih, karena mekanisme terbunuhnya virus dan bakteri
serta denaturasi protein asing (antigen); metabolisme xenobiotik (zat asing yang
berasal dari luar tubuh, seperti obat, toksikan); atau ketika tubuh terpapar polusi
lingkungan (Percival, 1998).
Tabel III. Beberapa macam ROS dan antioksidan yang menetralkan (Percival, 1998)
ROS Neutrazilizing Antioxidants
Radikal Hidroksil Vitamin C, gluthatione, flavonoid, liopic acid
Radikal Superoksid Vitamin C, gluthatione, flavonoid, SOD
Peroksida Hidrogen Vitamin C, gluthatione, flavonoid, beta karoten, vitamin E, lipoic acid
Peroksida Lipid Vitamin E, beta karoten, ubiquinone, flavonoid, gluthatione peroxidase
Radikal bebas dan oksidan mempunyai sifat yang mirip. Aktivitas kedua
senyawa ini sering menimbulkan akibat yang sama meskipun melalui proses yang
berbeda. Oksidan merupakan senyawa penerima elektron (elektron acceptor),
yaitu senyawa-senyawa yang dapat menarik elektron (Syahbana dan Bahalwan,
2. Definisi dan aktivitas antioksidan
Antioksidan merupakan senyawa yang dapat menghambat oksidasi yang
diperantarai oleh oksigen. Oksidasi memegang peranan penting dalam pertahanan
tubuh terhadap penyakit. Hal tersebut disebabkan senyawa antioksidan dapat
mencegah pengaruh buruk yang disebabkan oleh senyawa-senyawa radikal bebas.
(Percival, 1998).
Menurut Halliwel dan Auroma (1993) antioksidan memiliki aktivitas
dengan cara sebagai berikut.
(a).Menurunkan konsentrasi oksigen,
(b).mencegah inisisasi rantai pertama dengan menangkap radikal penyerang
yang pertama kali dalam reaksi seperti radikal hidroksil,
(c).mengikat ion logam dalam bentuk yang tidak akan menurunkan spesies
penginisiasi seperti radikal hidroksil dan tidak medekomposisi peroksida
lipid menjadi radikal peroksi atau alkoksi,
(d).mendekomposisi peroksida dengan mengubah menjadi produk non radikal
seperti alkohol, dan
(e).memecah rantai pada radikal intermediet seperti radikal peroksi dan
alkoksi yang ditangkap untuk mencegah abstraksi hidrogen selanjutnya.
3. Penggolongan antioksidan
Manusia mempunyai sistem antioksidan yang mampu melindungi tubuh
dari radikal bebas. Sistem antioksidan ini dibagi menjadi dua kelompok yaitu
kelompok enzimatik dan non-enzimatik. Antioksidan enzimatik terdiri dari
non-enzimatik terdiri dari vitamin E, A, provitamin A (beta karoten), dan vitamin
C. Antioksidan enzimatik secara alamiah dihasilkan oleh tubuh sedangkan
antioksidan non-enzimatik diperoleh dari luar tubuh (Fouad, 2005). Antioksidan
sintetik seperti BHA (butyl hydroxy anisol), PG (propil galat), TBHQ (tert-butyl
hydroquinone) dapat meningkatkan karsinogenisitas. Sebagai contoh BHA,
merupakan inhibitor lipid peroksidasi yang poten, tetapi ketika dikonsumsi
berlebihan menyebabkan kanker, karena terjadi kerusakan oksidatif pada DNA
sehingga memicu terjadinya mutasi. Hal ini menyebabkan penelitian eksplorasi
antioksidan yang berasal dari bahan alami seperti buah, sayuran dan tanaman
mengalami peningkatan (Amarowicz, Naczk, dan Fereiodon, 2000).
Sistem pertahanan internal tubuh terhadap radikal bebas adalah
antioksidan. Dari asal terbentuknya antioksidan dapat dibedakan menjadi dua
yaitu intraseluler dan ekstrasesuler. Dari sini antioksidan dapat dikelompokkan
menjadi tiga golongan sebagai berikut.
a. Antioksidan primer, yaitu antioksidan yang dapat menghalangi
pembentukan radikal bebas baru dan mengubah radikal bebas yang ada menjadi
molekul yang berkurang dampak negatifnya sebelum radikal bebas ini sempat
bereaksi. Contoh golongan ini adalah enzim SOD (Superoksid Dismutase),
Glutation Peroksidase, protein pengikat metal seperti ferritin dan ceruroplasmin.
b. Antioksidan sekunder atau penangkap radikal (radical scavenger)
adalah antioksidan yang menekan terjadinya reaksi rantai baik pada awal
antioksidan ekstraseluler yang kebanyakan berasal dari makanan seperti vitamin
E, vitamin C, β-karoten, asam urat, bilirubin, dan albumin.
c. Antioksidan tersier adalah antioksidan yang memperbaiki
kerusakan-kerusakan sel dan jaringan karena radikal bebas. Contoh: enzim yang
memperbaiki DNA pada inti sel yaitu metionin sulfoksidan reduktase yang
berguna untuk mencegah penyakit kanker (Niki et al.cit Ariyanto, 2006)
Menurut Percival (1998), proteksi antioksidan dapat berasal dari dalam
maupun luar tubuh dimana secara sinergis dan interaktif menetralkan radikal
bebas. Yang termasuk didalamnya antara lain:
a. nutrient-derived antioxidant biasa disebut dietary antioxidant, misalnya asam
askorbat (vitamin C), tokoferol (vitamin E) dan tokotrienol, karotenoid, dan
komponen lain yang membunyai bobot molekul rendah seperti glutation dan
lipoic acid (thiol dan biothiol). Vitamin C berfungsi dalam menetralkan ROS
dalam fase air sebelum reaksi peroksidasi awal. Vitamin E berfungsi dalam
memutus reaksi berantai karena melindungi membran asam lemak dari
peroksidasi lipid. β-karoten dan karotenoid lain berfungsi untuk memberikan
proteksi antioksidan pada jaringan yang kaya lipid;
b. antioxidant enzymes, seperti superoksid dismutase, gluthation peroksidase,
gluthation reductase, lipoic acid (thiol dan biothiol) yang mengkatalis reaksi
pemadaman (quenching) radikal bebas. Merupakan pertahanan endogen yang
membantu melindungi kerusakan sel dari radikal bebas. Aktivitas katalitiknya
akan meningkat jika ada mikronutrient seperti selenium, besi, tembaga, zinc
c. metal binding protein, seperti ferritin, laktoferin, albumin, ceruroplasmin yang
mengikat besi, tembaga dan logam pro-oksidan, yang berfungsi mengkatalisis
reaksi oksidasi;
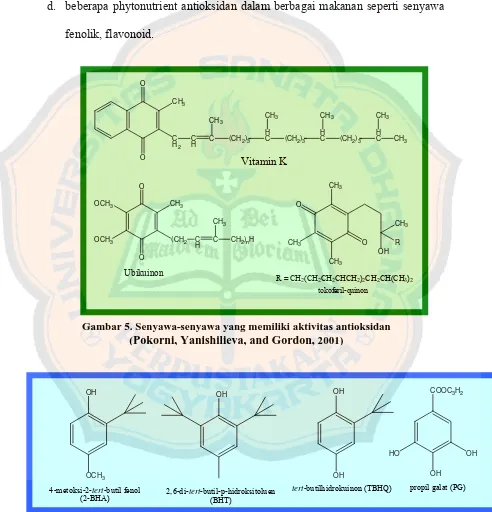
d. beberapa phytonutrient antioksidan dalam berbagai makanan seperti senyawa
fenolik, flavonoid.
Gambar 6. Stuktur kimia beberapa antioksidan sintetik Gambar 5. Senyawa-senyawa yang memiliki aktivitas antioksidan
C
(Pokorni, Yanishilieva, and Gordon,2001)
OH
4-metoksi-2-tert-butil fenol
(2-BHA) 2,6-di-tert-butil-p-hidroksitoluen(BHT)
4. Metode pengujian daya antioksidan
Terdapat beberapa metode pengujian aktivitas antioksidan baik secara
kualitatif maupun secara kuantitatif. Uji kualitatif untuk mengetahui apakah suatu
senyawa memiliki aktivitas antioksidan dapat dilakukan dengan metode
kromatografi baik kromatografi lapis tipis atau kromatografi kertas. Metode ini
dapat untuk memisahkan campuran antioksidan yang kompleks sekalipun.
Pereaksi semprot yang digunakan untuk deteksi dapat dibedakan menjadi empat
kelompok, yaitu :
(a).senyawa-senyawa yang dapat membentuk warna ketika tereduksi (kalium
permanganat, ferri-sianida, ferri-dipiridil, dan asam fosfomolibdat);
(b).senyawa yang dapat berikatan dengan senyawa fenol, seperti senyawa
diazo, pereaksi diazo, magnesium sulfat, aldehid aromatik-anisaldehid,
vanillin dan pereaksi Gibbs yang membentuk indofenol (akan membentuk
garam berwarna dalam kondisi basa);
(c).radikal bebas stabil yang menerima radikal hidrogen dari antioksidan
(1,1-difenil-2-pikrilhidrazil);
(d).senyawa-senyawa yang membentuk senyawa adisi yang berwarna
(palladium klorida dan pentadium klorida) (Davidek, 1997).
Uji aktivitas antioksidan dapat dilakukan secara spektrofotometri.
Beberapa uji kuantitatif untuk mengetahui aktivitas suatu antioksidan antara lain:
(1). pengujian panangkapan radikal (radical scavenging test),
dilakukan dengan cara mengukur penangkapan radikal sintetik dalam
sintetik yang sering digunakan adalah DPPH (2,2’- difenil-1-pikril
hidrazil) dan ABTS (2,2’-azinobis (3-etil benzotiazolin-asam sulfonat)).
Dasarnya adalah kemampuan suatu senyawa untuk menangkap radikal
DPPH. DPPH memberikan warna violet pada panjang gelombang 517 nm.
Penangkapan radikal bebas menyebabkan elektron menjadi berpasangan
yang kemudian menyebabkan penghilangan warna yang sebanding dengan
jumlah elektron yang diambil. Reaksi yang terjadi
DPPH• + AH Æ DPPH-H + A•
DPPH• + R Æ DPPH-R
(1).pengujian amtivitas antioksidan dengan system linoleat tiosianat,
dasar : pengukuran intensitas warna kompleks feritiosianat yang terbentuk
dari reaksi ion feri dengan amonium tiosianat. Ion feri terbentuk dari
oksidasi ion fero oleh peroksida ysng berasal dari oksidasi asam linoleat.
Kompleks feritiosianat yang berwarna merah diukur absorbansinya pada
panjang gelombang 490 nm. Semakin tinggi absorbansinya (warna merah
yang terbentuk semakin pekat) menunjukkan semakin banyak peroksida
yang teerbentuk. Dengan adanya senyawa yang berperan sebagai
antioksidan intensitas warna ynag terbentuk semakin rendah.
(2).pengujian dengan asam thiobarbiturat,
dasar uji ini adalah reaksi malondialdehid dengan asam thiobarbiturat
menghasilkan kromogen merah muda yang dapat diukur absorbansinya
pada panjang gelombang 532 nm. Malondialdehid terbentuk dari asam
rangkap. Adanya senyawa yang bersifat antioksidan akan menghambat
terbentuknya malondialdehid dari asam lemak bebas tidak jenuh.
(3).pengujian dengan sistem β-karoten-linoleat
pengujian ini dilakukan dengan mengamati kecepatan pemucatan warna β
-karoten. Karotenoid dapat meredam oksigen yang reaktif menghasilkan
oksigen yang lebih stabil. Energi dari oksigen tersebut dipindahkan ke
senyawa karotenoid. Energi tersebut dilepaskan melalui interaksi
rotasional dan vibrasional antara karotenoid dengan pelarut untuk
mengembalikan karotenoid ke ground state. Reaksi yang terjadi:
O2 reaktif + karotenoid Æ O2 stabil + karotenoid*
karotenoid* Æ karotenoid + energi termal
D. Deoksiribosa
Deoksiribosa (2-deoksi-D-ribosa) merupakan gula yang mempunyai lima
atom karbon yang merupakan turunan dari suatu gula pentosa, yaitu ribose. Gula
ini merupakan bagian dari DNA.
Gambar 7. Struktur deoksiribosa
HO
O
H H
H OH
H
OH
H
Beberapa produk degradasi deoksiribosa, saat dipanaskan pada pH rendah
terdekomposisi menjadi malondialdehid (MDA), yang dapat terdeteksi dengan
yang berwarna merah muda. Pembentukan MDA dari deoksiribosa menjadi dasar
uji penangkapan radikal hidroksil (Halliwel dan Gutteridge, 1999).
Proses degradasi deoksiribosa oleh radikal hidroksil terjadi melalui
beberapa tahap. Tahap-tahap ini terjadi pada saat campuran reaksi yang terdiri
dari pereaksi Fenton (FeCl3, EDTA, H2O2, vitamin C) dan deoksiribosa
diinkubasi pada suhu 37oC selama 30 menit. Tahap-tahap reaksi tersebut adalah reaksi pembentukan radikal hidroksil dari reaksi fenton dan degradasi
deoksiribosa oleh radikal hidroksil (Halliwel dan Gutteridge, 1999).
Tahap I. Reaksi pembentukan radikal hidroksil. Radikal hidroksil
dihasilkan melalui reaksi Fenton. Dalam reaksi Fenton, vitamin C berfungsi
sebagai reduktor yang mempercepat proses reduksi Fe3+ menjadi Fe2+. Fe2+ akan bereaksi dengan H2O2 dan menghasilkan radikal hidroksil. Penambahan suatu
ligan (EDTA) pada besi dapat meningkatkan konstante kecepatan reaksi antara
Fe2+ dengan H2O2.
Tahap II. Degradasi Deoksiribosa. Radikal hidroksil akan menyerang
deoksiribosa dan mendegradasinya menjadi fragmen-fragmen. Semua posisi pada
struktur gula deoksiribosa memungkinkan untuk diserang oleh radikal hidroksil
membentuk radilkal deoksiribosa melalui reaksi abstraksi hidrogen yang dengan
adanya O2 akan diubah secara cepat menjadi radikal gula peroksil. Selanjutnya terjadi serangkaian reaksi yaitu disproporsionasi, penataan ulang, eliminasi air,
dan pemecahan ikatan C-C menghasilkan produk karbonil yang bervariasi.
Konstante kecepatan reaksi orde dua dari reaksi antara radikal hidroksil dengan
degradasi deoksiribosa, saat dipanaskan pada pH rendah akan terdekomposisi
menjadi MDA (Halliwell dan Gutteridge, 1999). Adanya MDA dapat dideteksi
dengan mereaksikan campuran tersebut dengan TBA dalam suasana asam.
Molekul MDA dengan TBA membentuk kromogen berwarna merah muda yamg
absorbansinya dapat diukur pada panjang gelombang 532 nm. Reaksi kopling ini
terjadi antara dua molekul MDA dan satu molekul TBA (Halliwell, Gutteridge,
and Auroma, 1987).
E. Metode Penyarian
Penyarian merupakan peristiwa pemindahan massa zat aktif yang semula
berada dalam sel ditarik oleh cairan penyari sehingga terjadi larutan zat aktif
dalam cairan penyari tersebut. Pada umumnya penyarian akan bertambah baik bila
permukaan serbuk simplisia yang bersentuhan dengan cairan penyari makin luas.
Dengan demikian, makin halus serbuk simplisia, seharusnya makin baik
penyariannya. Menurut Anonim (1995) serbuk harus dapat melewati ayakan 20.
Tetapi dalam pelaksanaannya tidak selalu demikian karena penyarian masih
tergantung juga pada sifat fisik dan kimia simplisia yang bersangkutan. Cara
penyarian dapat dibedakan menjadi: infundasi, maserasi, perkolasi, dan penyarian
berkesinambungan (Anonim, 1986).
1. Infundasi
Merupakan proses penyarian yang umumnya digunakan untuk menyari zat
kandungan aktif yang larut dalam air dari bahan-bahan nabati. Sari yang
dihasilkan tidak stabil dan mudah tercemari oleh kapang dan kuman. Oleh karena
Infundasi dibuat dengan cara menyari simplisia dengan air pada suhu 90oC selama 15 menit (Anonim, 1986).
2. Maserasi
Cara maserasi merupakan cara penyarian yang sederhana. Maserasi
dilakukan dengnan cara merendam serbuk simplisia dalam cairan penyari
sehingga cairan penyari akan menembus dinding sel dan masuk ke dalam rongga
sel yang mengandung zat aktif di dalam sel dengan yang di luar sel
mengakibatkan pendesakan larutan terpekat dari dalam sel ke luar sel. Peristiwa
tersebut berulang sehingga terjadi keseimbangan konsentrasi antara larutan di luar
sel dan di dalam sel. Dapat dilakukan modifikasi terhadap teknik maserasi,
misalnya teknik remaserasi. Pada teknik ini, cairan dibagi menjadi dua kemudian
seluruh serbuk simplisia dimaserasi dengan cairan penyari pertama, sesudah
dienaptuangkan dan diperas, ampas dimaserasi lagi dengan cairan penyari kedua
(Anonim, 1986).
3. Perkolasi
Merupakan cara penyarian yang dilakukan dengan mengalirkan cairan
penyari melalui serbuk simplisia yang telah dibasahi. Cairan penyari akan
mengalir dari atas ke bawah melalui serbuk kemudian cairan akan melarutkan zat
aktif di dalam sel yang dilalui sampai mencapai keadaan jenuh. Serbuk simplisia
yang akan diperkolasi dibasahi terlebih dahulu dengan cairan penyari kemudian
dimasukkan sedikit demi sedikit ke dalam alat perkolasi (perkolator) sambil tiap
kali ditekan. Serbuk kemudian ditutup dengan kertas saring dan cairan penyari
Setelah 24 jam, keran dibuka dan diatur hingga kecepatan tetesannya adalah 1 ml
permenit. Akhir proses perkolasi ditentukan dengan pemeriksaan zat secara
kualitatif pada perkolat terakhir (Anonim, 1986).
4. Penyarian berkesinambungan
Proses ini merupakan gabungan antara proses untuk menghasilkan ekstrak
cair dan proses penguapan. Alat yang digunakan misalnya soxhlet. Pada penyarian
ini, cairan penyari dipanaskan hingga mendidih, kemudian uap penyari akan naik
ke atas kemudian akan menggembun karena didinginkan oleh pendingin balik.
Embun akan turun melalui serbuk simplisia sambil melarutkan zat aktif serbuk
simplisia (Anonim, 1986).
Cairan pelarut yang baik adalah pelarut yang dapat melarutkan zat aktif
dari ekstrak dengan demikian ekstrak bebas dari senyawa lain yang tidak
diinginkan. Faktor pertimbangan dalam pemilihan penyari adalah selektivitas,
kemudahan bekerja dan proses dengan cairan tersebut, ekonomis, ramah
lingkungan dan aman (Anonim, 2000). Menurut Anonim (1986) kriteria cairan
penyari yang baik adalah murah dan mudah didapat, stabil secara fisika dan kimia,
netral, tidak mudah menguap atau terbakar, selektif, tidak mempengaruhi zat
berkhasiat, dan diperbolehkan oleh peraturan.
Pelarut yang diperbolekan sesuai peraturan yang berlaku adalah air, etanol
dan campuran etanol air, metanol (dan yang segolongan), kloroform, eter, heksan,
aseton (Anonim, 2000). Etanol dapat melarutkan alkaloid basa, minyak menguap,
malam, tanin, dan saponin hanya sedikit larut dalam etanol. Campuran etanol dan
air dapat digunakan untuk meningkatkan penyarian (Anonim, 1986).
Separasi dan pemurnian bertujuan untuk menghilangkan senyawa yang
tidak dikehendaki seoptimal mungkin tanpa mempengaruhi kandungan senyawa
yang diinginkan, sehingga diperoleh ekstrak yang murni. Proses dari tahap ini
adalah pengendapan, pemisahan dua cairan yang tidak saling campur (ekstraksi),
sentrifugasi, dekantasi dan filtrasi (Anonim, 2000).
Ekstraksi adalah suatu metode pemisahan komponen dari suatu campuran
dengan menggunakan suatu pelarut. Dalam praktek digunakan untuk memisahkan
senyawa organik dari larutan air atau suspensi. Metode ini paling sering
digunakan untuk proses pemisahan. Alat yang digunakan tidak khusus dan rumit.
Jika tidak dinyatakan lain alat yang digunakan untuk pemisahan adalah corong
pisah (Khopkar, 1990).
F. Kromatografi Lapis Tipis (KLT)
Kromatografi merupakan suatu metode yang sering digunakan untuk
memisahkan dan mendeteksi suatu campuran senyawa berdasarkan proses
fisika-kimia. Salah satu sistem kromatografi yang digunakan adalah kromatografi lapis
tipis yang merupakan pemisahan pada lapisan tipis dengan suatu penyangga.
Lapisan yang memisahkan terdiri atas partikel-partikel- sebagai fase diam yang
ditempatkan pada penyangga yang berupa lempeng gelas, logam, pelat polimer
bahan pengikat, biasanya kalsium sulfat atau amilum. Lapisan ini berfungsi
sebagai permukaan padat yang menyerap (Grittter, Bobbit, and Schwarting, 1991).
Kromatografi lapis tipis adalah metode kromatografi cair yang paling
sederhana dan mempunyai beberapa kelebihan. Kelebihan KLT adalah sampel
yang digunakan sedikit, diperoleh pemisahan senyawa yang amat berbeda (seperti
senyawa organik alam, senyawa organik sintetik, komplek anorganik-organik dan
bahkan ion anorganik), waktu yang dibutuhkan singkat, serta jumlah pelarut yang
digunakan sangat sedikit. KLT dapat digunakan untuk dua tujuan. Pertama, untuk
hasil kuantitatif, kualitatif dan preparatif. Kedua, digunakan untuk menjajaki
sistem pelarut dan sistem penyangga yang akan dipakai dalam kromatografi
kolom atau kromatografi cair kinerja tinggi (KCKT) (Grittter et al., 1991).
Dalam KLT, pemisahan senyawa berdasarkan perbedaan adsorpsi atau
partisi solut antara fase diam dengan fase gerak yang terjadi secara kompetitif.
Kemampuan fase diam mengadsorpsi sangat bergantung pada topografi gugus
aktif yang terdapat pada masing-masing komponen. Senyawa yang terikat kuat
pada fase diam akan dielusi paling lama dan mempunyai nilai Rf (Retention
factor) yang kecil, sedangkan senyawa yang tidak terikat kuat pada fase diam
akan terelusi lebih dahulu dan mempunyai nilai Rf yang besar. Bercak yang
mempunyai nilai Rf sama kemungkinan merupakan senyawa yang sama. Bilangan
Rf didefinisikan sebagai jarak yang ditempuh oleh senyawa dibagi dengan jarak
yang ditempuh oleh garis depan fase pengembang (Markham, 1988).
Hasil elusi sampel oleh fase gerak menghasilkan bercak yang dapat
yang dihasilkan pada lempeng fase diam masih sulit untuk dideteksi. Masalah
tersebut dapat diatasi dengan menambahkan pereaksi yang mampu memperjelas
bercak, sehingga memudahkan dalam pendeteksian. Senyawa-senyawa yang
sering digunakan untuk pereaksi pendeteksi dalam KLT antara lain amonia,
AlCl3, FeCl3, sitroborat, dan berbagai pereaksi lain yang cukup banyak
macamnya (Mabry et al., 1970).
KLT Densitometri
Merupakan metode penetapan kadar suatu senyawa dengan mengukur
kerapatan bercak senyawa yang bersangkutan, yang terlebih dahulu dipisahkan
dengan cara KLT.
Untuk menetapkan kadar suatu senyawa dengan KLT densitometri, ada
dua cara. Pertama, penotolan dilakukan bersamaan antara senyawa baku dan
senyawa yang bersangkutan, kemudian dielusi. Kadar senyawa bersangkutan
ditentukan dengan membandingkan harga AUC (Area Under Curve) senyawa
dengan baku. Cara kedua yaitu dengan membuat kurva baku hubungan antara
jumlah zat baku dengan AUC (Wardani, 2003). Kurva baku diperoleh dengan
membuat totolan zat baku pada lempeng KLT dengan bermacam-macam
konsentrasi. Bercak yang diperoleh dicari nilai AUCnya, dari kurva baku
diperoleh persamaan Y= bX + a. Dimana Y adalah AUC dan X adalah banyaknya
zat yang ditotolkan (Supardjan, 1987).
Alat TLC scanner memiliki sumber sinar yang dapat digerakkan di atas
bercak-bercak pada lempeng KLT atau lempeng KLT dapat digerakkan menyusuri
didasarkan atas sinar yang diserap (absorbansi), sinar yang dipantulkan
(reflaktansi), atau sinar yang difluoresensikan. Sinar yang datang sebagian besar
diserap atau dipantulkan. Banyaknya sinar yang diserap sebanding dengan jumlah
zat pada bercak yang terkena sinar (Wardani, 2003).
G. Spektrofotometri UV-Vis
Spektrofotometri visibel adalah salah satu teknik analisis fisika-kimia yang
mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik
pada panjang gelombang 380-780 nm. Spektrofotometri UV-Vis lebih banyak
digunakan untuk analisis kuantitatif daripada kualitatif karena melibatkan energi
elektronik yang cukup besar pada molekul yang dianalisis (Mulja dan Suharman,
1995).
Bila cahaya jatuh pada suatu senyawa, maka sebagian dari cahaya tersebut
akan diserap oleh molekul-molekul sesuai dengan struktur dari molekul. Setiap
senyawa memiliki tingkat energi yang spesifik. Bila cahaya yang mengenai
senyawa memiliki energi yang sama dengan perbedaan energi antara keadaan
tingkat dasar dan energi keadaan tereksitasi, maka elektron-elektron pada keadaan
dasar akan dieksitasi ke tingkat energi eksitasi dan sebagian energi cahaya yang
sesuai dengan panjang gelombang ini diserap. Frekuensi yang diserap setiap
senyawa sangat spesifik karena perbedaan energi antara tingkat dasar dan tingkat
eksitasi setiap senyawa juga spesifik (Sastrohamidjojo, 2001).
Interaksi antara senyawa yang mempunyai gugus kromofor dengan radiasi
elektromagnetik pada daerah UV-Vis (200-800 nm) akan menghasilkan transisi
elektromagnetik yang diserap akan sebanding dengan jumlah molekul
penyerapnya, sehingga spectra absorbansi dapat digunakan untuk analisis
kuantitatif. Panjang gelombang cahaya UV-Vis lebih pendek daripada panjang
gelombang radiasi inframerah. Spectrum visibel atau tampak mempunyai
absorbansi antara 400-800 nm, sedangkan spectrum UV mempunyai absorbansi
antara 100-400 nm. Kuantitas energi yang diserap oleh suatu senyawa berbanding
terbalik dengan panjang gelombang radiasi (Fessenden dan Fessenden, 1995).
Bila suatu molekul senyawa organik menyerap sinar UV atau tampak,
maka di dalam molekul tersebut terjadi perpindahan (transisi elektron) dari
berbagai jenis tingkat energi orbital dari molekul tersebut (Sastrohamidjojo,
2001). Absorbsi cahaya oleh suatu molekul merupakan suatu bentuk interaksi
antara gelombang cahaya (foton) dan atom/molekul. Proses absorbsi cahaya
UV-Vis berkaitan dengan promosi elektron dari satu orbital molekul dengan tingkat
energi elektronik tertentu ke orbital lain dengan tingkat energi elektronik yang
lebih tinggi.
Secara umum, ada tiga macam distribusi elektron dalam suatu senyawa
organik yaitu orbital pi (π), sigma (σ) dan elektron tidak berpasangan (n). Apabila
radiasi elektromagnetik mengenai molekul, maka akan terjadi eksitasi elektron ke
tingkat energi yang lebih tinggi yang dikenal sebagai orbital elektron antibonding
σ* ( a n t i- bon din g)
π* ( a n t i- bon din g)
n ( n on - bon din g)
σ ( bon din g) π ( bon din g)
e n e r gi
Gambar 8. Tingkat energi elektronik
Macam-macam transisi elektron yang terjadi adalah sebagai berikut.
a. Transisi σ → σ*. Transisi jenis ini terjadi pada orbital ikatan sigma. Energi yang dibutuhkan untuk transisi ini sangat besar, sesuai dengan sinar yang
mempunyai frekuensi pada daerah ultraviolet vakum (<180 nm).
b. Transisi n → σ*. Jenis transisi ini terjadi pada senyawa organik jenuh yang mengandung atom-atom yang memiliki elektron bukan ikatan (ikatan n).
energi yang diperlukan untuk transisi ini lebih kecil dari transisi σ→σ*, sehingga sinar yang diserap memiliki panjang gelombang lebih besar dari 200 nm.
Pengaruh pelarut pada transisi jenis ini adalah pergesaran puncak absorbansi pada
panjang gelombang yang lebih pendek dalam pelarut yang lebih polar. Pergesaran
ini disebut pergesaran biru atau hipsochromic shift.
c. Transisi n → π* dan π → π*. Untuk memungkinkan terjadinya jenis transisi ini, maka molekul organik harus mempunyai gugus fungsional yang tidak
jenuh sehingga ikatan rangkap dalam gugus tersebut memberikan orbital ikatan π
analisis karena memiliki absorbansi pada 200-700 nm dan panjang gelombang ini
secara teknis dapat diaplikasikan pada spektofotometer(Sastrohamidjojo, 2001).
Secara sederhana, komponen-komponen spektrofotometer berkas ganda
dapat dijelaskan sebagai berikut.
a. Sumber radiasi
Sumber radiasi yang ideal untuk pengukuran serapan harus menghasilkan
spektrum kontinyu dengan intensitas yang seragam pada keseluruhan kisaran
panjang gelombang. Sumber radiasi cahaya tampak biasanya menggunakan lampu
filament tungsten yang menghasilkan suatu sumber yang berpijar yang
memancarkan radiasi terlihat pada daerah cahaya tampak pada panjang
gelombang 400-700 nm. Sumber radiasi ultraviolet banyak menggunakan lampu
hidrogen dan lampu deuterium, kedua lampu ini menghasilkan radiasi kontinu
pada daerah panjang gelombang 180-350 nm (Sastrohamidjojo, 2001).
b. Monokromator
Ada dua alat untuk mengubah radiasi yang polikromatik menjadi
monokromatik yaitu penyaring dan monokromator. Penyaring dibuat dari benda
khusus yang hanya meneruskan radiasi pada daerah panjang gelombang tertentu
dan menyerap radiasi dari panjang gelombang yang lain. Monokromator
merupakan serangkaian alat optik yang menguraikan radiasi polikromatik menjadi
panjang gelombang tunggalnya dan memisahkan panjang gelombang tersebut
c. Tempat cuplikan
Tempat cuplikan biasa disebut sel atau kuvet. Untuk daerah ultraviolet
biasanya menggunakan Quartz atau kuvet dari silica yang dilebur
(Sastrohamidjojo, 2001), sedangkan untuk daerah cahaya tampak biasanya
menggunkan Quartz atau gelas silikat (Skoog, Holler, and Nieman, 1998).
d. Detektor
Fungsi detektor adalah untuk mengubah sinyal radiasi yang diterima
menjadi sinyal elektronik. Persyaratan-persyaratan penting untuk detektor adalah
sensitivitas tinggi, waktu respon pendek, stabilitas panjang dan sinyal elektronik
yang mudah diperjelas. Detektor yang digunakan dalam ultraviolet disebut
detektor fotolistrik (Sastrohamidjojo, 2001).
Analisis spektrofotometer UV-Vis melibatkan pembacaan absorban radiasi
elektromagnetik oleh molekul atau radiasi elektromagnetik yang diteruskan.
Keduanya dikenal sebagai absorban (A) tanpa satuan dan transmitan dengan
satuan persen. Hubungan antara intensitas radiasi elektromagnetik yang diserap
oleh sistem (I0) dengan intensitas radiasi yang ditransmisikan (It) dapat dijelaskan dengan hukum Lambert-Beer, sebagai berikut :
Dengan T = persen transmitan; I0 = intensitas radiasi yang datang; It = intensitas
radiasi yang diteruskan; ε = daya serap molar (L.mol-1.cm-1); c = konsentrasi (mol/L); b = panjang sel (cm); A = serapan.
c b
Io
It
T
=
=
10
−ε. .Jika konsentrasi (c) dalam mol/L dan panjang sel dalam cm, persamaannya
menjadi
A = ε.b.c
Jika konsentrasi (c) dalam g/L, persamaannya menjdi
A = a.b.c
Jika a adalah daya serap, hubungan dengan daya serap molar ditunjukkan
dengan persamaan
ε = a.M
Dimana M adalah bobot molekul.
(Silverstein, 1991)
Daya serap (L/g/cm) adalah absorbansi dari 1 g/L larutan dalam sel dengan
panjang 1 cm. Serapan jenis (A 1%, 1 cm) adalah serapan dari larutan 1 % zat
terlarut dalam sel dengan ketebalan 1 cm. Harga serapan jenis pada panjang
gelombang tertentu dalam suatu pelarut merupakan sifat dari zat terlarut (Anonim,
1995). Hubungannya dengan daya serap ditunjukkan dengan persamaan
wt mol cm
A
a= = ε
10 ) 1 %, 1 (
(Clarke, 1986)
Kromofor merupakan group kovalen yang tidak jenuh (unsaturated) yang
bertanggung jawab atas serapan elektron, contoh: C=C, C=O, NO2. auksokrom adalah saturated group yang mempunyai elektron bebas, ketika tertarik oleh
kromofor, panjang gelombang dan intensitas serapan dapat berubah, contoh: -OH,