commit to user
PENGARUH PEMBERIAN VITAMIN C TERHADAP DIAMETER ARTERIOL PADA TIKUS WISTAR
MODEL SEPSIS Radin Intan
Radin Intan Edilla Sini, S. 501002003, 2015. Pengaruh Pemberian Vitamin C Terhadap Diameter Arteriol Pada Tikus Wistar Model Sepsis. TESIS. Pembimbing I : Dr. Hari Wujoso, dr. Sp.F. MM. Pembimbing II : M.H Sudjito, dr. Sp.An. KNA. Anestesiologi dan Terapi Intensif Fakultas Kedokteran, Program Pascasarjana Universitas Sebelas Maret Surakarta
ABSTRAK
Latar belakang : Sepsis dan syok septik telah lama dikenal sebagai masalah kesehatan serius di dunia, karena angka mortalitas dan morbiditasnnya yang masih sangat tinggi. Produksi berlebihan mediator pro-oksidan pada sepsis menguasai sinyal anti-oksidan. Ketidak seimbangan antara mediator pro oksidan dan antioksidan akan menyebabkan perubahan pada mikrosirkulasi, sehingga mikrosirkulasi tidak dapat menjalankan fungsinya sebagai pengatur distribusi oxygen carrying blood cell pada berbagai organ, sehingga terjadi kerusakan dan kematian sel Tujuan : Menganalisis pengaruh pemberian vitamin C 5,1mg/kgBB/hari/ i.v (setara dengan 50 mg/kgBB/hari/ i.v pada manusia dengan berat badan 60kg) pada tahap awal sepsis terhadap diameter arteriol pada tikus wistar dengan model sepsis polimikrobial.
Metode : Penelitian ini termasuk eksperimental laboratorik. Sejumlah 27 ekor tikus wistar di adaptasikan selama 7 hari sebelum dibagi dalam tiga kelompok yang masing-masing kelompok terdiri dari 9 ekor tikus yang ditentukan secara acak. Untuk kelompok satu (K1) yang merupakan kelompok kontrol, tidak dikukan induksi cecal inoculum maupun pemberian vitamin c.. Untuk kelompok dua (K2) diberikan injeksi cecal inoculum 40mg/kali/hari selama 3 hari berturut turut. Untuk kelompok perlakukan tiga (K3) perlakuan sama dengan kelompok dua ditambah dengan vitamin C 5,1 mg/kg/kali/hari secara intravena selama 3 hari berturut-turut. Setelah 72 jam tikus wistar akan di euthanasia dengan cara dekapitasi. Duodenum tikus kemudian diambil untuk dilakukan pemeriksaan histopatologi yang akan mengukur diameter arteriol rata-rata pada tiap sampel. Dikarenakan ada kelompok tidak lulus uji normalitas maka pengujian statistik di uji alternatif dengan Kruskal-Wallis test dan dilanjutkan dengan Mann Whitney Test. Dianggap bermakna secara statistik apabila nilai p < 0,05.
Hasil : Nilai uji beda antara kelompok 1 dan kelompok 2 mendapatkan nilai p=0,001 p<0,05, jadi ada perbedaan yang signifikan diameter arteriol antara kelompok 1 (tanpa perlakuan) dengan dengan kelompok 2 (diberi cecal inoculum) dimana rata-rata diameter arteriol tikus kelompok 1 (tanpa perlakuan) 30,8% lebih lebar dibandingkan dengan tikus kelompok 2 (diberi cecal inoculum). Demikian juga antara kelompok 1 (tanpa perlakuan) dan kelompok 3 (diberi cecal inoculum dan Vitamin C) mendapatkan hasil nilai p=0,001 p<0,05. Jadi ada perbedaan yang signifikan diameter arteriol antara kelompok 1 dan kelompok 3. Dimana kelompok 3 menghasilkan diameter arteriol 118,2% lebih lebar daripada kelompok 1. Uji beda antara kelompok 2 (diberi cecal inoculum) dan kelompok 3 (diberi cecal inoculum dan Vitamin C) mendapatkan hasil nilai p=0,000 p<0,05. Jadi ada perbedaan yang signifikan diameter arteriol antara kelompok 2 dan kelompok 3. Dimana kelompok 3 menghasilkan diameter arteriol 185,3% lebih lebar daripada kelompok 2.
Kesimpulan : Pemberian vitamin C pada tikus sepsis mampu meningkatkan diameter arteriol dibandingkan dengan tikus sehat (normal) dan tikus sepsis.
Kata kunci : Vitamin c, sepsis, mikrosirkulasi, diameter arteriol
Latar Belakang Masalah
Sepsis dan syok septik telah l lama dikenal sebagai masalah kesehatan serius di
commit to user Eropa ± 150.000 pasien mengalami sepsis,
sepsis berat (disertai disfungsi multi organ) dan syok septik per tahun, dimana 65.000 diantaranya meninggal (Engel, et al, 2007). Setidaknya > 50% dari kematian tersebut disebabkan syok septik dan gagal organ.
Telah disepakati bahwa bukanlah infeksi bakteri yang merupakan faktor penentu utama hasil pada sepsis, melainkan respon inflamasi terhadap infeksi tersebut (Cohen, 2002).
Mikrosirkulasi selama ini tidak mendapatkan perhatian yang baik pada pengobatan klinis, namun saat ini mikrosirkulasi mulai diketahui sebagai hal penting yang menyebabkan beberapa proses patofisiologi. Fungsi mikrosirkulasi yang normal akan berperan dalam oksigenasi dan fungsi suatu jaringan, namun hal ini masih kurang dipahami karena banyak sekali perbedaan struktur yang meyebabkan perbedaan fungsi pada tiap organ. Fungsi utama dari mikrosirkulasi adalah sebagai pengatur distribusi oxygen carrying blood cell pada berbagai organ. Faktor utama yang mempengaruhi oxygen delivery diantaranya adalah; regulasi aliran darah, tekanan oksigen jaringan, dan mitokondria, yang sampai dengan saat ini masih belum dipahami sepenuhnya, dan mikrosirkulasi adalah kunci untuk memahami hal tersebut.
Telah jelas bahwa variabel hemodinamik sistemik tidak menggambarkan kegagalan sirkulasi pada critical illness yang tidak responsif terhadap terapi. Kegagalan ini lebih disebabkan karena disfungsi dari mikrosirkulasi. Evaluasi dari mikrosirkulasi telah membuka ruang baru dalam monitoring fungsi hemodinamik. Identifikasi kegagalan mikrosirkulasi merupakan indikator yang paling sensitif dari kegagalan sirkulasi yang berakibat pada outcome yang buruk, dan ini merupakan target teraputik yang baru. Penelitian klinis telah dapat mengidentifikasi berbagai teraputik konvensional dan
pendekatan baru yang mampu memodifikasi mikrosirkulasi.
Vitamin C merupakan golongan antioksidan larut dalam air yang dapat meredam dampak negatif oksidan, termasuk enzim-enzim dan protein-protein pengikat logam. Fungsi antioksidan adalah mencegah terbentuknya radikal hidroksil, memutus rantai reaksi oksidan, mereduksi oksidan menjadi zat lain yang kurang reaktif misalnya H2O dan O2, menghambat peroksidase lipid dan scavenger langsung dari ROS.
Saat ini didapatkan bukti dimana pada keadaan sepsis juga didapatkan stress oksidatif yang berat. Oksigen radikal bebas dan ROS lainnya sepertinya berhubungan dengan messengers pada tranduksi signal dan aktivasi gen. Dan hal ini akan memberikan dampak terhadap ekspresi maupun kontrol respon immune-inflammantory selama periode sepsis. Studi molekuler pada saat ini berbasis terhadap pengenalan monosit terhadap LPS serta regulasi dari gen inflamasi, hal ini dapat membuat pendekatan baru dalam strategi teraputik.(Victor et al, 2005). Intervensi teraputik dengan menggunakan vitamin c sebagai antioksidan diharapkan dapat mengembalikan transduksi signal dan mengembalikan produksi mediator-mediator ke nilai normal. Strategi mencegah kerusakan endotel dapat dilakukan dengan cara mencegah pelepasan ROS dan mengembalikan trasduksi signal, sehingga fungsi endotel dapat dikembalikan ke fungsi normalnya. Strategi ini pada akhirnya diharapkan dapat memperbaiki fungsi dari mikrosirkulasi dan mengurangi kejadian MOD/MOFS serta angka kematian.
commit to user keadaan sepsis polimikrobial dapat
memperbaiki dan mengembalikan diameter arteriol seperti dalam keadaan normal.
Bahan dan Cara Kerja Penelitian
Bahan untuk perlakuan
Hewan coba adalah tikus wistar yang diperoleh dari Laboratorium Hewan Coba, Universitas Sebelas Maret, Surakarta. Selama proses percobaan, hewan coba ditempatkan pada kandang dan diberi makan dan minum secukupnya
1. Bahan dan alat
a. Phosphat buffer formalin 10%
b. Alkohol 70%, 80%, 90%, absolute
c. Xylol, parafin cair, albumin, Poly-L-Lysine, canada balsam, dan entelan d. Alat untuk pengamatan dan dokumentasi
sediaan
1 unit Multi Head Microscope Fluoresens
Monitor optilab
Canon Digital Camera Ixus 130 + SD card
1 unit notebook Asus, A43S
2. Cara Kerja Penelitian
a. Perlakuan
Sejumlah 27 ekor tikus wistar di adaptasikan selama 7 hari sebelum dibagi dalam tiga kelompok yang masing-asing terdiri dari 9 ekor tikus yang ditentukan secara acak. Untuk kelompok satu (K1) yang merupakan kelompok kontrol, tidak dikukan induksi cecal inoculum maupun pemerian vitamin c.. Untuk kelompok dua (K2 diberikan injeksi cecal inoculum 40mg/kali/hari selama 3 hari berturut turut. Untuk kelompok perlakukan tiga (K3) perlakuan sama dengan kelompok dua ditambah dengan vitamin C 5,1 mg/kg/kali/hari secara intravena selama 3 hari berturut-turut. Observasi dilakukan setelah 72 jam perlakuan. Setelah 72 jam
perlakuan maka dilakukan pengambilan sampel darah intravena sebanyak 0,5 ml menggunakan spuit 1 ml yang akan ditampung di tabung khusus untuk pemeriksaan neutrophil. Setelah itu tikus wistar akan di euthanasia dengan cara dekapitasi. Duodenum tikus kemudian diambil untuk dilakukan pemeriksaan histopatologi.
b. Pembuatan preparat histopatologi
secara umum - Fiksasi
Potongan jaringan organ dimasukkan ke dalam larutan formalin buffer (larutan formalin 10% dalam buffer Natrium Phosphat sampai mencapai pH 7,0). Setelah fiksasi selesai, jaringan dimasukkan dalam larutan aquadest selama 1 jam untuk proses penghilangan larutan fiksasi.
- Dehidrasi
Potongan jaringan dimasukkan dalam alkohol konsentrasi bertingkat. Jaringan menjadi lebih jernih dan transparan. Jaringan kemudian dimasukkan dalam larutan alcohol-xylol selama 1 jam dan kemudian laritan xylol murni selama 2 x 2 jam.
- Impregnansi
Jaringan dimasukkan dalam parafin cair selama 2x2 jam
- Embeding
commit to user
c. Pewarnaan Hematoxillin Eosin (HE)
Pewarnaan ini digunakan untuk mewarnai jaringan.
Prinsip: inti yang bersifat asam akan menarik zat/ larutan yang bersifat basa sehingga akan berwarna biru. Sitoplasma bersifat basa akan menarik zat /larutan yang bersifat asam sehingga berwarna merah.
d. Mengukur diameter arteriol
Diameter dikuru dengan mikrooskop cahaya dengan pembesaran 400 kali. Diamter dihitung dengan satuan micrometer ( . Dari tiap sampel (preparat) dipilih 5 arteriol secara acak dan dihitung nilai rata-rata diameternya. Pengukuran dilakukan oleh 2 orang, yaitu peneliti dan ahli patologi anatomi dengan persetujuan klinis 95%.
Hasil Penelitian
Penelitian ini dilakukan Laboratorium Hewan Coba UNS, Surakarta, selama periode bulan Januari 2015 – Maret 2015. Sejumlah 27 ekor tikus wistar di adaptasi selama 7 hari sebelum dibagi dalam tiga kelompok yang masing-masing terdiri dari 9 ekor tikus yang ditentukan secara acak. Untuk kelompok satu (K1) yang merupakan kelompok kontrol, tidak dilakukan induksi cecal inoculum maupun pemberian vitamin C. Untuk kelompok dua (K2) diberikan injeksi cecal inoculum40mg/kali/hari selama 3 hari berturut turut. Untuk kelompok perlakukan tiga (K3) perlakuan sama dengan kelompok dua ditambah dengan vitamin C 5,1 mg/kg/kali/hari secara intravena selama 3 hari berturut-turut. Observasi dilakukan setelah 72 jam perlakuan. Setelah 72 jam perlakuan maka dilakukan pengambilan sampel darah intravena sebanyak 0,5 ml menggunakan spuit 1 ml yang akan
ditampung di tabung khusus untuk pemeriksaan neutrophil. Setelah itu tikus wistar akan di euthanasia dengan cara dekapitasi. Duodenum tikus kemudian diambil untuk dilakukan pemeriksaan histopatologi.
1. Hasil Pemeriksaan Neutrophil
Gambaran Hasil Pemeriksaan Neutrophil Hasil pemeriksaan neutrophil pada ke tiga kelompok perlakuan sebagai berikut :
Tabel 2.
Deskripsi Hasil Pemeriksaan Neutrophil
No K1 K2 K3
1 43.5 56.5 80.2
2 35.7 82.0 83.2
3 35.9 48.8 70.5
4 15.6 54.7 78.1
5 16.0 42.0 43.2
6 23.2 59.7 79.4
7 23.3 39.5 75.8
8 35.4 88.7 79.6
9 43.7 54.4 57.6
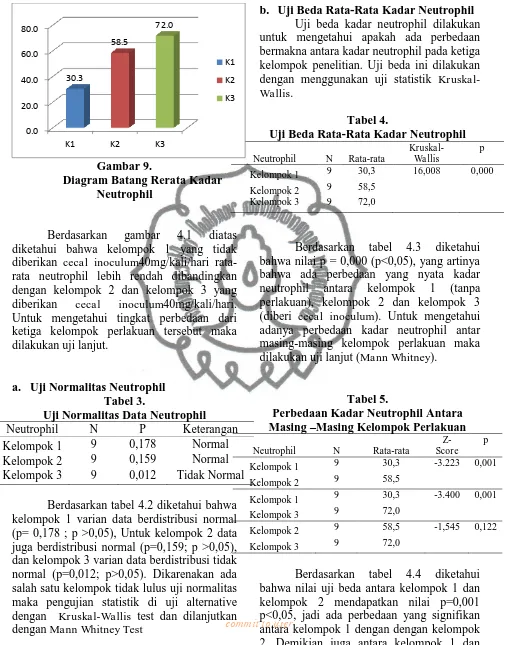
Rata -Rata 30.3 58.5 72.0
SD 10,96 16,69 13,21
commit to user Gambar 9.
Diagram Batang Rerata Kadar Neutrophil
Berdasarkan gambar 4.1 diatas diketahui bahwa kelompok 1 yang tidak diberikan cecal inoculum40mg/kali/hari rata-rata neutrophil lebih rendah dibandingkan dengan kelompok 2 dan kelompok 3 yang diberikan cecal inoculum40mg/kali/hari. Untuk mengetahui tingkat perbedaan dari ketiga kelompok perlakuan tersebut maka dilakukan uji lanjut.
a. Uji Normalitas Neutrophil
Tabel 3.
Uji Normalitas Data Neutrophil
Neutrophil N P Keterangan
Kelompok 1 9 0,178 Normal
Kelompok 2 9 0,159 Normal
Kelompok 3 9 0,012 Tidak Normal
Berdasarkan tabel 4.2 diketahui bahwa kelompok 1 varian data berdistribusi normal (p= 0,178 ; p >0,05), Untuk kelompok 2 data juga berdistribusi normal (p=0,159; p >0,05), dan kelompok 3 varian data berdistribusi tidak normal (p=0,012; p>0,05). Dikarenakan ada salah satu kelompok tidak lulus uji normalitas maka pengujian statistik di uji alternative dengan Kruskal-Wallis test dan dilanjutkan dengan Mann Whitney Test
b. Uji Beda Rata-Rata Kadar Neutrophil
Uji beda kadar neutrophil dilakukan untuk mengetahui apakah ada perbedaan bermakna antara kadar neutrophil pada ketiga kelompok penelitian. Uji beda ini dilakukan dengan menggunakan uji statistik Kruskal-Wallis.
Tabel 4.
Uji Beda Rata-Rata Kadar Neutrophil
Neutrophil N Rata-rata
Kruskal-Wallis
p
Kelompok 1 9 30,3 16,008 0,000 Kelompok 2 9 58,5
Kelompok 3 9 72,0
Berdasarkan tabel 4.3 diketahui bahwa nilai p = 0,000 (p<0,05), yang artinya bahwa ada perbedaan yang nyata kadar neutrophil antara kelompok 1 (tanpa perlakuan), kelompok 2 dan kelompok 3 (diberi cecal inoculum). Untuk mengetahui adanya perbedaan kadar neutrophil antar masing-masing kelompok perlakuan maka dilakukan uji lanjut (Mann Whitney).
Tabel 5.
Perbedaan Kadar Neutrophil Antara
Masing –Masing Kelompok Perlakuan
Neutrophil N Rata-rata
Z- Score
p
Kelompok 1 9 30,3 -3.223 0,001
Kelompok 2 9 58,5
Kelompok 1 9 30,3 -3.400 0,001
Kelompok 3 9 72,0
Kelompok 2 9 58,5 -1,545 0,122
Kelompok 3 9 72,0
Berdasarkan tabel 4.4 diketahui bahwa nilai uji beda antara kelompok 1 dan kelompok 2 mendapatkan nilai p=0,001 p<0,05, jadi ada perbedaan yang signifikan antara kelompok 1 dengan dengan kelompok 2. Demikian juga antara kelompok 1 dan 0.0
20.0 40.0 60.0 80.0
K1 K2 K3
30.3
58.5
72.0
K1
K2
commit to user kelompok 3.berdasarkan hasil uji tersebut
dapat diketahui bahwa ada berbedaan kadar neutrophil pada tikus yang diberikan cecal inoculum40mg/kali/hari dan yang tidak diberikan cecal inoculum40mg.
Sedangkan uji beda antara kelompok 2 dan kelompok 3 mendapatkan nilai p=0,122 p>0,05, jadi tidak anda perbedaan kadar neutrophil antara kelompok 2 dan kelompok 3. Hal ini berarti pemberian cecal inoculum40mg/kali/hari pada kedua kelompok tersebut telah berhasil dan memiliki kadar neutrophil yang sama (tikus dalam keadaan sepsis)
Berdasarkan hasil uji beda kadar neutrophil yang telah dilakukan maka dapat diketahui bahwa perlakuan dengan pemberian cecal inoculum40mg/kali/hari telah berhasil dimana tikus wistar pada kelompok 1 dalam keadaan sehat dan tikus wistar pada kelompok 2 dan kelompok 3 dalam keadaan sepsis.
2. Hasil Pengukuran Diameter Arteriol
Dari Organ Usus Halus
a. Gambaran Hasil Pengukuran
Diameter Arteriol
Diameter diukur dengan
mikrooskop cahaya dengan pembesaran 400 kali. Diameter dihitung dengan satuan micrometer ( . Dari tiap sampel (preparat) dipilih 5 arteriol secara acak per lapang pandang dan dihitung nilai rata-rata diameternya
Tabel 6.
Deskripsi Hasil Pengukuran Diameter Arteriol
No Tikus K1
(
K2
(
K3
(
1 A1 329.1 195.1 561.6
2 A2 216.6 135.2 311.0
3 A3 367.9 168.5 334.1
4 A4 208.9 133.5 570.0
5 A5 255.6 170.5 684.9
6 B1 208.5 137.4 585.8
No Tikus K1
(
K2
(
K3
(
7 B2 229.7 107.4 510.4
8 B3 184.6 136.7 459.0
9 B4 189.9 122.6 525.9
10 B5 247.5 139.6 402.6
11 C1 267.6 102.4 406.2
12 C2 232.2 107.9 424.8
13 C3 179.1 134.4 516.5
14 C4 150.4 129.5 411.3
15 C5 165.8 125.5 495.8
16 D1 330.3 136.1 400.7
17 D2 374.8 151.3 394.7
18 D3 231.8 166.6 394.9
19 D4 274.5 155 469.6
20 D5 170.3 137.3 445.6
21 E1 129.3 137.3 423.8
22 E2 165.6 108.2 550.0
23 E3 147.8 124.1 517.2
24 E4 134.1 124.1 695.9
25 E5 167.3 121.3 616.1
26 F1 173.1 134.9 455.9
27 F2 165.6 140.3 484.3
28 F3 173.8 120.1 433.5
29 F4 144.8 123.1 538.8
30 F5 177 146.1 511.3
31 G1 141.6 160.7 209.4
32 G2 89.2 151.9 309.1
33 G3 139.1 136.2 240.6
34 G4 142.2 144.9 205.7
35 G5 78.1 165.6 391.0
36 H1 97.7 151.8 192.4
37 H2 145.5 156.8 235.6
38 H3 127.8 157.2 255.2
39 H4 116.2 131.5 182.9
40 H5 91.4 154.5 227.7
41 I1 118.5 167.6 180.6
42 I2 133.3 144.2 178.0
43 I3 130.4 128.3 180.6
44 I4 144.9 135.8 182.3
45 I5 110.5 111.4 188.7
commit to user
No Tikus K1
(
K2
(
K3
(
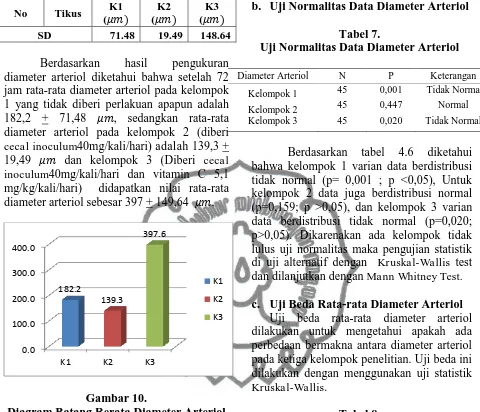
SD 71.48 19.49 148.64
Berdasarkan hasil pengukuran diameter arteriol diketahui bahwa setelah 72 jam rata-rata diameter arteriol pada kelompok 1 yang tidak diberi perlakuan apapun adalah 182,2 + 71,48 , sedangkan rata-rata diameter arteriol pada kelompok 2 (diberi cecal inoculum40mg/kali/hari) adalah 139,3 + 19,49 dan kelompok 3 (Diberi cecal inoculum40mg/kali/hari dan vitamin C 5,1 mg/kg/kali/hari) didapatkan nilai rata-rata diameter arteriol sebesar 397 + 149,64 .
Gambar 10.
Diagram Batang Rerata Diameter Arteriol
Berdasarkan gambar 4.2 diatas diketahui bahwa kelompok 1 (tanpa perlakuan) rata-rata diameter arteriol lebih tinggi dibandingkan dengan kelompok 2 (Diberi cecal inoculum). Sedangkan kelompok 3 (Diberi cecal inoculum dan vitamin C) nilainya lebih tinggi dari pada kelompok 1 dan kelompok 2. Untuk mengetahui tingkat perbedaan dari ketiga kelompok perlakuan tersebut maka dilakukan uji lanjut.
b. Uji Normalitas Data Diameter Arteriol
Tabel 7.
Uji Normalitas Data Diameter Arteriol
Diameter Arteriol N P Keterangan
Kelompok 1 45 0,001 Tidak Normal Kelompok 2 45 0,447 Normal Kelompok 3 45 0,020 Tidak Normal
Berdasarkan tabel 4.6 diketahui bahwa kelompok 1 varian data berdistribusi tidak normal (p= 0,001 ; p <0,05), Untuk kelompok 2 data juga berdistribusi normal (p=0,159; p >0,05), dan kelompok 3 varian data berdistribusi tidak normal (p=0,020; p>0,05). Dikarenakan ada kelompok tidak lulus uji normalitas maka pengujian statistik di uji alternatif dengan Kruskal-Wallis test dan dilanjutkan dengan Mann Whitney Test.
c. Uji Beda Rata-rata Diameter Arteriol
Uji beda rata-rata diameter arteriol dilakukan untuk mengetahui apakah ada perbedaan bermakna antara diameter arteriol pada ketiga kelompok penelitian. Uji beda ini dilakukan dengan menggunakan uji statistik Kruskal-Wallis.
Tabel 8.
Uji Beda Rata-Rata Diameter Arteriol
Diameter Arteriol N Rata-rata (
Kruskal-Wallis p Kelompok 1 45 182,2 80,505 0,000 Kelompok 2 45 139,3
Kelompok 3 45 397,6
Berdasarkan tabel 4.7 diketahui bahwa nilai p = 0,000 (p<0,05), yang artinya bahwa ada perbedaan yang nyata diameter arteriol antara kelompok 1 (tanpa perlakuan), kelompok 2 (diberi cecal inoculum) dan kelompok 3 (diberi cecal inoculum dan Vitamin C). Untuk mengetahui adanya perbedaan diameter arteriol antar masing-0.0
100.0 200.0 300.0 400.0
K1 K2 K3
182.2
139.3
397.6
K1
K2
commit to user masing kelompok perlakuan maka dilakukan
uji lanjut (Mann Whitney).
Tabel 9.
Perbedaan Diameter Arteriol Antara
Masing –Masing Kelompok Perlakuan
Diameter Arteriol N
Rata-rata
( Z-Score p
Kelompok 1 45 182,2 -3.326 0,001 Kelompok 2 45 139,3
Kelompok 1 45 182,2 -6,718 0,000 Kelompok 3 45 397,6
Kelompok 2 45 139,3 -8,114 0,000 Kelompok 3 45 397,6
Berdasarkan tabel 4.8 diketahui bahwa diketahui bahwa nilai uji beda antara kelompok 1 dan kelompok 2 mendapatkan nilai p=0,001 p<0,05, jadi ada perbedaan yang signifikan diameter arteriol antara kelompok 1 (tanpa perlakuan) dengan dengan kelompok 2 (diberi cecal inoculum) dimana rata-rata diameter arteriol tikus kelompok 1 (tanpa perlakuan) 30,8% lebih lebar dibandingkan dengan tikus kelompok 2 (diberi cecal inoculum).
Demikian juga antara kelompok 1 (tanpa perlakuan) dan kelompok 3 (diberi cecal inoculum dan Vitamin C) mendapatkan hasil nilai p=0,001 p<0,05. Jadi ada perbedaan yang signifikan diameter arteriol antara kelompok 1 dan kelompok 3. Dimana kelompok 3 menghasilkan diameter arteriol 118,2% lebih lebar daripada kelompok 1.
Uji beda antara kelompok 2 (diberi cecal inoculum) dan kelompok 3 (diberi cecal inoculum dan Vitamin C) mendapatkan hasil nilai p=0,000 p<0,05. Jadi ada perbedaan yang signifikan diameter arteriol antara kelompok 2 dan kelompok 3. Dimana kelompok 3 menghasilkan diameter arteriol 185,3% lebih lebar daripada kelompok 2.
Berdasarkan hasil uji tersebut dapat diketahui bahwa pemberian vitamin C pada tikus sepsis mampu meningkatkan diameter
arteriol lebih lebar dibandingkan dengan tikus sehat (normal) dan tikus sepsis.
Pembahasan
Sepsis dapat mengaktivasi berbagai macam sel seperti makrofag, netrofil, sel endotel maupun epithelial yang akan melepaskan sejumlah mediator, termasuk diantaranyya cytokines, chemokines, PAF, interferon-γ, komplemen prostanoid, leukotriene dan protease. Kejadian ini akan menyebabkan aktivasi dari sel imun yang disertai pelepasan ROS. Mediator inflamasi ini memiliki peran yang penting dalam membunuh organisme patoogen, namun jika respon yang terjadi terlalu eksesif, makan dapat menyebabkan infeksi sistemik pada orgam dibangian distal dan dapat menyebabkan kematian.
commit to user Vitamin C merupakan golongan
antioksidan larut dalam air yang dapat meredam dampak negatif oksidan, termasuk enzim-enzim dan protein-protein pengikat logam. Fungsi antioksidan adalah mencegah terbentuknya radikal hidroksil, memutus rantai reaksi oksidan, mereduksi oksidan menjadi zat lain yang kurang reaktif misalnya H2O dan O2, menghambat peroksidase lipid dan scavenger langsung dari ROS. Oleh sebab itu pemberian vitamin C pada tikus wistar mampu meningkatkan nilai diameter arteriol.
Anti oksidan merupakan senyawa-senyawa yang dapat meredam dampak negatif oksidan, termasuk enzim-enzim dan protein-protein pengikat logam. Fungsi antioksidan adalah mencegah terbentuknya radikal hidroksil, memutus rantai reaksi oksidan, mereduksi oksidan menjadi zat lain yang kurang reaktif misalnya H2O dan O2, menghambat peroksidase lipid dan scavenger langsung dari ROS. Pada sepsis terjadi inflamasi, inflamasi ditandai oleh pelepasan sitokin pro inflamasi seperti TNF-, 1L-1 , dan IL-6 dan mediator inflamasi termasuk NO, PGE2, iNOS dan COX.
Asam askorbat adalah reducing agent dan dapat mengurangi dan menetralkan, reaktif oksigen spesies seperti hidrogen peroksida. Oksidan seperti hidroksil radikal mengandung elektron tidak berpasangan dan sangat reaktif dan merusak pada tingkat molekuler. Hal ini disebabkan oleh interaksi ROS dengan asam nukleat, protein, dan lipid. Reaktif oksigen spesies mengoksidasi askorbat menjadi monodehydroascorbate dan kemudian menjadi dehydroascorbate. Reaktif Oksigen Spesies (ROS) direduksi menjadi air sementara bentuk askorbat teroksidasi relatif stabil, tidak reaktif dan tidak menyebabkan kerusakan sel.
Hasil penelitian ini juga didukung oleh hasil penelitian Victor VM et al, (2000)dimana Vitamin C (Asam Ascorbat/AA) merupakan donor elektron
yang kuat, bereaksi baik dengan O2- maupun dengan OH-.AA memainkan peran penting dalam mekanisme pertahanan terhadap kerusakan oksidatif terutama yang disebabkan oleh lekosit.Pengaturan utama dari AA pada organisme berhubungan dengan fungsinya sebagai reduktor, namun AA juga ikut berperan dalam memodulasi jalur kompleks biokimia dimana hal ini merupakan bagian penting dalam metabolisme normal dari sel imun. Antioksidan ini menghambat aktivasi dari faktor transkripsi nuclear NF-κB yang dicetuskan oleh adanya endotoksin, dimana
hal ini dapat menurunkan produksi TNFα.
Penelitian Ex vivo telah menunjukkan pengaruh pemberian vitamin c terhadap regulasi aktivitas seluler, seperti peningkatan adhesi dan produksi O2- yang dihasilkan oleh makrofag pada mencit dengan syok endotoksin yang akan berkurang dengan adanya AA. AA juga memperlihatkan kemampuan untuk memodulasi fungsi limfosit pada model yang sama.
Wu et al (2003) memperlihatkan dimana AA dapat menghambat ekspresi iNOS dan menurunkan kadar oksidan pada masa otot selama periode sepsis. Hasil ini menimbulkan dugaan dimana pemberian AA pada early sepsis dapat menjadi terapi tambahan yang berharga.
Dengan demikian pemberian vitamin C 5,1 mg/kgBB/hari/i.v pada tikus sepsis akan berdampak pada hasil pengukuran diameter arteriol, dimana pada tikus sepsis yang diberi vitamin C nilai dimater arteriol 118,2% lebih lebar dari tikus normal. Dan nilai dimater arteriol pada pada tikus sepsis yang diberi vitamin C 185,3% lebih besar dari tikus sepsis tanpa diberi vitamin C.
KESIMPULAN
commit to user tikus wistar dapat disimpulkan sebagai
berikut:
Pemberian Vitamin C pada tikus wistar dengan dosis 5.1 mg/kgBB/kali/hari telah berhasil meningkatkan diameter arteriol pada tahap awal sepsis. Nilai dimater arteriol kelompok 2 (diberi cecal inoculum) berbeda signifikan dengan kelompok 3 (diberi cecal inoculum dan Vitamin C) dengan nilai p<0.01. Dimana kelompok 3 menghasilkan diameter arteriol 185,3% lebih lebar daripada kelompok 2
DAFTAR PUSTAKA
Abraham E (2003). Nuclear factor-kB and its role in sepsis-associated organ failure. J Infect Dis, 187: S364-9.
Alpha A, Aamer A, Syed, Shelley K, Robin S, Don F, et al. 2014. Phase I safety trial of intravenous ascorbic acid in patients with severe sepsis. Journal of Translational Medicine. Vol:12(32): 1-10
Asada, K. 2006. Production and Scavenging of Reactive Oxygen Species in Chloroplasts and Their Functions. ASPB. Vol. 141 (2): 391-396
Backer, D, et al. 2011. Microsirculatory alterations: potential mechanism and implication for therapy. Annal of Intensive Care. 1:27
Baldwin AS. 2001. Series introduction: the transcription factor NF-kB and human disease. J Clin Invest; 107: 3-6.
Barnes PJ. 1997. Nuclear factor kB. Int J Biochem Cell, 29: 867-70.
Bateman RM, Sharpe MD, Ellis CG, 2003. Bench-to-bedside review: microvascular dysfunction in sepsis-hemodynamics, oxygen
transport, and nitric oxide. Crit Care; 7: 359-73.
Blackwell TS, Christman JW, 1997. The role of nuclear factor kB in cytokine gene regulation. Am J Respir Cell Mol Biol, 17: 3-9.
Blackwell TS, Yull FE, Chen CL, Venkatakrishnan A, Blackwell TR, Hicks DJ et al, 2000. Multiorganic nuclear factor kappa B activation in a transgenic mouse model of systemic inflammation. Am J Respir Crit Care Med, 162: 1095-101.
Bolon ML, Peng T, Kidder GM, Tyml K, 2008. Lipopolysaccharide plus hypoxia and reoxygenation synergistically reduce electrical coupling between microvascular endothelial cells by dephosphorylating connexin40. J Cell Physiol; 217(2): 350–359
Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, et al (1992). Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Comitte. American College of Chest Physicians/Society of Critical Care Medicine. 101: 1644-55.
Boveris A, Alvarez S, Navarro A (2002). The role of mitochondrial nitric oxide synthase in inflammation and septic shock. Free Radic Biol Med, 33: 1186-93.
Brahmbhatt S, Gupta A, Sharma AC. 2005. Big Endothelin-1 (I-21) Fragment during early sepsis modulates tai, p38-MAPK phosphorylation and nitric oxide synthase activation. Molecular and Cellular Biochemistry, 271: pp: 225-237
Brook G, Butel J, Morse A. 2003. Medical Microbiology. Singapore: Mcgraw Hill Company: 854-865
commit to user Cepinskas, G & Wilson, J. 2008. Respon
inflamasi pada endothel Mikrovaskuler Pada Sepsis: Peran Oksidan. J. Clin. Biochem. Nutr. 42: 175-184
Chopra M, Sharma A. 2007. Distinct cardiodynamic and molecular characteristics during early and late stages of sepsis induced myocardial dysfuncion. Life Sciencces-Journal Elsevier; 81(4): 306-316
Cohen, J. 2002. The Immunopathogenesis of Sepsis. Nature. 420: 885–891
Deitch E. 2005. Rodent models of intra-abdominal infection. Shock; 24:19-23
DeLeo FR, Renee J, McCormick S, Nakamura M, Apicella M, Weiss JP, et al (1998). Neutrophils exposed to bacterial lipopolysaccharide upregulate NADPH oxidase assembly. J Clin Invest, 101: 455-63.
Diding HP, Nurwati I, Indrayantp Y, Guntur HA, 2014. Penurunan kadar pro-adrenomedullin mencit Baalb/C model sepsis dengan kortikosteroid dosis rendah. Majalan Kedokteran Bandung, 46(2)
Dorland N, 2001. Kamus Kedokteran Dorland. Edisi 29. Jakarta: EGC, pp:1765
Edwin S, Theo J, Joohan K. 2003. Receptors, mediators and mechanism involved in bacterial sepsis and septic shock. Clinical Microbiology Reviews; 379-414
Fu B, Wang X, Qin Z, William R, Hsueh, Zheng X, Rozenfield A, Zuo L, Tan D. 2006. Lysozyme-modified probiotic components protect rats against polymicrobial sepsis: Role of macrophages and cathelicidin-related innate immunity. The Journal of Immunology. 177: 8767-8776
Guha M, Mackman N (2001). LPS induction of gene expression in human monocytes cell signal, 13: 85-94
Guntur, AH. 2008. SIRS, SEPSIS & SYOK SEPTIK (Imunologi, Diagnosis, Penatalaksanaan. Sebelas Maret University Press. Surakarta
Huang, A, et al. 2000. Ascorbic Acid Enhances Endothelial Nitric Oxide Synthase Activity By Increasing Intracellular Tetrahydrobiopterin. JBC.
Kaymak, C, Basar, H, Sardas, S. 2011. Reactive Oxygen Spesies (Ros) Generation in Sepsis. FABAD J Pharm Sci. 36: 41-47.
Kuzkaya, N, et al. 2003. Interactions of Peroxynitrite, Tetrahydrobiopterin, Ascorbic Acid, And Thiols: Implications For Uncoupling Endothelial Nitric-Oxide Synthase. J Biol Chem. 278 (25): 22546-54
Matei, V, et al. 2006. The eNOS Cofactor Tetrahydrobiopterin Improves Endothelial Dysfunction In Livers Of Rats With CCl4 Cirrhosis. PubMed. 44 (1): 44-52
Minakshi N, Shannon R, Nihal A. 2007. Dose translation from animal to human studies revisited. The Faseb Journal. Vol:22; 559-561
Murray, R, et al. 2003. Harper Illustrated Biochemistry 26 ed. McGraw Hill USA. 474-497
Nossaman, B, et al. 2012. Stimulators and Activators of Soluble Guanylate Cyclase: Review and Potential Therapeutic Indications. Critical Care Research and Practice. Vol 2012
Padayatty, S. 2003. Vitamin C as Anti Oxidant: Evaluation of its Roles in Disease Prevention. Journal of the American College of Nutrition. 22(1): 18–35
commit to user Remick DG, Bolgos GR, Siddiqui J, Shin J,
Nemzek JA, 2002. Six at six: Interleukin-6 measured 6 h after the initiation of sepsis predicts mortality over 3 days. Shock. 17:pp:463-467
Ren J, Ren B, Sharma A. 2002. Sepsis-induced depressed contractile function of isolated ventricular myocytes is due to altered calcium transient properties. Shock; 18 (3): 285-288.
Riedemann, N, Guo, R, and Ward, P. 2003. Novel Strate-Gies For The Treatment Of Sepsis. Nat Med. 9: 517–524
Rittirsch D, Markus S, Michael A, Peter A. 2009. Immunodesign of experimental sepsis by cecal ligation and puncture. Nature Protocols, 4(1): 31-36
Schildberger, A, et al. 2013. Monocytes, Peripheral Blood Mononuclear Cells, and THP-1 Cells Exhibit Different Cytokine Expression Patterns Following Stimulation with Lipopolysaccharide. Hindawi. Vol 2013
Spagnuolo, M, et al. 2006. Nitric Oxide Stimulates The Erythrocyte For Ascorbate Recycling. Elsevier Inc. 1089-8603
Supranto J. 2007. Teknik sampling untuk survey dan eksperimen. Ediasi ke-4. Jakarta: PT. Rineka Cipta: 5-9
Tiefenbacher, C. 2001. Tetrahydrobiopterin: a critical cofactor for eNOS and a strategy in the treatment of endothelial dysfunction?. APS. 280: H2484–H2488
Victor, M, et al. 2005. Role of Free Radicals in Sepsis: Antioxidant Therapy. Current Pharmaceutical Design. 11: 3141-3158
Wang W, Jittikanont S, Falk SA, Li P, Feng L, Gengaro PE, et al (2003). Interaction among nitric oxide, reactive oxygen species, and antioxidants during endotoxemia-related acute renal failure. Am J Physiol Renal Physiol; 284: 352-7.